
11 T Cells- ループスとT細胞
Introduction
・T細胞は免疫応答の中心的な役割を持つ。骨髄由来の前駆細胞から胸腺で生成され、ランダムなDNA再構成によって抗原受容体(T細胞受容体; TCR)を形成する。ナイーブ(未熟)T細胞(Naive CD4+T cell or Naive CD8+T cell)は、MHC分子に結合でき、かつ自己ペプチドに対して顕著な親和性を持たないTCRを有する細胞のみが分化を継続し、成熟したナイーブなCD4またはCD8 T細胞として胸腺を出る。ナイーブT細胞は二次リンパ組織(例:リンパ節や粘膜関連リンパ組織)を通じて移動し、抗原提示細胞(APCs)と相互作用して対応する抗原を探索する。
・ナイーブT細胞が高親和性で抗原を認識し、共刺激シグナルが存在するとき、そのT細胞は活性化される。これは、細胞周期を開始し、エフェクターサブセット(例:Th1、Th2、Th17)への分化を続けることを意味する。言い換えれば、ナイーブT細胞の活性化は、抗原特異性を共有し、免疫機能(すなわち、細胞溶解作用やサイトカイン産生)を発揮する能力を獲得した細胞群を生み出すという結果をもたらす。分化の全体像は以下の通り。
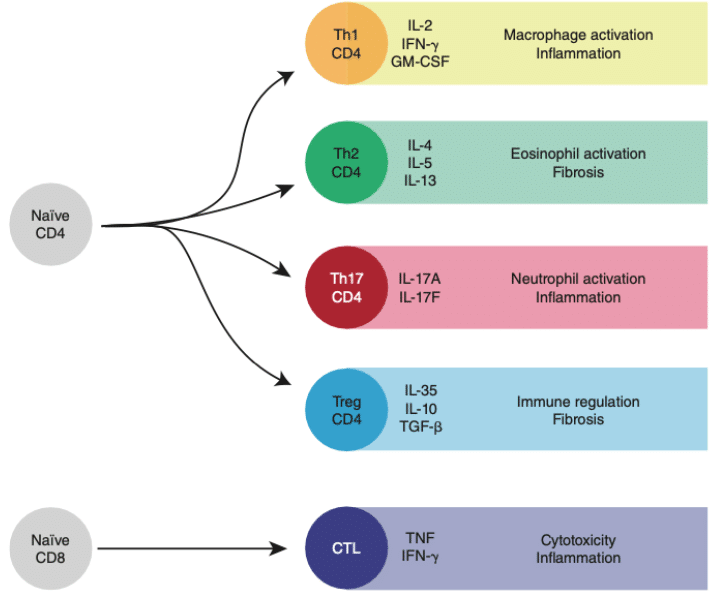
よくみるとTh2CD4+のところにFibrosisとあります。このIL-4/IL-13は強皮症の治療標的になるかも、という話があるようです。かなり興味深い。線維化にたいする治療は、膠原病科医ではアンメットニーズの本丸です。
Interleukin-4 and interleukin-13 as possible therapeutic targets in systemic sclerosis, Cytokine. 2020 Jan:125:154799
※以上が、T細胞の分化の全体像です。各種役割は複雑なのでここでは割愛します。SLEの遺伝子のところでまとめましたが
https://note.com/takenouchi14/n/nd3589a2b3307?magazine_key=mf7e35ac2aecd
SLEの病態のイメージとしては、自己抗原があって→自己抗体が産生され→pDCが増え→type1 IFN (免疫複合体が増強)→ JAK/STATが増えていく、みたいなもの。T細胞の役割は複雑なのでこの章でゆっくりみていきましょう。
Myth: 全身性エリテマトーデスはB細胞の抗体病なのでT細胞はあまり関係していない
Reality: Extensive evidence indicates that T cells are involved in the pathogenesis of systemic lupus erythematosus (SLE).
・そんな訳はない。CD4+T細胞は獲得免疫系のクォーターバックなのだから。全身性エリテマトーデス(SLE)の病態形成にはT細胞が関与していることを示す多数の証拠が存在する。
・SLE患者から分離されたT細胞の表現型は異常である。TCR/CD3複合体を介した刺激に対するT細胞の反応は過剰であり、健常者から得られた細胞と比較して、T細胞の遺伝子発現プロファイルも変化している。
・さらに、SLE患者に見られる免疫寛容の破綻および自己反応性の応答は、T細胞主導の免疫応答に特徴的なクローン拡大や体細胞超突然変異を伴っており、T細胞の枯渇はマウスモデルにおいてループスを抑制する。このように、SLEは複数の要因によって引き起こされる複雑な疾患であるが、T細胞は病的な自己免疫応答を促進し、標的臓器の損傷を直接的に引き起こす。
本章では、T細胞がSLEにどのように寄与するか、またSLE T細胞の挙動を変化させ、その病原性に寄与する内在的異常について論じる。
Role of T cells in autoimmunity and inflammation 自己免疫と炎症におけるT細胞の役割
B cell help - B細胞の助け
最初の主人公は、Tfh(濾胞ヘルパーT細胞)
Pearl: SLEのもつ自己抗体のほとんどが体細胞超変異を受けた高親和性IgGである
comment: the fact that they are mostly high affinity IgG that have undergone somatic hypermutation suggests that they have developed in GC or analogous structures.
・CD4T細胞は、胚中心(GC)で抗体産生を制御している。CD4+T細胞により高親和性抗体とメモリーB細胞が選択されるのだが、SLE患者の自己抗原に対する反応と高親和性自己抗体の発現はあまり理解されていない。
・自己抗体のほとんどが体細胞超変異を受けた高親和性IgGであるという事実は、それらがGCまたは類似の構造で発生したことを示唆している。
※高親和性: 親和性とは、抗体が特定の抗原にどれだけ強く結合できるかを示す指標であり、この親和性は、胚中心(GC: Germinal Center)でのB細胞の成熟過程、特に体細胞超変異によって高められる。
Pearl: SLEの患者ではリンパ濾胞でB細胞をサポートすることに特化した濾胞ヘルパーT細胞が増えており、ループス腎炎の腎臓にもTFH細胞は認められている。
comment: A subset of patients with SLE has increased numbers of T FH in the peripheral blood, suggesting overactivation of this T cell subset is involved in human SLE. Moreover, T FH cells have been documented in the kidneys of patients with lupus nephritis.The aforementioned studies, along with the presence of high titers of high affinity IgG autoantibodies in most patients with lupus, indicate that T cell-driven B cell hyperactivity is a key event in the self-directed immune response that underlies pathology in patients with SLE.
濾胞ヘルパーT細胞(T FH)は、GCで B細胞を助けることに特化し たCD4ヘルパーサブセットである
・T FHは、インターロイキン(IL)-6、IL-21、および誘導性共刺激因子(ICOS)を介したコスト刺激存在下で活性化されたナイーブCD4 T細胞から分化する。T FHはリンパ節のB細胞ゾーンに局在し、IL-21とCD40Lを介してアイソタイプスイッチングと体細胞超変異を誘導する。
・ユビキチンリガーゼroquinを欠損させたマウスではICOSや腫瘍壊死因子α(TNFα)を含む主要な免疫遺伝子のダウンレギュレーションに失敗し、T FHが増加し、全身性エリテマトーデスを発症する。
・一方、制御性CD8 T細胞がT FH上のMHCクラスI様分子であるQa-1と結合する能力を破壊する突然変異も、マウスにおいてループス様自己免疫を誘発する。
※つまりTfhが増える遺伝子変異はSLEを増やすということ。
・ IL-21とT FHはループス素因を持つマウスの発病に関与している。
・SLE患者の一部では、末梢血中のT FHの数が増加しており、このT細胞サブセットの過剰活性化がヒトSLEに関与していることを示唆している。 さらに、ループス腎炎患者の腎臓にもT FH細胞が記録されている。
※つまりTfhの存在がGC内のB細胞を強化させ、高力価の高親和性IgG自己抗体を存在させ、自己主導的免疫反応における重要な出来事であることを示している、ということ。

次の主人公はIL-17

Pearl: ループスではTh17 CD4+細胞だけでなく、一般的には認められないIL17産生のCD4-CD8-(ダブル・ネガティブ)T細胞を認める。
comment: in lupus, T H 17 CD4 cells are not the only relevant source of IL-17, as expansion of a normally rare IL-17-producing T cell population that lacks CD4 and CD8 (called double negative, DN) is common. Importantly, IL-17-producing T cells have been found within kidney infiltrates from patients with lupus nephritis.
・Th17細胞は、TGF-βと、IL-1β、IL-6、IL-21などの特定の炎症性サイトカインの存在下で活性化されたナイーブCD4 T細胞から生成される。 Th17細胞はIL-17A、IL-17F、IL-22の放出を通して炎症を誘導する。
・SLE患者の血清中には、IL-17を産生するT細胞が多く、高濃度のIL-17が認められる。 しかし、SLEでは、Th17 CD4細胞だけがIL-17の唯一の供給源というわけではなく、CD4とCD8を欠く、通常はまれなIL-17産生T細胞集団(ダブルネガティブ、DNと呼ばれる)の拡大を一般的に認める。実際にループス腎炎患者の腎臓浸潤の中に IL-17産生T細胞が見つかっていることである。
※ダブルネガティブ(DN)細胞とは、T細胞の分化の初期段階でCD4もCD8も発現しない細胞で、その後ダブルポジティブ(CD4+CD8+)になり、次の段階でCD4またはCD8いずれかの発現を失い、ヘルパーT細胞(CD4+CD8-)またはキラーT細胞(CD4-CD8+)のいずれかのT細胞となる。
・IL-17産生はループス傾向マウスでも増加しており、ループス様腎炎マウスの腎臓でもIL-17産生T細胞が見つかっている。 興味深いことに、マウスを用いた2つの研究において、疾患の改善はIL-17産生の減少を伴っていたが、IL-17(またはIL-17シグナル伝達)の遮断は、ループス傾向マウスにおいて相反する結果をもたらした。
・SLE患者でIL-17の産生が亢進する理由は以下の図に示される。I型インターフェロン(IFN)や 、Th17産生促進サイトカインであるIL-6やIL-21が豊富であること、制御性T細胞の分化を促進しTH17細胞の生成を抑制するIL-2が 減少していることがある。一方、DN (ダブルネガティブ) T細胞の増殖はIL-17産生細胞の頻度を増加させる。

次はCD44
Pearl: SLEのT細胞では接着分子であるCD44の変異を認め、これらは疾患活動性、腎疾患、ds-DNA抗体産生に関連している
Comment: The expression of two variants, CD44v3 and v6, is increased on T cells from patients with lupus and correlates with disease activity, renal disease, and double stranded DNA antibody production.
・T細胞は接着分子によってリンパ系器官や末梢組織に誘導される。SLEのT細胞ではその接着因子であるCD44の発現が増加し、親和性も亢進しているため、炎症臓器へのT細胞の遊走が亢進している 。
・CD44v3とv6という2つの変異体の発現がループス患者のT細胞で増加しており、疾患活動性、腎疾患、二本鎖DNA抗体産生と相関している。
Myth: CD8+T細胞とSLEに強い関連が証明されている
Reality: The phenotype and function of CD8 T cells have been scarcely studied in human SLE.
・SLEではCD8+T細胞の表現型と機能はほとんど研究されていない。
・CD4-CD8- T細胞(Double negative: DN T細胞)は、健常人ではほとんど見られないが、 SLE患者ではT細胞の5%以上とかなりの割合を占めている。 DN T細胞は、増殖するとB細胞をサポートし、炎症性サイトカイン(IL-1β、IL-17、IFN-γなど)を産生し、標的臓器に浸潤することで、SLEの病因的役割を果たす。しかし、SLEにおけるDN T細胞の増殖と炎症の機序はあまり分かっていない。
Pearl: SLEのT細胞はTregによる抑制に異常に抵抗している、という報告がある。
Comment: Others suggest that their function is conserved and that the suboptimal T cell suppression observed in in vitro assays is the consequence of SLE T cells being abnormally resistant to Treg-induced suppression.
Treg(制御性T細胞)は炎症を抑制する役割を持つT細胞
・SLE患者の末梢血では、特に疾患活動期にTreg数が減少している。またSLEのTregの機能障害について、増殖やサイトカイン産生を効率的に抑制できないという報告もあるし、逆に、Treg細胞の機能は保存されているが、SLEのT細胞がTregによる抑制に異常に抵抗している、という報告もある。
Myth: SLEにおいて胸腺におけるT細胞の中枢性寛容の仕組みは破綻している
Reality: Taken together, studies performed on patients and mice with lupus indicate that no gross defect in central tolerance processes underlies SLE.
※胸腺におけるT細胞の中枢性寛容とは、自己反応性のT細胞を除去し、免疫系が自己を攻撃しないようにする仕組み。
・胸腺における自己反応性T細胞の除去不全は、自己免疫を引き起こす可能性が、ループス患者やマウスを用いた研究を総合すると、SLEの根底には中枢寛容過程の重大な欠陥は認めない。
・しかし、T細胞の選択はMHCの分子に基づいているため、各人に存在するMHC分子の配列によって、T細胞のレパートリーと胸腺や免疫反応中に提示されるペプチドが決定されるため、中枢寛容過程に欠陥が見つからなくても、胸腺で作られるT細胞レパートリーは、ループス患者が反自己応答を起こしやすいことに関与している可能性は残る。
※T細胞の活性化とシグナル伝達に話が及ぶが、ここからはかなり専門的で難しいが図を理解するぐらいまでいきたい。
・SLE患者ではT細胞の活性化が異常である。下の図のように、例えばABCというシグナルがきても、健常人に比べてSLEのT細胞は異常に活性化されやすい。
・SLE患者のT細胞では、CD3の中心的な構成要素であるζ(ゼータ)鎖の発現が低下している。
※T細胞の表面では,CD3分子がTCRに非共有結合して,TCR/CD3受容複合物を形成する。抗原認識後にこれらがリン酸化され、活性化シグナルを細胞内に伝達する。
・これは逆説的にTCR刺激に対する反応の増加と関連している。

・SLEのT細胞では構造的な変化により、TCRシグナル伝達プロセスが変化している。
・CD3ζ(ゼータ)レベルの低下と、それに反比例してFcRγの発現の増加している。
・これによりTCRによるシグナル伝達をCD3ζとZAP-70ではなく、FcRγとSykに依存させてしまう。
・細かいことはおいておいて、この配線がずれたTCRシグナル伝達により、シグナル分子の強いリン酸化とカルシウム流入が増大する。したがって、同じシグナル(例:ABC)の存在下でも、SLE患者のT細胞は異なる歪んだメッセージを受け取り、その応答に影響を与える。
※細かな分子の説明を割愛
核のなかの反応

今度はFig.11.5を解読
転写因子の活性化における欠陥がSLE T細胞の遺伝子発現プロファイルの変化させる
・T細胞受容体(TCR)によるシグナルに対する反応の変化に加えて、特定のキナーゼやホスファターゼのレベルや活性の変化が転写因子の活性を修飾している。
・カルシウムシグナル伝達の増加は、活性化T細胞の核因子(NFAT)の過剰な活性化を引き起こし、これがCD40Lの過剰発現を促します。一方で、ホスファターゼPP2Aのレベルおよび活性の増加は、転写因子E74様因子1(Elf-1)および環状アデノシン一リン酸応答エレメント(CRE)結合タンパク質(CREB)を脱リン酸化して不活性化させている。
・Elf-1の活性低下は、CD3ζの転写の減少およびFcRγの産生増加と関連している。
・CREBの活性低下は、同じファミリーの抑制性転写因子であるCREモジュレーター(CREM)の活性増加と相まって、IL-2および他の転写因子であるFosの産生を減少させる。
・一方で、CREBの活性低下は、rho関連プロテインキナーゼ(ROCK)の活性によって影響を受けるIL-17の産生増加も引き起こす。これらの変化が組み合わさることで、SLE T細胞において遺伝子発現が大きく歪められている。
この後はループスのT細胞の代謝にうつっていく
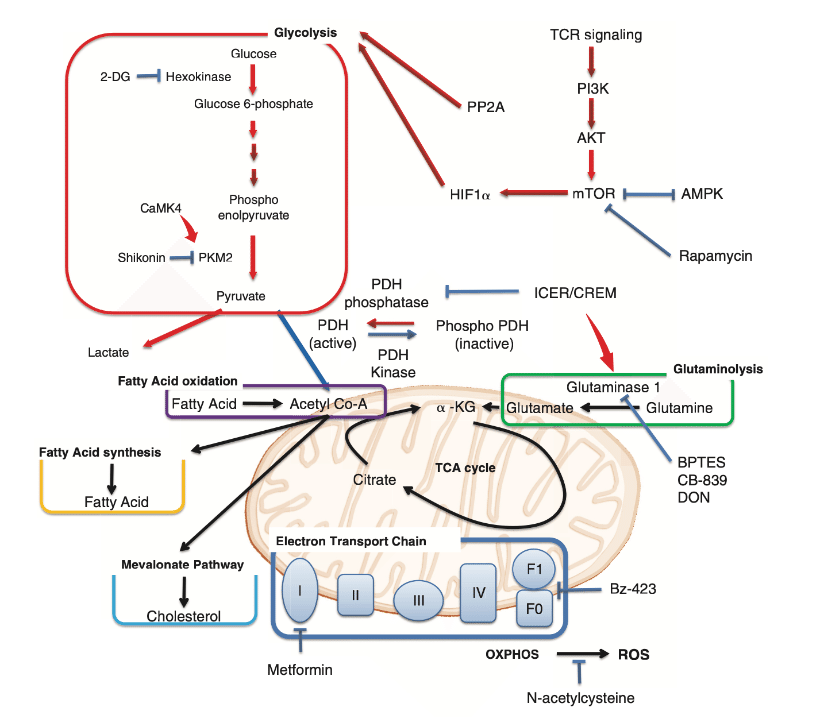
はい、もう締めに行きます。
Pearl: T細胞のいくつかの欠陥は、SLE患者に存在する慢性的な炎症シグナルの二次的な結果である可能性が高い
Comment: Some T cell defects are probably secondary to chronic inflammatory signals present in patients with SLE, whereas others are genetically determined. Although neither group of defects may be able to cause the appearance of autoimmune pathology, a combined action over time leads to disease expression.
最後に、
・SLE患者において、T細胞は他の免疫系の構成要素とともに深刻な影響を受けている。
・T細胞のいくつかの欠陥は、SLE患者に存在する慢性的な炎症シグナルの二次的な結果である可能性が高いが、遺伝的に決定されているものもある。
・これらの欠陥のいずれも単独で自己免疫病理の発現を引き起こすことはできないかもしれないが、長期間にわたる複合的な作用が病態の発現を導く。この章で述べたT細胞機能の欠陥は、おそらく、炎症促進性の環境刺激によって引き起こされる複数の欠陥の組み合わせによるものと推測される。こ
・これらの変化をより詳細に理解することで、病気の病因をよりよく理解し、どの欠陥が一次的であるかを特定できるようになる。また、それにより、正当な治療標的や病気の予後を予測するバイオマーカーの発見につながるであろう。
難しいところは飛ばしましたが、SLEにおけるT細胞の全体像、なんとなく整理が付きました。
