
Off Flavor入門〜④分子の形と極性
前回からの続き
前回は電子の性質についてでした。単体の原子で安定する貴ガス以外の原子では、電子の性質上他の原子と結合しないと安定しないです。
というわけで「化学結合は電子が安定したいから起こる」とも言えます。結合した結果できるのが分子。今回は分子の構造に関してです。
分子の形
あのね いつの間にか 気づいたんだ
愛に もし カタチがあって
それがすでに わたしの胸に はまってたなら
きっとずっと 今日よりもっと
あなたのことを知るたびに
そのカタチはもう あなたじゃなきゃ
きっと隙間を作ってしまうね
心に響くいい歌ですね。愛にも形があるように分子にも形があります。しかも愛の形と違って分子の形はある程度の正確さで計算で求められるそうですよ。
さて、化学結合により原子が分子になったときに、どの原子がどの方向に(どれくらいの角度で)どの長さで配置されるのかなどの分子の形はどう決まるのでしょうか。

上記のような分子の形はもちろん適当に決まっているわけではなく、計算で推定できます。精密な計算という意味では分子軌道法による導出が最も正確とされていますが、水素分子(H2)のような二原子分子ならまだしも、多原子分子だと非常に複雑な計算が要求されます。
VSEPR
分子軌道法による導出よりも簡便な方法として、原子価殻電子対反発則(Valence Shell Electron Pair Repulsion Rule)という理論があります。結合に関係する一番外側の電子対がそれぞれ反発を避けて一番干渉が少ない位置に落ち着くというものです。正確な角度や距離を計算するには軌道を求めないといけないのですが、VSPERによる推定は分子の形を求める理論としては十分有効で、かつとても分かりやすいです。VSPERの優れたところはルイス構造が分かっていればとりあえず分子の形が推定できちゃうところです。

オクテット則を満たし、二重結合を含まない分子は中心分子から見て4方向に反発を避けるように配置すると正四面体になります。メタンの構造が分かりやすいですね。アンモニアや水は非共有電子対も考慮すると正四面体に近い形になります。ちなみに、非共有電子対と結合に関係する電子対では反発力が違う(軌道が違う?波動関数が違う?)ので完全な正四面体にはなりません。
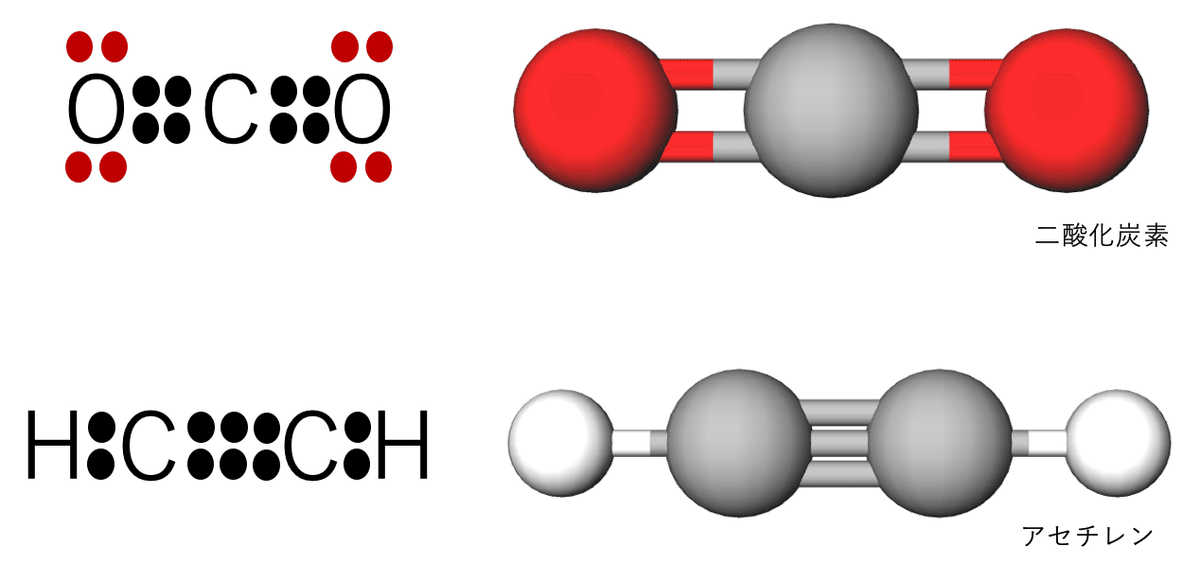
二酸化炭素やアセチレンは、直線構造を取ります。これも電子対から予測可能な形状です。
原子間の距離
原子と原子の間がどれくらい離れているか、これも計算である程度の精度で求められるようです。距離に影響を与えるのは原子の大きさ(原子半径)と多重結合です。

原子半径が大きいと距離が大きくなります。水素分子(H2)と塩化水素(HCl)だと10倍以上距離が違います。塩素原子は第3周期で原子番号17、3p軌道まで電子が埋まっていて、とても大きな原子だからです。
また、炭素-炭素結合のような同じ原子同士でも二重結合や三重結合があると結合距離が短くなります。
ちなみに原子間の距離を表すときは、オングストローム(Å)かナノメートル(nm)を使うことが多いです。1Å=0.1nm=10^-10mです。
立体配座
分子模型でエタンを組んでみると、炭素-炭素結合がくるくる回転可能なことが分かると思います。炭素-炭素の単結合は回転可能と習います。回転可能なのでエタンにはシス-トランス異性体は存在しません。ただし、実際のエタン分子は模型のように簡単にくるくる回転するわけではないようです。

エタンが取りうる2つの配座を、それぞれ重なり形配座とねじれ形配座とすると、どちらのほうがより安定でしょうか。化学の世界ではより安定なほうに収束していくので、2つの配座に安定性の差があれば安定なほうに固定されます。エタンの場合はねじれ形のほうが安定で、重なり形と比べると12kJ/molエネルギーが低いです。したがってねじれ形から重なり形を乗り越えてくるっと回転するためには相応のエネルギーが必要になります。
ねじれ形が安定になる理由は軌道(電子対)同士の反発力を考えると直感的にも分かりますよね。
極性
極性も電子の性質によって定まる構造です。分子の形は視覚的に確認できるのに対し、極性は作用(運動を起こす能力)です。
極性共有結合
前回触れたように原子価結合法では原子が電子を出し合う状態を結合といいます。この時、結合する原子の間に電気陰性度の差があると、電子が一方に引っ張られる現象がおきます。

水分子を見てみましょう。酸素の電気陰性度が高いので、共有電子対は酸素側に引っ張られます。これによって、酸素原子はややマイナスに帯電し、水素原子はややプラスに帯電した状態の共有結合になります。これが極性共有結合です。δ-/+を使って小さな電荷の偏り(極性)を表します。
極性分子
結合の極性のベクトルによって、分子自体が極性を持つものを極性分子といいます。正の方向のベクトルを合わせたものを双極子モーメントといいますが、これは実際に電子が引き寄せられる方向とは逆向きなのでちょっとトリッキーです。

水分子は酸素原子側に電子が引き寄せられるので、双極子モーメントは水素原子へ分極した正の矢印のベクトルになります。
一方で、二酸化炭素のように直線上に並んだ分子の場合、個々の結合が分極していても分子全体でみると打ち消しあって無極性になることがあります。
電気陰性度
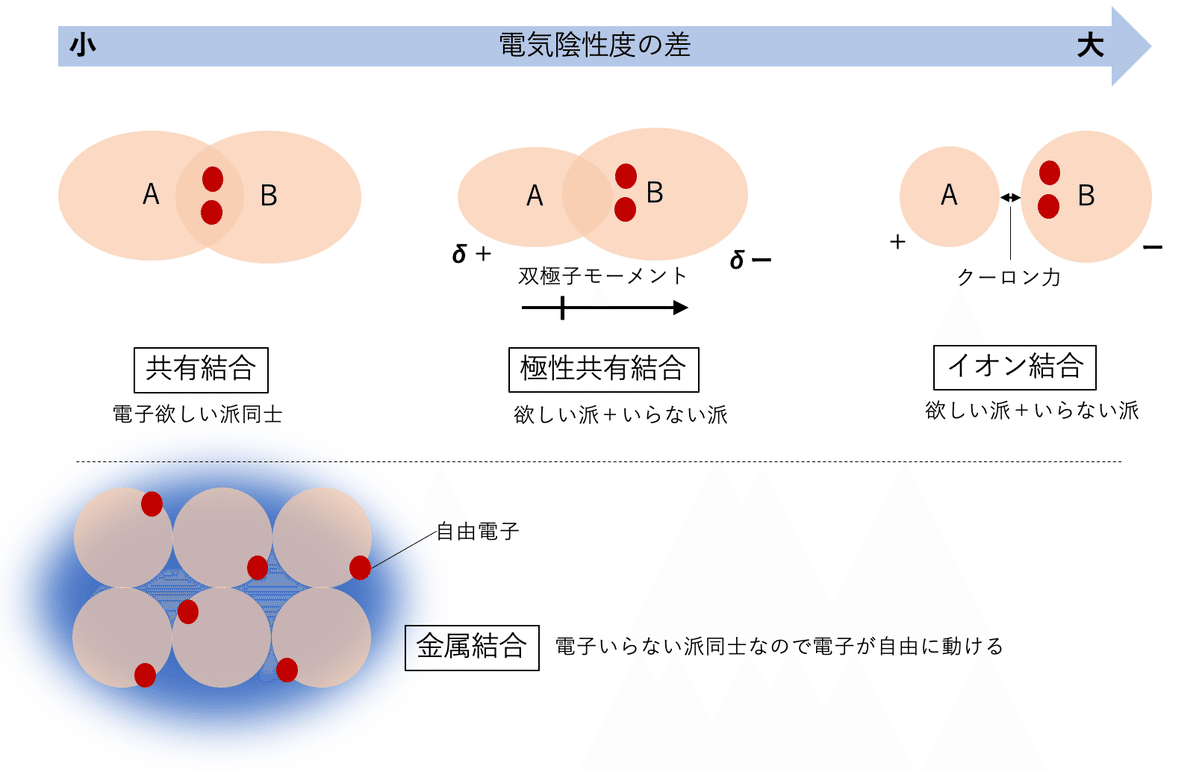
電気陰性度は原子が電子を引き寄せる強さの度合いです。乱暴に例えると電気陰性度が高い原子は「電子欲しい派」、低い原子は「電子いらない派」です。

電気陰性度は周期表の右上が高く左下が低いと言われます。別の言い方をすると、2p軌や3p軌道すべてに電子がペアで入ると安定する性質が関係しています。最外殻に8個の電子が入るのでオクテット則ともいいます。17族(ハロゲン)はあと電子1個を得ると安定するから「電子欲しい派」になり、1族は電子を1個手放せばいいので「電子いらない派」になるわけです。
欲しい度合いが同じ者同士が結合すると極性のない共有結合になります。「欲しい派」と「いらない派」が結合すると、「欲しい派」のほうに電子対が偏ります。その偏りが大きくなるとイオン結合と言われます。「いらない派」同士の結合は金属結合です。
電気陰性度はめちゃくちゃ大事です。誘起効果、酸化還元、酸と塩基など、すべてに関わってきます。イオン化エネルギーや電子親和力という用語もありますが、それらも電気陰性度が関係しています。
酸素は「電子欲しい派」の急先鋒で、炭素や水素はリベラルな感じ、ナトリウムやマグネシウムなどの金属は「いらない派」代表です。酸素は他の原子から電子をどんどん奪っていって、化学反応を起こしまくります。ある意味やべー奴です。ビールの品質管理で溶存酸素が重視されるのはそういった背景があるのです。
次回へと続く
分子の形と極性、いかがでしたでしょうか。分子の形も極性も電子の性質と軌道によって規定されています。電子の性質と軌道(電子対)同士の反発によって分子の形が決まります。極性は電子が安定したいために生じる作用の差という感じでしょうか。
次回は化学反応についてにしようか迷ったのですが、一旦官能基の話をしようと思います。反応に入る前に官能基を説明したほうが分かりやすいかなと思ったので。
お読みくださりありがとうございます。この記事を読んで面白かったと思った方、なんだか喉が乾いてビールが飲みたくなった方、よろしけばこちらへどうぞ。
今回は新規リリースがないので、定番ビールの紹介です。Far Yeast 東京ホワイト。地元では「Far Yeast ホワイト」「源流ホワイト」「富士山クラフト」という名前で出ていたりもします。
先日のBrewers Cupでも小麦ビール部門で4位入賞を果たし、これで通算19回めのコンペ受賞となりました。
タップマルシェやホームタップでも提供されています。
見かけたらぜひお試しくださいませ。

