
2021年ノーベル化学賞解説「不斉有機触媒の開発に対して」
初めに
6 October 2021
The Royal Swedish Academy of Sciences has decided to award the Nobel Prize in Chemistry 2021 to
Benjamin List
Max-Planck-Institut für Kohlenforschung, Mülheim an der Ruhr, Germany
David W.C. MacMillan
Princeton University, USA
“for the development of asymmetric organocatalysis”
引用元: "Press release: The Nobel Prize in Chemistry 2021". (Oct , 2021) The offical website of the Nobel Prize.
6 oktober 2021
Kungl. Vetenskapsakademien har beslutat utdela Nobelpriset i kemi 2021 till
Benjamin List
Max-Planck-Institut für Kohlenforschung, Mülheim an der Ruhr, Germany
David W.C. MacMillan
Princeton University, USA
“för utveckling av asymmetrisk organokatalys”
引用元: "Pressmeddelande: Nobelpriset i kemi 2021". (Okt 6, 2021) The offical website of the Nobel Prize.
【上記訳】
2021年10月6日、スウェーデン王立科学アカデミーは、2021年ノーベル化学賞を以下の者に授与する事に決定しました。
ベンジャミン・リスト
マックス・プランク石炭研究所、ミュールハイム・アン・デア・ルール、ドイツ連邦共和国
デイヴィッド・W・C・マクミラン
プリンストン大学、アメリカ合衆国
「不斉有機触媒の開発に対して」

Benjamin List
Ill. Niklas Elmehed © Nobel Prize Outreach
○Benjamin List (ベンジャミン・リスト): ドイツ連邦共和国出身、1968年1月11日生まれの53歳、ドイツ連邦共和国、マックス・プランク石炭研究所所属、賞への貢献度1/2

David William Cross MacMillan
Ill. Niklas Elmehed © Nobel Prize Outreach
○David William Cross MacMillan (デイヴィッド・ウィリアム・クロス・マクミラン): グレートブリテン及び北アイルランド連合王国出身、1968年3月16日生まれの53歳、アメリカ合衆国、プリンストン大学所属、賞への貢献度1/2
※以下の文章は、全て以下の参考文献に基づいています。また、画像は注記がある場合を除き、全て©Johan Jarnestad/The Royal Swedish Academy of Sciencesによる作品であり、以下の参考文献より引用したものです。
○"Popular information: Their tools revolutionised the construction of molecules". (Oct 6, 2021) The offical website of the Nobel Prize.
○"Scientific Background: Enamine and iminium ion-mediated organocatalysis (PDF)". Oct 6, 2021) The offical website of the Nobel Prize.
触媒はノーベル賞の宝庫

【図1】
自然と比べたら、人類の化学はつい最近まで石器時代のレベルだったよ。自然に対抗するには新しい道具の開発が必要だったよ。
私たちの身の回りには様々な物質があるよね。そしてそれらは多くの場合、自然そのままではなく、何らかの化学反応を経由して作られたものを使っているよ。紙でできた本、プラスチックと金属の塊のスマートフォン、体調がよくない時に飲む風邪薬……これは自然では希少なものや存在しないものでできているよ。例え天然木や自然石をそのまま使っている事をウリにしている家具だって、天板をジョイントしたり、そもそも天板へと加工するのにも、硬い金属の工具が必要だね。ところが、自然にはない物質を生み出して、見た目には化学の世界では自然に勝っているように見える人類の化学は、実際にはつい最近まで自然に相当負けていたよ。それこそ、自然を現代の家具職人とするなら、人類の化学は石器時代のノミとハンマーだけを使っているような状況で、これではまともに平らな椅子や机を作るのは難しいよね。それと同じような状況が化学にはあって、画期的な新しい道具の発明には何度もノーベル賞が贈られたくらいの難しい課題だよ。
ところで、話は現代の化学が花開いた19世紀に遡るよ。様々な物質を混ぜて化学反応をさせる実験が世界中で行われている中で、奇妙な発見があったよ。例えば、過酸化水素に銀を入れると、たちまち水と酸素に分解する反応が起きたよ。ところが、銀は全く化学反応していないように見えたよ。発芽した穀物由来の物質にでんぷんを混ぜると、それがブドウ糖に変化して見えるものの、穀物由来の物質には何の変化もなかったよ。1835年、イェンス・ヤコブ・ベルセリウスは、その物質を入れた時にだけ化学反応が開始されるけど、その物質自身は化学反応の前後で全く変化しない例がいくつもある事、そのような化学活性を生成するような力を持つ物質が存在する事を報告したよ。ベルゼリウスはこのような物質を触媒と名付け、この言葉は現在でも使われている、非常に重要な化学用語となったよ。触媒がなんで触媒として働くのか、というメカニズムについては、一言で簡単に語る事は不可能だけど、おおよそこんな感じだよ。化学反応というのは、突き詰めれば、原子同士の間でどのように電子がやり取りされるのか、という過程だよ。電子がやり取りされるための道筋は、平坦や谷間な事もあるけど、分解しにくい物質や反応しにくい物質は、この道がきつい峠道であり、中々登りにくい事を意味するよ。触媒は、例えば休憩スポットを用意したり、山にトンネルを掘ったりして、電子が行くルート (つまり反応が進むルート) を楽にし、化学反応を促進する役目を果たしているよ。それだけでなく、触媒は特定の電子のやり取りだけを促すから、決まった形の分子を作ったり、分子の特定の位置に原子をくっつけるなどを狙って行う事ができるんだよ!
現在、世界のGDPの35%が何らかの化学触媒作用に関係していると推定されているように、触媒の存在は人類の化学においてとてつもなく重要な立ち位置にあるよ。恐らく最も一番身近なのは、ガソリン車の排気ガス処理だね。ガソリン車が燃料を燃やして排出する排気ガスは、そのままだととても有害な物質を含んでいるけど、白金を主とする触媒を通過させる事で、そのような有害な物質を分解させてから排気ガスを外に出しているよ。白金と言うとプラチナジュエリーなど宝飾品のイメージがあるけど、それよりも多く使われる分野の1つが、この触媒に対する用途なくらいだよ!触媒は分解しにくい物質を分解させ、反応しにくい2つの物質を化合させ、化合物の特定の位置に特定の原子をくっつけるなど、様々な役割を担っているよ。石器時代のノミとハンマーより優れた道具と言うわけだね。触媒という新しい道具がいかに重要かは、過去8回も触媒に関係するノーベル化学賞が授与された事を観ればわかるね。つまり、今回は9回目の例となる訳だよ。
●1909年: フリードリヒ・ヴィルヘルム・オストヴァルト
白金触媒下でアンモニア・酸素・水から硝酸を得るオストワルト法の開発
●1912年: ポール・サバティエ
ニッケル触媒下で二酸化炭素と水素からメタンと水を得るサバティエ反応の開発
●1918年: フリッツ・ハーバー
鉄触媒下で窒素と水素からアンモニアを得るハーバー・ボッシュ法の開発
●1963年: カール・ツィーグラー&ジュリオ・ナッタ
三塩化チタン+トリエチルアルミニウム触媒下でオレフィン重合反応を促すツィーグラー・ナッタ触媒の開発
●1975年: ジョン・コーンフォース
酵素触媒がどの分子のどの位置の反応を促すかを解明
●2001年: ウィリアム・スタンディッシュ・ノールズ&野依良治&カール・バリー・シャープレス
不斉触媒に関して、ノールズと野依は野依不斉水素化反応などの水素化反応、シャープレスはシャープレス酸化など酸化反応に対する功績
●2005年: イヴ・ショーヴァン&ロバート・ハワード・グラブス&リチャード・ロイス・シュロック
オレフィンメタセシス反応を詳しく解明し、グラブス触媒の開発
●2010年: リチャード・ヘック&根岸英一&鈴木章
いずれもパラジウム錯体を触媒とする、溝呂木・ヘック反応、根岸カップリング、鈴木・宮浦カップリングの開発
2000年まで、触媒は2種類だった
ところで、2000年より前に発見された触媒は、そのほとんどが2種類に大別されていたよ。1種類目の金属触媒は、名前の通り金属そのものや、金属を含む化合物の触媒だよ。さっき、触媒は電子のやり取りを促す役割と言ったけど、金属原子はそのやり取りの効率がとても良いから、触媒として優秀な役割を果たすわけ。ところが、金属触媒には難点もあるよ。一部の金属触媒は水や酸素があると分解してしまうものがあるから、触媒として使うのに制約のあるものがあったよ。これは少量の反応だけやればよい実験室ならともかく、大規模な反応を起こす化学工業では維持しにくい環境で、仮にそれをやるなら莫大なコストがかかるよ。また、金属触媒の多くは、効率の良い貴金属や重金属を使っているから、価格が高くて資源的に不安定だったり、生成物への混入や環境へ漏れ出した時の健康や環境に対する悪影響とかが懸念されるんだよ。貴金属や重金属を使わない金属触媒を見つける努力も各地で行われているけど、これが中々置き換わらないのが金属触媒の難しいところでもあるんだよ。
2種類目の酵素触媒は、生物の身体で使用されている酵素をそのまま、あるいは改良して使用しているものだよ。酵素の身近な例は唾液だよ。ご飯やパンを噛み続けると、段々と甘く感じるのは、唾液に含まれるアミラーゼという酵素が、炭水化物をブドウ糖へと分解するという触媒作用に由来しているんだよ。生物の身体の中には酵素が無数にあって、様々な化学反応に関わっているけど、その中でも特にユニークなのは、光学異性体 (正確にはエナンチオマー) と言う分子の生成を担うものが多い、と言う点だよ。酵素触媒において光学異性体は欠かせないから、光学異性体について簡単に説明するね。
化学は鏡の世界

【図2】
光学異性体は、形が全く一緒だけど、鏡写しの関係で、どう回しても決して重なる事のない分子だよ。普通の化学反応においては区別されないけど、生体では全く違う反応をするよ。例えば柑橘類のリモネンでは、左側はレモンの香り、右側ではオレンジの香りとして感じるよ。
光学異性体は、鏡像異性体や対掌体という別名もある通り、分子の立体構造に重要な点があるよ。右手と左手は、一見すると同じ形に見えるけど、 (あなたが4次元以上の空間次元の住民でもない限り) 右手をどんな風に回転させようと、左手と全く同じ向きにすることはできないよね?これは、右手と左手が鏡写しの関係だからだよ。分子にも、このように形が全く同じでも、鏡写しのようにお互いに同じ向きにする事ができない関係のものがあって、これを光学異性体というよ。一般的な化学反応では、光学異性体は鏡写し以外の部分は全く同じだから、分子を合成した時に半々ずつできるよ。一方で酵素は、この光学異性体の片方だけに反応するように特化しているものがたくさんあるから、酵素触媒を使えば、光学異性体の片方だけを作る事ができるんだよ!このような、光学異性体の片方だけを作れる触媒を不斉触媒と言うよ。光学異性体の片方だけを作るのがなんで重要なのかと言うと、一般的ではない化学反応、つまりは生物の体内で行われる化学反応では重要な違いを生むからだよ。生物の体内で行われる化学反応は、光学異性体同士で反応が違う場合があるんだよ。例えばリモネンという柑橘類に含まれる分子は、その片方はレモンの香りがするけど、もう片方はオレンジの香りがするんだよ。香りに関わる分子だと、片方はいい匂いがする一方で、もう片方は別の臭い、それもいい匂いとは限らず、悪臭だったり、全く臭いを感じないという例がたくさんあるよ。ただ、単に悪臭で不快な思いをするだけならまだいいけど、人体に有害だったりする例もあるから非常に厄介だよ。有名な例がサリドマイドだよ。サリドマイドは胎児の催奇性を持っていて、睡眠薬や妊婦のつわり防止薬として処方された結果、死産や奇形などで多数の被害者が生じた、医薬品に関する負の歴史の例だよ。後の研究で、サリドマイドの催奇性は、光学異性体の片方にのみ存在する性質である事が明らかとなったんだよ (ただし更に後の研究で、無害な方のみを投与しても、有害な方への変化が生体内で起こる事も明らかになったよ) 。医薬品には、光学異性体の片方のみが有効性を示し、もう片方は有害だったり重大な副作用を持つものが多数あるから、光学異性体をまぜこぜに生み出す普通の化学反応ではなく、酵素触媒を使った化学反応が重宝される場面はたくさんあるんだよ。不斉触媒の研究だけでも大変な成果で、例えば2001年にウィリアム・スタンディッシュ・ノールズ、野依良治、カール・バリー・シャープレスに贈られたノーベル化学賞は、いずれも不斉触媒に関する研究に対して贈られたものだよ。野依不斉水素化反応やシャープレス酸化など、ノーベル賞だけでなく反応自体に名前が付けられるくらいのすっごい成果なんだよ!
さて話を酵素触媒に戻すと、酵素触媒が光学異性体の片方だけを作るような選択性があるのは、まず1つには酵素の構造の複雑さが理由だよ。酵素は複雑なタンパク質でできた分子で、タンパク質はアミノ酸という部品が寄り集まって作られているよ。アミノ酸の中にも、光学異性体で構成されているものがあったりして、アミノ酸の構造や、酵素の中での立体的な位置が、光学異性体の片方の分子のみを作り出すのにちょうどいい形をしているんだよ。右利き用のハサミで紙を切る時、右利きの人ならすぐに使いこなせるけど、左利きの人はそうはいかない、という感覚と似ているかな?また、酵素触媒は大抵1つの酵素触媒では反応が完結せず、1つの酵素触媒で反応が終わると、すぐに次の別の酵素触媒が別の反応のために分子を引き継ぐ、というカスケード反応が起こるよ。組立工場のベルトコンベアみたいだね。酵素触媒がこういう多段階方式を取っているのは、最終的に出来上がる分子を達成するには、途中で反応中間体と言う不安定な分子を経由する必要があるからだよ。反応中間体は非常に不安定な構造をしていて、速やかに分解してしまうんだけど、酵素触媒のカスケード反応はとても速度が速いから、反応中間体が壊れてしまう前に次の酵素触媒へと反応を引き継ぐ事ができるんだよ。酵素触媒の機能は非常に優れていて、生物はコレステロール、クロロフィル (葉緑素) 、あるいはストリキニーネと言った複雑な構造の分子を正確に構築する事ができるよ。天然に存在する有機分子は、科学者が実験室でイチから合成する事が達成されていないものも数多くあるから、自然の触媒というのはとてもすごいんだよ!ただ、酵素触媒にも難点はあるよ。まず、酵素そのものがかなり複雑な分子だから、これを作り出すのが困難で、コストも高くなりがちだよ。次に、酵素の中で起きている反応が多段階かつ複雑だから、解析するのも難しくて、酵素触媒の理解や人工的な改良を阻んでいるよ。そして、酵素はタンパク質という、いわば生ものだから、あまりに極端な温度や酸性度環境では壊れてしまうし、使い続けての変質も金属触媒よりもしやすい、という弱点もまたあるんだよ。
新登場!不斉有機触媒!

【図3】
有機触媒にはかなり古くから先例があったけど、これは単発の発見報告にとどまっていたよ。
2000年まで触媒のほとんどは金属触媒と酵素触媒に分けられると説明したけど、全てとは書かなかったのは、どちらにも当てはまらない触媒、低分子の有機化合物による有機触媒があったからだよ。ただし、これはあくまで単発で出された例であって、応用や発展が無かったからあんまり注目されてこなかったよ。一応おさらいしておくと、ここで言う有機化合物は、炭素を基本として、水素・酸素・窒素・硫黄・燐など、軽い元素が結合したもので、金属元素を含まないものだよ。最も古い例は1860年にユストゥス・フォン・リービッヒによって報告されたもので、ジシアンがオキサミドへと加水分解する反応をアセトアルデヒドが触媒する事を発見したよ。光学異性体を触媒として利用した例だと、1912年にゲオルク・ブレディグとスーザン・タフツ・フィスケによって報告されたものが最初で、ベンズアルデヒドにシアン化水素を特定の位置にくっ付け、シアノヒドリンという分子構造を作るのに、光学異性体を持つ分子であるキニンとキニジンが触媒作用を持つ事を発見したよ。1960年には、ホルスト・プラセユスがキニン由来の触媒によってメチルフェニルケトンからメタノールへの不斉付加を促進する事を発見したよ。これらを含め、いくつかの報告例はポツポツとあったんだけど、金属触媒や酵素触媒が優秀すぎる事もあって、単発での発見で終わってしまう事が多かったからだよ。ただし全く発展が無かったわけでもなくて、いくつかの有機物は触媒になり得る事が情報共有された事、酵素でなくてもアミノ酸が触媒になり得る事が指摘されていたよ。
ここでようやく登場するのが、今回のノーベル化学賞の受賞者の1人、ベンジャミン・リストだよ。リストは1990年代、カルロス・F・ハルバス3世の研究チームに所属し、酵素触媒について研究をしていたよ。その中で、抗体の1つであるAb38C2という酵素触媒を研究していたんだけど、リストはある考えに至ったよ。酵素触媒は、酵素と言うタンパク質の部品であるアミノ酸が複数結合したもので、更に酵素としての働きを促進するために金属原子を含んでいるよ、しかし、酵素触媒で触媒として作用する部分は、酵素の中の一部のアミノ酸である事も分かっていたよ。という事は、何も酵素を使わなくても、その中の一部の部品で、低分子有機化合物であるアミノ酸を使えば、触媒として働くんじゃないかと考えたんだよ。ただし、これはあまりに単純な考えだよ。斧が丸太を割るのは刃の部分だけど、じゃあ木の柄を無くしても働くのかと言われたらそうじゃないよね?これと同じように、アミノ酸の触媒作用は、酵素の特定の位置にある事によって触媒として働くものと考えられるから、部品としてばらしても触媒になるかどうかは分からなかったよ。

【図4】
多数の原子が絡み合った複雑な紐の塊のような酵素と比較すれば、プロリンは非常にシンプルな分子なことが分かるね。

【図5】
プロリンが触媒作用を持っているのは、既に1970年代には報告があったよ。ヘイオース=パリッシュ=エダー=ザウアー=ウィーチャート反応によって、様々な物質の合成の原料として使われるウィーランド・ミーシャーケトンという分子が合成できたよ。

【図7】
リストがプロリンによるアルドール反応の研究の参考にした、抗体酵素であるAb38C2を酵素触媒として使用した化学反応だよ。

【図8】
実験の結果、プロリンだけでも触媒としての活性があり、不斉反応が起きる事が明らかとなったよ!
リストやハルバス3世らは、プロリン (正確にはL-プロリン) いうアミノ酸が触媒として働くかどうかを調べたよ。リストがこの研究に着手する前に、1970年代に複数の研究チームによってプロリンが不斉有機触媒である事が報告されていて、研究者の名前を取ってヘイオース=パリッシュ=エダー=ザウアー=ウィーチャート反応と呼ばれていたよ。この反応はロビンソン環化反応というものに分類されるアルドール反応の1種だけど、これを説明してもチンプンカンプンになると思うから、有機物を作る上で非常によく使われる基本的な道具の1つ、という感じで覚えてもらえればいいかな。この報告では、様々な有機化合物の合成の原料となるウィーランド・ミーシャーケトンが合成できるという、かなり重要な結果があったけど、なぜかこの研究は、リストが研究を進展するまでしばらく忘れ去られていたよ。リストがAb38C2触媒の反応を参考に、単純な構成部品に過ぎないプロリンでも同様のアルドール反応が起きるかどうかを調べたよ。その結果、30mol%の割合でDMSO (ジメチルスルホキシド) にプロリンを溶かした溶液中での試験で、プロリンだけでもアルドール反応が起きる事が分かったんだよ!プロリンは金属触媒や酵素触媒と比べれば非常に低分子で、どこにでもあるからコストも安いし、環境に対して無害だよ。利点はそれだけでなく、プロリンは不斉触媒としての機能、つまり光学異性体を作り出すのに特化している事を見出したんだよ!6種類の化学反応で原料からの生産効率が54%から97%、光学異性体の片方の割合が98%と、とても効率的な事が分かったんだよ!2000年2月にこの研究を論文にまとめたリストは、この不斉有機触媒の発見が、単にプロリンだけにとどまらず、無数にある有機化合物にもそういった触媒が眠っている可能性について言及しているよ。
メタルフリーな有機触媒
これとほぼ同じ時期、もう1人の受賞者であるデイヴィッド・ウィリアム・クロス・マクミランも、同じように不斉触媒に取り組んでいたよ。マクラミンが当時研究していたのは金属不斉触媒で、この当時は他の研究者も熱心に取り組んでいる一般的なものだったよ。ただ、金属不斉触媒は効率は良かったけど、反応性が高くて、一部については水や酸素のある環境では使えないという弱点が明らかになっていたよ。実験室ならともかく、化学工業として大規模化するにはこれは明らかに弱点で、マクラミンは開発された金属不斉触媒のほとんどが産業界では使用されていない事を指摘していたよ。マクラミンはこの問題に対応したよ。

【図9】
金属触媒の機能は、化学的に不安定だったり、重金属を含んでいる事が問題とされてきたよ。一方でその優秀さは折り紙付きだから、メタルフリーな触媒を作るには一工夫が欠かせないよ。

【図10】
エナミンやイミニウムを不斉触媒とした化学反応の例だよ。

【図11】
エナミンやイミニウムを不斉触媒とした複雑な化学反応の例だよ。この反応は循環していて、一度化学反応に関わった触媒が別の反応で機能を取り戻すところに特徴があるよ。
金属触媒が優秀な理由は、簡単に言えば、金属原子が電子のやり取りを手助けする能力が高いからなんだけど、マクラミンは有機化合物を構成する非金属元素だけで金属元素と同じような能力を持つ触媒を見つける努力をしたよ。マクラミンは、豊富な有機化学に対する知識を使って、無限にすらあるとも思える候補から、イミニウムやエナミンという構造を持つ有機化合物に着目したよ。イミニウムは[R¹R²C=NR³R⁴]⁺、エナミンはR¹R²C=CR³−NR⁴一般構造を持つ有機化合物の事を言うけど、これじゃなんのこっちゃだよね。ここで覚えておいてほしいのは、イミニウムは全体でプラスの電荷を持っていて、電子のやり取りを促しやすい窒素原子が含まれている、エナミンは電荷としては中性だけど、やはり電子のやり取りを促しやすい構造である、という点だよ。マクラミンはイミニウムやエナミンを含むいくつかの有機分子を選び出して、ディールス・アルダー反応という炭素原子が環の構造を持つようにする化学反応に対して、どの程度触媒作用を持つのかを調べたよ。その結果、多くのイミニウムやエナミンを含む有機分子で触媒として機能した事を確認しただけでなく、一部の分子は不斉触媒としても働く事を見つけたんだよ。効率の良いものだと、片方の光学異性体を90%以上の割合で生成する事ができたんだよ!
2000年1月、つまりリストが論文を発表する直前に、マクラミンは一連の成果を論文として発表したよ。マクラミンは多くの低分子有機化合物に不斉触媒としての機能がある事を発見していて、過去の研究は単発的である事から、包括的な概念としての名前が必要なことに気づいたよ。マクラミンは一連の成果について有機触媒という名前を付けたよ。これにより、触媒の分類は3種類へと広がったんだよ。有機触媒は触媒の世界において、新しく発見された金脈で、リストとマクラミンは次々に不斉有機触媒を発見する、最初のゴールドラッシュを切り開いたんだよ。さっきも少し触れたけど、不斉有機触媒は低分子の有機化合物で、自然界にも豊富にあり、人工合成も用意な事から、まずは何よりもコストが低い事が利点として挙げられるよ。それだけでなく、不斉有機触媒は、酵素触媒と同じようにカスケード反応、つまりベルトコンベアのように次々と反応を継続させる機能を持つものも多く含まれている事が利点として挙げられるんだよ。カスケード反応が重要なのは、不安定な反応中間体を経由し、なおかつ分解してしまう前に別の分子へと速やかに作り変える点と、反応を途切れさせる事なく継続させられる点だよ。前者はまさに触媒としての働きだし、後者は原料から最終的な生成物を作るまでの無駄を最小限に抑える事が可能になるという点が優れているよ。複雑な構造を持つ有機分子は、合成するのに何段階ものステップが必要な場合があって、ステップが多ければ多いほど原料に対する生成物の量が減り、無駄な廃棄物が増えてしまう事に繋がるよ。
不斉有機触媒は化学の大革命!

【図12】
しばしば全合成の目標となる分子ストリキニーネ。低分子ながら複雑な立体構造をしている。
画像引用元: WikiMedia Commons (Autor: Vaccinationist / Public Domain)
有機触媒による著しい成果の一例はストリキニーネに観られるよ。マチンという植物から採れる物質で、極めて猛毒である上に激しい痛みを伴う事から、アガサ・メアリ・クラリッサ・クリスティの『スタイルズ荘の怪事件』を初め、ミステリーではよく登場する毒物だよ。アガサ・クリスティーがミステリーの女王なら、ストリキニーネはさながら有機分子全合成の女王とも言える存在で、低分子ながら構造が相当複雑な有機分子として知られているよ。全合成は、比較的簡単な分子から出発して目標となる分子を作る試みの事だよ。1952年にロバート・バーンズ・ウッドワードによって全合成された際、その化学反応は29ステップもあり、初めの原料に対するストリキニーネの量は0.0009%しかなかったよ。ストリキニーネを始めとする様々な有機分子の合成で1965年にノーベル化学賞が授与されたウッドワードでさえ手を焼くほどの難しさが、有機化学者がストリキニーネに夢中になる理由だよ。有機触媒が登場した後の2011年、ストリキニーネの全合成はわずか12のステップまで短縮され、生成効率も7000倍も増えたんだよ!

【図13】
不斉有機触媒を使って高血圧治療薬アリスキレンを製造する反応だよ。
サリドマイドでも述べた通り、光学異性体の違いは医薬品では非常に重大な意味を持っているよ。不斉有機触媒が光学異性体の片方を合成できるのは、これまで実験室留まりだった不斉触媒を、医薬品の新規開発や製造において実用化する大きなきっかけになったんだよ。天然物から採集される光学異性体は、希少な植物や深海魚のような中々得られないものからしか採集できないものも多くあるけど、こういったものに医薬品としての活用が期待される物質も多く存在するよ。不斉有機触媒は、これまで希少すぎて手出しできなかったこれらの有機分子を合成し、臨床試験や実用化につなげられる可能性を大きく残しているんだよ。既に実用化されているものもいくつもあって、例えば抗うつ薬や抗不安薬のパロキセチン (商品名パキシル) 、インフルエンザウイルスに効く抗ウイルス薬のオセルタミビル (商品名タミフル) 、高血圧治療薬アリスキレン (商品名ラジレス) などの生産には不斉有機触媒が使われているよ!
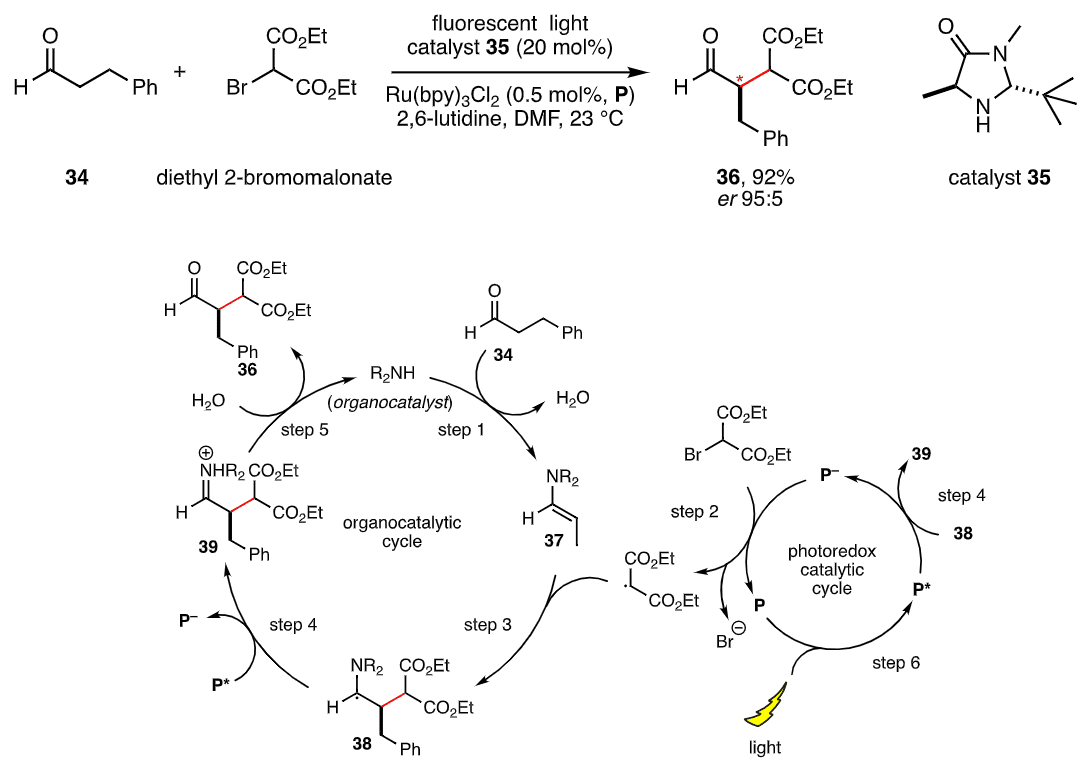
【図14】
左側が有機触媒による反応の循環、右側がフォトレドックス触媒による反応の循環。両輪は反応の循環をお互いに助けているよ。
また、医薬品以外でも有機触媒は大きな可能性を秘めているよ。植物は葉緑体によって光合成によって、無機物と光のエネルギーから有機物を生産しているよね?これと似たようなアイデアで、光のエネルギーを使う事で炭水化物などの有機物の形で化学エネルギーへと変換する試みが研究されているよ。これは環境問題や持続可能性のある社会においてとても重要なものだよね。このアイデアを実現するには、フォトレドックス触媒という遷移金属元素を中心とする触媒と、有機触媒の2種類が必要だよ。フォトレドックス触媒が光を受けて触媒として働く化学反応と、有機触媒が触媒として働く化学反応は、それぞれ環のように循環していて、その環の中で繋がる部分が1ヶ所だけあるよ。フォトレドックス触媒と有機触媒は、いわば自転車の両輪としてお互いに反応の環を回す原動力となるわけ。フォトレドックス触媒の相方となる環が、これまでの触媒ではいい候補が無かったんだけど、有機触媒の発見によってうまく行く相方が見つかった形で、この点も非常に重要な点なんだよ!
まとめ
リストやマクラミンが発見した、全く新しいカテゴリである不斉有機触媒は、見つける手掛かりが相当昔からあって、もっと早い時期に別の人が見つけていてもおかしくなかった発見だよ。でも、後で振り返ってみれば結構よくある事だけど、簡単な発想こそそこに気づくのが難しい、というのが不斉有機触媒にはあったんだよ。優秀な金属触媒や、自然が編み出した触媒である酵素触媒が無数にあり、化学者は誰もがここから触媒の勉強を初め、研究に取り組む、という環境では、低分子有機化合物が触媒になり得るなんて発想が逆に出てこないよ。そういう意味では、従来の知識や先入観にとらわれる事無く研究し、低分子有機化合物も触媒になるという事を発見したリストとマクラミンはとてもすごくて、だからこそノーベル化学賞に輝いだんだよ!不斉有機触媒は既に産業界に革命をもたらしていて、恐らくこれからももっと重要な触媒がたくさん出てくると思うんだよ!
主要な論文
Torsten Hoffmann, Guofu Zhong, Benjamin List, Doron Shabat, James Anderson, Svetlana Gramatikova, Richard A. Lerner & Carlos F. Barbas. "Aldolase Antibodies of Remarkable Scope". Journal of the American Chemical Society, 1998, 120 (12) 2768-2779. DOI: 10.1021/ja973676b
Benjamin List, Doron Shabat, Carlos F. Barbas III & Richard A. Lerner. "Enantioselective Total Synthesis of Some Brevicomins Using Aldolase Antibody 38C2". Chemistry—A European Journal, 1998; 4 (5) 881-885. DOI: 10.1002/(SICI)1521-3765(19980515)4:5<881::AID-CHEM881>3.0.CO;2-%23
Benjamin List, Richard A. Lerner & Carlos F. Barbas. "Proline-Catalyzed Direct Asymmetric Aldol Reactions". Journal of the American Chemical Society, 2000; 122 (10) 2395-2396. DOI: 10.1021/ja994280y
Kateri A. Ahrendt, Christopher J. Borths & David W. C. MacMillan. "New Strategies for Organic Catalysis: The First Highly Enantioselective Organocatalytic Diels−Alder Reaction". Journal of the American Chemical Society, 2000; 122 (17) 4243-4244. DOI: 10.1021/ja000092s
Benjamin List. "The Direct Catalytic Asymmetric Three-Component Mannich Reaction". Journal of the American Chemical Society, 2000, 122 (38) 9336-9337. DOI: 10.1021/ja001923x
Wendy S. Jen, John J. M. Wiener & David W. C. MacMillan. "New Strategies for Organic Catalysis: The First Enantioselective Organocatalytic 1,3-Dipolar Cycloaddition". Journal of the American Chemical Society, 2000, 122 (40) 9874-9875. DOI: 10.1021/ja005517p
Nick A. Paras & David W. C. MacMillan. "New Strategies in Organic Catalysis: The First Enantioselective Organocatalytic Friedel−Crafts Alkylation". Journal of the American Chemical Society, 2001; 123 (18) 4370-4371. DOI: 10.1021/ja015717g
Benjamin List. "Direct Catalytic Asymmetric α-Amination of Aldehydes". Journal of the American Chemical Society, 2002; 124 (20) 5656-5657. DOI: 10.1021/ja0261325
Nick A. Paras & David W. C. MacMillan. "The Enantioselective Organocatalytic 1,4-Addition of Electron-Rich Benzenes to α,β-Unsaturated Aldehydes". American Chemical Society, 2002; 124 (27) 7894-7895. DOI: 10.1021/ja025981p
Sean P. Brown, Nicole C. Goodwin & David W. C. MacMillan. "The First Enantioselective Organocatalytic Mukaiyama−Michael Reaction: A Direct Method for the Synthesis of Enantioenriched γ-Butenolide Architecture". American Chemical Society, 2003; 125 (5) 1192-1194. DOI: 10.1021/ja029095q
Benjamin List. "Enamine Catalysis Is a Powerful Strategy for the Catalytic Generation and Use of Carbanion Equivalents". Accounts of Chemical Research, 2004; 37 (8) 548-557. DOI: 10.1021/ar0300571
Jung Woon Yang, Maria T. Hechavarria Fonseca, Nicola Vignola & Benjamin List. "Metal-Free, Organocatalytic Asymmetric Transfer Hydrogenation of α,β-Unsaturated Aldehydes". Angewandte Chemie International Edition, 2004; 44 (1) 108-110. DOI: 10.1002/anie.200462432
Jayasree Seayad & Benjamin List. "Asymmetric organocatalysis". Organic & Biomolecular Chemistry, 2005; 3 (5) 719-724. DOI: 10.1039/B415217B
G. Lelais & D. W. C. MacMillan. "Modern Strategies in Organic Catalysis: The Advent and Development of Iminium Activation" Aldrichimica Acta, 2006; 39, 79-87.
T. D. Beeson, A. Mastracchio, J-B. Hong, K. Ashton & D. W. C. MacMillan. "Enantioselective Organocatalysis Using SOMO Activation" Science, 2007; 316 (5824) 582-585.
Jung Woon Yang, Carley Chandler, Michael Stadler, Daniela Kampen & Benjamin List. "Proline-catalysed Mannich reactions of acetaldehyde". Nature, 2008; 452 (7186) 453-455. DOI: 10.1038/nature06740
David A. Nicewicz & David W. C. MacMillan "Merging Photoredox Catalysis with Organocatalysis: The Direct Asymmetric Alkylation of Aldehydes". Science, 2008; 322 (5898) 77-80. DOI: 10.1126/science.1161976
Carley Chandler, Patrizia Galzerano, Anna Michrowska & Benjamin List. "The Proline-Catalyzed Double Mannich Reaction of Acetaldehyde with N-Boc Imines". Angewandte Chemie International Edition, 2009; 48 (11) 1978-1980.
Jay C. Conrad, Jongrock Kong, Brian N. Laforteza & David W. C. MacMillan. "Enantioselective α-Arylation of Aldehydes via Organo-SOMO Catalysis. An Ortho-Selective Arylation Reaction Based on an Open-Shell Pathway". American Chemical Society, 2009; 131 (33) 11640-11641. DOI: 10.1021/ja9026902
Benjamin List. "Asymmetric Organocatalysis (Topics in Current Chemistry Vol 291)". Springer, 2010. (Editor: Benjamin List)
