
【芳香族って】いくつあるんだ芳香族性 part1 【なんだよ(哲学)】
本稿は巷で「〇〇芳香族性」と呼ばれているものを著者の知りうる範囲で羅列していくコーナーです。
1.初めに
皆さんは普段、どのくらい芳香族について考えていますか?。そして、どれくらい芳香族のことを知っていますか。芳香族とは元素でいう希ガスのような存在です。高い反応性を有する類縁体が多い中で優雅に佇むその姿はまさにオアシス、癒しの存在。芳香族と聞いて普通に思い浮かぶもの、4n+2個のπ電子が環状にぐるぐる回っている方々。あなた方が思いをはせるのは、彼らだけではありませんか。もったいない、あまりにももったいない。この世の中にはいろんな「芳香族」があるんです。いろんな「芳香族化合物」ではありません、「芳香族」にもいろんな種類があるんです。「芳香族完全に理解したわ」と思っている学生の皆さん、さぁ、さらに深く、目くるめく芳香族の世界へ足を踏み入れてみましょう。そうすればきっと思うはずです。あぁ、芳香族ってなんだよ(哲学)。
※注意
本稿は芳香族に関する記事ですが、「そもそも芳香族性とは何か」とか「芳香族はなぜ安定か」といった内容には触れていません。それは簡単なようで奥深い議論であり、とてもサクッとまとめるのができないからです。なので、本稿は芳香族の基礎についてある程度知っている方が対象となるので、本稿を読む前に基礎有機化学や基礎量子科学の参考書でさらっとでも芳香族性について勉強しておくのがよいでしょう。
2.巷で芳香族と呼ばれているものの紹介
1. 非芳香族 (Nonaromatic)
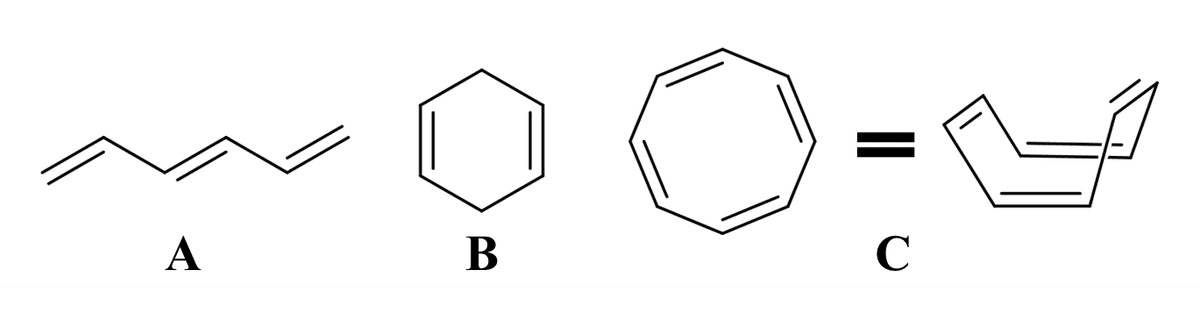
非芳香族とはその名の通り『芳香族ではない化合物』のことを指します。非芳香族は一般的に以下の3つの条件をどれか一つでも満たさないもの(化合物) が該当します。
①分子構造が環状である
②完全共役している
③分子構造が平面的である
Fig.1に示す化合物についてそれぞれ見てみましょう。Fig 1の化合物Aは環状ではないため明らかに条件①を満たしません。化合物Bは完全共役していないので明らかに条件②を満たしません。化合物Cの見た目は①~③を満たすように思えますが、実際の構造は右側のような折れ曲がった構造であり明らかに条件③を満たしません。以上よりFig 1のA~Cは芳香族ではない化合物=非芳香族化合物であるといえるのです。
非芳香族化合物は後述する芳香族のような安定化作用も反芳香族のような不安定化作用も働かないので、安定でもなくかつ不安定でもない通常の有機化合物のような振る舞いをします。特に次に紹介する反芳香族とこの非芳香族はごっちゃになりやすいので両者の違いをきちんと頭に入れておきましょう。
2. 反芳香族(Antiaromaticity)

芳香族性が「化合物の安定化」に寄与する性質ならば、反芳香族とは「化合物の不安定化」に寄与する性質です。反芳香族性は非芳香族で示した三つの条件にプラスして電子の非局在化に関与する電子の数(一般的にはπ電子が相当) が4n個の場合に発現します。すなわち、
①分子構造が環状である
②完全共役している
③分子構造が平面的である
④一つの環構造に4n個のπ電子を含む(nは0を含めた正の整数)
以上①~④の条件をすべて満たすものを一般的に反芳香族性化合物と呼びます。Fig.2に示している化合物は全て①~③の条件を満たし、かつπ電子の数はAは4個、Bは4個、Cは8個、Dは16個と4n個になっていることから④も満たしていることが分かります。安定化作用も不安定化作用も働かない非芳香族と異なり、反芳香族化合物は不安定で反応性が高く、結合長の等化も示しません。非芳香族とは明確に違う概念なのでごっちゃにならないようにしましょう。
※Fig.1 Cに示している物質、Cyclooctatetraeneは結構微妙な立ち位置の化合物で、非芳香族であると書いているものもあれば反芳香族であると書いているものもあります。Cyclooctatetraeneは基底状態では平面構造ではないため定義上は非芳香族に分類されるのですが、そもそもこの物質は反芳香族であり平面構造だと不安定になるからそれを回避するため折れ曲がっているという解釈もできます。なのでまぁ、どっちも間違いとは言えないのですが、個人的には非芳香族なんじゃないかなぁとは思っています。
3. ベンゼン系芳香族(ヒュッケル芳香族) (Hückel Aromaticity)

「親の顔より見た骨格」。はい、俗にいうヒュッケル則(4n+2個のπ電子を有する平面環状構造は芳香族性を有するというもの) に従う化合物をヒュッケル芳香族と呼び、その中でもベンゼン骨格を有するものはベンゼン系芳香族と呼びます。いわゆる古典的な芳香族化合物の一群であり、そのなかでもベンゼンおよびその誘導体は代表的な古典的芳香族化合物といえます。この子たちに関しては特になにか言うまでもないですね。大学有機化学でもしっかりと学ぶはずです。その安定化作用の起源についてはやや煩雑な議論が必要になるのですが、希ガスが閉殻という電子配置で安定になるように、ベンゼンもHückel則という電子配置で安定になっている、いわば分子における閉殻といえる状態になっているんだとざっくり解釈してOkです。なお、ベンゼンのようにπ電子によって生じる芳香族性はπ芳香族性とも呼ばれたりします。
4. 非ベンゼン系芳香族 (Non-benzenoid aromatics)

非ベンゼン系芳香族は、ヒュッケル則は満たすもののベンゼン骨格は持っていない化合物群のことを指します。後述するヘテロ芳香族とかもこの非ベンゼン系芳香族の一種ですが、特にヘテロ原子を持っていないものを指します。ここら辺からちょっと解釈が難しくなってきます。例えばFig.4-Aの化合物はナフタレンの中心結合がなくなったような構造をしており、確かに環全体でみれば10π電子系ですからぱっと見芳香族性をもっていることに疑問はないでしょう。が、ことはそう単純ではありません。Fig.5 をご覧ください。
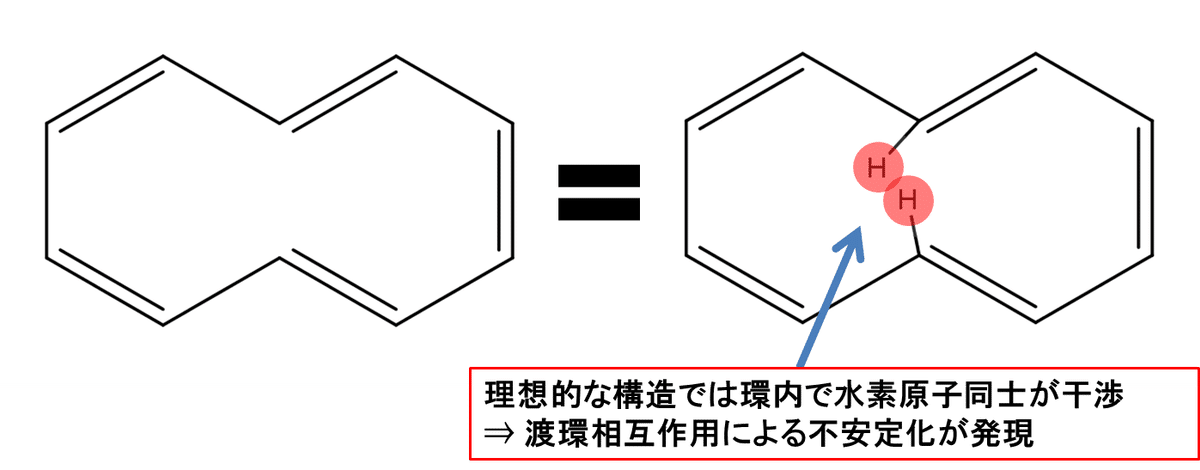
Fig.5 に示すように、Fig.4-Aの化合物は共役π結合が平面的になる理想構造(芳香族性が存分に発揮できる構造の意) では、環内で水素原子同士の渡環相互作用※1による不安定化が発現してしまうために実際の構造は理想構造よりも若干歪んでいます。また、そもそも Fig.4-Aの化合物にみられるような環内トランス二重結合が不安定であるということもあり、この化合物は多少芳香族性が失われているのです。これはまだ芳香族性による安定化が勝っていますが、もっと環が大きくなると([n]アヌレン) 分子のねじれが無視できなくなり、結果としてヒュッケル則を満たしていても芳香族性を発揮しないといった状況になってきます。
Fig4-Bの化合物はアズレンと呼ばれるもので非ベンゼン系芳香族の代表的なものです。π電子を数えてみるとちゃんと10π電子系であることが分かります。アズレンはベンゼン系芳香族であるナフタレンの構造異性体に相当する化合物ですが、ナフタレンと違って強い青色を呈するという特徴があります。これは励起状態においてFig.6に示すような2つの6π電子系芳香族構造に分極するためであると考えられています。
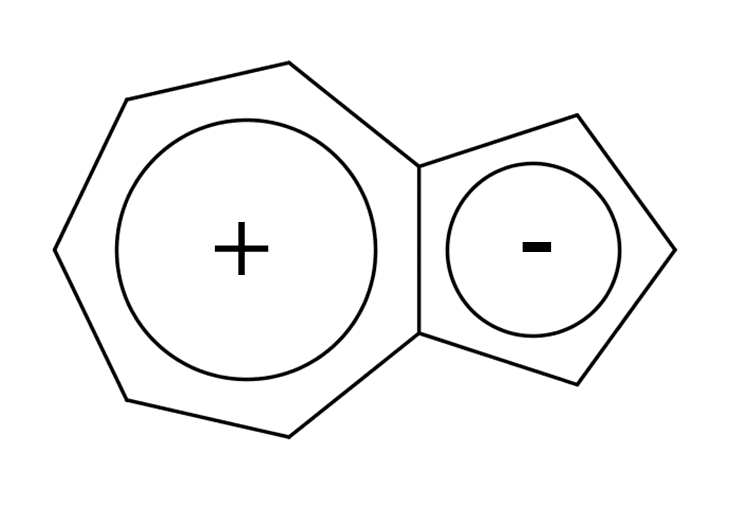
Fig.4-Cの化合物はトロポンといい、この構造を有する一連の化合物はトロポノイドと呼ばれて古くから研究がおこなわれています。余談ですが、トロポンの2位にヒドロキシ基がついた誘導体であるトロポロンを命名したのはかのDewar氏であり、そこからトロポノイドの化学はスタートしました。Fig.4-Cは「芳香族を持っている」という情報をもとに考えるとFig.7のような共鳴構造式がかけるために芳香族性をもつと考えられるでしょうし実際初期はそう考えられていました。つまりFig.7の真ん中の極限構造が6π電子系になっているということですね。

しかしながら各種理論計算の結果、Fig.7中央のような構造の共鳴寄与は小さいことが分かっており、Fig.4-Cの芳香族性は0ではないがとても小さいという状態のようです。なお、Fig.7の分極構造にプロトンが付加したヒドロキシトロピニウムカチオンやトロポン誘導体であるトロポロンは高い芳香族性をもっているということが分かっています。
Fig4-Dの化合物はペンタフルベンと呼ばれるもので、ベンゼンの構造異性体に相当するものです。ペンタフルベンはベンゼンと比べるとかなり不安定な化合物で、正直非ベンゼン系芳香族のグループに入れていいのかは結構悩みましたが、まぁ非ベンゼン系芳香族の一つとしてよく紹介されているのでここに入れました。ペンタフルベンの芳香族性についてはFig.8に示すような共鳴を考えてみましょう。

Fig8 に示すトロポンの極限構造を見てみると、Fig8-Aは6π電子系になっており芳香族性をもっていそうに見えます。が、ペンタフルベンの極限構造にはFig 8-Cのような反芳香族なものもあります。このようにペンタフルベンは芳香族と反芳香族の両方の性質を持っており、なかなか扱いの難しい化合物です。いっそ非芳香族に分類してもいいのかもしれませんね。因みにフルベンのような共役構造を持つ化合物を交差共役化合物とか呼んだりします。
5. ヘテロ芳香族(芳香族複素環化合物) (Aromatic Heterocycles)
ヘテロ芳香族は芳香族構造に炭素以外の原子が関与している化合物群のことを指します。芳香族性は別に炭素で構成しないとだめということはなく、芳香族性に寄与できる電子を持ってる原子ならぶっちゃけなんでも芳香族構造に組み込めることができます。ただし、炭素とヘテロ元素ではクーロン積分や共鳴積分が異なるため、ベンゼンの芳香族性とは性質が異なるという点には注意が必要です。具体的な化合物はFig 9をご覧ください。

Fig 9-Aはヘテロ芳香族の代表であるピリジンです。溶媒として使ったり塩基試薬として使ったり銅触媒を分液で抜くときに使ったりいろいろ便利な子なので有機化学系の研究室なら高確率で遭遇するでしょう。ただこの子の臭いのすさまじさは有名で、真夏に一週間くらい放置した生魚みたいな臭いがします。まぁ、真夏に生魚を一週間放置したことなんてないんですがね。Fig 9-Aの窒素原子はsp2混成状態になっており、その2p原子オービタルが6π電子系に組み込まれることで芳香族性を発揮します。

ピリジンの場合は窒素の非共有電子対がフリーなので塩基として作用したり水と水素結合できるから水に溶けたりといったことが可能です。逆に、非共有電子対が芳香系に組み込まれていないために、ピリジンは比較的酸化を受けやすい物質であるともいえるわけですね。まぁ、ここら辺の議論(ピロ―ルとの対比とか) は大体の教科書参考書で詳しく解説されてるのでそれらを参照してください。
Fig.9 -Bの化合物はフランですね。フランの芳香族性発現機構は酸素原子の非共有電子対が6π電子系に組み込まれることで発揮されます。

ただしこのフランという子、芳香族っちゃあ芳香族なんですが結構反応性の高い子です。ほっとくとあっという間に重合し始めるので重禁剤必須ですし、ジエンとしての性質が無視できないくらい残ってるのでDiels-Alder反応したり求電子置換を受けたりします。なので「芳香族だし安定っしょ!」と適当に扱うと痛い目を見るかもしれないので慎重に扱いましょう。余談ですがフランを水素化するとご存じTHFになります。現在の工業的な製法ではありませんが。THFと違いフランは水に溶けないのも注意です。
Fig.9-Cはウラシルと呼ばれているもので、DNAを構成している主要塩基成分の一つです。初見だと芳香族だと気づけない方も多そうですが、アミド結合がカルボニルと窒素の部分で共役するのでカルボニル炭素と窒素間の結合が二重結合性をもっているということを思い出せば、このウラシルも6個の電子が6員環をぐるりと囲んでいるということに気が付けるでしょう。ウラシル間についてはモルヌピラビルについて書いた記事内で詳しく説明しているので興味があったら是非見てみてください。
※この記事の余談-2にウラシルに関する話があります。
Fig.9-Dの化合物はぱっと見なんじゃこりゃな見た目をしていますね。これは環状ジアミノシリレンと呼ばれる化合物の一つで、ケイ素の部分が二価になっていることからケイ素版カルベンといえるようなものになります。いろいろと面白い特性を持つ子なんですが今回はあくまで芳香族の話なので深くは触れません。Fig.9-Dが芳香族を持つのは炭素-炭素二重結合のπ電子2個と窒素上の孤立電子対4個の計6個の電子がケイ素の非占有3p軌道を使って環状に非局在化できるためです。

ね?誰がどう見ても6π電子系の芳香族化合物でしょ?。え、なんか納得いかない?はい、その気持ちはよくわかります。この化合物の面白いところは2p軌道と3p軌道という異なる軌道間での共役によって芳香族性が成立している点で、芳香族性を構成するにはなにも同じ軌道オンリーである必要はないということが分かります。
part 1はここまで、part 2に続きます。
用語補足
※1 渡環相互作用
環状化合物におけるある原子・原子団・官能基と環の向かい側にある原子・原子団・官能基間に生じる相互作用。中員環以上の大きさを持つ環状分子ではその分子の反応性に大きくかかわってくることが多い。この相互作用の面白いところは、分子内相互作用であるにもかかわらず分子間相互作用のように扱える点である。
