XBB1価💉承認が示す厚労省の実態
久々,人口動態統計以外の厚労省ネタです。
Ⅴ類移行してから,厚労省が感染者数や死亡者数を公表しなくなり,アドバイザリーボードも月1になり,おまけにエクモネットもデータ更新を止めてしまったので,💉や感染者の公開情報がかなり限定されたため,実態が分かり難くなっています。
元々風邪なので,💉だ! 😷だ! 感染拡大だ! と大騒ぎする方が異常だったのですが,過剰死継続中なのに原因究明されないし,何より💉は継続してますので,9月20日からの秋接種で使用されるXBB1価💉がどのようなものか,というか,厚労省の実態を明らかにしたいと思います。
報道にある通り,9月1日にXBB1価💉が承認されました。
これまでは,医薬品メーカーが製造方法や臨床試験のデータを記載した申請書を提出し,それをPMDAが評価した報告書(特例承認に係る報告書)に基づいて厚労省が特例承認していました。P社だけでなくM社もT社も,さらに5~11歳用も6カ月~4歳用もブースターもそうでした。
ところが,今回のXBB1価💉の特例承認に係る報告書がPMDAのどこを探しても見つかりません。
で,色々調べてみた結果,厚労省はなかなか凄いことをやってました。
薬事・食品衛生審議会 医薬品第二部会において,以下の資料について議論されています。


「国際的な評価に倣って,ファイザーとモデルナの💉は,非臨床試験で中和抗体価が上昇していれば,必要に応じて販売後に有効性・安全性の確認を行うことにして承認する。」
ってことです。
Wikipediaによると
薬事承認(やくじしょうにん)とは、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第14条に基づき医薬品等について医薬品医療機器総合機構(PMDA)が有効性や安全性を審査したのちに、厚生労働省薬事分科会の答申を経た上で、厚生労働大臣が承認することである。
となっていて,この辺の法律は詳しくないので,どのような手続きがなされているのかわかりませんが,薬事法で決められてる手順を,たかが厚労省の審議会ごときが勝手に変えてよいものなのでしょうか?
これは,以前の記事
で取り上げた「緊急承認制度」に基づくものなのでしょうか?
例え,緊急承認制度に基づいて承認されたものだとしても,緊急承認は

緊急承認 : 緊急時に健康被害の拡大を防止するため、安全性が確認された上で有効性が推定される医薬品等に承認を与えるもの。
とあり,安全性の確認は絶対条件です。
で,新しい評価方針では,その最も重要な安全性について,
〇これまで実施されてきた臨床試験における安全性に係るデータや使用実績(接種後の副反応の発現状況等)から、安全性プロファイルには大きな差が無いことが確認されている。
〇安全性プロファイルに大きな影響を及ぼさないと考えられる。
〇従って、安全性に特段の懸念はないものと予見することは可能である。
となっています。
しかし,「臨床試験における安全性に係るデータ」が記載された「特例承認に係る報告書」には,

「現時点で本剤接種後長期の十分な安全性データは得られていないことには留意が必要である」
と書かれていて,さらに,「接種後の副反応の発現状況等」である「予防接種健康被害救済制度」の実態は


であり,これらのどこをどう解釈すれば
「安全性に特段の懸念はない」
などとふざけた結論に至るのか? 厚労官僚でも専門家でも審議会委員でも誰でもいいから説明してくれませんかね?
最終的に誰が責任を持ち承認するのかも,この文書からでは全く不明です。
しかも承認するのはファイザーとモデルナの💉だけという優遇措置。
明らかに秋接種に間に合わせるように臨床試験が無くても承認できるよう,あれこれ言い訳を並べて画策したという厚労省の実態が読み取れます。
で,この審議結果に基づいた,XBB1価💉の審査結果が以下の通りです。
薬事・食品衛生審議会 医薬品第二部会 資料
「1価(オミクロン株 XBB.1.5 系統)のコロナワクチンの審査結果について」

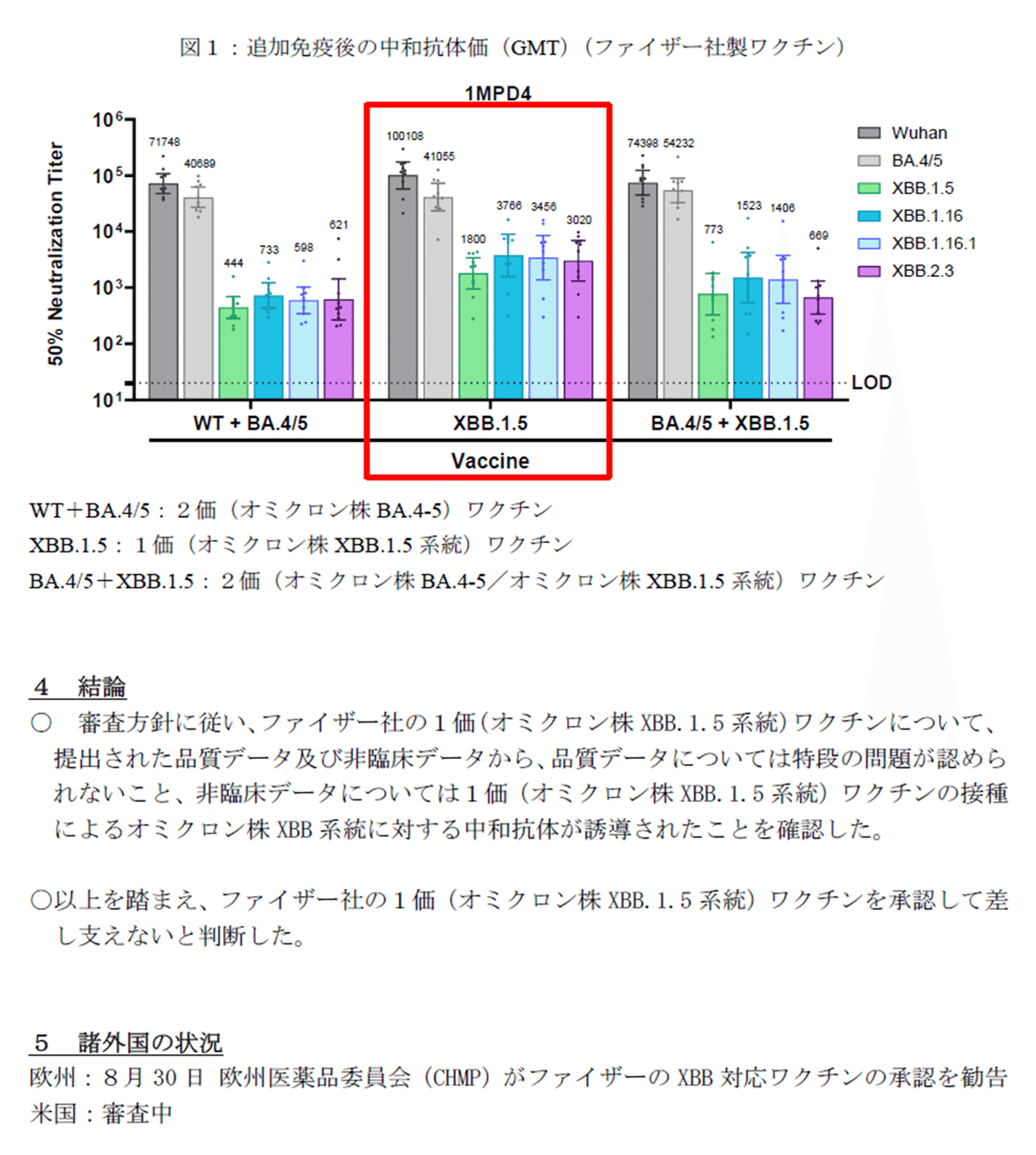
既に多くの方が暴露しているようにその有効性は「はぁ???」って感じです。
詳しくは他の方の記事を参照いただくとして,簡単に説明すると,
中和抗体価を,従来の2価💉とXBB1価💉で比較すると
武漢株 - 2価 : 71748,1価 : 100108
XBB1.5株- 2価 : 444, 1価 : 1800
で,武漢株に対しては,1価は2価の1.3倍しかないが,XBB1.5株に対しては,1価は2価の4倍もあるから従来の2価💉よりも1価の方が効果が高い。
というのが厚労省の説明ですが,武漢株の中和抗体価はXBB1.5株の50~150倍あるんですけど,そこは無視するようです。
(どなたかが作られたわかりやすい図がありましたので拝借しました)

で,この結果は
マウスによる試験のみで人では試験してません。(非臨床試験)
ということです。
しかも,「国際的な評価」に合わせて承認するなら,欧米がその手順で承認済みでないとおかしいはずですが
欧州は「承認を勧告」,米国は「審査中」
って,辻褄が合わなくないですか?
「必要に応じて製造販売後に有効性・安全性の確認を行う」
ってことは,承認時点で有効性も安全性も確認していないってことであり,この審査では,安全性については全く審査どころか言及さえなく,承認されました。
とうとう,政府・厚労省は,こんな恐ろしいことを平気で実行するようになってしまいました。
国民が黙っていたら,奴らのやり口はどんどんエスカレートしていくという典型的な例です。
せっかく今までロシアンルーレットで生き残ってきたのに,いそいそと接種会場に足を運ぶ羊たち。彼らも,XBB💉が,こんなバカげた手順で承認されたと知ったら・・・でも打つ人は大勢いるでしょうが,1人でも踏み止まってくれたらと思います。
なんとか日本を護りたいという一心から,陰謀論者と蔑まれても声を上げ続けてきました。
💉にLGBTにデジタルIDに移民・・・次々と仕掛けられる攻撃に対抗する人数が多ければ多いほど勝率は上がります。
是非,これを機会に多くの方に目覚めてほしいものです。
