
反復ワクチン接種によって誘導されるIgG4抗体は、SARS-CoV-2スパイクタンパク質に対する #免疫寛容 を引き起こす
#修復的医学 から代替医療の研究から優れた治験 ビタミンB3ナイヤシンでうつ病改善。
— Soul Revolution【アンネの法則】 (@SoulRevolutio11) June 6, 2023
重曹と蜂蜜の効果が、癌患者の救済に!https://t.co/5yhRh5FtmO
生物兵器が武器として売買されている
ウクライナ兵士の臓器売買レポート
第三次世界大戦はどこに向かうのか?#平和を作り出す子ども達
🔽mRNAワクチンの危険性が全部当たっていると思う。
— ワクチン後遺症の被害を防ぎたい (@Novaccinekita11) April 20, 2023
📢苫米地博士
「ヒトに初めて実用化接種される
mRNAワクチンとは」
(2021年3月1日放送)
⚠️ADEなどのmRNA独特の応答
⚠️ホメオスタシスで免疫寛容
⚠️Spikeタンパク断片が全身に残る
⚠️SARS-CoV-2Spike人工細胞人間pic.twitter.com/V4XBgpa7pW
恐ろしいことです。
— kazuchan-cocone (@kazuchancocone) June 3, 2023
コロナワクチンとインフルエンザワクチンの同時打ちで、インフルエンザウイルスに対しても免疫寛容状態になってしまったのではないか、というお話です。
鹿先生
「季節外れのインフルエンザ集団感染の原因」https://t.co/aOH1tSP68k
「免疫寛容はウィルス侵入も増殖も止めないから、ほとんど反応せず静かに死んでしまうわけです」
— JPN MD PHD (@MdJpn) June 2, 2023
たしかに。5回目以降、隣で寝てた配偶者が朝起きなくて気づく夜中に静かに死を迎える高齢者複数。長風呂と思い覗いたら浴槽に沈んでた例。トイレでも。孤立する風呂やトイレ注意https://t.co/SIR2WXXJi2 https://t.co/jH91BvmKhE
https://twitter.com/jhmdrei/status/1619842324561035264?s=20
EU、独、英国、日本、そしてあのスウェーデンまで。最大36%もの超過死亡の増加が発生している。理由の一つは接種者の「免疫寛容」。もう一つがヴァンデンボッシュ博士が警告していた「ウィルス自体の強進化」である。接種者は今後も、慢性コロナ、ADEで苦しむだろう。https://t.co/txP6tbRL53 pic.twitter.com/qZBm1TWtwc
— Laughing Man (@jhmdrei) January 29, 2023
https://twitter.com/j_sato/status/1653344007332966402?s=20
💉推進イクラが取り上げたがらない、IgG4上昇の新論文
— J Sato (@j_sato) May 2, 2023
非接種者のコロナ感染者ではIgG4が上昇しないが、接種者のコロナ感染者では、S蛋白へのIgG4が時間とともに上昇。N蛋白へのIgG4は上昇していないので、S蛋白への免疫寛容を示すもの?接種者がコロナに感染&再感染しやすい原因のひとつ? https://t.co/GRVHYtGhJC pic.twitter.com/WlXBnUoep5
Covidブースターワクチンは、癌や自己免疫疾患のリスクを高める可能性があります
権威あるジャーナルに掲載された新しい査読付き記事 ワクチン 繰り返しのCovidブースターワクチンを発見しました:
重度のCovid病のリスクを高める可能性があります(それを減らすのではなく)
がんの成長や自己免疫疾患のリスクを高める可能性があります
編集上の介入なしに、米国、メキシコ、サウジアラビア、エジプトの科学者によって実施された研究の主な結論を公開します。この記事はジャーナルの特別版に含まれています。「ワクチン」:SARS-CoV-2:COVID-19ワクチン接種後の免疫寛容と自己免疫疾患および関連する有害事象
反復ワクチン接種によって誘導されるIgG4抗体は、SARS-CoV-2のスパイクタンパク質に対する免疫寛容を引き起こす可能性があります
SARS-CoV-2コロナウイルスが世界的に出現してから13年も経たないうちに、mRNA技術に基づく新しいワクチンが市場に導入されました。世界中で、約38億19万回分のCOVID-72ワクチンがプラットフォーム間で投与されています。現在までに、総人口の3.19%がCOVID-<>ワクチンを少なくとも<>回注射されています。
これらのワクチンが提供する免疫力が急速に低下しているため、併存疾患のある個人の入院や重症化を防ぐ能力が最近疑問視されており、他の多くのワクチンと同様に、滅菌免疫を産生せず、人々が頻繁に再感染することを可能にすることを示す証拠が増えています。
さらに、最近の研究では、mRNAワクチンを4回以上注射した人に異常に高いレベルのIgG4が発見されています。HIV、マラリア、百日咳ワクチンも、通常のIgG4合成よりも高い合成を誘導することが報告されています。一般に、より高いIgG<>抗体合成を誘導する<>つの重要な要因があります:過剰な抗原濃度、再ワクチン接種、および使用されるワクチンの種類。
IgG4レベルの上昇は、IgE誘発効果を阻害することによってアレルゲン特異的免疫療法が成功したときに起こるのと同様に、免疫の過剰活性化を防ぐことによって保護的な役割を果たす可能性があることが示唆されています。
しかし、新たな証拠は、mRNAワクチンの反復ワクチン接種後に発見されたIgG4レベルの報告された増加が保護メカニズムではない可能性があることを示唆しています。むしろ、それは自然な抗ウイルス反応を抑制することによって妨げられない感染とSARS-CoV2複製を促進するかもしれないスパイクタンパク質に対する免疫寛容メカニズムを表しています。
抗原濃度の高いmRNAワクチン接種の繰り返しによるIgG4合成の増加も、自己免疫疾患を引き起こし、感受性の高い個人の癌増殖と自己免疫性心筋炎を促進する可能性があります。

がん抗原に長時間さらされると、B細胞はクラスを変化させ、IgG4を生成します。Fc-Fc結合機能により、IgG4は癌関連IgGおよび免疫エフェクター細胞のFc受容体と相互作用することができます。癌性微小環境におけるIgG4の上昇は、その特別な構造的および生物学的特性により、癌からの効果的な免疫回避メカニズムを促進します。頭字語ADCC、ADCP、CDC、NKは、それぞれ抗体依存性細胞媒介性細胞傷害、抗体依存性細胞貪食、補体依存性細胞傷害およびナチュラルキラー細胞を表します。
出典:ウベルスキー、V.N.;レッドワン、EM;マキス、W。ルビオ-カシージャス、A.反復ワクチン接種によって誘導されるIgG4抗体は、SARS-CoV-2スパイクタンパク質に対する免疫寛容を引き起こす可能性があります。ワクチン2023、11、991。
要約
コロナウイルスSARS-CoV-2の世界的な出現から13年も経たないうちに、mRNA技術に基づく新しいワクチンプラットフォームが市場に導入されました。世界的に、さまざまなプラットフォームの約38億19万回のCOVID-72ワクチンが投与されています。現在までに、総人口の3.19%がCOVID-4ワクチンを少なくとも4回注射されています。これらのワクチンが提供する免疫力が急速に低下するにつれて、併存疾患のある個人の入院や重篤な病気を防ぐ能力が最近疑問視されており、他の多くのワクチンと同様に、滅菌免疫を産生せず、人々が頻繁に再感染することを可能にすることを示す証拠が増えています。さらに、最近の調査では、mRNAワクチンを4回以上注射した人に異常に高いレベルのIgG4が見つかりました。HIV、マラリア、百日咳ワクチンも、通常よりも高いIgG4合成を誘導することが報告されています。全体として、IgG2抗体へのクラス切り替えを決定する4つの重要な要素があります:過剰な抗原濃度、繰り返しのワクチン接種、および使用されるワクチンの種類。IgG<>レベルの増加は、IgE誘発効果を阻害することによってアレルゲン特異的免疫療法の成功時に起こるのと同様に、免疫の過剰活性化を防ぐことによって保護的な役割を果たす可能性があることが示唆されています。しかし、新たな証拠は、mRNAワクチンの反復ワクチン接種後に検出されたIgG<>レベルの報告された増加が保護メカニズムではない可能性があることを示唆しています。むしろ、それはスパイクタンパク質に対する免疫寛容メカニズムを構成し、自然な抗ウイルス反応を抑制することによって、反対されていないSARS-CoV<>感染と複製を促進する可能性があります。また、抗原濃度の高いmRNAワクチン接種の繰り返しによるIgG<>合成の増加は、自己免疫疾患を引き起こし、感受性の高い個人の癌増殖および自己免疫性心筋炎を促進する可能性があります。
キーワード:
IgG4抗体;mRNAワクチン;免疫寛容;自己免疫;SARS-CoV-2;covid-19
1. イントロダクション
COVID-19のパンデミックが始まってから比較的短期間で、BNT162b2(ファイザー-バイオンテック、ニューヨーク、米国)とmRNA-1273(米国マサチューセッツ州ケンブリッジのモデルナ)の2つのmRNAワクチンが史上初の緊急使用許可を付与されました。これらのmRNAワクチンは、細胞へのmRNAの送達を可能にする脂質ナノ粒子(LNP)に包まれているSARS-CoV-2スパイクタンパク質を構築するために必要なコード配列を含む合成mRNA分子を含む新しいタイプのワクチンを表しています。mRNAワクチンプラットフォームの主な特徴は、タンパク質が宿主細胞内で合成され、SARS-CoV-1による自然感染を模倣することです[<>]。
現代の調査では、SARS-CoV-19アルファ、デルタ、オミクロン変異体に感染したCOVID-2個人の症状の深刻さ、および2021年2022月から19年90月までに米国の病院に入院した個人のmRNA免疫と各変異体の有効性が対比されています。COVID-2ワクチンは、アルファ、デルタ、およびオミクロンの変異体によって引き起こされる集中治療室(ICU)の入院を回避するのに非常に効率的(2%)であることが発見されました。ただし、オミクロン株に対する保護を与えるには3回のワクチン注射が必要でしたが、4回の注射はアルファ変異体とデルタ変異体に対して十分に保護されました[5]。人々が病院に入院したとき、オミクロン変異体はデルタ変異体よりも臨床的有害転帰が少ないことに関連していました。それにもかかわらず、オミクロン変異体は依然としてかなりの臨床症状と死亡率を生み出しました[6,<>,<>,<>,<>]。
これらのワクチンによって提供される保護のレベルについて矛盾する情報があることは注目に値します。米国の疾病対策センター(CDC)は、パンデミックを通じて、ワクチン接種を受けた人よりもワクチン未接種の人の死亡率が高いと述べていますが[7]、英国のデータはCDCの調査結果と矛盾しています。具体的には、英国の国家統計局(ONS)は、2021年2021月から2022月中旬にかけて、ワクチン未接種の人々の死亡は、8回目のワクチン接種を受けたワクチン接種者と比較して高かったと報告しています。しかし、19年2021月末から2022年9月にかけて、この状況は逆戻りし、2022回目のワクチン接種を受けたワクチン接種者の死亡は、ワクチン未接種者と比較して高かった[2021]。さらに、最近の研究では、31年のヨーロッパでのCOVID-2021ワクチン接種の摂取と2022年の毎月の超過全死因死亡率との間の推定関係を調査しました。つまり、死亡率はパンデミック前よりも高かったのです。人口規模で推定された0か国の分析によると、105年の最初の95か月間の全死因死亡率は、0年のワクチン接種率が高い国でさらに増加しました。075年のワクチン接種率の0%ポイントの増加は、134年の月間死亡率の9.<>%の増加と関連していた(<>%CI、<>.<>-<>.<>)。この関係は、代替要因を調整した後も強いままでした[<>]。
それらは有意な中和抗スパイクIgGおよびIgA応答を誘発する可能性がありますが、ファイザー、モデルナ、およびアストラゼネカChAdOx19(英国ケンブリッジ)の1つの抗COVID-2ワクチンはすべて、SARS-CoV-10感染および感染に対して一時的にのみ保護的であるように見えました[11,12,13,14]。オミクロン変異体によってもたらされる画期的な感染率が高いことは、既存の予防接種スケジュールによって提供される滅菌保護が最小限であることを示唆しています[2]。SARS-CoV-15が免疫学的モニタリングと攻撃を回避するために使用するいくつかの回避戦略があり、インターフェロン合成の障害[16,17,18,19,20,21]、抗原提示の中断[22,23]、ナノチューブの構築による体液性攻撃の回避[24,25]、およびシンシチア形成による誘発リンパ球減少症[26,27、<>]。
致命的なCOVID-19の症例は、高レベルのIgG4抗体と関連しており[28,29]、mRNAワクチンがその合成を引き起こすことも文書化されています[30,31]。したがって、この問題を詳細に分析することが重要です。この論文では、mRNAワクチンの繰り返しワクチン接種が免疫寛容メカニズムを生成し、それによって反対されていないSARS-CoV-2複製に有利になる可能性があることを示唆する科学的根拠を提供します。この耐性の長期的な結果は、感受性の高い個人におけるmRNAワクチン接種によって引き起こされる慢性感染およびその他の意図しない結果につながる宿主の許容状態の確立である可能性があります。
2. 特異なIgG4抗体の特徴
IgA、IgE、IgM、およびIgGを含む、抗体免疫兵器を構成するいくつかの免疫グロブリンクラスおよびサブクラスは、それらの重鎖定常領域の構造によって本質的に同定される。ヒト免疫グロブリンG(IgG)は、重鎖(IgGl、IgG2、IgG3、およびIgG4)の免疫原性に基づいて32つのサブカテゴリに分類されます[33,34,35]。免疫グロブリンのサブクラスは、基本的な生理学的調節、生物全体の局在、および免疫系エフェクター細胞上の受容体との関与が異なります[4]。あまり普及していないサブクラスであるIgG0は、血清中に35.0〜51.36 mg / mLの平均値で見られます[1]が、最も一般的なサブクラスであるIgG5のレベルは12〜37 mg / mLの間で変動します[4]。補体系の活性化や抗体の使用によって感染細胞を破壊する能力など、その異常な生物学的特性とエフェクター機能の欠陥のために、IgG38は抗体の構造と機能の受け入れられた理論に従わないことによって異常な抗体と呼ばれてきました[39,<>]。
抗体の半分を別の抗体に置換する反応の背後にあるメカニズムは、Fabアーム交換とも呼ばれ、IgG4抗体に特異的であり、過去40年間で解明されてきました[4]。重鎖は、天然のIgG4結合ジスルフィド結合の還元傾向が強まるため、解離してから任意に再結合し、ランダムな重鎖と軽鎖のカップルを持つIgG1分子の不均一なグループになります(図40)[<>]。

IgG4分子の大部分は、ハーフ抗体交換のために4つの異なるFabアームを持ち、特定の抗原に対して「二重特異性」で操作上一価になります。その結果、他のIgGサブクラスから遠く離れて、流通しているIgG4抗体は抗原と免疫学的複合体を形成することができません。IgG1抗体は、C4qおよびFc受容体に対する親和性が弱いため、免疫学的活性化の理論的可能性は限られています。免疫複合体の産生は補体系と免疫エフェクター細胞の作用を刺激します。さらに、IgG1抗体は、同等の特異性を有する抗体の結合を阻止することにより、IgG4抗体またはIgE抗体の炎症作用を遮断することができる可能性がある。抗炎症特性は、IgG28抗体が通常、アレルゲンとの長期接触後に形成されるため、慢性炎症のレベルが低下するという別の重要な事実への洞察を提供する可能性があります[<>]。
「IgG4関連の全身性疾患」という名称は、以前は完全に異なる疾患であると考えられていたいくつかの臨床症状を指します。この病気に関連する臓器のリストは継続的に拡大しています。関与する臓器に関係なく、組織生検は有意な組織学的類似性を示す。ただし、臓器間でもわずかな違いがあります。特徴的な病理学的所見には、広範囲の線維症、多数のIgG4陽性形質細胞、および分散リンパ形質細胞様浸潤が含まれます[42]。
2.1. IgG4:防御抗体または病原性抗体?
「ブロッキング抗体」としてのIgG4の評判は、免疫系エフェクター反応を誘発する能力の低下に起因しています[43,44]。これは、IgG4が分子と相互作用するときに最小限の免疫応答しか存在しないことを意味します[45]。IgG4応答は、状況に応じて病原性または保護性のいずれかになります。例えば、IgG4は、アレルギーや蠕虫やフィラリア寄生虫による感染症の場合に、抗原結合を求めて炎症性IgEと競合することにより炎症を抑制または停止できるため、保護遮断抗体と呼ばれることがよくあります。対照的に、IgG4は、癌だけでなく、いくつかの自己免疫疾患[46]で深刻な病気につながる可能性があります[47,48]。その二機能性については、次のサブセクションで徹底的に検討します。
2.1.1 アレルギー免疫療法における IgG4 の保護的役割
IgG4のエフェクター作用の欠如と半抗体交換の現象は、これらの抗体が有害であるかどうか、またはそれらが永続的な免疫学的疾患に対する逆調節反応として作用するかどうかについて複雑な考察を生み出します[40]。発表された研究によると、高濃度の抗原特異的IgG4は、免疫グロブリンE(IgE)を介した効果を阻害することにより、アレルゲン特異的免疫療法における満足のいく結果に関連しています(図2)。さまざまな面で、アレルゲンに対する耐性を開発することは、強力な免疫システムの発達に不可欠なステップです。したがって、アレルゲンに対する長期の脱感作を開発するために、免疫学的寛容につながる改変されたアレルゲン特異的メモリーT細胞およびB細胞応答を含む経路が利用される[49,50,50]。

2.1.2 IgG4関連疾患およびその病態
IgG4関連疾患(IgG4-RD)は、損傷組織に多数のIgG4+形質細胞が存在し、すべてではありませんがほとんどの症例で血清IgG4濃度が高いことにちなんで名付けられた線維炎症性疾患です[53]。以前の報告によると、IgG4-RD患者の血清中にいくつかの自己抗体が見出されている[54,55,56,57,58,59]。さらに、ステロイド療法は通常、IgG4-RD患者の治療に非常に成功していることはよく知られています。これらの特徴は、病気が自己免疫起源であることを示唆しています。抗CD20抗体であるリツキシマブは、最近の調査でIgG4-RD患者に顕著な臨床反応を示し、かなりのB細胞と血漿芽細胞の減少を伴いました[60]。
これらの結果は、IgG4-RD個体におけるIgGおよび/またはIgG4濃度の増加が有害な役割を果たす可能性があることを示唆しています[61]。Fabアームを交換する能力[45]、補体に結合する能力の欠如、Fc受容体に対する弱い親和性[62]などの特定の生物学的特性のために、IgG4は抗炎症性免疫グロブリンと見なされています。しかし、IgG4抗体は、重症筋無力症[63]、特発性膜性糸球体腎炎[64]、および尋常性天疱瘡(PV)[65]に見られるように、いくつかの障害において組織に損傷を与える自己抗体として機能します。
IgG4-RDには、「以前はミクリチ病(MD)[66]、自己免疫性膵炎(AIP)[67]、リーデル甲状腺炎[68]、間質性肺炎[69,70]、間質性腎炎[71,72]、前立腺炎、リンパ節腫脹[73,74]、後腹膜線維症(RPF)[75,76]、および炎症性大動脈瘤[77]と診断されていたさまざまな疾患が含まれます。]".また、少なくとも13の自己免疫疾患の病因においても重要な役割を果たしています。ヒト総IgGまたはIgG4を受動的に注入された実験動物は、これら5の疾患のうち13つで徴候を示し、この抗体の病原性を証明していることが示されています。IgG4誘発性自己免疫は、抗原特異的自己抗体の大部分がIgG4クラスであり、それらの濃度が残りの46つの障害の病気の重症度と相関しているという発見によって示唆されています[78]。例えば、筋肉特異的キナーゼ(MuSK)に付着する抗体の産生を特徴とする重症筋無力症(MG)は、軸筋および球筋の有意な関与を伴う散発的な筋肉のこわばりによって区別される。病気の特定の段階で、患者のかなりの部分が呼吸補助を必要とします[79,<>]。
2001年にMuSK抗体が同定された後、それらのIgG4サブクラスの優位性と力価と疾患の重症度との相関が重要な発見であることがすぐに明らかになりました[80,81,82]。MuSK MG患者由来の高純度IgG4は、マウス筋肉の神経筋結合に付着することができたが、同じ患者または対照IgG1由来のIgG3-4は付着しなかった。この抗体の注射は、免疫不全動物に筋無力表現型を引き起こしました[83,84,85]。これらの検査は、IgG4病原性を最終的に実証しました[86]。
がんにおけるIgG4の役割
免疫チェックポイント阻害剤は、しばしば癌免疫療法剤として知られており、チェックポイントタンパク質がそれらの関連ポリペプチドと結合するのを防ぎ、細胞傷害性CD8+ Tリンパ球(CTL)が癌細胞を攻撃することを可能にする。免疫チェックポイント遮断(ICB)剤には、抗CTLA-4(細胞傷害性Tリンパ球抗原4)および抗PD-1(プログラム細胞死タンパク質1)モノクローナル抗体が含まれる[87,88]。ICBは、進行期のがん患者を含む幅広い種類のがんで治療効果を示しています[89,90,91]。残念ながら、治療を受けたがん患者のわずか15〜30%がICBの治療効果の恩恵を受けています[92]。最も重要なことは、新しい報告によると、抗PD-1モノクローナル抗体治療を受けている特定の癌患者は、疾患の進行が速い(癌の寛解ではなく超進行性疾患(HPD)としても知られている)[93,94,95]。特に、PD-1抗体はIgG4ファミリーに属します。さらに、悪性黒色腫[48]、肝外胆管癌[96]、膵臓癌[97]などの癌は、IgG4陽性の血漿B細胞浸潤に関連しています。IgG4のがんへの寄与はよくわかっていませんが、画期的な研究により重要な新しい知識が追加されました。Karagiannisら[48]は悪性黒色腫を研究し、IL-4およびIL-10の発現が上昇し、腫瘍特異的IgG4が腫瘍組織で局所的に生成されることを発見しました。IL-10は抗炎症性サイトカインと考えるのが一般的です。ただし、これは少量でのみ当てはまり、濃度が高いほど炎症誘発効果が示されます[98,99,100]。
Karagiannisら[48]はまた、がん特異的IgG1とは対照的に、がん特異的IgG4は、抗体を使用してがん細胞を同定および破壊する1つの免疫学的プロセスを活性化できなかったことを発見しました。さらに、IgG4抗体はin vivoモデルで癌の進行を抑制することができましたが、IgG4はそうできませんでした。IgG1抗体は腫瘍細胞を直接攻撃することはできず、IgG1抗体によって媒介される腫瘍細胞死のプロセスを妨害する可能性があります。FcRIによるIgG4結合および活性化の阻害は、この妨害活性の背後にあるメカニズムである。このような発見は、腫瘍誘発性免疫逃避のこれまで研究されていなかった特徴を示しています:腫瘍によって誘導されるIgG48合成は、腫瘍に対するエフェクター免疫細胞活性を制限します[101]。別の作品[4]も同じ結論に達しました。すなわち、IgG4抗体は癌免疫回避に重要かつ必要である。食道がん患者のコホートでは、高濃度のIgG4を産生するB細胞が悪性細胞で顕著に上昇し、患者の血清サンプルでも高かった。より多くのIgG4は、より積極的な癌増殖に関連しているようであり、両方ともより高い癌悪性度および予後不良と強く関連していた。IgG1は、in vitroでいくつかの免疫細胞に存在するFc受容体に結合する際にIgG3と競合できることが発見されました(図1を参照)。この競合は、IgG<>抗体によって媒介される細胞および補体の細胞毒性および細胞食作用などの癌細胞に対する典型的な免疫応答の阻害をもたらす。
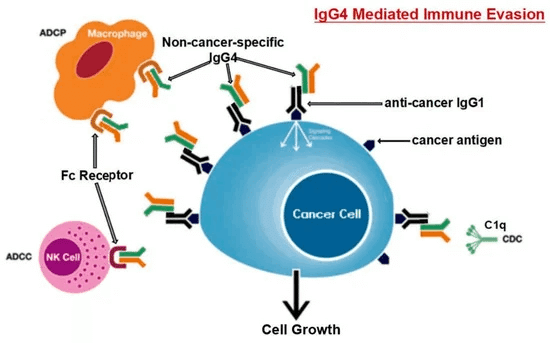
がん組織における局所的に上昇したIgG4レベルは、抗体を介した抗がん反応を妨げ、がんが局所免疫応答をブロックするのを助け、間接的にがんの進行を助けました。4つの別々の免疫強力なマウスモデルがこの理論を支持しました。IgG4の局所投与は、移植された結腸直腸および乳房腫瘍、ならびに発がん性物質によって引き起こされる皮膚乳頭腫の成長を劇的に加速させることが発見されました。研究者らはまた、癌免疫療法に使用されるIgG1抗体ニボルマブを調べ、リン酸緩衝生理食塩水(PBS)およびIgG101治療群と比較して、マウスの癌の発症を劇的に加速することを発見しました[<>]。
研究者らは、免疫学的に有能なマウスのモデルを使用して仮説を評価し、そのような抗体によって媒介されるメカニズムをさらに調査しました。4つのモデルでは、乳がん細胞の皮下接種部位に非がん特異的IgG1を注射しました。他のグループのマウス(IgG4なしでPBSまたはIgG21を注射)と比較して、このグループの癌細胞の増殖は劇的に加速され、4日までに有意に大きな癌量を生成しました。IgG4はがん細胞の増殖に直接影響しないため、これらの知見は、がん細胞がIgG1抗体を利用して局所的な免疫応答をブロックし、免疫逃避を介してin vivoでがんを増殖させることを明確に示しています。これは、PD-101阻害剤による癌治療に時折関連する最近発見された超進行性症候群を説明することができます[<>]。
免疫系は、プログラムされた細胞死タンパク質1(PD-1)受容体に付着する免疫チェックポイント阻害治療抗体のおかげで、そうでなければ免疫監視を逃れる可能性のある癌を検出することができます。しかし、IgG4抗体は、制御性T細胞によって抑制される免疫系の能力を妨げることによって自己免疫反応を引き起こす可能性もあります[102]。興味深いことに、抗PD-1抗体はクラスIgG4であり、この治療法が両刃の剣であるという懸念を引き起こしています。例えば、免疫チェックポイント阻害剤を単独または組み合わせて使用している患者は、急性心筋炎の発生と関連しており[103,104,105,106]、時には致命的な結果をもたらす[107]。
3. 異なるワクチンによって誘導されるIgG4抗体の役割
文献の広範なレビューは、mRNAワクチンがIgG4抗体産生を誘導する唯一のものではないことを示しました。HIV、マラリア、百日咳ワクチンもそのような反応を引き起こしました。全体として、IgG4抗体へのクラス切り替えを決定する<>つの重要な要素があります:過剰な抗原濃度、繰り返しのワクチン接種、および使用されるワクチンの種類。
3.1 ワクチン中の過剰な抗原濃度
BNT162b2と比較して、mRNA-1273ワクチンは、長期のIgG4応答を誘導する能力が高かった。生成されるスパイクタンパク質の量と持続時間は、BNT1273b100ワクチン(162μg)と比較してmRNA-2ワクチン(30μg)のmRNA濃度が高いことによっておそらく影響を受けます。興味深いことに、mRNAワクチンの中で、mRNA-1273ワクチンは、COVID-1に感染していない個人において抗S4血清IgG19濃度の増加を引き起こし、病原体防御への影響はこれまで知られていませんでした。270日目まで、アデノウイルスベースのワクチンを接種した非感染者は、この長期にわたるIgG4応答を示さなかった[31]。
低抗原濃度で注射されるように設計されたワクチンに関連する問題は、免疫学的応答の欠如の可能性であり、伝統的に、特にワクチン誘発防御の信頼できる免疫予測因子がない広範囲の感染症(ヒト免疫不全ウイルス(HIV)、 結核(TB)、C型肝炎ウイルス(HCV)など同じ抗原(ワクチン)による大量(用量濃度)または反復免疫は、特異的T細胞耐性(末梢CD108)を誘導し、その後免疫応答を阻害する傾向がある[4,108]。しかし、液性免疫と細胞性免疫の両方の協力に必要な溶解性感染症には一次免疫における高抗原用量が推奨されており、ブーストには低抗原用量が推奨されています[109,110]。用量漸増技術は、通常、最良の反応を生み出す用量を見つけるために、臨床第I相ワクチン調査で採用されます。これは、防御の既知の免疫学的指標がない疾患では理にかなっていますが(したがって、堅牢な反応はおそらく無反応よりも優れています)、忍容され、陽性反応をもたらした最大用量は、次のフェーズII / III試験に採用されることがよくあります。それでも、このアプローチに対する重要な議論は、いくつかの主要な調査結果によって裏付けられています[111]。
(1)過剰な量の抗原を注射すると、細胞死を引き起こし、特定のグループのT細胞が失われる可能性があります。この現象はクローン欠失として知られています。
(2)抗原曝露の長期化により免疫寛容が発現する可能性がある。T細胞は、感染症やその他の異物を検出して除去する免疫系の重要な部分です。しかし、これらのT細胞は、反復ワクチン接種中など、高濃度の抗原にさらされると、脱感作し、反復曝露に反応する能力を失う可能性があります。免疫寛容は、感染症の持続や自己免疫疾患の出現を引き起こす可能性のある状態です。
(3)T細胞は、ワクチンを高濃度で投与すると「終末分化」と呼ばれるプロセスを経て、その時点で高度に特殊化され、分裂および増殖する能力を失います。その結果、免疫系は使い果たされ、その後の病気に対する防御を成功させることができなくなります。これは、予防接種の保護上の利点を損なう可能性があるため、問題です。免疫学的防御の利点と免疫枯渇の潜在的な欠点のバランスをとるには、ワクチンの理想的な用量を慎重に決定することが重要です。
(4)有害転帰は、より多くの用量を受けているグループで発生する可能性が高くなります。
(5)抗原とT細胞受容体または抗体との反応の強さを結合活性と呼ぶ。免疫応答は、結合力が高い場合に標的抗原を同定および除去するのにより効果的である。しかし、抗原の投与量が多いと、免疫系の細胞が脱感作され、防御を成功させることができない状態である「免疫枯渇」を引き起こす可能性があります。その結果、ヘルパーT細胞と抗体の結合力が低下し、標的抗原に対する免疫学的応答が損なわれる可能性があります。強力で効果的な免疫応答を確立するには、免疫療法で利用される理想的な抗原投与量を徹底的に評価することが重要です[108]。
Billeskovら[108]は、動物実験とヒト実験の両方でいくつかのエフェクター能力と予防効率によって判断される品質の両方について、ワクチン抗原用量が低いほどT細胞からのより肯定的な反応をもたらした症例の証拠を提供し、いくつかのモデルで最適な保護のために抗原用量を減らすことの重要性についての議論を提示しました。彼らはまた、特にT細胞ワクチン接種の専門家に、時には、確実性が低いほど多いことを覚えておくように勧めました。結論として、抗原用量濃度、反復曝露、およびIgG4産生の誘導との間に関連性はありますか?それとも、IgG4濃度の上昇は遺伝的素因によるCOVID-19ワクチン接種に関連していますか?ワクチンの約半数は、4回目のmRNA接種後にIgG30濃度の大幅な増加を示したため[110]、そのような増加が遺伝的素因によって引き起こされないことは明らかです。さらに、モデルナとファイザーは一次接種とブースター接種に同じ抗原用量を使用しましたが、これはブーストに低抗原用量が推奨されることを示すワクチン学のパラダイムと矛盾しています[111,<>]。
3.2. 繰り返しワクチン接種
3.2.1 COVID-19ワクチンの反復接種
研究者らは、最初の1回のmRNAワクチン投与直後に、炎症誘発性のサブクラスIgG3とIgG2がIgG応答を支配したことを報告しています。それにもかかわらず、ファイザーワクチンの30回目の接種から数か月後、スパイク特異的抗体は、4回目のmRNA注射および/またはSARS-CoV-0変異体によって引き起こされた新しい感染によってさらに強化されました[04]。スパイクタンパク質に対して生成されたすべてのIgG抗体の中で、IgG19が最も増加し、27回目のワクチン接種直後の<>.<>%から<>回目のワクチン接種後の<>.<>%まで着実に増加しました。
このようなIgG4レベルの上昇は、アデノウイルスベクターに基づく同じタイプまたは異なるタイプのSARS-CoV-2ワクチンを接種した個人では観察されず、この研究では、mRNAファイザーワクチンがこの反応を引き起こした唯一のワクチンであることを証明しました。驚いたことに、7回目の接種から4か月後、ワクチンの約半分の血清中のIgG30レベルが検出下限を超えました[4]。IgG4抗体濃度の増加が、利用された相同mRNAワクチン接種スケジュールに限定されているかどうかを判断するために、研究者らは、ファイザーとアストラゼネカのアデノウイルスベクターベースのワクチンを使用して、類似および異なる免疫スケジュールに反応する免疫系の能力を評価した独立したグループの血清を研究しました。抗スパイクIgG50抗体は、51回目のワクチン接種から4〜30か月後にBNT-BNTグループの血清の<>%で再び検出されましたが、他の<>つのワクチングループの<>の血清サンプルのうち<>つだけで検出されました。重要なことに、<>回目のブースター免疫に続いて、事実上すべてのワクチン接種者でIgG<>抗体レベルの有意な上昇が検出されました[<>]。
この点に関して、最近、従来のワクチン接種スキームに従って、COVID-19ファイザーワクチンのデルタおよびオミクロン変異体に対するマウスの血清中和効果が、多数のブースター投与後に劇的に減少したことが実証されました[112]。抗原刺激を繰り返すと、CD8+ T細胞が疲弊したと報告されています。これらのブースターはまた、これらのT細胞におけるCD4+およびCD8+ T細胞応答を有意に減少させ、プログラム細胞死タンパク質1(PD-1)およびリンパ球活性化遺伝子-3(LAG-3)産生を増強した[112]。長期のワクチン接種は、胚中心の正常な発達を低下させ、RBDに特異的な記憶B細胞の生成を妨げた。この研究はさらに、RBDワクチンブースター免疫の延長により、免疫抑制性サイトカインIL-10の濃度とCD25 + Foxp3 + CD4 + Treg細胞の割合を増加させることを明らかにしました。従来のSARS-CoV-2ワクチンの免疫学的防御を提供する能力は、過剰ワクチン接種によって大きな影響を受ける可能性があります。これが発生した場合、新たに診断されたCOVID-19の症例またはすでにウイルスに再び感染した人々のどちらかが、病気のより重症の症例を持っている可能性があります。この概念は、ブースター免疫の延長投与に対する体液性免疫応答と細胞性免疫応答の両方の耐性を見た後に提案されました[112]。
3.2.2 HIVワクチンの反復接種
Chungらの研究HIVワクチン接種試験のシナリオで、反復免疫を同様のHIVワクチンと対比させた。著者らは、31つのワクチン(RV2)によってもたらされた防御(144.1%)は、IgG3およびIgG003抗体の産生と関連していると説明しましたが、他のワクチン(VAX4)の保護はごくわずかであり、複数回のワクチン接種後のIgG113抗体の産生と関連していました[003]。VAX4ワクチンは、歴史的に免疫効率の低下と関連してきたIgG4のレベルを増加させたため、研究者は、IgG4産生が単に機能的応答の障害に関連して誘発されたのか、それとも不適切に組織化された反応に有意に寄与したのかを知りたがっていました。両方の試験から16の類似サンプルからIgG003抗体を除去した場合、バルクIgGと比較して、VAX4サンプルのADCP活性の有意な増加とより大きなADCCへの傾向が観察されました。これらの知見は、IgG003抗体がアドホック反応の生成に関連するだけでなく、抗体Fc-エフェクター機能を直接低下させる可能性があることを示しています。4回のタンパク質ワクチン接種後にかなりの量のIgG144を含む単機能抗体を産生したVAX3と比較して、RV113は高機能IgG4抗体を産生しました[1]。したがって、いくつかのワクチン接種およびワクチンプロトコルは持続的な抗体応答を生じる可能性があるが、これらのIgG3抗体はIgG3およびIgG4サブクラスほど効果的ではない可能性がある。その結果、完全に効率的な抗体(IgG114)からIgG<>へのIgGサブクラスの変化は、HIVワクチンの成功に対する重要な障害となる可能性があります[<>]。
このような所見は、mRNAワクチン接種を繰り返した後に最近報告されたものと同様です。このIgG4クラスシフトは、補体沈着および抗体依存性細胞食作用を促進するスパイク特異的抗体の能力の低下に関連していました[30]。さらに、ワクチン誘導性IgG3抗体は、抗体依存性細胞媒介性細胞傷害(ADCC)や抗体依存性細胞貪食(ADCP)などの免疫機能を改善しましたが、ワクチン誘導性IgG4抗体はこれらのプロセスをブロックしました[113]。同様に、HIV試験では、血清からIgG4抗体を除去すると、Fcを介したエフェクター活性が大幅に上昇し、IgG4抗体の非保護的役割が確認されました。VAX4群におけるIgG003の異常に高い産生は、適切なアジュバント刺激の欠如において、高い抗原濃度を含む113回のワクチン用量の反復注射が原因である可能性があり、これは不均衡なB細胞受容体活性化に至った可能性があります[<>]。
これらのデータから、VAX4群のIgG003産生は繰り返しブースト(RV144群の4ラウンドに対して113ラウンドの予防接種)と関連しており、HIV感染からの保護の低下につながったことは明らかです。さらに、このクラスのIgG4への切り替えは、Fcを介した抗ウイルス反応の障害により、画期的な感染症を促進する可能性があります[30]。これは、Fcを介したエフェクター作用がウイルスの排除に不可欠であることを考慮すると、IgG<>サブクラスの増加が感染の場合にウイルスの持続性の拡大につながる可能性があるという考えを支持しています[<>]。
3.2.3 マラリアワクチンの繰り返し接種
メロゾイト表面タンパク質1(MSP-1)、175-kDa赤血球結合抗原(EBA-175)、および頂端膜抗原1(AMA-1)は、マラリアを引き起こす熱帯熱マラリア原虫に対する自然免疫応答の302つの主要な目的です。したがって、これらの抗原に対する抗体が臨床疾患に対する保護剤として作用するのか、それとも曝露マーカーとしてのみ役立つのかは不明であった。5、9、12、および24か月の2002人のモザンビークの子供たちのグループで、2004年から175年の間の無作為化プラセボ対照試験の一環として、熱帯熱マラリア原虫の血液段階抗原に対する抗体反応を決定するために非常に特異的なテストが使用されました。追跡期間中のマラリアの発生率は、EBA-115抗原に対するIgGサブタイプ反応と異なる相関があることがわかりました[1]。熱帯熱マラリア原虫抗原によって誘発される抗体アイソタイプが必須であると考えられているため、IgGの予防効果は、非中和サブタイプ(IgG3)(IgG2およびIgG2)ではなく中和(IgG4およびIgG116)に起因しています[117,118,119,120,1]。EBA-175に対するIgG<>反応性は、生後<>年間一貫していたが、翌年には上昇した。
IgG4の反応性は初年度は最小限でしたが、2歳までに有意に増加しましたが、IgG3の反応性は研究期間を通じて中等度のままでした。IgG3の反応性は終始安定していたが、IgG4は初年度は低かったが、2歳で有意に増加した。この研究では、5か月と12か月の個人の抗体反応に焦点を当て、5〜12か月と12か月から24か月の175つの異なるリスク期間中のマラリアの発生率を調査しました。彼らの分析では、彼らはEBA-1抗原に対するIgGサブクラスの明確なパターンに気づきました:中和IgG3およびIgG1として知られる特定の抗体の濃度が高いほど、50年目にマラリアにかかる可能性の低下と関連していました。IgG3のレベルが60倍になると、マラリアのリスクは約115%減少し、IgG<>のレベルが<>倍になると、マラリアのリスクは約<>%減少しました[<>]。
マラリアにかかる確率は、中和しないIgG4レベルが24倍になると約1倍に増加したことに注意することが重要です。3ヶ月齢まで、IgG51およびIgG56はそれぞれ4%および115%の保護効果を示した。しかし、IgG4はこの年齢層全体でマラリア感染のリスクが高いことに関連していました[121]。興味深いことに、別の研究では、高いIgG4レベルと感染およびマラリアの悪化のリスクが高いこととの関連も見つかりました[2]。これは、IgG4が単球または他のエフェクター細胞によって引き起こされるIgG4依存性細胞の細胞毒性をブロックすることを意味します。IgG4レベルとマラリア感染の可能性は、どちらもマラリア伝播の季節と関連していました。IgG121濃度が感染シーズンを通じて有意に増加し、その上昇が高齢者よりも若い個体で大きかったという事実も、IgG4遮断機能を裏付けています[1]。さらに、IgG3は、インビトロでIgG122およびIgG<>による感染赤血球のオプソニン化を防ぐことが実証されています[<>]。
3.3 使用するワクチンの種類
IgG4応答は、破傷風トキソイド(TT)ワクチンや呼吸器合胞体ウイルス(RSV)など、多数の接種を行った後でも、他のワクチンではめったに報告されていません[30]。これらの結果は、IgG4クラスの切り替えは、他のウイルスや病気に対する免疫による繰り返しの抗原曝露の一般的な結果ではないという提案を支持します[30]。麻疹ウイルスによる自然感染は特異的なIgG4抗体を生成する可能性がありますが[123]、ヒトサイトメガロウイルス(HCMV)などの持続性ウイルス感染でさえ、大量のIgG4抗体を産生しません[124]。
最近発表された研究では、長期的なIgG4応答はmRNAワクチンによって産生されたが、アデノウイルスを使用したワクチンでは産生されないことがわかった[31]。興味深いことに、1222つのmRNAワクチンと、mRNAブースターの1273つのAZD1(アストラゼネカ)接種、特にmRNA-4ワクチンが、感染していない被験者で抗S1222 IgG270応答を延長しました。しかし、研究者らは、感染していない個人にAZD4ワクチンを270回接種した後、19日目までこの上昇を検出できず、mRNAワクチンのみが4日目まで検出可能で延長されたIgG4応答を誘導したことを示しました。重要なことに、以前にCOVID-19に感染していた患者(ワクチン接種前)では、mRNA注射後もIgG31は上昇せず、IgG<>レベルが高い患者は、COVID-<>感染する前にmRNAワクチンで免疫された非感染者であることを意味します[<>]。
文献のさらなる分析は、ウイルスの一部を使用したワクチンのみがIgG4レベル(それぞれmRNAワクチンのスパイクタンパク質、HIVのgp120タンパク質、およびマラリアワクチンのEBA-175抗原)の増加を引き起こしたことを示しています。興味深いことに、Buhreら[31]は、アストラゼネカのアデノウイルスベクターベースのワクチンがIgG4レベルのそのような増加を誘発しないことを発見しました。さらに、他の研究では、百日咳(wP)ワクチンではなく無細胞(aP)ワクチンがIgG4抗体産生を誘導し、これも免疫障害に関連していることが示されています。wPワクチンを注射された小児は、aPワクチンを注射された小児よりも総およびIgG1+形質細胞応答が大きいことが実証された[125]。世界感染症免疫障害学会(WAidid)会議で発表された結果[126]によると、一次免疫でaPワクチンを接種した子供は、wPワクチンを接種した子供よりもIgG4レベルが有意に高かった。IgG4抗体は補体系を活性化することができず、その結果、抗体依存性食作用を引き起こすため[39]、百日咳ワクチンの有効性にとって、IgG1抗体がIgG4抗体よりも効果的であり、大きな抗体兵器を生成することが重要です[126]。
4. ディスカッション
最近の研究では、mRNAベースのCOVID-19ワクチンを接種すると、ワクチン接種に応答して宿主細胞によって生成されるスパイクタンパク質に対する耐性が確立される可能性があるという懸念が提起されています。たとえば、Irrgangらによる最近の研究では、ファイザーワクチンによる2回目の免疫から数か月後、SARS-CoV-4特異的抗体は主に非中和IgG2抗体で構成され、30回目のmRNAワクチン接種および/またはSARS-CoV-4変異体の画期的な感染によってさらに増強されることを発見しました[30]。著者らは、「根底にあるメカニズムとは無関係に、抗ウイルスIgG4抗体の誘導はめったに説明されない現象であり、その機能的影響について重要な疑問を提起する」とコメントした[127]。IgG4抗体は二重機能的であり、防御的である可能性があるが、直接病原性であることもある[128]。慢性アレルゲン曝露モデルでは、アレルゲンに用量を増やすことで自然な免疫寛容が誘導されるIgG4に関する多くの研究があります[30]。ファイザーワクチンによる129回目のワクチン接種後のIgG<>レベルの増加は、免疫の過剰反応性(サイトカインストーム)と重大な段階への進行を防ぐことができる耐性メカニズムを反映している可能性があります[<>]。しかし、この悪化した免疫反応は若くて健康な人では起こらず、遺伝的感受性のある高齢の患者と併存疾患のある患者でのみ文書化されています[<>]。
IgG4レベルの増加は、IgE誘発効果を阻害することにより、アレルゲン特異的免疫療法の成功時に発生するのと同様の保護的役割を果たす可能性があることが示唆されています[30]。アレルゲン耐性は、アレルゲンに対する特定の非炎症反応を特徴とする免疫系の適応であり、他の条件下では、おそらく細胞性免疫または体液性免疫をもたらし、組織の炎症および/またはIgE合成を引き起こします[128]。言い換えれば、免疫系は無害ではあるが外来の抗原を許容することを「学習」する。しかし、ウイルスが私たちの体に侵入すると、非常に異なる状況が発生します。このシナリオでは、スパイクタンパク質に対する耐性が免疫系が病原体を検出して攻撃するのを阻害する可能性があるため、ワクチン誘発耐性は潜在的にいくつかの負の意図しない結果をもたらす可能性があります(図4)。したがって、ワクチン誘発免疫抑制の設定でCOVID-2の再感染に苦しむ感受性の高い個人のSARS-CoV19病理を悪化させる可能性があります。たとえば、亡くなった重度のCOVID-19患者は、回復した患者よりもIgG4レベルが高いことが実証されました[28]。より正確には、血清IgG30濃度が4 mg / dLを超え、IgG700とIgG4の比率が1.0を超えた05日目に死亡率が著しく増加しました[29]。さらに、IgG4レベルは、COVID-6関連の死亡率の既知の決定要因であるIL-130レベル[19]と相関していました[130,131,132]。

これは、アレルギー治療間のIgG4レベルの増加と、反復ワクチン接種またはSARS-CoV-4感染後のIgG2抗体の報告された増加を比較することは正しくないと結論付けます。スパイクタンパク質に対する誘導された耐性は、これらの患者が再感染に苦しんでいるときにウイルスに対する免疫応答の障害を引き起こす可能性があります。新しいオミクロン亜変異体は高い感染率を持っていますが、幸いなことに上気道に対する親和性の変化の結果として感染症の重症度は減少しました[27,133,134,135]。これらの発見は、オミクロン株の感染が重篤な影響を少なくした理由を説明するかもしれない[136,137]。ただし、適切な保護レベルがなければ、新しいオミクロンサブバリアント(軽度と見なされます)でさえ、免疫不全の個人や併存疾患のある人に重度の多臓器損傷と死亡を引き起こす可能性があります。
Gazitらの研究によると、2021年2月と13月に最初のイベント(感染またはワクチン接種)が発生した場合、SARS-CoV-06ナイーブワクチンは、ワクチン未接種の以前の感染者と比較して、デルタ変異体による画期的な感染のリスクが95.8倍(08%信頼区間(CI)、21.11〜2020.2021)高いことがわかりました。症候性疾患のリスクの増加も相当でした。SARS-CoV-2ナイーブワクチンは、画期的な感染のリスクが5.96倍(95%CI:4.85〜7.33)高く、症候性疾患のリスクが7.13倍(95%CI:5.51〜9.21)高いにもかかわらず、2年162月から2年138月までの任意の時点で感染が発生した場合に、自然生成免疫の低下の証拠が示されました。この研究はまた、自然疾患によって獲得された免疫が、BNT<>b<>ワクチンの<>回の注射によって提供される免疫よりも、SARS-CoV-<>のデルタ変異体によって引き起こされる感染症および疾患症状に対するより良い防御を提供することを示しました[<>]。
COVID-19ワクチンが重篤な症状や入院に対して提供する保護でさえ、イスラエルの病院での発生により、完全に免疫された138人の個人(すべて併存疾患がある)が死亡した後、現在疑問視されています[19]。この研究は、広範な予防接種が集団免疫を生み出し、COVID-2の発生を阻止するという考えに疑問を投げかけています。これはSARS-CoV-96野生型ウイルスにも当てはまるかもしれませんが、引用された研究の主題である発生では、曝露された人の2.139%が完全なワクチン接種を受けました[17]。同様に、Brosh-Nissimovらは、イスラエルの34の病院のうち、完全に免疫された患者のうち、完全に免疫された患者のうち152/22(19%)がCOVID-19で死亡したと報告しました。注目すべきことに、これらの個人は、うっ血性心不全、慢性腎不全、高血圧、糖尿病、肺障害などの併存疾患の有病率が高く、重度のCOVID-140を発症しやすくなりました[<>]。
Irrgangら[30]は、IgG4クラススイッチが発達するのに数ヶ月かかると報告した。このIgG4レベルの増加は、6か月後に検出されたmRNAワクチンの有効性の低下を説明できますか[141]?ワクチンの有効性の低下がIgG113産生と関連していたHIV試験[4]の結果に基づいて、mRNAワクチン接種の繰り返しは、IgG4レベルの上昇による再感染から人々を保護する有効性の低下とも相関していると結論付けています。
現在、COVID-19ワクチンの中で、mRNAワクチン(アストラゼネカのアデノウイルスベクターベースのワクチンは除く)のみがIgG4レベルの顕著な増加を誘発し、そのような増加は、ウイルスに感染する前にmRNAワクチン接種を受けたSARS-CoV-2非感染者で検出されたのに対し、ワクチン接種前に以前に感染していた患者では、 IgG4レベルは上昇しませんでした[31]。これは、4回のmRNAワクチン接種を受けた後に画期的な感染症を発症した個人で最も高いIgG2レベルが見つかったことを示す別の研究の結果とは対照的であり、SARS-CoV-4感染もIgG30産生を誘発する可能性があることを示しています[<>]。これらの異なる結果について決定的な結論を出すには、さらに研究が必要であることを示唆しています。
HIV [113] とマラリアの試験 [115]、および百日咳ワクチンの研究は、ワクチン接種の繰り返しが感染からの保護の低下に関連しており、この反応の悪さがIgG4産生の増加に直接関係していることを私たちに知らせました。さらに、このクラススイッチは、fcを介した抗ウイルス反応の障害による画期的な感染症に寄与する可能性があることが示唆されました[113]。全体として、レビューされたデータは、反復ワクチン接種によって誘導されるIgG4産生が決して保護メカニズムを構成しないことを示しています。また、最近の文献には、典型的なワクチン接種コースによって誘発される細胞性免疫応答が、同じブースターショットの反復投与またはワクチン接種後の感染によって著しく損なわれる可能性があり、抗体免疫応答の障害と組み合わせて、レシピエントの症状を悪化させたり、病気を長持ちさせたりする可能性があることを示す警告サインもあります。過剰なワクチン接種は、免疫寛容を促進するために重要な免疫抑制微小環境を作り出す可能性があります。これらの知見は、密集した集団におけるSARS-CoV-2ブースター免疫の繰り返しには注意して取り組むべきであることを示している[112]。
mRNAワクチンによって誘発される仮想的な免疫寛容メカニズムを提案しますが、これは少なくとも6つの負の意図しない結果をもたらす可能性があります。
(1)ワクチン接種の結果として合成されたスパイクタンパク質を無視することにより、宿主の免疫系は新しいオミクロンサブバリアントによる再感染に対して脆弱になり、再感染が起こるとウイルスの自由な複製が可能になります。このような状況では、これらの病原性の低いオミクロン亜変異体でさえ、併存疾患や免疫不全状態の個人に重大な害や死さえも引き起こす可能性があることを示唆しています。
(2)mRNAおよび不活化ワクチンは、インターフェロンシグナル伝達を一時的に損ない[142,143]、免疫抑制を引き起こし、他の病原体に対して脆弱な状況に個人を残す可能性があります。さらに、この免疫抑制は、潜在的なウイルス、細菌、または真菌感染症の再活性化を可能にし、癌細胞の制御されない増殖も可能にする可能性があります[144]。
(3)耐性免疫系は、宿主におけるSARS-CoV-2の持続を可能にし、B型肝炎ウイルス(HBV)、ヒト免疫不全ウイルス(HIV)、およびC型肝炎ウイルス(HCV)によって生成されるものと同様の慢性感染症の確立を促進する可能性があります[145]。
(4)複合免疫抑制(SARS-CoV-2感染[15,16,17,18,19,20,21,22]によって生成され、ワクチン接種によってさらに増強される[142,143,144])は、癌、再感染、および両方に時間的に関連する死亡など、多数の自己免疫状態を説明することができます。COVID-19ワクチン接種率の高いいくつかの国で報告された超過死亡は、この複合免疫抑制効果によって部分的に説明できると考えられます。
(5)ワクチン接種の繰り返しも自己免疫につながる可能性があり、2009年には、重要な研究の結果はほとんど見過ごされていました。研究者らは、他の方法では自発的な自己免疫疾患の影響を受けにくいマウスでは、抗原の反復投与が全身性自己免疫を促進することを発見しました。自己抗体を誘導できるCD4+ T細胞(自己抗体誘導CD4+ T細胞、またはaiCD4+ T細胞)の発生は、CD4+ T細胞の過剰な刺激によって引き起こされました。aiCD4+ T細胞は、交差反応ではなく、新しい遺伝子TCR修飾によって生成されました。過剰に刺激されたCD8+ T細胞は、抗原に特異的な細胞傷害性Tリンパ球(CTL)に発達するように誘導しました。これらのCTLは抗原クロスプレゼンテーションによってさらに成熟することができたため、その状況では、全身性エリテマトーデス(SLE)に似た自己免疫組織損傷を誘発しました[146]。自己組織化臨界理論によれば、免疫系の自己組織化臨界性が許容できるよりも高い濃度での抗原曝露によって宿主の免疫系が継続的に過剰刺激されると、全身性自己免疫が必然的に発生します[147]。
生成されるスパイクタンパク質の量と持続時間は、BNT1273b100ワクチン(162 μg)と比較してmRNA-2ワクチン(30 μg)のmRNA濃度が高いことによっておそらく影響を受けることが提案されています[31]。したがって、mRNAワクチン接種に応答して生成されるスパイクタンパク質が高すぎて、体内で長持ちしすぎる可能性があります。それは免疫系の能力を圧倒し、自己免疫につながる可能性があります[146,147]。実際、いくつかの調査では、COVID-19免疫が自己免疫応答の発達に関連していることがわかっています[148,149,150,151,152,153,154,155,156,157,158,159,160,161,162,163,164,165,166]。
(6)反復ワクチン接種により誘導されるIgG4レベルの上昇は、自己免疫性心筋炎につながる可能性があります。IgG4抗体は、制御性T細胞によって抑制される免疫系の能力を妨げることによって自己免疫反応を引き起こす可能性があることも示唆されています[102]。免疫チェックポイント阻害剤を単独または組み合わせて使用している患者は、急性心筋炎の発生と関連しており[103,104,105,106,107]、時には致命的な結果をもたらします[102]。抗PD-1抗体はIgG4クラスであり、これらの抗体は繰り返しワクチン接種によっても誘導されることから、過剰ワクチン接種が心筋炎症例数の増加や心臓突然死の発生と関連している可能性が示唆されます。
最後に、これらの否定的な結果は、これらのmRNAワクチンを接種したすべての人々に影響を与えるとは予想されていません。遺伝的感受性、免疫不全、および併存疾患を持つ個人は、おそらく影響を受ける可能性が最も高いです。しかし、これは不穏なパラドックスを引き起こします—COVID-19疾患の影響を最も受けている人々(高齢者、糖尿病患者、高血圧症、HIV感染者のような免疫不全の人々)もmRNAワクチン接種の繰り返しの悪影響に苦しみやすい場合、それらを後押しすることは正当化されますか?オミクロンサブバリアントは病原性が低いことが実証されており[133,134,135,136,137]、mRNAワクチンは再感染から保護しない[14,138]ため、臨床医はブースターを投与することによって免疫系に有害な影響を与える可能性があることに注意する必要があります。
#アンネの法則の山下安音です。私のライフワークは、平和学研究とピースメディア。VISGOのプロデューサーに就任により、完全成果報酬型の教育コンテンツと電子出版に、専念することになりました。udmyとVISGOへ動画教育コンテンで、世界を変える。SDGs3,4の実現に向けて一歩一歩
