
コンクリート診断士 深掘りサイエンス
[1]過去問
2020年 「火害を受けたコンクリートの受熱温度推定方法」
【問題15】
火災を受けたコンクリートの受熱温度を推定するための方法に関する次の記述中の(A)~(C)に当てはまる(1)~(4)の語句の組合せのうち、適当なものはどれか。
コンクリートの受熱温度を推定する方法には、UVスペクトル法と、(A)による酸素消費量の定量分析の2種類がある。いずれの方法も、コンクリートが600℃ 付近まで加熱されるとコンクリート中の化学混和剤の濃度が(B)することに着目したものである。
UVスペクトル法は、分光光度計を用いて波長260nmにおけるUV光を分析し、吸光度と加熱温度との関係(検量線)から、受熱温度を推定する方法であるが、(C)系の化学混和剤を用いたコンクリートには適用することはできない。これは(C)系の化学混和剤の分子構造にはベンゼン環が含まれておらず、波長260nmにおけるUV光が吸光されないためである。


[2]UVスペクトル法
(1)概要
簡単に言うと、リグニンスルフォン酸には不安定な結合をしているベンゼン環を含むので紫外線を吸収する(=紫外線に影響されて分子の結合状態が変化し、紫外線を放出して元の状態に戻る)が、リグニンスルフォン酸は熱により分解してしまうため、火害を受けると減少する。
それを利用し、リグニンスルフォン酸系混和剤を使用したコンクリートの紫外線の吸光度を調べることにより、受熱温度を推定するというものである。
(2)吸光度と加熱温度
リグニン系混和剤を添加したコンクリートを加熱し、UVスペクトル分析すると、吸光度と加熱温度の関係は以下のようになる。

履歴温度の上昇とともに吸光度は全波長域にわたり減少し、履歴温度500℃以上ではほとんど変化しないことがわかる。
また、混和剤が混入されていないコンクリートでは、吸光度はきわめて小さく、波長約340nmにおける吸光度のピークが現れない。
(3)UVスペクトル法のメリット
・混和剤は、水による化学的変化はなく、熱により熱分解するのみのため、受熱温度推定にとって有利
・微量の試料あるいは、低濃度でも定量分析が可能
・常温から600℃までの温度範囲で推定可能(火災後の鉄筋とコンクリートの使用可否の目安と同じ範囲)
・現在、混和剤としては減水剤が主に用いられ、その中ではリグニン系混和剤を使用するケースが最も多いため、適用できる可能性が高い
・減水剤としては、リグニン系に次いでナフタリン系混和剤が使用され、ナフタリン系混和剤入りコンクリートでも不可能ではない(推定可能温度範囲は狭くなる)
https://www.gbrc.or.jp/assets/documents/gbrc/GBRC178_863.pdf
ここからは、かなり遠回りな説明になるかと思いますので、知っていたら途中飛ばしても結構です。
[3]化学混和剤
リグニンスルフォン酸も、ポリカルボン酸も高分子の重合体(ポリマー)で、単純な化学式ひとつで表せられるものではありませんが、分子構造例として表すとこのようになります。

(1)リグニンスルフォン酸
リグニンといえば、植物の道管、仮道管、木部繊維に沈着し、木化を起こす物質です。化学構造は、ベンゼン環に炭素3個がついたフェニルプロパン型の炭素骨格からなり、これと多数の側鎖と側鎖、ベンゼン環と側鎖の間で互いに結合した樹枝状構造をもちます。分子量は、5万以上のポリマー(重合体)で、多くの溶媒に不溶(疎水性、親油性)です。
ちなみに側鎖(R)とは、鎖式化合物で、主鎖から枝分かれしている炭素鎖。また、環式化合物で、環に結合している炭素鎖のことです。

リグニンスルフォン酸は、リグニンの一部を親水性のスルホ基に置換し、分子の中に疎水基と親水基を持つことで、石鹸のような界面活性剤になります。
スルホ基(-SO3H)は、硫酸(H2SO4)から水酸基(-OH)を1つ除いた化学式で、硫酸と同様に強酸性を示し、水と良く水和するので、染料や界面活性剤を始め多くの有機化合物に導入され利用されています。
リグニンスルフォン酸は、界面活性効果によって、コンクリートの減水剤・AE減水剤(混和剤)として働きます。AE剤については、別の機会に詳しく掘り下げようと思います。
そして、リグニンスルフォン酸は、凝結遅延剤にもなります。前述したように高分子で、たいへん入り組んだ結合をしている重合体のため、セメントと水との接触を一時的に遮断することにより、初期水和反応を遅らせます。
混和剤については、日本コンクリート工学会のサイトで詳しく説明されています。
(2)ポリカルボン酸
ポリとは、たくさん(重合体)を意味し、カルボン酸とは、分子内にカルボキシル基(-COOH)をもつ物質の総称です。こちらは、高校化学の授業で習っているはずなので、覚えている方もいるかと思います。最も単純なカルボン酸には、アリが生合成するギ酸や、お酢の酸味成分である酢酸があります。

少々脱線すると、皆さんの大好きなアルコール飲料も下図のように途中で酢酸に分解されます。

化学混和剤で使用されるポリカルボン酸は、櫛形の構造をしており、その構造は、単一なものではなく、ほぼ無限大のバリエーションを持っています。これは、主鎖の構成成分、側鎖の長さ、その長短の組合せなどをほぼ自由に選択できるからです。そのバリエーションのお蔭で、ポリカルボン酸塩系の高性能AE減水剤は、流動性を保持する性能も具備することが可能となりました。
[4]光の波長
UVスペクトル法について知るには、光の波長について知る必要があります。光には波長があり、その波長の差によって物体が様々な色に見えます。ヒトの目に見えるのは、380~780nmの波長の光で、可視光線と言います。可視光線より波長の短いものを紫外線(ultra-violet)、長いものを赤外線(infrared)と呼びます。紫外線については、UVカットなどとよく聞きますね。UVスペクトル法で用いる波長も、問題文にもあるように、260nmですので紫外線となり、ヒトが眼で見ることができない不可視光線になります。

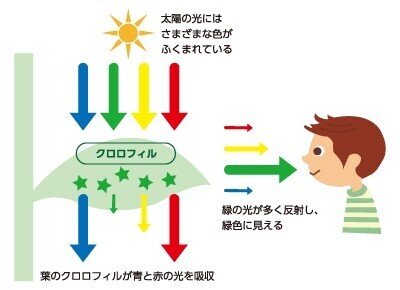
それでは、発光していない物体に色がついて見えるのは、なぜでしょうか?
例えば緑色植物ならば、クロロフィル(葉緑素)という物質が赤や青の波長の光を吸収し、緑の波長(500~550nm)の光を反射しているので、ヒトの目には緑に見えるのです。
吸収された可視光の色と、吸収されなかった可視光の色には、補色(余色)の関係が成り立ちます。
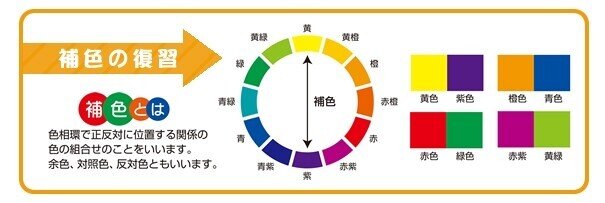
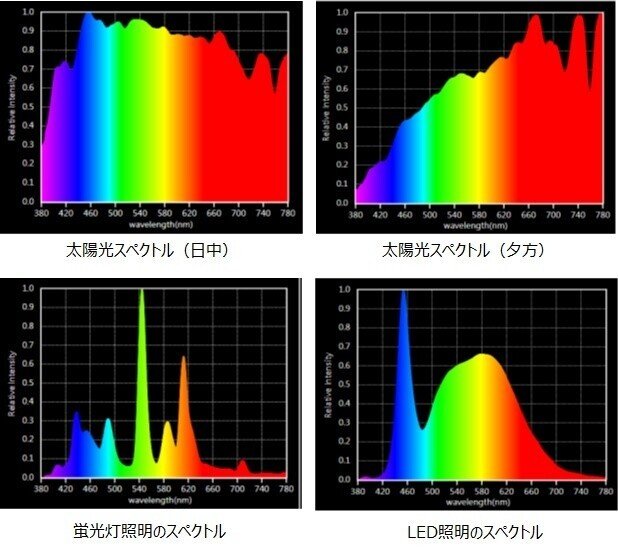
また、太陽や照明から発せられる様々な波長の可視光線が混ざった状態では、光は白に近い色に見えます。プリズムなどを用いて、可視光線を分散させてみると、それぞれの波長の可視光線が含まれていることが認識できます。
光の波長によって屈折率は異なるため、プリズムを出る光の方向は波長ごとに変わります。

このように、光をプリズムなどの分光器を通すことにより得られる、光の波長ごとの強度の分布を分光スペクトルといいます。
[5]吸光メカニズム
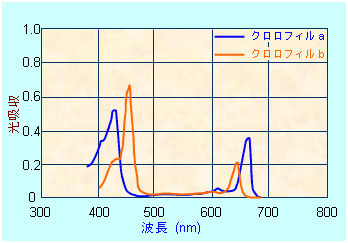
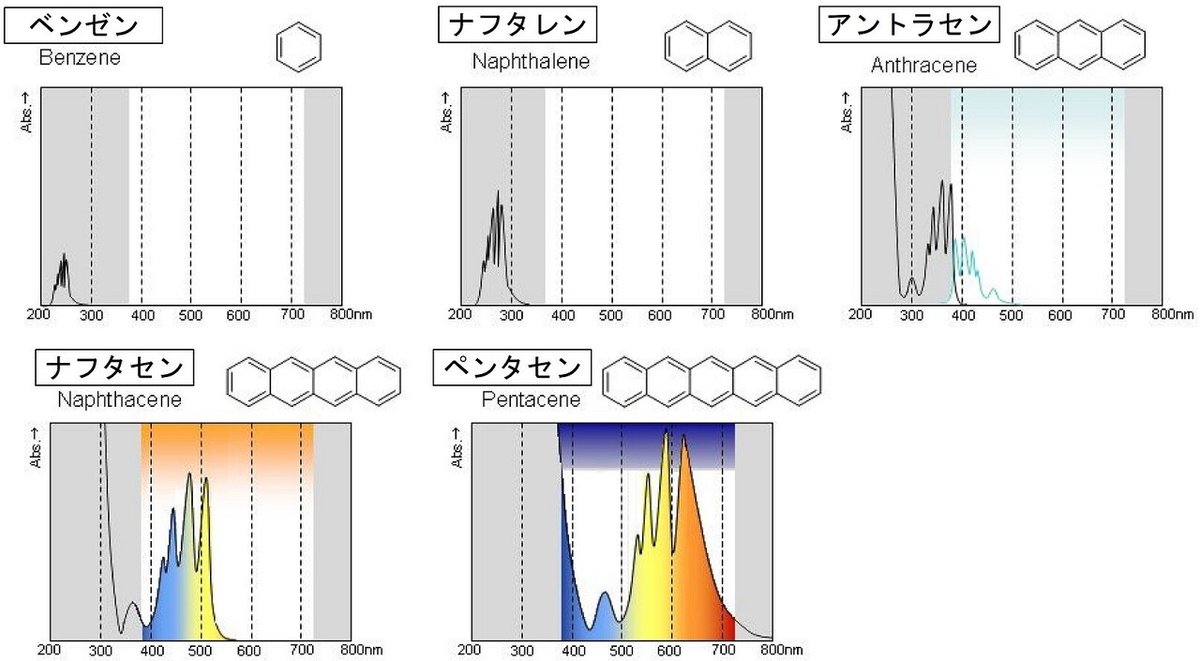
UVスペクトル法は、問題文の通りリグニンスルフォン酸系混和剤に含まれるベンゼン環が波長260nmの紫外線を吸収することを利用しています。
なぜ、ベンゼン環はこのような吸光スペクトルを示すのでしょうか。
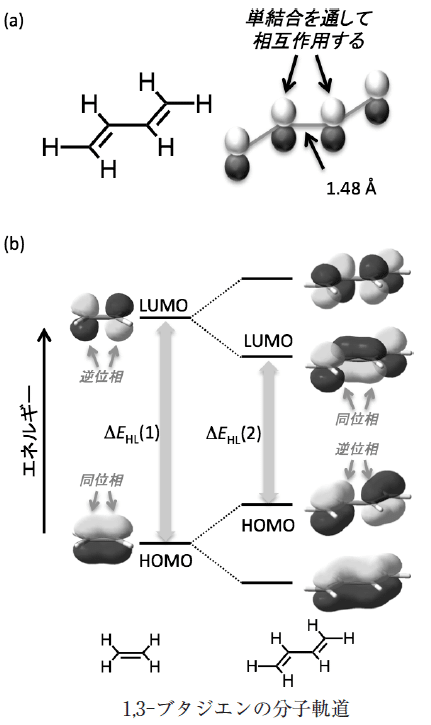
(1)共役二重結合(共役系)
吸光スペクトルには、共役二重結合が関わっています。共役二重結合とは、2つ以上の二重結合が単結合を挟んだ結合のことです。ベンゼンのように、六角形の結合をしているものもあれば、ニンジンに含まれるβ-カロテンのように長い炭素鎖となっているものもあります。下図のβ-カロテンの赤線の部分は、11本の共役二重結合で、発色団と呼ばれ、オレンジ色の色素になっています。



共役二重結合が8本よりも少ない共役系は、高エネルギーの紫外領域しか吸収せず、人間の眼には無色に見えます。共役二重結合が増えるにつれ、共役系は長波長(低エネルギー)の光子を吸収し、化合物は色を呈します。
(2)電子軌道
二重結合について理解するには、二重結合における電子軌道についても知っていた方が理解が深まるかもしれません。ですが、お急ぎの方は(3)まで飛ばしても構いません。
炭素は、原子番号6の元素であり、プラスの電荷をもつ陽子6個、中性子6個、マイナスの電荷をもつ電子6個で構成されています。平面のモデル図で表すと下図のようになります。この図ですと、簡単にわかりやすく殻ごとの電子数を把握することができます。

しかし、本当の電子軌道は、陽子のプラス電荷と電子のマイナス電荷がひきつけ合う力と、マイナスの電子同士が磁石のように反発する力により下図のような立体的な軌道になっています。

電子軌道については、この動画がわかりやすいと思います。
炭素の6つの電子は、内側のK殻のS1軌道に2個、L殻のS2軌道に2個、P2軌道に2個存在しています。電気的には、陽子と電子の数がそろった原子の状態で釣り合っているのですが、陽子と電子の引き付け合う力はそんなに強い力ではなく、それよりも元素周期表の一番右端の希ガスと同じ電子軌道になりたがります。炭素の場合は、L殻の4つの電子を失いヘリウム(He)と同じ電子軌道になるか、L殻に4つの電子を受け入れてネオン(Ne)と同じ電子軌道になりたがるため、単結合や二重結合を合計して4つの結合をして安定します。


(3)二重結合
ベンゼンなどを平面で表すと二重結合の2本線の向きは同じ方向で一致しているように見えます。しかし、実際には電子が立体の軌道を持っており、電子同士がマイナスの電荷をもつため反発し、2つの結合は全く同じ向きで繋がることができません。1つの安定したσ結合(シグマ結合)と1つの不安定なπ結合(パイ結合)により結合しています。
これについては以下のサイトがわかりやすいです。
(4)光の吸収
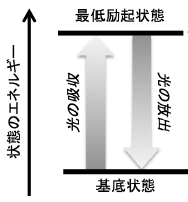
そもそも、分子が光を吸収するということは、光(電磁波)の電場の振動に合わせて分子中の電子分布が共鳴して振動することによって起きます。分子の最も安定な電子状態は「基底状態」と呼ばれ、その次に安定なエネルギーをもつ状態は「最低励起状態」と呼ばれます。
励起状態とは、光、熱、電場、磁場などの外場によって引き起こされる基底状態より高いエネルギーの全ての状態を指します。
例えば、光(電磁波)のエネルギーが電子にぶつかると、本来の軌道よりエネルギーレベルの高い外側の軌道に移ります。エネルギーレベルの高い状態の電子は不安定なため、エネルギーレベルの低い基底状態に戻ろうとして、余分なエネルギーを放出します。

ある分子が吸収することができる最も長波長の光のエネルギーは、基底状態と最低励起状態のエネルギー差に相当します。この状態間のエネルギー差と光のエネルギーが一致しないと分子は光を吸収できないため、それぞれの分子はある特定の領域の波長の光だけを吸収し、吸収スペクトルは一定の幅をもつスペクトルになります。
多くの有機分子において、基底状態と最低励起状態のエネルギー差は、エネルギーの高い紫外線の光エネルギーに対応しますが、色をもつπ 共役系分子の場合はこのエネルギー差が可視光のエネルギーの範囲内となります。
共役系のπ電子は、分子の骨格を形づくっているσ結合の電子より運動状態が変化しやすい性質をもっています。このようなπ電子に光子が衝突するとその運動状態は簡単に別の運動状態に変えられてしまいます。つまり、エネルギーの小さい長波長域の光でも、π電子ならば比較的簡単に励起状態に変わるので、π電子をもつ共役系が大きくなればなるほど小さなエネルギーの光子の影響を受けやすくなるのです。
これだけでもコンクリート診断への理解としては十分だと思うのですが、更に共役二重結合の場合は、位相というものが関わっています。詳しく知りたい方は、以下のサイトをご確認下さい。
(余談)
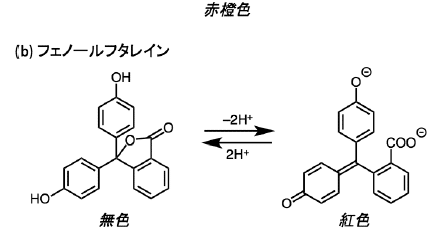
中学校の時にアンモニアの噴水の実験がありましたが、その時使用した赤紫色に変化する液体を覚えているでしょうか?
それは、フェノールフタレインという有機化合物です。これが塩基性の環境下では赤紫色に呈色するのも、構造が変化することによって共役二重結合が増えることで起こります。
土木工事で土や路盤にセメントを混ぜた際に、フェノールフタレインを霧吹きで吹きかけることがあります。これはセメントが塩基性なことを利用し、きちんと混ざっているか確認する手段のひとつです。
土木関係の方は、覚えておくと役に立つかもしれません。
[6]過マンガン酸カリウムによる酸素消費量の定量分析
(1)過マンガン酸カリウム
過マンガン酸カリウム(KMnO4)は、強力な酸化剤として実験室および工業の場面で数多くの種類の酸化反応に用いられています。水溶液はカメレオン液と呼ばれ、CODを測定するのに使用されます。

COD(Chemical Oxygen Demand)とは、化学的酸素要求量のことで、湖沼、海域の有機汚濁を測る代表的な指標です。水中に有機物等が多く、汚濁の度合いが大きい程、有機物と酸化力の強い過マンガン酸カリウムが反応し消費されるため、ピンク色から右側の色に近づきます。
![]()
なぜこのような色になるかは以下のサイトをご覧ください。
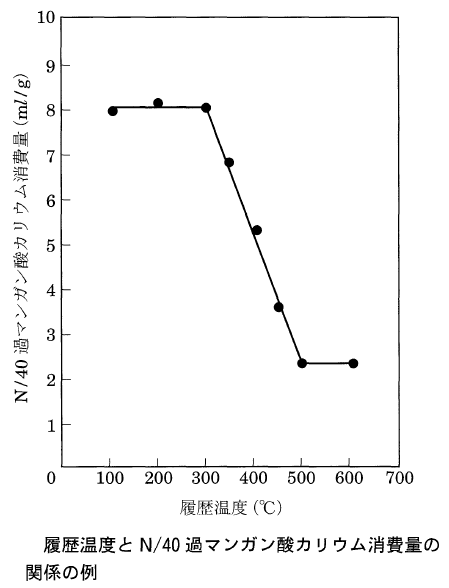
(2)消費量と受熱温度
リグニン系混和剤入りコンクリート以外の場合には、過マンガン酸カリウムによる酸素消費量の定量分析が有効です。
110℃~300℃まではほとんど混和剤が熱分解しないため、消費量は高いまま変化せず、500℃以上では熱分解残留物が、過マンガン酸カリウムによって分解されなくなるため、約600℃までの受熱温度の推定が可能です。
以上でコンクリートの受熱温度推定方法の説明を終えようと思います。
UVスペクトル法も過マンガン酸カリウムによる酸素消費量の定量分析も、一見全く別な方法に思えますが、どちらも吸光度の違いをよく利用される物質が用いられていましたね。
大変長文になってしまい、読んで下さった方はお疲れかと思います。
ありがとうございました!!
