
量子力学を概観する(4)「不確定性原理」
量子力学は古典力学と並ぶ物理学の2本柱の一つです。
これらはミクロ/マクロの物理学として区別され,量子力学はミクロ=原子などの微粒子の運動を表すことができます。
本連載では,数式の導入などは行わず,量子力学とは何かを概観していきます。
学問の勉強というよりは手軽に読んでいただけるような読み物を目指していきます。
今回のテーマは「不確定性原理」です。
不確定性とは?
不確定性の原理
まずは不確定性を示す数式を見てみましょう。
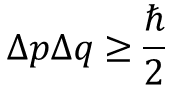
右辺のhみたいなやつは定数なのであまり気にしなくて大丈夫です。
重要なのは左辺です。
左辺のpとqは異なるパラメータ(位置,エネルギー,運動量など)であり,Δpはパラメータpの不確かさです。
簡単に言うとだパラメータpの取りうる範囲みたいなものです。
不確かさって何だろう?
わかりやすくイメージしてみましょう。
例えばA君が家から公園まで行くとします。
家から公園まではおよそ30分かかるとしましょう。

では,A君が家から出発して15分後,A君はどこにいるでしょうか?
恐らくですが,家と公園のちょうど真ん中でしょう。
しかし,途中で友達と会って立ち話をしていたらどうでしょう?
トイレに行きたくなって少し走っていたかもしれません。
そうして考えていくと正しい答えは「家と公園の間のどこか」と大雑把な範囲で答えることになります。
このように,「ちょうどここです!」と言えないのが不確定性です。
少し硬く言うと,明確な答えでないとも言えます。
ハイゼンベルグの不確定性原理
位置と運動量にまつわる不確定性原理
では,ハイゼンベルグの不確定性原理について見てみましょう。
これは「位置」と「運動量」にまつわる不確定性なので,数式にすると次のようになります。
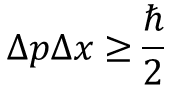
また,教科書的に説明すると次のようになります。
ある粒子の運動量と位置の両方を同時に,任意の精度で測定することは不可能である。
言い換えると,「電子などの微粒子は運動量を測定するとその位置は分からず,位置がわかるとその運動量は分からない」ということです。
つまりどういうことか?
難しいのでわかりやすく噛み砕いてみましょう。
前回の記事で解説しましたが,電子の位置は分子軌道(量子力学的には波動関数と考えて大丈夫です)で記述されます。

人間の力では,あるタイミングでの電子の位置を正確に決めることはできません。
一方,運動量は質量×速度で求めることができ,電子の質量は既知,速度は電場などの外部的要因で操作できるので,人間が求めることができると言えます。
つまり,電子の運動量を知ることはできるけど,その電子がどこにいるかは分からないということです。
これがハイゼンベルグの不確定性原理です。

逆も同じことが言えます。
仮に神のような力を得た人間がいて,電子の位置を知ることができたとします。
その場合,位置を特定した電子の運動量を知ることは不可能になります。

まとめ
今回は不確定性原理について説明してきました。
この「ハイゼンベルグの不確定性原理」は量子力学においても重要ポイントの1つです。
量子力学の講義では観測者という概念が登場してこの説明に入り,オブサーバルがどうのこうのという話になり,のうむもはじめ聞いたときはちんぷんかんぷんでした。
一つひとつの事項を細かく見ることでその本質を理解できます。
それでは,また。
