
有機金属化学の基礎(2)「結晶場理論と配位子場理論」
有機金属化合物は,配位子(有機化学)と中心金属(無機化学)により,構造,反応性が決まる。
ここでは有機金属化学の基礎について解説していきます。
なお,本連載は不定期で行います。
有機化学の視点から解説するため,有機化学の基礎事項についての解説は省略しますが,無機化学の基礎事項についてはなるべくフォローしながら解説していきます。
今回のテーマは「結晶場理論と配位子場理論」です。
結晶場理論
遷移金属種のd軌道の分裂を考える理論の一つ。配位子を点電荷とみなし,金属との静電相互作用のみを考える。
分裂したエネルギー差Δ(= 10Dq)は結晶場分裂パラメータ(配位子場分裂パラメータ)と呼ぶ。
正八面体構造錯体

dx2–y2はx, y軸方向,dz2はz軸方向に配位子(点電荷)と静電反発が生じるため軌道エネルギーは不安定化する。
→ eg > t2g
正四面体構造錯体

dxy,dyz,dzxはOhより弱いが配位子(点電荷)と静電反発が生じるため軌道エネルギーは不安定化する。
→ t2 > e,Do > Dt
平面四配位構造錯体

正八面体構造錯体のz軸方向の配位子(点電荷)を離せばD4hになる。
dz2は静電反発がなくなるため安定化し,dx2–y2とdxyは静電反発に変化はないため,相対的にエレルギー順位が上がる。
→ dx2–y2 > dxy > dz2 > dyz,dzx
高スピン錯体と低スピン錯体
分裂したd軌道へはフント則とパウリの排他的原理に基づいて電子が占有される。
ただし,結晶場分裂パラメータが小さい場合,フント則に反して低エネルギー側に2電子入る前に高エネルギー側にも電子が占有される。
(例1)Dが大きい場合
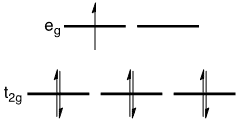
t2gが完全に占有されてからegに電子が占有される。
→スピン多重度小 = 低スピン錯体
(例2)Dが小さい場合

t2gに1電子ずつ占有された後,egに電子が占有される。
→スピン多重度大 = 高スピン錯体
配位子場理論
遷移金属種のd軌道の分裂を考える理論の一つ。中心金属と配位子の軌道相互作用を考える。
分子軌道理論に基づくため,軌道の位相が重要になる。正八面体構造錯体の配位子にはa1g(s軌道と相互作用),t1u(p軌道と相互作用),eg(d軌道と相互作用),t2g(d軌道と相互作用)の4つの軌道がある。

配位子は大きくσ供与性配位子,π供与性配位子,π受容性配位子の3つに大別できる(σ受容性配位子はσ*軌道のエネルギー準位が高いため存在しない)。
正八面体構造錯体とσ供与性配位子の軌道相互作用
σ供与性配位子は,金属d軌道よりも低いエネルギーのa1g,t1u,egの3種類の軌道が相互作用する。

正八面体構造錯体とσ供与+π供与性配位子の軌道相互作用
π供与性配位子は,金属d軌道のt2g軌道と相互作用する。
これにより,t2g軌道が非結合性軌道でなく,結合性軌道と反結合性軌道に分離するため,σ供与のみよりもDoは小さくなる。

正八面体構造錯体とσ供与+π受容性配位子の軌道相互作用
π受容性配位子は,金属d軌道のt2g軌道と相互作用する。
これにより,結合性のt2g軌道は安定化されるが,反結合性のt2g軌道はπ供与性配位子よりもはるかに高い順位を有する。
また,Doは大きくなる。

平面四配位構造錯体とσ供与配位子の軌道相互作用
平面四配位構造錯体のσ受容性配位子は,a1g,eu,egの3種類の軌道が存在する。
18電子占有する場合,反結合性軌道へ電子を占有しなければならず,不安定化してしまう。そのため,平面四配位構造錯体は16電子錯体になることが多い。

※本連載は不定期連載であるため,次回更新日は未定です。
