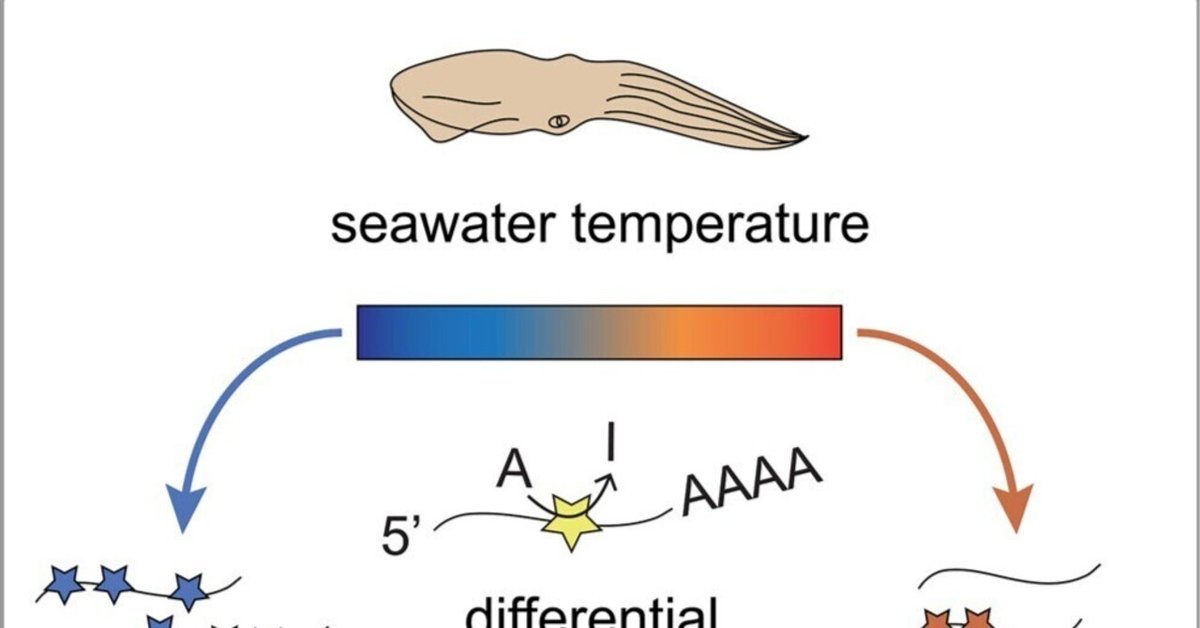
頭足類におけるRNAの再コード化により微小管モータータンパク質の機能が調整される
記事|186巻12号、p2531-2543.e11、2023年6月8日発行
全号ダウンロード
頭足類におけるRNAの再コード化により微小管モータータンパク質の機能が調整される
https://www.cell.com/cell/fulltext/S0092-8674(23)00466-X
カビタ J. ランガン
サマラ・L・レック=ピーターソン 4
脚注を表示する
オープンアクセスDOI:https://doi.org/10.1016/j.cell.2023.04.032
PlumX メトリクス
ハイライト
イカのRNA編集により、組織ごとに異なるキネシンタンパク質のバリエーションが特定される
海水温に反応して特異なキネシン変異体が作られる
寒冷地特異的なキネシンバリアントは寒冷地での1分子の運動性を向上させる
頭足類のエディトームから、頭足類以外のタンパク質の機能的な置換がわかる
概要
RNA編集は、タンパク質のアミノ酸配列を変えることができるエピジェネティックなプロセスで、"再コード化 "と呼ばれ、広く普及している。頭足類では、ほとんどの転写物が再コード化されており、再コード化は表現型の可塑性を生み出す適応的な戦略であると仮定されている。しかし、動物がRNAの再コード化をどのように動的に利用しているかは、ほとんど解明されていない。我々は、微小管モータータンパク質であるキネシンとダイニンにおける頭足類のRNA再コード化の機能を調査した。その結果、イカは海水温の変化に対応して急速にRNAの再コード化を行い、冷たい海水で生成されたキネシンの変異体は、冷たい中で行われた1分子実験で運動特性が向上することがわかった。また、組織特異的にコードされたイカのキネシンバリアントは、異なる運動特性を示すことも明らかにした。最後に、頭足類の再コード化部位が、非頭足類のキネシンやダイニンの機能的置換の発見を導くことができることを明らかにした。このように、RNAの再コード化は、頭足類の表現型の可塑性を生み出す動的なメカニズムであり、保存された非頭足類のタンパク質の特徴づけに役立つ。

グラフィカルな抄録
大きな画像を見る
高解像度画像をダウンロードする
キーワード
キネシン
ダイニン
頭足類
イカ
RNA編集
RNAの再コード化
微小管
エピジェネティクス
温度
馴化
はじめに
アデノシン-イノシン(AtoI)RNA編集は、動物に広く見られ、mRNAの制御や多様化など、多くの機能を担っている。
1
この種の編集は、RNAに作用するアデノシンデアミナーゼ(ADAR)酵素によって媒介されます。
1
コード領域におけるRNA編集は、「リコーディング」と呼ばれる非同義コドンの変化を生じさせ、その結果、アミノ酸組成が変化したタンパク質の変異体が生じることがある。
2
,
3
ほとんどの動物において、RNA編集によるリコーディングは比較的まれであり、例えば、リコーディングはヒトで報告されている編集部位の1%未満である。
2
一方、軟体動物である頭足類では、RNAの再コード化が広範囲に起こっている。
4
イカ、タコ、イカでは、全mRNAの約60%が再コード化されている。
5
,
6
,
7
,
8
RNA配列決定により、頭足類のトランスクリプトームには何万もの再コード化部位が存在し、ほとんどの再コード化転写物は複数の再コード化部位を保有していることが明らかになった。したがって、頭足類におけるRNAの再コード化は、プロテオームを劇的に多様化する可能性がある。
頭足類のRNA編集に関するバイオインフォマティクス解析は、頭足類のRNA編集の適応的役割と幅広い有用性についての議論につながった。
7
,
9
,
10
再コード化の部位は、正の選択の特徴を示す、
7
,
9
,
10
が、再コード化の機能的効果は、いくつかの頭足類タンパク質についてしか評価されておらず、この研究のほとんどは、電位依存性カリウムチャネルに焦点を当てている、
5
,
11
,
12
,
13
,
14
があり、これらは哺乳類でも再コード化されている。
15
これらのタンパク質以外では、頭足類のRNA再コード化の機能的な範囲については調査されていない。
頭足類はRNAの再コード化を利用して、特定の細胞や生物に反応してタンパク質の機能を動的に変化させることができると考えられている。
16
と環境的な合図に応答して、タンパク質の機能を動的に調節するためにRNAの再コード化を使用している可能性がある。
11
,
17
実際、RNA編集は頭足類の異なる種や組織で異なる、
5
,
6
,
7
,
8
,
16
しかし、これらの動物の中でRNAの再コード化が、環境的な合図に反応して機能的に異なるタンパク質の変異体を生成するかどうかはわかっていない。例えば、Kv1カリウムチャネルの再コード化の頻度は、異なる気候に生息するタコの種によって異なる、
11
しかし、同じ種内でRNAの再コード化が環境温度の変化に鋭敏かつ柔軟に反応して、タンパク質の機能を変化させることができるかどうかはわかっていない。
頭足類の再コード化部位の多くは、他の生物で広く保存されている未解明のアミノ酸残基に存在することから、頭足類の再コード化部位を独自のマップとして活用し、頭足類以外のタンパク質における機能残基や調節の標的を明らかにできる可能性がある。このアプローチは、従来のスクリーニングアプローチとは根本的に異なる。なぜなら、再コード化部位の置換は、動物が異なる文脈でタンパク質の機能を強化または調節するために用いる天然の変異体である可能性があるからである。この考えを評価するために、我々はまず、RNA再コード化が異なる条件下で頭足類のタンパク質機能を調節できるかどうか、また、個々の頭足類の再コード化部位置換が非頭足類タンパク質ホモログにおけるタンパク質機能を変えることができるかどうかを決定する必要があった。
ここでは、微小管モータータンパク質であるキネシンとダイニンにおける頭足類の再コード化の機能を調べることを目的とした。まず、RNAの再コード化が、動物内で表現型の可塑性を生み出す柔軟なメカニズムとして利用されているかどうかを明らかにしたいと考えた。イカのキネシンのRNA再コード化を評価したところ、イカは組織や海水温の変化(イカにとって重要な環境要因)に応じて動的にRNA再コード化を行い、固有のキネシン変異体を生成することを発見しました。そして、異なる組織や環境条件下での再コード化の違いが、イカのキネシンの運動特性をどのように変化させるかを検討した。イカのキネシンを用いた1分子実験により、異なる組織や海水温度で生成されたキネシンの変異体が運動特性を変化させることを見いだしました。このことは、頭足類におけるRNAの再コード化が環境の変化に対応するものであり、機能を調整したタンパク質の変異体を動的に生成することによって、生理的な必要性をサポートするために利用できる可能性を示している。第二に、我々は、頭足類の再コード化部位が、保存された非頭足類タンパク質の機能的に重要な未解明残基を明らかにできるかどうかを見極めたいと考えた。我々は、ヒトのキネシンと酵母のダイニンの保存残基における頭足類の再コード化部位の置換の機能的影響を評価した。このアプローチにより、キネシンとダイニンの両方において、運動性を調節する予想外の置換を多数発見し、頭足類の再コード化部位が保存タンパク質の機能を調べるために使用できることが示された。
研究成果
微小管モータータンパク質は頭足類で広範囲に再コード化されている
ヒオウギイカの編集済みタンパク質と未編集タンパク質のジーンオントロジー(GO)項解析から、編集済みタンパク質には輸送と局在に関わるタンパク質が有意に濃縮されていることがわかった。
5
(図1A)。頭足類全体では、微小管ベースの輸送に関わるタンパク質が広範囲に再編集されている
5
(図1Bと1C; 表S1)。細胞質ダイニン-1(DYNC1H1、ヒトのダイニン重鎖をコード、以下ダイニン)とキネシン-1(KIF5B、ヒト、以下キネシン)は、タンパク質の機能に対するレコーディングの影響を特徴付ける理想的なモデルタンパク質である。ダイニンもキネシンも高度に保存されており、構造的・機構的によく理解されている。さらに、1分子運動アッセイは、タンパク質の機能に対する再コード化の影響を定量化するための強固な方法である(図S1)。
図1微小管モータータンパク質は、頭足類の再コード化の機能を探索するための良いモデルである
キャプションの全文を表示する
大きな画像を見る
高解像度画像をダウンロードする
図S1自動カイモグラフ解析とハンドトラッキングによるカイモグラフ解析の比較、図2、4、6に関連するもの
フルキャプションを表示する
大きな画像を見る
高解像度画像をダウンロードする
組織特異的な再コード化がイカのキネシンの運動性を変化させる
RNAの再コード化が表現型の可塑性を生み出すメカニズムであるとすれば、再コード化の差によって、異なる組織や環境条件下で異なる機能を持つタンパク質の変異体が生まれることが予想されます。我々は、イカ属Doryteuthisのキネシン-1のRNAリコーディングに注目した。まず、イカのキネシンが組織ごとにどのように異なってコードされているのかを調べた。RNA配列決定により、D. pealeiiのキネシンモータードメインの31アミノ酸にわたる37の再コード化部位が同定された。
5
,
6
,
7
,
8
(図2A )が、これらの部位が個々のキネシン転写産物に沿ってどのように組み合わされて存在するかは不明であった。そこで、星状神経節と視床という2つの異なるイカの神経細胞集団におけるキネシンモータードメインのRNA再コード化を比較した(図2B)。星状神経節には巨大な軸索を形成する細胞体の集まりがあり、迅速な長距離輸送のためには、モータータンパク質の機能が異なることが必要であると考えられる。各組織でどのようなキネシンの変異体が生成されるかを明らかにするため、星状神経節と視床からRNAを抽出し、それぞれの組織からキネシンモータードメインの個々のcDNAクローンの配列を決定した(図S2)。星状神経節からの転写物は、視神経葉と比較してより広範囲に再コード化されており(図2C)、各組織に固有の再コード化部位の組み合わせが確認された(図2D)。両組織において、各部位が独立して編集された場合に予想されるよりも、多重にコードされた転写物が多く検出されました。また、再コード化部位間に有意なペアワイズ相関が検出され、これらの相関の一部は組織特異的であった(図2Eおよび図2F)。これらのデータは、RNAの再コード化が異なる組織でユニークな組み合わせで起こり、組織特異的なキネシンタンパク質の変異体を生成することを示し、コンビナトリアル編集の組織特異的な制御を示唆している。
図2イカのキネシンの組織特異的な再コード化により機能的に異なるモーターが生成される
キャプションを表示する
大きな画像を見る
高解像度画像をダウンロードする
図S2図2に関連するD. pealeiiのキネシンモータードメインの組織特異的な再コード化
フルキャプションを表示する
大きな画像を見る
高解像度画像のダウンロード
次に、視神経葉と星状神経節から同定された異なるキネシンの変異体の運動特性を評価した。まず、編集されていないGFPタグ付きD. pealeiiキネシン構築物(D. pealK554)を作成し、組み換えタンパク質を精製し、1分子運動アッセイでその運動特性を定量化しました。未編集のD. pealeiiキネシンは、ヒトキネシン(ヒトK560)と比較して、同程度の速度で、わずかに短い走行距離を示した。
18
)と比較して、同程度の速度と短い走行距離を示した(図2Gおよび図2H)。次に、視神経葉と星状神経節で発見された異なるコード化D. pealeiiキネシンの変異体(図2I)の運動性を未編集D. pealeiiキネシンと比較しました。再コード化された変異体は、未編集のD. pealeiiキネシンと比較して、有意に異なる運動特性を示した(図2J-2N; 表S2)。視神経葉に特有な変異体(OL-1)は速度が低下し(図2K)、星状神経節に特有な2つの変異体(SG-1とSG-2)は速度が上昇した(図2M)。これらのデータは、異なる組織でRNAを再コード化することにより、運動特性が異なる独自のキネシン変異体を生成できることを示している。星状神経節特異的なキネシン変異体で観察された速度の増加は、これらの細胞でより速い長距離軸索輸送の必要性を反映していると考えられる。
野生イカのキネシンの再コード化は、海水温に応答する
海水温は、イカにとってダイナミックで生態学的に重要な環境要因である。野生イカは、季節的・日常的に深海を移動する際に幅広い温度帯を経験し、6℃程度の低温の海域を頻繁に行き来しています。
19
,
20
ヒトキネシンの運動性は、in vitroでは温度によって劇的に変化する。例えば、ヒトKIF5B
21
とKIF5A
22
,
23
は、気温の低下とともに速度が低下し、走行距離が短くなることを示す。人間と異なり、頭足類は外温動物である。
24
,
25
そこで我々は、イカが異なる海水温下でキネシンの運動性を調節するために、キネシンの温度依存的なRNA再コード化が一つのメカニズムである可能性を考えた。また、RNAの再コード化は、イカが海水温の変動にさらされる中で、輸送機能を維持するための恒常性維持機構を提供する可能性があると考えた。
我々は、オパールセント・インショア・イカDoryteuthis opalescensのキネシンモータードメインの再コード化に及ぼす海水温の影響を調査した。これらの動物は、サンディエゴの海岸に沿って季節的に産卵回遊を行う、
19
このイカはサンディエゴの海岸を季節ごとに産卵のために回遊しており、私たちはこのイカの集団に接近することができます。D. opalescensのキネシンモータードメインをcDNAから配列決定したところ、D. pealeiiと99.5%同一であることがわかった(図S3A-S3C)。D. opalescensのキネシンモータードメインの再コード化部位を特定するために、キネシンモータードメインのゲノム配列と同一個体由来の87個のcDNAクローンを比較しました(図S3D)。その結果、14のリコーディングサイトが同定され、そのすべてがD. pealeiiから以前に同定されたサイトと重複していた。
図S3D. opalescensのキネシンモータードメインにおける再コード化部位の同定、図3との関連性
キャプションの全文を表示する
大きな画像を見る
高解像度画像をダウンロードする
図S4寒冷地特異的キネシンの変異体および置換体の頻度と運動性(図4と関連あり
フルキャプションを表示する
大きな画像を見る
ハイレゾ画像のダウンロード
まず、D. opalescensのキネシンモータードメインのRNA再コード化が海水温に反応して変化するかどうかを検討した。D. opalescensの卵嚢を海から採取し、孵化した子ガメ(図3A )を温度管理された海水タンクに24時間移し、個体全体からRNAを抽出した(図3B)。水温は6℃から20℃の範囲で、これらの動物が野生で経験する極端な温度範囲を網羅するように暴露しました。
19
,
20
,
26
次に、全cDNAからキネシンの塩基配列を決定し、各温度にさらされた動物のキネシンモータードメインに沿った個々の再コード化部位におけるRNA編集レベルを決定した。キネシンモータードメインで検出されたほとんどの再コード化部位について、編集率は温度の低下とともに有意に増加した(図3C)。
図3イカのキネシン転写産物は海水温に応答して異なる形で再コード化される
キャプションの全文を表示する
大きな画像を見る
高解像度画像をダウンロードする
次に、異なる海水温度にさらされた動物で、どのようなキネシンの再コード化部位の組み合わせが生成されるかを確認した。6℃または20℃の海水にさらされた動物のcDNAクローン(個々のキネシンの転写物を表す)の配列を決定した(図3-3F、S4A、およびS4B)。バルクシーケンスの結果と一致して、20℃の海水と比較して、6℃の海水にさらされた動物のキネシン転写物には高い編集レベルが観察された(図3D)。20℃の海水にさらされた動物の転写物の30%が編集されていないのに対し、6℃の海水にさらされた動物の転写物は11%でした(図3D)。さらに、6℃の海水にさらされた動物の転写物はより広範囲に再コード化されており、3つ以上の再コード化イベントを持つ転写物が38%あったのに対し、20℃にさらされた動物の転写物は13%でした(図3D)。このように、D. opalescens squidのキネシンのRNA再コード化は、海水温の変化に対応していることがわかった。キネシンのコード化された変異体は、より冷たい海水で優先的に生成され、編集されていないキネシンはより暖かい海水で優先的に生成される。また、再コード化部位間の有意なペアワイズ相関が確認され、これらの相関の一部は温度特異的であった(図3Gおよび図3H)。このことは、RNAの再コード化が環境温度に応答して温度特異的なキネシンバリアントを急性的に生成することを示すものである。さらに、今回のデータは、RNAの再コード化における温度依存的な変化が、動物において24時間以内に急速に起こりうることを示すものである。
再コード化によってイカのキネシン運動が寒冷化で促進される
我々は、冷たい海水でより広範囲に再コード化されたD. opalescensキネシン変異体は、未編集のD. opalescensキネシンと比較して、低温でのin vitroでの運動性が向上している可能性があると仮定した。そこで、編集されていないD. opalescensキネシンの構築物(DopalK554)を作成し、25℃と8℃(1分子アッセイ用のイメージングセットを確実に冷却できる最も低温)での1分子運動性アッセイでその運動特性を計測した。ヒトキネシンと同様に
23
D. opalescensのキネシンは、25℃と比較して8℃では速度が遅く、走行距離も短かった(図4Aおよび4B)。冷たい海水にさらされた動物に特有の3種類のキネシン変異体を作製し(図4C)、8℃と25℃におけるこれらの変異体の運動特性を定量化した(図4D-4G、S4C-S4H;表S2)。2つの寒冷地特異的D. opalescensキネシン変異体(Cold-2およびCold-3)は、編集前のD. opalescensキネシンと比較して8℃で有意に長い走行距離を示し、一方で速度はわずかに減少した(図4Eおよび図4F)。また、3種類の寒冷地特異的D. opalescensキネシン変異体はいずれも、未編集のD. opalescensキネシンと比較して、8℃で微小管着陸率(キネシンが微小管に結合する頻度)が有意に増加することが示された(図4G)。このように、イカのキネシンのRNA再コード化が海洋寒冷化に対応して急性的に変化することで、寒冷下での運動特性が向上したキネシン変異体が生成されることがわかった。これは、イカが異なる環境下でキネシン活性と荷物の細胞内輸送を最適化するための一つのメカニズムかもしれない(図3H)。寒冷地特異的な変異体で観察された平均着陸速度の増加は、これらの変異体が編集されていないキネシンと比較して生体内で機能的に強化される可能性を示唆している。例えば、寒冷地では、編集されたキネシン変異体は、編集されていないキネシンよりも効率よく微小管トラックに結合して輸送を促進することができるかもしれない。
図4寒冷地におけるイカのキネシン変異体の運動性向上が確認される
キャプションの全文を表示する
大きな画像を見る
高解像度画像をダウンロードする
寒冷地に適した再コード化部位の置換により、ヒトのキネシンの寒冷地での運動性が向上した
寒冷地特異的キネシン変異体に見られる3つのアミノ酸変化(Lys67Arg、Tyr77Cys、Asn117Asp)は、温水にさらされた動物よりも冷水にさらされた動物のキネシン転写物を再コーディングした場合に有意に多く見られた(図3Fおよび図S4I)。これらの寒冷地仕様の置換がキネシンの運動性にどのような影響を与えるかを調べるために、Lys67Arg、Tyr77Cys、Asn117Aspの置換を、GFPタグ付きヒトキネシンの切断体(K560
18
ここでは「ヒトキネシン」)を作成し、野生型ヒトキネシンと比較して8℃での運動性を評価した。(図4I-4K、S4J、およびS4K;表S2)。その結果、これらの個々の置換は、野生型ヒトキネシンと比較して、8℃におけるヒトキネシンの走行距離と着地率を有意に増加させることがわかった(図6H)。これらの置換は寒冷地特異的なイカのキネシンの転写産物に濃縮されていることから、より高い着地率と走行距離の増加は、寒冷な海水にさらされた後にこれらの動物で生成されたキネシン変異体の一般的特徴である可能性がある。
キネシンとダイニンの間で保存されたアミノ酸にコード化部位が存在する
イカのキネシンを用いた今回の結果は、RNAの再コード化が、異なる組織や環境条件下でタンパク質の機能を動的に変化させる可能性があるという考えを裏付けるものである。我々は、再コード化によって、再コード化されたアミノ酸の異なる組み合わせを含む複雑なバリアントが多様に生成されることを見いだした。例えば、D. pealeiiのキネシンモータードメインにあるコード化アミノ酸の24/31(77%)は、ヒトのキネシンに保存されています。ヒトキネシンの低温優先型イカの置換を調べた我々のデータは、個々の頭足類の再コード化部位の置換が、非頭足類タンパク質の機能を変化させることを支持している。そこで我々は、ヒトのキネシンと酵母のダイニンという、よく研究されているモーターのホモログにおいて、ダイニンと同様にキネシンのセファロポッド再コード化部位置換の影響を特徴付けることを目指した。
我々はまず、キネシンとダイニンの間で報告されている頭足類の再コード化部位を調査した。我々は、6種の頭足類から、以前に発表されたエディトームデータを収集した。
5
,
6
,
7
,
8
ダイニンとキネシンは、これらの頭足類とヒトの間で高度に保存されており、それぞれ約74%と約65%のアミノ酸配列の同一性を共有している。両モーターは頭足類で広範囲に再コード化されており、再コード化部位は保存アミノ酸と非保存アミノ酸に広く分布している(図5A、5B;表S3、S4)。解析した6種の頭足類全体では、キネシンの再コード化イベントは合計154個あり、そのうち55個は複数の頭足類間で共有されており、ダイニンの再コード化イベントは合計500個あり、そのうち125個は共有されている。
図5頭足類の再コード化部位はダイニンとキネシンの保存残基で起こる
キャプションの全文を表示する
大きな画像を見る
高解像度画像をダウンロードする
キネシンとダイニンはともに二量体モーターで、ATP加水分解によるエネルギーを使って構造変化を起こし、最終的に微小管に沿った一方向の動きを駆動する。
27
,
28
,
29
ダイニンのモータードメインにはAAA+ドメインのリングがあり、AAA1とAAA3のヌクレオチド状態がダイニンの微小管結合ドメイン(MTBD)と微小管の間の親和性を支配している。長い反平行コイルドコイル「ストーク」と短いコイルドコイル「バットレス」がダイニンのAAA+リングとMTBDをつなぎ、「リンカー」がダイニンのAAA+リングとモーターのカーゴ結合端とをつなぎ、ダイニンのATP加水分解サイクル中に大きな動きをして力を発生させます。
30
,
31
,
32
活性化前のダイニン二量体は、ダイニンの茎、AAA+ドメイン、リンカーの接触を伴う自己抑制された「ファイ」コンフォメーションで存在します。
33
キネシンのモータードメインはダイニンに比べて非常に小さくコンパクトであり、単一のATP結合部位と微小管結合部位は近接している。
34
キネシンのモータードメインは、ヌクレオチド依存的にモータードメインとのドッキングとアンドッキングを繰り返す「ネックリンカー」を介して、コイルドコイル二量化ドメインとカーゴ結合ドメインに連結されている。
35
また、キネシンには自己抑制状態があり、尾部ドメインがモーターと相互作用している。
36
,
37
いくつかの再コード化部位は、キネシンやダイニンの既知の力学的要素内の保存アミノ酸に生じるが、これらの部位での再コード化によって生じる特定の置換は検討されていない(図5Cおよび図5D)。例えばダイニンでは、モータードメインとリンカーの間のアミノ酸の接触部位が再コード化される、
30
,
31
,
32
は、ダイニンの自動抑制型Phiフォームを安定化するために重要な接触部位である。
33
キネシンでは、ネックリンカーのドッキングに関与するアミノ酸、
38
,
39
微小管結合に関与するアミノ酸、
40
およびテールペプチドの自己阻害作用
36
も再コード化されている。我々の知る限り、キネシンとダイニンの合計540のコード化されたアミノ酸のうち、過去に疾患と関連したアミノ酸と重なるものは2つだけである、
41
また、これらの部位の置換は疾患関連変異とは異なる。キネシンとダイニンの両方で、再コード化部位の大部分は、機能的に重要であることがこれまで強調されていないアミノ酸に存在する。このように、頭足類の再コード化部位は、他の方法では容易に予測できない残基や置換を指し示している。
酵母ダイニンとヒトキネシンのアミノ酸残基のうち、頭足類に保存され、かつ頭足類にコードされているものに焦点を当てることで、評価すべき置換の数を劇的に減らすことができた。例えば、ヒト、酵母、頭足類のダイニンの間で約1,265残基が保存されているが、頭足類のどの種でもこれらの残基のうち89残基しかリコーディングされていない。さらに、再コード化によって、どのような特定の置換を評価すべきかが導かれる。これらの置換は頭足類に見られる自然な変異であり、動物は異なる文脈で再コード化された残基とゲノムにコードされた残基のいずれかを使用するかもしれない。ヒトのキネシンでは、K560を使用した。
18
(ヒトキネシンはK560 18(「ヒトキネシン」)、酵母ダイニンはGST二量化されたトランケート構造体である
42
(GST-Dyn1(331kDa),「酵母ダイニン」)を用いた。これらの最小構成体のモータードメイン内で保存されている部位で、RNA配列データから少なくとも2%のRNAで再コード化されているものに着目した。
5
,
6
,
7
,
8
のいずれかの頭足類の種である。これらの基準を適用して、ヒトのキネシンの6つのアミノ酸にわたる10の再コード化部位置換(図5A)および酵母のダイニンの7つのアミノ酸にわたる11の再コード化部位置換(図5B)のパネルを作成した。
それぞれの置換について、1分子運動アッセイで速度、走行距離、過程的事象の割合を定量した(図6、S5、S6;表S2)。ヒトのキネシンと酵母のダイニンの両方で、評価したアミノ酸置換の大部分は運動性を著しく変化させた。キネシンやダイニンの疾患関連変異と異なり
43
,
44
,
45
頭足類から導かれた置換は、いずれも処理能力を失わせるものではなく、ほとんどが走行距離または速度を有意に増加させるものであった。我々が分析した置換のほとんどは、これまで解明されていなかったアミノ酸で起こっており、頭足類の再コード化部位は、機能的に重要な保存残基を特定するためのガイドとして使用できることが示されている。以下、両モーターの例を強調する。特徴的な追加の置換については、図S5とS6を参照してください。
図6ヒトのキネシンと酵母のダイニンの運動性を調整するコード化部位の置換
キャプションの全文を表示する
大きな画像を見る
高解像度画像をダウンロードする
図S5図6に関連するヒトキネシン変異体の運動性
完全なキャプションを表示する
大きな画像を見る
高解像度画像をダウンロードする
図S6図6に関連する酵母ダイニン変異体の運動性
キャプションを表示する
大きな画像を見る
高解像度画像をダウンロードする
リコーディングサイトの置換でヒトのキネシンの運動性が変わる
キネシンでは、モーターヘッドの27個のアミノ酸が少なくとも1種の頭足類で再コード化されており、そのうち22個のアミノ酸がヒトのキネシンと保存されている。これらのアミノ酸のうち、K67、Y77、N117、K166、K281の5つのアミノ酸の再コード化部位置換を評価した。これらの残基のうち3つ(K67、Y77、N117)は、D. opalescensの低温特異的な再コード化の解析でも特徴づけられている(図4H-4K)。
Tyr77は、カバーネックバンドル(CNB)の形成とネックリンカーのドッキングを安定化するのに役立つと予測される、
38
この位置の芳香族残基は、キネシン全体で高度に保存されている。
39
遺伝性痙性対麻痺(HSP)では、Kif1Aの類似部位(Tyr89)がAspに変異しており、1分子運動アッセイでは、Tyr89Aspは速度が遅く、走行距離が長くなる。
39
複数の頭足類において、Tyr77はCysに編集されることがある。ヒトキネシンのTyr77Cys置換は、速度に有意な変化を与えずに走行距離を増加させることがわかった(図6Bおよび6C)。このことは、ネックリンカーのドッキングを安定化させるというこの残基の役割と一致する。
Asn117とLys67はともに表面に露出した残基であり、機能的な知見はほとんどない。Asn117はAsp、Ser、Glyに編集することができ、微小管に結合したキネシンの最近の構造から、Asn117はネックリンカーのドッキングに関与していると考えられる。
46
Asn117Aspは走行距離を著しく増加させ、速度を低下させるが、Asn117Serは走行距離や速度にほとんど影響せず、Asn117Glyは速度と走行距離を低下させることがわかった(図6Bおよび図6C)。Lys67はGlu、Arg、またはGlyに編集することができる。その結果、Lys67Gluは走行距離をわずかに減少させ、Lys67Argは走行距離を増加させ、速度を減少させた(図6Bおよび図6C)。これらの結果から、Lys67は微小管との長距離静電相互作用の安定化に関与していると考えられ、隣接する残基Lys68の役割も計算で予測されたものと同様である。
47
また、モータードメインの微小管相互作用面に沿って位置するLys166とLys281の再コード化部位置換の影響も評価した。これらの残基をアラニンに変異させると、微小管結合が減少する。
40
Lys281Alaは、Lys166Alaと比較して微小管結合に深刻な影響を及ぼすことが示されており、HSPで変異しているKIF5Aの隣接残基(Arg280)をセリンに変異させたものである、
48
,
49
も微小管結合の親和性が低下する。
50
,
51
O. bimaculoidesとO. vulgarisでは、Lys281がArgにリコードされ、モーターヘッドと微小管の間の静電的相互作用が強まると予想される。S. officinalisでは、Lys166はGluにリコードされ、微小管との相互作用を弱めることが予想される。このことは、微小管との静電的な相互作用を安定化させるというこれらの残基の役割と一致している(図6Bおよび図6C)。
リコーディングサイトの置換が酵母ダイニンの運動性を変える
次に、ダイニンの運動性に及ぼすリコーディングサイトの置換の影響を評価した。ダイニンでは、いくつかの再コード化部位の置換がバットレスで起こる。バットレス/ストーク相互作用ループの欠失は、ATPase活性を微小管結合から切り離す。
30
と運動性が失われる、
52
しかし、バットレス/ストーク相互作用ループ以外の特定のバットレス残基に関する知見は限られている。バットレス内の10個のアミノ酸は頭足類の再コード化部位であり、そのうちの5個は酵母ダイニンと保存されている。我々は、バットレスコイルドコイルに沿って位置するこれらのアミノ酸のうち、2つのアミノ酸の再コード化部位置換を特徴付けた: コイルドコイル1(CC1)に位置するLys3544と、CC2に位置するLys3600である。Lys3544はGlu、Arg、Glyのいずれかにコード化することができ、これらの多様なアミノ酸のいずれかに置換すると、走行距離を著しく変化させずに酵母ダイニンの速度が向上することがわかった(図6Eと図6F)。Lys3600はArgにリコードされており、Lys3600Argは野生型ダイニンと比較して速度が増加し、走行距離が減少した(図6Eおよび6F)。これらの置換の効果は、運動性に大きく影響するバットレスの未解明な残基を強調するものである。
また、ダイニンの微小管結合ドメイン(MTBD)における再コード化部位置換の特徴も明らかにした。MTBDの8つのアミノ酸は頭足類で再コード化され、そのうちの4つのアミノ酸は酵母ダイニンと保存されている。我々は、茎のCC2がMTBDから出る際に位置するAsn3218の再コード化部位置換の影響を評価した。
53
,
54
に位置し、微小管に直接接触することはないと予測される。Asn3218はAsp、Ser、Glyに置換することができ、酵母ダイニンのこれらの置換はそれぞれ野生型と比較して速度の低下と走行距離の増加をもたらすことを見出した。(図6Eおよび図6F)。Asn3218は微小管格子と直接相互作用することは予測されていないが、このアミノ酸がチューブリンの長い非構造化C末端尾部と相互作用し、Asp、Ser、Glyへの変異がこれらの相互作用を増大させている可能性が、我々が観察した表現型から推測された。
ヒトのキネシンと酵母のダイニンにおける再コード化部位の置換に関するこの調査は、頭足類の再コード化部位が、タンパク質機能に微妙な影響を与える保存アミノ酸をいかに明らかにするかを示し、さらにタンパク質機能の多様化におけるRNA再コード化の役割を明らかにするものである。
考察
我々の結果は、頭足類が表現型の可塑性を生み出すメカニズムとしてRNAの再コード化を利用していることを裏付けている。我々は、イカが異なる組織や環境温度において、RNA再コード化によってキネシンの機能を柔軟に調整できることを示し、生理学的な必要性や環境条件の変化への順応をサポートすると考えられる。これらのデータは、RNAの再コード化が温度順応に関与しているのではないかという長年の仮説を支持する証拠を提供するものである。
11
,
17
,
55
生物は環境温度の変動を補償するために多様な分子機構を採用している
56
,
57
キネシンや他のタンパク質の温度依存的な再コード化は、ショウジョウバエや冬眠中の哺乳類など、他の動物においても温度順応の重要な要素である可能性があり、RNA編集の温度依存的な変化がグローバルに報告されている。
58
,
59
,
60
,
61
イカのキネシン転写産物の解析は、コンビナトリアルRNA編集を制御するメカニズムを探る今後の研究の動機となる。編集部位は通常、短時間のRNAシーケンスから決定されるため、ほとんどの転写産物において、編集部位が同じ転写産物に沿ってどのように組み合わされて発生するかは不明である。ヒトでは、セロトニン2C受容体のコンビナトリアル編集により、機能的に異なる受容体バリアントが生成され、編集の異常が神経疾患と相関している。
62
,
63
,
64
,
65
,
66
イカのキネシンにおいて、組織特異的かつ温度特異的な編集部位の組み合わせを同定し、運動特性が異なる変異体をコード化することができた。先行研究と同様に、編集部位間に有意な相関が検出された。
67
このことは、コンビナトリアル編集が条件によって制御されていることを示唆している。このような制御は、ADARの発現や局在、RNAの局在やフォールディングの違い、あるいは他のRNA結合タンパク質との相互作用のレベルで媒介される可能性がある。実際、ショウジョウバエのShakerカリウムチャネルのコンビナトリアルエディットにおける組織特異的な違いは、ADARの発現レベルの違いだけではない調節が関係しているようである。
68
イカキネシンの再コード化については、どのADARがどの部位で編集に関与しているのか、あるいはどこで(核と細胞質)再コード化が起こっているのかは不明である。例えば、哺乳類のADAR2とは異なり、イカのADAR2は核と細胞質の両方に局在することが示されている、
16
は、潜在的な制御の新たなモードを切り開くものである。新しいロングリードRNA配列決定法
69
,
70
は、多様な細胞型、細胞内コンパートメント、条件下でのコンビナトリアルRNA編集を広く評価する機会を将来的に提供するはずである。
ヒトのキネシンと酵母のダイニンにおける再コード化部位の置換を調査した結果、頭足類のエディトームが保存タンパク質の機能を調査するためにどのように利用できるかが明らかになった。複数のタンパク質配列のアラインメントは、保存された機能の領域を推論するための比較遺伝学的アプローチを提供する。頭足類のRNA編集は、保存された残基の機能的に重要な置換をさらに特定するためのエピジェネティックなレンズを提供し、相同性だけで得られる洞察を補完する。このアプローチは、機能に重要なアミノ酸残基の先験的な同定が困難なタンパク質領域において特に有用であると考えられ、異なる状況下でタンパク質の機能を強化または調整するアミノ酸置換を同定するために使用される可能性がある。このように、我々は頭足類の再コード化部位が、他のタンパク質を特徴付けるための一般的なリソースおよびガイドとなることを提案する。例えば、多くの疾患関連タンパク質は頭足類で高度に再コード化されており(例:タウ、アミロイドベータ、LRRK2)、再コード化部位を特徴付けることで、これらのタンパク質の制御と機能に対する新たな視点が得られるかもしれない。
本研究の制限事項
本研究では、最小限のモーター構築物の1分子運動性に対する再コード化の効果を評価したが、ダイニンとキネシンの編集部位の調査から、再コード化はATPase活性、微小管結合、力発生、自己抑制機構など、他のモータータンパク質の特性にも影響を与える可能性が高いことが示唆された。さらに、リコーディングが、タンパク質のターンオーバー、カーゴの結合、複合体の組み立て、トラフィッキングなど、他のプロセスにどのような影響を与えるかを調べることは、興味深い。今回のデータは、温度依存的な編集の変化が動物で急速に起こりうることを示している(24時間未満)。しかし、編集された転写物がどの程度の速さで翻訳され、輸送成分がターンオーバーするのかは不明である。今後のプロテオーム研究によって明らかになるかもしれない。生体内では、動物が低温にさらされると、キネシン-1変異体の混合体が高度に再コード化された変異体に偏るようになると想像される。滑空アッセイにおける混合モーター集団の運動性、およびヘテロ二量体の一分子運動性を明らかにすることで、この異質性の影響を明らかにすることができる。今回のデータから、着陸速度と走行距離は、低温に応答するキネシンのRNA再コード化によって調節される重要な運動パラメータであり、このことは、生体内で再コード化キネシン変異体の機能強化のメカニズムになる可能性があることが示された。しかし、今後、運動性の他の側面に対する再コード化の効果を評価する研究が必要である。微小管に基づく輸送には何百ものタンパク質が関与しており、輸送装置の様々な構成要素においてリコーディングがどのように調整されているかを、特に温度順化の状況において、生体内で評価することは興味深いと思われる。
STAR★メソッド
主要リソース表
REAGENTまたはRESOURCESOURCEIDENTIFIER細菌およびウイルス株E.coli BL21-CodonPlus(DE3)-RIPLAgilentCat #230280生物試料Doryteuthis pealeiiRosenthal lab - The Marine Biological LaboratoryN/ADoryteuthis opalescensegg casings collected off Scripps Pier, San Diego, CAN/AChemicals, peptides、 EDTAフリープロテアーゼ阻害剤カクテル錠RocheCat #COEDTAF -ROIgG Sepharose 6 fast flow beadsGE HealthcareCat #17 -0969-01Ni-NTA agaroseQIAGENCat #30210HaloTag TMR ligandPromegaCat #G8251寄託データキモグラフ分析用スクリプトこの論文Githubリポジトリ kjran/Kymo_analysis
DOI:10.5281/zenodo.7699922ペアワイズ相関分析のスクリプトこの論文Githubリポジトリkjran/pairwise_corr_analysis
DOI:10.5281/zenodo.7699924Experimental models: 生物/菌株本研究で作製したS. cerevisiae株本論文表S6オリゴヌクレオチドD. opalescensゲノムDNAからキネシンモータードメイン領域を増幅するプライマー本論文表S5組み換えDNApET17b-K560Vale et al.
18
N/ApET17b-DpealK554th論文N/ApET17b-DopalK554th論文N/ASソフトウェアおよびアルゴリズムIlastik 1.3.3post3Berg et al.
71
www.ilastik.orgMATLAB R2021a Update 4MathWorks (Natick, MA)www.mathworks.comPrism9Graphpad (Boston, MA)www.graphpad.comFiji (ImageJ)Schindelin et al.
72
imagej.net/software/fiji/downloadsOmicsBox (Blast2Go)Biobam (Valencia, Spain)www.biobam.com
新しいタブで表を開く
リソースの有無
リードコンタクト
リソースや試薬に関する詳細な情報およびリクエストは、リードコンタクトであるSamara L. Reck-Peterson (sreckpeterson@health.ucsd.edu)に直接お問い合わせください。
材料の入手方法
本論文で作成されたすべてのプラスミドは、要求に応じてリードコンタクトが共有する。
実験モデルおよび被験者の詳細
動物
D. pealeiiの視葉と星状神経節は、The Marine Biological LaboratoryのJoshua Rosenthalから贈られたものである。標本は、2017年の11月の間にマサチューセッツ州ウッズホールの海洋生物学研究所の動物収集部によって収集された。星状神経節と視葉の組織は、K.J.R.によって3匹の成人男性それぞれから解剖され、組織は-80℃で保存されました。なお、これらの個体は野生で捕獲されたものであるため、年齢は不明である。
D. opalescensの卵嚢は、2021年8月にカリフォルニア大学サンディエゴ校のスクリップス海洋研究所の海洋コレクション責任者であるPhil Zerofskiによって、カリフォルニア州サンディエゴのスクリップスピア沖で採取されました。水深の水温は12~13℃であった。卵莢は12~13℃の海水水槽で管理した。孵化したばかりの個体(生後24時間未満)は、下記の方法詳細に記載されている温度実験に使用した。
酵母の種類
本研究で使用したS. cerevisiaeの菌株を表S6に記載する。タンパク質精製用のS.cerevisiaeの培養は、以下の方法詳細に記載されているように増殖および収穫された。
メソッドの詳細
編集部位のマッピング
D. pealeii、S. officinalis、O. vulgaris、およびO. bimaculoides、E. scolopes、S. lineolataの編集部位と編集レベルは、既報のRNA-seqデータから得た
5
,
7
,
8
であり、表S3および表S4に表されている。アラインメントは、T-coffee multiple protein sequence alignmentsを使用して行った。
73
を使用してアラインメントを行い、頭足類の再コード化部位におけるアミノ酸保存を決定した。頭足類DYNC1H1ホモログは、H. sapiens (Uniprot: DYHC1_HUMAN), M. musculus (DYHC1_MOUSE), S. cerevisiae (DYHC_YEAST), A. nidulans (DYHC_EMENI), およびDoryteuthis melanogaster (DYHC_DROME) とアラインした。頭足類のKINHホモログは、H. sapiens (KINH_HUMAN), M. musculus (KINH_MOUSE), D. melanogaster (KINH_DROME) にアライメントした。
ジーンオントロジー(GO)タームエンリッチメント解析
GO用語の濃縮解析は、OmicsBox suite (Biobam; Valencia, Spain)のBlast2GO toolkitを使用して行った。D. pealeiiのトランスクリプトームと編集されたタンパク質のリストは、以前に報告されています。
5
p値はFisher's exact t-testにより決定した。
D. opalescensのキネシンモータードメインにおける再コード化部位の同定
D. opalescensのキネシン-1モータードメイン(aa1-554)の配列はcDNAから決定した:1匹の動物を溶解し、RNAeasy Plus抽出キット(Qiagen)を用いて製造者のプロトコルに従って全RNAを抽出した。cDNAはAccuscript High-fidelity first-strand cDNA synthesis kit(Agilent)で作成した。キネシン-1モータードメインは、D. pealeiiの配列に基づく遺伝子特異的プライマー(FW:CCTACTTTTGTTTGCGCG RV:TCTGCAGCATTTCCACCTACA) を用いてcDNAからPCR増幅した。
RNA編集部位を決定するために、以下に述べるように、襟元で半分に切った同一個体の動物のゲノムDNAとcDNAからキネシン1モータードメインの配列を決定した。ゲノムDNAは、DNAeasy抽出キット(Qiagen)を用いて製造元のプロトコールに従って動物の後方部分から抽出し、RNAはRNAeasy Plus抽出キットを用いて前方部分から抽出した。
ゲノムDNAからキネシンモータードメインの配列を決定するために、D. pealeiiのゲノム配列とともに我々のcDNA配列をガイドとして用い、予測されるイントロン配列にまたがるPCRプライマーのセットを設計した。これらのプライマーは表S5に、配列決定結果は図S3に示されている。D. pealeiiではエキソン1と2、エキソン2と3にまたがるイントロンはそれぞれ25,726bpと7,245bpであり、これらのイントロンにまたがるPCR産物を増幅することはできなかった。したがって、これらの領域については、D. pealeiiの配列に基づいてプライマーを設計し、エクソンだけでなく、配列決定のための5′および3′イントロン-エクソン接合部を増幅するようにした。その他の領域については、隣接するエクソンにまたがる産物をPCRで増幅し、完全なエクソンと5′および3′イントロン-エクソン結合部の塩基配列を決定した。
RNA編集部位を決定するために、同じ個体から抽出したRNAから、Accuscript High-fidelity first-strand cDNA synthesis kitを使用してcDNAを作成した。キネシン-1モータードメインは、遺伝子特異的プライマー(FW:CCTACTTTTGTTTGCGCG RV:TCTGCAGCATTTCCACCTACA)を用いてcDNAからPCR増幅し、製造者のプロトコルに従ってpCR-XL-2-TOPOベクター(Invitrogen)へクローニングした。87個の個々のクローンの塩基配列を決定し、各クローンについて検出されたすべてのAからGへの置換を図S3に示す。その結果、非同義コドンの変化をもたらす12の編集部位(すなわち、再コード化部位)と、同義コドンの変化をもたらす6つの編集部位が確認された。これらの12個のリコーディングサイトは、D. pealeiiで以前に報告されたリコーディングサイトと重複している。
5
,
8
6℃に暴露された動物由来のクローンでは、ヌクレオチド位置818にAからGへの置換が、20℃に暴露された動物由来のクローンでは、ヌクレオチド位置1102にAからGへの置換が検出されたのである。これらの2つの位置は、D. pealeiiで以前に報告された再コード化部位とも重なっている。
菌株の作製
酵母株の作製
全てのダイニン構築物はS. cerevisiae strain W303aで生成した。GST-Dyn1(331kDa)
42
をPCRベースの手法で改変し、酢酸リチウム法で形質転換した。QuikChange site-directed mutagenesis (Agilent)を用いて以下の点変異を生じさせ、DNA配列決定により株を確認した: T2122A、N2915S、N3218D、N3218S.、N3218G、i3272V、A3473T、K3455E、K3544R、K3544G、K3600R.本研究で使用した酵母株の一覧は表S6を参照。
大腸菌株の作製
全てのキネシン構築物は、大腸菌BL21-Codon Plus(DE3) (Agilent)で発現させた。すべての変異は、QuikChange部位特異的変異誘発およびマルチ部位特異的変異誘発(Agilent)を用いて生成し、すべての構築物はDNA配列決定によって確認した。ヒトK560-GFPはVale lab.から贈られた。ヒトK560-GFPに以下の点変異を生じさせた:K67E、K67R、K67G、Y77C、N117D、N117S、N117G、K166E、K281R、およびR367K。未編集のD. pealeii K554-GFPを生成するために、D. pealeii KINHの最初の554アミノ酸をD. pealeiiトランスクリプトームから決定した、
7
コドン最適化遺伝子ブロック(IDT)として合成し、pET17bにクローニングした。D. pealeii未編集のK554-GFPに以下の変異バリアントが生じた:OL-1:S75G、Y77C、N117G、K368R、K479R、K483R; SG-1:S75G、Y77C、N117D、K368R、K479R、K483G、E515G; SG-2:K368R, K479R, K483R. D. opalescensキネシン-1モータードメイン配列を上記のように決定し、D. opalescens K554-GFPをpET17bで作製した。D. opalescens未編集K554-GFPに以下の変異バリアントを生成した:Cold-1:S75G、Y77C、K368R、K483R;Cold-2:S75G、Y77C、N117D、K368R、K483R;Cold-3:K67R、Y77C、N117D、K368R、K479R、K483G、E515G.
タンパク質の精製
ダイニン・コンストラクト
タンパク質精製用のS. cerevisiaeの培養は、以前に記述したように、増殖、収穫、凍結、精製した。
42
酵母細胞はOD600が2-3になるように増殖させた。細胞は遠心分離により収穫し、水で一度洗浄した後、液体窒素に滴下して凍結した。液体窒素で凍結した酵母細胞ペレットを、冷やしたコーヒーグラインダーで粉砕し、ダイニン溶解バッファー(DLB:最終濃度30mM HEPES [pH7. 4]、50mM酢酸カリウム、2mM酢酸マグネシウム、1mM EGTA、10%グリセロール、1mM DTT)を補充し、0.1mM Mg-ATP, 0.5mM Pefabloc, 0.05% TritonおよびcOmplete EDTAフリープロテアーゼ阻害カクテルタブレット(Roche))。ライゼートを264,900×g、4℃で1時間遠心分離することにより清澄化した。清澄化した上清をIgGセファロースビーズ(GE Healthcare Life Sciences)と4℃で1.5時間インキュベートした。ビーズをグラビティフローカラムに移し、250 mM塩化カリウム、0.1 mM Mg-ATP、0.5 mM Pefablocおよび0.1% Tritonを補充したDLBバッファーで洗浄し、TEVバッファ-(10 mM Tris-HCl [pH 8.0], 150 mM塩化カリウム、10%グリセロール、1 mM DTT, 0.1 mM Mg-ATP および 0.5 mM Pefabloc)で処理しました。構築物をカラム内で5μM Halo-TMR(Promega)で室温で10分間標識し、未結合の色素を4℃のTEVバッファーで洗浄した。ダイニンは、0.15 mg/mL TEVプロテアーゼと16℃で1時間インキュベートすることによりIgGビーズから切断された。切断されたタンパク質は、Ultra-free-MC VVフィルター(EMD Millipore)を用いて卓上遠心機で4℃の遠心分離によりろ過し、液体窒素で瞬間冷凍して-80℃に保存した。
キネシン構築物
ヒトK560-GFPおよびイカK554-GFPコンストラクトは、BL21-CodonPlus(DE3)-RIPL(Agilent)大腸菌から精製した。培養物をOD 0.6-0.8まで増殖させ、0.75mM IPTGで18℃、16時間発現を誘導した。培養物をペレット化し、PBSで洗浄した後、液体窒素で凍結した。凍結したペレットを、0.5 mM Mg-ATP、10 mM β-メルカプトエタノール、1 mM Pefabloc、cOmplete EDTA-free protease inhibitor cocktail tablet (Roche) および 50 mg/mL lysozymeを添加した溶解バッファ(50 mM Tris [pH 7.5], 250 mM chloride sodium, 1 mM chloride, 20 mM imidazole [pH 7.4] )に再懸濁し、30分間氷上においた。氷上で5秒のパルスと20秒の休息を30サイクル、50%の出力で超音波処理することにより、培養物を溶解した。溶解液を92,600×g、4℃、30分間の遠心分離により清澄化した。清澄化した上清を、Ni-NTAアガロースビーズ(Qiagen)と4℃で1時間インキュベートした。ビーズをグラビティフローカラムに移し、0.5 mM Mg-ATP、10 mM β-メルカプトエタノール、1 mM Pefablocを添加した溶解バッファで洗浄し、0.1 mM Mg-ATP、10 mM β-mercaptoethanol を添加した溶解バッファ(50 mM Tris [pH7.5], 250 mM塩化ナトリウム、1 mM塩化マグネシウム、250 mM imidazole [pH 7.4]) で溶解させる。その後、溶出液をPD-10カラム(GEヘルスケア)で脱塩し、0.1 mM Mg-ATPと0.1 mM DTTを加えたBRB80(80 mM K + PIPES[pH 6.8], 2 mM塩化マグネシウム、1 mM EGTA)にバッファ交換をした。スクロースを最終濃度10%になるように溶出液に添加し、溶出液を液体窒素で瞬間凍結して-80℃で保存した。
TIRF顕微鏡観察
100×1.49N.A.の油浸対物レンズ(Nikon, Plano Apo)を装着した倒立顕微鏡(Nikon, Ti-E Eclipse)で撮像を行った。ステージのxy位置は、Pro-Scanリニアモーターステージコントローラー(Prior社製)で制御した。顕微鏡には、405nm、488nm、561nm、640nmのレーザーラインを持つMLC400Bレーザー発射(Agilent)が装備されていた。励起および発光経路は、適切なシングルバンドパスフィルタキューブ(Chroma)を用いてフィルタリングされた。発光信号は、電子増倍型CCDカメラ(Andor Technology, iXon Ultra 888)で検出された。照明と画像取得は、NIS Elements Advanced Researchソフトウェア(Nikon)で制御した。温度制御された運動性アッセイは、リンカムPE100-NIF倒立ペルチェステージとT96システムコントローラを用いて実施した。フローチャンバーのスライドは、カスタム銅メッキアルミニウム製フィッティングで覆われ、フローチャンバーの経験温度は、タイプK熱電対センサープローブを使用して監視された。
運動性アッセイ
1分子運動アッセイは、上記のTIRF顕微鏡のセットアップを使用して、両面テープで作られたフローチャンバーで行われた。フローチャンバーの組み立てには1-1/2号カバースリップ(Corning)を用い、非特異的なタンパク質結合を減らすために100%エタノール中で10分間超音波処理した。ビオチン-チューブリン約10%とアレクサ488-チューブリンまたはアレクサ405-チューブリン約10%を含むタキソール安定化微小管は、前述のようにビオチン-BSAとストレプトアビジンを介してフローチャンバーに付着した。
74
各フレームについて、キネシン-GFPとTMR-ダイニンをそれぞれ488nmレーザーと561nmレーザーで100ms露光した。
運動性アッセイでは、2.5-5 pMのダイニンまたは50-500 pMのキネシンの最終濃度を、タキソールで安定化した微小管で予め組み立てたフローチャンバーに流した。使用したモーター濃度は、キモグラフ1枚あたりの実行回数を最適化するために経験的に決定した。最終的なイメージングバッファーは、DLB(30mM HEPES [pH7.4]、2mM 酢酸マグネシウム、1mM EGTA、10%グリセロール、50mM 酢酸カリウム)、20μM タキソール、1mM Mg-ATP、1 mg/mL ケースイン、1mM DTT、 71. 5 mM β-メルカプトエタノール、および酸素スカベンジャーシステム(0.4%グルコース、45 μg/mL グルコースカタラーゼ、および 1.15 mg/mL グルコースオキシダーゼ)である。微小管は、まず1フレームのスナップショットを撮ることでイメージ化された。ダイニンは500msごとに5分間、キネシンは200msごとに1分間撮像された。最後に微小管を再度スナップショットで撮像し、ステージのドリフトを確認し、ドリフトを示す画像は解析から除外した。ダイニンは20分以上、キネシンは10分以上撮像されなかった。25℃と8℃で行った運動性アッセイでは、撮像前にスライドをペルチェステージ上で1.5分間平衡化し、撮像の直前と直後に熱電対プローブを用いて温度をモニターした。
カイモグラフ解析
運動動画は、図S1に概説した解析ワークフローを使用して解析した。まず、ImageJのマクロを使用して、以前に説明したようにカイモグラフを作成した。
75
次に、Ilastik 1.3.3post3を用いてカイモグラフのピクセル分類を行った、
71
そして、ピクセル分類された画像をカスタムMATLABスクリプト(MATLAB R2021a Update 4)を用いて解析した。スケルトン化された画像から個々のランが解析され、速度とラン距離の測定値が決定された。4フレームより短いランは解析から除外された。プロセス走行は、速度が15nm/s以上の走行と定義された。運動速度は走行中に変化する可能性があるため、速度測定はセグメントの速度を反映する。セグメントはfindchangepts関数を用いて定義し、走行の平均と傾きの変化を検出した。各カイモグラフの着地率は、イベントの総数(運動性+非運動性)/微小管の長さμmとして計算した。統計解析については下記を参照。
D. pealeii組織からの編集部位の組み合わせの決定
星状神経節と視葉を溶解し、RNAeasy Plus抽出キットを用いてtotal RNAを抽出した。 cDNAはAccuscript High-fidelity first-strand cDNA synthesis kitを用いて作成した。キネシン-1モータードメインは、遺伝子特異的プライマー(FW:CCTACTTTTGTTTGCGCG RV:TCTGCAGCATTTCCACCTACA)を用いてcDNAからPCR増幅し、pCR-XL-2-TOPOベクターにクローニングした。個々の転写産物の編集部位の組み合わせを決定するために、個々のクローンを選択し、配列決定した。各データセットについて、3つのサンプルを処理し、各サンプルについて100クローンの配列を決定した。モータードメインのいずれかの部分について、不完全または低品質の配列決定が行われた配列は省略され、データは条件ごとにプールされた。統計解析については下記を参照。
D. opalescensの温度実験
D. opalescensの卵ケースは、カリフォルニア州サンディエゴのScripps Pier沖で採取した。水深の水温は12-13℃であった。卵嚢は12-13℃に保たれた海水タンクに移された。水槽は温度の安定性をモニターした。孵化したばかりの動物(生後24時間未満)を6℃、8℃、12℃、16℃、20℃の水槽に移し、これらの温度で24時間保持した後、動物を液体窒素で瞬間冷凍し、-80℃で保管した。
D. opalescensにおける編集レベルおよび編集部位の組み合わせの決定
キネシンのRNA抽出、cDNA合成、およびPCR増幅は、各温度から10匹の動物について、D. pealeiiについて上記と同じプライマーセットを用いて、上記と同様に行った。その後、PCR産物をリバースプライマーを用いて直接配列決定し、(Cピークハイト)/(C+Tピークハイト)で計算したピークハイト解析により、各再コード化部位における編集率を決定した。編集率解析には、高品質で完全な塩基配列データのみを使用した。
D. opalescensにおける編集部位の組み合わせは、D. pealeiiについて上記したように、6℃の水にさらされた3匹の動物、および20℃の水にさらされた3匹の動物について決定した。
定量化および統計解析
運動性アッセイの統計解析
すべての統計解析は、Prism9(GraphPad)を用いて決定した。速度測定については、速度ヒストグラムをガウス分布に当てはめることにより、平均速度を求めた。平均値、平均値の標準誤差(SE)、平均値の95%信頼区間、適合度(R2)、および各適合の自由度(dF)は表S2に報告されており、p値はベストフィットの平均値を比較する両側t検定により算出された。ラン距離の測定では、平均減衰定数(tau)は、1累積頻度分布を1相の指数関数的減衰にフィットさせることによって決定された。タウ、タウの95%信頼区間、K(速度定数)、Kの標準誤差(SE)、適合度(R2)、および各適合の自由度(dF)を表S2に報告し、p値は速度定数Kのベストフィット値を比較する両側t検定によって計算した。すべての速度と走行距離データについて、nは少なくとも2つの独立したタンパク質準備からプールした測定回数である。パーセント処理能力測定については、p値は両側t検定により決定した。着地率測定では、p値はWelchの補正を加えた両側t検定によって決定された。すべてのフィットとp値は表S2に表わされている。
コンビナトリアルエディットの統計解析
再コード化部位の相関分析は、カスタムMATLABスクリプトを用いて以下のように実施した: 各リコーディングサイトのペアの観察されたインスタンスは、転写物の配列数が与えられた各ペアのすべての可能な結果に対して比較された。各対比較のp値は、転写物の配列が互いに独立しており、転写物に沿った各部位での再コード化が観察された頻度で独立して起こるという帰無仮説を仮定して、より稀なシナリオを観察する確率を計算することにより決定した。すべてのp値は表S2に表わされている。
6℃と20℃の間の部位ごとの編集レベルの統計解析
図3Cについては、有意性は順位を比較するマン・ホイットニー検定によって決定し、Benjamini and Yekutieliの補正FDR法(Desired FDR (Q) of 1.00%)によって誤発見率(FDR)を決定して多重比較のために補正した。図S4Iについては、有意性はフィッシャーの正確検定によって決定した。すべてのp値は表S2に表されている。
データおよびコードの入手可能性
本論文で報告されたすべてのデータは、要求に応じてリードコンタクトによって共有される。
すべてのオリジナルコードはGithubに寄託され、出版日現在、一般に入手可能である。DOIは主要リソース表に記載されています。
本論文で報告されたデータを再分析するために必要な追加情報は、要求に応じてリードコンタクトから入手できます。
謝辞
ニューヨーク大学クーラント数理科学研究所のAaditya Rangan氏にはコンビナトリアルRNA編集のペアワイズ相関分析を、Donovan Ventimiglia氏にはキモグラフ解析ソフトウェアの設計とコーディングを、UC San DiegoのScripps Institute for OceanographyのPhil Zerofski氏にはD. opalescens卵ケースの収集を、Lilly McCormickにはタンクの設置を、Marine Biological LaboratoryのJoshua RosenthalにはD. pealeii組織サンプルを提供いただき感謝申し上げます。Andres Leschziner、Donovan Ventimiglia、Reck-Peterson研究室のメンバーには、原稿に対するフィードバックをいただいたことに感謝する。K.J.R.は生命科学研究財団のHoward Hughes Medical Institute Awardee、S.L.R.-P.はHoward Hughes Medical InstituteとNational Institutes of Health grant R35 GM141825から資金提供を受けています。
著者の貢献
K.J.R.とS.L.R.-P.は、本研究を構想した。K.J.R.は実験を行った。K.J.R.とS.L.R.-P.は原稿を執筆した。
利害関係の宣言
著者らは、競合する利害関係がないことを宣言する。
インクルージョンと多様性
私たちは、包括的で多様な、そして公平な研究の実施を支持します。
補足情報
.pdfをダウンロードする (.08 MB)
pdfファイルのヘルプ
資料S1. 表S1、表S5、表S6
.xlsx のダウンロード (.05 MB)
xlsxファイルに関するヘルプ
表S2. すべての図に関連する、フィットと統計
ダウンロード .xlsx (.04 MB)
xlsxファイルのヘルプ
表S3. キネシン1重鎖の頭足類再コード化部位、図5関連
ダウンロード .xlsx (.05 MB)
xlsxファイルのヘルプ
表S4. 図5に関連する細胞質ダイニン1重鎖1の頭足類再コード化部位
参考文献
Nishikura K.
ADARによるコーディングRNAとノンコーディングRNAのA-to-I編集。
Nat. Rev. Mol. Cell Biol. 2016; 17: 83-96https://doi.org/10.1038/nrm.2015.4
記事で見る
スコープス(552)
PubMed
クロスフィルム
グーグル奨学生
ガベイ O.
ショシャンY.
コペルE.
ベン・ツヴィU.
マン・T.D.
ブレスラー N.
コーエン=フルトハイムR.
シャファーA.A.
ロート S.H.
ツァーZ.
他。
ヒト組織におけるアデノシンからイノシンへのRNAの再コード化の風景。
Nat. Commun. 2022; 13: 1184https://doi.org/10.1038/s41467-022-28841-4
記事で見る
スコープス(17)
パブコメ
クロスフィルム
グーグル奨学生
アイゼンベルグ E.
RNA編集によるプロテオームの多様化.
Methods Mol. Biol. 2021; 2181: 229-251https://doi.org/10.1007/978-1-0716-0787-9_14
記事で見る
スコープス(11)
クロスフィルム
グーグルシュラー
ローゼンタール J.J.C.
アイゼンバーグ E.
RNA編集による頭足類の神経プロテオームの広範な再コード化。
Annu. Rev. Anim. Biosci. 2023; 11: 57-75https://doi.org/10.1146/annurev-animal-060322-114534
記事で見る
スコープス(1)
クロスフィルム
Google Scholar
リスコビッチ・ブラウアー N.
アロンS.
ポラス・H.T.
エルシュタインB.
アンガーR.
ジブ T.
アドモン A.
レバノン E.Y.
ローゼンタール J.J.C.
アイゼンバーグ E.
頭足類におけるトランスクリプトームの可塑性とゲノムの進化のトレードオフ。
Cell. 2017; 169: 191-202.e11https://doi.org/10.1016/j.cell.2017.03.025
記事で見る
スコープス(181)
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
アロンS.
ギャレットS.C.
レバノン E.Y.
オルソンS.
グレイブリーB.R.
ローゼンタールJ.J.C.
アイゼンバーグ E.
イカの神経系における転写物の大部分は、A-to-I RNA編集によって広範囲に再コード化されている。
Elife. 2015; 4: e05198https://doi.org/10.7554/eLife.05198
記事で見る
スコープス(89)
PubMed
クロスフィルム
グーグル奨学生
ショシャン Y.
リスコビッチ・ブラウアーN.
ローゼンタール J.J.C.
アイゼンベルグ E.
頭足類における非同義A-to-I RNA編集によるプロテオームの適応的多様化。
Mol. Biol. Evol. 2021; 38: 3775-3788https://doi.org/10.1093/molbev/msab154
記事で見る
スコープス(7)
クロスフィルム
グーグルシュラー
アルバーチン C.B.
メディナ-ルイスS.
ミトロスT.
シュミッドバウルH.
サンチェスG.
ワン・Z.Y.
グリムウッド J.
ローゼンタールJ.J.C.
ラグスデールC.W.
シマコフ O.
ロクサーD.S.
頭足類の進化を駆動するゲノムとトランスクリプトームメカニズム。
Nat. Commun. 2022; 13: 2427https://doi.org/10.1038/s41467-022-29748-w
記事で見る
スコープス (13)
PubMed
クロスフィルム
グーグル奨学生
モルドバンM.
チェルヴォンツェワZ.
バジキンG.
ゲルファンドM.S.
軟体頭足類におけるmRNA編集部位の適応進化。
PeerJ. 2020; 8: e10456https://doi.org/10.7717/peerj.10456
記事で見る
スコープス(6)
クロスフィルム
グーグル・スカラー
ジアンD.
Zhang J.
コロイドにおける非同義A-to-I RNA編集の優位性は非適応的である。
Nat. Commun. 2019; 10: 5411https://doi.org/10.1038/s41467-019-13275-2
記事で見る
スコープス(22)
パブコメ
クロスフィルム
グーグル奨学生
ギャレット S.
ローゼンタール J.J.C.
極地タコのK+チャネルの温度適応をRNA編集が支える。
Science. 2012; 335: 848-851https://doi.org/10.1126/science.1212795
記事で見る
スコープス (160)
PubMed
クロスフィルム
グーグル奨学生
コリーナ C.
パラビチーニJ.P.
スリックマールD.
ホルムグレンM.
ローゼンタール J.J.C.
RNA編集によるNa+/K+ ATPase輸送速度の制御。
PLoS Biol. 2010; 8: e1000540https://doi.org/10.1371/journal.pbio.1000540
記事で見る
スコープス (21)
PubMed
クロスフィルム
グーグル奨学生
ローゼンタール J.J.C.
ベザニラ F.
イカ遅延整流K+チャネルのmRNAの広範な編集はサブユニットの4量体化を制御する。
Neuron. 2002; 34: 743-757https://doi.org/10.1016/s0896-6273(02)00701-8
記事で見る
スコープス (0)
PubMed
要旨
全文
全文PDF
Google Scholar
パットンD.E.
シルバ T.
ベザニラ F.
RNA編集により、機能特性が変化したイカKv2 K+チャネルをコードする多様な転写産物が生成される。
Neuron. 1997; 19: 711-722https://doi.org/10.1016/s0896-6273(00)80383-9
記事で見る
スコープス (0)
PubMed
要旨
全文
全文PDF
Google Scholar
ホルムグレン M.
ローゼンタール J.J.C.
RNA編集によるイオンチャネルとトランスポーターの機能制御.
Curr. イシュー Mol. Biol. 2015; 17: 23-36https://doi.org/10.21775/cimb.017.023
記事で見る
Crossref
グーグル・スカラー
ヴァレシロ=ヴィエホ I.C.
リスコビッチ=ブラウアー N.
ディアス・キロスJ.F.(Diaz Quiroz J.F.
モンティエル-ゴンザレスM.F.(Montiel-Gonzalez M.F.
ネメス S.E.
ランガン K.J.
レヴィンソン S.R.
アイゼンバーグ E.
ローゼンタール J.J.C.
神経細胞内の遺伝情報の空間的に制御された編集。
Nucleic Acids Res. 2020; 48: 3999-4012https://doi.org/10.1093/nar/gkaa172
記事で見る
スコープス (0)
PubMed
クロスフィルム
グーグル奨学生
ローゼンタール J.J.C.
可塑性におけるRNA編集の新たな役割。
J. Exp. Biol. 2015; 218: 1812-1821https://doi.org/10.1242/jeb.119065
記事で見る
スコープス(49)
PubMed
クロスレフ
グーグル奨学生
ベール R.D.
船津 孝
ピアスD.W.
ロンバーグL.
原田 祐子
柳田 毅
微小管に沿って移動するキネシン1分子の直接観察。
Nature. 1996; 380: 451-453https://doi.org/10.1038/380451a0
記事で見る
スコープス (619)
PubMed
クロスフィルム
グーグル奨学生
ゼイドバーグL.
Doryteuthis opalescens, Opalescent Inshore Squid.
in: Rosa R. O'Dor R. Pierce G. Advances in Squid Biology, Ecology and Fisheries. Part I - Myopsid Squids. ノヴァ・サイエンス・パブリッシャーズ・インク, 2013: 159-204
記事で見る
Google Scholar
ジェイコブソンL.D.
必須魚類生息地のソースドキュメント。Longfin inshore squid, Loligo pealeii, life history and habitat characteristics.
in: NOAA Technical Memorandum NMFS-NE. 193. 2005
記事で見る
Google Scholar
川口和彦
石渡 聡
キネシン1分子の力、速度、処理速度の温度依存性。
Biochem. Biophys. Res. Commun. 2000; 272: 895-899https://doi.org/10.1006/bbrc.2000.2856
記事で見る
スコープス (102)
パブコメ
クロスフィルム
グーグル奨学生
ドバル F.
千葉 圭一
マッケニーR.J.
オリ-マッケニーK.M.
バーシニンM.D.
キネシンの温度依存性活性は調節可能である。
Biochem. バイオフィジックス(Biophys. Res. Commun. 2020; 528: 528-530https://doi.org/10.1016/j.bbrc.2020.05.157
記事で見る
スコープス(2)
クロスフィルム
グーグル奨学生
ホン・W.
タクシャクA.
オスンバイヨO.
クンワーA.
ヴェルシーニンM.
細胞質ダイニンとキネシン-1モーターによる微小管輸送に及ぼす温度の影響.
バイオフィジカル(Biophys. J. 2016; 111: 1287-1294https://doi.org/10.1016/j.bpj.2016.08.006
記事で見る
スコープス(17)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
シッケレA.
フランクールP.
レイボーV.
気候変動シナリオ下におけるヨーロッパの頭足類の分布。
Sci. Rep. 2021; 11: 3930https://doi.org/10.1038/s41598-021-83457-w
記事で見る
スコープ (11)
クロスフィルム
グーグルシュラー
バーフォード B.P.
ワイルドL.A.
シュワルツ・R.
チェノウェス E.M.
Sreenivasan A.
エラヒR.
キャリー N.
ホービング H.-J.T.
ストレーリーJ.M.
デニー M.W.
海水温度と溶存酸素の短期変動がもたらす人口動態と生態系への影響を明らかにした海洋性外温生物の急激な生息域拡大。
Am. Nat. 2022; 199: 523-550https://doi.org/10.1086/718575
記事で見る
スコープス(5)
Crossref
Google Scholar
ザイドバーグ L.D.
アイザックG.
ウィドマーC.L.
ノイマイスターH.
ギリーW.F.
カリフォルニア産マーケットイカDoryteuthis (Loligo) opalescensの卵カプセルの孵化率と孵化期間:実験室での操作から得られた知見。
Mar. Ecol. 2011; 32: 468-479https://doi.org/10.1111/j.1439-0485.2011.00445.x
記事で見る
スコープス (25)
クロスフィルム
Google Scholar
カーター A.P.
ディアマントA.G.
ウルナヴィシウス L.
ダイニンとダイナクチンはどのように荷物を運ぶのか:構造的な観点から。
Curr. Opin. Struct. Biol. 2016; 37: 62-70https://doi.org/10.1016/j.sbi.2015.12.003
記事で見る
スコープス (83)
パブコメ
クロスレフ
グーグル奨学生
バーバ G.
ジョンソンG.T.
シュローダーC.M.
ベールR.D.
ダイニンはどのようにして微小管に沿って移動するのか?
Trends Biochem. Sci. 2016; 41: 94-105https://doi.org/10.1016/j.tibs.2015.11.004
記事で見る
スコープス (97)
PubMed
アブストラクト
全文
全文PDF
グーグル・スカラー
ハンコックW.O.
キネシン-1のケモメカニカルサイクル: コンセンサスへの歩み寄り。
バイオフィジカル(Biophys. J. 2016; 110: 1216-1225https://doi.org/10.1016/j.bpj.2016.02.025
記事で見る
スコープス(58)
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
今 毅
大山 毅
下紺 亮
イマムラK.
嶋 毅
須藤 圭一
栗栖 悟
ダイニン・モータードメインの2.8Å結晶構造。
Nature. 2012; 484: 345-350https://doi.org/10.1038/nature10955
記事で見る
スコープス (185)
PubMed
クロスフィルム
グーグル奨学生
シュミット H.
グリーヴ E.S.
カーター A.P.
ダイニンモータードメインの機能に関する3.3Åの結晶構造からの洞察
Nat. Struct. Mol. Biol. 2012; 19: 492-497https://doi.org/10.1038/nsmb.2272
記事で見る
スコープス (132)
パブコメ
クロスフィルム
グーグル奨学生
ロバーツ A.J.
マルコバB.
ウォーカーM.L.
サカキバラH.
沼田直樹
Kon T.
大倉 理
エドワーズ T.A.
ナイトP.J.
スートー・K.
他
ダイニンモーターにおけるリンカー・ドメインのATP駆動型リモデリング。
Structure. 2012; 20: 1670-1680https://doi.org/10.1016/j.str.2012.07.003
記事で見る
スコープス (71)
PubMed
概要
全文
全文PDF
Google Scholar
Zhang K.
フォスターH.E.
ロンデレA.
レイシーS.E.
バヒ・ブイソンN.
バード・A.W.
カーター A.P.
ヒト細胞質ダイニンの自己抑制と活性化の仕組みを低温電子顕微鏡で明らかにした。
Cell. 2017; 169: 1303-1314.e18https://doi.org/10.1016/j.cell.2017.05.025
記事で見る
スコープス(142)
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
カルF.J.
サブリンE.P.
ラウ R.
フレトリックR.J.(Fletterick R.J.
ベールR.D.
キネシンモータードメインの結晶構造から、ミオシンとの構造的な類似性が明らかになった。
Nature. 1996; 380: 550-555https://doi.org/10.1038/380550a0
記事で見る
スコープス (581)
PubMed
クロスフィルム
グーグル奨学生
ライス S.
リンA.W.
セーファーD.
ハートC.L.
ネイバーN.
キャラガー B.O.
カイン S.M.
ペチャトニコワ E.
ウィルソン=クバレク E.M.
ウィッタカーM.
他
運動性を駆動するキネシンモータータンパク質の構造変化。
Nature. 1999; 402: 778-784https://doi.org/10.1038/45483
記事で見る
スコープス (650)
PubMed
クロスフィルム
グーグル奨学生
カーン・H.Y.K.
ハックニーD.D.
コジエルスキ F.
キネシン-1モーターテール複合体の構造から、自己抑制のメカニズムが明らかになった。
Science. 2011; 333: 883-885https://doi.org/10.1126/science.1204824
記事で見る
スコープス (118)
PubMed
クロスフィルム
グーグル奨学生
ディートリッヒ・K.A.
シンデラーC.V.
ブリュワーP.D.
ダウニングK.H.
クレモC.R.
ライス S.E.
キネシン-1モータータンパク質は、その頭部と尾部の直接的な相互作用によって制御されている。
Proc. Natl. Acad. Sci. USA. 2008; 105: 8938-8943https://doi.org/10.1073/pnas.0803575105
記事で見る
スコープス (85)
PubMed
クロスフィルム
グーグル奨学生
ホワン W.
ラング M.J.
カープラス M.
キネシンの力発生はカバーネックバンドル形成に依存している。
Structure. 2008; 16: 62-71https://doi.org/10.1016/j.str.2007.11.008
記事で見る
スコープス (121)
PubMed
概要
全文
全文PDF
Google Scholar
ブダイティス B.G.
ジャリワラS.
ラオ L.
Yue Y.
セプトD.
ヴァーヘイ K.J.
ゲンネリッチ A.
キネシン3モーターKIF1Aの病原性変異は、アロステリックメカニズムにより力の発生と運動を低下させる。
J. Cell Biol. 2021; 220: e202004227https://doi.org/10.1083/jcb.202004227
記事で見る
スコープス (0)
PubMed
クロスフィルム
グーグル奨学生
ヴェールケG.
ルビーA.K.
ハートC.L.
Ly B.
ホムブーハーN.
ベールR.D.
キネシンモーターの微小管相互作用部位。
Cell. 1997; 90: 207-216https://doi.org/10.1016/S0092-8674(00)80329-3
記事で見る
スコープス (317)
PubMed
概要
全文
全文PDF
Google Scholar
ポワリエ K.
ルブランN.
ブロワL.
ティアンG.
サイユール Y.
ボシュロンC.
パリーニ E.
ヴァランス S.
ピエール B.S.
オジェM.
他
TUBG1、DYNC1H1、KIF5C、KIF2Aの変異は、皮質発達の奇形と小頭症を引き起こす。
Nat. Genet. 2013; 45: 639-647https://doi.org/10.1038/ng.2613
記事で見る
スコープス (321)
パブコメ
クロスフィルム
グーグル奨学生
レック・ピーターソン S.L.
イルディズA.
カーターA.P.
ゲンネリッチA.
チャン・N.
ヴェール R.D.
ダイニンのプロセス性とステップ動作の1分子解析。
Cell. 2006; 126: 335-348https://doi.org/10.1016/j.cell.2006.05.046
記事で見る
スコープス (488)
PubMed
概要
全文
全文PDF
グーグル奨学生
ホアン・H.T.
シュラガーM.A.
カーターA.P.
ブルック S.L.
神経疾患と関連するDYNC1H1変異は、ダイニン-ダイナクチン-カーゴアダプター複合体の処理能力を低下させる。
Proc. Natl. Acad. Sci. USA. 2017; 114: E1597-E1606https://doi.org/10.1073/pnas.1620141114
記事で見る
スコープス(65)
パブコメ
クロスフィルム
グーグル奨学生
マルゾー M.G.
グリスウォルドJ.M.
ラフ・K.M.
ブッフマイヤーR.E.
フィーズC.P.
マーカス S.M.
ダイニンパチーの分子基盤から、ダイニンの制御と機能障害に関する知見が得られた。
Elife. 2019; 8: e47246https://doi.org/10.7554/eLife.47246
記事で見る
スコープス(22)
Crossref
グーグル スカラー
ジェニングス S.
シェネヴェールM.
リュー・エル
モッタマルM.
ヴォイチク E.J.
Huckaba T.M.
遺伝性痙性対麻痺の原因であるキネシンスイッチI変異の特性評価
PLoS One. 2017; 12: e0180353https://doi.org/10.1371/journal.pone.0180353
記事で見る
スコープス(14)
パブコメ
クロスフィルム
グーグル奨学生
張 C.
グオ C.
ラッセルR.W.
クイン・C.M.
Li M.
ウィリアムズ J.C.
グロネンボーンA.M.
ポレノバ T.
キネシン-1モータードメインが微小管と結合したNMR構造から、ネックリンカーの配向が明らかになった。
Nat. Commun. 2022; 13: 6795https://doi.org/10.1038/s41467-022-34026-w
記事で見る
スコープス (0)
クロスフィルム
グーグル奨学生
グラント・B.J.
ゲオルゲD.M.
Zheng W.
アロンソM.
フーバーG.
ドゥルゴシュ M.
マキャモンJ.A.
クロスR.A.
キネシンの微小管への静電気による結合。
PLoS Biol. 2011; 9: e1001207https://doi.org/10.1371/journal.pbio.1001207
記事で見る
スコープス (53)
PubMed
クロスフィルム
グーグル奨学生
ゴイゼC.
ブクリスA.
ムンドウィラーE.
タラークセンC.
フォルラニS.
トゥータン A.
キャリエール N.
パキス V.
デピエンヌC.
ダーA.
et al.
常染色体優性遺伝性痙性対麻痺の合併症型はSPG10で頻発する。
Hum. Mutat. 2009; 30: e376-e385https://doi.org/10.1002/humu.20920
記事で見る
スコープス (101)
PubMed
クロスフィルム
グーグル奨学生
フィシェラ M.
ロ・ジュディーチェM.
ファルコ M.
ストルニオM.
アマタ S.
カラブレーゼ O.
ビゴーニ S.
カルゾラーリ E.
Neri M.
純粋遺伝性痙性対麻痺におけるキネシン重鎖(KIF5A)関与の証拠。
Neurology. 2004; 63: 1108-1110https://doi.org/10.1212/01.wnl.0000138731.60693.d2
記事で見る
PubMed
クロスフィルム
グーグル奨学生
ダッタ M.
ディールM.R.
オヌチッチJ.N.
ヤナ B.
キネシンの遺伝性痙性対麻痺疾患関連変異の構造的帰結。
Proc. Natl. Acad. Sci. USA. 2018; 115: E10822-E10829https://doi.org/10.1073/pnas.1810622115
記事で見る
スコープス(13)
クロスレフ
グーグル スカラー
エビング B.
マン・K.
スタロスタA.
Jaud J.
シェールスL.
シュール・R.
Woehlke G.
KIF5Aキネシンの痙性対麻痺変異が輸送活性に及ぼす影響。
Hum. Mol. Genet. 2008; 17: 1245-1252https://doi.org/10.1093/hmg/ddn014
記事で見る
スコープス (106)
PubMed
クロスフィルム
グーグル奨学生
ラオ・L.
ベルガーF.
ニコラスM.P.
ゲンネリッチ A.
細胞質ダイニンの張力検知の分子機構。
Nat. Commun. 2019; 10: 3332https://doi.org/10.1038/s41467-019-11231-8
記事で見る
スコープス(30)
パブコメ
クロスフィルム
グーグル奨学生
レッドワイン・W.B.
エルナンデス-ロペスR.
ゾウ・S.
ホアン・J.
レック-ピーターソンS.L.
レッシュジナー A.E.
ダイニンによる微小管の結合と解放の構造的基礎。
Science. 2012; 337: 1532-1536https://doi.org/10.1126/science.1224151
記事で見る
スコープス (125)
PubMed
クロスフィルム
グーグル奨学生
レイシー S.E.
He S.
シェレスS.H.
カーター A.P.
ダイニン微小管結合ドメインの低温電子顕微鏡による軸索ダイニンの微小管歪曲機構の解明
Elife. 2019; 8: e47145https://doi.org/10.7554/eLife.47145
記事で見る
スコープス(33)
パブコメ
クロスレフ
グーグル奨学生
ヤブロノビッチA.L.
デンP.
ジェイコブソンD.
リー・J.B.
A-to-I RNA編集の進化と適応。
PLoS Genet. 2017; 13: e1007064https://doi.org/10.1371/journal.pgen.1007064
記事で見る
スコープス(56)
クロスフィルム
グーグル スカラー
ソメロ G.N.
ゴルディロックス・プリンシプル: 海中の生物的ストレスに対する生化学的適応に関する統一的な視点。
Ann. Rev. Mar. Sci. 2022; 14: 1-23https://doi.org/10.1146/annurev-marine-022521-102228
記事で見る
スコープス(6)
クロスフィルム
Google Scholar
クラーク M.S.
ワーランド M.R.
昆虫はいかにして寒さをしのぐか:分子メカニズム-レビュー。
J. Comp. Physiol. B. 2008; 178: 917-933https://doi.org/10.1007/s00360-008-0286-4
記事で見る
スコープス (202)
PubMed
クロスフィルム
グーグル奨学生
リーダーL.E.
サヴァY.A.
レイナ・M.A.(Reyna M.A.
Chang Y.-J.
ドースキー J.S.
Rezaei A.
リーナンR.A.
ショウジョウバエにおける温度に対するRNA編集の動的応答。
BMC Biol. 2015; 13: 1https://doi.org/10.1186/s12915-014-0111-3
記事で見る
スコープス(50)
PubMed
クロスフィルム
グーグル奨学生
ブフメンスキー I.
バルトークO.
アシュワル=フルスR.
パンデイ V.
ポラス・H.T.
レバノン E.Y.
カデナー S.
ショウジョウバエの温度適応を支える動的な超編集。
PLoS Genet. 2017; 13: e1006931https://doi.org/10.1371/journal.pgen.1006931
記事で見る
スコープス(34)
パブコメ
クロスフィルム
グーグル奨学生
リーモンディ・K.A.
ギレンA.E.
ホワイトE.A.
ボグレンL.K.
ヘッセルバースJ.R.
マーティン S.L.
冬眠中の異温性哺乳類の脳における動的な温度感受性A-to-I RNA編集。
RNA. 2018; 24: 1481-1495https://doi.org/10.1261/rna.066522.118
記事で見る
スコープス(18)
PubMed
クロスフィルム
グーグル奨学生
Duan Y.
ドウ S.
ルオS.
Zhang H.
Lu J.
ショウジョウバエにおけるAtoI RNA編集の適応性。
PLoS Genet. 2017; 13: e1006648https://doi.org/10.1371/journal.pgen.1006648
記事で見る
スコープス(39)
PubMed
クロスフィルム
グーグル奨学生
バーンズ C.M.
チュウ・ヒ
ルエター S.M.
ハッチンソンL.K.
カントン H.
サンダース・ブッシュ E.
エメソンR.B.
RNA編集によるセロトニン2C受容体G蛋白質結合の制御。
Nature. 1997; 387: 303-308https://doi.org/10.1038/387303a0
記事で見る
スコープス (860)
PubMed
クロスフィルム
グーグル奨学生
ニスウェンダーC.M.
コープランドS.C.
ヘリック・デイビスK.
エメソンR.B.
サンダース=ブッシュ E.
ヒトセロトニン5-ヒドロキシトリプタミン2C受容体のRNA編集は、定常的な活性を沈黙させる。
J. Biol. Chem. 1999; 274: 9472-9478https://doi.org/10.1074/jbc.274.14.9472
記事で見る
スコープス (298)
PubMed
概要
全文
全文PDF
グーグル奨学生
アッバス A.I.
アーバンD.J.
ジェンセンN.H.
ファレル M.S.
クルーゼ・W.K.
ミエツコウスキー P.
ワン・Z.
Roth B.L.
新規超高速シーケンサーによるセロトニン受容体mRNA編集頻度の評価。
Nucleic Acids Res. 2010; 38: e118https://doi.org/10.1093/nar/gkq107
記事で見る
スコープス (31)
PubMed
クロスフィルム
グーグル奨学生
ガッパー R.H.
フェイ J.F.
Roth B.L.
5HT2Cセロトニン受容体のRNA編集による構成的活性の制御に関する分子的洞察。
セル・レップ 2022; 40: 111211https://doi.org/10.1016/j.celrep.2022.111211
記事で見る
スコープス (4)
要旨
全文
全文PDF
グーグル奨学生
ニスウェンダー C.M.
ヘリック・デイビス K.
ディルリーG.E.
メルツァーH.Y.
オーバーホルサーJ.C.
ストックマイヤーC.A.
エメソンR.B.
サンダース・ブッシュ E.
ヒトセロトニン5-HT2CレセプターのRNA編集: 自殺における変化とセロトニン系薬物療法への示唆.
Neuropsychopharmacology. 2001; 24: 478-491https://doi.org/10.1016/S0893-133X(00)00223-2
論文で見る
スコープス (215)
PubMed
クロスフィルム
グーグル奨学生
ウィーラー E.C.
ウォッシュバーンM.C.
メジャーF.
ラッシュ D.B.
ハンドリーH.A.
線虫mRNAの非コード領域は、選択的なアデノシンからイノシンへの脱アミノ化を受け、転写物あたり少数の編集部位を含んでいます。
RNA Biol. 2015; 12: 162-174https://doi.org/10.1080/15476286.2015.1017220
記事で見る
スコープ(9)
Crossref
グーグルシュラー
イングルビーL.
マロニーR.
ジェプソンJ.
ホーンR.
リーナンR.
シェーカーポタシウムチャネルにおけるRNA編集の制御と機能エピスタシス。
J. Gen. Physiol. 2009; 133: 17-27https://doi.org/10.1085/jgp.200810133
記事で見る
スコープス (31)
PubMed
クロスフィルム
グーグル奨学生
グエン・T.A.
ヘング J.W.J.
カエサプサックP.
コックE.P.L.
スタノジェヴィッチD.
リュウ H.
カルディラ A.
プラディティヤA.
イー・ズー
リン・M.
et al.
ナノポアネイティブRNAシーケンスによるA-to-I編集部位の直接同定。
Nat. Methods. 2022; 19: 833-844https://doi.org/10.1038/s41592-022-01513-3
記事で見る
スコープス (11)
PubMed
クロスフィルム
グーグル奨学生
ウェンガー A.M.
ペルーソP.
ローウェル W.J.
チャン P.-C.
ホール R.J.
コンセプシオンG.T.
エブラー J.
ファングタンマサンA.
コレスニコフA.
オルソンN.D.
ら。
正確な円形コンセンサスロングリードシーケンスにより、ヒトゲノムのバリアント検出とアセンブリーが改善された。
Nat. Biotechnol. 2019; 37: 1155-1162https://doi.org/10.1038/s41587-019-0217-9
記事で見る
スコープス(545)
パブコメ
クロスレフ
グーグル奨学生
ベルク S.
クトラD.
クローガーT.
シュトレーレC.N.
カウスラーB.X.
ハウボルドC.
シーグ M.
アレス J.
バイヤー T.
ルディM.
他
ilastik:(バイオ)画像解析のための対話型機械学習。
Nat. Methods. 2019; 16: 1226-1232https://doi.org/10.1038/s41592-019-0582-9
記事で見る
スコープス(898)
パブコメ
クロスレフ
グーグル奨学生
シンデリン J.
アルガンダ-カレラスI.
フリーズE.
ケイニッヒV.
ロンゲアM.
ピエツシュ T.
プライビッシュ S.
ルーデン C.
ザールフェルト S.
シュミッドB.
他
Fiji:生物学的画像解析のためのオープンソースプラットフォーム。
Nat. Methods. 2012; 9: 676-682https://doi.org/10.1038/nmeth.2019
記事で見る
スコープス (32123)
パブコメ
クロスフィルム
グーグル奨学生
ノトレダームC.
ヒギンズD.G.
ヘリンガ J.
T-coffee:高速かつ正確な多重配列アライメントのための新規手法 1 1Edited by.
J. Mol. Biol. 2000; 302: 205-217https://doi.org/10.1006/jmbi.2000.4042
記事で見る
スコープス (5517)
PubMed
クロスフィルム
グーグル奨学生
ホァン J.
ロバーツ A.J.
レッシュジナーA.E.
レック・ピーターソン S.L.
Lis1はダイニンモーターのATPaseドメインと微小管結合ドメインの間の "クラッチ "として機能する。
Cell. 2012; 150: 975-986https://doi.org/10.1016/j.cell.2012.07.022
記事で見る
スコープス (161)
PubMed
概要
全文
全文PDF
グーグル奨学生
ロバーツ A.J.
グッドマンB.S.
レック・ピーターソン S.L.
キネシンによる微小管プラス端へのダイニンの輸送の再構成。
Elife. 2014; 3: e02641https://doi.org/10.7554/eLife.02641
記事で見る
スコープス (0)
PubMed
クロスフィルム
グーグル奨学生
バーバ G.
チェン・エイチシー(Cheng H.-C.
チャン・N.
モーラー A.
リャオ M.
スピアJ.A.
チェン Y.
Vale R.D.
ダイニンモータードメインにおけるアロステリックコミュニケーション。
Cell. 2014; 159: 857-868https://doi.org/10.1016/j.cell.2014.10.018
記事で見る
スコープス (66)
PubMed
概要
全文
全文PDF
グーグル奨学生
マルゾー M.G.
グリスウォルドJ.M.
マーカス S.M.
Pac1/LIS1はダイニンの非抑制構造を安定化させ、その局在と活性を調整する。
Nat. Cell Biol. 2020; 22: 559-569https://doi.org/10.1038/s41556-020-0492-1
記事で見る
スコープス (30)
PubMed
クロスフィルム
グーグル奨学生
記事情報
出版履歴
掲載されました: 2023年6月8日
受理された: 2023年4月24日
改訂版受理 2023年3月5日
受理された: 2022年10月10日
識別情報
DOI: https://doi.org/10.1016/j.cell.2023.04.032
著作権について
© 2023 The Author(s). 発行:エルゼビア・インク
ユーザーライセンス
クリエイティブ・コモンズ 表示 (CC BY 4.0) |.
再利用の方法
サイエンスダイレクト
ScienceDirectでこの論文にアクセスする
図版
図解要旨
図1微小管モータータンパク質は、頭足類の再コード化の機能を探索するための良いモデルである
図S1自動キモグラフ解析とハンドトラッキングによるキモグラフ解析の比較(図2、4、6関連
図2イカキネシンの組織特異的な再コード化により、機能的に異なるモーターが生成される
図S2D. pealeiiにおけるキネシンモータードメインの組織特異的な再コード化、図2に関連する。
図S3図3に関連するD. opalescensのキネシンモータードメインにおける再コード化部位の同定
図S4寒冷地特異的なキネシンの変異体および置換体の頻度と運動性、図4との関係
図3イカのキネシン転写物は海水温に応答して異なる形で再コード化される
図4寒冷地特異的なイカのキネシン変異体は寒冷地での運動性が向上していることがわかる
図5頭足類のコーディング部位はダイニンとキネシンの保存残基で起こる
図6コーディング部位の置換は、ヒトのキネシンと酵母のダイニンの運動性を調整する
図S5図6に関連するヒトキネシン変異体の運動性
図S6図6に関連する酵母ダイニンの変異体の運動性
リンク記事
タコの温度依存性RNA編集が神経プロテオームを広範に再編成する
Birk et al.
セル2023年06月08日
イン・ブリーフ
全文
PDF
関連記事
本サイトのコンテンツは、あらゆる分野の医療従事者や研究者を対象としています。
研究ジャーナル
細胞
癌細胞
細胞化学生物学
細胞ゲノミクス
細胞宿主と微生物
細胞メタボリズム
セルレポート
セルレポートメディスン
セルレポートメソッド
セルレポート 物理科学
セルレポート サステイナビリティ
細胞幹細胞
細胞システム
化学
化学触媒
カレントバイオロジー
発生細胞
デバイス
ヘリオン
イミュニティ
アイサイエンス
ジュール
物質
医学
分子細胞
ニューロン
一つの地球
パターン
STAR プロトコル
構造
トレンドレビュー誌
生物化学
バイオテクノロジー
癌
細胞生物学
化学
認知科学
エコロジー&エボリューション
内分泌学・代謝学
遺伝学
免疫学
微生物学
分子医学
神経科学
寄生虫学
薬理学
植物科学
パートナージャーナル
AJHG
生物物理学雑誌
生物物理学レポート
HGGアドバンス
モレキュラープラント
分子療法ファミリー
ネクサス
植物通信
幹細胞レポート
イノベーション
コレクション
ベスト・オブ・セルプレス
セルプレスレビュー
セルプレスセレクション
コンソーシアムハブ
Nucleus Collections
スナップショット・アーカイブ
ジャーナルを越えて
Cellキャリアネットワーク
セルメンター
細胞シンポジューム
ラボリンク
ウェビナー
記事を進化させる
コミュニティレビュー
Figure360
スニークピーク
STARメソッド
サイエンス・イン・ソサイエティ
セル画展
セルプレスポッドキャスト
セルプレスビデオ
ぬりえ・コミック
リサーチアーク
コネクト
セルプレスについて
採用情報
お問い合わせ
ヘルプ&サポート
ニュースルーム
出版物のお知らせ
アクセス
購読する
今すぐ読む
図書館に薦める
INFORMATION
広告主様向け
採用担当者様へ
図書館員の方へ
ご利用条件
個人情報保護方針
アクセシビリティ
当社は、サービスの提供・向上およびコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を変更するには、本サイトのクッキー設定にアクセスしてください。
著作権 © 2023 Elsevier Inc.ただし、第三者が提供する一部のコンテンツを除く。
この記事が気に入ったらサポートをしてみませんか?
