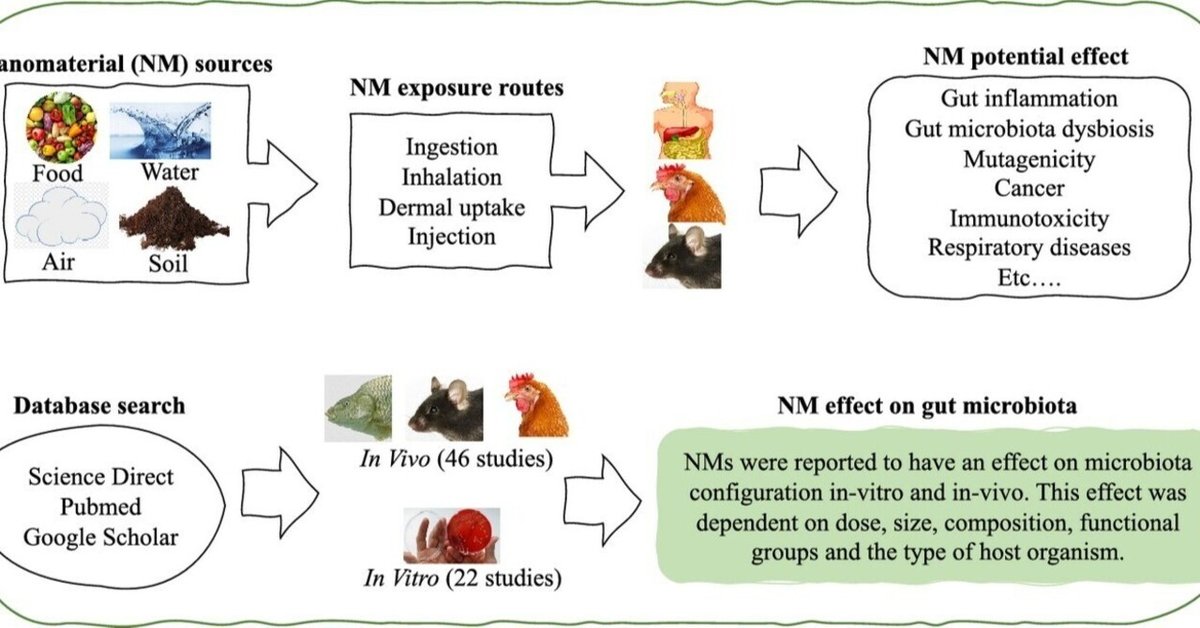
ナノマテリアルの腸内細菌叢への影響に関するシステマティックレビュー
微生物科学における最新の研究
第3巻、2022、100118
ナノマテリアルの腸内細菌叢への影響に関するシステマティックレビュー
著者リンク オーバーレイパネルWUtembeabAWKamng'onadを開く
https://doi.org/10.1016/j.crmicr.2022.100118
権利と内容を取得する
クリエイティブ・コモンズ・ライセンスに基づくオープンアクセス
ハイライト
ナノ材料は、in vivoおよびin vitroの両方で腸内細菌叢(GM)に影響を与えることが示されている。
その影響は、サイズ、投与量、投与期間、機能群に依存することが示されている。
一般に、より多くの研究が、GMに対するナノマテリアルの用量依存的な悪影響を示しているようである。
NMs の特性評価、投与、試験系(in vitro および in vivo)の標準化プロトコルが必要である。
概要
ナノマテリアル(NM)の中には、抗菌活性を有し、遺伝子組換え異常症を引き起こすものがあることが明らかにされている。ナノマテリアルは広く使用されているため、ナノマテリアルのGMへの影響を系統的に評価することが必要である。このシステマティックレビューでは、Science-Direct、Pubmed、Google scholarなどのデータベースや検索エンジンから、in vivo研究46件、in vitro研究22件を検索した。研究の評価基準は、in vitro または in vivo 研究の使用、NM の特性、単一または複数の用量の使用、結果の一貫性などであった。遺伝子組換え生物は、TiO2、Ag、ZnベースのNMsで最も広く研究されている。Zn および Cu ベースの NM、Cu 担持キトサン NP および Ag NM、ならびにアナターゼ TiO2 NP による GM ディ スバイオシスの証拠は中程度であり、SWCNT、ナノセルロース、SiO2、Se、ナノプラスチック、 CeO2 および MoO3、グラフェンベースの NM では低い証拠であった。ほとんどの研究が、GM に対する NMs の悪影響を示している。しかし、生物の種類や性別、NMs のサイズ、形状、表面特性、NMs の混合物への曝露による影響によって報告されている NM の影響の違いを明らかにするためには、さらに研究が必要である。遺伝子組換え生物に関する研究間の一貫性とより良い合意のためには、特に、NMの特性、投与量(量、回数、期間)、超音波処理の使用、試験系(in vitroとin vivoの両方)、in vitroモデルでの酸素濃度などに関する国際的な合意プロトコルが必要である。
図表による説明
グラフィカルアブストラクト

画像、グラフィカルアブストラクト
ダウンロード 高解像度画像のダウンロード (183KB)Download : フルサイズ画像のダウンロード
.
前の記事へ次の記事へ
キーワード
ナノマテリアル腸内細菌叢ディスバイオシスエクスポージャー代謝性疾患
はじめに
ナノマテリアル(NM)は、少なくとも1つの次元において100ナノメートルより小さい構造要素を持つ材料と定義される(Buzea et al.、2007)。ナノスケールで発現するユニークな生物学的および物理化学的特性(RS and RAE, 2004)により、ナノマテリアルは医薬品、食品、農薬、電子機器、繊維など多くの分野で応用されてきた。しかし、NMsはヒトの皮膚、肺、消化管に浸透し、全身循環に移行し、最終的には組織や臓器に移行する可能性がある(Nemmarら、2002; Bachlerら、2015)。さらに、NMは、代謝(Rowlandら、2018)、免疫(Geukingら、2014)、神経行動プロセス(MacFabe、2012)など、人間の健康に不可欠な多くの役割を果たす腸内細菌叢(GM)の改変を通じて、人間に対して間接的に悪影響を与える可能性がある。GMディスバイオーシスと呼ばれることが多い正常なGM構成の乱れは、特に、喘息(Johnson and Ownby、2017)、糖尿病および肥満(Moreno-Indiasら、2014)、結腸癌(Garrett、2019)、炎症性腸疾患(IBD)(Galrett、2019)ならびに中枢神経系障害(Carabottiら、2015;Chin-Chanら、2015;Zhuら、2017)等のいくつかの人間の疾患および状態に関連しているとされてきた。
二酸化チタン(TiO2)、デンプン、二酸化ケイ素(SiO2)NMは、しばしば食品中に意図的に添加され(Dekkersら、2011;Weirら、2012b;Chenら、2017b)、銀NP(AgNPs)、ナノ粘土、酸化亜鉛(ZnO)NP、TiO2は抗菌性があるので食品包装によく使用されます(Bumbudsanpharokeら、2015;Radusinら、2016)。例えば、オランダ人のTiO2 NPの推定平均摂取量は、高齢者では0.19 mg/kg bw/日、7~69歳では0.55 mg/kg bw/日、幼児では2.16 mg/kg bw/日でした(Rompelberg et al.、2016年)。さらに、リポソーム、有機ポリマー、ミセル、金属/金属酸化物、カーボンナノチューブ(CNT)および他の無機材料を含む医療製剤における多数のNMsの使用は、ヒト腸へのNMsの著しい曝露につながる可能性がある。
また、ヒトの腸は、経口経路以外の他の経路からもNMsに曝露される可能性がある。例えば、静脈注射と同様に、吸入されたNMsの粘膜繊毛クリアランスから、摂取されたNMsによるGMへの悪影響が予想される(Pietroiusti et al.、2017)。後者の例として、Leeら(2012)は、静脈内投与後のラットのAg NPsのかなりの糞便排泄を検出した。
GMに対するNMの効果については、様々な検討結果が得られている。しかし、これらの研究は、通常、様々な方法とアプローチを採用し、同じ種類のNMについて矛盾した結果をもたらす場合があるようだ。Bouwmeesterら(2018)、Lamasら(2020)、Zhangら(2020)など、このテーマに関する多くの叙述的レビューが行われているにもかかわらず、様々な種におけるNMのGMへの影響に関する証拠の体系的評価が必要であるとされている。
方法
Pubmed、Google scholar、ScienceDirectなどの電子検索エンジンから、「ナノ材料」、「ナノ粒子」、「超微粒子」、「腸内細菌叢」、「常在腸微生物」、「常在腸微生物叢」を含む用語を用いて2010年から2020年までに発表された科学原稿を特定した。電子検索は雪だるま式に補完された。PECO(Population, Exposure Comparator and Outcome)戦略を用いた(Hoffmann et al.、2017)。GM(P)、NM(E)および対照群(C)を使用した実験的研究は、負の効果(O)の有無を特定するために評価された。
2.1. 対象研究の特徴および質
2.1. 収録された研究の特徴と質 研究の適格性評価には、3名の独立した研究者が関与することにより、バイアスのリスクを低減させた。対象とした研究はすべて、in vivo あるいは in vitro の系で、GM に対する NM の有害作用を評価するものでなければならない。この要件を満たさない場合、その研究は自動的に除外された。しかし、いくつかの方法と研究デザインは、GM への NMs の影響を評価する上で、他の方法よりも適切であると考えられた。例えば、in vivoで実施された研究は、in vitro研究に関連する固有の限界があるため、in vitro(ex vivo)で実施された研究よりも信頼できる証拠を提供すると考えられる(Pearce et al.、2018)。また、生物学的勾配または用量反応の証明は、因果関係のBraford-Hill基準の一つであるため、1つの用量レベルを用いた研究は、複数の用量レベルを用いた研究よりも効果が低いと考えられる(Swaen and van Amelsvoort, 2009)。このことは、この研究が因果関係の証明を試みていないにもかかわらず、この評価において有用である。
ネガティブコントロールの使用は、偽の因果関係を推論する原因と疑われるもの、疑われないものの両方を検出することができる(Lipsitch et al.、2010)。陰性対照は反応を引き起こさないが、陽性対照を用いると、ベースラインから予想される方向と範囲での反応を引き起こすことができ、エビデンスが強化される(Leist et al.、2010)。GM に対する NM の影響を評価する研究において陽性対照を使用することは、試験システムの性能と感度の指標となる(Hothorn, 2014)。
NMs の毒性学的特性は、しばしばその物理化学的特性に影響される。したがって、これらの特性の特性評価は、ナノ毒性学において基本的に重要である。しかし、NMsの物理化学的特性を評価するための異なる技術には強みと限界があるため、サイズや形態などのoナノ固有の特性を評価するためには、複数の方法が必要となる。本研究で使用した基準を以下の表 1 に示す。
表1. 収録した研究の強度を評価するための基準
スコア 説明
1 In vitro(ex vivo)試験で、1つの用量レベルと陰性対照を使用し、NMの特性評価が十分でないもの。
2 In vitro(ex vivo)試験で、1つの用量レベルと陰性対照及び陽性対照を用いるとともに、NMs の特徴 付けを十分に行ったもの、又は in vivo 試験で、1つの用量レベルと陽性対照及び/又は陰性対照を用いるとともに、 NMs の特徴付けを十分に行わなかったもの。
3 複数の投与量レベルと陰性及び/又は陽性対照を用い、かつ NMs の特性を十分に評価した In vitro(Ex vivo)試験、あるいは一つの投与量レベルと陽性及び/又は陰性対照を用い、 かつ NMs の特性を十分に評価した In vivo 試験。
4 陰性及び/又は陰性対照とともに複数の投与量を用いた in vivo 試験であり、NMs の特徴付けが最小限である。
5 陰性および/または陽性対照とともに複数の投与量を用い、かつ NMs の特徴を十分に把握した In vivo 試験。
表 2 に示すように、各結論文の証拠の質は、特定の NM の GM への影響に関する結果の信頼性に 応じて、低、中、高と評価された。品質評価は、結論の背後にある研究における結果の強さと、類似の研究間での結果の一貫性に基づいて行われた。
表2. 結論の記述に対するエビデンスの質の意義(Debiaら(2016)から引用
品質 説明
High 一貫した結果を持つ多数の研究からの強力なエビデンス。さらなる研究によって結論の記述の信頼性が変化することはないだろう
中程度 全体的に中~高程度の強いエビデンス、および/または結果に一貫性がない可能性がある。さらなる研究により、結論の信頼性が変化する可能性がある。
Low 全体的に弱いエビデンス、または限られた数の研究から得られた結果に矛盾がある。さらなる研究によって結論の信頼性が変わる可能性が非常に高い:以下に基づいています。
3. 結果
総説、書籍、およびNMのGMへの影響や効果を評価していない研究を除外した結果、合計68の学術論文が特定された(Google scholar、PubMed、Science Directから46、さらに雪だるま式に20論文を追加)(図1)。
図1:
ダウンロード 高解像度画像のダウンロード(219KB)Download : フルサイズ画像のダウンロード
図1. 試験選定のフロー図
3.1. ナノ材料が腸内細菌叢に及ぼす影響
3.1.1. In vivo試験
3.1.1.1. モデル生物の腸内細菌叢に及ぼす NMs の影響
炭素系 NMs は、マウスやラットなどのモデル動物の GM に大きな影響を与えることが示されている。一例として、0.05、0.5、および2.5mg/kg bw日の単層カーボンナノチューブ(SWCNT)を7日間経口投与すると、炎症性細菌Alitipes_uncultured_bacteriumおよびLachnospiraceae細菌A4の存在量の増加とともに代謝炎症応答が生じた(Chen et al., 2018a)。一方、多層カーボンナノチューブ(MWCNTs;4 or- 40 mg/week)の10週間の反復経口曝露は、マウスのGMの組成に変化を起こさなかった(Christophersen et al.、2016)。研究されている他の炭素系NMには、マウスでグラム陰性菌よりもグラム陽性菌に大きな効果を示したグラフェン(Xieら、2016)、およびフラーレン(Liら、, 2018a)、フラーレン(Đurašević et al., 2020)、ナノフィブリル(ナノセルロース)(Khare et al., 2020)、キチンナノファイバー(CNF)(Azuma et al., 2015)、Cu担持キトサンNP(Han et al., 2010)などが報告されています。これらの研究結果を表 3 にまとめた。
表3. in vivo 試験による NMs の GM への影響のまとめ
ナノマテリアル 種 類 暴露量 GMへの影響 エビデンススコア 参考文献
SWCNTs(1.04 - 1.17nm x 1-5 µm) マウス 0, 0.05, 0.5, 2.5 mg/kg bwt/d を 7 日間経口投与 炎症性細菌の存在量が用量依存的に増加するとともに、堅果類の著しいシフトが認められた 5 Chen et al.
MWCNTs (49-74 nm x 3.86-5.7 µm) マウス 経口および肺に 0, 4, 40 mg/week を 10 週間投与 GM の組成に変化なし 4 Christophersen ら (2016)
フラーレン 100nm、90nm マウス 0、20mg/kg/日、経口投与、1ヶ月間 GMの全体構造の変化;推定SCFAs産生属に属する細菌の著しい増加 3 Liら(2018a)。
フラーレン(サイズ記載なし) ラット 食事 0 および 5 mg/kg b.w 日、12 週間 脂質恒常性を改善する細菌に向けた GM 構造のシフト 2 Đurašević et al.
ナノセルロース(50 nm) ラット 0または10 ml/kg bwの1%を週2回、5週間経口投与 特定種の濃縮とSCFAを大量に生産する種の個体数の減少 3 Khareら(2020).
TiO2(29 nm アナターゼ) ラット 0、2、10、50 mg/kg を毎日 30 日間経口投与 用量依存的な GM ディスバイオシス 5 Chen ら(2019a).
TiO2 (29 nm anatase nm) Rats Oral administration of 0, 2, 10, 50 mg/kg daily for 90 days Dose-dependent increases in the abundance of Lactobacillus_reuteri and a decrease in the Romboutsia) 5 Chen et al (2019b).
TiO2 (anatase 16.8 nm) マウス 0, 2.5 mg/kg bw/day, 7 日間経口投与 明らかな GM 異状なし 3 Chen et al (2017a)
TiO2 (220 nm および 255 nm, 85% anatase, 15% rutile) ラット 0, 10 mg/kg bw/day, 7 日間胃内投与 明らかな GM 異常なし 3 Talbot 他 (2018 年)
ルチル(16、148、361nm)およびアナターゼ(20、135、420nm)TiO2 マウス 0、100 mg/kg/日、28日間、経口投与 ルチルでGM構造のより顕著なシフト 3 Liら(2018b)
30 nm TiO2 NPs (majority anatase) Mice 0, 40 mg/kg by oral gavage for 8 weeks GMの組成の変化 3 Zhu et al.
食品グレードのTiO2 (28-1,158 nm) マウス 0, 2, 10, 50 mg/kg/日を4週間、飲料水にて投与 GMの組成に与える影響は最小である。 5 Pingetら(2019)。
TiO2(一次サイズ10nm、結晶構造未定) ゼブラフィッシュ 水系100 µg/L TiO2 NPとBPA(0、2、20 µg/L) に3ヶ月暴露 BPA低濃度で拮抗的相互作用があるがBPA高濃度で相乗的相互作用がある。
2 Chenら(2018b)
TiO2 NPs (10-65 nm mixed anatase and rutile) M. hemolymph Aquatic 0, 100 μg/L for 4 days 一部の属の現存量が減少するが、他の属では増加する 3 Auguste et al.
TiO2(アナターゼ、10、50、100nm) マウス 0.1%を3か月間、自由食で食事暴露 いくつかのプロバイオティクス分類群の存在量が有意に減少 3 Mu et al.
TiO2 NPs (anatase <100 nm) Mice 経口 1 mg/kg bw /day, 7 days ビフィドバクテリウムの豊富さの減少を含むGM組成が変化した。
3 Liら(2019b)
TiO2 NPs(チョコレートからの食品グレード) 白アルビノマウス 0、50、100μg/日を18日間摂取 B. coagulans、E. faecalis、および E. faeciumのプロバイオティクス製剤の増殖と活性を阻害 5 Khan et al.
TiO2 NPs (6-10 nm anatase) カイコ (Bombyx mori) 0 および 5 mg/L の摂取 個々の細菌種の存在量の変化 3 Li et al (2020)
Ag (12.2 nm) マウス 0, 2.5 mg/kg bw/day を 7 日間経口投与 バクテロイデーテスおよびファーミキューテスの菌相間および菌相内存在比の変化 3 Chen et al.
Ag (55 nm) マウス 食事 0-4600 ppb (0-1140 µg/kg b.w./d), 28 日間 α多様性とβ多様性の乱れ 5 Van Den Brûle et al (2015)
Ag (50 nm nanosheres and 45 nm nanocubes) coated with PVP ラット 経口投与 0, 3.6 mg/kg b.w./day, two weeks ナノキューブはClostridium spp.の減少を引き起こした。B. uniformis, Christensenellaceae, and C. eutactus; nanospheres caused decrease in Oscillospira spp., Dehalobacterium spp., Peptococcaeceae, Corynebacterium spp., Aggregatibacter pneumotropica; 3 Javurek et al.
Ag NPs (10, 75 and 110 nm) ラット 0, 9, 18 and 36 mg/kg bw/日を13週間経口投与 回腸粘膜微生物集団にサイズおよび用量依存的な変化、およびFirmicutes phylaの明らかな減少 5 Williamsら(2015)
Ag NPs (20 and 110 nm PVP and citrate-coated) マウス 0, 10 mg/kg bw/day 28日間経口投与 GMのメンバー、構造、多様性に影響なし 3 Wildingら (2016)
Ag NPs (<100 nm) ゼブラフィッシュ 0, 500 mg/kg in food, 14 日間 コントロールと同様にコミュニティの豊かさと多様性にわずかな変化 3 Merrifield ら (2013)
Ag NPs (14 nm, PVP安定化) ラット 0, 2.25, 4.5, 9 mg/kg bw/日を28日間経口投与 消化管細菌の2大菌門である Firmicutes と Bacteriodetes のバランスに影響を与えなかった。 5 Hadrupら(2012)
Ag NPs (55 nm) ゼブラフィッシュ 水棲 Ag NPs (0, 10, 33 or 100 μg L-1) 35 日間。 雄のゼブラフィッシュでGM組成を有意に変化させたが、雌では変化させなかった
5 Maら(2018)
Ag NPs Drosophila melanogaster 水中投与量を 10 μg/ml から 9000 μg/mL まで変化させた 幼虫の GM の多様性が低下し、対照と比較して Lactobacillus brevis の優勢が上昇し、Acetobacter が減少した 5 Han et al.
Ag NPs 鱗翅目害虫 Spodoptera litura 水生 1.0, 0.1, 0.01, 0.001 g/mL 21 日間 Klebsiella pneumoniae, Bacillus licheniformis, Bacillus cereus and Citrobacter freundi, Enterobacter cloacae で非常に有意な減少 5 Bharani and Namasivayam(2017).
Ag NPs ミミズ E. fetida 0, 10, 26, 64, 160 および 400 mg/kg 乾燥土壌 Firmicutes および Patescibacteria の相対的存在量に有意な負の効果;Bacteroidetes の相対的存在量に有意な正の効果 5 Swart ら (2020b)
Ag NMs (from a water filtration system) マウス 0.2 mL/day, 45 days by ingestion メスの糞便中のBacteroidetesの相対量が増加、Firmicutesの相対量が減少 3 Wu et al (2020)
ZnO NPs (<50 nm) マウス 0, 26 mg/kg 胃間投与 30 日間 神経行動障害および機能障害と密接に関連するGM組成の変化が見られた。 3 Chenら(2020)。
ZnO NPs (23.0) nm, 豚 食餌 0, 600, 2000 mg/kg, 14 日間。 回腸の細菌の豊富さと多様性が増加し、盲腸と結腸の細菌の豊富さと多様性が減少した;5 Xiaら(2017)
ZnO NPs (30 nm) Chicken Dietary 0, 25, 50, 100 mg/kg, for 9 weeks. 細菌の豊富さ、グルコースといくつかのアミノ酸の代謝、およびコリン、乳酸、メチオニンにおける用量依存的な変化 5 Feng et al.
ZnO NPs(30 nm C carpio. 食事 0 および 500 mg kg-1 ZnO NPs を 6 週間摂取 腸内細菌群集に有意な影響なし
2 チュパニら(2019)
HAHp (3.0) と ZnO NPs マウス 0 および 1.0 g/kg bw を経口投与した。
14日間 雌マウスにおいてFirmicutesの存在量が増加し、Bacteriodetesの存在量が減少した;雌マウスの糞便中にプロバイオティクス型細菌が濃縮された 2 Song et al (2018)
Zn NPs (90 nm) Chicken Dietary 0, 5 mg/kg of feed for 28 days Bacteroides and Faecalibacterium increase; decrease in Lactobacillus 2 Yausheva et al (2018)
Zn NPs (30 nm) マウス 0, 0.5, 5, 50 mg/kg in feed for 5 days IBDの発症と維持に関与するGM組成の改善 3 Li et al (2017)
Zn/Cu 合金 NP (65 nm) 鶏 0, 2.84 mg/kg を飼料に 42 日間投与 分類群 Bacteroidetes に属する細菌がわずかに増加し、Firmicutes が減少した。
2 Yaushevaら(2018年)
SiO2 NPs (11 nm) マウス 経口摂取 0, 2.5 mg/kg bw/day, 7 日間 腸管内の微生物種の豊かさと多様性が増加した 3 Chen et al.
SiO2 NPs (49 nm) マウス 経口投与 0, 5.0 mg/kg b.w. 2日に1回、5週間 ノッチ経路のトリガーにより肺上皮障害を促進したと報告された GM ディスバイオシス 3 Ju ら (2020)
Fe NPs (50 nm) Chicken 0, 8 mg/kg of feed for 28 days GMに有意な変化なし 2 Yausheva et al (2018)
鉄(III)オキソヒドロキシデナノ(10nm) ラット 20 mg Fe/kg飼料を硫酸鉄(II)または20 mg Fe/kg飼料をナノ鉄(III)として投与。 ラクトバチルス属の割合が増加し、バクテロイデス属が減少 2 Pereira et al.(2014)
CuO NPs Collembolans 0, 100 mg Cu/kg dry soil GMだけでなく、腸管関連ARGの多様性と存在量の両方が減少 2 Chen et al.
CuO NPs (183 nm) 土虫 E. fetida 0, 160 mg/kg dw soil, 28 日 C. Lumbricincola' の相対存在量に負の効果、Aeromonas に正の効果。 3 Swartら(2020b)
CuO NPs (20 and 50 nm) ミミズ E. fetida 0, 10, 26, 64, 160 and 400 mg/kg 乾燥土壌 処理した複製物のアルファ多様性は対照と異なる 5 Swart 他 (2020a)
CuO NPs (<50 nm) Enchytraeus crypticus 0 および 100 mg Cu/kg soil (dry weight). 21 日間 α多様性の顕著な増加、および GM 群集のシフト 2 Ma et al.
Cu NPs (55nm) 鶏 0, 1.7 mg/kg 飼料 28 日間 Blautia の減少 2 Yausheva et al (2018)
Cu NPs (87nm nm) ゼブラフィッシュ 0, 500 mg/kgを餌に14日間 C. someraeなどの有益な細菌株の抑制 3 Merrifieldら(2013)
MoO3 NPs (92 nm) ゼブラフィッシュ 水棲 0.2, 0.4 mg/dm3, 7 日間 腸内 GM 多様性の変化 5 Aleshina ら (2020 年)
Se NPs (size not indicated) 鶏 0, 0.3, 0.9, 1.5 mg/kg in feed ラクトバチルスやフェーカリバクテリウムなどの有益なバクテリアの存在量の増加 5 Gangadoo et al.
GR (0.5 µm x 1.6 nm) GO ナノシート (0.3 µm x 1.76 nm) および rGO (42 nm x 13 nm) ゼブラ フィッシュ. 0, 1 µg /day, 21 日間, 食餌暴露 フソバクテリアとセトバクテリウム属、ラクトバシラス属の相対量が増加するが、ファーミキューテスとシュードモナスは減少 3 Zheng et al (2019).
グラフェン ラット 食事 1、10、100μg/日 GM多様性と群集構造の変化、10μg/日、100μg/日よりも1μg/日の方が影響が大きい 5 Xieら(2016)。
GO (321.74 nm x 0-1.2 nm) ゼブラフィッシュ。 水生 0.05, 0.5, 5 mg L-1, 25 日間 門・属レベルで GM 多様性を破壊し、病原性細菌の増加が顕著、5 Jia et al (2019)
ナノポリスチレン(ナノプラスチック、100nm) 海洋魚 Larimichthys crocea 水生 14 日間暴露(0, 5.50 × 10-12, 5.50 × 10-9, 5.50 × 10-7 mg/L) Bacteroidetes, Proteobacteria, Firmicutes の割合が大きく変化、潜在的に病原性のある Parabacteroides と Alistipes が大幅に増加 4 Gu ら (2020 年 ).
ナノポリスチレン(50 - 100 nm) 土壌オリゴキャップEnchytraeus crypticus 10%土壌(乾燥重量基準) Rhizobiaceae、Xanthobacteraceae、Isosphaeraceaeの相対存在度が有意に減少したが、Amoebophilaceaeが増加 2 Zhuら(2018).
ナノサイズプラスチック(44nm) エビ 水生 0、50μg/L、21日間 GM、アミノ酸、脂肪酸の変化と微生物活性 3 Chaeら(2019)
鉛ハロゲンペロブスカイトNP (889 - 1206 nm) ゼブラフィッシュ 0, 5, 10, 50, 100, 200 mg/L の24時間水中曝露と食餌曝露 (500 mg/kg) GMに大きな変化なし 5 Patsiouら(2020)
CNFs and SDA CNFs マウス 経口投与 0.1% (v/v) in tap water for 28 days バクテロイデスの増加だけでなく、アシルカルニチンや脂肪酸の代謝の変化 3 Azuma et al (2015).
Cu担持キトサンNP ラット 食事 80および160 mg/kg bwを21日間投与 腸内ビフィズス菌と乳酸菌の増加、総好気性菌、総嫌気性菌、クロストリジウム、サルモネラ、大腸菌群の減少 4 Hanら(2010)
銅担持キトサン NPs 豚 飼料中 100 mg/kg 十二指腸、空腸、盲腸の大腸菌数が有意に減少し、乳酸菌およびビフィズス菌数も増加 3 Wang ら (2012 年)
シトラール担持ナノ構造システム シルバーキャットフィッシュ(Rhamdia quelen). 21 日間 0.25g/kg を食餌 魚の腸内の総細菌数を減少させた 3 Sutili et al.(2019)
金属系NMもGMディスバイオシスを引き起こすことが報告されている。例えば、0、2、10、50 mg/kgのアナターゼTiO2 NP(29nm)をラットに30日間毎日経口投与すると、L. gasseri, Turicibacter, L. NK4A136_group の増加、Veillonellaの減少などのGM dysbiosisを誘導できた(Chen et al., 2019a)。曝露期間を30日から90日に延長すると、糞便中のLactobacillus_reuteriが濃縮され、Romboutsiaが枯渇し、用量依存的にGMの多様性に有意な影響を与えた(Chen et al.、2019b)。同様に、0.1%アナターゼTiO2 NPsのマウスへの3ヶ月間の低用量食事曝露は、GMの総存在に有意な影響がなかったにもかかわらず、ビフィドバクテリウムおよびラクトバチルスを含むいくつかのプロバイオティクス分類群の存在量を有意に減少させることによって、GMバランスを妨害することができた(Mu et al.、2019年)。TiO2 NPsによるGMディスバイオーシスも他の著者によって報告されており(Li et al., 2018b; Khan et al., 2019; Li et al., 2019b; Zhu et al., 2020)、これはPingetら(2019)、Chenら(2019a)、Liら(2018b)の研究とは対照的であり、明らかなGMディスバイオーシスは観測されていない。
Ag NP の GM への影響についても、相反する研究が報告されている。例えば、2.5 mg/kg bw/日を7日間曝露すると、BacteroidetesとFirmicutesの系統間および系統内存在度のシフト、Firmicutes/Bacteroidetes比の減少、低濃度の細菌科の増加、およびプロバイオティクス細菌であるLactobacillus属の減少が見られた(Chenら、2017a)。同様に、1.18から36 mg/kg b.w./d Ag NPsの28日間のマウスへの曝露は、細菌多様性の用量依存的な障害だけでなく、FirmicutesとBacteroidetes phyla間の比率の増加をもたらした(Van Den Brûle et al.、2015年)。しかしながら、Wildingら(2016)は、10mg/kg bw/日の20および110nmのポリビニルピロリドン(PVP)およびクエン酸でコーティングされたAg NPの28日間の反復経口投与が、マウスのGMのメンバーシップ、構造、または多様性に影響を及ぼさないことを示すことができた。同様に、Hadrupら(2012)は、Ag NPが消化管細菌の2つの主要な門、FirmicutesとBacteriodetesの間のバランスに影響を与えないことを示すことができた。モデル生物に対する GM の影響の概要を表 3 に示す。
3.1.1.2. 家畜の腸内細菌叢に及ぼすNMの影響
ニワトリを対象としたいくつかの研究が行われている。例えば、Fengら(2017)は、細菌群集の多様性がZnO NPsの量の増加に伴って負の相関を示し、100 mg/kg bwで有意に減少することを明らかにした。さらに、ZnO NPsはグルコースと一部のアミノ酸の代謝を変化させ、コリン、乳酸、メチオニンは細菌の豊かさと正の相関があった。鶏におけるGMの負の影響は,食餌ZnおよびCu/Zn合金NP Yaushevaら(2018),羊膜内投与ZnO NP,TiO2 NPおよびSiO2(Kolbaら,2020)に対して報告されている。一方、Gangadooら(2018)は、セレンNP(Se NPs)に対して、ラクトバチルスやフェカリバクテリウムなどの有益なバクテリアの存在量の増加や、SFCAs 、特に酪酸の変化などの鶏のポジティブ効果を報告している。
GMに対するNMの効果も豚で報告されている。例えば、150、300、または450 mg/kg、および3000 mg/kg ZnO NPsの21日間の食餌投与は、ブタの盲腸、結腸、および直腸における大腸菌のカウントを減らすことによって腸のGMに有益な効果を誘発した(Pei et al, 2019)。ブタのGMディスバイオーシスを引き起こした他のNMには、Cu担持キトサンが含まれる(Wang et al.)
3.1.1.3. 水生生物の腸内細菌叢に対するNMsの影響
NMsは、多くの水生生物種におけるGMの構成に影響を与えることも示されている。例えば、単層グラフェン粉末(GR)、酸化グラフェンナノシート(GO)、還元酸化グラフェン粉末(rGO)などのグラフェン材料に21日間食事暴露すると、ゼブラフィッシュ(Danio rerio)のFusobacteriaとCetobacteriumおよびLactobacillus属の存在量が増加した(Zheng et al.、2019年)。Jiaら(2019)も、0.05、0.5、5 mg L-1 GOのゼブラフィッシュへの慢性曝露(25日)により、門と属の両レベルでGM構成の崩壊が起こり、病原性細菌が増加したことを報告している。腸内細菌叢の異常は、Larimichthys croceaのナノポリスチレン(Guら、2020)、および銀ナマズ(Rhamdia quelen)のナノエマルション(NE)とアルギン酸NPからなるシトラール担持ナノ構造体(Sutiliら、2019)についても報告されている。昆虫および土壌のマイクログラムに対するGMへの影響を含むすべてのin vivo試験の概要は、表3に示されている。
3.1.2. インビトロ(エクスビボ)試験
GM に対する NM の毒性作用は、in vitro 系でも報告されている。例えば、10 nm ZnO、10 nm CeO2、21 nm TiO2 NPをそれぞれ 0.01 µg/L、0.1 および 3 mg/L の濃度で結腸細胞培養モデルに曝露すると、SCFA 産生、細胞外高分子物質の糖度、疎水性および電気泳動移動度を含む微生物群集の表現型特性に非致死ながら著しい変化が生じることが報告されている (Taylor et al., 2015)。同様に、100および250mg/Lでin vitro試験した25nmの食品グレードのTiO2 NPは、ヒトGMに軽微な影響を引き起こし、それはClostridium cocleatumを支持して優勢なBacteroides ovatusの相対存在度を適度に減少させることに限定された(Dudefoi et al.、2017年)。Radziwill-Bienkowskaら(2018)はまた、P25経済協力開発機構(OECD)基準TiO2とは異なる食品グレードTiO2が、最も敏感な種に何らかの生理的変化を誘発し、その結果、GM組成と機能に影響を与える可能性があると述べている。さらに、実験室規模のin vitroモデルヒト大腸リアクターを使用して、Wallerら(2017)は、工業用および食品用TiO2 NPsの両方によって引き起こされるGMの組成、表現型、および生化学的変化を観察し、食品用TiO2 NPsによってより顕著な効果が引き出された。GMに関するin vitro試験のその他の結果を表4にまとめた。
表4. in vitro(ex vivo)試験で得られた GM に対するナノマテリアルの影響のまとめ
ナノマテリアル 試験系 影響 エビデンススコア 参考文献
ZnO NPs (10 nm) 0.01 µg/L の ZnO を含む連続複製コロン、5 日間 非致死的、微生物群集の表現型に著しい変化 2 Taylor ら (2015 年)
CeO2 (10 nm) 0.01 µg/L の CeO2 を含む連続的な複製コロン、5 日間 非致死性、微生物群集の表現型への有意な変化 2 Taylor et al (2015)
TiO2 (27 nm, 82% anatase and 18% rutile) 3 mg/L の TiO2 を 5 日間含む連続複製のコロン 非致死性、微生物群集の表現型への有意な変化 2 Taylor et al.
TiO2 NPs (25 nm, 結晶構造未定) A continuous Human Gut Simulator system, 100 mg/day dose for 7 days コミュニティ多様性と均等性に影響を与えず、コミュニティ密度を適度に減少させた。 2 アガンスら(2019)
TiO2 NPs(食品グレード、25 nm) In vitro 静置培養、濃度 100 および 250 mg/L 支配的な Bacteroides ovatus の相対的存在度が適度に低下し、Clostridium cocleatum が有利になる 3 Dudefoi et al.
TiO2 NPs(食品グレード) 32、62.5、125、320 mg/mL の濃度で In vitro 静置培養。 最も感受性の高い種に何らかの生理的変化を誘発し、その結果、GMの組成や機能に影響を与える。 3 ラジヴィル=ビエンコウスカら(2018 年)
TiO2 NPs (チョコレートから分離した食品グレード) (40 nm) 125-250 μg/ml 48 時間 バチルス・コアギュランス、エンテロコッカス・フェカリス、エンテロコッカス・フェシウムのプロバイオティクス製剤の成長と活性を阻害 2 Khan et al. (2019).
TiO2 NPs(工業用-252 nm、75%アナターゼおよび25%ルチル-および食品グレード-212 nm、98%アナターゼおよび2%ルチル) In vitroモデルヒト大腸リアクター、36 mg/.日 工業グレードTiO2 NPsと食品グレードの両方によるGMの組成、表現型および生化学変化、より顕著な効果は食品グレードTiO2 NPsで誘発されました。 2 ウォーラーら(2017)
Se NPs(サイズ不明) In vitro 静置培養で濃度 0.9 mg/kg 病原性 E. cecorum の存在量を、全 GM 群集に大きな障害を与えずに有意に減少させた 2 Gangadoo ら(2019)。
ナノ構造化脂質担体(NLC、211nm) In vitro静置培養、0、1.25、2.5、5% v/v 試験した他のヒトGMに影響を与えずに、このH. pyloriの選択的除菌 3 Seabraら(2018)
Ag NPs (11 nm), PVP-capped Cultured GM from human stool exposed NPs at 0, 25, 100 and 200 mg/L ガス産生の減少だけでなく、脂肪酸メチルエステルプロファイルの変化 2 Das et al (2014)
Ag NPs (49 nm), Static GIS1 simulator, 200 mg /mL Bacteroides, Enterobacteriaceae, and Lactobacillus populationの減少 2 Vamanu et al.
Ag NPs (10 nm), citrate capped In vitro static culture, 25, 50 and 100 μg/mL for 24 hours Concentration, temperature- and time-dependent inactivation of gastrointestinal phage/virus manner 3 Gokulan et al. (2018)
Ag NPs(30~50 nm) ヒト腸管動態シミュレーターシステム、100 mg/日投与、7日間 GM個体密度の劇的な減少 2 アガンスら(2019)
Ag NPs、ポリエチレングリコール(PEG)、グルタチオン(GSH)安定化 連続SIMGI®シミュレーター、PEG-AgNPs 88μg/ml、GSH-Ag 20および61μg/ml、8日間 GMの組成および代謝活性に大きな変化はない 3 Cuevaら(2019).
Ag NPs(14 nm)、クエン酸キャップ付き In vitroバッチ発酵モデル、ヒト糞便と1 μg/mL NPsを24時間接種 糞便微生物叢の組成と多様性および代謝プロファイルに影響なし 2 Cattòら(2019).
ナノセルロース繊維(4-5nm) In vitro静置培養、500、250、100、50μg/mL 大腸菌に静菌効果、ラクトバチルスロイターには効果なし 2 Lopesら(2020年)
SWCNTs (1-3μm) and MWCNTs (> 50 μm) In vitro static culture (20, 50 100 µg/L L. acidophilus, B. adolescentis, E. coli, E. faecalis, and S. aureus に対するブロードスペクトラム抗菌活性; MWCNTsよりも薄くて堅い SWCNTsに対して抗菌活性がより高い。 1 Chenら(2013)。
酸化グラフェン in vitro 静置培養、10~500μg/ml、24時間 ヒト腸内グラム陰性大腸菌K-12、グラム陽性L. acidophilus ADH、Bifidobacterium animalis Bif-6 に悪影響なし 3 Nguyenら(2015).
4. 考察
本研究では、マウス、ラット、陸生昆虫、水生生物、土壌生物など多くのモデルを用いた in vivo 研究 46 件と、ヒトの消化管を模倣したものを含む in vitro 研究 22 件が確認された。GM に対する NM の影響の種類と大きさは、一般に NM の種類に依存し、試験生物またはモデル、用量、曝露経路、投与 の種類(単回または反復)、NM のサイズ、曝露期間、影響評価の時点、物理化学的特性の評価方法、 GM 異 常の評価方法など多くの実験因子に影響を受けると思われる。これらの条件が大きく異なるため、異なる研究結果の比較は複雑であった。
このレビューでは、異なるNMがGMにおいて異なる効果を誘発することを示すことができた。さらに、同じ種類のNMの異なる形態は、いくつかのケースで異なる効果を引き起こした。例えば、Chenら(2019a)およびLiら(2018b)は、TiO2 NMによって引き起こされたマウスのGM異種症を報告したが、Pingetら(2019)、Chenら(2017a)およびTalbotら(2018)がマウス種で明白なGM異種症を報告しなかったのとは対照的であった。しかし、TiO2について報告された結果の違いは、TiO2の形態のバリエーション、特に食品グレードと非食品グレードのTiO2 NPの違いに起因すると考えられる(EFSA, 2016)。食品グレードのTiO2のGMに対する毒性は、P25 OECD参照または工業用TiO2 NPの毒性と異なることに注意することが重要である(Wallerら、2017;Radziwill-Bienkowskaら、2018)。GMに対する2つの形態のTiO2の毒性の矛盾は、in vitroでも観察された(Wallerら、2017)。
Ag NPについても、in vivo (Hadrup et al., 2012; Williams et al., 2015; Wilding et al., 2016; Javurek et al., 2017) とin vitro (Hadrup et al., 2012; Das et al., 2014; Vamanu et al., 2018; Agans et al., 2019; Cueva et al., 2019) の双方において対照的な結果が報告されている。これらの違いの理由は明らかではありません。Ag NPのGMに対する作用機序は、Ag+イオンの放出、酸化ストレス、DNA複製の阻害だけでなく、細菌細胞膜の破壊と思われるが(Li et al., 2019a)、Javurekら(2017)が報告したNCおよびNPによる効果の形状依存性の違いを説明できるかもしれない。とはいえ、NMの形状がGMに対する毒性に及ぼす影響については、さらなる研究が必要である。機能化Ag NPの悪影響は、1つのin vivo(Javurekら、2017)および2つのin vitro研究(Dasら、2014;Gokulanら、2018)で報告されたが、いくつかのin vivo(Hadrupら、2012;Wildingら、2016)およびin vitro(Cattòら、2019;Cuevaら、2019)研究では報告がなかったため、機能グループの効果についてもさらなる研究が必要である。GMに対する性依存的な毒性作用はいくつかの従来物質で報告されているが(Ba et al., 2017; Lozano et al., 2018)、Maら(2018)およびWuら(2020)が報告したゼブラフィッシュGMに対するAg NPの性依存作用はさらなる調査を必要としている。同様に、サイズ依存的な効果は1つの研究でのみ観察されたため(Williamsら、2015)、GMに対する毒性に対するNMのサイズの影響を評価する必要がある。
少数の研究で観察されたサイズ依存的な効果とは対照的に、用量依存性は多くの研究で観察された(Van Den Brûle et al., 2015; Williams et al., 2015; Wilding et al., 2016; Chen et al., 2018a; Chen et al., 2019a; Chen et al., 2019b)。それにもかかわらず、ナイーブコントロールまたはネガティブコントロールに加えて、1つの用量しか使用しない多数の研究があった。先に述べたように、因果関係を立証するためには用量反応の証明が必要であるため、これらの研究は効果が低いだろう(Swaen and van Amelsvoort, 2009)。さらに、ある時点で評価された効果は、長期間にわたって観察された効果とは異なる可能性がある。
表 3 に示すように、in vivo 試験の大半は、NMs を経口投与(食事または経口ガベージ)したものであり、水や土壌を介した環境暴露を伴う研究は少なかった。10、33、100μg L-1 Ag NPs(55 nm)への35日間の環境曝露が、雄のゼブラフィッシュのGM組成を有意に変化させた(Maら、2018)一方で、同じ種を500 mg/kg Ag NPs(<100 nm)に14日間食曝露しても、コミュニティの豊かさと多様性にわずかな変化しか生じない(Merrifieldら、2013)のは興味深いことであった。この効果の違いは、曝露経路の違いだけでなく、NMsの大きさや曝露期間の違いにも起因していると考えられる。残念ながら、MWCNTをマウスに経口曝露と肺曝露の両方を行ったChristophersenら(2016)の研究では、経口曝露後のGMへの影響のみに着目していたため、投与経路による影響の比較はできなかった。
ナノ毒性学では、標準化された分散プロトコルの欠如とNMの適切な特性評価の欠如のために、in vitroとin vivoの両方の研究間で矛盾が報告されている(Sayesら、2007b; Sayesら、2007a; Cohenら、2015年)。NMを分散させるために使用される方法は、凝集の程度と表面特性に影響を与え、それは次にその毒性に影響を与えるであろう。NP分散液を調製するためのいくつかのプロトコルは、凝集を制限するために、溶液に供給される音響エネルギーのレベルおよび超音波処理の時間を規定している(Pradhanら、2016)。Chenら(2018a)、Juら(2020)、Christophersenら(2016)、(Zhuら、2020)および(Pingetら、2019)などの多くの著者は、GMディスバイオージスの研究のためにNMを調製するために様々な超音波処理を使用したが、Khareら(2020)、Liら(2018a)、Liら(2018b)およびMuら(2019)などの他の著者はいかなる超音波処理手順の使用も報告しなかった。分散手順のばらつきが類似のNM間の結果に影響を与える可能性があるため、DeLoidら(2017)が提案したような標準プロトコルの使用は、強調しすぎることはないだろう。
また、NMの毒性に影響を与える物理化学的特性(特に、サイズ、形状、表面積、電荷、キラリティ、官能基など)の評価にも標準プロトコルが必要である。実際、それぞれの物理化学的特性を測定するための手法は、長所と短所があり、最適な手法の選択を難しくしている。例えば、ナノ粒子のサイズや形態の測定には、透過型電子顕微鏡(TEM)、走査型透過型電子顕微鏡(SEM)、動的光散乱(DLS)などの技術が広く用いられている。これらの技術の様々な組み合わせが研究の大部分で使用されたが、Chupaniら(2019)、Songら(2018)およびYaushevaら(2018)によるものなどの少数の研究は、サイズ、形状および表面積などのNMsの適切なナノ特有の物理化学特性を特徴付けるための方法を特定しなかった。特性評価に使用される技術や方法の違いは、確かに類似のNMの間で結果に違いをもたらす可能性があります。
また、研究間の結果の違いは、特にサンプルの種類や採取場所の違い、培養依存型アプローチか培養非依存型アプローチか、また微生物相の分析に用いた技術の違いに起因する可能性がある(Goodrichら、2014年;Van Den Brûleら、2015年)。多数の要因が関与しているため、多数の研究の間で特定のNMによる効果の違いに方法論の違いが関与していると確認することは困難である。全体として、大半の研究では、GM構成の培養に依存しない特徴付けに16S rRNAのPCR増幅を利用しており、シングルコロニーを使用した研究はごく少数であった。
GMに対するNMの悪影響が報告されたいくつかの研究では、非常に高い用量が使用されていた。例えば、Liら(2018b)は100 mg TiO2 /kg/日の用量を使用したが、米国におけるTiO2へのヒトの曝露は、子供で1~2 mg/kg日、成人で0.2~0.7 mg/kg日と推定されている(Weirら, 2012a)。同様に、食品包装からの移行により、Ag NPs の食事暴露は 5.89 × 10-5 から 8.9 × 10 -5 mg/kg.day と推定されているが(Cushen et al., 2014)、500 mg/kg という高用量(ヒトでは 7.1 mg/kg.day 相当)であった (Merrifield et al., 2013)。一方、Chenら(2018b)は、環境に関連する水中濃度100 µg/L のTiO2 NPsにゼブラフィッシュを曝露したと主張している。効果的かつ適切な結果を得るためには、ヒトや他の種に対するNMの現実の曝露レベルを推定し、これらの用量が毒物学的に重大な結果をもたらし得る方法でGMを変化させるのに十分大きいかどうかを確認する研究が必要です(Utembe and Kamng'ona, 2021)。確かに、経口経路以外の経路でGMのNMへの曝露レベルを決定することは困難であろう。例えば、CNT の GM への影響に関する研究では、投与量は 0.05~5 mg/kg bw/d であったが、吸入可能な CNTs 用量のごく一部(ヒトで 4.07 μg/日、マウスで 2 ng/日)だけが、粘膜繊毛輸送により肺から消化管に輸送されると考えられる(Erdely et al, 2013)。
表 3 は、曝露期間(および影響の検討)が数日から 3 ヶ月(90 日)であり、研究に大きなばらつきがあることを示している。この重要な側面が、GMディスバイオシス研究の比較を非常に困難にしている。非常に注目すべき例として、Chenら(2019a)が29nmのアナターゼTiO2 NMを30日間、Chenら(2019b)が同じNMを90日間実施した研究があります。どちらの研究でもTiO2 NMはGMに用量依存的な変化を誘発したと報告されているが、GMの特定種における変化は異なるようである。したがって、今後の研究では、投与頻度や投与期間、効果の検討期間を考慮する必要がある。
細胞壁の破壊により GM に影響を及ぼす NMs については、細胞壁の存在や性質が毒性に影響することが予想される。その点、グラム陰性菌は、細胞壁の構造の違いからグラム陽性菌よりも高い耐性を持つと考えられる。グラム陽性菌が細胞質膜と厚いペプチドグリカン層を持つのに対し、グラム陰性菌は外膜と細胞膜の2つの細胞膜と1つの薄いペプチドグリカン層からなる厚い細胞壁を持つ(Fuら、2005)。実際、Xieら(2016)は、グラム陰性菌のグラフェンに対する耐性がグラム陽性菌よりも高いことを報告している。同様に、Ag NPはグラム陽性菌よりも低濃度でグラム陰性菌に悪影響を及ぼす(Fröhlich and Fröhlich, 2016; Zhang et al, 2020)。とはいえ、ZnO NPは同程度の濃度で両方の細菌群に悪影響を及ぼすため(Fröhlich and Fröhlich, 2016)、グラム陽性菌とグラム陰性菌に対するNMの影響の違いに寄与する要因についてさらなる研究が必要である
一部のNMsは、細胞壁やDNAを含む生体分子を直接損傷する活性酸素の生成を通じてGMに影響を与える。好気的環境下での活性酸素の発生は、嫌気的環境下での活性酸素の発生と似て非なるものである可能性がある。したがって、高酸素濃度でのGM破壊の速度とメカニズムは、GM管の一部に優勢な嫌気性または無酸素性環境では関係ないかもしれない(Zhang et al.、2020)。しかし、in vitro研究の大半は好気的条件で実施されており、Cuevaら(2019)、Taylorら(2015)、Agansら(2019)によるものなど、この論文で引用した連続シミュレータは、様々な区画の酸素レベルや好気的/嫌気的条件について言及していない。
GMに対するNMの影響の研究において非常に重要な問題は、in vitroおよびin vivoシステムのうち試験システムまたはモデルを選択することである。in vitroモデル系は、比較的現実的な曝露環境を提供すると同時に、実験条件のより高い制御を可能にするが、複数の細菌群が相互に影響し合う現実的な宿主環境下での研究を可能にするのは動物モデルだけである(Zhang et al, 2020)。一方、動物モデルは最も信頼性が高いように思われますが、動物のGMはヒトのGMと大きく異なる可能性があることを認識することが重要です。動物モデルの中でも、マウスはヒトと類似した消化管の構造を持つため、GM研究に最も広く用いられている(Velmurugan, 2018)。表3では、マウスが20回登場するのに対して、ラットは11回登場する。8 件は、GM 研究の新たなモデルであるゼブラフィッシュを用いた研究である。成体哺乳類のGMコミュニティは、ゼブラフィッシュではProteobacteria、Fusobacteria、Firmicutesが多いのに対して、BacteroidetesとFirmicutesが多いという特徴があるが(Catron et al, 2019)、ゼブラフィッシュのGMディスバイオシスの研究は、その70%以上がヒトの遺伝子と相同であるため(Howe et al, 2013)、ヒトにとって役立つ情報をもたらすことができる。表3はまた、成長促進のためのNM製剤の使用が増加しているため、GM研究における動物モデルとしてニワトリの使用が増加していることを示している(Yausheva et al.、2018)。ヒトのブタと生理学的、代謝的、栄養学的に類似しているため、他の非霊長類モデルと比較して優れたモデルとして認識されているブタに関する研究はほとんど行われていない(Heinritz et al.、2013)。
実際、試験生物の選択は、多くの研究間でばらつきの原因となっているようである。例えば、C carpioを500 mg kg-1 ZnO NPs(30 nm)に6週間、食事を通して曝露しても、腸内微生物群に有意な影響は生じなかった(Chupani et al.、2019)。一方、ニワトリをはるかに低い食餌量の50および100 mg/kg(30 nm)のZnO NPsに9週間暴露すると、細菌の豊富さだけでなく、グルコースおよびいくつかのアミノ酸の代謝に用量依存的な変化が生じた(Fengら、2017年)。
in vitroまたはex vivo研究において、多くの研究は、in vivo条件を模倣する培養条件を用いて、腸から分離した特定の単培養細菌の増殖と代謝に対するNPの直接的効果を評価した。しかし、単離された細菌の使用は、細菌の特定の種または株に対するNMの効果を評価するものである。これに対し、最も適したin vitroモデルは、現実的でより代表的なGMの多様性を含むヒトの糞便サンプルを使用するものである。単培養モデルは、NMsの特定の影響を評価したり、NMと微生物との相互作用のメカニズムを解明したりする上で、依然として有用である(Camposら、2022年)。
ほとんどの研究は、実験室で制御された条件下で、単一の NMs の GM への悪影響を評価しているが、現実の曝露には NMs の混合物が関わっている。その点、TiO2 NPsとBPAは、低BPA濃度では拮抗作用を、高BPA濃度では相乗作用を惹起しました(Chenら、2018b)。同様に、SiO2 NPsと低線量放射線についても、相乗的な異食作用が報告されている(Ju et al.、2020)。したがって、GMと他の物質の混合物だけでなく、NMの様々な混合物のGMへの複合的な影響を評価する必要がある。
この系統的レビューでは、GMに対するNMsの毒性に関する証拠の質を評価するために、主観的で恣意的、かつ議論の余地がありそうな点数基準を用いている。これらの指標は、議論や考察のきっかけとなり、GM異臭研究において普遍的に合意された品質評価基準や指標を開発するための出発点となることが期待される。最後に、本研究は、GMディスバイオシスに関する研究間の一貫性とより良い合意のために、特に、NMの特徴づけ、投与量(量、回数、期間)、超音波処理の使用、試験系(in vitroとin vivoの両方)、in vitroモデルの酸素濃度に関する国際的に合意されたプロトコルが必要であることを示している。
NMの種類別のエビデンスの質の要約は表5に示されている。GMに対する様々なNMの効果は多くの代謝性疾患につながる可能性があるが、その効果は、細菌の多様性を高め、ディスバイオシスを修正するために使用できる微量栄養素製剤としてこれらのNMを使用する機会を提供する(Chenら、2017a; Liら、2017; Yaushevaら、2018; Gangadooら、2019)。
表5. ナノマテリアルの種類別のエビデンスの質のまとめ
ナノ材料 in vivo研究の総数 ex vivo研究の総数 GMディスバイオシスに関する総評 エビデンスの質評価
SWCNTs 1 1 GMの変化、より多くの研究が必要 Low
MWCNTs 1 1 GMに変化なし、さらなる研究が必要 Low
フラーレン 2 0 GM の変化、より多くの研究が必要 中程度
ナノセルロース 1 1 GMの変化、より多くの研究が必要 低い
酸化チタン
アナターゼ 7 0 6つの研究で異常が見られたが、1つの研究では明らかな異常は見られなかった 中程度
ルチル 1 0 より多くの研究が必要 低
食品グレード 2 3 GM の組成への影響は最小限またはわずかである。より多くの研究が必要 低
混合結晶構造または未定義の結晶構造 4 3 中程度のGM形成不全 低
銀 12 6 銀ナノ粒子は GM の生育障害を引き起こすとする研究がある一方、そうでないとする研究もある。機能化されたNPでも同様の結果 中程度
ZnO 4 1 著しいGMの変化 中程度
Zn 2 0 GMに有意な変化あり 中程度
Zn/Cu合金 1 0 GMのわずかな変化 低
HAHp (3.0)とZnO NPs 1 0 GMが大きく変化 Low
SiO2 2 0 GM の変化、さらなる研究が必要 Low
Fe 1 0 GMに有意な変化なし Low
ナノ粒子状鉄(III)オキソ-ヒドロキシデナノ 1 0 GMに有意な変化を示す Low
CuO 4 0 GMに大きな変化をもたらす 中程度
Cu 2 0 GMに大きな影響を与える Moderate
Se 1 1 GM低で有意な変化
GR、GOナノシート、rGO 3 1 GM異常の研究結果もあるが、そうでないものもある Low
ナノポリスチレン 2 0 大幅なGM変化 中程度
ナノプラスチック 1 0 GMの変化 低
鉛ハロゲンペロブスカイト 1 0 GMに変化なし Low
CeO2 0 1 GMの変化 低
MoO3 NPs 1 0 大幅な変化あり GM 多様性 低位
CNFと(SDA)とCNF 1 0 GMの多様性に大きな変化あり 低
銅担持キトサンNP 2 0 GMの大幅な変化 中程度
ナノエマルション(NE)とアルギン酸NPからなるシトラール担持ナノ構造体 1 0 著しいGMの変化 低 低
シトラール担持ナノ構造体 1 0 GMの有意な変化 低
5. 結論
このシステマティックレビューは、多くの種およびヒトにおいて、NMsがGMディスバイオシスを引き起こす可能性を示した。全体として、Zn系NM、Ag NP、Cu系NM、Cu担持キトサンNP、アナターゼ型TiO2 NPによるGMディスバイオーシスの証拠が中程度であった。このような様々なNMのGMに対する効果は、GMディスバイオーシスに関連した病気や症状の治療に利用する機会を提供するものである。
GMに対するNMの効果は、NMの種類と生物によって異なることがわかった。特に酸化チタンと銀は、in vivoとin vitroの両方で相反する結果をもたらした。その結果、GM毒性に及ぼすNMサイズの影響について、さらなる研究が必要である。また、形状、官能基、その他の物理化学的特性の影響についても、さらなる研究が必要である。また、複数の非金属を同時に暴露した場合の GM への影響も評価されなければならない。遺伝子組換え生物に関する研究間の一貫性とより良い合意のためには、特に、NMsの特徴づけ、投与量(量、回数、期間)、超音波処理の使用、試験系(in vitroとin vivo)、in vitroモデルでの酸素濃度などについて国際的に合意されたプロトコルが必要である。
免責事項
この記事は、著者自身の能力で作成されたものです。したがって、本論文の意見、知見、結論は、著者自身のものであり、必ずしもKamuzu University of Health Sciences、National Institute for Occupational Health(NIOH)、National Health Laboratory Service(NHLS)またはUniversity of Johannesburgの見解を反映または代表するものであるとは限りません。
著者の貢献
W.U.、N.T.、A.W.K.は、文献検索、原稿執筆、編集に携わった。
利害関係者の宣言
著者らは、本論文で報告された研究に影響を及ぼすと思われる競合する金銭的利益や個人的関係がないことを宣言する。
謝辞
N. Sanabria博士の校正・編集の協力に感謝する。
参考文献
アガンスら,2019
RT Agans、A Gordon、S Hussain、O. Paliy
二酸化チタンナノ粒子は、銀ナノ粒子よりも低いヒト腸内細菌叢の直接阻害効果を誘発する
Toxicol Sci, 172 (2) (2019), pp.411-416.
CrossRefView レコードをScopusGoogle Scholarで見る
アレシナ、ミロシニコワ、シゾバ、2020年
Eアレシナ、Eミロシニコワ、Eシゾバ
環境中の酸化モリブデンナノ粒子を背景とした魚類の腸および鰓の微生物相の変容
Int J Environ Sci Technol, 17 (2) (2020), pp.721-732.
CrossRefView Record in ScopusGoogleスカラー
オーギュストら, 2019
M Auguste、A Lasa、A Pallavicini、S Gualdi、L Vezzulli、L. Canesi
TiO2ナノ粒子への曝露は、Mytilus galloprovincialis hemolymphの微生物叢組成のシフトを誘発する
Sci Total Environ, 670 (2019), pp.129-137
記事ダウンロードPDFView Record in ScopusGoogle Scholar
アズマら, 2015
東 紘一、和泉 亮、川田 真、長江 崇、大崎 孝、村畑 祐子、塚 孝、今川 孝、伊藤 直、岡本 恭平
キチンナノファイバーの経口投与が血漿中代謝物および腸内細菌に及ぼす影響
Int J Mol Sci, 16 (9) (2015), pp.21931-21949
CrossRefView Record in ScopusGoogle Scholar
バら、2017
Q Ba、M Li、P Chen、C Huang、X Duan、L Lu、J Li、R Chu、D Xie、H.Song
幼少期のカドミウム曝露がマウスの腸内細菌叢と脂肪蓄積に及ぼす性差の影響
エンバイロン・ヘルス・パースペクト, 125 (3) (2017), pp.437-446
ScopusGoogle Scholarで記録を見る
バッハラーら、2015
G Bachler、S Losert、Y Umehara、N von Goetz、L Rodriguez-Lorenzo、A Petri-Fink、B Rothen-Rutishauser、K Hungerbuehler
金ナノ粒子の肺上皮組織バリアーにおけるトランスロケーション。in vitro と in silico の組み合わせによる in vivo 実験の代替法
粒子・繊維毒性学, 12 (1) (2015), pp.1-18
Google Scholar
バラニ・ラナマシバヤム、2017年
SKR. バラニ・ラナマシバヤム(Bharani RANamasivayam
生物起源銀ナノ粒子による主要鱗翅目害虫Spodoptera litura (Fab.)(Lepidoptera: Noctuidae)の発育期間および腸生理学へのストレス-環境に優しい害虫駆除のアプローチ
J Environ Chem Eng, 5 (1) (2017), pp.453-467
Google Scholar
ブーメスターら, 2018
H Bouwmeester、M van der Zande、MA Jepson、et al.
食品由来ナノ材料の消化管組織および微生物叢への影響
Wiley Interdiscip Rev Nanomed, 10 (1) (2018), p. e1481
ScopusGoogle Scholarで記録を見る
ブンブンサンファロケ、チョイ、コウ、2015年
N Bumbudsanpharoke、J Choi、S.Ko。
食品包装におけるナノマテリアルの応用
J Nanosci Nanotechnol, 15 (9) (2015), pp.6357-6372
CrossRefView レコードをScopusGoogle Scholarで見る
ブゼア、ブランディーノ、ロビー、2007年
C ブゼア、P ブランディーノ II、K ロビー
ナノマテリアルとナノ粒子。発生源と毒性
バイオインターフェーズ, 2 (4) (2007), pp.MR17-MR172
CrossRefGoogle Scholar
カンポスら, 2022
D Campos、R Goméz-García、D Oliveira、AR. マドゥレイラ
ナノ粒子の摂取と腸内細菌叢への影響:試験管内および動物モデルで検証可能
腸内細菌叢, 3 (2022), pp.1-16
ScopusGoogle Scholarで記録を見る
カラボッティら、2015
M Carabotti、A Scirocco、MA Maselli、C. Severi
腸脳軸:腸内細菌叢、中枢神経系および腸管神経系の間の相互作用
Ann Gastroenterol, 28 (2) (2015), pp.203-209
ScopusGoogle Scholarで記録を見る
キャトロン、ガバラ、タル、2019年
TRキャトロン、Sガバラ、T.タル
ゼノバイオティクスと微生物叢の相互作用を調べるためのゼブラフィッシュの使用
カレント・ファーマコロジー・リポート, 5 (6) (2019), pp.468-480
CrossRefView レコードをScopusGoogle Scholarで見る
Cattòら、2019年
C Cattò、E Garuglieri、L Borruso、D Erba、MC Casiraghi、F Cappitelli、F Villa、S Zecchin、R. Zanchi
食餌性銀ナノ粒子およびプロバイオティクス投与がin-vitro腸内モデルの微生物叢に与える影響
エンバイロン・ポルット, 245 (2019), pp.754-763
ArticleDownload PDFView Record in ScopusGoogle Scholar
チェら、2019
Y Chae、D Kim、M-J Choi、Y Cho、Y-J. An
ナノサイズプラスチックの食事暴露によるシロエビLitopenaeus vannameiの栄養価および腸内細菌叢に与える影響
エンバイロン・イント, 130 (2019), 記事 104848
ArticleDownload PDFView Record in ScopusGoogle Scholar
チェンら, 2013
H Chen, B Wang, D Gao, M Guan, L Zheng, H Ouyang, Z Chai, Y Zhao, W. Feng (チェン、ワン、Dガオ、Mグアン、Lチェン、Hオウヤン、Zチャイ、Yザオ、Wフォング
カーボンナノチューブのヒト腸内細菌に対する広範な抗菌活性
Small, 9 (16) (2013), pp.2735-2746
CrossRefView レコードをScopusGoogle Scholarで見る
チェンら、2017a
H Chen, R Zhao, B Wang, Cai, L Zheng, H Wang, M Wang, H Ouyang, X Zhou, Z. Chai
経口投与したAg、TiO2、SiO2ナノ粒子の腸内細菌叢組成と大腸炎誘発に対するマウスへの影響
ナノインパクト, 8 (2017), pp.80-88
ArticleDownload PDFView Record in ScopusGoogle Scholar
チェンら、2018a
H Chen, R Zhao, B Wang, L Zheng, H Ouyang, H Wang, X Zhou, D Zhang, Z Chai, Y. Zhao
単層カーボンナノチューブの急性経口投与は、腸管透過性と炎症反応を増加させる。マウスにおける腸内細菌叢の変化との関連性
Adv Healthc Mater, 7 (13) (2018), 記事 1701313
CrossRefView Record in ScopusGoogleスカラー
チェンら、2020
j Chen、S Zhang、C Chen、X Jiang、J Qiu、Y Qiu、Y Zhang、T Wang、X Qin、Zou、C Chen
酸化亜鉛ナノ粒子経口曝露による神経行動障害における腸内細菌叢と血清・海馬の代謝物のクロストーク
ナノスケール, 12 (41) (2020), pp.21429-21439
CrossRefView Record in ScopusGoogleスカラー
チェンら、2018b
L Chen、Y Guo、C Hu、PK Lam、JC Lam、B. Zhou
二酸化チタンナノ粒子とビスフェノールAへの慢性的な共曝露による腸内細菌叢のディスバイオシス:ゼブラフィッシュにおける宿主の健康へのインプリケーション
エンバイロン・ポルット, 234 (2018), pp.307-317
ArticleDownload PDFView Record in ScopusGoogle Scholar
チェンら, 2017b
Q-j Chen、X-m Zheng、L-l Zhou、X-f Dong、J-h Wang。
ナノスターチとその食品産業への応用に関する研究
フード&マシナリー、7(2017)、47-60頁
ScopusGoogle Scholarで記録を見る
チェンら、2019a
Zチェン、Sハン、D周、S周、G.ジア
二酸化チタンナノ粒子の経口曝露が生体内の腸内細菌叢と腸管関連代謝に及ぼす影響
ナノスケール, 11 (46) (2019), pp.22398-22412
CrossRefView レコードをScopusGoogle Scholarで見る
チェンら、2019b
Zチェン、D周、Sハン、S周、G.ジア
二酸化チタンナノ粒子経口投与後のラットの肝毒性および腸肝軸の役割について
パート・ファイバー・トキシコル, 16 (1) (2019), pp.1-17
Google Scholar
チン-チャン、ナバロ-イェペス、キンタニラ-ベガ, 2015
M Chin-Chan、J Navarro-Yepes、B.Quintanilla-Vega。
神経変性疾患のリスクファクターとしての環境汚染物質。アルツハイマー病とパーキンソン病
細胞神経科学のフロンティア, 9 (2015), pp.1-22
ScopusGoogle Scholarで記録を見る
クリストファーセンら、2016
DV Christophersen、NR Jacobsen、MH Andersen、SP Connell、KK Barfod、MB Thomsen、MR Miller、R Duffin、J Lykkesfeldt、U. Vogel
ApoE欠損マウスにおける多層カーボンナノチューブの経口および肺曝露による心血管健康への影響
トキシコロジー, 371 (2016), pp.29-40
記事ダウンロードPDFView Record in ScopusGoogle Scholar
チュパニ、バルタ、ズスコバ、2019年
Lチュパニ、Jバルタ、E.ズスコバ
食品由来のZnOナノ粒子がコイ(Cyprinus carpio L.)の腸内細菌叢に与える影響
エンバイロン・サイ・ポリュート・レズ, 26 (25) (2019), pp.25869-25873
CrossRefView Record in ScopusGoogleスカラー
コーエン、デロイド、デモクリトウ、2015年
JMコーエン、GMデロイド、P.デモクリトゥー
人工ナノ材料のin vitro線量測定の批判的レビュー
ナノメディシン, 10 (19) (2015), pp.3015-3032
CrossRefView Record in ScopusGoogleスカラー
クエバら、2019
C Cueva、I Gil-Sánchez、A Tamargo、B Miralles、J Crespo、B Bartolomé、MV. モレノ-アリーバス
GastroIntestinal tract(simgi®)の動的SIMulatorを用いた食品用銀ナノ粒子の消化作用。ヒト腸内細菌叢への影響
Food Chem Toxicol, 132 (2019), 記事 110657
ArticleDownload PDFView Record in ScopusGoogle Scholar
クーシェンら、2014
M Cushen、J Kerry、M Morris、M Cruz-Romero、E. Cummins
ポリエチレンナノコンポジットから食品への銀および銅ナノ粒子の移行と関連する暴露評価の評価とシミュレーション
ジャーナル オブ アグリカルチュラル アンド フード ケミストリー, 62 (6) (2014), pp.1403-1411
CrossRefView レコードをScopusGoogle Scholarで見る
ダスら、2014
P Das, JA McDonald, EO Petrof, E Allen-Vercoe, VK. ウォーカー
ナノシルバーメディエイトによるヒト腸内細菌叢の変化
J Nanomed Nanotechnol, 5 (5) (2014), p. 1
Google Scholar
デビアら, 2016
M Debia、B Bakhiyi、C Ostiguy、JH Verbeek、DH Brouwer、V. Murashov
報告された人工ナノ材料への曝露に関するシステマティックレビュー
アン・オキュップ・ハイグ, 60 (8) (2016), pp.916-935
CrossRefView Record in ScopusGoogleスカラー
デッカーズら, 2011
S Dekkers、P Krystek、RJ Peters、DP Lankveld、BG Bokkers、PH van Hoeven-Arentzen、H Bouwmeester、AG. オーメン
食品中のナノシリカの存在とリスク
ナノトキシコロジー, 5 (3) (2011), pp.393-405
CrossRefView レコードをScopusGoogle Scholarで見る
デロイドら、2017
GM DeLoid、JM Cohen、G Pyrgiotakis、P. Demokritou
分散した人工ナノ材料の調製、特性評価、およびin vitro線量測定
ネイチャープロトコル, 12 (2) (2017), pp.355-371
CrossRefView Record in ScopusGoogleスカラー
ドゥデフォイら、2017
W Dudefoi、K Moniz、E Allen-Vercoe、M-H Ropers、VK. ウォーカー
食品グレードとナノTiO2粒子がヒトの腸内環境に与える影響
フードケム・トキシコール、106(2017)、242-249頁
ArticleDownload PDFView Record in ScopusGoogle Scholar
Đuraševićら、2020年
S Đurašević, G Nikolić, A Todorović, D Drakulić, S Pejić, V Martinović, D Mitić-Ćulafić, D Milić, TJ Kop, N. Jasnić
フラーレンC60の補給がラットの腸内細菌叢およびグルコースと脂質のホメオスタシスに及ぼす影響
フードケムトキシコール(2020)、記事111302
ArticleDownload PDFView Record in ScopusGoogle Scholar
EFSA 2016
EFSA
食品添加物としての二酸化チタン(E 171)の再評価
EFSA J, 14 (9) (2016), p. e04545
Google Scholar
エルデリーら, 2013
A Erdely、M Dahm、BT Chen、PC Zeidler-Erdely、JE Fernback、ME Birch、DE Evans、ML Kashon、JA Deddens、T Hulderman、SA Bilgesu、L Battelli、D Schwegler-Berry、HD Leonard、W McKinney、DG Frazer、JM Antonini、DW Porter、V Castranova、MK. Schubauer-Berigan
カーボンナノチューブの線量測定:職場暴露評価から吸入毒性学まで
Part Fibre Toxicol, 10 (1) (2013), pp.1-14
ScopusGoogle Scholarで記録を見る
Fengら、2017年
Y Feng、L Min、W Zhang、J Liu、Z Hou、M Chu、L Li、W Shen、Y Zhao、H. Zhang
酸化亜鉛ナノ粒子は回腸消化物の微生物叢に影響を与え、血中代謝産物とよく相関する
フロント・マイクロバイオル, 8 (2017), pp.992-1002
ScopusGoogle Scholarで記録を見る
フレーリッヒ EEFröhlich, 2016
Eフレーリッヒ EEFröhlich
食品に含まれるナノ粒子の腸内細胞および腸内細菌叢に対する細胞毒性
Int J Mol Sci, 17 (4) (2016), p. 509
Google Scholar
フー、ヴァーリ、リン、2005
G Fu、PS Vary、C-T.Lin
抗菌性コーティングのためのアナターゼ型TiO2ナノコンポジット
J Phys Chem B, 109 (18) (2005), pp.8889-8898
CrossRefView レコードをScopusGoogle Scholarで見る
ガンガドゥーら, 2019
S ガンガドゥー、BW バウアー、YS バジャガイ、TTH バン、RJ ムーア、D. スタンレー
セレンナノ粒子による腸内細菌叢の試験管内増殖
Anim Nutr, 5 (4) (2019), pp.424-431
ArticleDownload PDFView Record in ScopusGoogle Scholar
ガンガドゥーら, 2018
S Gangadoo、I Dinev、J Chapman、RJ Hughes、TTH Van、RJ Moore、D. Stanley
家禽飼料中のセレンナノ粒子は腸内細菌叢を修正し、Faecalibacterium prausnitziiの存在量を増加させる
Appl Microbiol Biotechnol, 102 (3) (2018), pp.1455-1466
CrossRefView Record in ScopusGoogleスカラー
ギャレット、2019
WS. ギャレット
腸内細菌叢と大腸がん
サイエンス, 364 (6446) (2019), pp.1133-1135
CrossRefView Record in ScopusGoogleスカラー
ゲーキングら, 2014
MB Geuking、Y Köller、S Rupp、KD. マッコイ
腸内細菌叢と免疫系の相互作用
腸内細菌, 5 (3) (2014), pp.411-418
CrossRefGoogle Scholar
ゴクーランら、2018
K Gokulan、AZ Bekele、KL Drake、S. Khare
銀ナノ粒子に対する腸内ビロームの反応:古典的なウイルス学、全ゲノム配列およびバイオインフォマティクスアプローチによる安全性評価
Int J Nanomedicine, 13 (2018), pp.2857-2867
CrossRefView Record in ScopusGoogleスカラー
グッドリッチ・ジュリアら, 2014
K Goodrich Julia, C Di Rienzi Sara, C Poole Angela, O Koren, A Walters William, JG Caporaso, R Knight, E Ley Ruth
マイクロバイオーム研究の実施
セル, 158 (2) (2014), pp.250-262
Google Scholar
グーら、2020年
H Gu、S Wang、X Wang、X Yu、M Hu、W Huang、Y. Wang
ナノプラスチックは大型イシモチ幼魚Larimichthys croceaの腸の健康を損なう
J Hazard Mater, 397 (2020), pp.1-8
CrossRefGoogle Scholar
ハドラップら, 2012
N Hadrup, K Loeschner, A Bergström, A Wilcks, X Gao, U Vogel, HL Frandsen, EH Larsen, HR Lam, A. Mortensen
ナノ粒子およびイオン性銀のラットにおける亜急性経口毒性試験
Arch Toxicol, 86 (4) (2012), pp.543-551
CrossRefView Record in ScopusGoogle Scholar
ハンら、2014
X Han、B Geller、K Moniz、P Das、AK Chippindale、VK. ウォーカー
ショウジョウバエとそのマイクロバイオームにおける銅と銀のナノ粒子曝露の発達への影響のモニタリング
サイエンス・オブ・ザ・トータル・エンバイロメント, 487 (2014), pp.822-829
記事ダウンロードPDFViewレコードin ScopusGoogle Scholar
ハンら、2010
XY Han、WL Du、CL Fan、ZR. Xu
銅含有キトサンナノ粒子を添加した飼料を摂取したラットの腸内細菌叢の組成と代謝の変化
J Anim Physiol Anim Nutr, 94 (5) (2010), pp.e138-e144
CrossRefView Record in ScopusGoogle Scholar
ハインリッツ、モーゼンタイン、ワイス、2013年
SNハインリッツ、Rモセンティン、E.ワイス
ヒトの腸内細菌叢の食事調節に関する研究のための潜在的なモデルとしての豚の使用
栄養研究レビュー, 26 (2) (2013), pp.191-209
ScopusGoogle Scholarで記録を見る
ホフマンら, 2017
S Hoffmann、RB de Vries、ML Stephens、NB Beck、HA Dirven、JR Fowle、JE Goodman、T Hartung、I Kimber、MM. ラル
毒性学におけるシステマティックレビューの入門書
アーカイブス・オブ・トキシコロジー, 91 (7) (2017), pp.2551-2575
CrossRefView Record in ScopusGoogleスカラー
ホソーン、2014
LA. Hothorn
毒性学的バイオアッセイの統計的評価-レビュー
トキシコロジー・リサーチ, 3 (6) (2014), pp.418-432
ScopusGoogle Scholarで記録を見る
ハウら、2013
K Howe、MD Clark、CF Torroja、J Torrance、C Berthelot、M Muffato、JE Collins、S Humphray、K McLaren、L. Matthews
ゼブラフィッシュの参照ゲノム配列とそのヒトゲノムとの関係
ネイチャー, 496 (7446) (2013), pp.498-503
CrossRefView レコードをScopusGoogle Scholarで見る
ジャヴレックら, 2017
AB Javurek、D Suresh、WG Spollen、ML Hart、SA Hansen、MR Ellersieck、NJ Bivens、SA Givan、A Upendran、R. Kannan
銀ナノ粒子曝露ラットにおける腸内細菌異常と神経行動変化
サイ・レップ、7(1)(2017)、pp.1-15
Google Scholar
ジアら、2019
P-P Jia、T Sun、M Junaid、Y-H Xiong、Y-Q Wang、L Liu、S-Y Pu、D-S. ペイ
酸化グラフェン(GO)の慢性曝露は、ゼブラフィッシュの炎症を誘発し、腸内細菌叢を差別的に撹乱した
エンバイロン・サイ・ナノ, 6 (8) (2019), pp.2452-2469
CrossRefView Record in ScopusGoogleスカラー
ジョンソンCCOwnby, 2017
DR Johnson CCOwnby(ジョンソン・シーコウンビー
乳児の腸内細菌叢と小児喘息およびアレルギー疾患のリスク
トランスレーショナルリサーチ、179(2017)、60-70頁
Google Scholar
ジュウら, 2020
Z Ju、G Ren、M Zhou、J Jing、J Xiang、X Liu、R Huang、P-K. Zhou
シリカナノ粒子と低線量放射線の組み合わせへの曝露は、腸内細菌叢の調節を介してマウスの肺線維症を悪化させる
エンバイロン・サイ・ナノ, 7 (12) (2020), pp.3979-3998
CrossRefView Record in ScopusGoogleスカラー
カーンら、2019
STカーン、Sサリーム、Mアハメド、J.アハマド
チョコレートからの食品グレードのナノ粒子の存在下でのプロバイオティクス細菌の生存:in vitroおよびin vivo研究
Appl Microbiol Biotechnol, 103 (16) (2019), pp.6689-6700
CrossRefView レコードをScopusGoogle Scholarで見る
カレら、2020年
S Khare、GM DeLoid、RM Molina、K Gokulan、SP Couvillion、KJ Bloodsworth、EK Eder、AR Wong、DW Hoyt、LM Bramer、TO Metz、BD Thrall、JD Brain、P. Demokritou
ナノセルロースの摂取がWistar Hanラットの腸内細菌叢とホメオスタシスに与える影響
ナノインパクト, 18 (2020), Article 100216
記事ダウンロードPDFViewレコードin ScopusGoogle Scholar
コルバら, 2020
N Kolba、Z Guo、FM Olivas、GJ Mahler、E. Tako
TiO2、SiO2、およびZnOナノ粒子の羊水内投与(Gallus gallus)はブラシボーダー膜機能に影響を与え、腸内細菌叢の集団を変化させる
Food Chem Toxicol, 135 (2020), pp.1-38
Google Scholar
ラマスら, 2020
B Lamas、N Martins Breyner、E Houdeau
食品由来無機ナノ粒子の腸内細菌-免疫軸への影響:宿主の健康への潜在的影響
パート・ファイバー・トキシコル, 17 (2020), pp.1-22
CrossRefGoogle Scholar
リーら、2012
Y Lee, P Kim, J Yoon, B Lee, K Choi, K-H Kil, K. Park
銀ナノ粒子単回静脈注射後28日経過したウサギにおける銀の血清動態、分布および排泄量
ナノトキシコロジー, 7 (6) (2012), pp.1120-1130
CrossRefGoogle Scholar
ライスト、エフレモワ、カレマン、2010年
Mライスト、Lエフレモバ、C.カレマン
毒性学における基本的な試験法記述のための考察とガイドライン。動物実験に代わる方法
ALTEX, 27 (4) (2010), pp.309-317
CrossRefView レコードをScopusGoogle Scholarで見る
リー、タン、シュエ、2019a
J Li、M Tang、Y. Xue
銀ナノ粒子曝露の腸内細菌への影響に関する総説
J Appl Toxicol, 39 (1) (2019), pp.27-37
Google Scholar
リーら、2017
J Li、H Chen、B Wang、C Cai、X Yang、Z Chai、W. Feng
ZnOナノ粒子は、腸の恒常性維持とNrf2シグナルの活性化により、DSS誘発潰瘍性大腸炎マウスにおける支持療法として作用する
サイ・レップ、7(1)(2017)、pp.1-11
記事ダウンロードPDFGoogle Scholar
リーら、2018a
J Li, R Lei, X Li, F Xiong, Q Zhang, Y Zhou, S Yang, Y Chang, K Chen, W. Gu.
フラーレンナノ粒子の生体内腸内細菌叢の調整を介した抗高脂血症作用について
パート・ファイバー・トキシコル, 15 (1) (2018), pp.1-11
記事ダウンロードPDFGoogle Scholar
リーら、2018b
J Li, S Yang, R Lei, W Gu, Y Qin, S Ma, K Chen, Y Chang, X Bai, S. Xia(李、楊、R黎、W顧、Y秦、S馬、陳、Y張、X白、S夏
ルチル型およびアナターゼ型TiO 2ナノ粒子の経口投与は、マウス腸内細菌叢の構造をシフトさせる
ナノスケール, 10 (16) (2018), pp.7736-7745
CrossRefView レコードをScopusGoogle Scholarで見る
リーら、2020年
M Li、F Li、Z Lu、Y Fang、J Qu、T Mao、H Wang、J Chen、B. Li
カイコ(Bombyx mori)の腸内細菌組成に及ぼす酸化チタンナノ粒子の影響
Sci Total Environ, 704 (2020), Article 135273
ArticleDownload PDFView Record in ScopusGoogle Scholar
リーら、2019b
X Li、Y Zhang、B Li、J Cui、N Gao、H Sun、Q Meng、S Wu、J Bo、L Yan、J Wu、R. Chen。
プレバイオティクスはアナターゼ型酸化チタンナノ粒子が誘発する微生物叢を介した大腸バリア欠損から保護する
ナノインパクト, 14 (2019), 記事 100164
記事ダウンロードPDFViewレコードin ScopusGoogle Scholar
リプシッチ、チェトゲン、コーエン、2010年
Mリプシッチ、ETチェトゲン、T.コーエン
ネガティブコントロール:観察研究における交絡とバイアスを検出するためのツール
Epidemiology (Cambridge, Mass), 21 (3) (2010), pp.383-388.
ScopusGoogle Scholarで記録を見る
ロペス、ストロンメ、フェラーズ、2020年
VR Lopes、M Strømme、N. Ferraz
ナノセルロース繊維のヒト腸内細菌および消化管細胞に対するin vitro生物学的影響
ナノマテリアルズ, 10 (6) (2020), pp.1159-1174
CrossRefView レコードをScopusGoogle Scholarで見る
ロザノら、2018
VL Lozano、N Defarge、L-M Rocque、R Mesnage、D Hennequin、R Cassier、JS de Vendômois、J-M Panoff、G-E Séralini、C. アミエル
ラウンドアップがラットの腸内細菌に与える性差の影響
トキシコロジー・リポート、5(2018)、96-107頁
記事ダウンロードPDFViewレコードin ScopusGoogle Scholar
マーら、2020年
J Ma、Q-L Chen、P O'Connor、GD Sheng
土壌のCuOナノ粒子汚染はEnchytraeus crypticusの腸内細菌叢とレジストメを変化させるか?
Environ Pollut, 256 (2020), Article 113463
ArticleDownload PDFView Record in ScopusGoogle Scholar
マーら、2018
Y Ma、L Song、Y Lei、P Jia、C Lu、J Wu、C Xi、PR Strauss、D-S. ペイ
ゼブラフィッシュの腸内細菌叢に対する銀ナノ粒子の性差効果
エンバイロン・サイ・ナノ, 5 (3) (2018), pp.740-751
CrossRefView Record in ScopusGoogleスカラー
マクファーベ、2012年
DF. マクファーベ
腸内細菌群の短鎖脂肪酸発酵産物:自閉症スペクトラム障害における含意
健康と疾患における微生物生態学, 23 (1) (2012), p. 19260
Google Scholar
メリフィールドら, 2013
DLメリフィールド、BJショー、GMハーパー、IPサウド、SJデイヴィス、RDハンディ、TB. ヘンリー
金属ナノ粒子で汚染された食物の摂取は、ゼブラフィッシュ(Danio rerio)の内因性微生物叢を破壊する。
エンバイロン・ポルット, 174 (2013), pp.157-163
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
モレノ-インディアスら、2014年
I Moreno-Indias, F Cardona, FJ Tinahones, MI. ケイポ・オルトゥーニョ
肥満と2型糖尿病の発症に及ぼす腸内細菌叢の影響
フロント・マイクロバイオル, 5 (2014), pp.190-200
ScopusGoogle Scholarで記録を見る
ムーら、2019
W Mu、Y Wang、C Huang、Y Fu、J Li、H Wang、X Jia、Q.Ba。
食餌性酸化チタンナノ粒子の長期摂取がマウスの腸の炎症に与える影響
J Agric Food Chemy, 67 (33) (2019), pp.9382-9389
CrossRefView レコードをScopusGoogle Scholarで見る
ネンマルら、2002
A Nemmar、PM Hoet、B Vanquickenborne、D Dinsdale、M Thomeer、M Hoylaerts、H Vanbilloen、L Mortelmans、B. Nemery
ヒトにおける吸入粒子の血液循環中への移行について
Circulation, 105 (4) (2002), pp.411-414.
Google Scholar
グエン、リン、ムスタファ、2015年
TH Nguyen、M Lin、A. Mustapha
腸内細菌とCaco-2細胞に対する酸化グラフェンの毒性
J Food Prot, 78 (5) (2015), pp.996-1002
ScopusGoogle Scholarで記録を見る
パッツィウら, 2020
D Patsiou、C del Rio-Cubilledo、AI Catarino、S Summers、AM Fahmi、D Boyle、TF Fernandes、TB. ヘンリー
鉛ハロゲン化ペロブスカイトナノ粒子への曝露は、生物学的利用可能な鉛を供給できるが、ゼブラフィッシュの内因性腸内細菌叢を変化させない
Sci Total Environ, 715 (2020), pp.1-12
Google Scholar
ピアースら, 2018
SC Pearce、HG Coia、JP Karl、IG Pantoja-Feliciano、NC Zachos、K. Racicot
宿主-マイクロバイオーム相互作用と急性ストレス因子を研究するための腸内in vitroおよびex vivoモデル
フロントフィジオール, 9 (2018), p.1584
ScopusGoogle Scholarで記録を見る
ペイら、2019
X Pei、Z Xiao、L Liu、G Wang、W Tao、M Wang、J Zou、D. Leng
離乳豚の成長成績、亜鉛の状態、腸の形態、微生物叢の集団、免疫反応に対する酸化亜鉛ナノ粒子の食事による補給の影響
J Sci Food Agric, 99 (3) (2019), pp.1366-1374.
CrossRefView Record in ScopusGoogleスカラー
ペレイラら、2014
DIA Pereira、SFA Bruggraber、N Faria、LK Poots、MA Tagmount、MF Aslam、DM Frazer、CD Vulpe、GJ Anderson、JJ. パウエル
ナノ粒子化したオキソ水酸化鉄は、ヒトによく吸収され利用される安全な鉄を供給する。
ナノメッド-ナノテクノ, 10 (8) (2014), pp.1877-1886
記事ダウンロードPDFViewレコードin ScopusGoogle Scholar
ピエトロイウスティら, 2017
A Pietroiusti, E Bergamaschi, M Campagna, L Campagnolo, G De Palma, S Iavicoli, V Leso, A Magrini, M Miragoli, P. Pedata.
人工ナノ材料と胃腸管の相互作用の職業的関連性が認識されていないこと:学際的ワーキンググループからのコンセンサスペーパー
粒子・繊維毒性学,14(1)(2017),pp.1-23
Google Scholar
ピンゲットら, 2019
G Pinget、J Tan、B Janac、NO Kaakoush、AS Angelatos、J O'Sullivan、YC Koay、F Sierro、J Davis、SK. Divakarla
食品添加物である二酸化チタン(E171)が腸内細菌-宿主間相互作用に与える影響
フロント・ニュートリ、6(2019)、pp.1-13
グーグル・スカラー
プラダンら, 2016
S Pradhan, J Hedberg, E Blomberg, S Wold, I Odnevall Wallinder(プラダン、Jヘドベリ、Eブロムベリ、Sウォルド、Iオドネバルワリンダー
非機能化非不活性金属ナノ粒子の粒子分散、投与量、金属放出に及ぼす超音波処理の影響
ナノパーティクルリサーチ誌, 18 (9) (2016), p.285
ScopusGoogle Scholarで記録を見る
ラドゥーシンら、2016
TI Radusin、IS Ristić、BM Pilić、AR. ノヴァコヴィッチ
食品包装アプリケーションのための抗菌ナノマテリアル
フード・レス, 43 (2) (2016), pp.119-126
ScopusGoogle Scholarで記録を見る
ラジヴィル=ビエンコウスカら, 2018
JM Radziwill-Bienkowska、P Talbot、JB Kamphuis、V Robert、C Cartier、I Fourquaux、E Lentzen、J-N Audinot、F Jamme、M. Réfrégiers
腸内常在菌および一過性の食中毒菌に対する食品用TiO2の毒性:ナノSIMSおよびシンクロトロンUV蛍光イメージングを用いた新しい洞察
フロント・マイクロバイオル、9(2018)、pp.1-14
グーグル・スカラー
ロンペルベルクら, 2016
C Rompelberg、MB Heringa、G van Donkersgoed、J Drijvers、A Roos、S Westenbrink、R Peters、G van Bemmel、W Brand、AG. Oomen
オランダ人による食品、食品サプリメントおよび歯磨き粉からの二酸化チタンおよびそのナノフラクションの経口摂取量
ナノトキシコロジー, 10 (10) (2016), pp.1404-1414
CrossRefView レコードをScopusGoogle Scholarで見る
ローランドら、2018
I Rowland、G Gibson、A Heinken、K Scott、J Swann、I Thiele、K. Tuohy
腸内細菌叢の機能:栄養素とその他の食品成分の代謝
ヨーロッパ栄養学雑誌, 57 (1) (2018), pp.1-24
CrossRefGoogle Scholar
RSRAE 2004
RSRAE
ナノサイエンスとナノテクノロジー。チャンスと不確実性
英国王立協会&英国王立工学アカデミー、ロンドン (2004)
Google Scholar
セイズ、リード、ウォーハイト、2007a
CMセイズ、KLリード、DB.Warheit
微粒子およびナノ粒子の毒性評価:in vitro 測定と in vivo 肺毒性プロファイルの比較
毒性科学, 97 (1) (2007), pp.163-180
CrossRefView レコードをScopusGoogle Scholarで見る
セイズら, 2007b
CMセイズ、AAマルキオーネ、KLリード、DB.Warheit
ラットにおけるC60水懸濁液の比較肺毒性評価。 フラーレンの毒性は、in vitro のプロファイルとは対照的に、in vivo ではほとんど差がない。
ナノレターズ, 7 (8) (2007), pp.2399-2406
CrossRefView Record in ScopusGoogleスカラー
セアブラら, 2018
CL Seabra、C Nunes、M Brás、M Gomez-Lazaro、CA Reis、IC Gonçalves、S Reis、MCL. マルティンス
腸内細菌叢に影響を与えずに胃の感染症に対抗する脂質ナノ粒子
Eur J Pharm Biopharm, 127 (2018), pp.378-386
ArticleDownload PDFView Record in ScopusGoogle Scholar
ソンら、2018
R ソン、J ヤオ、Q シー、R ウェイ
ハーフフィンアンチョビ加水分解物/酸化亜鉛ナノ粒子のナノ複合体は実際の無毒性を示し、マウスの腸内細菌叢、短鎖脂肪酸産生および酸化状態を調節する
マリンドラッグ, 16 (1) (2018), p.23
CrossRefView レコードをScopusGoogle Scholarで見る
スーティリら、2019
FJ Sutili、LC Kreutz、FC Flores、da Silva CdB、KS Kirsten、Voloski APdS、R Frandoloso、CG Pinheiro、BM Heinzmann、Baldisserotto
シトラール担持ナノ構造システムの食餌補充がシルバーキャットフィッシュ(Rhamdia quelen)の自然免疫反応と腸内細菌叢に与える影響
J Funct Foods, 60 (2019), 記事 103454
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
スウェン・グヴァン・アメルスヴォルト、2009年
L. Swaen Gvan Amelsvoort(スウェン・グヴァン・アメルスヴォート
因果関係推論への証拠の重み付けアプローチ
臨床疫学雑誌, 62 (3) (2009), pp.270-277
Google Scholar
Swartら, 2020a
E Swart, T Goodall, P Kille, DJ Spurgeon, C.Svendsen(イー・スワート、ティー・グッドオール、ピー・キレ、DJスパージョン、C.スベンセン
ミミズのマイクロバイオームは、殺生物性金属ナノ粒子への曝露に対して回復力がある
エンバイロン・ポリュート、267(2020)、pp.1-14
Google Scholar
スワートら, 2020b
E Swart、J Dvorak、S Hernádi、T Goodall、P Kille、D Spurgeon、C Svendsen、P. Prochazkova
酸化銅ナノ粒子の生体内曝露がミミズの腸内細菌叢、宿主免疫、細菌感染症感受性に与える影響
ナノマテリアルズ, 10 (1337) (2020), pp.1-21
ScopusGoogle Scholarで記録を見る
タルボットら, 2018
P Talbot, JM Radziwill-Bienkowska, JB Kamphuis, K Steenkeste, S Bettini, V Robert, M-L Noordine, C Mayeur, E Gaultier, P. Langella(P.ランジェラ
食品用酸化チタンはin vitroで腸管粘液に捕捉されるが、in vivoではムチンO-グリコシル化および短鎖脂肪酸合成を損なわない:腸管バリア保護への影響
J Nanobiotechnology, 16 (1) (2018), pp.1-14
Google Scholar
テイラーら, 2015
AAテイラー、IMマーカス、RLガイシ、SL.ウォーカー
金属酸化物ナノ粒子は、モデル大腸腸内細菌叢の最小限の表現型変化を誘発する
エンバイロン・エンジン・サイ、32 (7) (2015), pp.602-612
CrossRefView Record in ScopusGoogleスカラー
ウテンベ WKamng'ona、2021年
AW ウテンベ WKamng'ona(ウテンベ・ワカミングオナ
腸内細菌叢を介したヒトの農薬毒性:農薬のリスク評価における方法論的な問題点と課題
ケモスフィア (2021), Article 129817
グーグルスカラー
ヴァマヌら, 2018
E Vamanu、M Ene、B Biță、C Ionescu、L Crăciun、I. Sârbu
キノコ抽出物で生合成した銀ナノ粒子への曝露に対するin vitroヒト微生物叢の反応
ニュートリエンツ, 10 (607) (2018), pp.1-12
CrossRefGoogle Scholar
ヴァン・デン・ブリュレら, 2015
S Van Den Brûle, J Ambroise, H Lecloux, C Levard, R Soulas, P-J De Temmerman, M Palmai-Pallag, E Marbaix, D. Lison(英語)。
食餌性銀ナノ粒子はマウスの腸内細菌叢を撹乱することができる
パート・ファイバー・トキシコル、13(1)(2015)、pp.1-16
Google Scholar
ヴェルムルガン, 2018
G.ヴェルムルガン
医薬品や化学物質の毒性学的リスク評価における腸内細菌叢。時代のニーズ
腸内細菌, 9 (5) (2018), pp.465-468
ScopusGoogle Scholarで記録を見る
ウォーラー、チェン、ウォーカー、2017
T ウォラー、C チェン、SL. ウォーカー
食品および工業用グレードの二酸化チタンは腸内細菌叢に影響を与える
エンバイロン・エンジェル・サイ、34 (8) (2017), pp.537-550
CrossRefView レコードをScopusGoogle Scholarで見る
ワンら、2012
M-Q Wang, Y-J Du, C Wang, W-J Tao, Y-D He, H. Li.
離乳子豚の腸内細菌叢と形態に及ぼす銅担持キトサンナノ粒子の影響
生物微量元素研究, 149 (2) (2012), pp.184-189
Google Scholar
ウィアーら, 2012a
A Weir, P Westerhoff, L Fabricius, K Hristovski, N von Goetz(ウィアー、Pウェスターホフ、Lファブリキウス、Kフリストフスキー、Nフォンゲッツ
食品およびパーソナルケア製品に含まれる二酸化チタン・ナノ粒子
環境科学と技術, 46 (4) (2012), pp.2242-2250
CrossRefView レコードをScopusGoogle Scholarで見る
ウィアーら、2012b
A Weir, P Westerhoff, L Fabricius, K Hristovski, N Von Goetz(ウィアー、Pウェスターホフ、Lファブリキウス、Kフリストフスキー、Nフォン・ゲッツ
食品およびパーソナルケア製品に含まれる二酸化チタン・ナノ粒子
環境科学技術, 46 (4) (2012), pp.2242-2250
CrossRefView レコードをScopusGoogle Scholarで見る
ワイルディングら, 2016
LA Wilding、CM Bassis、K Walacavage、S Hashway、PR Leroueil、M Morishita、AD Maynard、MA Philbert、IL. Bergin
サイズとコーティングが異なる銀ナノ粒子の反復投与(28日間)は、マウス腸内常在菌に有意な変化を与えない
ナノトキシコロジー、10(5)(2016)、pp.513-520
CrossRefView Record in ScopusGoogleスカラー
ウィリアムズら、2015
K Williams、J Milner、MD Boudreau、K Gokulan、CE Cerniglia、S. Khare
Sprague-Dawley ラットの回腸における腸内細菌叢および腸管関連免疫反応に対する銀ナノ粒子の亜慢性曝露の影響
ナノトキシコロジー, 9 (3) (2015), pp.279-289
CrossRefView レコードをScopusGoogle Scholarで見る
Wuら、2020年
J Wu、C Li、J Zhang、NW Menzies、PM Bertsch、P Wang、PM. Kopittke
ナノ粒子を用いた濾紙からの銀の放出とマウス腸内細菌叢への影響
エンバイロン・サイ・ナノ, 7 (5) (2020), pp.1554-1565
CrossRefView Record in ScopusGoogleスカラー
Xia et al., 2017
T Xia、W Lai、M Han、X Ma、L. Zhang
食事性ZnOナノ粒子は、離乳子豚の腸内細菌叢と炎症反応を変化させる
オンコターゲット, 8 (39) (2017), pp.64878-64891
CrossRefView Record in ScopusGoogleスカラー
Xieら、2016年
Y Xie、B Wu、X-X Zhang、J Yin、L Mao、M. Hu
ハイスループットなシーケンシングにより決定されたマウス腸内の微生物群集と抗生物質耐性遺伝子に対するグラフェンの影響
ケモスフィア, 144 (2016), pp.1306-1312
記事ダウンロードPDFView Record in ScopusGoogle Scholar
ヤウシェバ、ミロシニコフ、シゾバ、2018年
Е ヤウシェヴァ、S ミロシュニコフ、Е.Sizova
ナノ粒子と金属塩を使用した後のブロイラー鶏の腸内マイクロバイオーム
エンバイロン・サイ・ポリュート・レズ, 25 (18) (2018), pp.18109-18120
CrossRefView レコードをScopusGoogle Scholarで見る
チャン、モーティマー、グオ、2020年
Y Zhang、M Mortimer、L-H. Guo
人工ナノ材料と微生物叢の相互作用
エンバイロン・サイ・ナノ, 7 (9) (2020), pp.2454-2485
CrossRefView レコードをScopusGoogle Scholarで見る
Zheng et al.
M Zheng、J Lu、G Lin、H Su、J Sun、T. Luan
ゼブラフィッシュ(Danio rerio)における3種類のグラフェン系材料の食餌暴露による腸内細菌叢のディスバイオーシス
エンバイロン・ポリュート、254(2019)、pp.1-10
ScopusGoogle Scholarで記録を見る
Zhuら, 2018
B-K Zhu、Y-M Fang、D Zhu、P Christie、X Ke、Y-G. Zhu
ナノプラスチックへの曝露は、土壌オリゴカイのEnchytraeus crypticusの腸内細菌叢を乱す
エンバイロン・ポルット, 239 (2018), pp.408-415
記事ダウンロードPDFGoogle Scholar
Zhuら、2017年
X Zhu、Y Han、J Du、R Liu、K Jin、W Yi
微生物叢-腸-脳軸と中枢神経系
オンコターゲット, 8 (32) (2017), pp.53829-53838
CrossRefView Record in ScopusGoogleスカラー
Zhuら、2020年
X Zhu、L Zhao、Z Liu、Q Zhou、Y Zhu、Y Zhao、X. Yang
二酸化チタンナノ粒子の長期暴露は、腸管粘液層の損傷と微生物叢の異常の悪化を通じて、食事誘発性肥満を促進する
ナノ・レス(2020)、pp.1-11
Google Scholar
引用元: (2)
グラフェン系ナノ材料と微生物群:生態毒性学からバイオプロセス工学の視点まで、その相互作用のレビュー
2022年、環境科学 ナノ
学術的なナノテクノロジー研究室:良い実践と学生の健康状態の調査
2022, Journal of Nanoparticle Research(ナノ粒子研究ジャーナル
