
腸-筋肉軸と敗血症誘発性ミオパシー:腸内細菌叢の役割の可能性
生物医学・薬理学
第163巻 2023年7月号 114837号
レビュー
腸-筋肉軸と敗血症誘発性ミオパシー:腸内細菌叢の役割の可能性
https://www.sciencedirect.com/science/article/pii/S0753332223006273?via%3Dihub
著者リンク open overlay panelYukun Liu a, Ligang Xu b, Zhaohui Yang c, Dongfang Wang b, Tianyu Li b, Fan Yang b, Zhanfei Li b, Xiangjun Bai b, Yuchang Wang b
もっと見る
概要
シェア
引用する
https://doi.org/10.1016/j.biopha.2023.114837Get 権利と内容
クリエイティブ・コモンズ・ライセンスに基づく
オープンアクセス
ハイライト
腸内細菌叢の異常は、敗血症と関連する合併症に重要な役割を果たします。
腸-骨格筋軸は、敗血症における臓器機能不全の重要なメカニズムであり、重要な治療ターゲットである。
腸-骨格筋軸は、敗血症によるミオパチーのメカニズムおよび治療ターゲットとなる可能性がある。
要旨
敗血症は、微生物が無視できない役割を果たす感染症に対する宿主の免疫反応障害と説明される。敗血症の生存者の多くは、骨格筋の萎縮、脱力、修復不可能な損傷/再生または機能不全を特徴とする、敗血症性ミオパシーとしても知られるICU後天性の脱力を経験する。敗血症によるミオパシーのメカニズムは、現在のところ不明である。この状態は、循環する病原体やそれに関連する有害因子によって引き起こされ、筋肉の代謝が損なわれると考えられてきました。敗血症とそれに伴う腸内細菌叢の変化は、骨格筋の消耗を含む敗血症関連臓器機能障害と関連しています。また、糞便微生物叢移植、経腸栄養剤における食物繊維やプロバイオティクスの添加など、細菌叢を標的とした介入により、敗血症関連ミオパシーの改善を目指した研究も行われている。本総説では、敗血症性ミオパシーの発症における腸内細菌叢の潜在的なメカニズムと治療の展望について、批判的に評価することとする。

前の記事
次の記事
キーワード
筋萎縮(きんいしゅく
アイキューブ
マイクロビオーム
感染症
敗血症によるミオパシー
はじめに
敗血症は、感染に対する宿主の反応不全によって引き起こされる生命を脅かす臓器機能障害である[1]。集中治療の発展に伴い、早期診断と積極的な治療により、敗血症患者の早期生存率は著しく向上している[2]。しかし、敗血症生存者のかなりの部分は慢性重症期(CCI)に進行し、その基礎となる病態と特徴として、持続性炎症・免疫抑制・異化症候群(PICS)[2]があり、長期にわたる臓器機能障害を引き起こすことがわかっています。PICSは、入院・退院後の予後不良(身体・認知機能の低下など)の病態メカニズムになりうるものです[3]、[4]。また、敗血症の後期における高い罹患率と死亡率の主な原因となっている[5], [6]。近年、骨格筋の機能不全が患者の長期予後に及ぼす影響が徐々に注目されるようになってきた [7], [8].
骨格筋の萎縮は、筋力や断面積の低下、衛星細胞量の減少、筋再生の障害などが主な特徴です[9]。現在、敗血症における骨格筋萎縮には複数のメカニズムが関与している可能性があることが分かっており、いくつかの研究では、神経筋接合部における神経入力の障害によってミオパシーが引き起こされる可能性があることが分かっています [10], [11]. また、敗血症における骨格筋の機能障害は、筋のミトコンドリア機能障害とも関連し、タンパク質の合成低下(活性酸素の過剰生成による)、タンパク質の分解促進(プロテアソーム蛋白の加水分解、オートファジー経路の強化による)が起こる[12]。筋由来の骨格筋幹細胞(サテライト細胞)は、骨格筋損傷後の再生・修復に必須である[13]。敗血症では、骨格筋組織におけるサテライト細胞の数が減少し、増殖能力が弱まり、機能的な筋管に分化できなくなり、再生障害が起こる [8], [9]. また、筋衛星細胞の減少や機能不全により、運動刺激に反応できなくなり、筋力低下を悪化させるため、敗血症性ミオパチーの重要なメカニズムの一つである[13]が、そのメカニズムについては、まださらなる解明が必要である。カテコールアミン [14], [15], ヒートショック [16], リポポリサッカライド [17] などのストレス源に対して、骨格筋は運動機能にとどまらず、インターロイキン-6などのサイトカイン(筋因子ともいう)を分泌する機能を持ち、敗血症の腹腔内感染における免疫・炎症反応に必須の役割を果たすことがわかってきた [18]. しかし、その制御機構はまだ不明である。
微生物叢は、数兆個の細菌、ウイルス、真菌、原生動物、古細菌で構成されている。ヒトのミクロフローラの原核生物ゲノムは、宿主ゲノム以外の一連の代謝能力をコード化し、ヒトの生理に不可欠なミクロフローラを形成している[19]。腸内フローラは、最も大きく、最も研究されている微生物群集である。ヒトの場合、消化管では動物細胞と細菌細胞の相互作用が重要である。健康な状態では、腸内細菌叢は宿主の免疫系の安定性に密接に関係しています[20]。腸内細菌叢は、宿主の代謝、免疫系の発達、病原体のコロニー形成に対する抵抗力において重要な役割を担っています。腸内フローラの乱れは、腸管調節障害として知られ、炎症性腸疾患や感染症など様々な疾患で予想されます[21], [22]. 哺乳類の免疫系は、宿主微生物群集の恒常性維持に重要な役割を担っています。同時に、細菌異常症は、宿主免疫と全身性炎症が継続的に存在する重要な原因でもあります [23], [24]。免疫系と敗血症の間の相互作用が知られていることから、微生物叢が関連する可能性があると考えられている [25], [26], [27].
最近の前臨床試験では、腸内微生物環境と骨格筋の間の複雑なクロストークが示されています [28], [29]。腸内細菌叢は、糖尿病、肥満、がんなど、さまざまな慢性疾患の発症に関与しています。腸の慢性炎症や悪液質など、異なる病態下で腸内フローラと骨格筋の相互作用が働くことが示唆されています。しかし、腸内フローラと骨格筋の相互作用は不明である [30], [31], [32]。本総説は、敗血症による筋障害と腸内細菌叢との相互作用に関する現在の証拠を批判的に評価し、敗血症における腸-骨格筋軸に関する今後の研究のための潜在的標的を特定することを目的としている。敗血症と腸内細菌叢のクロストーク
感染は初期傷害とその後の免疫異常の基礎であり、敗血症の有害な転帰の重要な決定要因の一つである。微生物学、特に腸内細菌叢は、この全体的な対応に不可欠なものとなっています。例えば、健康な腸内細菌叢を維持することで、腸内の病原体のコロニー形成に対する抵抗力をつけることができます。腸内細菌叢は、敗血症を引き起こす微生物の主な発生源である[33]。しかし、腸内細菌叢の乱れた状態、すなわち細菌異常症は、感染症への感受性を高める上で重要な役割を果たします[34]、[35]。
2.1. 腸内細菌叢は病原体に対する必須の防御線である
腸内細菌は、コロニー形成抵抗性により病原体と直接栄養を奪い合うとともに、抗菌ペプチドを産生する能力を有し、粘液産生や腸管上皮の完全性を高めることができる。さらに、腸内細菌は、上皮細胞に抗菌因子を産生させることで体液の侵入病原体に対する反応を高め、腸内病原体に対する薬剤耐性を促進させます[36]。また、微生物叢が全身性免疫の調節にも関与していることが研究で示されています。全血や末梢血単核球をin vitroで刺激することで、腸内微生物の種類や属が炎症性サイトカインと有意に相関することが明らかになった[37]。例えば、マウスに4種類の嫌気性共生細菌をコロニー形成し、フラジェリンと抗cd3抗体という2種類の免疫原で刺激した。その結果、共通のエフェクターを持つ、あるいは共通の経路を活性化することがわかった。腹腔内では、短鎖脂肪酸の発現が低下し、芳香族代謝物の濃度が上昇した[38]。また、共生細菌の中には、急性免疫活性化時に比較的安定した状態を保ち、耐性を高めて身を守る戦略を進化させたものがあるのかもしれません[39], [40].さらに、腸内フローラの代謝物の中には、抗菌力を高めるものもあります。腸内フローラは、共生細菌由来のd-乳酸を介して門脈から肝臓に到達し、クッパー細胞の循環病原体捕捉・殺傷能力を高めるため、細菌感染が血液を介して広がるのを防ぐことができます[41]。嫌気性細菌発酵の産物である短鎖脂肪酸(SCFA)酪酸は、mTORキナーゼ活性を低下させ、lc3関連の宿主防御や抗菌ペプチド産生を増加させます。また、その生成物である酪酸は、in vivoで腸管マクロファージの抗菌活性を誘導し、腸管病原体の薬剤耐性を高めることができます[42]。まとめると、これらの研究は、正常な細菌叢は病原体に対する私たちの最初の防御線であり、その破壊は生命を脅かす重症感染症や敗血症のリスクを高めるということを示しています。
2.2. 敗血症性ディスバイオシスと敗血症
研究によると、敗血症患者の腸内フローラの多様性は、入院すると減少し、組成のバランスが著しく崩れることが分かっています。入院後期には悪化する [43], [44] 。腸は、Enterococcus、Enterobacter、Clostridium difficile、Candidaなど多くの病原体の重要な貯蔵庫となる。敗血症患者においては、消化管運動の損傷、腸管上皮の完全性の低下、「有益な」嫌気性菌の喪失、バリアの破壊をもたらす。これらの変化は、日和見病原体の過剰増殖や日和見腸内細菌の転流を招き、臓器不全のリスクを増大させる。この説も改めて注目されている[45]、[46]。敗血症やARDS患者のマウスモデルにおいて、肺のマイクロバイオームが腸内細菌に富んでいることが判明した。生態学的解析の結果、敗血症後の肺細菌の供給源となりうるのは下部消化管であり、腸内細菌(Bacteroides)が広く豊富に存在し、全身の炎症の強さと関連していることがわかった[47]。マウスと敗血症で死亡した患者を対象とした研究では、細菌の転流がマウスの敗血症の急性神経炎症に関係し、敗血症の急性脳機能障害に重要な役割を果たすことが示されています[48]。マウスモデルでは、腸内フローラは敗血症による肝障害に重要な役割を果たす[52]。敗血症は、腸内フローラや肺・皮膚フローラの構成に影響を与える[49]。これらの研究から得られた手がかりは、敗血症患者で観察される細菌叢のアンバランスは、疾患の重症度を示すだけでなく、悪性の結果につながる可能性があることを示しています。もちろん、この結果を確認するためには、さらなる研究が必要である。マイクロバイオームの乱れは、敗血症の反映にとどまらず、臓器不全につながるのです(図1)。
ダウンロード: 高解像度画像ダウンロード(250KB)
ダウンロード フルサイズ画像をダウンロードする
図1. 敗血症に伴う消化管機能、免疫微小環境、微生物の病態変化について。Figdrawで作成した。腸内細菌叢と骨格筋の関係
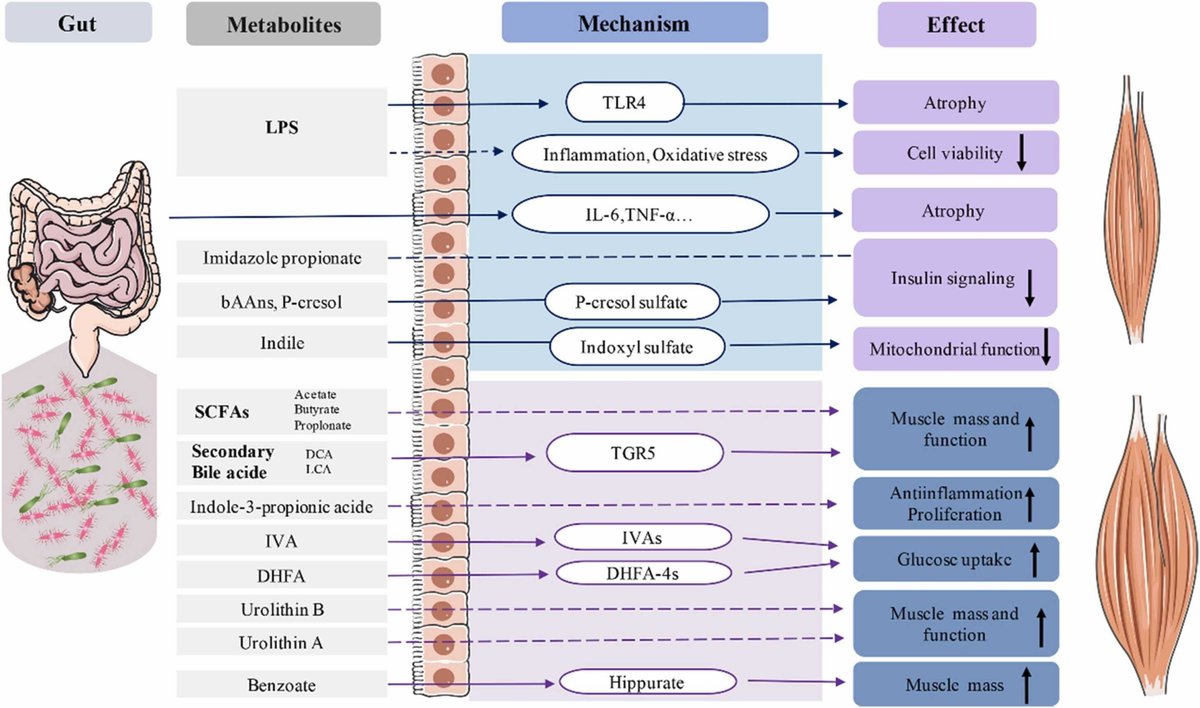
サルコペニアは、骨格筋量、筋力、機能の継続的な低下によって引き起こされる症候群と定義され、世界保健機関によって疾病としてリストアップされている[50]。腸内細菌叢と骨格筋の関係は、加齢や腫瘍によって引き起こされる関連するサルコペニアでより多く研究されていますが、敗血症ミオパシーではあまり研究されていません(図2)。
ダウンロード 高解像度画像ダウンロード(349KB)
ダウンロード フルサイズ画像をダウンロードする
図2. 腸内細菌叢とその代謝産物の筋生理学への作用機序 これらの代謝産物は腸管関門を通過し、骨格筋の代謝に直接、あるいは宿主を介して共代謝産物に変換して関与し、異なる病態的役割を果たすことができる。破線の矢印は、解明されていない特定のメカニズムに使用されている。LPS, リポポリサッカライド;TLR4, Toll-like receptor 4;bAAms, bacterial amino acid metabolites;SCFAs(short chain fatty acids);CA, bile acid;CDCA chenodeoxycholic acid;DCA、deoxycholic acid; LCA, lithocholic acid; TGR5, Gタンパク質共役型受容体5; IVA isovanillic acid; IVAS, Isovanillic acid-3-o-sulfate; DHFA dihydroferulic acid; DHFA-4S, 4-O-dihydroferulic acid.
3.1. 腸内細菌叢の変化と骨格筋の衰弱
この10年、骨格筋の消費量や高齢者のフローラ組成を研究している人がいます。加齢に伴い腸内フローラの組成が変化することが分かっています。個人差はあるものの、フローラの多様性が低下することが特徴である[51]。筋力低下のない対照群と比較して、筋力低下は短鎖脂肪酸(SCFA-酢酸、プロピオン酸、酪酸を含む)産生菌(バラ科、真正細菌など)の減少に関係している [52], [53]. 動物モデルでは、通常のマウスと比較して、不妊治療や抗生物質を投与したマウスの筋肉量や筋力が低下していることがわかった。興味深いことに、こうした筋肉量や機能の変化は、マイクロバイオームの移植によって回復させることができます [54], [55], [56]。また、低機能高齢者から移植したマウスと比較して、高機能高齢者の微生物叢を無菌マウスに移植したマウスは握力が向上し、身体機能が向上することが分かっています。中でも、高機能高齢者の細菌叢には、SCFAの産生に関わるファミリーレベルのPrevost family、属レベルのPrevost and Barnella、種レベルのBarnellaが多く含まれています[31]。以上のことから、サルコペニアでは一部のマイクロバイオーム群の存在量や腸内細菌叢の組成が減少し、筋力障害との関連が示唆されている[28]、[31]。
3.2. 腸内細菌叢を介した炎症と骨格筋の消耗
骨格筋の重量と機能の低下をもたらす主なメカニズムの1つは、持続的な炎症である。骨格筋の代謝と免疫機能における腸内フローラの重要性は、徐々に深く認識されるようになってきた。腸内障害や多様性の喪失は腸管バリアの完全性を破壊し、リポポリサッカライド(LPS)などの有害な微生物産物を血液中に侵入させ、全身性の炎症や代謝障害を引き起こし、筋肉の機能や質を低下させます[28]。老化モデルにおいて、インスリン抵抗性と骨格筋の減少がTLR4の発現/シグナル伝達の増加と関連していることを研究者は発見し、これは二次代謝性内毒素血症によるものと考えられる[57]。TLR4シグナル伝達経路の活性化は、核因子(NF-)κBタンパク質(p50およびp65)のレベルおよびc-Jun N-ターミナルキナーゼのリン酸化レベルの著しい上昇につながり、結果として感受性を高めることになります[57]。TLR4シグナル経路は、カスケード反応により炎症性サイトカインIL - 6とTNF-αのアップレギュレーションを誘導し、全身性の炎症反応を誘発する [58]。炎症性サイトカイン(TNFαやIL6など)は筋萎縮の制御に関与しており、腸内フローラの調整によるこれらの炎症性サイトカインの産生抑制は筋萎縮の緩和に関係している [59], [60]. ある研究では、ICUAW患者の骨格筋でIL-6の標的遺伝子SOCS3が上昇しており、IL-6はgp130/JAK2/stat3経路を通じて敗血症により誘発される筋萎縮を媒介し、ICUAWと関係がある可能性が示された[60]。しかし、細菌叢を調整することで炎症環境を改善し、その上で敗血症による骨格筋の消費と疲労を改善できるのか、まだ答えは出ておらず、探求する価値があると思われる。
3.3. 微生物叢の代謝産物と骨格筋消耗の関係
3.3.1. 短鎖脂肪酸(SCFA)
栄養素を消化する過程で、腸内微生物は多くの代謝物を産生し、それらは疾病に関与する。短鎖脂肪酸(SCFA)や様々な代謝産物は、微生物と他の臓器との間で情報を伝達します[61]。SCFAは、炭水化物やタンパク質(程度は低い)の細菌発酵によって生産され、主に酢酸、プロピオン酸、酪酸を含み、宿主の代謝や免疫に様々な影響を与える[62], [63], [64].敗血症におけるSCFAなどの必須代謝物の不十分な産生は、腸-筋軸および筋機能障害に重要な役割を果たすと考えられる。さらに、SCFAはミトコンドリア機能を制御するホルモンシグナルを刺激することができる[65]。研究により、SCFAはマウスの骨格筋における脂質、炭水化物、およびタンパク質の代謝に積極的な役割を果たすことが示されている。同時に、SCFAはAMPKとPGC1αのリン酸化を増加させることにより、骨格筋のグルコースと脂質の代謝に影響を与えることができます。さらに、SCFAはインスリン受容体基質(IRS1)の発現とプロテインキナーゼB(PKB)のリン酸化を増加させ、骨格筋のインスリン感受性を維持することができます[66]。さらに、無菌マウスに混合SCFAを与えると、筋重量と四肢の握力が増加し、筋肉におけるatrogin1の発現が減少します[54]。老化マウスモデルにおいて、研究者は、老化マウスに酪酸を長期投与すると後肢の筋萎縮を防ぐことができることを発見した。酪酸は筋肉重量を保護し、酸化ストレスやアポトーシスマーカーを減少させることができます[67]。これらの研究は、短鎖脂肪酸がヒトの筋肉の代謝と機能を改善することを示唆している。しかし、現時点では、これらの研究は加齢に関連する骨格筋の代謝にのみ焦点を当てており、腸内フローラからのSCFAがヒトの筋肉生理学、特に敗血症ミオパシーに及ぼす影響に関する研究は不足している。腸内フローラのアンバランスや微生物由来の代謝物(SCFAなど)の変化と炎症による筋機能障害との関係については、さらなる研究が必要です。
3.3.2. 胆汁酸
一次胆汁酸とは、肝細胞で生成される胆汁酸のことです。一次胆汁酸は、コール酸(CA)とデオキシコール酸(CDCA)です。二次胆汁酸は、一次胆汁酸の微生物による代謝によって生成されるすべての胆汁酸を含みます。二次胆汁酸は主にデオキシコール酸(DCA)とリトコール酸(LCA)である[68], [69].これらの胆汁酸は、遊離の状態で存在したり、肝臓の反応によってaAAと結合したり、胆汁酸によって活性化される受容体を介して様々な役割を果たす。マウスの骨格筋では、運動誘発性UPRにより胆汁酸受容体Tgr5の発現が増加し、筋機能の改善に役立ち、運動による骨格筋活動への有益な効果を説明しています[70]。逆に、Abrigoたちは、筋繊維のTGR5を欠損させると、コール酸(CA)およびデオキシコール酸(DCA)による骨格筋の萎縮が消失することを発見した。そして、CAデオキシコール酸は、TGR5受容体を介して骨格筋の萎縮を誘導することを明らかにした[71]。このことは、胆汁酸が環境の違いによって骨格筋に与える影響が異なることを示しており、敗血症ミオパシーを研究する際にも注意が必要である。
3.3.3. 細菌性アミノ酸代謝産物(bAAms)
食事のAAやペプチドの多くは小腸で吸収されますが、大量のAAやペプチドが大腸に入ることがあります。そこで、これらのAAがバクテリアによってバームへと代謝されることがある。現在、筋肉細胞の生理学と病理学に関連するビームが数種類ある。これらの薬剤には、p-クレゾール硫酸塩(PCS)、イミダゾールプロピオン酸塩、インドキシル硫酸塩(IS)などがある。PCSは蛋白結合型尿毒症毒素で、腸内微生物によるチロシン代謝に由来する。腎機能が正常なマウスにPCSを4週間投与すると、インスリン抵抗性、脂肪量の減少、筋肉や肝臓での脂質の異所性再分布が誘発され、CKDに関連した特徴を持つ。C2C12筋管はCKDとしてシミュレーションされた。PCSは、ERK1/2を直接活性化することにより、インスリン抵抗性を誘導することが観察された[72]。ISとPCSは、ASK1とその下流経路を活性化することにより、部分的に増殖と線維化を促進する性質を示す[73]。さらに、PCSはin vitroおよびin vivoの心筋細胞において抗増殖作用およびプロアポトーシス作用を示す[74]、[75]。プロピオン酸イミダゾールは、微生物が産生するヒスチジン由来の代謝物で、2型糖尿病患者および非2型糖尿病患者で濃度が高くなる。プロピオン酸イミダゾールは、p38γMAPKを活性化することにより、インスリン受容体基質のレベルでインスリンシグナルを破壊し、インスリン抵抗性を誘導する[61]。インドキシル硫酸(IS)は、トリプトファンの細菌性代謝物である[76]。研究では、ISがC2C12細胞の活性酸素種(ROS)や炎症性サイトカイン(TNF-α、IL-6、TGF-β1)などの骨格筋消費に関連する因子を増やすだけでなく。ISは、筋萎縮関連遺伝子であるミオスタチンやアトロジン1の発現を促進することが判明した。このことから、ISは酸化ストレスを介したミオスタチンとアトロジン1の発現誘導により骨格筋の萎縮を促進する可能性があることが示唆された[77]。インドフェノール硫酸塩を慢性的に外来投与すると、マウスの体重と骨格筋の重量を減少させることができる[77]。さらに、インドフェノール硫酸レベルは、慢性血液透析(HD)を受けている患者の骨格筋指数と負の相関がある[78]。AST-120(腸管内でインドールを結合できる吸着炭)を投与すると、インターロイキン-6、ミオスタチン、アトロジン1などCKDによる萎縮関連因子の発現が減少し、運動能力が向上した[79]。しかし、意外なことに、トリプトファンを代謝し、抗炎症代謝物であるインドール - 3- プロピオン酸(IPA)を生成するC. sporogenesは、miR-26a-3p/il - 1βを介して筋肉細胞やC2C12に抗炎症作用や筋成長促進作用を発揮できる[80]。5-アミノ吉草酸ベタイン(5-AVAB)は、N、N、N-トリメチル-5-アミノ吉草酸(TMAVA)としても知られ、トリメチルリジン(およびおそらく他のaa)の細菌代謝に由来するか、食事から供給される[81]。5-AVABは、細胞のカルニチンレベルを下げることにより、マウス心筋細胞における脂肪酸酸化を減少させる[82]。In vivoでは、5-AVABは高脂肪食を与えたマウスの心臓エネルギー代謝を変化させ、脂肪酸酸化を阻害し、心臓肥大を悪化させ、心臓肥大の発症の重要な決定因子として機能している[82]。しかし、5-AVABが骨格筋細胞の生理にも影響を及ぼすかどうかは、まだ不明である。
3.3.4. ポリフェノール(PPs)
ポリフェノール(PP)は、化学的多様性の高い植物化学物質の大家族である。その多くは大腸に到達し、腸内微生物によって分解され、元の(ポリ)フェノールよりも吸収されやすい代謝物を生成し、大腸や全身で生物学的作用を示す[83]。食用アントシアニン-3-o-グルコシドを主成分とする血液中に存在する微生物代謝物であるイソバニル酸-3-o-硫酸(IVAS)は、LHCN-M2筋芽細胞のGLUT1、GLUT4、PI3K p85αタンパクを上昇させ、Aktのリン酸化を増加させることができます [84] Urolithin B、 は、エラギタンニン由来の代謝物であり、タンパク質の合成を増加させ、ユビキチン-プロテアソーム経路を阻害することにより、C2C12筋管の成長と分化を促進します。In vivoの実験では、ウロリチンBがマウスの筋肥大を誘導し、坐骨神経切断後の筋萎縮を抑制することが確認されています [85] 。食事や微生物の天然代謝物であるウロビリンA(UA)は、老化した動物や前臨床モデルにおいて、筋肉の健康を改善することが示されています。第1相臨床試験において、UAはミトコンドリアの生合成と機能を高めることにより、脂肪酸酸化能を改善することが明らかになりました[86]、[87]。ヒップレートは安息香酸のグリシン結合体であり、腸内細菌がポリフェノールを中心とした食事成分の代謝によって生成する[88]。通常、腸内細菌叢の多様性と組成を反映する[89]。
3.4. 細胞外小胞(EVs)
近年、放出される細胞外ベシクル(EVs)が腸内細菌叢と他臓器との相互作用の重要な要素になりうることが分かってきた[90]。細菌由来のEVは、直径20〜100ナノメートルの球状二層リン脂質で、すべてのグラム陰性菌と一部のグラム陽性菌に広く存在する[91]。グラム陰性菌由来のEVは、外膜タンパク質、リポポリサッカライド(LPS)、外膜脂質、ペリプラスムタンパク、DNA、RNAから構成されている[92]。大腸菌などのグラム陰性菌由来のナノエーブは、生菌がいない状態で重度の免疫反応と敗血症性ショックを誘発することが示されている[93]。P. panacisのEVは、骨格筋と脂肪組織におけるインスリンシグナル伝達経路をブロックした。さらに、単離されたP. panacis EVは、グルコース摂取または全身インスリン注射後のグルコース不耐性などの典型的な糖尿病表現型を誘発する[90]。したがって、EVSに運ばれた細菌成分や情報は、末梢臓器における炎症性プロセスなどの全身反応をより効果的に誘導することができる[93]。腸管に由来すると思われるグラム陰性菌やグラム陽性菌のEV[82]が、どのように骨格筋に移動し、肥大や萎縮のプロセスを媒介するのか、さらなるメカニズム研究が必要である。非常に興味深いことではあるが、我々の知る限り、敗血症性ミオパシーにおけるEVの役割に関する現在の研究は空白のままであることを強調することが不可欠である。したがって、EVがどのように骨格筋との潜在的な関連性を確立し、敗血症環境で生物学的効果を発揮するのかも、さらに研究する価値のある研究分野である。
3.5. 敗血症における腸内細菌叢と筋衛星細胞
サテライト細胞は、筋繊維基質とサルコレマの間に位置する単核筋肉由来の幹細胞として、損傷後の骨格筋の修復と再生に必要である [94] 。通常、サテライト細胞は静止状態にあり、傷害時に活性化され、増殖性の筋芽細胞を産生する。基底膜の下と筋線維膜の外にあるサテライト細胞の局在とその周辺環境は、ニッチまたは微小環境と呼ばれる[89]。P Rocheteauらの研究では、ミトコンドリアと代謝の変化が、敗血症によって引き起こされる衛星細胞の長期的な傷害の基礎となり、非効率な筋再生につながることを発見した。間葉系幹細胞の移植は、サイトカインレベルを下げ、サテライト細胞のミトコンドリアと代謝機能を回復させ、筋力を向上させ、敗血症の状態を改善させることができる[8]。Notchシグナル伝達経路は哺乳類では非常に保守的で、衛星細胞が静止状態を維持するか、細胞周期に入り筋管に分化するかを決定する。ノッチ受容体のリガンドには、ジャグドプロテインファミリーやデルタライクプロテインファミリーがある[91]。興味深いことに、これらのNotch受容体のリガンドは、グラム陽性菌やグラム陰性菌だけでなく[92]、EV表面にも存在する[93]。したがって、これらは腸内細菌叢による衛星細胞の分化や機能の調節に関与している可能性がある。可溶性JAGタンパク質によってNotchシグナル伝達経路を阻害すると、骨格筋の再生にダメージを与えるという研究結果がある。一方、特異的な抗体によってNotchの活性化を促進すると、修復過程が促進されることが示された[97]。Notchシグナル伝達経路の遮断は、損傷した骨格筋線維の再生を可能にするための不可欠な条件である[90]。敗血症における腸内フローラのアンバランスによって引き起こされるEVや細菌上のNotchリガンド、特にDLL1の過剰発現は、Notchシグナル活性化とNumbタンパク質不活性化の間の不均衡をもたらし、これが敗血症における衛星細胞の分化不良の理由である可能性がある[94]。しかし、この仮説はさらなる確認が必要である。腸内細菌叢:治療標的の可能性
敗血症における腸管-骨格筋軸のエビデンスは、まだ出始めたばかりである。有効な治療ターゲットにつながる可能性のあるメカニズム的な関連性を特定するためには、さらなる研究が必要であるが、将来の治療戦略が可能であると推測される。微生物叢のアンバランスを防ぐための研究、すなわち健常者の糞便微生物叢の移植が行われている。敗血症マウスモデルにおける若いマウスの微生物叢の安定化は、高齢者と比較して若い敗血症患者の予後が良好であることの説明に役立つことを示す証拠がある [95]。さらに、糞便微生物叢移植(FMT)は、宿主の免疫力を回復させる。インターフェロン制御因子3依存的な方法で病原体のクリアランスを高め、それによって、当初致命的だった敗血症のプロセスを逆転させるのである[96]。しかし、FMTの臨床試験で被験者が死亡していることから[97]、有害な細菌叢や細菌叢移植自体が炎症反応を引き起こす可能性があることを考慮する必要がある。健康なラットに糞便を移植すると、5-フルオロウラシルによる筋肉組織のIL-6とTNF-αの増加が抑えられ、栄養状態や筋肉機能が改善された[98]。敗血症がフローラ移植によって改善されるかどうかについては、まだ報告がない。FMTのような治療法のさらなる研究は、治療の時間、用量、投与量、期間などの疑問に答えることを目的としているはずである。
プレバイオティクス、プロバイオティクス、または合成細菌による腸内フローラの調節は、筋萎縮や悪液質の予後を改善する可能性のある治療法と考えることができる [99], [100], [101]. イヌリン型フルクタンと生きたLactobacillus reuteriを含む常在菌を白血病マウスに注入した。この治療法は、乳酸菌の集団を回復させ、腸内細菌科のレベルを低下させる。また、肝臓がん細胞の増殖、筋肉の萎縮、発症を抑制し、生存期間を延長することができます[100]。また、白血病や悪液質のマウスモデルでは、筋萎縮対策として菌株を合理的に選択することで乳酸菌数を回復させ、全身性の炎症を抑えることができる[99]。乳酸菌の投与による筋萎縮の減少は、別のがん悪液質モデルマウスでも報告されている[102]。Varianらは最近、癌性悪液質におけるプロバイオティクスとしてのラクトバチルス・ロイテリの役割について評価した。大腸がん悪液質モデルApcMIN/+マウスに、乳酸菌ロイテリを飲料水として投与した。彼らは、乳酸グラム陽性菌が全身の炎症マーカーを減少させ、悪液質を抑制し、それがFoxN1の発現低下と関連していることを発見した[102]。Redmanらは、がん患者におけるプロバイオティクスの安全性に関わる17のランダム化比較試験のシステマティックレビューを実施した。その結果、悪性腫瘍患者における敗血症のリスク上昇を含む、さまざまな副作用が報告されました。悪性腫瘍の進行によって患者が副作用を発症する傾向があることを考えると、直接的な因果関係を支持する証拠は不十分である [103] 。敗血症を引き起こす可能性のある一連の感染症において、生きた常在菌がプロバイオティクスとして研究されている[104]、[105]。しかし、メタアナリシスでは、プロバイオティクスが有益なのは限られた患者のサブセットのみで、全体的な効果はわずかであることが判明した [104], [106]。
さらに、プロバイオティクスが健康なヒトの常在菌叢の再構成を遅らせる可能性があるという最近の証拠により、これらの治療法に対する潜在的な懸念が提起されている [39] 。したがって、今後の研究の焦点は、プロバイオティクスがもたらす副作用を回避し、敗血症ミオパチーにおけるプロバイオティクスの治療効果を発揮させる方法となるであろう。プレバイオティクスとは、食品中に含まれる発酵性繊維などの常在動物の成長を促進する化合物で、SCFAs産生種の発生をサポートするものです。現在、Critical Care Medicine AssociationとAmerican Association for Enteral and Parenteral Nutritionは、ほとんどの血行動態が安定した重症患者に対して、水溶性および混合繊維の補助経腸栄養が安全かつ有益であると推奨している。最適な繊維組成を決定するためには、さらなる研究が必要である [107] 。しかし実際には、敗血症および敗血症関連ミオパチーの患者に対する有益性を明らかにするために、臨床試験が必要である。プロスペクティブと結論
腸内細菌-筋肉軸は、ヒトと動物の両方において重要な役割を担っています。敗血症における急性および慢性の筋機能障害患者は、制御不能な炎症反応と、敗血症によって誘発される腸内細菌叢の長年の調節障害によるものである。腸内細菌叢の乱れや外来有害物質の侵入は、腸管バリアの損傷や炎症性サイトカインの分泌増加を招き、筋肉の成長・発達に害を及ぼす。腸内フローラは、炎症性免疫、代謝産物、EVなど、骨格筋との相互作用を調節することで、筋肉の発達や代謝を制御できることが分かってきました。プロバイオティクス菌株(および菌株の組み合わせ)は、同化および異化の動物において、筋肉量と機能を効果的に改善することが示されているが、まだ臨床試験の裏付けには至っていない。敗血症による微生物多様性の変化や、代謝物やEVなどの細胞情報伝達物質の産生は、腸内細菌叢と骨格筋再生過程の相互作用を説明できるかもしれない。しかし、上記の影響因子とそのメカニズムを検証するためには、上記の手段がどのように骨格筋消費を制御しているかを証明するために、多数の質の高い実験研究が必要である。最後に、筋肉と宿主細菌叢の機能を向上させるために、プロバイオティクス菌株を、微生物叢(プレバイオティクスやポリフェノールなど)や筋肉(タンパク質やエネルギーなど)を対象とした他の栄養因子と組み合わせて、その効果を最適化することができる。ミオパチーにおける腸内フローラの研究が深まることで、腸内微生物-筋肉軸の理解が深まり、本研究の核となる敗血症性ミオパチーの発症における微生物由来のメカニズムや治療可能性が明らかになると考えています。
資金提供
本研究は、中国国家自然科学基金(助成番号:82002101、82002096)の助成を受けた。
同意書
該当しない。個人の個人情報は含まれていません。
CRediTの著者の貢献声明
著者は全員、研究の設計と原稿執筆に貢献した。Yukun Liu、Ligang Xu、Dongfang Wang、Tianyu Liは研究を引き受けた。Yukun Liu、Zhaohui Yang、Fan Yang、Yuchang Wangは、原稿の本文を執筆し、図を作成した。Zhanfei Li、Xiangjun Bai、Yuchang Wangは、重要な知的コンテンツについて批判的に論文を修正し、提出するバージョンの最終承認を得た。すべての著者が原稿を確認した。
競合利益の宣言
著者らは、本研究が潜在的な利益相反と解釈され得る商業的または金銭的な関係なしに行われたことを宣言する。
謝辞
本記事に対して有益なコメントをいただいた査読者の方々に感謝いたします。
おすすめ記事
データの有無
本研究では、新たなデータの作成・解析は行っていないため、データ共有は本論文の対象外です。
参考文献
[1]
M. Singer, C.S. Deutschman, C.W. Seymour, M. Shankar-Hari, D. Annane, M. Bauer, et al.
敗血症と敗血症性ショックの第3次国際合意定義(Sepsis-3)
JAMA J. Am. Med. Assoc., 315 (2016), pp.801-810.
CrossRefGoogle Scholar
[2]
A.K. Gardner, G.L. Ghita, Z. Wang, T. Ozrazgat-Baslanti, S.L. Raymond, R.T. Mankowski, et al.
外科系ICUにおける敗血症の早期生存者において、慢性重症の発症が身体機能、QOL、長期生存を決定する
クリット. ケアメディ, 47 (2019), pp.566-573
CrossRefView in ScopusGoogle Scholar
[3]
A.A. Ginde, P.J. Blatchford, S. Trzeciak, J.E. Hollander, R. Birkhahn, R. Otero, et al.
敗血症による入院中の急性炎症のバイオマーカーにおける年齢による違い
ショック』42(2014)、99-107頁
ScopusGoogle Scholarで見る
[4]
S. Yende, J.A. Kellum, V.B. Talisa, O.M.P. Palmer, C.C.H. Chang, M.R. Filbin, et al.
敗血症の入院患者における長期的な宿主免疫反応の軌跡
JAMA Netw. オープン(2019)、p. 2
グーグル・スカラー
[5]
M.M. Levy, R.P. Dellinger, S.R. Townsend, W.T. Linde-Zwirble, J.C. Marshall, J. Bion, et al.
生存敗血症キャンペーン:重症敗血症を対象とした国際的なガイドラインに基づくパフォーマンス改善プログラムの結果
集中治療医学, 36 (2010), pp.222-231
CrossRefView in ScopusGoogle Scholar
[6]
P.A. Efron, A.M. Mohr, A. Bihorac, H. Horiguchi, M.K. Hollen, M.S. Segal, et al.
持続的な炎症、免疫抑制、異化作用と術後の慢性重症の発症
外科』164号(2018年)、178~184頁
PDFを見る記事を見るScopusGoogle Scholarで見る
[7]
Z.A. Puthucheary, J. Rawal, M. McPhail, B. Connolly, G. Ratnayake, P. Chan, et al.
重症患者における急性骨格筋消耗症
JAMA J. Am. Med.Assoc., 310 (2013), pp.1591-1600
CrossRefView in ScopusGoogle Scholar
[8]
P. Rocheteau, L. Chatre, D. Briand, M. Mebarki, G. Jouvion, J. Bardon, et al.
敗血症は、間葉系幹細胞治療が有効な長期的な代謝およびミトコンドリア筋幹細胞機能不全を誘発する
Nat. Commun. (2015), p. 6
グーグル スカラー
[9]
C. dos Santos, S.N.A. Hussain, S. Mathur, M. Picard, M. Herridge, J. Correa, et al.
集中治療室滞在後の慢性的な筋消耗と機能不全のメカニズム
Am. J. Respir. Crit. Care Med.、194(2016)、821-830ページ
ScopusGoogle Scholarで見る
[10]
L. Liu, F. Xie, K. Wei, X.C. Hao, P. Li, J. Cao, et al.
敗血症による神経筋接合部の脱神経様変化について
J. Surg. Res., 200 (2016), pp.523-532
PDFを見る記事を見るScopusGoogle Scholarで見る
[11]
R. ルドルフ、M.R.デシェネス、M.サンドリ
筋力低下における神経筋接合部変性について
Curr. Opin. Clin. Nutr. Metab. ケア, 19 (2016), pp.177-181
ScopusGoogle Scholarで見る
[12]
L.A.キャラハン、G.S.スーピンスキー
敗血症によるミオパシー
クリット. ケアメディ, 37 (2009), pp.S354-S367
ScopusGoogle Scholarで見る
[13]
A. ブーグル、P.ロシュトー、T.シャルシャール、F.クレティアン
敗血症後の筋の再生
クリットです。ケア(2016年)』20頁
Google Scholar
[14]
K. 飯塚、町田、平藤正人
骨格筋は内分泌器官である
J. Pharmacol. Sci.、125(2014)、pp.125-131
PDFを見る記事を見るGoogle Scholar
[15]
A.J.マッティングリー、O.ライタノ、T.L.クランドン
エピネフリンによるマウス四肢筋のCXCL1、IL-1α、IL-6分泌の促進作用
Physiol.Rep. (2017), p. 5
グーグル スカラー
[16]
J. Iwaniec, G.P. Robinson, C.K. Garcia, K.O. Murray, L. de Carvalho, T.L. Clanton, et al.
マウスにおける熱中症に対する急性期反応
Exp. フィジオール, 106 (2021), pp.222-232
CrossRefView in ScopusGoogle Scholar
[17]
S.S.ウェルク、D.A.モース、A.J.マッティングリー、O.ライタノ、M.A.キング、T.L.クランドン
マウス骨格筋における受容体を介したインターロイキン-6制御に対する温熱療法の影響
PLoS One (2016), p. 11
Google Scholar
[18]
O. Laitano, G.P. Robinson, K.O. Murray, C.K. Garcia, A.J. Mattingly, D. Morse, et al.
骨格筋線維はマウスの敗血症時の宿主防御に機能的役割を果たす
Sci. Rep. (2021), p. 11
Google Scholar
[19]
A.S.ニシュ
胃腸の健康と病気における微生物
消化器病学, 136 (2009), pp.65-80
PDFを見る記事を見るScopusGoogle Scholarで見る
[20]
A.L. カウ、P.P. アハーン、N.W. グリフィン、A.L. グッドマン、J.I. ゴードン
ヒトの栄養、腸内細菌叢、免疫システム
ネイチャー, 474 (2011), pp.327-336
CrossRefView in ScopusGoogle Scholar
[21]
A. スポール、O.コレン、R.レイ
環境と宿主の遺伝子型が腸内細菌叢に及ぼす影響を解明する
Nat. Rev. Microbiol., 9 (2011), pp.279-290
CrossRefView in ScopusGoogle Scholar
[22]
M.Y. Zeng, N. Inohara, G. Nunez
炎症が引き起こす腸内細菌異常のメカニズム
粘膜免疫学, 10 (2017), pp.18-26
PDFを見る記事を見るCrossRefGoogle Scholar
[23]
L.V. フーパー、D.R. リットマン、A.J. マクファーソン
微生物叢と免疫系の相互作用
サイエンス, 336 (2012), pp.1268-1273
CrossRefView in ScopusGoogle Scholar
[24]
E.A.メイヤー、K.ティリシュ、A.グプタ
腸・脳軸と微生物叢
J. Clin. Investig.、125(2015)、926-938ページ
ScopusGoogle Scholarで見る
[25]
K. ベラー、M.ミュース、M.クトロロス、Z.アルラスビ、M.ボジキ、C.ヨナー、他。
常在細菌とミエリン自己抗原の協同による自己免疫性脱髄の誘発
Nature, 479 (2011), pp.538-U266
CrossRefView in ScopusGoogle Scholar
[26]
F.H. カールソン、F. ファク、I. ヌーカウ、V. トレマローリ、B. ファガーバーグ、D. ペトラノビッチ、他。
症候性アテローム性動脈硬化症は腸内メタゲノムの変化と関連している
Nat. Commun. (2012), p. 3
Google Scholar
[27]
J. オチョア-レパラズ、D.W.ミエルカーズ、S.ベグム-ハーク、L.H.カスパー
腸、虫、脳:中枢神経系疾患の制御における常在菌の役割
Ann. ニューロール, 69 (2011), pp.240-247
CrossRefView in ScopusGoogle Scholar
[28]
G.J.グロシッキー、R.A.フィールディング、M.S.ラストガーデン
腸内細菌は骨格筋のサイズ、組成、機能の加齢変化に寄与する:腸-筋肉軸の生物学的根拠
Calcif. Tissue Int., 102 (2018), pp.433-442
CrossRefView in ScopusGoogle Scholar
[29]
A. Ticinesi, A. Nouvenne, N. Cerundolo, P. Catania, B. Prati, C. Tana, et al.
加齢における腸内細菌叢と筋肉量および機能:身体的虚弱およびサルコペニアに着目して
栄養素(2019年版)』11ページ
Google Scholar
[30]
K. Nay, M. Jollet, B. Goustard, N. Baati, B. Vernus, M. Pontones, et al.
腸内細菌は最適な筋肉機能に不可欠:グルコースホメオスタシスとの関連性の可能性
Am. J. Physiol.-Endocrinol. Metab.、317(2019)、E158-E171頁。
CrossRefView in ScopusGoogle Scholar
[31]
R.A.フィールディング、A.R.リーブス、R.ジャスジャ、C.リュー、B.B.バレット、M.S.ラストガーデン
高機能高齢者の微生物叢をコロニー化したマウスでは筋力が向上する
Exp. Gerontol. (2019), p. 127
CrossRefView in ScopusGoogle Scholar
[32]
B.W. Haak, W.J. Wiersinga
敗血症における腸内細菌叢の役割について
Lancet Gastroenterol. Hepatol., 2 (2017), pp. 135-143
PDFを見る記事を見るScopusGoogle Scholarで見る
[33]
R.T. Mankowski, O. Laitano, D. Darden, L. Kelly, J. Munley, T.J. Loftus, et al.
敗血症によるミオパチーと腸内細菌叢の異常:メカニズム的関連性と治療ターゲット
ショック, 57 (2022), pp.15-23
CrossRefView in ScopusGoogle Scholar
[34]
J.Y. Chang, D.A. Antonopoulos, A. Kalra, A. Tonelli, W.T. Khalife, T.M. Schmidt, et al.
再発性Clostridium difficile関連下痢症における糞便微生物群の多様性の低下
J. Infect. Dis., 197 (2008), pp.435-438
CrossRefView in ScopusGoogle Scholar
[35]
V.C. Harris, B.W. Haak, M.B. van Hensbroek, W.J. Wiersinga
感染症における腸内細菌叢:急成長する分野の臨床的関連性
オープンフォーラム Infect. Dis. (2017), p. 4
グーグル スカラー
[36]
S. キム、A.コビントン、E.G.パマー
腸内細菌叢:抗生物質、コロニー形成抵抗性、腸内病原体
Immunol. Rev., 279 (2017), 90-105ページ
CrossRefView in ScopusGoogle Scholar
[37]
M. Schirmer, S.P. Smeekens, H. Vlamakis, M. Jaeger, M. Oosting, E.A. Franzosa, et al.
ヒト腸内細菌叢と炎症性サイトカイン産生能の関連性
Cell, 167 (2016), p. 1125
PDFを見る記事を見るScopusGoogle Scholarで見る
[38]
S. ベカッティーニ、M.T. ソルバラ、S.G. キム、E.L. リットマン、Q. ドン、G. ウォルシュ、他。
宿主の免疫活性化に対する腸内微生物の迅速な転写および代謝の適応
細胞宿主微生物, 29 (2021), pp.378-393
e5
ScopusGoogle Scholarで見る
[39]
M.W. Adelman, M.H. Woodworth, C. Langelier, L.M. Busch, J.A. Kempker, C.S. Kraft, et al.
敗血症の発症、維持、転帰における腸内細菌叢の役割
クリット ケア, 24 (2020), p.278
ScopusGoogle Scholarで見る
[40]
B.W. Haak, W.J. Wiersinga
敗血症における腸内細菌叢の役割について
Lancet Gastroenterol. Hepatol., 2 (2017), pp. 135-143
PDFを見る記事を見るScopusGoogle Scholarで見る
[41]
B. McDonald、A.Z. Zucoloto、I.L. Yu、R. Burkhard、K. Brown、M.B. Geuking, et al.
腸内細菌叢による血管内免疫ファイアウォールのプログラムにより、感染時の病原体の播種から保護される
セルホストマイクロベ、28(2020)、pp.660-668
e4
ScopusGoogle Scholarで見る
[42]
J. Schulthess, S. Pandey, M. Capitani, K.C. Rue-Albrecht, I. Arnold, F. Franchini, et al.
短鎖脂肪酸の酪酸はマクロファージに抗菌プログラムを刻み込む
Immunity, 50 (2019), pp.432-445
e7
ScopusGoogle Scholarで見る
[43]
M. 尾島真理子、本岡大輔、清水和彦、後藤和彦、新谷篤史、吉谷和彦、他。
メタゲノム解析による集中治療室患者の急性期における全腸内細菌叢の動的変化の解明
Dig. Dis. Sci.、61(2016)、1628-1634ページ
CrossRefView in ScopusGoogle Scholar
[44]
D. McDonald、G. Ackermann、L. Khailova、C. Baird、D. Heyland、R. Kozar、et al.
重症患者におけるマイクロバイオームの極端な不衛生状態
エムスフィア(2016)、P.
グーグル・スカラー
[45]
N.J.クリンゲンスミス、C.M.クーパースミス
重症患者における多臓器機能不全のモーターとしての腸管
クリット(Crit) Care Clin.、32(2016)、203頁。
PDFを見る記事を見るScopusGoogle Scholarで見る
[46]
C.J.ドンスキー
院内感染病原体のリザーバーおよび伝播源としての腸管の役割について
Clin. Infect. Dis., 39 (2004), pp.219-226
ScopusGoogle Scholarで見る
[47]
R.P. Dickson, B.H. Singer, M.W. Newstead, N.R. Falkowski, J.R. Erb-Downward, T.J. Standiford, et al.
敗血症および急性呼吸窮迫症候群における肺マイクロバイオームの腸内細菌による濃縮性
Nat. Microbiol、1(2016)、16113ページ
ScopusGoogle Scholarで見る
[48]
B.H. Singer, R.P. Dickson, S.J. Denstaedt, M.W. Newstead, K. Kim, N.R. Falkowski, et al.
敗血症における脳への細菌播種について
Am. J. Respir. Crit. Care Med., 197 (2018), pp.747-756
CrossRefView in ScopusGoogle Scholar
[49]
R.P.Dickson
マイクロバイオームと重症患者
Lancet Respir. Med., 4 (2016), pp.59-72
PDFを見る記事を見るScopusGoogle Scholarで見る
[50]
B. Vellas, R.A. Fielding, C. Bens, R. Bernabei, P.M. Cawthon, T. Cederholm, et al.
サルコペニアの臨床と臨床試験におけるicd-10の意味:虚弱とサルコペニアに関する国際会議タスクフォースによるレポート
J. Frailty Aging, 7 (2018), pp.2-9.
ScopusGoogle Scholarで見る
[51]
M.J. Claesson, I.B. Jeffery, S. Conde, S.E. Power, E.M. O'Connor, S. Cusack, et al.
腸内細菌叢の組成は高齢者の食事と健康に相関する
Nature, 488 (2012), pp.178-184.
CrossRefView in ScopusGoogle Scholar
[52]
L. Kang, P. Li, D. Wang, T. Wang, D. Hao, X. Qu
サルコペニア患者における腸内細菌叢の多様性、組成、および機能の変化
Sci. Rep., 11 (2021), p. 4628
ScopusGoogle Scholarで見る
[53]
A. Ticinesi, L. Mancabelli, S. Tagliaferri, A. Nouvenne, C. Milani, D. Del Rio, et al.
筋肉量とパフォーマンスが低い高齢者における腸-筋肉軸:ショットガンメタゲノミクスシーケンスによる糞便微生物叢の組成と機能の探索という概念実証研究
Int. J. Mol. Sci.(2020年)、p.21
Google Scholar
[54]
S. Lahiri, H. Kim, I. Garcia-Perez, M.M. Reza, K.A. Martin, P. Kundu, et al.
腸内細菌叢はマウスの骨格筋量と機能に影響する
Sci. Transl. メド(2019年)、11頁
Google Scholar
[55]
K. Nay, M. Jollet, B. Goustard, N. Baati, B. Vernus, M. Pontones, et al.
腸内細菌は最適な筋肉機能に不可欠:グルコースホメオスタシスとの関連性の可能性
Am. J. Physiol. Endocrinol. Metab.、317(2019)、E158-E171ページ
CrossRefView in ScopusGoogle Scholar
[56]
T. 岡本、森野和彦、鵜木聡、中川文雄、レメカ、井田聡、他.
マイクロバイオームによる腸管酢酸産生を介した持久的運動の増強効果
Am. J. Physiol.-Endocrinol. Metab.、316(2019)、E956〜E966頁
CrossRefView in ScopusGoogle Scholar
[57]
S. Ghosh, R. Lertwattanarak, J. Garduno Jde, J.J. Galeana, J. Li, F. Zamarripa, et al.
ヒト加齢に伴う筋TLR4発現の上昇と代謝性内毒素血症
J. Gerontol. A Biol. Sci. Med. Sci.、70(2015)、pp.232-246
CrossRefView in ScopusGoogle Scholar
[58]
N. Thevaranjan, A. Puchta, C. Schulz, A. Naidoo, J.C. Szamosi, C.P. Verschoor, et al.
加齢に伴う微生物異常は、腸管透過性、全身性炎症、マクロファージ機能不全を促進する
Cell Host Microbe, 21 (2017), pp. 455-466
e4
ScopusGoogle Scholarで見る
[59]
R. サルトーリ、V.ロマネッロ、M.サンドリ
筋萎縮と筋肥大のメカニズム:健康と疾患における意義
Nat. Commun., 12 (2021), p. 330
Google Scholar
[60]
L. Zanders, M. Kny, A. Hahn, S. Schmidt, S. Wundersitz, M. Todiras, et al.
敗血症はインターロイキン6、gp130/JAK2/STAT3、筋肉の衰弱を誘導する
J. カシェックス サルコペニア・マッスル, 13 (2022), pp.713-727
CrossRefView in ScopusGoogle Scholar
[61]
C.J. Kelly, L. Zheng, E.L. Campbell, B. Saeedi, C.C. Scholz, A.J. Bayless, et al.
微生物叢由来の短鎖脂肪酸と腸管上皮HIFのクロストークは組織バリア機能を増強する
Cell Host Microbe, 17 (2015), pp.662-671
PDFを見る記事を見るScopusGoogle Scholarで見る
[62]
E.E.カンフォーラ、J.W.ヨッケン、E.E.ブレイク
体重とインスリン感受性のコントロールにおける短鎖脂肪酸の役割
Nat. Rev. Endocrinol., 11 (2015), pp.577-591
CrossRefView in ScopusGoogle Scholar
[63]
E.E. Canfora、R.C.R. Meex、K. Venema、E.E. Blaak
肥満、NAFLD、T2DMにおける腸内細菌の代謝産物
Nat. Rev. Endocrinol., 15 (2019), pp. 261-273
CrossRefView in ScopusGoogle Scholar
[64]
B. ダリール、L.ヴァン・オーデンホーフ、B.ヴァーヴリート、K.ヴァーベック
微生物叢-腸-脳のコミュニケーションにおける短鎖脂肪酸の役割
Nat. Rev. Gastroenterol. Hepatol., 16 (2019), pp.461-478
CrossRefView in ScopusGoogle Scholar
[65]
P. バジパイ、A.ダラ、A.アグラワル
微生物とミトコンドリアとのクロストークと健康:新たなパラダイムの出現
ミトコンドリオン, 39 (2018), pp.20-25
PDFを見る記事を見るScopusGoogle Scholarで見る
[66]
J. フランプトン、K.G.マーフィー、G.フロスト、E.S.チェンバース
骨格筋の代謝および機能の調節因子としての短鎖脂肪酸の可能性
Nat. メタブ, 2 (2020), pp.840-848
CrossRefView in ScopusGoogle Scholar
[67]
M.E. Walsh, A. Bhattacharya, K. Sataranatarajan, R. Qaisar, L. Sloane, M.M. Rahman, et al.
ヒストン脱アセチル化酵素阻害剤である酪酸は、加齢による代謝を改善し、筋萎縮を抑制する
Aging Cell, 14 (2015), pp. 957-970
CrossRefView in ScopusGoogle Scholar
[68]
M.M.ティボー、L.B.ビンデルス
腸肝炎における胆汁酸活性化受容体とマイクロバイオームのクロストーク
トレンド・モル. Med, 28 (2022), pp.223-236
PDFを見る記事を見るScopusGoogle Scholarで見る
[69]
A. ペリーノ、H.デマニー、L.ベラスケス=ビレガス、K.シューンヤンス
健康・疾病・老化における胆汁酸シグナルの分子生理学的研究
Physiol. Rev., 101 (2021), pp.683-731
CrossRefView in ScopusGoogle Scholar
[70]
T. 佐々木、久保山、三田、村田、清水、井上、他。
運動誘導性胆汁酸受容体Tgr5はマウスの骨格筋機能を改善する
J. Biol. Chem., 293 (2018), pp. 10322-10332
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る。
[71]
J. Abrigo, F. Gonzalez, F. Aguirre, F. Tacchi, A. Gonzalez, M.P. Meza, et al.
コール酸およびデオキシコール酸は、TGR5受容体に依存するメカニズムで骨格筋の萎縮を誘導する
J. 細胞生理学, 236 (2021), pp.260-272
CrossRefView in ScopusGoogle Scholar
[72]
L. Koppe, N.J. Pillon, R.E. Vella, M.L. Croze, C.C. Pelletier, S. Chambert, et al.
p-クレジル硫酸はCKDに伴うインスリン抵抗性を促進する
J. Am. Soc. Nephrol., 24 (2013), pp.88-99
ScopusGoogle Scholarで見る
[73]
F. Savira, L. Cao, I. Wang, W. Yang, K. Huang, Y. Hua, et al.
アポトーシスシグナル制御キナーゼ1阻害は尿毒症毒素による心肥大と心腎線維化を抑制する:心腎症候群への影響
PLoS One, 12 (2017), 記事e0187459
CrossRefView in ScopusGoogle Scholar
[74]
T.H. Huang, H.K. Yip, C.K. Sun, Y.L. Chen, C.C. Yang, F.Y. Lee
P-クレシル硫酸はH9C2心筋芽細胞でミトコンドリア過灌流を引き起こす
J. Cell Mol. Med., 24 (2020), pp. 8379-8390
CrossRefView in ScopusGoogle Scholar
[75]
H. Han、J. Zhu、Z. Zhu、J. Ni、R. Du、Y. Dai、et al.
p-クレジル硫酸は心筋細胞のアポトーシスを促進し、慢性腎臓病に伴う心機能障害を悪化させる
J. Am. Heart Assoc.、4(2015)、記事e001852
CrossRefView in ScopusGoogle Scholar
[76]
H.M.ローガー、T.R.リヒト
健康および疾病における微生物性トリプトファン代謝産物
Nat. Commun.、9 (2018), p. 3294
ScopusGoogle Scholarで見る
[77]
Y. 榎木、渡辺裕、荒木理恵、杉本亮太、今福忠彦、富永祐一郎、他。
硫酸インドキシルは、酸化ストレスを介したミオスタチンおよびアトロジン-1の発現を誘導することにより、骨格筋の萎縮を増強させる。
Sci. Rep.、6 (2016), p. 32084
ScopusGoogle Scholarで見る
[78]
Y.L. Lin, C.H. Liu, Y.H. Lai, C.H. Wang, C.H. Kuo, H.H. Liou, et al.
慢性血液透析患者における血清インドキシル硫酸濃度と骨格筋量および筋力との関連:2年間の縦断的解析
Calcif. Tissue Int., 107 (2020), pp.257-265
CrossRefView in ScopusGoogle Scholar
[79]
Y. 榎木洋一郎、渡辺裕之、荒木理恵、藤村亮、石渡和也、今福俊彦、他.
インドキシル硫酸によるミトコンドリア機能障害を介した慢性腎臓病関連サルコペニアへの治療介入の可能性
J. カシェックス サルコペニア・マッスル, 8 (2017), pp.735-747
CrossRefView in ScopusGoogle Scholar
[80]
L. Du, R. Qi, J. Wang, Z. Liu, Z. Wu
クロストリジウム・スポロゲネスの機能性代謝物であるインドール-3-プロピオン酸は、筋組織の発達を促進し、筋細胞の炎症を抑制する。
Int. J. Mol. Sci. (2021), p. 22
Google Scholar
[81]
R. ハイコネン、O. カルカイネン、V. コイスティネン、K. ハンヒネヴァ
食事・微生物関連代謝物5-aminovaleric acid betaine (5-AVAB)の健康・疾病における作用について
トレンド・エンドクリノル(Trends Endocrinol. メタブ, 33 (2022), pp.463-480
PDFを見る記事を見るScopusGoogle Scholarで見る
[82]
M. 趙、魏、李、R. Zhan、C. Liu、J. Gao、他。
腸内細菌叢によるトリメチル-5-アミノ吉草酸の産生は脂肪酸酸化を抑制し、心肥大を促進する
Nat. Commun., 13 (2022), p. 1757
ScopusGoogle Scholarで見る
[83]
J.C.エスピン、A.ゴンザレス=サリアス、F.A.トマス=バルベラン
腸内細菌叢:(ポリ)フェノールの治療効果における重要なファクター
Biochem. Pharmacol., 139 (2017), pp.82-93
PDFを見る記事を見るScopusGoogle Scholarで見る
[84]
M.J.ホートン、A.ケリミ、V.ムーリー、S.トゥモヴァ、G.ウィリアムソン
筋細胞のグルコース代謝の新規調節因子としての腸内細菌叢の異化物質
FASEB J., 33 (2019), pp.1887-1898
CrossRefView in ScopusGoogle Scholar
[85]
J. ロドリゲス、N. ピエール、D. ナスラン、F. ボンタンプ、D. フェレイラ、F. プリーム、他。
骨格筋量の調節因子として新たに発見されたウロリチンB
J. Cachexです。サルコペニア・マッスル,8(2017),pp.583-597
CrossRefView in ScopusGoogle Scholar
[86]
P.A. Andreux, W. Blanco-Bose, D. Ryu, F. Burdet, M. Ibberson, P. Aebischer, et al.
マイトファジー活性化剤ウロリチンAは安全であり、ヒトにおいてミトコンドリアと細胞の健康状態を改善する分子シグネチャーを誘導する
Nat. Metab.、1(2019)、595-603ページ
CrossRefView in ScopusGoogle Scholar
[87]
J. ロドリゲス、O.カイユ、D.フェレイラ、M.フランコー
ザクロ抽出物は急性TNF-α注射によるマウスの骨格筋の衰弱を防ぐ
Mol. Nutr. フード・レス(2017)、61頁
Google Scholar
[88]
T. Pallister, M.A. Jackson, T.C. Martin, J. Zierer, A. Jennings, R.P. Mohney, et al.
腸内細菌叢の多様性を示すメタボロームマーカーとしてのヒプラート:食事による変調とメタボリックシンドロームとの関連性
Sci. Rep.、7(2017)、13670ページ
ScopusGoogle Scholarで見る
[89]
B.F. Bitner, J.D. Ray, K.B. Kener, J.A. Herring, J.A. Tueller, D.K. Johnson, et al.
食事性フラボノイドの一般的な腸内細菌代謝物は、β細胞および骨格筋細胞において強力な保護活性を発揮する
J. Nutr. Biochem., 62 (2018), pp. 95-107
PDFを見る記事を見るScopusGoogle Scholarで見る
[90]
Y. Choi, Y. Kwon, D.K. Kim, J. Jeon, S.C. Jang, T. Wang, et al.
腸内細菌由来の細胞外小胞はインスリン抵抗性を誘導し、それによって骨格筋のグルコース代謝を阻害する。
Sci. レップ、5 (2015), p. 15878
ScopusGoogle Scholarで見る
[91]
M. カパラキス-リアスコス、R.L.フェレロ
細菌外膜ベシクルによる免疫調節機構
Nat. Rev. Immunol., 15 (2015), pp.375-387
CrossRefView in ScopusGoogle Scholar
[92]
E.Y. Lee, J.Y. Bang, G.W. Park, D.S. Choi, J.S. Kang, H.J. Kim, et al.
大腸菌由来ネイティブ外膜ベシクルのグローバルプロテオームプロファイリング
プロテオミクス, 7 (2007), pp.3143-3153
CrossRefView in ScopusGoogle Scholar
[93]
B. シャー、C.J.サリバン、N.E.ロナーガン、S.スタンリー、M.C.スール、L.D.ブリット
循環する細菌膜ベシクルがラットの敗血症を引き起こす
ショック, 37 (2012), 621-628 pp.
ScopusGoogle Scholarで見る
[94]
F. リレイクス、P.S.ザミット
骨格筋の再生に不可欠なサテライト細胞:端にある細胞が再び主役になる
開発』139号 (2012), pp.2845-2856
CrossRefView in ScopusGoogle Scholar
[95]
R.T. Mankowski, R.M. Thomas, D.B. Darden, R.Z. Gharaibeh, R.B. Hawkins, M.C. Cox, et al.
敗血症の安定性?若年成体マウスのGuT微生物叢は老齢成体マウスと比較して敗血症後に全体的な安定性を維持する
ショック, 55 (2021), pp.519-525
CrossRefView in ScopusGoogle Scholar
[96]
S.M. Kim, J.R. DeFazio, S.K. Hyoju, K. Sangani, R. Keskey, M.A. Krezalek, et al.
糞便微生物叢移植は、全身免疫を回復させることでヒト病原体を介した敗血症からマウスを救済する
Nat. Commun.、11 (2020), p.2354
ScopusGoogle Scholarで見る
[97]
Z. デフィリップ、P.P.ブルーム、M.トーレス・ソト、M.K.マンスール、M.R.A.サター、M.H.ハントリー、他。
糞便微生物移植により感染した薬剤耐性大腸菌による菌血症
N. Engl. J. Med., 381 (2019), pp.2043-2050
CrossRefGoogle Scholar
[98]
H. 陳、徐、張、劉、郭、姚
化学療法誘発性栄養失調ラットにおける腸内細菌叢のエネルギー代謝制御による筋力消耗の抑制
キャンサー・ケマザー(Cancer Chemother. 薬学、85(2020)、1049-1062頁
CrossRefView in ScopusGoogle Scholar
[99]
L.B. Bindels、R. Beck、O. Schakman、J.C. Martin、F. De Backer、F. M. Sohet, et al.
急性白血病マウスモデルにおいて、特定の乳酸菌レベルを回復させると、炎症および筋肉萎縮マーカーが減少する。
PLoS One, 7 (2012), Article e37971
CrossRefView in ScopusGoogle Scholar
[100]
L.B. Bindels, A.M. Neyrinck, S.P. Claus, C.I. Le Roy, C. Grangette, B. Pot, et al.
シンバイオティクスによる腸内恒常性の回復と悪液質を伴う白血病マウスの生存期間延長効果
ISME J., 10 (2016), pp. 1456-1470
CrossRefView in ScopusGoogle Scholar
[101]
L.B. Bindels, A.M. Neyrinck, N. Salazar, B. Taminiau, C. Druart, G.G. Muccioli, et al.
非消化性オリゴ糖は腸内細菌叢を調節し、マウスにおける白血病とそれに伴う悪液質の発生を制御する。
PLoS One, 10 (2015), 記事e0131009
CrossRefView in ScopusGoogle Scholar
[102]
B.J. Varian、S. Gourishetti、T. Poutahidis、J.R. Lakritz、T. Levkovich、C. Kwok, et al.
善玉菌が悪液質を抑制する
オンコターゲット, 7 (2016), pp.11803-11816
CrossRefView in ScopusGoogle Scholar
[103]
M.G.レッドマン、E.J.ウォード、R.S.フィリップス
がん患者におけるプロバイオティクスの有効性と安全性:システマティックレビュー
アン. オンコル, 25 (2014), pp.1919-1929
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る。
[104]
W. マンザナレス、M.ルミュー、P.L.ラングロワ、P.E.ウィッシュマイヤー
重症患者におけるプロバイオティクスおよびシンバイオティクス療法:システマティックレビューおよびメタアナリシス
クリット ケア, 19 (2016), p.262
ScopusGoogle Scholarで見る
[105]
M. ニウ、チェンP.
腸内細菌叢と敗血症のクロストーク
火傷のトラウマ(2021年)』9頁
グーグル・スカラー
[106]
A. ザヴィストフスカ=ロジェック、S.ティスキ
プロバイオティクスは、本当に人間にとって安全なのか?
ポル. J. Microbiol, 67 (2018), pp.251-258
CrossRefView in ScopusGoogle Scholar
[107]
C.H. Green、R.A. Busch、J.J. Patel
ICUにおける食物繊維:摂食の常套手段であるべきなのか?
Curr. Gastroenterol. Rep.、23(2021)、p.14
ScopusGoogle Scholarで見る
引用元: (0)
© 2023 Elsevier Masson SASが発行しています。
ScienceDirectについて
リモートアクセス
ショッピングカート
広告を出す
お問い合わせ・サポート
ご利用条件
個人情報保護方針
当社は、サービスの提供や強化、コンテンツや広告のカスタマイズのためにCookieを使用しています。継続することで、クッキーの使用に同意することになります。
著作権 © 2023 Elsevier B.V.またはそのライセンサーもしくは貢献者。ScienceDirect® は、Elsevier B.V. の登録商標です。
