
上皮細胞におけるアリール炭化水素受容体シグナルは、腸におけるHelios+ Tregのリクルートとロケーションを支配している
メインコンテンツへスキップ
ログイン
記事|第39巻 第6号 110773号 2022年5月10日発行
全号ダウンロード
上皮細胞におけるアリール炭化水素受容体シグナルは、腸におけるHelios+ Tregのリクルートとロケーションを支配している
吉松 祐介 7
筋野智久 8
宮本賢太郎 7
今村岳史
吉村昭彦
金井隆典
すべての著者を表示する
脚注を表示する
オープンアクセスDOI:https://doi.org/10.1016/j.celrep.2022.110773
PlumX メトリクス
ハイライト
Indigo naturalis(IN)が大腸のHelios+ Tregを増加させる
IN誘導されたTregは、大腸のクリプトトップ付近に局在する
大腸上皮細胞におけるAhRシグナルはTregの蓄積に不可欠である
IN投与により大腸Tregが誘導され、実験的大腸炎が抑制される
概要
CD4+Foxp3+制御性T細胞(Treg)は大腸のホメオスタシスに必須であるが、局所環境キューが大腸Tregの局在を決定する機構は不明である。ここでは、アジアで潰瘍性大腸炎(UC)患者の治療に使用されている無毒の植物化学物質であるアリール炭化水素受容体(AhR)アゴニスト、indigo naturalis(IN)を投与し、INが大腸のHelios+ TregとMHCクラスII+ 上皮細胞(ECs)を増加することを示しています。TregとMHC class II+ECの相互作用は、定常状態では主に陰窩底部付近で起こるが、IN投与後はTregが劇的に増加し陰窩上部に移動する。さらに、CD25+ T細胞の数は、他の治療法で治療した患者と比較して、IN治療したUC患者のECの表面付近で増加していることがわかった。さらに、大腸におけるHelios+ Tregの蓄積と局在を決定する、腸管ECにおけるさらなるAhRシグナル伝達機構を明らかにした。
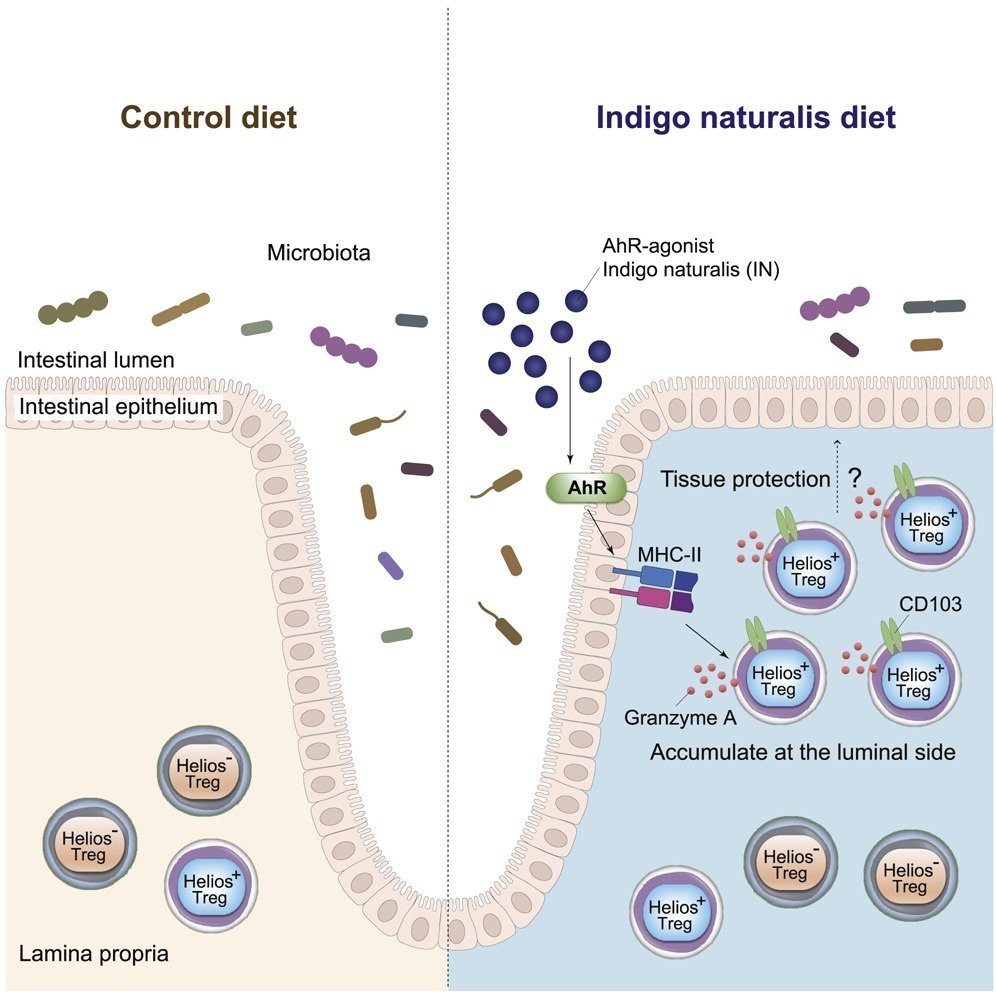
図解抄録
大きな画像を見る
高解像度画像ダウンロード
キーワード
アリールハイドロカーボンレセプター
制御性T細胞
MHCクラスII+上皮細胞
潰瘍性大腸炎
研究テーマ
CP:免疫学
はじめに
腸のホメオスタシスは、食物や微生物由来の抗原やマイクロバイオームそのものによって誘導される病原性T細胞と抗炎症性T細胞のバランスである (
ベルカイドとハンド、2014年
;
本田・リットマン, 2016
;
鎌田ら、2013
). 腸のホメオスタシスを達成・維持するために、CD4+Foxp3+制御性T細胞(Tregs)は哺乳類種において腸の炎症を抑制する(
アタラシら, 2011
;
Brunkowら, 2001
;
堀ら、2003
;
坂口ほか,2013
)は、インターロイキン(IL)-10などの抗炎症性サイトカインや、CD25や細胞傷害性Tリンパ球関連抗原4(CTLA-4)などの細胞表面タンパク質を通じて、他のいくつかのタイプの免疫細胞を抑制することにより、腸管を活性化します。トレグは、腸の恒常性維持に不可欠であり、様々な要因によって誘導される(
Brunkowら、2001年
;
堀ら、2003
). トレグは、Foxp3に加えて主要な転写因子の発現パターンに基づいて、胸腺由来のナチュラルトレグ(thymic Treg, tTregs)と末梢トレグ(pTregs)に分類される。Helios+ tTregsは主に胸腺で生成され、出生時から全身に分布し、自己免疫疾患から守る(
Littman and Rudensky, 2010
;
大倉ら、2013
;
坂口ほか,2008
). 末梢組織では、GATA3を発現するtTregがIL-33受容体ST2を通じてIL-33に応答し、免疫抑制と組織修復に寄与している(
Schieringら、2014年
;
Wohlfert et al., 2011
)であるのに対し、pTregは腸内に最も多く存在し、腸内細菌や細菌由来の代謝物によって誘導される(
アタラシら, 2011
;
柏木ら, 2015
;
ヌッチら、2016
;
坂口ほか,2008
;
セフィクら、2015
;
吉村・武藤, 2011
)や食物抗原(
キムら、2016年
). 特に、トリプトファンの異化物であるキヌレニンは、樹状細胞のアリール炭化水素受容体(AhR)を活性化し、pTregの発生を促進する(
Mezrichら、2010年
)、AhrのTreg特異的な欠失は、in vivoでpTregを減少させるがtTregを減少させない(
Yeら、2017年
). IBD感受性遺伝子であるCARD9遺伝子に変異がある炎症性腸疾患(IBD)患者では、微生物叢由来のAhRアゴニストの減少が観察された(
ラマスら、2016年
)、AhRリガンドが腸の免疫学的ホメオスタシスを維持するという仮説を支持する。無毒のAhRリガンドである2-(1′H-インドール-3′-カルボニル)-チアゾール-4-カルボン酸メチルエステルは、Tregの数を増やすことによって、ヒトCD4+T細胞を介する2,4,6-トリニトロベンゼンスルホン酸誘発大腸炎を改善させる (
ゲッテルら、2016年
). また、インジゴ・ナチュラリス(IN)は、インディゴ、インジルビン、インドール-3-アルデヒドなどのインドール誘導体を含むファイトケミカル化合物である。INは、発酵プロセスによって生成される(
Hsuら、2018年
;
杉本ら、2016a
)、最近ではAhRアゴニストとして難治性の潰瘍性大腸炎(UC)の治療に臨床応用されています(
長沼ら、2018年
;
杉本ら、2016b
;
吉松ほか,2020
). INの有効性は65%~75%であり、抗TNFα剤や副腎皮質ホルモン剤と同等である(
Rutgeertsら、2005年
;
ターナーほか, 2007
). pTregsや他の免疫細胞に対するAhRリガンドの作用が研究されているが(
グティエレス=ヴァスケス、キンタナ、2018年
;
Qiu et al., 2012
;
Quintanaら、2008
,
Quintanaら、2010年
;
ストッキンガーら、2014
;
Yeら、2017年
)、腸内の内因性・外因性AhRリガンドの複雑なネットワークが腸内トレグを制御するメカニズムは不明なままである。
本研究では、AhRアゴニストを含むIN食に曝露することで、腸内細菌叢に依存して大腸のGATA3lo Helios+ RORγt-トレグ(IN-Tregs)が増加することを見いだした。トレグのシングルセル(sc)トランスクリプトーム解析により、IN-トレグではT細胞受容体(TCR)のレパートリーが増加していることが明らかになった。これらのトレグは、INを与えたマウスでは内腔側に近いMHCクラスII陽性上皮細胞(EC)の隣に位置し、INで治療したUC患者ではCD25+ T細胞が大腸の内腔側付近に位置していた。T細胞ではなく、ECにおけるAhRシグナルが、Tregの数の増加と結腸におけるその局在を支配していた。この結果は、ECのAhRシグナルがトレグを増加させ、そのトランスクリプトームプロファイルと局在を変化させるという証拠を提供するものである。
結果
INは大腸のHelios+ Tregを増加させる
植物化学的なAhRアゴニストであるINは、慢性腸炎の治療に用いられているが、その腸内における抗炎症作用は解明されていない。この疑問を解決するため、INを3週間与えたマウス(IN-fedマウス)の腸管免疫細胞のプロファイリングを行った。これまでの報告と一致する(
シャオら、2015
)、qPCRによりAhRシグナルの下流標的であるCyp1a1発現の上昇を介して、INによるAhRシグナルの活性化を確認した(図S1A)。IL-22産生3型自然リンパ球、Tヘルパー1(Th1)、Th17、B細胞、MHCクラスII+抗原提示細胞、マクロファージ、好中球などの腸管免疫細胞の構成は、劇的に変化しなかった(図S1B〜S1F)。しかしながら、Foxp3+ Tregの総数は、CE2食(対照食)を与えたマウス(Ctrl-fedマウス)の数と比較して、INを与えたマウスの大腸(図1A〜1C )および脾臓(図S1G)ではなく、小腸や腸間膜リンパ節(図S1HおよびS1I)の上皮内区画および薄層突起において著しく増加した。
図1INはCTL様特性を持つTregを大腸に特異的に誘導した
フルキャプションを表示
大きな画像を見る
高解像度画像ダウンロード
IN食マウスで増加したトレグの表現型を特徴付けるために、次に、IN食またはCtrl食を与えたタモキシフェン誘導性Foxp3eGFP-Cre-ERT2:Rosa26lsl-tdtomato(iFoxp3Tomato)マウスの大腸CD4+TCRβ+Tomato+トレグの転写体をRNAシーケンス(RNA-sec)により比較した(IN-トレッグとCtrl-トレッグを称する)。偽発見率カットオフ0.2未満で、IN-TregsとCtrl-Tregsでそれぞれ1,537と1,396の遺伝子が高発現した(図1D)。特に、IN-Tregでは、Ikzf2(Heliosをコード)、Gzma(グランザイムAをコード)、Itgae(CD103をコード)、Prf1(パーフォリン-1をコード)の発現レベルが高いことが特徴であり、一方Ctrl-Tregでは、IL10、Rorc、Mafの発現率が高いpTregと関連していた (
ウィブリー他、2019年
)が確認された(図1Dおよび図1E)。
これらの知見は、さらにフローサイトメトリー解析によって検証された。その結果、IN-Tregは主にHelios+ TregとHelios+GZMA+ Tregからなり、Ctrl-Tregと比較して約4倍増加し、大腸の固有層(図2A-2C )と上皮内区画(図2D)において、脾臓、小腸、腸間膜リンパ節では見られなかった(図S2A-S2C)。次に、IN-Helios+ TregとCtrl-Helios+ TregにおけるGzmaとPrf1の発現を検討した。この目的のために、HeliosVenusマウスとiFoxp3Tomatoマウスを交配してHeliosとFoxp3発現のデュアルレポーター(HeliosVenus:iFoxp3Tomatoマウス)を作成し、INまたはCtrl食を与えたHeliosVenus:iFoxp3Tomatoマウスから金星+トマト+細胞として選別した大腸Helios+Foxp3+ TregのmRNA発現量を評価した。予想通り、IN食マウスのHelios+Foxp3+ Tregは、Ctrl食マウスのものと比較して、細胞障害性遺伝子GzmaおよびPrf1をより高レベルで発現した(図2E)。
図2INはHelios+ RORγt-トレグを結腸に蓄積し、Helios+ RORγt-トレグが1週間以内に結腸で増殖し、その後結腸に留まるようにする
フルキャプションを表示
大きな画像を見る
高解像度画像ダウンロード
IN-Tregが細胞溶解活性(GzmaとPrf1)を持つHelios+ tTreg表現型を示すことを考えると(
ラフィンら、2020年
;
シェバッハ, 2009
)、次にtTregsとpTregsのマーカーについて検討した。フローサイトメトリー解析の結果、IN-TregはHeliosと組織常在細胞マーカーCD103を高濃度に発現していた(
Annackerら、2005年
)が、pTregマーカーであるRORγtとc-MAFは低レベルであった(
シュウら、2018年
)や、GATA3やT-betなどの系統決定転写因子(
ユウら、2015年
)(図2F、S2D-S2F)。GATA3+ tTregsはST2を発現し、IL-33刺激後の組織損傷に応答し、組織修復に寄与する(
Schieringら、2014年
;
Wohlfert et al., 2011
). しかしながら、TregにおけるST2の発現レベル(図2F、S2G、およびS2H)および全大腸組織または大腸ECにおけるそのリガンドIl33は、IN-fedマウスでは誘導されなかった(図S2I)。以上のことから、IN-TregはtTregと同様に高レベルのHeliosと低レベルのRORγtを発現するが、ST2やGATA3といった他のtTregメーカーを発現しないことがわかった。
次に、IN-Tregが大腸で増殖するのか、他の臓器から移動してくるのかについて検討した。まず、IN食マウスのTregの動態を解析したところ、IN食曝露後2-3週間でTreg全体とHelios+RORγt- Tregが結腸に集積することがわかった(図2G)。次に、各時点のTregにおける5-エチニル-2′-デオキシウリジン(EdU)の取り込みを評価した。TregおよびHelios+ TregにおけるEdU+細胞の割合は、IN食曝露後1週間で有意に増加したが、2週目および3週目のEdU+細胞の割合は、ベースライン時と同様であった(図2H)。一方、RORγt+ TregのEdU+細胞の割合は、IN食の3週間を通して同程度であった(図S2J)。次に、IN給餌マウスにおいて、Tregが腸間膜リンパ節から大腸に移動する可能性を検討した。FTY720の存在下または非存在下で処理したIN給餌マウスのTregの数を評価した。FTY720は、野生型(WT)マウスのTregにおけるHelios+RORγt-細胞の割合をわずかに増加させた。FTY720で処理したIN-fedマウスの大腸トレグにおけるHelios+RORγt-細胞の割合は、FTY720なしのIN-fedマウスのそれと比較して減少したが、FTY720で処理したIN-fedマウスのトレグにおけるHelios+RORγt-細胞の割合は、FTY720処理Ctrlダイエットマウスのそれと比較して著しく増大した(図2I)。これらのデータは、一部のIN-Tregが二次リンパ系器官から発生しないことを示唆している。さらに、INがナイーブT細胞からHelios+RORγt- Tregの分化を誘導する可能性を検討するために、INまたはCtrl食を与えたRag2-/-マウスにナイーブT細胞を移入した。総トレグおよびHelios+RORγt-トレグの割合は、Ctrl食とIN食を与えたRag2-/-マウスの間で有意差がなかったことから(図S2K)、INは腸内においてナイーブT細胞のHelios+RORγt-トレグへの分化を促進しないことが示された。これらのデータを総合すると、INは組織常在型tTreg表現型を持つ大腸Tregの拡大および採用を制御している可能性が示唆される。
AhRアゴニストINによって誘導されるTregの特徴
INが大腸トレッグに与える影響をより深く理解するために、IN食とCtrl食のマウスの大腸固有層におけるトレッグのトランスクリプトームを比較するために、scRNA-seqを実施しました。この目的のために、解析の1日前にタモキシフェンを投与した後、INまたはCtrl食を与えたiFoxp3Tomatoマウスから大腸CD4+Tomato+細胞を分離した。まず、IN食とCtrl食のマウスのTregのscRNA-seqデータを組み合わせ、5つのクラスター(クラスター0〜4)を不偏的に同定した(図S3A)。Foxp3を発現する4つのクラスター(クラスター0-3)のうち(図3AおよびS3B)、クラスター1および3の相対量は、IN-fedマウスではCtrl-fedマウスのそれと比較して劇的に増加した(図3Bおよび3C)。発現量の異なる遺伝子と遺伝子シグネチャーに基づいて、RorcとMafを発現するRORγt+ Treg(クラスター0)とRORγt- Treg(クラスター1-3)を同定した(図3Aおよび図3D)。これまでの知見と一致する(
ミラガイア他、2019年
)、RORγt+ Tregは、Il10、Ctla4、Gzmbを含む他のTregシグネチャー遺伝子を発現した(図3D)。Ikzf2陽性RORγt-トレグ(図3EおよびS3B)は、Gata3およびIl1rl1を発現するGata3hi組織修復トレグ(「Repair Treg」)(クラスタ2)とGata3loトレグ(クラスタ1および3)にさらに分類された(図3DおよびS3B)。IN食マウスに最も多く存在するGata3lo Tregは、GzmaおよびItgae(それぞれ細胞毒性顆粒およびαEβ7インテグリンをコードする遺伝子[クラスター1])およびItgb1(動員マーカーとして知られている[クラスター3])の発現によって特徴付けられる2つのサブセットからなる。これらの結果は、AhRアゴニストINがin vivoでGATA3lo Helios+ Tregを誘導し、これらのGATA3lo Helios+ TregがCtrl-fedマウスのTregとは異なるトランスクリプトームプロファイルを示すことを示す。
図3AhRアゴニストINによって誘導されるトレグの特徴
フルキャプションを表示
大きな画像を見る
高解像度画像ダウンロード
AhRリガンドINを摂取したマウスにおける大腸Tregの局在の変化
そして、AhRアゴニストであるINが誘導するGATA3lo Helios+ Tregの特徴をさらに明らかにした。遺伝子オントロジー(GO)解析を用いて、GATA3lo Helios+ Treg(クラスタ1および3、IN食マウスの優勢なRORγt- Tregクラスタ)でRepair Treg(クラスタ2、Ctrl食マウスの優勢なRORγt- Tregクラスタ)のものと比較して、著しく富んでいる生物過程を検索した。GATA3lo Helios+ TregsのGO解析では、細胞骨格やアクチンフィラメントに基づくプロセスが有意に濃縮されていたのに対し、Repair TregsのGO解析では、細胞活性化、増殖、発生が有意に濃縮されていた(図S3CおよびS3D)。したがって、我々は、IN誘導Tregは、我々が以前に報告したように、小腸のTregと同様に、非常に移動性の高いものであると仮定した(
スジノら、2016
).
Ctrl食またはIN食を与えたiFoxp3Tomatoマウスの大腸トレグをTomato+細胞として、眼窩内顕微鏡で可視化した。予想通り、Tomato+細胞は、Ctrl飼料を与えたマウスよりもIN飼料を与えたマウスの結腸で著しく速く移動した(図3Fおよび3G;ビデオS1およびS2)。大腸Tregの位置の詳細な図を得るために、大腸の3D再構成を作成した。Ctrl-fedマウスの大腸Tregは、主に陰窩の下部周辺で観察された(図3H、上部;ビデオS3)のに対し、IN-fedマウスのTregの多くは陰窩の上部近くで検出された(図3H、下部、および3I;ビデオS4)。さらに、IN-fedマウスのTregは、クリプト上部のMHCクラスII+ECの近くに位置し、Ctrl-fedマウスのTregは、クリプト下部に観察された。注目すべきは、Ctrl-fedマウスでは、MHC class II+のECが内腔側で低量に検出されたことである(図S3E;動画S5およびS6)。これらのデータは、AhRアゴニストINがECに作用し、その結果、Tregを陰窩の内腔側に引き寄せ、in vivoでその動態を変化させることを示唆している。次に、マウスモデルで示されたように、AhRアゴニストINがUC患者におけるTregの位置を変化させるかどうかを検討した。INは現在、アジアでUC患者の治療薬として使用されていることから(
JiangとCui, 2002
;
長沼ら、2018
)を投与したUC患者の大腸から、IN療法を行った場合と行わなかった場合の粘膜生検試料を採取しました。IN療法を受けたUC患者は、IN療法を受けなかった患者と比較して、クリプト上部付近のTreg(CD25+細胞と定義)の数が増加した(図3Jおよび3K)。これは、INがマウスとUC患者の両方でクリプト上部付近へのTregの蓄積を誘導するという我々の仮説を支持する。
ダウンロード.mp4 (0.58 MB)
.mp4ファイルに関するヘルプ
動画S1. 図3に関連する、Ctrl-dietマウスにおける大腸トレグのイントラビジュアル画像
ダウンロード .mp4 (0.97 MB)
.mp4ファイルに関するヘルプ
動画S2. 図3に関連する、IN-dietマウスにおける大腸トレグのイントラビジュアル画像
ダウンロード .mp4 (3 MB)
.mp4ファイルに関するヘルプ
動画S3. 図3に関連する、結腸におけるTregの局在について
マウスはCtrl食を与えた。
ダウンロード .mp4 (4.19 MB)
.mp4ファイルに関するヘルプ
動画S4. 図3に関連する、結腸におけるTregの局在について
マウスにIN食を与えた。
.mp4ダウンロード (5.23 MB)
.mp4ファイルに関するヘルプ
動画S5. 図3に関連する、結腸におけるTregとMHCクラスII陽性細胞の局在性
マウスはCtrl食を与えた。
ダウンロード .mp4 (10.92 MB)
.mp4ファイルに関するヘルプ
動画S6. 図3に関連する、結腸におけるTregとMHCクラスII陽性細胞の局在性
マウスにはIN食を与えた。
IN食マウスのTregは、インテグリンβ7とヘテロ二量体を形成し、腸内のE-カドヘリンに結合するCD103(図2Fおよび図3D)を高レベルで発現したことを考えると(
セペック他、1994年
;
Paulsら、2001
)、我々は、腸におけるTregと腸管ECの相互作用の可能性を考えた。実際、最近の報告では、TregがMHCクラスII分子を介して上皮幹細胞と相互作用し、腸の恒常性を維持することが示されている(
ビトンら、2018年
). そこで、HeliosVenus:iFoxp3Tomatoマウスの大腸組織サンプルを用いてEpCAMおよびMHCクラスIIの免疫組織学的染色を行い、大腸におけるTregの位置を可視化した。Ctrl飼育マウスでは、ほとんどのTomato+ Tregがクリプトの底部周辺に観察された(図3L)。一方、IN-fedマウスでは、Total(Tomato+)およびHelios+(Tomato+Venus+)Tregが著しく増加し、管腔側付近に位置していた(図3L-3N)。興味深いことに、EpCAMのユビキタスな発現とは異なり、MHC class IIの発現は、Ctrl-fedマウスと比較してIN-fedマウスでは内腔側のECに限定された(図3L)。そこで、INが抗原特異的Tregを誘導している可能性を検討した。Rag2-/-バックグラウンドのオバルブミン(OVA)特異的TCRトランスジェニックマウス(Rag2-/-:OT-II)にOVAとINまたはCtrl食をチャレンジした。Tregの総数およびHelios+ RORγt-およびHelios- RORγt+Tregの割合は、OVAとIN食またはCtrl食を与えたRag2-/-:OT-IIマウス間で同等であり(図S3F)、INが抗原特異的Tregを優先的に誘導しないことを示唆した。一貫して、scRNA/TCR-seqにより、比較的大きなクローンサイズ(1%以上と定義)を有するTreg(図3A〜3Cのクラスタ0〜3)の割合は、IN飼料マウスおよびCtrl飼料マウスの両方で10%未満であり(図S3G)、各クラスタのTCRクローンは、IN飼料マウスではCtrl飼料マウスよりも多様であった(図S3H)。無菌IN飼料を与えた無菌(GF)マウスでは、Tregの総数やHelios+ RORγt-Tregの割合の増加は認められず(図S3I)、INによる大腸Tregの誘導が常在菌に依存していることが示唆された。また、IN食を与えたマウスではマイクロバイオーム組成が変化していることがわかった(図S3J〜S3L)。しかし、これまでの報告では、マイクロバイオームがRORγt+ Tregを誘導すること(
アタラシら, 2011
;
ヌッチら、2016
;
坂口ほか,2008
;
セフィクら、2015
). さらに、抗微生物処理(アンピシリン、メトロニダゾール、硫酸ネオマイシン、またはバンコマイシン)は、IN食下でのHelios+ RORγt-トレグの蓄積を阻害しなかったことから、IN誘導トレグには特定のマイクロバイオームが必須ではないことがわかった(図S3Mおよび図S3N)。これらのデータを総合すると、INは腸内常在菌の存在下でポリクローナルなHelios+ RORγt-Tregsを誘導することが示された。
INによる大腸でのTregの蓄積には、ECのAhRシグナルが必須である。
次に、IN による大腸での Treg の蓄積の基礎となる潜在的な分子メカニズムを明らかにするために、 AhR リガンド IN に主に応答する細胞の種類を調べた。AhRはリガンド依存性の転写因子であり、環境からの合図に応答していくつかの遺伝子を制御する (
Mezrichら、2010年
;
Quintanaら、2010
). AhRシグナルは、TregやECの転写プログラムを直接変化させることにより、腸の恒常性を維持することが報告されている (
Quintanaら、2008年
;
シエーリング他、2017年
). そこで、タモキシフェンを投与し、IN食を3週間摂取させたAhrf/f、Cd4Cre-ERT2:Ahrf/f、VillinCre-ERT2:Ahrf/fマウス(それぞれAhrWT、AhrΔCD4、AhrΔECと称する)における大腸Treg蓄積に対するAhrシグナルによるT細胞およびEC特異性の作用を分析した。IN食を与えたAhRWTマウス(IN-AhRWT)およびIN食を与えたAhRΔCD4マウス(IN-AhRΔCD4)は、Helios+ RORγt-トレグの数の同様の有意な増加を示した(図4Aおよび図S4A)。興味深いことに、Helios+ RORγt-トレグ数は、IN食を与えたAhRΔECマウス(IN-AhRΔEC)では、IN-AhRWTに比べて有意に低かった(図4BおよびS4B)。さらに、トレグにおけるCD103の発現は、IN-AhRΔECマウスでは基底レベルまで低下した(図S4C)。これらの知見は、IN食マウスの結腸におけるHelios+ RORγt-トレグの蓄積には、トレグではなくECにおけるAhRシグナル伝達が重要であることを示している。
図4Helios+ RORγt-トレグの増加には、上皮細胞におけるAhRシグナルが不可欠であること
フルキャプションを表示
大きな画像を見る
高解像度画像ダウンロード
IN食マウスの大腸トレグ増加にECのAhRシグナルが寄与する潜在的な分子メカニズムを明らかにするために、Ctrl食またはIN食を与えたWTマウス(それぞれCtrl-AhRWTおよびIN-AhRWT)とIN-AhRΔECのECを比較するRNA-seqを実施した。これら3つのグループのトランスクリプトームの不偏的階層クラスタリングにより、IN-AhRWTマウスのECのトランスクリプトームは、Ctrl-AhRWTおよびIN-AhRΔECマウスのものとは明らかに異なることがわかった(図S5A)。このことは、INの既知の代表的な成分、AhRリガンド(インジゴ、インジルビン、アントラニル酸を含む)、およびベツリンの混合物は、大腸トレグを増加させるには十分ではなかったが、IN-AhRシグナルがECのトランスクリプトーム変化の主要な決定要因であることを示唆している(図S5B)。IN-AhRWTマウスのECにおいて、Ctrl-AhRWTマウスおよびIN-AhRΔECマウスのECと比較して有意に発現が上昇した331遺伝子のうち、IN-AhRWTマウスのECにおけるMHCクラスII関連遺伝子(H2AAおよびH2ab1)の発現を更に検証した(図5A )。図3Lに示すように、IN-AhRWTマウスはCtrl-AhRWTマウスよりもMHC class II+のECの割合が高く、IN-AhRΔECマウスでは観察されなかった(図5B)。また、無菌IN食を与えたGFマウスは、EC上のMHC class II発現の増加を示さないことを確認したが、これは無菌IN食がGFマウスのHelios+RORγt- Tregを増やさないというデータと一致する(図5CおよびS3I)。これらのことから、腸内細菌叢とAhRリガンドの両方が、大腸ECにおけるMHCクラスII発現に不可欠であることが示された。IN-Tregの誘導におけるECのMHCクラスIIシグナルの関与を明らかにするために、ECのMHCクラスII欠失の遺伝子モデル(H2ab1f/f[MHC IIWT]およびVillinCre-ET2: h2ab1f/f [MHC IIΔEC]マウス)にIN食を与えるか与えないで飼育した(Ctrl-MHC IIWT, Ctrl-MHC IIΔEC, IN-MHC IIWT, IN-MHC IIΔECと称する)(図S5CおよびS5D)。Helios+ Tregの数及び割合は、IN-MHC IIΔECマウスでは、IN-MHC IIWTマウスよりも僅かではあるが有意に少なかった。注目すべきは、IN-MHC IIΔECマウスのHelios+ Tregは、Ctrl-MHC IIΔECマウスのものと比較して依然として増加していたことである(図5D)。これらのデータは、EC上のMHC II発現が、IN-Tregの誘導に部分的に関与していることを示す。また、GO解析の結果、全身プロセス(ヘムオキシゲナーゼ関連遺伝子であるHmox1)、グルタチオン代謝・補酵素代謝経路(Gss、Gclm、Gclc、Aldh1a1)、異種物質刺激に対する応答(AhR標的遺伝子であるCyp1a1)に関する遺伝子が濃縮されていた(図5A及びS5E)。そこで次に、IN食マウスの大腸トレグに対するヘムオキシゲナーゼ阻害剤の影響を評価したところ、亜鉛プロトポルフィリン9がIN食マウスの総トレグおよびHelios+RORγt-トレグを有意に減少させることが確認された(図5E)。IN-MHC IIWTマウスのECではグルタチオン代謝プロセス関連遺伝子が濃縮されていたが(図S5E及びS5F)、グルタチオン阻害剤ブチオニンスルホキシミンの投与は、IN食マウスのHelios+RORγt- Tregsの総数を減少しなかった(図S5G)。これらのデータは、INによってECのAhRを介して誘導されるMHCクラスIIおよびヘムオキシゲナーゼの発現が、大腸におけるIN-トレグの蓄積に重要であることを示している。最後に、ECにおけるIN-AhRシグナルが、腸におけるIN-Tregの局在を決定するかどうかを調査した。大腸標本の3D組織学的構築を行い、Ctrl-AhRWT、IN-AhRWT、IN-AhRΔECマウスのクリプトボトムにおけるCD25+細胞の位置を決定した。予想通り、IN-AhRWTマウスでは、CD25+細胞の位置がIN-AhRΔECマウスやCtrl-AhRWTマウスと比較して有意に内腔側にシフトしていた(図5F)。したがって、これらの知見は、ECにおけるIN-AhRシグナルが、腸におけるIN-Tregの蓄積と局在を支配していることを示唆している。
図5ECのAhRシグナルによって誘導されるMHCクラスII分子とヘムオキシゲナーゼは、Helios+ RORγt-トレグの大腸への集積に重要である。
フルキャプションを表示
大きな画像を見る
高解像度画像ダウンロード
IN食は実験的大腸炎を改善する
INがナイーブT細胞からのTregの分化を促進しないことを踏まえ、大腸炎におけるTregに対するINの影響を明らかにすることを目的とした。この目的のために、ナイーブT細胞(WTマウス由来のCD4+CD45RBhigh細胞)とTreg(iFoxp3Tomatoマウス由来のCD4+TCRβ+Tomato+細胞)を8:1の比率で移植したRag2-/-マウスを解析した(図6A )。これまでの報告と一致する(
パウリーら、1993年
)、ナイーブT細胞とTregを移植したCtrl食のRag2-/-マウスは、共移植Tregの数が少ないため大腸炎を発症した。しかし、INの補充は、大腸炎を有意に改善した(図6B-6D)。ナイーブT細胞およびTregを接種したRag2-/-マウスにINを与えたところ、大腸の炎症および体重減少に重要な免疫サブセットであるTh1細胞(図S6A)の減少が見られた(
Sujinoら、2011
). 養子縁組大腸炎に加えて、IN食はCtrl食と比較してデキストラン硫酸ナトリウム(DSS)誘発大腸炎を改善した(図6E-6H)。特に、IN食を与えたマウスでは、Helios+RORγt- Tregの数が増加したが、Helios-RORγt+ Tregや他の免疫細胞サブセットには影響がなかった(図6Iおよび6J、S6B-S6E)。さらに、IN食は、Tregが存在しないRag2-/-マウスの大腸炎を抑制しなかったことから、INを介した抗大腸炎効果はT細胞依存性であることが示唆された(図S6FおよびS6G)。IN給餌マウスから得られた大腸トレグは機能的であり、Ctrl給餌マウスから得られたものと同様に、CD3/CD28刺激下でナイーブT細胞の増殖を抑制した(図S6H)。これらのデータを総合すると、INは腸内のTregを増加させることにより、in vivoで抗炎症機能を発揮することが示唆された。
図6IN食はHelios+ RORγt-Tregsの増加により大腸炎を改善する。
フルキャプションを表示
大きな画像を見る
高解像度画像ダウンロード
ディスカッション
トレグは、大腸における過剰な炎症の制御に極めて重要な役割を担っており、IBDや自己免疫疾患の治療に向けたTreg療法の開発に関心が高まってきている。ここで、我々は、植物化学物質であるAhRアゴニスト含有化合物であるINが、大腸のクリプトトップ付近でTregの数を優位に増加させることを実証した。このAhRリガンドによって誘導されたTregは、GATA3lo Helios+ RORγt-という特徴を持ち、GzmaやPrf1といった特異的な遺伝子発現プロファイルを持っていた。 INを与えたマウスにおける大腸Tregのlamina propriaのcrypt top付近への集積は、T細胞ではなくECにおけるIN-AhRシグナルに依存していた。さらに、MHCクラスII遺伝子の条件付き欠失や、ECにおけるヘムオキシゲナーゼの化学的摂動は、Tregの総数を減少させた。したがって、IN処理によってTregの数が増加し、DSS誘発大腸炎モデルの重症度が改善された。
現在までに、自己免疫疾患やIBDの患者において、Tregの数を増やし、その機能を強化する試みがいくつかの研究者によってなされている(
クラウら、2020年
;
ラフィンら、2020
). しかし、少数の患者を対象とした臨床試験を除いて、Tregの養子移入の有効性を説明する証拠は限られている(
ブルンシュタイン他、2016年
;
Desreumauxら, 2012
). これは、ヒトTregのFoxp3発現と腸管ホーミング能力を安定的に得ることが困難であることに起因しているのかもしれない。Tregを移植する代わりに、腸内でTregを拡大・動員することはIBD治療の代替戦略であり、AhRは魅力的な治療標的となっている(
グティエレス=ヴァスケス、キンタナ、2018年
). 実際、我々と別のグループは、INや他の無毒なAhRアゴニストが、ヒトとマウスの両方のモデルで大腸炎を改善することを報告している(
ゲッテルら、2016年
;
河合ら、2017
;
長沼ら、2018
;
杉本ら、2016b
;
吉松ほか,2020
). 今回のデータにより、腸内の寛容な環境を誘導する制御メカニズムについて、メカニズム的な知見が加わった。
これまでの研究で、pTregsに対するAhRシグナルの影響が解明されている(
ブランドシュテッター他、2016年
;
Gandhi et al, 2010
;
ゲッテルら、2016
;
Mezrich et al, 2010
;
Monteleone et al., 2011
;
Qiu et al., 2012
)、そして植物化学的なAhRアゴニストの研究により、腸のホメオスタシスと病理の基礎となるメカニズムのいくつかの重要な側面が明らかになりました。IN投与は、ECをプライミングしてMHCクラスII分子を発現させることにより、Tregの数を増加させた。Lgr5+腸管幹細胞とECはMHCクラスII分子を発現し、小腸においてそれぞれIL-10+ TregsまたはHelios- Tregsを誘導する (
ビトンら、2018年
;
スティーブンス他、2021年
). 我々は、定常状態では少数の大腸ECがMHCクラスII分子を発現しており、INは大腸ECのMHCクラスII発現を増強することでTregを増加させることを明らかにした。ECのAhRが欠損すると、Tregの総数がわずかに減少するが、Ctrl食下ではHelios+ Tregは減少しないという観察結果は、ECのAhRシグナルが定常状態でMHCクラスII発現を介してpTregを維持していることを示唆する。
scRNA-seqデータから、IN食マウスのTregは、Tregのエフェクター分子であるGzmaとPrf1を発現するGATA3loHelios+ Tregが中心であることがわかった(
Cao et al, 2007
;
グロスマンら、2004
)と細胞傷害性Tリンパ球(
ヴォスコボイニク他、2015年
). 腸のIN-トレグにおけるエフェクター分子の正確なメカニズムや役割を明らかにするためには、さらなる研究が必要である。IN-トレッグのこの特異的な特徴は、腸の炎症を制御するAhRアゴニストの役割について、メカニズム的な洞察を与える。
腸内細菌叢や食物抗原など、複数の局所環境因子が腸内トレグの発生と維持に寄与している (
ミラガイア他、2019年
;
田之上ほか,2016
;
ウィブリーら、2019年
). しかし、いくつかのtTregは大腸で観察され、微生物抗原に反応する。しかし、tTregは胸腺で自己抗原によって選択されると考えられてきた (
Littman and Rudensky, 2010
;
大倉ら、2013
;
坂口ほか,2008
). 一部のtTregは胸腺ECに提示された微生物抗原によって選択され、大腸の微生物抗原を認識する可能性がある (
Zegarra-Ruizら、2021年
). また、Helios+ Tregは一般的に胸腺由来のTregとして認識されているが、pTregや誘導性Tregはin vitroの環境によってはHeliosを発現する (
Akimovaら、2011年
;
Gottschalk et al, 2012
). TCRレパートリーのポリクローナリティは、TregがHeliosを発現し、腸の免疫学的恒常性を維持するために重要であるようだ (
西尾ら、2015年
;
Thorntonら、2010
). 大腸のIN-トレグには様々なTCRクローン型が観察され、INが抗原特異的Tregを増加させないことが示唆された。IN-TregsとTCR抗原、そして微生物叢の関与は、今後の研究課題として残されている。
我々は、IN-Tregがエフェクター分子だけでなく、CD103も発現することを証明した。CD103は、活性化後に抑制能を持つTregによって発現される(
Annackerら、2005年
;
レーマンら, 2002
;
McHughら, 2002
)、Tregの局在化に必要である(
Schönら, 1999
;
Suffiaら、2005年
). 我々は、IN誘導されたTregが大腸の陰窩上端付近に局在し、一部のTregはMHC II+ECの隣に存在することを明らかにした。さらに、CD25+細胞の陰窩上端付近への局在は、活性化した非トレッグの混入があるにもかかわらず、AhRアゴニストで治療したUC患者において観察された。小腸で観察されたように、Helios+ Tregのごく一部は、前膜から上皮内コンパートメントに移動する可能性がある (
森川ら、2021年
;
スジノら、2016
). しかし、上皮内リンパ球がまばらであるため、(
原田ら、2022年
;
ロンドン他、2021年
;
スジノら、2016
)、IN-induced TregsにおけるCD103の役割と、クリプトの上部または上皮内空間付近への局在は、まだ解明されていない。このダイナミックなプロセスは、主にECのAhRシグナルに依存しているが、T細胞には依存していない。なぜなら、EC特異的AhR欠失マウスにおけるTregの総数および位置は、Ctrl-fedマウスで観察されたものと同様であった。
全体として、ECにおけるAhRシグナルの活性化は、GzmaやPrf1などの細胞毒性機能に関連する遺伝子を発現するHelios+ Tregの集積を誘導することを確認した。 また、AhRシグナルの活性化は、腸管Tregの局在を内腔側近くの腸内に変化させていた。腸やその他の末梢組織におけるトレグの生理的役割や局在を理解することは、自己免疫疾患、感染症、癌の治療戦略のブレークスルーにつながると考えられる。今回のデータは、IBDの治療に無毒なAhRアゴニストを使用する可能性を強調する、説得力のあるメカニズム的洞察を提供するものである。
本研究の制限事項
INを受けるUC患者の数が限られているため、各治療群3名のみからサンプルを取得しました。また、CD25陰性Tregが腸内に存在することはよく知られている。しかし、ヒトのFoxp3陽性細胞は、非サプレッシブ活性化細胞を含め、機能的にも表現型的にも異質である(
宮良ら、2009
;
坂口ほか, 2010
;
杉山ら、2013
). 従って、CD25陽性細胞が抑制細胞であることが示された。腸管上皮におけるAhRシグナルについては、IN-AhRΔECマウスでは、INによって誘導されるHelios+ Tregの割合の増加は完全には防止されなかった。このことは、INによって誘導されたTregの蓄積には、別のメカニズムが寄与している可能性を示している。AhRリガンドであるINには、インジゴやインジルビンなどのAhRリガンドが混在している。したがって、IN-Tregsを増加させる単一の物質は依然として不明である。さらに、IN-Tregsのような細胞傷害性細胞によって抑制される細胞も、依然として同定されてはいない。Tregが様々な抑制機能を持つことを考えると、IN-Tregを含む細胞傷害性細胞と他の標的細胞との相互作用について、さらなる解析が必要である。
STAR★メソッド
キーリソース表
REAGENTまたはRESOURCEIDENTIFIER抗体CD4(クローン:RM4-5;BV421)BiolegendCat# 100544; RRID: AB_11219790CD8α(Clone: 53-6. 7; PE-Cy7)BD BioscienceCat# 552877; RRID: AB_394506CD8β (clone: eBioH35-17.2; APC)eBioscienceCat# 17-0083-81; RRID: AB_657760CD25 (clone: PC61. 5; PE)eBioscienceCat#;12-0251-83;RRID:AB_465607CD44(クローン:IM7;APC)BiolegendCat# 103012;RRID:AB_312963CD45(clone:30-F11; BV510)BiolegendCat#103138;RRID:AB_2563061CD45RB(clone:C363. 16A;PE)eBioscienceCat#;12-0455-82RRID:AB_465681CD45. 1 (クローン: A20; PerCP-Cy5.5)eBioscienceCat#45-0453-82; RRID:AB_1107003CD45. 2(クローン:104;PE-Cy7)BiolegendCat#109830;RRID:AB_1186098CD62L(クローン:MEL-14;FITC)BiolegendCat#104406;RRID:AB_313093CD103(クローン:2-E7;FITC)BiolegendCat#121419;RRID:AB_10714791CD326 (Ep-CAM) (Clone:G8. 8; APC)BiolegendCat#118212; RRID: AB_1134102CTLA-4 (clone: UC10-4F10-11; PE)BD BioscienceCat#553720; RRID: AB_395005TCRβ (clone: H57-597; APC-Cy7)BiolegendCat# 109220; RRID: AB_893624TCRγδ (clone: GL3; PerCP-Cy5. 5)BiolegendCat# 118117; RRID: AB_10612572Foxp3 (clone: FJK-16s; PE)eBioscienceCat# 12-5773-82; RRID: AB_465936Gata-3 (clone: TWAJ; FITC)eBioscienceCat#53-9966-42; RRID: AB_1963600Rorγt (clone: Q31-378; BV421)BD BioscienceCat# 562894; RRID: AB_2687545Helios (clone: 22F6; PE)BiolegendCat#137216; RRID: AB_10660749Granzyme A (clone:GzA-3G8. 5; APC)eBioscienceCat#17-5831-80; RRID: AB_2573228c-MAF (clone:sym0F1; eFluor 660)eBioscienceCat#50-9855-80; RRID: AB_2574388T-bet (clone: 4B10;APC)BiolegendCat#644814;RRID:AB_10901173IL-17A(クローン:eBio17B7;PE)eBioscienceCat#12-7177-81;RRID:AB_763582IFNγ(クローン:XMG1. 2; FITC)eBioscienceCat# 11-7311-82; RRID: AB_465412IL-22 (clone: IL-22JOP; APC)eBioscienceCat# 11-7311-82; RRID: AB_465412E-Cadherin (clone: 36/E-Cadherin; FITC)BD BioscienceCat#612131; RRID: AB_2076677I-A/I-E (clone: M5/114.15.2; PerCP-Cy5. 5)BiolegendCat#107626;RRID:AB_2191071IL-33Rα(ST2)(クローン:DIH9;BV421)BiolegendCat#145309;RRID:AB_2565634CD3e(クローン:145-2C11)BiolegendCat#100359;RRID.AB_2616673化学物質、ペプチド、 および組換えタンパク質タモキシフェンSigma-AldrichCat# T5648コーン油WakoCat# 032-17016ホルボール12-ミリスチン酸13-アセテート(PMA)Sigma- AldrichCat#P8139イオノマイシンSigma-AldrichCat# I9657FTY720≧98%(HPLC)Sigma-AldrichCat# SML0700L-ブチオニンスルホキシミン≧97%(TLC)Sigma-. アルドリッチCat# B2515-1GZinc Protoporphyrin-9CAYMANCat# 14483Fixable Viability Dye eFluor 780eBioscienceCat# 65-0865-14Click-iT™ Plus EdU Alexa Fluor™ 647 Flow Cytometry Assay KitThermo Fisher ScientificCat# C10635Mouse Lipocalin-2/NGAL Duoset Kit ElISA、 5-PlateR&D SystemsCat# DY1857-05Dithiothreitol (DTT)Thermo Fisher ScientificCat# P2325EDTANacalai TesqueCat# 06894-85CollagenaseWakoCat# 032-22364DNase ISigma-。 AldrichCat# DN25PercollGE HealthcareCat# 1789101Ammonium chlorideNacalai TesqueCat# 02424-554% Paraformaldehyde Phosphate Buffer SolutionWakoCat# 163-201458% GlutaraldehydeWakoCat# 533-08681Agarose LMNacalai TesqueCat# 01161- 54ウシ血清アルブミン(BSA)ナカライテスクCat# 01863-48Triton-X100PolysciencesCat# 04605DAPIDojindoCat#D523マウスナイーブCD4+T細胞分離キットMiltenyi BiotechCat# 130-104-. 453TGF-β研究開発システムCat# 7666-MB-005レチノイン酸(RA)東京化成工業Cat# 0064-1GIFN-γペプロテックCat# 315-05牛胎児血清(FBS)サーモフィッシャーサイエンティフィックCat# 10270-。 106HBSSNacalai TesqueCat# 17460-15RPMI1640Nacalai TesqueCat# 30264-85DPBSNacalai TesqueCat# 14249-24Penicillin/streptmycinNacalai TesqueCat# 09367- 34ピルビン酸ナトリウムThermo Fisher ScientificCat# 11360070MEM/NEAAThermo Fisher ScientificCat# 11140050HEPESThermo Fisher ScientificCat# 156300801 mg/mL Mitomycin C SolutionFUJIFILMCat# 133-15931β-. mercaptoethanolThermo Fisher ScientificCat# 21985023TRIzolInvitrogenCat# 15596018Critical commercial assaysiScript cDNA Synthesis KitBioRadCat# 170-8891SYBR Green FAST qPCR Master Mix kitKapa BiosystemsCat# KK4602Foxp3/転写因子染色バッファセットBioscienceCat# 00-5523-00GoldiStop Protein Transport InhibitorBD BioscienceCat# 554724; RRID AB_2869012実験モデル: 生物/系統マウス C57BL/6JThe Jackson LaboratoryJAX:000664Mouse: Cd4creERT2The Jackson LaboratoryJAX:022356Mouse: VillincreERT2The Jackson LaboratoryJAX:020282Mouse: Foxp3eGFP-cre-ERT2The Jackson LaboratoryJAX:016961Mouse: H2ab1fl/fl(
橋本ら、2002
)N.A.(
グルーバー他、2007年
)マウス Ahrfl/flThe Jackson LaboratoryJAX:006203Mouse: ヘリオスヴェヌス(
杉田ら、2015
)N.A.Mouse(エヌエー マウス) Rosa26lsl-tdtomato()です。
マディセンら、2010
)N.A.オリゴヌクレオチドQPCRプライマー北海道システム科学Table S1ソフトウェアとアルゴリズムGraphPad Prism 8GraphPad Softwarehttps://www.graphpad.com/FlowJo Vx softwareTreeStarhttps://www.flowjo.com/ImageJImageJhttps://imagej.net/WelcomeImaris 8.4Bitplanehttps://imaris.oxinst.comDeposited dataRaw RNA sequencing of Tregthe DDBJ BioProjecthttps://ddbj.nig.ac. jp/resource/bioproject/PRJDB13371 (DRA013836)Raw RNA sequencing of IECthe DDBJ BioProjecthttps://ddbj.nig.ac.jp/resource/bioproject/PRJDB13371 (DRA013837)Raw RNA single cell sequencing of Tregthe DDBJ BioProjecthttps://ddbj.nig.ac.jp/resource/bioproject/PRJDB13371 (DRA013838)Raw 16S rRNA sequencethe DDBJ BioProjecthttps://ddbj.nig.ac.jp/resource/bioproject/PRJDB13371 (DRA013839)
新しいタブでテーブルを開く
リソースの確保
リードコンタクト
リソースや試薬に関する詳細な情報およびリクエストは、リードコンタクトの筋野智久 (tsujino1224@keio.jp) にお願いします。
材料の入手方法
本試験で使用したすべてのマウス系統は、リクエストに応じて入手可能です。
この研究では、新しい試薬は生成していない。
実験モデルおよび被験者の詳細
患者様
大腸組織サンプルは、既存の治療法(n = 3)またはIN(n = 3)で治療されたUC患者から得た。ヒト大腸上皮は、大腸再切除または内視鏡組織生検標本から分離した。UCは、厚生労働省の炎症性腸疾患研究班が定めた基準により診断された。すべての実験は慶應義塾大学医学部施設審査委員会の承認を得ており、ヘルシンキ宣言に基づき、すべての患者から書面によるインフォームドコンセントを得た。ヒト結腸組織サンプルの個人提供者は、年齢27-56歳、年齢中央値(IQR)47.5(42.5-50.25)の合計6名を使用しました。患者の年齢は、2つのグループ間で有意な差はない。
動物
C57BL6/J 成体雄性マウス(6-7 週)は、CLEA Japan(東京、日本)より購入した。GF(C57BL6/Nバックグラウンド)マウスは、三共ラボサービス株式会社(東京、日本)より購入した。Foxp3eGFP-CreERマウス、Ahr fl/flマウス、Viilin Cre-ERマウス、Cd4Cre-ERマウスはJackson Laboratories社から購入した。Rosa26lsl-tdTomatoマウスは、Hongkui Zeng博士(Allen Institute, USA)のご厚意によりご提供いただきました。HeliosVenusマウスは、樺島健二氏のご厚意によりご提供いただきました。野村隆(京都大学皮膚科学教室)。H2Ab fl/flマウスは、根本康雄氏(東京医科歯科大学)のご厚意により提供されました。GFマウスを除くマウスは、特定病原体不使用(SPF)条件下で維持された。GFマウスはビニール製のアイソレーターで飼育・管理した。遺伝子型判定は、ジャクソン研究所がそれぞれの系統について定めたプロトコールに従って実施した。すべての実験は、慶應義塾大学動物実験施設審査委員会の承認を得ており、施設のガイドラインおよび本庁の規則に従って行われた。
方法の詳細
タモキシフェン治療
HeliosVenus;Rosa26lsl-tdTomato;Foxp3eGFP-CreERマウスは、犠牲またはイントラビタルイメージングの24時間前に200mg/kgのタモキシフェン(Sigma、米国)で2日間連続してガベージした。VilinCre-ER;Ahrfl/flマウス、VilinCre-ER;H2Ab1fl/flマウスおよびCd4Cre-ER;Ahrfl/flマウスに、100 mg/kgのタモキシフェンを4日間(1週間以内に連続2日)腹腔内(I.P)投与した。タモキシフェンはコーン油(和光)に10 mg/mLで溶解させた。
DSSによる大腸炎の誘発
マウスに与えた滅菌飲料水に2%(wt/vol)のデキストラン硫酸ナトリウム(DSS;分子量:36,000-50,000;MP Biomedicals, Solon, OH, USA)を添加し、大腸炎を誘発しました。DSS投与後6-7日目に補給を中止し、1-2日間無処理水を与え、マウスを犠牲とした。すべてのDSS投与動物の体重と一般的な外観の臨床評価を毎日行った。SPFマウスは毎日体重を測定し、ベースラインからの体重減少の割合を決定した。体重減少、便の硬さ、直腸出血を評価し、疾患活動性指数(DAI)をスコア化した(
林ら、2013
). 体重減少がない場合を0点、ベースラインから1%~5%の体重減少を1点、ベースラインから6%~10%の体重減少を2点、ベースラインから11%~20%の体重減少を3点、ベースラインから20%以上の体重減少を4点として登録しました。便の硬さについては、整ったペレット状のものは0点、肛門に付着しないペースト状や半形状のものは2点、肛門に付着する液体状のものは4点とした。出血については、出血がない場合を0点、出血がある場合を2点、出血が著しい場合を4点とした。大腸は切除され、その長さが記録された。炎症と上皮の損傷の程度は、以下に述べるように、ヘマトキシリンとエオシン(H&E)で染色した結腸の切片を顕微鏡で観察して決定した。
養子縁組移植
CD4+ T細胞は、抗CD4(L3T4)MACS磁気分離システム(Miltenyi Biotec)を用いてC57BL/6J(Ly5.1+)マウスの脾臓から分離された。濃縮されたCD4+ T細胞をCD4、CD45RBおよびCD25 mAbsで染色し、FACSAria(Becton Dickinson, NJ, USA)を用いてCD4+CD25-CD45RBhighフラクションを得るために選別した。脾臓、腸間膜リンパ節(mLN)および大腸ラミナプロプリアのトマト+ CD4+T細胞は、Rosa26lsl-tdTomato x Foxp3eGFP-Cre-ERT2 マウスから得た。精製CD4+CD45RBhigh(3.0×105細胞/マウス)単独またはTomato+CD4+T細胞(3.75×104細胞/マウス)と組み合わせて、RAG-2-/-マウスに腹腔内注射した。マウスは、移植後の指示された時点で犠牲にした。マウスは、4つのパラメータの合計として臨床スコアを評価した:猫背と衰弱、0または1;結腸肥厚、0〜3(0、結腸肥厚なし;1、軽い肥厚;2、中程度の肥厚;3、広範囲の肥厚);および便の一貫性、0〜3(0、通常のビーズ便;1、軟便;2、下痢)、および肉眼的血液が認められた場合は追加点を加えた (
Sujinoら、2011
).
抗生物質による治療
抗生物質(アンピシリン(6.7g/L;SigmaAldrich)、メトロニダゾール(6.7g/L;Sigma Aldrich)、バンコマイシン(3.3g/L;Sigma Aldrich)、または硫酸ネオマイシン(6.7g/L;Sigma Aldrich)は最終濃度で無菌蒸留水に溶解し、マウスに週3回(マウス1匹につき500μL)経口投与しました。
インビトロTreg抑制アッセイ
ナイーブCD4+細胞およびCD11c+抗原提示細胞(APC)は、それぞれナイーブCD4+CD62L+ T細胞およびCD11c+分離キットを用いてC57BL/6J(Ly5.1+)マウスの脾臓から分離した。大腸ラミナプロプリアのトマト+ CD4+T細胞は、FACS Ariaを用いて、Ctrl食またはIN食のRosa26lsl-tdTomato x Foxp3eGFP-Cre-ERT2 mouseから得た。T細胞増殖に対するTregの効果を評価するために、ナイーブCD4+細胞をバイオレット増殖色素(VPD450;BD Biosciences)の希釈溶液で37℃、15分間染色し、CD11c+APCを50μg/mLのMitomycin C(Wako、東京、日本)で37℃、30分処理したのは既報通りである (
カンポス=モーラら、2019年
;
幸田ら、2019
). Naive CD4+ 細胞(4×104)単独または Tomato+ CD4+ T 細胞(2×104)と組み合わせて、96ウェルプレートにおいて、10%ウシ胎児血清、100 U/mL ペニシリン、100 μg/mL ストレプトマイシン、25 mM HEPES、1 mM ピルビン酸ナトリウム、1x MEM/NEAA および 55 μM 2-mercaptoethanol で補充した RPMI-1640 メジウム中で培養を行った。ナイーブT細胞を可溶性α-CD3(2μg/mL)の存在下で3日間刺激し、脾臓からのCD11c+APC(5×104)を(APC)として使用した。 インキュベーション後、細胞を洗浄し、細胞増殖をフローサイメトリで評価した。
組織学的検査
DSS誘発大腸炎後の遠位結腸切片および乾癬様皮膚炎誘発後の皮膚切片を採取し、10%ホルマリン(068-03841、ロットTWE1483;Wako、東京、日本)で固定した。固定したサンプルをパラフィンに埋め込み、Morphotechnology Co, Ltd(札幌、日本)によりH&Eで染色した。DSS誘発大腸炎の重症度を評価するために、組織学的活性度スコア(
Mennigenら、2009年
)(最大合計スコア40)は、3つのパラメータ(範囲、炎症、クリプト損傷)の合計として以下のように評価した: 範囲は0~3点(0、なし、1、粘膜、2、粘膜下層、3、経粘膜)、炎症は0~3点(0、なし、1、軽度、2、中度、3、重度)、クリプト損傷は0~4点(0、なし、1、基底部1/3喪失、2、基底部2/3喪失、3、表面上皮のみ無事、4、クリプト全体と上皮喪失)であった。これらのスコアに、1から4までの広がりに関するスコアを乗じた(1, 0%-25%; 2, 26%-50%; 3, 51%-75%; 4, 76%-100% )。掛け合わせた各スコアを合計し、組織学的スコア(0~40)として定義した。養子縁組大腸炎の重症度を評価するため、病理標本の最も罹患した部分を、細胞浸潤、クリプト伸長、クリプト膿瘍の数の3項目の合計として組織学的スコアを評価した。それぞれ、盲検下で0~3のスケールで採点した。
免疫組織化学
ヒト結腸サンプルを2%PFAで4℃、ロッカー上で一晩固定した。すべてのサンプルを、DPBS中の0.1% Triton X-100 (04605, Polysciences, Inc., Warrington, PA) および5% ウシ血清アルブミン (BSA) (01863-48; Nacalai Tesque) を用いて室温で1時間ブロックおよび透過処理した (
Sontheimer-Phelpsら、2020年
). その後、サンプルはDPBS中の2%BSA中で、以下のコンジュゲート抗体:抗ヒトCD25(BC96、1:200;eBioscience)およびファロイジン-iFluor™ 647 Conjugate(20555、1:2000;Cayman Chemical, Ann Arbor, MI)で4℃で一晩染色されました。マウスの結腸組織を4%PFAで4℃、ロッカー上で一晩固定した。固定した組織をDPBSで20分間3回洗浄し、4%低融点アガロース(ナカライテスク)に埋め込み、ビブラトーム(VT1200S;Leica、Wetzlar、ドイツ)で200μmの切片に切断した。切片をブロッキングバッファー(1%正常マウス血清、1%ウシ血清アルブミン、0.3%Triton X-100を含むDPBS)中で少なくとも8時間インキュベートした。次に、組織をブロッキングバッファーで1:100に希釈した以下のコンジュゲート抗体とインキュベートした:抗マウス Ep-CAM Alexa Fluor 488 (G8.8; Bio Legend, San Diego, CA, USA), 抗マウス I-A/I-E Alexa Fluor 488 (M5/114.15.2; Bio Legend) and anti-mouse CD4 Brilliant Violet 421 (RM4-5; Bio Legend), shaker上で室温から一晩、。画像は、レーザー走査型共焦点顕微鏡(Olympus FV3000; Olympus, Tokyo, Japan)を用いて撮影した。取得した画像は、IMARIS(Bitplane, Zurich, Switzerland)ソフトウェアを用いて解析した。
マウント組織全体のCe3Dクリアリングとイメージング
マウス大腸のボリュームイメージングには、既報の通り、Ce3Dプロトコルを用いて全層標本を組織クリアリングした(
李ら、2017年
). 固定・染色したホールマウント標本を洗浄バッファー(0.2% Triton X-100と0.5% (v/v) 1-thioglycerolを含むDPBS)で1日間、室温で洗浄した。洗浄したサンプルをキムワイプ上で乾燥させ、直ちにCe3Dクリアリング液(22% (v/v) N-methylacetamide, 0.8 g/mL Histodenz, 0.1% (v/v) Triton X-100 and 0.5% (v/v) 1-thioglycerol を含むDPBS)中に1日室温で浸漬させました。クリアリングした組織は、新鮮なCe3Dクリアリング溶液を入れたガラス底の35mmディッシュに埋め込み、カバースリップでしっかりと密閉した。組織は、チタンサファイアレーザー(MaiTai eHP DeepSee, SpectoraPhysics, Santa Clara, CA)を備えた多光子共焦点顕微鏡(A1R-MP; Nikon, Tokyo, Japan)によりz軸の5μmごとにスキャンされました。取得した画像は、IMARIS(Bitplane)ソフトウェアを用いて解析した。
多光子イントラビタルイメージングと細胞追跡
Tregイメージングのために、Foxp3eGFP-CreERマウスをRosa26lsl-tdTomatoマウスと交配し、Foxp3eGFP-CreER:Rosa26lsl-tdTomatoマウス(iFoxp3Tomato)を取得した。マウスは、イントラビタルイメージングの前に、200mg/kgのタモキシフェンで2日間連続してガバメントされた。動物は、トリブロモルタノール(Avertin)1gあたり15mLで麻酔し、処置の間中、1%イソフルラン酸素混合液で保たれた。正中線に沿って腹部皮膚を1cm切開し、ピンセットで結腸を慎重に外挿した。その後、結腸に沿って1cmの切開を行い、さらに2つの垂直な切開を行い、内腔面を露出させた。チタンサファイアレーザー(MaiTai eHP DeepSee、SpectoraPhysics)を搭載した多光子共焦点顕微鏡(A1R-MP、Nikon)を用いてイントラビタルイメージングを実施した。30μmのzスタック画像を最小間隔で10分間取得した。IMARIS(Bitplane)ソフトウェアは、ボリュームレンダリングされた4Dムービーの生成と、細胞運動の半自動追跡に使用された。
リポカリン-2のELISA
リポカリン-2は、Lcn-2 ELISAキット(R&D、MN)を用いて、既述のように分析した(
Chassaing et al, 2012
).
FTY720の治療
蒸留水または蒸留水に溶解したFTY720(1mg/kg)を、先に述べた方法に従って、特別給餌開始日から1日1回、マウスに経口投与した(
片岡ら, 2005
).
大腸IELsとLPLsの分離
上皮内リンパ球(IEL)および腸管ラミナプロプリアリンパ球(LPL)の分離は、既述の通り行った(
ムシダら、2007
). 簡単に言うと、大腸と小腸を解剖し、脂肪組織とPayer's patchesを除去した。腸を縦に切り開き、HBSSで洗浄した後、1cmに切り、洗浄し、1mM DTT (Sigma-Aldrich, St. Louis, MO) と 0.5M EDTA (Thermo Fisher Scientific, Waltham, MA) を含むHBSSで37℃、30分間振とうした。この溶液の上清を、100μmのセルストレーナーを通過させて50mLのファルコンチューブに入れ、上皮細胞を採取した。この細胞を40%等張パーコール液でペレット化し、Ficoll-Hypaque密度勾配遠心分離(40/75%)に供した。同時に、上皮細胞を除いた組織を、ウシデオキシリボヌクレアーゼI(Sigma)およびコラゲナーゼ(富士フイルム和光純薬株式会社、日本)を含むHBSS培地で、小腸は30分、大腸は40分、それぞれ37℃にて消化させた。また、消化組織を激しく振盪してホモジナイズし、100μmのセルストレーナーを通して1%EDTAを含む50mLファルコンチューブに通し、その後、上皮細胞について述べたように、Percollによる勾配遠心分離ステップを経た。IEL と薄層プロプリア単核細胞の両方をパーコール勾配の間期で集め、洗浄し、10% FBS とペニシリン/ストレプトマイシンを含む FACS バッファまたは RPMI-1640 (Sigma) (Gibco, Carlsbad, CA, USA) で再懸濁した。
フローサイトメトリー解析
蛍光色素結合抗体は、BD Pharmingen社(米国)から購入した(抗E-Cadherin, 36/E-Cadherin; 抗RORgt, Q31-378; 抗ICOS, 7E.17 G9;抗GITR、DTA-1;抗CD45.2、104)、eBioscience(抗CD45.1、A20;抗Foxp3、FJK-16s;抗GATA3、TWAJ;抗IL-7Ra、A7R34;抗CXCR3、CXCR3-173;抗CCR7、4B12;抗CD45RB、C363. 16A;抗CD25、PC61.5;抗CD8a、53-6.7;抗IL-17A、eBio17B7;抗IFN-g、XMG1. 2;抗IL-22、IL-22JOP)およびBio Legend(抗CD326、Ep-CAM;G8. 8;抗CD45、30-F11;抗CD103、2-E7;抗ST2、DIH9;抗CD3e、145-2C11;抗CD44、IM7;抗CD62L、MEL-14;抗CCR6、29-2L17;抗Helios、22F6;抗T-β、4B10;抗CD4、RM4-5;抗TCRb、H57-597;抗I-A/I-E、M5/114・15・2)。FACSデータは、FACSCanto II (Becton, Dickinson, NJ, USA)で取得し、FlowJo (Tree Star, Inc. Ashland, OR, USA) で解析した。細胞内染色は、Foxp3 Mouse Regulatory T Cell Staining Kit (eBioscience, USA)を用いて実施した。サイトカイン分泌細胞のフローサイトメトリー解析のために、大腸からリンパ球を分離した後、細胞をRPMI1640に再懸濁した。細胞を刺激するために、50 ng/mL PMA(Sigma)、1 μg/mL Ionomycin(Sigma)および50 ng/mL mouse IL-23 recombinant protein(eBioscience)(IL-22分析用のみ)の存在下で、5% CO2下、37℃で4時間インキュベートした。サイトカインの分泌を阻害するため、インキュベーション開始2時間後にGolgiStop(BD Biosciences社製)を添加した。死細胞はFixable Viability Dye eFluor (eBioscience)を用いて除外した。ライブセル集団は、細胞表面抗原を染色する前に、FcγRブロッキングモノクローナル抗体(抗マウスCD16/32, 2.4G2, 553142, lot 7248907; BD Biosciences, San Diego, CA)とプレインキュベートした。FcγRブロッキング後、指示された細胞表面マーカーに対する抗体で染色し、その後、Fix/Permバッファーで透過処理し、Perm/Washバッファー(BD Pharmingen)でキット説明書に従って細胞内染色を行いました。
In vivo EdU取り込み試験
EdU標識は、Click-iT® Plus EdU Cytometry Assay Kit(Molecular Probes)を用いて、既述のように実施しました(
網谷ら、2016
). 簡単に説明すると、WTマウスに400μg/headのEdUを3日間連続で腹腔内注射した。最後のEdU注射から1時間後にマウスを犠牲にし、各臓器から得られた細胞をフローサイトメトリーで分析した。
RNA単離および定量的リアルタイムPCR
Trizol reagent (Ambien, USA)を用いたトータルRNAの単離は、製造者の指示に従い実施した。抽出したRNAから、iScript complementary DNA Synthesis Kit (1708891, lot 64086966; Bio-Rad, Hercules, CA)を用いて、逆転写により相補的DNAを製造者の指示に従って合成した。得られた相補的DNAを、プライマーセット(表S1)およびSYBR Green FAST qPCR Master Mixキット(KK4602、ロット004569-4-1;Kapa Biosystems, Wilmington, MA, USA)を用いて定量リアルタイムポリメラーゼ連鎖反応(PCR)によって増幅し、遺伝子発現を比較サイクル閾値法によって定量化した。内部コントロールとしてRpl32を用い、内部コントロールの発現量と比較して相対的な遺伝子発現量を決定した。PCR反応は、まずサンプルを95℃で3分間加熱した後、95℃3秒、60℃20秒の2段階を40サイクル適用した。定量的リアルタイムPCRは、Step OnePlus real-time PCR system (Thermo Fisher Scientific)で行った。
シングルセルRNAシークエンス(scRNA-seq)
選別したばかりのTreg細胞(5,327 Ctrl-Tregおよび7,419 IN-Treg)を液滴に封入し、Chromium Single Cell 3′ Reagent Kits v2を用いてメーカーのプロトコル(10X Genomics)に従ってライブラリーを調製した。作成したscRNA-Seqライブラリーは、DNBSEQ-G400(BGI)を用いて、28bpのファーストリードと100bpのセカンドリード(ペアエンドリード)を用いて配列決定しました。すべてのサンプルのシーケンスリードは、Cell Ranger(10X Genomics)で処理した。処理されたデータは、Seurat version 3.2.3 (
マコスコ他、2015年
). Seuratを使用し、公式ビネット(https://satijalab.org/seurat/articles/integration_introduction.html)に従って処理データの集計・解析を行った。具体的には、PCA解析によりクラスターを同定し、正規化された遺伝子発現を持つ5つの遺伝子クラスター(0-4)をUMAP空間上に投影した。各クラスターの上位10個の差分発現遺伝子を不偏的に生成した遺伝子発現ヒートマップが作成された(図3D)。scTCR-seqについては、Cell Rangerを使用して定義されたすべてのクロノタイプをすべてのライブラリアノテーションファイルで識別し、クロノタイプ情報をscRepertoire version 1.3.2 (https://ncborcherding.github.io/vignettes/vignette.html) によって統合した。
バルク mRNA シーケンス
マウスから選別したばかりの細胞やin vitroで様々な条件で刺激した細胞約20,000~50,000個をTRIzol(Life Technologies)で溶解し、Direct-zol RNA MicroPrep(Zymo Research)を使用して全RNAを抽出した。続いて全RNAを、NEBNext Poly(A) mRNA Magnetic Isolation Module(NEB、E7490S)、NEBNext Ultra RNA Library Prep Kit for Illumina(NEB、E7530S)、NEBNext Multiplex Oligos for Illumina (Index Primers Set 1) (NEB、E7335S)を用いてmRNA-Seqライブラリーを生成し、提供されているプロトコルに従って処理した。ライブラリーは、HiSeq 3000(Illumina)を用いて150サイクル(ペアエンドリード)配列決定した。配列決定されたリードの品質トリミングと3′-エンドアダプタークリッピングは、trim_galore(v 0.6.4_dev)を用いて同時に実行した。転写物の存在量を定量化するために、salmon(v 1.14.0)を用いてRNA-SeqリードをENSEMBL転写物(GRCm38.p6)に疑似アラインし、RパッケージTCC-GUIを用いて遺伝子発現差異解析の評価を行いました。正規化法は、M値のトリム平均(TMM)を使用した。差分発現遺伝子同定法にはedgeR(カットオフFDR <0.1)を使用した。ボルケーノプロットはTCC-GUIを使用して作成した。ヒートマップはRパッケージでgplots (v 3.1.1) とpals (v 1.6)を用いて作成した。主成分分析(PCA)および遺伝子オントロジー(GO)濃縮分析は、iDEP.92ツール(http://bioinformatics.sdstate.edu/idep92/)を用いてTMM値を用いて生成した。GO分析および遺伝子セット濃縮分析(GSEA)は、clusterProfiler version 4.0.5で実施した。
多光子イントラビタルイメージングと細胞追跡
ECの核は、イメージング前にHoechstで染色した。動物は2.5%トリブロモエタノール(Avertin)15 mL/gで麻酔し、処置中は1%イソフルラン酸素混合液で保温した。腹側小切開から終末回腸のループを露出させ、高温使い捨て焼灼ペン(Bovie Medical, USA)を用いて腸を切り開き、粘膜側を露出させた。金属ピンを含むプラスチックリングに取り付けたラミナを用いて、組織をサーマルプレイドウ(Laird Technologies, USA)内で固定した。画像は、A1MP正立多光子システム(Nikon, Japan)で、それぞれ平均30分間取得した。データはIMARISソフトウェアを用いて解析した。ターゲット細胞は、適切なチャンネル強度の共局在を使用して識別された。自動回帰トラッキングアルゴリズムは、デフォルトの設定で実行され、リンパ球の正しい識別の手動検証を含め、すべてのサンプルについて同じアルゴリズムで細胞追跡が実行されました。蠕動運動(短時間で複数のコンパートメントが切り替わることを指す)の影響を受けた細胞トラックは自動的に除外した(全サンプルで除外した細胞の平均割合は5.4±2.4%)。距離は、Hoechst染色されたIEC核のレンダリングサイズに基づいて、各ムービーで正規化した。可能であれば、同じ動画内の複数のクリプトのデータをプールした。
定量化および統計解析
統計解析は、Graph-Pad Prism software version 8.0 g (GraphPad)を用いて行った。結果は、サンプル数に応じて、平均値±SDまたは±SEMで表した。データのグループは、腸内細菌叢の主座標分析を除き、Tukey多重比較ポストホック分析または学生t検定またはMann-Whitney U検定による一元配置分散分析で比較された。主座標分析の差は、順列多変量分散分析(PERMANOVA)で分析された。p値が0.05未満の場合に有意な差と判断した。実験の統計的な詳細はすべて各図の凡例に示されている。
データおよびコードの利用可能性
RNA-seq実験の生データはRDAに寄託されており、出版日現在で公開されている。アクセッション番号は、主要リソース表に記載されています。
本論文はオリジナルコードを報告していません。
本論文で報告されたすべてのデータは、要求に応じてリードコンタクトによって共有されます。
本論文で報告されたデータを再分析するために必要な追加情報は、要求に応じてリード・コンタクトから入手できます。
謝辞
井戸智恵美、野村恵那、幸田雄三、清原宏樹、谷木伸仁、岡林浩二(慶應義塾大学)、Daniel Mucida(ロックフェラー大学)、Mariya London(ニューヨーク大学)、堀正平(東京大学)、知念孝俊(九州大学)、宮本都大には、原稿に対する議論と読解、JKic、慶応コアファシリティにはマルチフォトン顕微鏡を手伝ってもらったことに感謝しています。本原稿のドラフトを編集してくれたエダンズ(https://jp.edanz.com/ac)のMelissa Crawford, PhDに感謝します。日本学術振興会の科学研究費補助金(17K19668, 17H05082, 19K22624, 20H03665, 21K18272 to T.S., 21K07084 to K.O., 19K08402 to N.H., 21H02905 to H.O..、 20H00536 to T.K., 17H06175 and JP21H05044 to A.Y.), 日本医療研究開発機構 (19ek0109214 to T.S. and CREST-16813798, 21gm1510002h0001 to T.K..、 CREST-1110009, CREST JP21gm1110009, and MOON SHOT JP21zf0127003h to A.Y.), ヤクルト生命科学研究財団 (T.S.), 慶應義塾大学医学研究費(坂口記念、福澤記念) (T.S..). )、武田科学振興財団、持田記念財団(T.S.)、GSK科学振興財団(T.S.)、JSR研究基金(T.S.)、三菱財団(T.K)、高松宮記念癌研究財団、安田医学財団 (A.Y.).
著者貢献
概念化: Y.Y.およびT.S.、方法論: Y.Y.、K.M.、T.S.、Y.H.、S.T.、K.O.、S.U.、K.Y.、T.S.、N.S、 K.T. K.S., T.I.; investigation: Y.Y.、K.M.、T.S.、Y.H.、N.S.、可視化: Y.Y.、K.M.、T.S.、Y.H.、N.S.;資金獲得: T.S.、N.H.、H.O.、A.Y.、T.K.、プロジェクト管理:T.T.S.、監督:T.S.: T.S.およびT.K.、執筆 - 原案: Y.Y.およびT.S.、および執筆-レビュー&編集: K.M.、Y.Y.、Y.M.、N.N.、A.Y.、T.K.
利害関係の宣言
K.M.およびT.S.は、宮里山製薬株式会社の従業員です。
補足説明
.pdfをダウンロード (6.01 MB)
pdfファイルに関するヘルプ
資料S1. 図S1〜S6
参考文献
アキモワ T.
ベイヤー U.H.
Wang L.
レヴィンM.H.
Hancock W.W.
ヘリオス発現は、T細胞の活性化と増殖のマーカーである。
PLoS One. 2011; 6: e24226https://doi.org/10.1371/journal.pone.0024226
記事で見る
スコープス (275)
パブコメ
クロスリファレンス
Google Scholar
アミヤ・ティ
ナカモト・N.
チュウ P.S.
テラタニ T.
中島裕之
福地 祐子
タニキ N.
山口 晃
柴 聡
三宅理恵.
他
組織常在マクロファージとは異なる骨髄由来マクロファージは、CCR9軸を介してコンカナバリンA誘発マウス肝障害に極めて重要な役割を果たす.
Sci. Rep. 2016; 6: 35146https://doi.org/10.1038/srep35146
記事で見る
スコープス (22)
パブコメ
クロスリファレンス
グーグルシュラー
アナッカー O.
クームス・J.L.
マルムストローム V.
ウーリッグH.H.
ボーン T.
ヨハンソン-リンドボムB.
アゲイス W.W.
パーカー C.M.
パウリーF.
実験的大腸炎のT細胞による制御におけるCD103の重要な役割。
J. Exp. Med. 2005; 202: 1051-1061https://doi.org/10.1084/jem.20040662
記事で見る
スコープス(408)
パブコメ
クロスリファレンス
グーグルシュラー
アタラシ K.
田之上哲也
嶋 毅
今岡 敦
桑原 亨
百瀬由美子
チェン G.
山崎 聡
齋藤 孝
大場義雄.
他.
土着菌による大腸制御性T細胞の誘導.
Science. 2011; 331: 337-341https://doi.org/10.1126/science.1198469
記事で見る
スコープス (2634)
パブコメ
クロスリファレンス
グーグルシュラー
ベルカイド Y.
ハンドT.W.
免疫と炎症における微生物叢の役割。
Cell. 2014; 157: 121-141https://doi.org/10.1016/j.cell.2014.03.011
記事で見る
スコープス (2576)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ビトン M.
ハーバーA.L.
ロジェル N.
バーギンG.
ベヤズS.
シュネルA.
アシェンバーグ O.
スーC.W.
スミリー・C.
シェカールK.
他
Tヘルパー細胞サイトカインが腸管幹細胞の再生と分化を調節している。
Cell. 2018; 175: 1307-1320.e22https://doi.org/10.1016/j.cell.2018.10.008
記事で見る
スコープス (238)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ブランドシュテッターO.
シャンツO.
ヴォラック J.
ケーニッヒ J.
森 毅
Maruyama T.
コルコウスキー M.
ハールマン=ステンマン T.
フォン・スモリンスキーD.
シュルツェJ.L.
他
アリール炭化水素受容体抑制因子の細胞種特異的発現による腸管と全身の炎症のバランス調整
Sci. Rep. 2016; 6: 26091https://doi.org/10.1038/srep26091
記事で見る
スコープス (42)
パブコメ
クロスリファレンス
Google Scholar
ブランコウ M.E.
ジェフェリーE.W.
ヒェリルド・K.A.
ペーペーB.
クラーク・L.B.
ヤサイコS.A.
ウィルキンソンJ.E.
ガラスD.
ジーグラー S.F.
ラムズデル F.
新しいフォークヘッド/翼状螺旋タンパク質であるスカーフィンの破壊は、スカーフィーマウスの致命的なリンパ増殖性障害をもたらす。
Nat. Genet. 2001; 27: 68-73https://doi.org/10.1038/83784
記事で見る
スコープス(2031)
パブコメ
クロスリファレンス
Google Scholar
ブルンスタイン C.G.
ミラーJ.S.
マッケンナD.H.
ヒッペンK.L.
デフォール T.E.
サムスタッド D.
カーツィンガーJ.
ヴェルネリス M.R.
マクミランM.L.
レヴィンB.L.
他
GVHDを予防する臍帯血由来T制御細胞:動態、毒性プロファイル、および臨床効果。
Blood. 2016; 127: 1044-1051https://doi.org/10.1182/blood-2015-06-653667
記事で見る
スコープス (278)
パブコメ
クロスリファレンス
Google Scholar
カンポス-モーラM.
コントレラス=カレンス P.
ガルベス・ジロン F.
ロハス・M.
ロハス C.
レフィシュ A.
セルダ O.
ピノ=ラゴス K.
CD4+Foxp3+T制御細胞は、ニューロピリン-1依存的にエフェクターCD4+T細胞を調節することにより、移植耐性を促進する。
Front. Immunol. 2019; 10: 882https://doi.org/10.3389/fimmu.2019.00882
記事で見る
スコープス (20)
パブコメ
クロスリファレンス
Google Scholar
Cao X.
カイ・S.F.
フェーニガー・T.A.
ソン J.
コリンズ L.I.
ピウニカ=ワームス D.R.
レイ T.J.
グランザイムBとパーフォリンは、制御性T細胞を介した腫瘍クリアランスの抑制に重要である。
Immunity. 2007; 27: 635-646https://doi.org/10.1016/j.immuni.2007.08.014
記事で見る
スコープス (602)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
セペック K.L.
ショー・S.K.
パーカー C.M.
ラッセルG.J.
モロー J.S.
リム D.L.
Brenner M.B.
E-カドヘリンとαEβ7インテグリンを介した上皮細胞とTリンパ球の接着。
Nature. 1994; 372: 190-193https://doi.org/10.1038/372190a0
記事で見る
スコープス (974)
パブコメ
クロスリファレンス
Google Scholar
シャッサイン・ビー
スリニバサンG.
デルガドM.A.
ヤングA.N.
ゲウィルツA.T.
ヴィジャイ・クマールM.
便中リポカリン2、腸内炎症の高感度かつ広範な動的非侵襲性バイオマーカー。
PLoS One. 2012; 7: e44328https://doi.org/10.1371/journal.pone.0044328
記事で見る
スコープス(310)
パブコメ
クロスリファレンス
Google Scholar
クラウ J.N.
オマーO.S.
タスカー S.
ロードG.M.
Irving P.M.
クローン病における制御性T細胞療法:課題と進歩。
Gut. 2020; 69: 942-952https://doi.org/10.1136/gutjnl-2019-319850
記事で見る
スコープス (62)
パブコメ
クロスリファレンス
Google Scholar
デスルモー P.
フーサットA.
アレーズ M.
ボーグリーL.
エビュテルヌ X.
ブーニク Y.
ナチュリーM.
ブリュン V.
バスティアン H.
ベルモンテ N.
他。
難治性クローン病患者に対する抗原特異的制御性T細胞療法の安全性と有効性.
Gastroenterology. 2012; 143: 1207-1217.e2https://doi.org/10.1053/j.gastro.2012.07.116
記事で見る
スコープス (278)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ガンジー R.
クマール D.
バーンズ E.J.
ナドー M.
デイク B.
ラローニ A.
コゾリズ D.
ワイナー H.L.
Quintana F.J.
アリール炭化水素受容体の活性化により、ヒト1型制御性T細胞様およびFoxp3(+)制御性T細胞が誘導される。
Nat. Immunol. 2010; 11: 846-853https://doi.org/10.1038/ni.1915
記事で見る
スコープス (346)
パブコメ
クロスリファレンス
Google Scholar
ゲッテルJ.A.
ガンジー・R.
ケニソンJ.E.
イエステ A.
ムルガイヤン G.
サンバンタムオルティS.
グリフィス A.E.
パテル B.
シュヴァル D.S.
ウェイナーH.L.
ら
AHR活性化は、ヒト化マウスのT細胞によって駆動される大腸炎に対して保護的である。
セル・レップ 2016; 17: 1318-1329https://doi.org/10.1016/j.celrep.2016.09.082
記事で見る
スコープス (115)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ゴットシャルクR.A.
コルス E.
アリソン J.P.
末梢性Foxp3+制御性T細胞におけるHeliosの発現。
J. Immunol. 2012; 188: 976-980https://doi.org/10.4049/jimmunol.1102964
記事で見る
スコープス (227)
パブコメ
クロスリファレンス
Google Scholar
グロスマン W.J.
バーブスキーJ.W.
バーシェット・W.
コロンナ M.
アトキンソンJ.P.
レイ・T.J.
ヒトT制御細胞はパーフォリン経路を利用して自己の標的細胞死を引き起こすことができる。
Immunity. 2004; 21: 589-601https://doi.org/10.1016/j.immuni.2004.09.002
記事で見る
スコープス (769)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
グルーバー M.
フー・C.J.
ジョンソン・R.S.
ブラウン E.J.
キース B.
サイモン M.C.
Hif-2αの出生後の急性アブレーションは貧血をもたらす。
Proc. Natl. Acad. Sci. U.S.A. 2007; 104: 2301-2306https://doi.org/10.1073/pnas.0608382104
記事で見る
スコープス(350)
パブコメ
クロスリファレンス
Google Scholar
グティエレス=ヴァスケス C.
クインタナ F.J.
アリールハイドロカーボン受容体による免疫応答の制御。
Immunity. 2018; 48: 19-33https://doi.org/10.1016/j.immuni.2017.12.012
記事で見る
スコープス(411)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
原田康夫
スジノT.
宮本和彦
野村英世
吉松由美子
種本 聡
梅田 聡
小野紘一
三上洋一
中本直樹.
他.
上皮内CD4(+)CD8α(+)Tリンパ球の細胞内代謝適応.
iScience. 2022; 25: 104021https://doi.org/10.1016/j.isci.2022.104021
記事で見る
スコープス (6)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
橋本 圭一
ジョシ S.K.
コニ P.A.
主要組織適合性IA-β鎖遺伝子の条件付きヌルアレル。
Genesis. 2002; 32: 152-153
記事で見る
スコープス (54)
パブコメ
クロスリファレンス
Google Scholar
林 敦
佐藤 孝
鎌田直樹
三上陽子
松岡 圭一
久松 毅
日比忠明
ロアーズA.
ヤギタ・ヒデ
オオテキ・ティ.
他
クロストリジウム・ブチリカムの単一株は、腸内IL-10産生マクロファージを誘導し、マウスの急性実験性大腸炎を抑制する。
Cell Host Microbe. 2013; 13: 711-722https://doi.org/10.1016/j.chom.2013.05.013
記事で見る
スコープス (194)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ホンダ K.
リットマンD.R.
適応免疫のホメオスタシスと疾患における微生物叢。
Nature. 2016; 535: 75-84https://doi.org/10.1038/nature18848
記事で見る
スコープス (1001)
パブコメ
クロスリファレンス
Google Scholar
堀 聡
野村哲也
坂口 聡
転写因子Foxp3による制御性T細胞の発生制御。
Science. 2003; 299: 1057-1061https://doi.org/10.1126/science.1079490
記事で見る
スコープス (51)
パブコメ
クロスリファレンス
Google Scholar
シュー T.M.
ウェルナーD.H.
ラスZ.N.
セルバンテスB.
プラトゥーリR.L.
アダムス P.D.
デューバー J.E.
持続可能な藍染め戦略のための生化学的保護基の使用。
Nat. Chem. Biol. 2018; 14: 256-261https://doi.org/10.1038/nchembio.2552
記事で見る
スコープス (1)
パブコメ
クロスリファレンス
Google Scholar
江 X.L.
Cui H.F.
中国における潰瘍性大腸炎10218例の解析。
World J. Gastroenterol. 2002; 8: 158-161https://doi.org/10.3748/wjg.v8.i1.158
記事で見る
スコープス (179)
パブコメ
クロスリファレンス
Google Scholar
鎌田直樹
Seo S.U.
チェン・G.Y.
Núñez G.
免疫と炎症性疾患における腸内細菌叢の役割。
Nat. Rev. Immunol. 2013; 13: 321-335https://doi.org/10.1038/nri3430
記事で見る
スコープス (1404)
パブコメ
クロスリファレンス
Google Scholar
柏木勇夫
森田理恵子
シチタ・ティ
駒井 圭一
佐伯啓太
松本真一
武田 圭一
野村宗弘
林 敦
金井 毅.
他
Smad2 と Smad3 は、Clostridium butyricum 活性化樹状細胞における TGF-β 自己誘導を逆調節する。
Immunity. 2015; 43: 65-79https://doi.org/10.1016/j.immuni.2015.06.010
記事で見る
スコープス (126)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
片岡秀樹
スガハラK.
島野和彦
手島 圭一
小山真理子
福成 敦
千葉 圭一
スフィンゴシン1リン酸受容体モジュレーターFTY720は、T細胞浸潤の抑制により実験的自己免疫性脳脊髄炎を改善する。
Cell Mol. Immunol. 2005; 2: 439-448
記事で見る
パブコメ
Google Scholar
河合 聡.
飯島浩司
新崎 聡
檜山 聡
山口智子
荒木美智子
岩谷聡
白石英明
向井亜紀
井上哲也.
他
Indigo Naturalisは、アリールハイドロカーボン受容体の活性化を介して、マウスデキストラン硫酸ナトリウム誘発大腸炎を改善する。
J. Gastroenterol. 2017; 52: 904-919https://doi.org/10.1007/s00535-016-1292-z
記事で見る
スコープス (61)
パブコメ
クロスリファレンス
Google Scholar
キム・K.S.
ホン・S.W.
Han D.
Yi J.
Jung J.
ヤン B.G.
リーJ.Y.
リー M.
スールC.D.
食餌性抗原は小腸の制御性T細胞を誘導することにより粘膜免疫を制限する。
サイエンス(Science)。2016; 351: 858-863https://doi.org/10.1126/science.aac5560
記事で見る
スコープス (319)
パブコメ
クロスリファレンス
Google Scholar
幸田陽子
ナカモト・N.
チュウ P.S.
ウガムラ・ア
三上陽子
テラタニ T.
辻川裕子
シバ S.
タニキ N.
スジノT.
他
プラズマサイトイド樹状細胞はIL-35を介して免疫介在性急性肝障害を予防する。
J. Clin. Invest. 2019; 129: 3201-3213https://doi.org/10.1172/jci125863
記事で見る
スコープス (0)
パブコメ
クロスリファレンス
Google Scholar
ラマスB.
リチャードM.L.
ルドゥックV.
ファムH.P.
ミッシェルM.L.
ダ・コスタ G.
ブリドノー C.
ジェグー S.
ホフマン・T.W.
ナティヴィダードJ.M.
他
CARD9は、トリプトファンの腸内細菌叢によるアリール炭化水素受容体リガンドへの代謝を変化させることで大腸炎に影響を与える。
Nat. Med. 2016; 22: 598-605https://doi.org/10.1038/nm.4102
記事で見る
スコープス (755)
パブコメ
クロスリファレンス
Google Scholar
レーマン J.
ヒューンJ.
デ・ラ・ロサM.
マジーナF.
クレッチマーU.
クレン V.
ブルンナーM.
シェフォルド A.
Hamann A.
インテグリンαEbeta 7の発現により、CD25+およびCD25-制御性T細胞のユニークなサブセットが特定される。
Proc. Natl. Acad. Sci. U.S.A. 2002; 99: 13031-13036https://doi.org/10.1073/pnas.192162899
記事で見る
スコープス (409)
パブコメ
クロスリファレンス
Google Scholar
リ・ウー
ジェルマンR.N.
ゲルナー M.Y.
クリアランス強化3D顕微鏡(C(e)3D)による大容量組織でのマルチプレックス定量細胞解析。
Proc. Natl. Acad. Sci. U.S.A. 2017; 114 (E7321-e7330)https://doi.org/10.1073/pnas.1708981114
記事で見る
スコープス (175)
クロスリファレンス
Google Scholar
リトマンD.R.
ルデンスキー A.Y.
炎症の媒介と抑制におけるTh17と制御性T細胞。
Cell. 2010; 140: 845-858https://doi.org/10.1016/j.cell.2010.02.021
記事で見る
スコープス (791)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ロンドンM.
ビラート A.M.
カストロ T.B.R.
スジノ T.
ムシダD.
上皮内リンパ球プログラムの段階的クロマチンおよび転写獲得。
Nat. Immunol. 2021; 22: 449-459https://doi.org/10.1038/s41590-021-00883-8
記事で見る
スコープス (14)
パブコメ
クロスリファレンス
Google Scholar
マコスコ E.Z.
バスー A.
サティヤR.
ネメシュ J.
シェカールK.
ゴールドマンM.
ティロシュ I.
ビアラスA.R.
カミタキ・N.
マーテルステックE.M.
他
ナノリットル液滴を用いた個々の細胞の高度な並列ゲノムワイド発現プロファイリング。
Cell. 2015; 161: 1202-1214https://doi.org/10.1016/j.cell.2015.05.002
記事で見る
スコープス (3721)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
マディセン・L.
ズウィングマンT.A.
サンキンS.M.
オーS.W.
ザリワラH.A.
グー・エイチ.
ウン・L.L.
パルミターR.D.
ホーリィリッツ M.J.
ジョーンズ A.R.
他
マウス全脳を対象とした堅牢でハイスループットなCre報告および特性評価システム。
Nat. Neurosci. 2010; 13: 133-140https://doi.org/10.1038/nn.2467
記事で見る
スコープス(3899)
パブコメ
クロスリファレンス
Google Scholar
マクヒューR.S.
ウィッターズM.J.
ピッキリーロC.A.
ヤングD.A.
シェバッハ E.M.
コリンズ M.
バーン M.C.
CD4(+)CD25(+)免疫制御性T細胞:遺伝子発現解析によりグルココルチコイド誘導型TNF受容体の機能的役割を明らかにした。
Immunity. 2002; 16: 311-323https://doi.org/10.1016/s1074-7613(02)00280-7
記事で見る
スコープス (0)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
メンニゲンR.
ノルテ K.
ライッケン E.
ユーテック M.
ロフラー B.
センニンガー N.
Bruewer M.
プロバイオティクス混合物VSL#3は、大腸炎のマウスモデルにおいて、タイトジャンクションタンパク質の発現を維持し、アポトーシスを防止することにより上皮バリアを保護する。
Am. J. Physiol. Gastrointest. Liver Physiol. 2009; 296: G1140-G1149https://doi.org/10.1152/ajpgi.90534.2008
記事で見る
スコープス (378)
パブコメ
クロスリファレンス
Google Scholar
メズリッチ・J.D.
フェヒナーJ.H.
チャン X.
ジョンソン B.P.
バーリンガムW.J.
ブラッドフィールドC.A.
キヌレニンとアリール炭化水素受容体の相互作用により制御性T細胞が生成される。
J. Immunol. 2010; 185: 3190-3198https://doi.org/10.4049/jimmunol.0903670
記事で見る
スコープス (1049)
パブコメ
クロスリファレンス
Google Scholar
ミラガイアR.J.
ゴメス T.
チョムカ A.
ジャーディンL.
リーデルA.
ヘガジーA.N.
ウィブリーN.
トゥッチA.
チェン X.
リンドマンI.
ら。
制御性T細胞のシングルセル・トランスクリプトミクスは、組織適応の軌跡を明らかにした。
Immunity. 2019; 50: 493-504.e7https://doi.org/10.1016/j.immuni.2019.01.001
記事で見る
スコープス (218)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
宮良真理子
吉岡靖子
喜藤 晃
嶋 T.
ウイング K.
ニワ A.
パリゾー C.
タフリンC.
ハイケ T.
ヴァレイユD.
et al.
FoxP3転写因子を発現するヒトCD4+T細胞の機能解明と分化動態。
Immunity. 2009; 30: 899-911https://doi.org/10.1016/j.immuni.2009.03.019
記事で見る
スコープス(1657)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
モンテレオーネ I.
リッツォ A.
サーラ M.
シーカ G.
シレーリ P.
ビアンコーネL.
マクドナルド T.T.
パローネF.
モンテレオーネG.
アリール炭化水素受容体誘導シグナルはIL-22産生をアップレギュレートし、胃腸の炎症を抑制する。
Gastroenterology. 2011; 141: 237-248.e1https://doi.org/10.1053/j.gastro.2011.04.007
記事で見る
スコープス(401)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
森川理恵子
根本由紀夫
米本 祐一
田中 聡
武井祐一
大島 聡
永石 崇
土屋和彦
野崎和彦
水谷哲也.
他
上皮内リンパ球はCD103/E-cadherinシグナルを介した細胞間接触により腸管腫瘍の成長を抑制する。
Cell Mol. Gastroenterol. Hepatol. 2021; 11: 1483-1503https://doi.org/10.1016/j.jcmgh.2021.01.014
記事で見る
スコープス (6)
パブコメ
アブストラクト
全文表示
全文PDF
グーグルシュラー
ムシダD.
パク Y.
キム・G.
トゥロフスカヤO.
スコット I.
クローネンバーグ M.
Cheroutre H.
レチノイン酸を介したTH17と制御性T細胞の相互分化。
Science. 2007; 317: 256-260https://doi.org/10.1126/science.1145697
記事で見る
スコープス (1614)
パブコメ
クロスリファレンス
Google Scholar
長沼 昌彦
杉本 聡
光山和彦
小林 毅
吉村直樹
大井裕之
田中 聡
安藤 敦
大宮直樹
三枝健一.
他.
潰瘍性大腸炎患者を対象とした多施設共同無作為化比較試験における藍ナチュラリスの有効性.
Gastroenterology. 2018; 154: 935-947https://doi.org/10.1053/j.gastro.2017.11.024
記事で見る
スコープス (98)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
西尾 潤
馬場真理子
アタラシK.
田之上 毅
根岸秀樹
柳井秀樹
土生聡
堀 聡
本田邦彦.
谷口哲也
制御性T細胞が腸の恒常性を維持するためには、TCRレパートリーが充実していることが必要である。
Proc. Natl. Acad. Sci. U.S.A. 2015; 112: 12770-12775https://doi.org/10.1073/pnas.1516617112
記事で見る
スコープス (42)
パブコメ
クロスリファレンス
Google Scholar
ヌッチ K.
チャイ・J.N.
アイ・ティーエル(Ai T.L.
ラスラー=ジャーマン E.
フィーリー T.
ナグラー C.R.
Hsieh C.S.
末梢の常在抗原に対する制御性T細胞の迅速かつ効率的な生成。
セル・リップ 2016; 17: 206-220https://doi.org/10.1016/j.celrep.2016.08.092
記事で見る
スコープス (90)
パブコメ
アブストラクト
全文表示
全文PDF
グーグルシュラー
大倉直樹
北川陽子
坂口 聡
制御性T細胞の発生と維持。
Immunity. 2013; 38: 414-423https://doi.org/10.1016/j.immuni.2013.03.002
記事で見る
スコープス (554)
パブコメ
アブストラクト
全文表示
全文PDF
グーグルシュラー
パウルス K.
シェーンM.
クビッツァR.C.
ホーミーB.
ヴィーゼンボーンA.
レーマン P.
ルジッカ T.
パーカー C.M.
シェーン M.P.
CD8+Tリンパ球の組織特異的表皮局在におけるインテグリンαE(CD103)β7の役割。
J. Invest. Dermatol. 2001; 117: 569-575https://doi.org/10.1046/j.0022-202x.2001.01481.x
記事で見る
スコープス (122)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
パウリーF.
リーチM.W.
マウゼ S.
キャディL.B.
コフマン・R.L.
C. B-17 scidマウスにおいて、表現型的に異なるCD4+ T細胞のサブセットが慢性腸炎を誘発または防御する。
Int. Immunol. 1993; 5: 1461-1471https://doi.org/10.1093/intimm/5.11.1461
記事で見る
スコープス (928)
パブコメ
クロスリファレンス
Google Scholar
チュウ J.
ヘラーJ.J.
Guo X.
チェン Z.M.
フィッシュ K.
Fu Y.X.
Zhou L.
アリール炭化水素受容体は、自然リンパ球の調節を通じて腸管免疫を制御する。
Immunity. 2012; 36: 92-104https://doi.org/10.1016/j.immuni.2011.11.011
記事で見る
スコープス (580)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
クインタナ F.J.
バッソ A.S.
イグレシアスA.H.
コルン T.
ファレズ M.F.
ベッテリ E.
カッチャモ M.
オウッカ M.
ワイナー H.L.
アリール炭化水素受容体によるT(reg)およびT(H)17細胞の分化の制御。
Nature. 2008; 453: 65-71https://doi.org/10.1038/nature06880
記事で見る
スコープス (1338)
パブコメ
クロスリファレンス
Google Scholar
クインタナ F.J.
ムルガイヤンG.
ファレズM.F.
ミツドエルファーM.
トゥクパA.M.
バーンズ E.J.
Weiner H.L.
内因性アリール炭化水素受容体リガンドが樹状細胞およびT細胞に作用して実験的自己免疫性脳脊髄炎を抑制する。
Proc. Natl. Acad. Sci. U.S.A. 2010; 107: 20768-20773https://doi.org/10.1073/pnas.1009201107
記事で見る
スコープス(323)
パブコメ
クロスリファレンス
Google Scholar
ラフィン・C.
ヴォー・L.T.
ブルーストンJ.A.
T(reg)細胞ベースの治療法:課題と展望。
Nat. Rev. Immunol. 2020; 20: 158-172https://doi.org/10.1038/s41577-019-0232-6
記事で見る
スコープス (236)
パブコメ
クロスリファレンス
Google Scholar
ルトゲアーツ P.
サンドボーンW.J.
フィーガンB.G.
ライニシュ・W.
オルソン A.
ヨハネス J.
トラバース S.
ラクミレウィッツ D.
ハナウアー S.B.
リヒテンシュタインG.R.
他
潰瘍性大腸炎の導入療法と維持療法におけるインフリキシマブ。
New Engl. J. Med. 2005; 353: 2462-2476https://doi.org/10.1056/nejmoa050516
記事で見る
スコープス (0)
パブコメ
クロスリファレンス
Google Scholar
坂口 聡
宮良真一
コスタンティーノC.M.
ハフラーD.A.
ヒト免疫系におけるFOXP3+制御性T細胞。
Nat. Rev. Immunol. 2010; 10: 490-500https://doi.org/10.1038/nri2785
記事で見る
スコープス(1808年)
パブコメ
クロスリファレンス
Google Scholar
サカグチ・エス.
ヴィグナリD.A.
ルデンスキー A.Y.
ニエックR.E.
ワルトマンH.
制御性T細胞の可塑性と安定性。
Nat. Rev. Immunol. 2013; 13: 461-467https://doi.org/10.1038/nri3464
記事で見る
スコープス (385)
パブコメ
クロスリファレンス
Google Scholar
坂口 聡
山口 拓也
野村哲也
小野真理子
制御性T細胞と免疫寛容
Cell. 2008; 133: 775-787https://doi.org/10.1016/j.cell.2008.05.009
記事で見る
スコープス (3706)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
シエリング C.
クラウスグルーバー T.
チョムカ A.
フレーリッヒA.
アデルマン K.
ヴォールフェルトE.A.
ポット J.
グリゼリ T.
ボルラート J.
ヘガジーA.N.
他
アラーミンIL-33は、腸の制御性T細胞機能を促進する。
Nature. 2014; 513: 564-568https://doi.org/10.1038/nature13577
記事で見る
スコープス (675)
パブコメ
クロスリファレンス
グーグルシュラー
シエーリング C.
ウィンセントE.
メティジ A.
イセポンA.
リー Y.
ポトクニック A.J.
オメネッティ S.
ヘンダーソンC.J.
ウルフC.R.
ネバートD.W.
他
AHRシグナリングのフィードバック制御が腸管免疫を制御する。
ネイチャー(Nature)。2017; 542: 242-245https://doi.org/10.1038/nature21080
記事で見る
スコープス (284)
パブコメ
クロスリファレンス
グーグルシュラー
シェーン M.P.
アーリアA.
マーフィーE.A.
アダムスC.M.
シュトラウチ U.G.
アガチェ W.W.
マルサル J.
ドノヒュー J.P.
ハー H.
ベイヤー D.R.
他
インテグリンαE(CD103)欠損マウスでは粘膜Tリンパ球の数が選択的に減少する。
J. Immunol. 1999; 162: 6641-6649
記事で見る
パブコメ
クロスリファレンス
Google Scholar
セフィク E.
ゲバ=ザトルスキー N.
オー S.
コンニコワL.
ゼムールD.
マクガイアA.M.
ブルジンD.
オルティス-ロペス A.
ロベラ・M.
ヤン・J.
他
粘膜免疫学。個々の腸内共生生物は、RORγ⁺制御性T細胞の異なる集団を誘導する。
サイエンス(Science)。2015; 349: 993-997https://doi.org/10.1126/science.aaa9420
記事で見る
スコープス (533)
パブコメ
クロスレフ
Google Scholar
シェバッハ E.M.
foxp3+ T制御細胞を介した抑制のメカニズム。
Immunity. 2009; 30: 636-645https://doi.org/10.1016/j.immuni.2009.04.010
記事で見る
スコープス (1386)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ソントハイマー・フェルプス A.
チョウD.B.
トバグリエリ A.
フェランテ T.C.
ダックワース T.
ファデル C.
フリスマンタスV.
サザーランド A.D.
ジャリリ-フィロオジネシャドS.
カセンドラM.
他
ヒトcolon-on-a-chipによる結腸粘液層の蓄積と生理のin vitro連続解析。
Cell Mol. Gastroenterol. Hepatol. 2020; 9: 507-526https://doi.org/10.1016/j.jcmgh.2019.11.008
記事で見る
スコープス (96)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
スティーブンス・W.Z.
クビナク・J.L.
ガザリャン A.
バウアー K.M.
ベル・R.
ビュルケ K.
キアロ T.R.
ワイス A.M.
タン・W.W.
モンツ・J.K.
他
MHCクラスIIの上皮-ミエロイド交換は、免疫と微生物叢の組成を制約する。
セル・レップ 2021; 37: 109916https://doi.org/10.1016/j.celrep.2021.109916
記事で見る
スコープス (12)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ストッキンガー B.
ディ・メグリオP.
ジアリタキスM.
ドゥアルテ J.H.
アリール炭化水素受容体:免疫系におけるマルチタスク。
Annu. Rev. Immunol. 2014; 32: 403-432https://doi.org/10.1146/annurev-immunol-032713-120245
記事で見る
スコープス (567)
パブコメ
クロスリファレンス
Google Scholar
スフィア I.
レックリングS.K.
サライ G.
ベルカイド Y.
CD4+CD25+Tregの保持とLeishmania major感染症の制御におけるCD103の役割。
J. Immunol. 2005; 174: 5444-5455https://doi.org/10.4049/jimmunol.174.9.5444
記事で見る
スコープス (267)
パブコメ
クロスリファレンス
Google Scholar
杉本 聡
長沼雅彦
金井 崇
インドール化合物は潰瘍性大腸炎の治療薬として有望である。
J. Gastroenterol. 2016; 51: 853-861https://doi.org/10.1007/s00535-016-1220-2
記事で見る
スコープス (74)
パブコメ
クロスリファレンス
Google Scholar
杉本 聡
長沼正明
清原 浩
新井美樹
小野紘一
森 圭一
三枝健一
南木 啓介
竹下恭平
タケシタ タケシタ
他
潰瘍性大腸炎患者における経口清涼飲料水の臨床的有効性と安全性:単施設共同非盲検前向き試験。
Digestion. 2016; 93: 193-201https://doi.org/10.1159/000444217
記事で見る
スコープス (62)
パブコメ
クロスリファレンス
Google Scholar
杉田和彦
花川 聡
本田 毅
近藤 剛
宮地佑典
椛島 圭一
野村哲也
Heliosレポーターマウスの作製とHelios(+)制御性T細胞のin vitroでの抑制能の評価.
Exp. Dermatol. 2015; 24: 554-556https://doi.org/10.1111/exd.12711
記事で見る
スコープス (23)
パブコメ
クロスリファレンス
Google Scholar
杉山大輔.
西川博之.
前田恭子
西岡美樹
種村明美
片山 郁夫
江副聡美
金倉康雄
佐藤英樹
福森靖子.
他
抗CCR4 mAbはエフェクター型FoxP3+CD4+制御性T細胞を選択的に枯渇させ、ヒトにおける抗腫瘍免疫応答を誘発する。
Proc. Natl. Acad. Sci. U.S.A. 2013; 110: 17945-17950https://doi.org/10.1073/pnas.1316796110
記事で見る
スコープス (469)
パブコメ
クロスリファレンス
Google Scholar
スジノ T.
金井 毅
小野由美子
三上陽子
林 敦
土井 毅
松岡 圭一
久松 毅
高石秀樹
緒方英明.
他
制御性T細胞は、T-helper 17からalternative T-helper 1細胞への分化を阻害し、大腸炎の発症を抑制する。
Gastroenterology. 2011; 141: 1014-1023https://doi.org/10.1053/j.gastro.2011.05.052
記事で見る
スコープス (52)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
スジノ T.
ロンドン・M.
ホイテマ・ファン・コニェンブルグ D.P.
レンドン T.
ブフ T.
シルバ H.M.
ラファイユJ.J.
レイス B.S.
ムシダD.
制御性CD4⁺ T細胞と上皮内CD4⁺ T細胞の組織適応が腸の炎症を制御する。
サイエンス(ニューヨーク、NY)。2016; 352: 1581-1586
記事で見る
スコープス (141)
クロスリファレンス
Google Scholar
田之上貴久
アタラシ K.
本田邦彦.
腸管制御性T細胞の発生と維持。
Nat. Rev. Immunol. 2016; 16: 295-309https://doi.org/10.1038/nri.2016.36
記事で見る
スコープス (346)
パブコメ
クロスリファレンス
Google Scholar
ソーントン A.M.
コーティP.E.
トランD.Q.
ウォルファートE.A.
マーレイ P.E.
ベルカイド Y.
シェバッハ E.M.
イカロス転写因子ファミリーメンバーであるヘリオスの発現は、胸腺由来と末梢性Foxp3+ T制御細胞を分化させる。
J. Immunol. 2010; 184: 3433-3441https://doi.org/10.4049/jimmunol.0904028
記事で見る
スコープス(1000)
パブコメ
クロスリファレンス
Google Scholar
ターナー D.
ウォルシュ C.M.
スタインハートA.H.
Griffiths A.M.
重症潰瘍性大腸炎におけるコルチコステロイドへの反応:文献の系統的レビューとメタ回帰。
Clin. Gastroenterol. Hepatol. 2007; 5: 103-110https://doi.org/10.1016/j.cgh.2006.09.033
記事で見る
スコープス (466)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ヴォスコボイニクI.
ウィスストックJ.C.
トラパニJ.A.
パーフォリンとグランザイム:機能、機能障害、ヒトの病理。
Nat. Rev. Immunol. 2015; 15: 388-400https://doi.org/10.1038/nri3839
記事で見る
スコープス (616)
パブコメ
クロスリファレンス
Google Scholar
ウィブリーN.
トゥッチA.
パウリーF.
腸と皮膚における制御性T細胞の適応。
Nat. Immunol. 2019; 20: 386-396https://doi.org/10.1038/s41590-019-0351-z
記事で見る
スコープス (88)
パブコメ
クロスリファレンス
Google Scholar
ウォルファート E.A.
グレインジャーJ.R.
ブーラドゥーN.
コンケルJ.E.
オルデンホフG.
リベイロ C.H.
ホールJ.A.
Yagi R.
ナイク S.
バイラバボトラR.
ら。
GATA3は、マウスの炎症時にFoxp3⁺制御性T細胞の運命を制御する。
J. Clin. Invest. 2011; 121: 4503-4515https://doi.org/10.1172/jci57456
記事で見る
スコープス (0)
パブコメ
クロスリファレンス
Google Scholar
シャオ・H.T.
Peng J.
フー・D.D.
Lin C.Y.
Du B.
Tsang S.W.
リン Z.S.
Zhang X.J.
Lueng F.P.
ハンQ.B.
et al.
デキストラン硫酸ナトリウム投与マウスにおける大腸マクロファージの炎症反応を抑制し、大腸炎の回復を促進する青島粉末。
Chin. Med. 2015; 10: 29https://doi.org/10.1186/s13020-015-0061-x
記事で見る
スコープス (32)
パブコメ
クロスリファレンス
Google Scholar
シュー・M.
Pokrovskii M.
ディン・Y.
Yi R.
Au C.
ハリソン O.J.
ガランC.
ベルカイド Y.
ボノー・R.
Littman D.R.
c-MAF依存性制御性T細胞が腸内病原体に対する免疫寛容を媒介する。
ネイチャー(Nature)。2018; 554: 373-377https://doi.org/10.1038/nature25500
記事で見る
スコープス (272)
パブコメ
クロスリファレンス
Google Scholar
Ye J.
Qiu J.
ボスティック・J.W.
Ueda A.
Schjerven H.
リー S.
ジョビン C.
チェン Z.E.
Zhou L.
アリール炭化水素受容体は、腸管制御性T細胞を優先的にマークし、促進する。
セル・レップ 2017; 21: 2277-2290https://doi.org/10.1016/j.celrep.2017.10.114
記事で見る
スコープス (102)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
吉松由美子
長沼 昌彦
杉本 聡
種本 聡
梅田 聡
福田哲也
野村英世
吉田和彦
小野紘一
牟田口雅彦.
他.
潰瘍性大腸炎患者への局所導入療法を目的とした藍ナチュラリス坐剤の開発.
Digestion. 2020; 101: 492-498https://doi.org/10.1159/000501152
記事で見る
スコープス (9)
パブコメ
クロスリファレンス
Google Scholar
吉村 彰
武藤 悟.
免疫抑制におけるTGF-βの機能.
Curr. Top. Microbiol. Immunol. 2011; 350: 127-147https://doi.org/10.1007/82_2010_87
記事で見る
パブコメ
クロスリファレンス
Google Scholar
ユー・フー
シャルマ S.
エドワーズ J.
フェイゲンバウムL.
Zhu J.
制御性T細胞による転写因子T-betとGATA-3の動的な発現が免疫寛容を維持する。
Nat. Immunol. 2015; 16: 197-206https://doi.org/10.1038/ni.3053
記事で見る
スコープス (178)
パブコメ
クロスリファレンス
Google Scholar
ゼガラ-ルイス D.F.
キム・D.V.
ノーウッドK.
キム・M.
ウー・W.H.
サルダナ=モラレス F.B.
ヒル A.A.
マジュムダール S.
オロスコ S.
ベル・R.
他
腸内細菌特異的T細胞の胸腺発達。
ネイチャー(Nature)。2021; 594: 413-417https://doi.org/10.1038/s41586-021-03531-1
記事で見る
スコープス (59)
パブコメ
クロスリファレンス
Google Scholar
記事情報
出版履歴
掲載されました: 2022年5月10日
受理されました: 2022年4月12日
改訂版として受理された: 2021年12月30日
受領しました: 2021年6月1日
アイデンティフィケーション
DOI: https://doi.org/10.1016/j.celrep.2022.110773
著作権について
© 2022 The Author(s).
ユーザーライセンス
クリエイティブ・コモンズ 表示 - 非商用 - 非デリバリー (CC BY-NC-ND 4.0)|Creative Commons Attribution - NonCommercial - NoDerivs
再利用の方法
サイエンスダイレクト
ScienceDirectでこの記事にアクセスする
数値
グラフィカルアブストラクト
図1INが大腸でCTL様特性を持つTregを特異的に誘導した例
図2INがHelios+ RORγt-トレグを結腸に集積し、Helios+ RORγt-トレグが1週間以内に結腸で増殖し、その後結腸に留まるようにする。
図3AhRアゴニストINで誘導されるTregの特徴
図4Helios+ RORγt-Tregの増加には上皮細胞でのAhRシグナルが必須である
図5Helios+ RORγt-トレグの大腸での集積には、ECのAhRシグナルによって誘導されるMHCクラスII分子とヘムオキシゲナーゼが重要である。
図6IN食によるHelios+ RORγt-トレグ数の増加で大腸炎が改善される。
関連記事
本サイトのコンテンツは、あらゆる分野の医療従事者や研究者を対象としています。
研究雑誌
セル
がん細胞
セルケミカルバイオロジー
セルゲノミクス
細胞宿主と微生物
細胞メタボリズム
セルレポート
セルレポート医学
Cell Reports Methods
セルレポート 物理科学
セルがサステナビリティを報告
細胞幹細胞
セルシステム
ケム
ケム・キャタリシス
カレントバイオロジー
発生細胞
デバイス
ヘリヨン
イミュニティ
アイサイエンス
ジュール
マター
メド
分子細胞
ニューロン
ワンアース
パターン
STARプロトコル
構造
トレンドレビュー ジャーナル
生物化学系
バイオテクノロジー
がん(Cancer
細胞生物学
ケミストリー
コグニティブサイエンス
エコロジー&エボリューション
内分泌・代謝内科
遺伝学
免疫学
微生物学
分子医学
ニューロサイエンス
寄生虫学
薬理科学
植物科学
パートナージャーナル
AJHG
バイオフィジカルジャーナル
バイオフィジカルレポート
HGGアドバンス
モレキュラープラント
分子療法ファミリー
プラントコミュニケーション
ステムセルレポート
ザ・イノベーション
コレクションズ
ベスト・オブ・セルプレス
セルプレスのレビュー
セルプレスセレクション
コンソーシアムハブ
Nucleus Collections
SnapShotアーカイブ
誌面を越えて
セルキャリアネットワーク
セルメンター
細胞シンポジューム
ラボリンクス
ウェビナーズ
奉加帳
コミュニティレビュー
Figure360
スニークピーク
STARメソッド
社会科学
セル画展
セルプレスポッドキャスト
セルプレスの動画
カラーリングとコミック
リサーチアーク
コネクト
セルプレスについて
採用情報
連絡先
ヘルプ&サポート
ニュースルーム
パブリケーションアラート
ACCESS
サブスクライブ
リード・イット・ナウ
ライブラリアンへの推薦
INFORMATION
広告主様向け
採用担当者様へ
ライブラリアン向け
ご利用条件
個人情報保護方針
アクセシビリティ
当社は、サービスの提供や強化、コンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を変更するには、本サイトのクッキー設定にアクセスしてください。
Copyright © 2023 Elsevier Inc. 第三者から提供された一部のコンテンツを除く。
