
ヒトマイクロバイオームプロジェクトの10年-「第3のゲノム」ヒトウィロームについての批判的コメントと考察
メインページコンテンツへスキップ
米国国旗米国政府の公式ウェブサイトです。
NIH NLMロゴログイン
アクセスキーNCBIホームページMyNCBIホームページメインコンテンツメインナビゲーション
pubmedロゴ
上級者向け
ユーザーガイド
ヒトマイクロバイオームプロジェクトの10年-「第3のゲノム」ヒトウィロームについての批判的コメントと考察
https://pubmed.ncbi.nlm.nih.gov/38045612/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10688805/



本文へスキップ
米国国旗アメリカ合衆国政府の公式ウェブサイトです。
NIH NLMロゴログイン
アクセスキーNCBIホームページMyNCBIホームページメインコンテンツメインナビゲーション
NLMは図書館として、科学文献へのアクセスを提供しています。NLMデータベースへの掲載は、NLMまたは米国国立衛生研究所がその内容を支持または同意していることを意味するものではありません。
詳細はこちら: PMC免責事項|PMC著作権表示
mrrのロゴ
Microbiome Res Rep: 7. オンライン公開 2023年3月29日. doi: 10.20517/mrr.2022.20
PMCID: PMC10688805PMID: 38045612
ヒトマイクロバイオームプロジェクト10年-「第3のゲノム」ヒトビロームに関する批判的コメントと考察
ハラルド・ブリュッソー筆者
著者情報 論文ノート 著作権およびライセンス情報 PMC免責事項
関連データ
データ利用声明
戻る
要旨
ヒトマイクロバイオームプロジェクト(HMP)は、肥満や栄養失調から腸をはるかに超えた影響に至るまで、マイクロバイオームがヒトの健康や疾病に及ぼす広範囲な影響を主張し、大きな期待を集めている。これまでのところ、クロストリジオイデス・ディフィシル感染症における糞便微生物叢移植を顕著な例外として、マイクロバイオーム介入を実用化しても、わずかな臨床効果しか得られていない。ここでは、コッホの定説における病原体と感染症との関連をモデル化した、マイクロバイオームと疾患との関連についての基準が必要であると論じている。最も重要な問題は、マイクロバイオームの変化が疾患の原因なのか、それとも疾患につながる病態の結果なのかであり、マイクロバイオームの変化は疾患との因果関係を持たない並行的な事象、哲学用語で言うところのエピフェノメノン(随伴現象)に過ぎない。またここでは、ヒト・ヴィローム研究が、実用化の可能性が高いマイクロバイオーム・プロジェクトを補完するために必要なものであるかどうかについても論じている。
キーワード マイクロバイオーム、疾患、関連性、因果関係、糞便移植、プロバイオティクス、バクテリオファージ、ビローム
次へ
マイクロバイオーム
HMPはもう古い?
10年前、ヒトマイクロバイオームプロジェクト・コンソーシアムによって画期的な論文が発表された。この論文では、300人の口腔、腸、皮膚、膣など18の異なる部位を分析した結果、健康な人でも微生物が著しく異なり、ニッチに強く特化していることが述べられている[1]。この記念すべき年に、このイニシアチブの先駆者の一人であるルース・レイは、マイクロバイオーム分野で過去10年間に得られた知識を紹介した。発表されたデータは、マイクロバイオームが、発達中の免疫系の成熟の舵取りから、食物の消化の補助、病原体の対抗に至るまで、私たちの身体の適切な機能の鍵を握っていることを示している。ヒトを媒介する微生物の組成は、心血管疾患や肥満といった一般的な病気と関連している[2]。ルース・レイは、私たちがなぜこれほど多くの重要な機能を、環境から拾ってきた微生物に委託しているのか(中略!)疑問に思った。常在微生物に多くの重要な機能を "委託 "するのではなく、"帰属 "すると言った方がいいかもしれない。どのような言葉を使うにせよ、彼らはそのような仮説の論理的妥当性に疑問を表明しているようだ。次の段階として、彼女はより多様なヒト集団のマイクロバイオーム、さらには野生動物のマイクロバイオームの塩基配列をもっと決定するよう求めた。
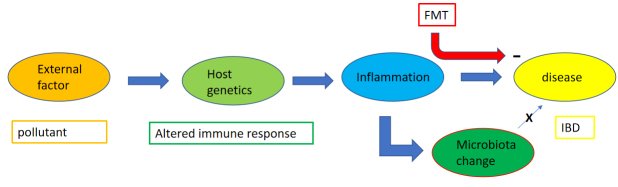
10年にわたる集中的なヒトマイクロバイオーム調査(最高の科学雑誌のコラムを埋め尽くした)を経て、記述的な部分を拡大するよりも、より広い網を使った大漁探検の方がより緊急性の高い疑問があると言えるかもしれない。今こそ、獲得した知識を評価し、いくつかの重大な疑問を投げかける時かもしれない。例えば この "第二の "ゲノムに関連するヒトの明確な表現型は何か?懐疑的な観察者であれば、マイクロバイオームが個人によってこれほど異なるのであれば、ヒトに関連する明確な表現型を期待できるのか、と問うかもしれない。動物モデルにおけるメカニズム的データに裏打ちされていない、単なる関連性がどれほどあるのだろうか?動物を対象とした研究のどれだけが、ヒトを対象とした研究に転用できるのだろうか?ここでも、「関連性はまだ因果関係ではない」という古い教訓が当てはまる。あるケースでは、マイクロバイオームの変化は平行線で、病気とは因果関係がないが、病気につながる要因の結果である(哲学的に言えば、エピフェノメノンとしてのマイクロバイオーム)[図1]。また別のケースでは、マイクロバイオームの変化は、疾患状態に向かう直接的な因果の連鎖の中にある(現象としてのマイクロバイオーム)[図2]。マイクロバイオームの変化がエピフェノメノン(疾患状態の結果)なのか、さもなければ疾患の原因なのかを検証することができる。マイクロバイオームの組成を変化させるような介入(基質、プレバイオティクス、プロバイオティクス、抗体、ファージ、糞便微生物叢移植などが考えられる)を考え、この変化が病状に影響を及ぼすかどうかを観察する[図1および2]。もちろん、これには時間とコストのかかる臨床試験が必要である。加えて、マイクロバイオームの変化が不可逆的に疾患への病理学的連鎖反応を引き起こした場合、後にマイクロバイオームを修正しても、病状はもはや緩和されないかもしれない。それなら、微生物の「ディスバイオシス」の発生を未然に防ぐための予防的介入の可能性が残っているかもしれない。しかし、「ディスバイオーシス」という用語には正確な科学的定義がないため、その使用には議論の余地がある[3]。「ディスバイオーシス」とは、細菌群集の組成の変化、細菌生態系によって産生される代謝産物の変化、特定の身体部位における細菌負荷の総体的増加、または異常な解剖学的部位へのコロニー形成のシフトを指すことがある。健常人であっても微生物叢の構成には生理的なばらつきがあることから、少数の被験者を用いた症例対照研究でも微生物叢の構成に多少のばらつきがあることが予想される。これまでのところ、"dysbiosis "と疾患との因果関係は多くの場合証明されていない。したがって、「ディスバイオーシス」という包括的な用語は避けた方がよいかもしれない。ディスバイオーシス」という用語の未定義性を強調するため、本文では引用符で囲んでいる。驚くべきことに、微生物叢の文献には、疾患状態と微生物の「ディスバイオーシス」を関連づける報告があふれているが、一方で、微生物叢の「ディスバイオーシス」と疾患との関連について明確に反論しようとする研究はほとんどない。哲学者カール・ポパーの議論によれば、より良い理論への科学的進歩は、推測から、特にその反証への試行からもたらされる[4]。
画像、イラストなどを保持する外部ファイル。
オブジェクト名はmrr-2-1-7.fig.1.jpg。
図1
マイクロバイオームの変化("epiphenomenon")が病原メカニズムの結果であり、疾患の原因ではない場合の理論的なフロースキームの提案。このスキームは一般的なものであると考えられるが、IBDを想定することもできる。詳細は本文を参照。FMT:fecal microbiota transplantation;IBD:炎症性腸疾患 IBD。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はmrr-2-1-7.fig.2.jpg。
図2
マイクロバイオームの変化(「現象」)が疾患と因果関係にある場合の理論的フロースキームの提案。例として、再発性C. difficile感染症(CDI)を挙げる。VRE:バンコマイシン耐性腸球菌。詳細は本文参照。CDI:Clostridioides difficile感染症、FMT:糞便微生物叢移植;
予防的介入に話を戻すと、この概念も同様に臨床試験による検証が必要であり、それは治療試験よりもさらに時間と費用がかかる。このような実際的かつ理論的な困難があるにもかかわらず、科学分野の成熟度は、その実用化によって定義される(ただし、ここで筆者は、産業界での研究経歴とバイオテクノロジー専門誌の編集者としての活動を明らかにすることがある)。哲学者の有名な格言に、「哲学者は世界をさまざまに解釈してきたにすぎない。しかし、重要なのはそれを変えることである」という言葉があるが、マイクロバイオーム研究にも確かに当てはまる。
テストベッドとしてのRCT:マイクロバイオームを標的とした栄養介入による栄養不良の治療
ジェフリー・ゴードンが主導した腸内マイクロバイオーム介入によるランダム化比較臨床試験(RCT)が、小児期の栄養不良の分野でいくつか実施されている。基本的なマイクロバイオーム観察は、バングラデシュの重度急性栄養失調(SAM)に罹患した小児を対象として行われた。この小児は、体重対体長の測定値が基準集団の中央値より3標準偏差以上低い、すなわちWLZスコアが-3であると定義された。これらの小児は、腸内細菌叢組成の変化の発達において、地元の健康な対照小児より遅れていた[5,6]。その後、J.ゴードンとの共同研究により、離乳期に特徴的な微生物の発現を選択的に増加させるいくつかの補完食品成分が、gnotobioticマウスで同定された。栄養失調児では、腸内細菌叢のこれらの年齢識別細菌が欠乏していた。これらの知見に基づき、組成の異なる(MDCF-2のようにひよこ豆粉、大豆粉、ピーナッツ粉、バナナを含むもの、またはこれらのうち2つのみを含む)いくつかの「微生物指向性補完食」(MDCF)アイテムを、gnotobioticの子豚の成長効果について試験した。2成分配合に比べ、4成分配合ではより良好な体重増加が観察された。次に、中等度の急性栄養失調(MAM)に苦しむバングラデシュの子どもを対象に、3種類のMDCF製剤と市販のすぐに使える補助食(RUSF、米とレンズ豆がベース)を試験した。投与1ヵ月後、3種類のMDCFとRUSFの対照群はすべて、WLZスコアを-2.2から-1.9に改善したが、群間に差はなかった。しかし、MDCF-2では、中上腕周囲長(MUAC)が有意に増加した:RUSFで観察された1.6%の増加に対し、2.3%の増加であった[7]。1群につき14~17人の小児しかリクルートされなかったため、差異を検出する能力は低かった。その後のRCTでは、バングラデシュのMAM患児123人が、MDCF-2またはRUSFによる3ヵ月間の治療に無作為に割り付けられた。WLZスコアは両群とも中等度に改善した(やはりWLZ-2.2程度から-1.9)が、その差はわずかであったものの、MDCF-2の方がRUSFよりも統計的に良好であった。治療終了時、両群間のMUAC増加の差は統計学的に有意ではなかった。研究者らは高度な血漿プロテオーム解析を行い、MDCF-2群ではWLZの改善と骨成長および神経発達のバイオマーカーとの間に正の関連があることを明らかにした。腸内細菌叢解析では、WLZスコアの改善と腸内細菌叢の2つの細菌分類群(Bifidobacterium longumとEscherichia coli)との間に負の関連が認められたが、例えばPrevotellaは正の関連を示した[8]。ビフィドバクテリウム・ロンガムは母乳栄養児における多くの有益な結果と関連している一方で、この菌のレベルはこの栄養介入を受けた小児における小指の成長率と負の相関を示したことから、この結論は驚くべきものである。バングラデシュの健康な子ども222人を対象とした独立した2年間の縦断研究では、矛盾する結論が得られた。この研究では、B. longumは体長に対する体重および年齢に対する体重のZスコアと正の相関を示し、Prevotellaは負の相関を示した[9]。バングラデシュの中等度栄養失調児と対照児を直接比較することはできないが、それにもかかわらず、分析的に高度に洗練された2つの研究が、単一の、特によく調査された集団の子どもにおける腸内細菌叢分類群の成長に影響を与える役割に関して、このように異なる結論に達したことは不快である。2番目の研究[9]では、39の細菌種について腸内細菌叢組成の強い季節的シフトも報告されており、再現可能な微生物叢-成長関連の確立をさらに複雑にしている。
最初の報告[8]は、臨床的に有意ではない栄養状態の改善が小さいと批判されている[10]。この結果は、別の研究[7]で報告された、SAMに罹患したバングラデシュの小児343人を対象に、適切な抗生物質の投与後に、コメレンティル製剤、ヒヨコマメ含有製剤(いずれも地元産)[11]、またはすぐに使える治療用食品(RUTF:Plumpy'Nut、市販のピーナッツバター製剤)で治療したデータとは対照的である。これらの治療用製剤を用いた場合、WLZスコアは入院中に-3.5から退院時には-2.0まで低下し、MAMの小児におけるMDCF-2で達成されたよりもはるかに大きな効果が得られた。MAMとSAMにおける栄養介入と出生コホート研究における小児の追跡調査を比較することが正当化されるかどうか疑問があるかもしれない。MAMがSAMよりも栄養介入による治療が容易であるかどうかは明らかでない[12]。期待されるエフェクトサイズが大きいため、MAMよりもSAMの乳児でマイクロバイオーム-人体計測相関研究を実施する方が容易であった可能性がある。MAM試験におけるエフェクトサイズが小さかったことが、[8]と[9]の間で結論が食い違ったことの一因かもしれない。
微生物と疾患との関連における因果関係の仮説の開発
2つの臨床試験において、「微生物指向性補完食」(MDCF)がMAMに対してわずかな治療効果しか示さず、臨床的有用性は境界線上にあるという観察結果は、懐疑的な読者に、腸内細菌叢は栄養失調の原因というよりも、栄養失調につながる要因の結果である可能性が高い-したがって、随伴現象である-ことを示唆するかもしれない(図1のスキームを参照)。病原体を疾患と関連付けるために満たすべき定説(コッホの定説とその派生[13])が開発されているように、特定の腸内マイクロバイオームのコンステレーションを疾患と関連付けるためには、それに適合した定説を開発する必要がある。マイクロバイオームの変化は健康状態の変化と頻繁に関連しているため、マイクロバイオームと健康との関連を定義する際には、健康の定義とその測定[14]が困難であることがさらに複雑な問題となる。統計学的な関連性は、たとえ同胞マウスを用いた実験と組み合わせたとしても、おそらく十分ではない。より医学的な方向性を持った「マイクロバイオーム-疾患定説」がなければ、マイクロバイオーム分野は、医学的な実践に裏打ちされない大きな期待を抱かせる危険性をはらんでいる。これは最終的に助成機関や投資家を失望させることになりかねない。ラテン語の詩人ホレスの古い言葉を引用すれば、Parturient montes, nascetur ridiculus mus(山は苦労してネズミを生んだ)である。
微生物と健康との関連について、コッホの仮説のような基準を作成するのは、今のところ大それたことではあるが、暫定的なルールを議論することは有益であろう[図3]。症例対照研究によって、特定の疾患の患者とマッチさせた健常対照者との間に、統計的に有意なマイクロバイオームの違いが証明された場合、関連性があると言えるかもしれない。この差異が、複数の地理的地域における独立した研究において一貫して確認された場合、統合された関連性と言えるかもしれない。次のレベルでは、縦断的な集団研究が、同定されたマイクロバイオームの変化が、疾患の発現に追随するものではなく、先行するものであることを示した場合、時間的相関と言えるかもしれない。このレベルでは、純粋に統計的な用語ではなく、微生物学的に定義された疾患関連「病原体」または健康関連「恩恵物質」(仮の用語を用いて説明する)の複合体が同定されることが望ましい。患者から採取した特異的に変化したマイクロバイオームを移植することで、適切な動物モデルにおいてヒト疾患の関連する病理学的側面が再現されるという証拠があれば、この議論はさらに強化されるだろう。あるいは、変化したマイクロバイオームから推定される病原体が、患者における病態の側面を説明する遺伝子/特性を示すか、あるいは動物における疾患の病態的側面の一部を再現することが必要かもしれない。有益と疑われる常在菌が、マイクロバイオームを安定させ、in vitroやin vivoで病原体を抑制し、宿主を疾患から守る化合物を分泌しているという証拠が必要であろう。これらの条件が満たされれば、メカニズム的な相関関係が満たされたと言えるかもしれない。しかし、これらの連続的な基準を満たすだけでは、微生物と疾病の因果関係を立証するにはまだ不十分である。その証明のためには、マイクロバイオーム解析の知見に基づく標的を絞った介入が、罹患患者の臨床的改善につながるか、あるいはこの疾患のリスクのある被験者の疾患発症を予防するような、RCTの基準を満たすヒト試験が必要である。介入は、FMT、プロバイオティクス/有益な常在菌、有益な常在菌をサポートする特定のプレバイオティクス、シンバイオティクスの組み合わせ、バクテリオシン、または同定された病原体を標的とするファージによって行われるかもしれない。介入試験でポジティブなシグナルが得られて初めて、マイクロバイオームの変化と疾患との因果関係を語ることができる。もちろん、これらの仮説は、関連性から因果関係へ至るためのハードルを非常に高く設定している。しかし、病原体と感染症との因果関係を明らかにするには、同様の高い基準が求められる。マイクロバイオームと疾病の分野で、なぜ因果関係について同様の厳しい基準が要求されないのか、その理由は明らかではない。厳密な基準がなければ、小規模な症例対照研究からの関連を軽々しく因果関係として受け入れてしまい、偽の関連につながる。これは、介入研究の見通しに関して誤った期待を抱かせることになる。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はmrr-2-1-7.fig.3.jpgである。
図3
マイクロバイオームの変化(微生物叢の "dysbiosis")と疾患との因果関係を立証するための仮説の提案。詳細は本文を参照。FMT:糞便微生物叢移植、RCT:ランダム化比較臨床試験。
以下の文章では、図1と図22に描かれた議論を、明確なマイクロバイオーム介入、すなわち糞便微生物叢移植(FMT)に関する臨床試験のデータを用いて説明する。
糞便微生物叢移植はCDIに非常に有効である。
FMTは一般的に腸内細菌叢研究における画期的な臨床応用として挙げられており、確立された症例はクロストリジオイデス・ディフィシル感染症(CDI)である。その多くはマイクロバイオーム研究が台頭する以前にすでに実施されており[15]、317人のCDI患者の腸内に、健康なドナーの便の新鮮な菌懸濁液の形で腸内微生物を注入することで、大きな有害事象を引き起こすことなく、CDI患者の92%において微生物叢のバランスが回復し、症状が消失したことが実証されている。これは、臨床研究および臨床において、驚くべき成功率である。219人のCDI患者を対象に新鮮FMTと凍結FMTを比較した大規模ランダム化比較臨床試験(RCT)でも、症例研究の結果と同様の結果が得られ、それぞれ70%と75%で症状が消失した[16]。研究者らは、CDI患者におけるFMTの有効性を説明するために2つの可能性を検討した。すなわち、患者が自身の健康な微生物叢を完全に失っており、これらの菌株の供給が必要であるか、あるいは微生物叢が平衡を回復できないかのいずれかであった。前者の場合、FMTは不足している有益な細菌を提供することになる。第二のケースでは、FMTは、細菌集団の均衡を再確立するのに役立つ、欠けている非細菌性因子を提供することになる。この疑問については、2つの臨床報告がヒントを与えてくれるかもしれない。1つの研究では、46人の再発性CDI患者が健康なドナー便(異種便)または自分の便(自己便)を投与された。治癒率は異種便移植群では非常に高かった(91%)が、自家便移植群では63%とまだ驚くべき高さであった[17]。この小規模な臨床試験は、自家便と何が一緒に提供されたのかを問うている。2つ目の報告は、便濾液移植(FFT)、すなわち生菌を欠くドナー便の投与を受けた慢性再発性CDI患者5人の小規模臨床ケースシリーズである。興味深いことに、FFTは正常な便習慣を回復させ、最低6ヵ月の追跡期間中にCDIの症状を消失させた[18]。このような少数の症例から遠大な結論を導き出すべきではない。さらに、無細胞便画分には多くの化合物(細菌の代謝産物、バクテリオシン、宿主の代謝産物、ウイルス)が含まれている可能性がある。FMTの有効性における代謝物の役割は、FMTのダークマターと呼ばれることもあるが、体系的に研究されていない[19]。これまでのところ、マウス実験では、経口酪酸が炎症と粘膜障害を軽減し、経口二次胆汁酸がデキストラン硫酸ナトリウム(DSS)誘発大腸炎の重症度を軽減することが示されている。小規模のケースシリーズ[18]では、ウイルスのみが研究されている。この研究では、ドナーのビローム(1組のドナーと患者の便しか分析できなかった)は、様々なラクトコッカス・バクテリオファージで占められており、分析された1人のレシピエントでは、糞便ビロームがラクトコッカス・ファージにシフトし、腸内細菌ファージが減少した。その後、FMTまたは抗生物質バンコマイシンで治療された24人のCDI患者と20人の未治療の家庭対照を比較した縦断的な糞便ビローム研究では、CDI患者における微生物とウイルスの「ディスバイオシス」の両方が報告された。治療反応者では、FMTはウイルスゲノムと細菌マイクロバイオームの両方の変化と関連していた[20]。CDIの発症には、腸球菌とC. difficileの代謝的相互作用のような、後者による毒素産生を刺激するような他の要因が病的な役割を果たしていることは確かである[21]。CDIに対するFMTのメカニズムの最終的な説明がどうであれ、抗生物質治療[22]のささやかな成功に比べ、FMTの高い有効性は、図2のスキームに描かれた線に沿って、腸内細菌叢の「ディスバイオシス」とCDIとの因果関係を証明している。
...しかし、IBDではそうでもない。
FMTの高い成功率は、腸内細菌叢の不均衡が報告されている他の病状では再現できなかった。例えば、炎症性腸疾患(IBD)のサブタイプである潰瘍性大腸炎(UC)である。75人の患者を対象とした1つのRCTでは、プラセボ(水)摂取者の寛解率が5%であったのに対し、FMT摂取者の寛解率は24%であったと報告されている[23]。40人のUC患者を対象とした2番目のRCTでは、異種FMTでは30%、自家FMTでは20%の寛解率が認められた[24]。80人のUC患者を対象とした第3のRCTでは、週1回の健常ドナーのFMTまたはプラセボを2ヵ月間投与したところ、寛解率はそれぞれ27%と8%であった[25]。嫌気的に調製された異種または自家FMTを受けた73人のUC患者を対象とした第4のRCTでは、寛解率はそれぞれ32%と9%であった[26]。これらの臨床データから、UC患者の4分の1だけが健康なドナーFMTの恩恵を受け、5%から8%の患者がプラセボの恩恵を受け、9%から20%の患者が自分の便によるFMTの恩恵を受けるようである。ある研究[24]では、異種便FMTと自己便FMTの差は統計的に有意ではなかった。対照患者における改善を考慮しない場合でも、FMTを受けたUC患者の4分の3は有益な効果を経験していない。このことは、図1に描かれた図式で概念化されるように、腸内細菌叢がIBDにつながる他の要因の随伴現象または結果である状況を示唆している。IBDの2番目の臨床症状であるクローン病(CD)患者におけるFMTの有効性は、潜在的な有効性を報告している現在の研究がコホート規模が限られており、プラセボ治療群を欠いているため、依然として不明確である[27]。19人のFMT治療CD患者を対象としたこれまでの最大規模の研究では、58%の患者で臨床スコアとQOLの改善が認められたが、内視鏡的重症度指標には変化がみられなかった[28]。
マイクロバイオームの「ディスバイオーシス」は、腸疾患や食物アレルギーからアトピー性皮膚炎に至る小児のアレルギー疾患など、他の様々な臨床症状においても研究されている[29]。口腔マイクロバイオーム組成の変化は歯科疾患(う蝕、歯周病)と、膣マイクロバイオーム組成の変化は細菌性膣炎と、皮膚マイクロバイオーム組成の変化は皮膚科疾患(にきび、アトピー性皮膚炎)と関連していた。さらに、生きた乳酸菌の局所塗布による細菌性膣炎の治療、時にはプレーンヨーグルトの形態での治療など、マイクロバイオーム移植のいくつかの形態も試みられている。
FMTとやや関連するが、異なる概念に基づくのがプロバイオティクス介入、すなわち培養された有益な健康促進細菌の適用である。この分野では多くの微生物学的および臨床的研究が行われており、医療応用のための標的微生物アプローチによって何が達成できるかを知るヒントになるかもしれない。よく知られているのは、超早産児や超低出生体重児における壊死性腸炎(NEC)である。コクラン・レビューは、56の臨床試験に登録された早産児の11,000症例におけるプロバイオティクス介入(主にビフィズス菌と乳酸菌)を分析している[30]。メタアナリシスでは、プロバイオティクス介入によりNEC(プラセボと比較して相対リスク(RR)0.54)、死亡率(RR 0.76)、晩期侵襲性感染症(RR 0.89)のリスクが低下する可能性が示された。エビデンスの確実性は低または中程度と判定された。Funnel plot解析により、プロバイオティクスによる良好な転帰を過剰に報告した症例数の少ない研究による出版バイアスが明らかになった。別のコクランレビューでは、6件の臨床試験に登録された925人の超早産児の症例におけるシンバイオティクス(プロバイオティクスとプレバイオティクスの組み合わせ)介入を分析している[31]。メタアナリシスでは、シンバイオティクスはNECのリスクを顕著な割合で減少させ(RR 0.18)、死亡率を減少させる(RR 0.53)可能性が示唆されたが、晩発性の侵襲性感染症は減少させなかった。しかしながら、試験データからはシンバイオティクスの有効性に関する確実性の低いエビデンスしか得られなかった。査読者は、大規模で質の高い臨床試験による確認が必要であると結論づけた。そのような試験が、実際にインドの農村部の新生児4,556人を対象に実施された。新生児の平均出生体重は2.7kgで、NECのリスクはなかった。新生児にはシンバイオティクス(ラクトバチルス・プランタラム+フラクトオリゴ糖)またはプラセボが投与された。医師によって診断された約300例の敗血症が観察され、研究者らはシンバイオティクスによって敗血症が40%減少したことを検出した。死亡率は2群間で差がなかった(Panigrahiら、2017年)[32]。
プロバイオティクスの効果は、アトピー性皮膚炎(AD)に対しても報告されている。多数の小規模研究が有望な結果を報告しているが[29]、2,600人の患者からなる39の試験から、主に小児のAD症例を対象としたプロバイオティクス治療(主にビフィズス菌と乳酸菌による治療)に関するコクラン・レビューでは、参加者が評価した湿疹症状やQOLに対するプロバイオティクスの臨床的に有意な効果は示されなかった。医師は湿疹スコアのわずかな減少を認めたが、その差は臨床的に有意ではなかった。著者らは、湿疹治療のためのプロバイオティクスの使用は、現在のところエビデンスに基づくものではないと結論づけた[33]。別の系統的レビューでは、特定のプロバイオティクスであるラクトバチルスLGGを周産期に適用した場合のAD発症に対する効果を検討したところ、より楽観的な結論が得られた。彼らは、合計2,600人の乳児を登録した11の試験を評価した。全体として、35%の有意なリスク減少が認められた[34]。
CDIにおけるFMTの顕著な成功は、他の疾患に関してこのアプローチへの過度の熱狂を引き起こしたかもしれない。過去20年間に実施されたプロバイオティクスの臨床試験の結果がさまざまであったことは、微生物学的な概念からエビデンスに基づく治療法への道のりが長いことを思い起こさせるものである。
こちらへ
ウイルス
この視点の第2部では、ヒトマイクロバイオームの中でもやや軽視されている側面、すなわちヒトビロームに焦点を当てる。その軽視の一因は、技術的な問題にある。細菌と古細菌が共有する16S rRNA遺伝子とは異なり、ウイルスには共有マーカー遺伝子が存在しない。ビロームの解析は、メタゲノム配列決定技術の発展を待たなければならなかった。さらに、ウイルスゲノムの配列データベースは細菌ゲノムの配列データベースよりもはるかに小さいため、バイオインフォマティクス解析がより複雑になっていた。しかし、ヒトのウイルスゲノムは、HMPの中で比較的無視されている部分であるだけでなく、その解析は、マイクロバイオーム工学だけでなく、抗生物質耐性の細菌病原体に対する標的医療アプローチの可能性も秘めた、大きな可能性を開くものであると私は考えている。以下では、まずIBDにおけるウイルスの役割について考察し、次にヒトの健康における細菌ウイルス(ファージ)の役割に焦点を当て、最後に公衆衛生上重要性の高いビローム研究の一端を紹介する。
IBDにおけるウイルス研究
これまでのところ、UC患者の約4分の1だけがFMTに反応して症状が改善した理由はわかっていない。ウイルスが「第3のゲノム」であり、細菌の「第2のゲノム」に次ぐ存在であることから、研究者たちは、微生物叢、遺伝学、免疫学、環境リスク因子を超えて、IBDの病態を補完する知見を得るために、IBDにおけるウイルスゲノム解析に注目した。包括的な研究が発表された[35]。研究者らはまず、クローン病(CD)患者18人とUC患者42人の便濾過液のメタゲノム配列決定を行い、IBDでない家庭内対照者12人の便と比較した。Caudovirales(尾状二本鎖(ds)DNAファージ)目およびMicroviridae(小型キャプシド一本鎖(ss)DNAファージ)科のファージが便中の最も豊富なウイルス分類群であり、その他のウイルス配列は5%未満であった。残りのウイルスは、Virgaviridae(ssRNA植物ウイルス)、Tymovirales(ssRNA植物ウイルスの形態学的に異なるグループ)、ds RNAウイルス(動物性レオウイルス、細菌性シストウイルス、植物性ウイルス、真菌性ウイルス、原虫性ウイルスを含む)、Anelloviridae(広範に分布しているが、疾病に起因しない環状ssDNA動物ウイルス)であった。
便中の植物および昆虫ウイルスは、UCに特異的ではなかったが、ヒトの腸内ビローム解析で頻繁に報告されており、おそらく食物中の植物材料に関連したウイルスを表している[36]。実際、膀胱のビロームには植物や昆虫のウイルスは含まれていない[37]。これは一般的な問題を示している。すなわち、腸管内容物は人体の外部に存在するということである。消化されるために腸を通過する食物(宿主の分泌物もある)を表している。したがって、便に含まれるものすべてが、有機物やエネルギーの供給源として人体に役立つだけでなく、人体の生理学に関連するわけではない。したがって、藻類ウイルスがUC患者の腸粘膜に過剰に存在するという観察結果が、一部の著者[38]によって示唆されているように、UCの食事リスク因子を示しているかどうかは疑問である。この議論は、食品、特に発酵食品に関連する微生物を含む腸内細菌叢の細菌にセテリス・パリブスを適用するものである。この議論は、便中のすべてがヒト宿主にとって生物学的に理にかなっているわけではないという警告になるかもしれない。
Normanらの研究[35]では、Caudoviralesは、CD患者とコントロールの両方と比較した場合、UC患者においてMicroviridaeよりも有意な濃縮を示した。次の段階として、彼らは糞便から分離したウイルス様粒子(VLP)画分を用いてメタゲノムシークエンシングを行った。IBD患者と対照者の便を縦断的に調査したところ、IBD患者においてCaudoviralesの濃度が増加していることが観察された。各病型(CD、UC)には固有のファージが存在した。ラクトコッカス、ラクトバチルス、クロストリジウム、エンテロコッカス、ストレプトコッカスの尾部ファージが疾患と関連していた。CDおよびUC患者の便は、対照群と比較して細菌の多様性が有意に減少していた。ファージの拡大は宿主細菌の増加の結果ではなかった。英国のコホートのデータは米国のコホートのデータで再現された。真核生物のウイルスの中では、アネロウイルス科がIBD患者で対照群より多かったが、疾患活動性との相関はみられなかった。
別の研究[39]では、FMTを受ける前と4週間後の活動性UC患者20人のウイルス群集を調査した。治療に反応しなかった患者と比較して、FMTに臨床的反応を示した患者では、移植時のCaudoviralesバクテリオファージの相対量が少なかった。さらに、非奏効例ではFMT後にCaudoviralesの相対量が増加したが、奏効例では変化はみられなかった。著者らは、大腸炎関連バクテリオファージがIFN-γ産生T細胞を誘導するのではないかと考えた。in vitro実験により、彼らは、活動性UCからのVLPは、非活動性UCや健常対照ではなく、ナイーブCD4+ T細胞の活性化とIFN-γの強力な誘導を引き起こすことを実際に示すことができた。
さらに、他の研究者[40]は、[35]のデータセットをバイオインフォマティクス的に再解析した。彼らは、ビロームには膨大な多様性と個人差があるため(ある研究では、一卵性双生児でさえビロームが異なっていた[41])、傾向を検出するためには、より高いウイルス分類学的レベル(すなわち、タンパク質の相同性レベル)でデータを解析することが不可欠であると主張した。彼らは[40]、健常人のコアビロームに関連する3つの主要なウイルスクラスター(VC)のいずれも溶原性に関連する遺伝子を特徴としていない一方で、IBDに関連する7つの主要なVCのうち1つを除くすべてが溶原性遺伝子も特徴としていることに注目した。健常人の便では溶菌性ファージが優勢で、疾患患者の便では温和性ファージが優勢であるという観察結果は、IBD以外にも一般化することはできない。実際、40年前に行われた2つの研究では、日本人患者の便中では、ファージ力価の上昇だけでなく、健康な対照群と比較して、病原性コリファージの割合が増加していることが示されている[42]。このことは、健康な小児とバングラデシュの小児下痢患者の便ファージを比較した際にも観察された。後者の場合、下痢患者から分離されたファージの95%が病原性ファージであり、そのほとんどがT4様コリファージであった[43]。より最近の研究では、1歳の健康な小児の便から分離されたコリファージは、温帯性ファージが最も多かった[44]。
Clooneyら[40]は、IBD患者の腸内ビロームの変化は、バクテリオームの変化と同時に起こることを観察した。彼らは、活性酸素種(ROS)のような炎症を起こした腸に関連する環境ストレス因子が、溶菌サイクルに入る溶原性細菌のプロファージを誘導するというモデルを提案した。この結果、影響を受ける細菌種が減少し、細菌の多様性が低下し、温帯性Caudoviralesが増加することになる。この解釈は、IBD関連ファージは温帯性ファージを多く含む尾状ファージが主体であったのに対し、健常者の腸内ビロームは病原性ミクロウイルス科が主体であったという観察結果と一致する。
便は腸内マイクロバイオーム解析のための簡便なサンプルであるが、便が腸内マイクロバイオームの信頼できる指標であるかどうかという疑問が提起された。そこで一部の研究者[38]は、便の代わりに直腸からの組織生検を分析材料として用いた。サンプルは香港の63人のUC患者と48人の健常対照者から採取された。Caudoviralesの存在量はUCで有意に高く、ウイルス種の多様性はコントロールに比べて減少していた。注目すべきは、UC患者の非炎症粘膜と健常対照粘膜の間で粘膜ビロームの多様性に差は認められなかったが、炎症性UC粘膜と対照粘膜の間では差が検出されたことである。UCにおけるウイルス "異常 "は、患者の個人差が大きく、中国本土の2つの参照群を用いた場合、研究者らは粘膜ウイルス叢の構造に対する地理的影響を検出した。属レベルでは、アスコウイルス(昆虫ウイルス)と連鎖球菌ファージがUC粘膜で検出されたウイルスの主流であった。解析の結果、ウイルス群集は2つのクラスターに収束し、2つ目のクラスターはほぼUC患者のみに見られた。このクラスターには腸内細菌のファージが多く含まれており、ΦX174-、P1-、P22-、λ-、T4-likeファージなどがよく知られている。
哺乳動物宿主と相互作用する細菌ウイルス
ファージはヒトの細胞には感染しないので、細菌ウイルスはヒトの宿主とは無関係ではないかという疑問が生じる。しかし、細菌ウイルスがヒト宿主といくつかのレベルで相互作用する可能性を示すデータもいくつか発表されている。直接的な相互作用に関するデータはまだ少ない。あるグループの報告によると、ファージM13のような糸状ファージのDNAはマウスに与えても消化されずに生き残った。ファージのDNA断片は、ファージDNAを与えた数時間後に血液中に検出された。PCRとin situ DNAハイブリダイゼーションによって、ファージDNAは白血球、脾臓、肝臓細胞で検出され、クローニング実験によって、ファージDNAがマウスのDNAに組み込まれたことが示されたとされる(Schubbertら)[45]。他の遺伝学者(Science : Can DNA in food find its way into cells? | New Scientist)は、これらの実験に懐疑的であり、私の知る限り、これらのデータは独自には確認されていない。
ビブリオコレラや緑膿菌(Pa)など、いくつかの重要な細菌性病原体の病原性を増強する糸状ファージに関するデータの方が、はるかに裏付けが取れている。例えば、糸状ファージを含む緑膿菌に感染した創傷は、プロファージを含まない緑膿菌に感染した創傷と比較して、創傷治癒の遅延を示した。創傷治癒の遅延は、糸状ファージの放出と関連しており、創傷内へのケラチノサイトの遊走阻害と関連していた[46]。Pa糸状ファージPf4は食細胞に直接作用して、免疫系のサイトカインである腫瘍壊死因子(TNF)の細胞内産生を抑制し、これがPa細菌のかみ込みを阻害して、創傷感染の除去を遅らせる。蛍光標識されたPf4はマウス食細胞に取り込まれ、リソソーム小胞と細胞質に局在した。細胞内のPf4粒子は、自然免疫系のパターン認識受容体であるTLR3の発現を誘発し、I型インターフェロンの産生を促し、その結果TNFの産生が阻害され、それによって貪食が阻害された[47]。これらのデータは、Pf4ファージが真核細胞内でRNAを転写することを証明するものではないが、50年前のデータでは、ファージ・ラムダに暴露されたヒト線維芽細胞からの全RNAの0.2%がラムダRNAであったと報告されている[48]。糸状ファージは、細菌細胞の完全性を損なうことなく、細菌膜を通して細菌宿主から離脱することを学んでいるので、糸状ファージが食細胞に侵入し、食細胞と密接に相互作用することができることは驚くべきことではない。従って、糸状ファージは真核生物の細胞膜も通過する可能性がある。実際、遺伝子組み換え糸状ファージは、ラットの鼻腔に投与された後、非常にタイトな血液脳関門を通過することが報告されている[49]。
研究者たちは最近、ファージに対する特異的な抗体やT細胞応答を誘導することによって、ファージが免疫系と相互作用するという事実に注目している[50]。ファージはエンドサイトーシスを経験する[51]。T4のようないくつかのファージは、そのキャプシドに免疫グロブリン様ドメインを発現しており、これが腸内の粘液との相互作用につながっている[52]。細胞培養実験では、ファージが上皮細胞を通過することでヒト細胞の細胞内コンパートメントと接触することが示されている。さらに、上皮下細胞層との接触も示された[53]。無菌マウスにバクテリオファージを投与すると、腸内で免疫細胞が増殖した。乳酸菌、大腸菌、バクテロイデス菌のファージとファージDNAは、ヌクレオチド感知受容体TLR9を介してIFN-γを刺激した[39]。ポーランドの科学者は、ファージ療法に関連するかもしれないファージの潜在的な免疫調節活性に注目している[54]。
ファージは細菌の病原性を高める
細菌病原体におけるファージコード化病原性因子を考慮すると、ヒト宿主におけるファージの相互作用は別のレベルでも起こる。細菌病原体の病原性を高めるファージは、糸状ファージ(イノウイルス)に限らない。この特徴は、プロファージとしてゲノムを細菌の染色体に組み込む多くのファージ(温帯ファージ)に共通している。ラムダファージをプロファージとして組み込んだ大腸菌株は、ラムダファージを欠いた株よりも試験管内で増殖する利点があることが、古典的な研究で示されている。また、補助的なλ遺伝子は、血流に達する大腸菌細胞に抗貪食性を付与する。その後、プロファージは重要な細菌毒素や病原性因子をコードすることにより、多くの重要な細菌病原体の病原性において重要な役割を果たしていることが明らかになった[55,56])。驚くべき数のプロファージ遺伝子が哺乳類宿主の免疫系に作用しており、貪食を阻害する因子や、プロファージがコードする超抗原による過剰活性化によって免疫防御を麻痺させる因子から始まっている。
細菌の病原性の発達におけるプロファージの重要な役割は、進化論的な議論によって合理化されてきた。ファージがそのDNAを細菌の染色体に組み込むとき、溶原性細菌の進化の成功から受動的に利益を得る。細菌はファージを万能の遺伝子キャリア(プロファージに付随する溶原性転換遺伝子、伝達物質としてのファージ)として利用し、進化を加速させる。この協力関係は、現在でもアメーバがそうであるように、真核生物がまだ単細胞で細菌を餌にしていた進化のはるか昔に遡るという推測がある[57]。アメーバを溶かす毒素をコードするプロファージを持つ細菌は、捕食を免れるだけでなく、アメーバを狩ることで生計を立てることができた。真核生物における多細胞性の進化に伴い、アメーバ細胞は、最初は海綿動物で、後には高等動物の貪食細胞として体内を巡回し、細菌の侵入をかわすようになった。細菌の病原性は、このような食物の捕食者と被食者の関係から進化したのかもしれない。もしファージと細菌の遺伝的協力関係が細菌の病原性に限定されるのであれば、それは驚くべきことである。プロファージが動物や植物をコロニー化する際、細菌の共生においても同様に重要な役割を果たすことは十分に予想される。腸や根に局在する細菌とそれに関連するプロファージやファージのゲノムは、常在性を高めるウイルス遺伝子の豊富な供給源となるかもしれない。
ファージは抗生物質耐性遺伝子を伝達するのか?
ファージを介した細菌への遺伝子導入に対する医学的関心は、病原性因子にとどまらず、抗生物質耐性遺伝子の導入の可能性にも及んでいる。Covid-19のパンデミックは公衆衛生上の危機であり、主要な細菌病原体における抗生物質耐性遺伝子(ARG)の増加も同様である。ESKAPE(Enterococcus faecium、Staphylococcus aureus、Klebsiella pneumoniae、Acinetobacter baumannii、Pseudomonas aeruginosa、Enterobacter spp)菌の一群は、現在すでに一般的な抗生物質による治療を免れている。今世紀半ばまでには、抗生物質耐性感染症によって年間約1000万人が死亡すると予測されている。これは、世界保健機関(WHO)にこれまでに報告されているCOVID-19による死亡者数650万人を上回る数である。このように、抗生物質使用の危機は、もう一つの差し迫った健康上の大惨事なのである。
現時点では、バクテリオファージが抗生物質耐性の危機にどのような役割を果たしているのか、研究者の意見は一致していない。個々のファージゲノムを研究している研究者たちは、約1200のファージゲノムに存在するARGの量が大幅に過大評価されていること、そして予測されたARGのうち4つは実験的に大腸菌に抗生物質耐性を付与できなかったことを報告した。これらの科学者は、ARGはファージにはほとんどコードされていないと結論づけた[58]。対照的に、臨床サンプルや環境サンプルから読み取られたウイルス分画やウイルス配列には、多くのARGが含まれている。しかし、メタゲノムリードから組み立てられたウイルスコンティグからは、わずかなARGしか見つかっておらず、これらの遺伝子のほとんどは有効な抗生物質耐性表現型を持たない[59]。しかし別の報告では、3種類の食品(鶏肉、魚、ムール貝)に含まれるウイルス分画が、ARGを保有するファージ粒子の供給源として同定された。大腸菌宿主に感染し増殖する能力は、分離後に実験的に確認された。ファージ粒子の結合を確実にするために、ARGを含む画分をCsCl密度勾配遠心分離でさらに精製し、キャプシド外のDNAを酵素的に除去した[60]。ファージゲノム内のARGについて最終的にどのような結論が出されるにせよ、古典的なファージ遺伝学では、一般化された伝達が可能なファージもARGを伝達できることが示された。特に興味深い事例が最近実証され[61]、側方伝達と呼ばれるようになった。pac-site系統の黄色ブドウ球菌プロファージは、統合されたプロファージDNAが細菌染色体から切り離される前にDNA複製を開始する。このプロセスにより、プロファージの複製起点の周囲に一種の "ポリテン "複製バブルが形成される。切除されたファージDNAの従来のローリングサークル複製機構に従う代わりに、この統合型プロファージは隣接する細菌DNAに数百キロベースにわたってDNAを複製する。その後、DNAパッケージングは統合されたプロファージから開始され、複製されたDNAをヘッドフルパッケージング機構によってファージのキャプシドに充填する。このようにして、かなりの量の細菌DNAがファージ粒子に取り込まれ、細菌DNAを高効率で導入する。現在、サルモネラ菌ファージP22についても、同様の側方伝達のメカニズムが同定されている[62]。
治療薬としてのファージ
バクテリオファージはヒトの健康を脅かすだけでなく、医師にとってもESKAPE菌に対する潜在的なツールである。ソビエト連邦では、抗生物質が不足していた時代にファージ療法(PT)が行われていた[63]。その根拠は単純で、さまざまな細菌性病原体に感染し溶解するバクテリオファージカクテルをさまざまな投与経路で投与し、患者から病原体を根絶するか、少なくとも患者の免疫系が残りの感染レベルに対処できる程度まで病原体の力価を低下させることを期待するものである。しかし、1つの顕著な例外を除いて、RCTはこれまでほとんどPTの有効性を証明することができなかった。経口投与されたT4コリファージ・カクテルも市販のロシア・ファージ・カクテルも、バングラデシュの小児における急性細菌性下痢に対する治療効果を示さなかった。この失敗は、使用されたファージ力価が低すぎたこと、あるいはin vivoの病原体力価がT4ファージの複製閾値以下にとどまっていたことに起因しているのかもしれない[64]。トビリシのエリアヴァ研究所から市販されているグルジア産パイオファージカクテルによる膀胱感染症の治療は、プラセボや抗生物質による膀胱洗浄よりも優れていなかった[65]。著者らは、差異を検出するための治療患者数に関して、試験がパワー不足であったことを示唆した。緑膿菌に感染した熱傷患者を対象とした3つ目のPT RCTは、治療患者数に関して深刻な検出力不足であり、ファージカクテルはさらに安定性の問題に悩まされていた[66]。緑膿菌ファージを用いた外耳道感染症に関する4番目の注意深くコントロールされたRCTは、少なくとも一過性の有効性を示唆するいくつかのヒントを与えたが、その証拠はまだ予備的なものである[67]。これまでのところ、成功した唯一のRCTは、トビリシ(グルジア共和国)で実施された1963年の予防試験であり、錠剤に押し込んだ赤痢菌ファージを経口投与した3歳未満の小児における赤痢症および大腸菌による下痢の有意な減少を実証している。このプラセボ対照無作為化試験は、微生物学的および臨床的評価で3ヵ月間追跡された30,000人の小児を対象に実施された[63]。ESKAPE菌に対するPTの見通しにとってさらに心強いのは、症例報告や症例シリーズの数が増えていることであり、そのうちのいくつかは慎重な微生物学的分析を伴っており、長期のファージ治療を必要とすることが多いとはいえ、比較的高い確率で感染症が治癒していることを示している。その多くは抗生物質耐性のESKAPE菌に感染していた。文献には14のケースシリーズ報告(最近の例は[68-71])があり、症例報告も増えている。倫理的な理由から、ほとんどの治療がファージと抗生物質の両方を使って行われたため、有望な臨床結果は、ファージと抗生物質の相乗効果によって、病原菌が二重の選択圧にさらされたことが一因かもしれない。伝統的な方法[72]や遺伝子工学[73]によって、治療用ファージを個々の患者の病原体にあらかじめ適合させることは可能である。ファージを事前に適応させることで、耐性菌の発生を抑えることもできる[74]。遺伝子工学によって、宿主受容体結合タンパク質をシャッフルすることで、ファージの宿主範囲を広げることができる[75]。これらの可能性は、潜在的な治療ツールとしてのファージの多用途性をさらに高めている。
マイクロバイオーム工学のためのファージ?
新たな展開として、ファージ療法を病原体、つまり患者の微生物叢の異常や特定の遺伝的・免疫学的欠陥の存在下で病気を引き起こす生物に拡張することが挙げられる。ファージアプローチは、選択的介入によって、種や、しばしば株特異的なレベルでさえ作用する、標的微生物叢工学の可能性を提供する。これとは対照的に、抗生物質は常在菌を含むすべての細菌に対して作用する。FMTはさらに選択性が低く、病原性ウイルスを含む可能性のある複雑なマイクロバイオーム全体に作用する。この概念を証明するものとして、大規模な研究コンソーシアムが、異なる地理的背景を持つ500人のIBD患者の腸内細菌叢を調査し、IBD関連病原細菌と推定されるKlebsiella pneumoniae(Kp)を同定した[76]。次にコンソーシアムは、IBD疾患の再燃時に増加する特定のKp株に注目した。これらの菌株はマウスの大腸で炎症反応を誘発した。研究チームは次に、これらのKp株に対するファージのカクテルを調製した。抗生物質で前処理したKp株コロニー形成マウスにファージを経口投与したところ、腸内Kp力価は1000倍減少し、腸刺激性物質によって誘発されたマウス大腸炎モデルにおける炎症は改善された。技術的ヒト腸管モデルでは、低pHの胃シミュレーション条件下でファージの消失が観察された。胃酸抑制剤(オメプラゾール)で前処置した健常人ボランティアでは、高用量の経口ファージ(1010感染性ファージ粒子)が胃を通過しても生存し、副作用を引き起こさなかった[76]。全体として、これは有望なアプローチであり、重要な問題は、同定されたKpがIBDの原因なのか、それともIBDに直接影響を与えることなく、IBDにつながる病態の「並行した」エピフェノメノンにすぎないのか、ということである。この報告書にコメントを寄せた科学者たちは、この研究の素晴らしい範囲を賞賛したが、ファージを追加することが、IBDにおいてすでに過剰に増殖しているファージの生態系にどのような影響を与えるのか、また、ファージが介在する細菌殺傷がさらに進んだ結果、炎症が上昇する可能性はないのか、と疑問を投げかけている[78]。
分子生物学のモーターとしてのファージ
現在の状況において、ファージと細菌の相互作用に関する研究が歴史的に分子生物学の基礎となってきたことを思い出すことは価値がある。ファージの感染を制御するファージ酵素と細菌の制限酵素は、遺伝子工学を可能にし、分子生物学革命を起こした。ファージと細菌の相互作用の研究、特にその軍拡競争の遺伝的側面の研究は、牛乳発酵におけるファージとヨーグルトスターター菌の相互作用を研究した際に発見されたCRISPR-Casシステムの発見に記録されているように、遺伝子工学に革命をもたらしたツールを提供し続けている[79]。ファージとその宿主細菌との間の軍拡競争の遺伝的側面の解析は、分子生物学のツールボックスに新たな遺伝子やタンパク質を提供し続けている。
ヒトに適応した(有益な?
腸内ビロームの調査は、ヒトウイルスを抜きにしては完結しない。ヒトウイルスはヒト細胞に感染することができるため、腸内で発見されたヒトウイルスは、ヒト細胞に対する細胞障害作用を通じて、ヒトの健康に悪影響を及ぼすに違いないと結論付けたくなるかもしれない。しかし、必ずしもそうではない。ウイルス学的研究によって、過去には全くあるいは最小限の症状しか引き起こさなかったために発見されなかったウイルス感染が発見されている。進化論的な議論では、ウイルスの病原性は、ヒトの宿主を不安定にする動物由来(人獣共通感染症)の交差感染によるウイルスの不適応であるとしばしば主張される。SARS-CoV-2はこの概念の一例である。このウイルスの起源はおそらく動物、特にコウモリにあり、そこではコロナウイルスは自然宿主との長い共進化のために、最小限の疾患しか引き起こさないか、全く引き起こさない[82]。ヒトでは、SARS-CoV-2はまだ不適応であり、特定の個体で重篤な疾患を引き起こす。よく適応したウイルスとは、宿主の中で多くの症状を引き起こすことなく効率的に複製するものである。多くのウイルス学者が、これがウイルスの進化の頂点であると考えている。
ヒトの便に含まれるアレロウィルス(AV)は、ヒトの便中に広く分布しているが無害なウィルスの例かもしれない。ほとんどのヒトはアレロウイルスに慢性的に感染しているか、継続的に再感染している。感染は乳児の早い時期から始まる(胎盤感染は起こらないようである)。AV種の豊富さは乳児期早期に増加し、1歳で最大レベルに達する。ヒトの血液中には100以上の異なるヒトAV配列が同定されている[83]。AVはヒトの多くの組織で発見されるが、縦断的研究では鼻腔の「コロニー形成」が血液感染に先行するようである。AVはHIVよりもはるかに高い遺伝的多様性を示し、AVが数百万年前に霊長類に侵入した「古い」ウイルスであることを示唆している。これまでのところ、AV感染に関連した疾患は見つかっておらず、AVは、発育初期にウイルス感染に攻撃的に対処しないように免疫系を訓練する、有益なウイルス感染の候補であると考える著者さえいる[84]。慢性ウイルス感染から得られたいくつかのデータは、危害をもたらすのは主に細胞レベルでのウイルス感染の細胞病理学(アレロウイルスはその複製サイクルの間に誘導しなければならない)ではなく、「まだ適応していない新しい」ウイルスに対する免疫系の攻撃的な反応であり、それが重篤な臨床症状を引き起こすことを示しているようである[85]。
糞便を排泄する呼吸器ウイルス
一見すると、ヒトの腸内にSARS-CoV-2が存在することは意外かもしれない。SARS-CoV-2は主に上気道と下気道で複製する。ヒト細胞のウイルス受容体であるACE2は、呼吸器系で広く発現しているだけでなく、腸管上皮で最も顕著に発現している。したがって、Covid-19患者の最大20%が消化器症状を示し、そのほとんどが腹痛、下痢、嘔吐であったことは驚くべきことではない。ウイルスRNAは糞便から検出され、その排泄は呼吸器分泌物からSARS-CoV-2 RNAが検出された後もしばしば続いた。そのため、当初は糞便-経口感染経路が考えられたが、疫学的データからは糞便が主な感染源であることは確認できなかった。SARS-CoV-2の腸内複製に関する証拠は曖昧であり[86]、細胞培養における糞便からの感染性ウイルスの増殖は、おそらく糞便中に阻害物質が存在するために失敗している[87]。現在のところ、SARS-CoV-2の糞便-経口感染経路は、存在するとしても軽微であると考えられているが、伝達性胃腸炎ウイルスのような多くの動物コロナウイルスが腸管上皮に感染し、腸の陰窩にある幹細胞に感染するため、子豚にほぼ100%の死亡率を引き起こすことから、それは予期できないことであった。また、呼吸器系ウイルスである鳥インフルエンザウイルスも腸内で複製され、大量の感染性ウイルスが鳥の糞と一緒に排泄される。SARS-CoV-2の糞便感染の懸念から、下水中のコロナウイルスの存在が研究されるようになった。下水のウイルス学は、PCRによるウイルス検出と、後にメタゲノム配列決定と組み合わされ、公衆衛生活動の新たな分野を切り開いた[88]。SARS-CoV-2の数の増加は、病院がCovid-19患者の増加を指摘する数日前に排水から検出することができ、公衆衛生当局に早期警告を与えた[89,90]。廃水ウイルス学は、SARS-CoV-2に限らず診断ツールである。最近、廃水サンプル中のポリオウイルスの増加が観察され、臨床データからは欧米諸国のヒト集団でそれほど大規模に循環しているとは考えられていなかった他の腸管ウイルスにも注目が集まった[91]。
次へ
結論
HMPの10回目の誕生日にあたり、マイクロバイオームの変化と疾患との関連を、マイクロバイオームとヒトの疾患との因果関係を示す証拠とする性急な結論に対する賛辞に、私は批判的な意見を付け加えたい。マイクロバイオームの変化を、それ自体が疾患に直接的な影響を及ぼすことなく、疾患に至る病理学的プロセスの結果、すなわち随伴現象(epiphenomena)として除外するためには、マイクロバイオームへの介入が疾患の発現に影響を及ぼすという証明が必要である。そのような証拠は、C. difficile感染症におけるFMTによって得られているが、IBDから肥満や栄養失調に至るまで、他の腸内疾患におけるマイクロバイオームを標的とした介入については、今のところ明確な証拠は得られていない。非現実的な高望みを抑制するために、ヒトのマイクロバイオーム研究にもコッホの定説に相当するものが必要である。
第二のポイントとして、「第二の」細菌ゲノムに続く第三のゲノム、ウイルスに注目したい。これを第3のゲノムと呼ぶのは、細菌を第2のゲノムと呼ぶのと同じくらい見当違いであろう。私に言わせれば、これらの微生物が私たちの利益のために働いているかどうかは疑問である。実際、進化は1つの細菌が2つになることを望むような原理で動いている。私たちの体は、真核生物、原核生物、そしてウイルスが、海であれ、土壌であれ、私たちの体であれ、生態系における居場所を求めて戦い続けている中で、偶然にも戦いの場となっている。私たちの」という所有代名詞の使用は、私たちの利益のために環境から微生物を選択的に選ぶことを予期しているため、ここでは見当違いである。微生物とその宿主の間に有益な関係が生まれることもあるが、多くは中立的な関係を保ち、わずかに否定的なものもあるが、防衛のための投資を正当化するほどではない。微生物によっては宿主を死に至らしめるほどの悪影響を及ぼすものもあり、それは細菌やウイルスが大流行を引き起こしたときにまざまざと見せつけられる。
腸内マイクロバイオームと肥満や栄養失調との関連性に関する複雑かつ科学的に印象的な研究が示すように、マイクロバイオームへの介入を臨床応用する道は長く険しい。ファージ療法の長く紆余曲折した物語は、魅力的なアイデアを臨床応用することの難しさを如実に物語っている。私が言いたいのは、ファージ研究は過去に何度もその科学的豊饒さを実証してきたということである。HMPの10回目の誕生日に、このプロジェクトをウイルスにまで拡大する時が来たのは確かである。ヒトの健康のためにマイクロバイオームを操作したいのであれば、ヒト宿主内での細菌とウイルスのダイナミックな相互作用を分析する必要がある。
ヒト腸内ビロームの様々な側面に関するこの視点が、ヒトマイクロバイオーム・プロジェクトの今後の活動において、ウイルスへの注力を高める動機となることを願っている。筆者は、食品産業におけるウイルス学の様々な側面について、産業研究者として長年研究してきた。ヒト・ヴィロームの研究は、多くの実用的な応用が可能かもしれない。最後に、パンデミック対策へのアプローチのひとつを挙げておこう: 新興ウイルス感染の検出と制御は、人獣共通感染症の脅威のセンチネルとしての野生動物よりも、攪乱された生息環境で野生動物と密接に接触して生活している人々や、生きた動物市場で働いている人々のビロームスクリーニングの方が容易かもしれない。早期の警告とタイムリーな介入によって、コヴィド19の大流行を繰り返さずに済むかもしれない。
こちらへ
宣言
謝辞
原稿を批評的に読んでくださったOlga Sakwinska博士に感謝する。
著者の貢献
本論文は、著者が単独で執筆した。
データおよび資料の入手
該当なし。
資金援助およびスポンサーシップ
なし。
利益相反
著者はネスレリサーチ在職中に様々な抗体、プレバイオティクス、プロバイオティクス、ファージ介入研究に従事し、現在もネスレのウイルス学コンサルタントを務めている。著者はネスレの株式を保有していない。
倫理的承認および参加同意
該当なし。
出版に関する同意
該当なし。
著作権
© 著者(複数可) 2023.
このページのトップへ
参考文献
ヒトマイクロバイオームプロジェクトコンソーシアム。健康なヒトのマイクロバイオームの構造、機能、多様性。Nature. 2012;486:207-14. doi: 10.1038/nature11234. [PMCフリー論文] [PubMed] [CrossRef] [Google Scholar].
レイR.ヒトマイクロバイオーム:やるべきことがたくさん残っている。ネイチャー。doi: 10.1038/d41586-022-01610-5. [PubMed】【CrossRef】【Googleスカラー
腸内細菌叢異常症の概念の問題点。Microb Biotechnol。2020;13:423-34. doi: 10.1111/1751-7915.13479. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ポパー K 仮説と反駁。科学的知識の成長。Available from: https://books.google.com.hk/books/about/Conjectures_and_Refutations.html?id=IENmxiVBaSoC&redir_esc=y. [最終アクセス日:2023年3月24日].
Subramanian S, Huq S, Yatsunenko T, et al. 栄養不良のバングラデシュの子どもたちにおける持続的な腸内細菌叢の未熟さ。Nature. 2014;510:417-21。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
健康なヒト腸内細菌叢の発達と障害のあるヒト腸内細菌叢の発達を記述する疎な共変量単位。Science. 2019;365:eaau4735. doi: 10.1126/science.aau4735. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
GehrigJL、Venkatesh S、Chang HW、他。 gnotobiotic動物と栄養不良の子供における微生物指向性食品の効果。Science. 2019;365:eaau4732. doi: 10.1126/science.aau4732. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
栄養不良の子どもに対する微生物指向の食品介入。N Engl J Med. 2021;384:1517-28. doi: 10.1056/nejmoa2023294. [この論文では、栄養不良の子どもたちに対して、生物学的手法を用いた食品介入を実施した。
バングラデシュの小児の腸内に存在するビフィドバクテリウム・ロンガムの別個のクレードは離乳期に増殖する。Cell. 2022;185:4280-4297.e12.doi:10.1016/j.cell.2022.10.011。[PubMed][CrossRef][Googleスカラー]。
栄養不足の子供に対する微生物指向の食品介入。N Engl J Med 2022;386:1483-4. [PubMed] [CrossRef] [Google Scholar].
地元で入手可能な食材から作られたすぐに使える治療食は、バングラデシュの重症急性栄養失調の子どもたちによく受け入れられている。Food Nutr Bull. 2018;39:116-26. doi: 10.1177/0379572117743929. [PubMed] [CrossRef] [Google Scholar].
Lenters LM, Wazny K, Webb P, Ahmed T, Bhutta ZA. 低・中所得環境における重症・中等症急性栄養失調の治療:システマティックレビュー、メタアナリシス、デルファイプロセス。BMC Public Health. 2013;13補助3:S23。[PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Sultana S, Sarker SA, Brüssow H. What happened to Koch's postulates in diarrhoea? Environ Microbiol. 2017;19:2926-34. doi: 10.1111/1462-2920.13787. [PubMed] [CrossRef] [Google Scholar].
健康とは何か?Microb Biotechnol。2013;6:341-8. doi: 10.1111/1751-7915.12063. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar] 。
Gough E, Shaikh H, Manges AR. 再発性クロストリジウム・ディフィシル感染症に対する腸内細菌叢移植(糞便細菌療法)の系統的レビュー。Clin Infect Dis. 2011;53:994-1002. doi: 10.1093/cid/cir632. [PubMed] [Google Scholar].
再発性クロストリジウム・ディフィシル感染症患者における凍結対新鮮糞便微生物叢移植と下痢の臨床的消失:無作為化臨床試験。JAMA. 2016;315:142-9. doi: 10.1001/jama.2015.18098. [PubMed] [CrossRef] [Google Scholar].
多発性クロストリジウム・ディフィシル感染症の再発に対する糞便微生物叢移植の効果:無作為化試験。Ann Intern Med. 2016;165:609-16. doi: 10.7326/M16-0271. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Ott SJ, Waetzig GH, Rehman A, et al. クロストリジウム・ディフィシル感染症患者の治療における無菌糞便濾液移植の有効性。Gastroenterology. 2017;152:799-811.e7. doi: 10.1053/j.gastro.2016.11.010. [PubMed] [CrossRef] [Google Scholar].
イヌの糞便微生物叢移植における重要成分のメカニズム。Vet Sci. 2022;9:695. doi: 10.3390/vetsci9120695. [この論文では、イヌの糞便微生物叢移植に重要な役割を果たす成分について、そのメカニズムに迫る。
Zuo T, Wong SH, Lam K, et al. クロストリジウム・ディフィシル(Clostridium difficile)感染症における糞便微生物叢移植中のバクテリオファージ移行は治療成績と関連する。Gut. 2018;67:634-43... doi: 10.1136/gutjnl-2017-313952. [PMC free article] [PubMed] [Ref] [Google Scholar].
Smith AB, Jenior ML, Keenan O, et al. Enterococci enhance clostridioides difficile pathogenesis. Nature. 2022;611:780-6. doi: 10.1038/s41586-022-05438-x. [この論文では、腸球菌がクロストリジウム・ディフィシルの病原性を高めることを明らかにした。
偽膜性大腸炎を含むクロストリジウム・ディフィシル感染症。https://accessmedicine.mhmedical.com/content.aspx?bookid=2129§ionid=186949817。[最終アクセス日:2023年3月23日].
Moayyedi、Surette、MG、Kim、PT、他。無作為化比較試験において、活動性潰瘍性大腸炎患者において、糞便微生物叢移植が寛解を誘導した。Gastroenterology. 2015;149:102-109.e6. doi: 10.1053/j.gastro.2015.04.001. [PubMed] [CrossRef] [Google Scholar].
潰瘍性大腸炎患者に対する糞便移植のランダム化比較試験の結果。Gastroenterology. 2015;149:110-118.e4. doi: 10.1053/j.gastro.2015.03.045. [PubMed] [CrossRef] [Google Scholar].
活動性潰瘍性大腸炎に対する多臓器集中糞便微生物移植:無作為化プラセボ対照試験。Lancet. 2017;389:1218-28. doi: 10.1016/S0140-6736(17)30182-4. [PubMed] [CrossRef] [Google Scholar].
Costello SP, Hughes PA, Waters O, et al. 潰瘍性大腸炎患者の8週間寛解に対する糞便微生物叢移植の効果:無作為化臨床試験。JAMA. 2019;321:156-64. doi: 10.1001/jama.2018.20046. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
炎症性腸疾患における宿主-微生物叢相互作用。Nat Rev Immunol. 2020;20:411-26. doi: 10.1038/s41577-019-0268-7. Google Scholar] [PubMed] [CrossRef] [Google Scholar] [PubMed] [CrossRef] [Google Scholar].
Vaughn BP, Vatanen T, Allegretti JR, et al. 活動性クローン病に対する糞便微生物叢移植後の腸内微生物多様性の増加。Inflamm Bowel Dis. 2016;22:2182-90. doi: 10.1097/MIB.000000000893. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
アトピー性皮膚炎の微生物学。Environ Microbiol. 2016;18:2089-102. doi: 10.1111/1462-2920.13050. [PubMed] [CrossRef] [Google Scholar].
超早産児または超低出生体重児における壊死性腸炎予防のためのプロバイオティクス。Cochrane Database Syst Rev. 2020;10:CD005496. doi: 10.1002/14651858.CD005496.pub5. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
超早産児または超低出生体重児における壊死性腸炎予防のためのシンバイオティクス。コクランデータベースシストリビューション(Cochrane Database Syst Rev. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
インド農村部における乳児の敗血症予防のためのシンバイオティクス無作為化試験。Nature. 2017;548:407-12. doi: 10.1038/nature23480. [PubMed] [CrossRef] [Google Scholar].
湿疹治療のためのプロバイオティクス。Cochrane Database Syst Rev. 2018;11:CD006135... doi: 10.1002/14651858.CD006135.pub3. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
乳幼児のアトピー性皮膚炎予防のために周産期に使用される乳酸菌:無作為化試験の系統的レビューとメタアナリシス。Am J Clin Dermatol. doi: 10.1007/s40257-022-00723-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
炎症性腸疾患における腸内ビロームの疾患特異的変化。Cell. 2015;160:447-60. doi: 10.1016/j.cell.2015.01.002. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
マレーシアの2つの先住民集団における腸内ビローム. このような背景のもと、マレーシアの2つの先住民集団における腸内ウィルソームが明らかになった。[PMC無料論文] [PubMed] [CrossRef] [Google Scholar].
下部尿路のバクテリオファージ。Nat Rev Urol. 2019;16:422-32. doi: 10.1038/s41585-019-0192-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Zuo T, Lu XJ, Zhang Y, et al. 潰瘍性大腸炎における腸粘膜ビロームの変化。Gut. 2019;68:1169-79. doi: 10.1136/gutjnl-2018-318131. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Gogokhia L, Buhrke K, Bell R, et al. バクテリオファージの拡大は腸の炎症と大腸炎の悪化に関連している。Cell Host Microbe. 2019;25:285-299.e8. doi: 10.1016/j.chom.2019.01.008. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Whole-virome analysis sheds light on viral dark matter in inflammatory bowel disease. Cell Host Microbe. 2019;26:764-778.e5. doi: 10.1016/j.chom.2019.10.009. [PubMed] [CrossRef] [Google Scholar].
Moreno-Gallego JL, Chou SP, Di Rienzi SC, et al. Virome diversity correlates with intestinal microbiome diversity in adult monozygotic twins. Cell Host Microbe. 2019;25:261-272.e5. doi: 10.1016/j.chom.2019.01.019. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ヒト糞便中におけるバクテリオファージの分布:健常人および内科疾患・白血病患者の連続調査.J Gen Virol. 1983;64:2039-43. doi: 10.1099/0022-1317-64-9-2039. [PubMed] [CrossRef] [Google Scholar].
バングラデシュの小児下痢患者の便からエシェリヒア・コリ バクテリオファージを分離した。J Bacteriol. 2004;186:8287-94. doi: 10.1128/JB.186.24.8287-8294.2004. [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Mathieu A, Dion M, Deng L, et al. 1歳児糞便検体中の病原性コリファージは温帯性コリファージより少ないが感染力は強い。Nat Commun. 2020;11:378. doi: 10.1038/s41467-019-14042-z. [この論文では、大腸菌の感染経路を明らかにすることを目的とした。
マウスが摂取した外来(M13)DNAは腸壁粘膜を介して末梢白血球、脾臓、肝臓に到達し、マウスのDNAと共有結合する。このようなDNAは、マウスのDNAと共有結合することができる。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Bach MS, de Vries CR, Khosravi A, et al. 糸状バクテリオファージは偽モナス感染創傷の治癒を遅らせる。Cell Rep Med. このような研究は、日本ではほとんど行われていない。[このような研究は、日本ではほとんど行われていない。
バクテリオファージは抗ウイルス免疫の引き金となり、細菌感染のクリアランスを防ぐ。Science. 2019:363. doi: 10.1126/science.aat9691. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Merril CR, Geier MR, Petricciani JC. ヒト細胞における細菌ウイルス遺伝子の発現。Nature. 1971;233:398-400. doi: 10.1038/233398a0. [PubMed] [CrossRef] [Google Scholar].
カレラMR、カウフマンGF、ミーJM、メイラーMM、クーブGF、ジャンダKD。ウイルスによるコカイン中毒の治療。(1)コカイン中毒の治療法,(2)コカイン中毒の治療法,(3)コカイン中毒の治療法,(4)コカイン中毒の治療法,(5)コカイン中毒の治療法. [この論文では、コカイン中毒の原因として、ウイルスの感染経路の解明が重要であることを指摘した。
Popescu M, Van Belleghem JD, Khosravi A, Bollyky PL. バクテリオファージと免疫系。Annu Rev Virol. 2021;8:415-35. doi: 10.1146/annurev-virology-091919-074551. Google Scholar] [PubMed] [CrossRef] [Google Scholar] [PubMed] [CrossRef] [Google Scholar].
バクテリオファージのエンドサイトーシス。Curr Opin Virol. 2022;52:229-35. doi: 10.1016/j.coviro.2021.12.009. [PubMed][CrossRef][Googleスカラー]。
粘液に付着したバクテリオファージは非宿主由来の免疫を提供する。このような研究は、日本ではほとんど行われていない。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Nguyen S, Baker K, Padman BS, et al. Bacteriophage Transcytosis Provides a Mechanism To Cross Epithelial Cell Layers. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Górski A, Międzybrodzki R, Borysowski J, et al. Phage as a modulator of immune response: practical implications for phage therapy. この論文では、ファージが免疫応答の調節因子であることを明らかにした。Google Scholar] [PubMed] [CrossRef] [Google Scholar] [PubMed] [CrossRef] [Google Scholar].
Brüssow H, Canchaya C, Hardt WD. ファージと細菌病原体の進化:ゲノム再編成から溶菌転換まで。この論文では、ファージが細菌病原体にどのような進化をもたらしたかを明らかにした。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
プロファージゲノミクス. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
原生生物とファージ間の細菌:捕食戦略から病原性の進化まで. Mol Microbiol. 2007;65:583-9. doi: 10.1111/j.1365-2958.2007.05826.x. [PubMed] [CrossRef] [Google Scholar].
Enault F, Briet A, Bouteille L, Roux S, Sullivan MB, Petit MA. Phages rarely encode antibiotic resistance genes: a cautionary tale for virome analyses. ISME J. 2017;11:237-47. doi: 10.1038/ismej.2016.90. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Moon、Jeon JH、Kang I、et al. 淡水のウイルスメタゲノムから、ファージが媒介する新規かつ機能的な抗生物質耐性遺伝子が明らかになった。Microbiome. 2020;8:75。doi: 10.1186/s40168-020-00863-4. [このような背景のもと、日本では、「微生物ゲノム」の研究が進められている。
食品小売店のビロームにおける抗生物質耐性遺伝子を持つファージ粒子の優位性。ISME J. 2023;17:195-203. doi: 10.1038/s41396-022-01338-0. [このような研究は、日本ではほとんど行われていない。
横方向伝導によるゲノムの超可動性。Science. 2018;362:207-12. doi: 10.1126/science.aat5867. [PubMed] [CrossRef] [Google Scholar].
Fillol-Salom A, Bacigalupe R, Humphrey S, Chiang YN, Chen J, Penadés JR. サルモネラ菌ファージP22のライフサイクルには側方伝達が必須である。Nat Commun. 2021;12:6510。doi: 10.1038/s41467-021-26520-4. [この論文では、サルモネラ菌ファージP22の生活環を明らかにした。
Sulakvelidze A, Alavidze Z, Morris JG Jr. バクテリオファージ療法。Antimicrob Agents Chemother. 2001;45:649-59. doi: 10.1128/AAC.45.3.649-659.2001. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
急性細菌性下痢に対する2種類のコリファージ製剤による経口ファージ療法:バングラデシュの小児を対象とした無作為化試験。EBioMedicine. 2016;4:124-37. doi: 10.1016/j.ebiom.2015.12.023. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
経尿道的前立腺切除術を受けた患者における尿路感染症治療のための膀胱内バクテリオファージ:無作為化プラセボ対照二重盲検臨床試験。Lancet Infect Dis. 2021;21:427-36. doi: 10.1016/S1473-3099(20)30330-3. [PubMed] [CrossRef] [Google Scholar].
緑膿菌に感染した熱傷に対するバクテリオファージカクテルの有効性と忍容性:無作為化対照二重盲検第 1/2 相試験。Lancet Infect Dis. 2019;19:35-45. doi: 10.1016/S1473-3099(18)30482-1. [PubMed] [CrossRef] [Google Scholar].
Wright A, Hawkins CH, Anggård EE, Harper DR. 抗生物質耐性緑膿菌による慢性耳鼻咽喉科炎における治療用バクテリオファージ製剤の対照臨床試験;有効性の予備報告。Clin Otolaryngol. 2009;34:349-57. doi: 10.1111/j.1749-4486.2009.01973.x. [PubMed] [CrossRef] [Google Scholar].
多剤耐性菌感染症に対するバクテリオファージ静注療法の米国単一施設における最初の連続10症例から得られた教訓。Open Forum Infect Dis. 2020;7:ofaa389。doi: 10.1093/ofid/ofaa389. [PMC無料論文] [PubMed] [CrossRef] [Google Scholar].
Dedrick RM, Smith BE, Cristinziano M, et al.マイコバクテリウム感染症のファージ療法:薬剤耐性マイコバクテリウム疾患患者20人に対するファージの思いやり使用。Clin Infect Dis. 2023;76:103-12. doi: 10.1093/cid/ciac453. [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Doub JB, Johnson AJ, Nandi S, et al. 10例の難治性人工関節周囲感染症に対する補助バクテリオファージ療法の使用経験:ケースシリーズ。Clin Infect Dis. 2023;76:e1463-6. doi: 10.1093/cid/ciac694. [PubMed] [CrossRef] [Google Scholar].
Fabijan A, Lin RCY, Ho J, Maddocks S, Ben Zakour NL, Iredell JR; Westmead bacteriophage therapy team.重症黄色ブドウ球菌感染症におけるバクテリオファージ療法の安全性。Nat Microbiol. doi: 10.1038/s41564-019-0634-z.
Eskenazi、Lood C、Wubbolts J、他。パンドラッグ耐性肺炎桿菌による骨折関連感染症の治療における、事前に適合させたバクテリオファージ療法と抗生物質の併用。Nat Commun. doi: 10.1038/s41467-021-27656-z. [このような場合、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う必要があります。
Dedrick、Guerrero-Bustamante CA、Garlena RA、et al. 播種性薬剤耐性膿瘍性マイコバクテリウム患者の治療のための工学的バクテリオファージ。Nat Med. 2019;25:730-3. doi: 10.1038/s41591-019-0437-z. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
寄生ファージの病原体への前適応は、緑膿菌嚢胞性線維症細菌分離株で病原体クリアランスの増加と耐性進化の低下をもたらす。J Evol Biol. 2016;29:188-98. doi: 10.1111/jeb.12774. [PubMed] [CrossRef] [Google Scholar].
Dunne M, Prokhorov NS, Loessner MJ, Leiman PG. バクテリオファージの宿主範囲をリプログラミングする:受容体結合タンパク質を工学的に設計するための設計原理と戦略。Curr Opin Biotechnol. 2021;68:272-81. doi: 10.1016/j.copbio.2021.02.006. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
腸内炎症治療のためのファージ・コンソーシアによるヒトIBD関連腸内細菌叢常在菌の標的化抑制。Cell. doi: 10.1016/j.cell.2022.07.003. [PubMed][CrossRef][Googleスカラー]。
腸内細菌の異所性コロニー形成はT(H)1細胞の誘導と炎症を促進する。Science. 2017;358:359-65. doi: 10.1126/science.aan4526. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Bertocchi A, Powrie F. A viral cocktail calms gut inflammation. Nature. 2022;612:220-1. doi: 10.1038/d41586-022-03703-7. [PubMed] [CrossRef] [Google Scholar].
CRISPRは原核生物にウイルスに対する獲得耐性を与える。Science. 2007;315:1709-12. doi: 10.1126/science.1138140. Google Scholar] [PubMed] [CrossRef] [Google Scholar] [PubMed] [CrossRef] [Google Scholar].
ウイルスにコードされたCRISPR-casシステムには、合理的なゲノムエディターが含まれている。Cell. 2022;185:4574-4586.e16. doi: 10.1016/j.cell.2022.10.020. [このようなゲノムエディターは、ゲノム編集の効率化に役立つと考えられている。
ウイルスはTIR gcADPRシグナルを阻害して細菌の防御を克服する。Nature. 2022年;611:326-31. doi: 10.1038/s41586-022-05375-9. [このような研究は、日本ではほとんど行われていない。
蝙蝠の適応の進化を6つの参照ゲノムから明らかにした。Nature. 2020年;583:578-84. doi: 10.1038/s41586-020-2486-3. [この論文では、コウモリの適応進化を明らかにするために、6つのリファレンスゲノムクオリティのゲノムを作成した。
Tisza MJ, Pastrana DV, Welch NL, et al. 数千種類の高度に多様な環状DNAウイルスの発見。Elife. 2020:9。doi: 10.7554/eLife.51971. [また、そのようなウイルスを発見した場合には、そのウイルスの遺伝子発現を解析し、ウイルスを発見したウイルスの遺伝子発現を解析し、ウイルスを発見したウイルスの遺伝子発現を解析する。
ヒトアネロウイルス:多様で遍在するビロームの常在菌。FEMS Microbiol Rev. 2020;44:305-13. doi: 10.1093/femsre/fuaa007. [このような研究は、日本ではほとんど行われていない。
慢性ウイルス感染の再定義。Cell. 2009;138:30-50. doi: 10.1016/j.cell.2009.06.036. [PubMed] [CrossRef] [Google Scholar].
COVID-19患者の腸管サンプルのウイルス学的および組織学的評価。World J Gastroenterol. 2022年;28:6282-93. doi: 10.3748/wjg.v28.i44.6282. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Wölfel R, Corman VM, Guggemos W, et al. COVID-2019による入院患者のウイルス学的評価。Nature. doi: 10.1038/s41586-020-2196-x. [PubMed] [CrossRef] [Google Scholar].
下水道からの信号。科学。2022;375:1100-4. doi: 10.1126/science.adb1874. [PubMed] [CrossRef] [Google Scholar].
公衆衛生上の優先事項に取り組むために、確立された近隣レベルのオープンアクセス廃水モニタリングネットワークを活用する:集団ベースの研究。Lancet Microbe. 2023;4:e29-37. doi: 10.1016/S2666-5247(22)00289-0. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
廃水中のSARS-CoV-2 RNAの測定は地域社会の感染ダイナミクスを追跡する。Nat Biotechnol. doi: 10.1038/s41587-020-0684-z. [このような研究結果は、日本ではあまり知られていない。
2022年3月9日から10月11日にニューヨークで発生した麻痺性ポリオ症例から分離されたウイルスと遺伝的に関連する2型ポリオウイルスの排水検査と検出。MMWR Morb Mortal Wkly Rep. 2022;71:1418-24. doi: 10.15585/mmwr.mm7144e2. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Microbiome Research Reportsの記事はOAE Publishing Inc.の好意によりここに提供されています。
NCBIをフォローする
NLMとつながる
国立医学図書館
8600 Rockville Pike
ベセスダ, MD 20894
ウェブポリシー
情報公開
HHS脆弱性情報公開
ヘルプ
アクセシビリティ
採用情報
NLM
NIH
保健省
USA.gov
ご意見をお聞かせください!
© The Author(s) 2023.
PubMed免責事項
利益相反声明
著者はネスレリサーチ在職中に様々な抗体、プレバイオティクス、プロバイオティクス、ファージ介入研究に従事し、現在もネスレのウイルス学コンサルタントを務めている。著者はネスレの株式を保有していない。
図表
図1
図1 理論的フローの提案
図2
図2 理論的な流れの提案
図3
図3... を確立するためのポスチュレートの提案
参考文献
ヒトマイクロバイオームプロジェクトコンソーシアム。健康なヒトのマイクロバイオームの構造、機能、多様性。Nature. 2012;486:207-14. doi: 10.1038/nature11234. - DOI - PMC - PubMed
レイR.ヒトマイクロバイオーム:やるべきことがたくさん残っている。ネイチャー。2022;606:435。- DOI - PubMed
Brüssow H.腸内細菌叢異常症の概念の問題点。Microb Biotechnol。2020;13:423-34。- DOI - PMC - PubMed
ポパーKの推測と反論。科学的知識の成長。利用できる: https://books.google.com.hk/books/about/Conjectures_and_Refutations.html.... [最終アクセス日:24 Mar 2023].
Subramanian S、Huq S、Yatsunenko T、ら。 栄養不良のバングラデシュの子どもたちに持続的な腸内細菌叢の未熟さ。Nature. 2014;510:417-21。- DOI - PMC - PubMed
ヒトの健康な腸内細菌叢の発達と障害された腸内細菌叢の発達を記述する疎な共変量単位。Science. 2019;365:eaau4735. doi: 10.1126/science.aau4735. - DOI - PMC - PubMed
ヒトの腸内細菌叢の発達を阻害している。Science. 2019;365:eaau4732. doi: 10.1126/science.aau4732. - DOI - PMC - PubMed
チェンRY、モスタファI、ヒバードMC、ら、栄養不良の子供のための微生物指向の食品介入。栄養不良児に対する微生物学的介入。2021;384:1517-28. doi: 10.1056/nejmoa2023294. - DOI - PMC - PubMed
栄養不良児の腸内ビフィズス菌は離乳期に増殖する。Cell. 2022;185:4280-4297.e12.doi:10.1016/j.cell.2022.10.011. - DOI - PubMed
栄養不足の子供に対する微生物指向の食物介入。栄養不良児のための微生物学的食品介入。- DOI - PubMed
また、そのような栄養失調児を対象に、微生物学的手法を用いた栄養補助食品を開発した。Food Nutr Bull. 2018;39:116-26. doi: 10.1177/0379572117743929. - DOI - PubMed
Lenters LM、Wazny K、Webb P、Ahmed T、Bhutta ZA。中低所得環境における重度および中等度の急性栄養不良の治療:系統的レビュー、メタ分析およびデルファイ過程。BMC Public Health. 2013;13 Suppl 3:S23. doi: 10.1186/1471-2458-13-S3-S23. - DOI - PMC - PubMed
Sultana S, Sarker SA, Brüssow H. What happened to Koch's postulates in diarrhoea? Environ Microbiol. 2017;19:2926-34. doi: 10.1111/1462-2920.13787. - DOI - PubMed
健康とは何か?Microb Biotechnol。2013;6:341-8. doi: 10.1111/1751-7915.12063. - DOI - PMC - PubMed
ゴフE、シャイフH、マンジスAR。クロストリジウム・ディフィシル(Clostridium difficile)感染症の再発に対する腸内細菌叢移植(糞便細菌療法)の系統的レビュー。Clin Infect Dis. 2011;53:994-1002. doi: 10.1093/cid/cir632. - DOI - PubMed
再発性クロストリジウム・ディフィシル(Clostridium difficile)感染症患者における凍結便微生物叢移植と新鮮便微生物叢移植による下痢の臨床的消失:無作為化臨床試験。JAMA. 2016;315:142-9. doi: 10.1001/jama.2015.18098. - DOI - PubMed
Kelly CR, Khoruts A, Staley C, et al.多発性再発性クロストリジウム・ディフィシル感染症の再発に対する糞便微生物叢移植の効果:無作為化試験。Ann Intern Med. 2016;165:609-16. doi: 10.7326/M16-0271. - DOI - PMC - PubMed
クロストリジウム・ディフィシル感染症患者に対する無菌糞便濾液移植の有効性。Gastroenterology. 2017;152:799-811.e7. doi: 10.1053/j.gastro.2016.11.010. - DOI - PubMed
イヌ糞便微生物叢移植における重要成分のメカニズム。Vet Sci. 2022;9:695. doi: 10.3390/vetsci9120695. - DOI - PMC - PubMed
クロストリジウム・ディフィシル感染症における糞便微生物叢移植中のバクテリオファージ移行は治療成績と関連する。Gut. 2018;67:634-43... doi: 10.1136/gutjnl-2017-313952. - DOI - PMC - PubMed
腸球菌はclostridioides difficileの病原性を高める。Nature. 2022年;611:780-6. doi: 10.1038/s41586-022-05438-x. - DOI - PMC - PubMed
(1)偽膜性大腸炎を含むクロストリジウム・ディフィシル感染症、(2)偽膜性大腸炎を含むクロストリジウム・ディフィシル感染症。入手先:https://accessmedicine.mhmedical.com/content.aspx?bookid=2129§ionid=.... [最終アクセス:23 Mar 2023].
MoayyediのP、SuretteのMG、キムPT、らランダム化比較試験で活動性潰瘍性大腸炎患者の寛解を誘導する糞便微生物叢移植。Gastroenterology. 2015;149:102-109.e6. doi: 10.1053/j.gastro.2015.04.001. - DOI - PubMed
潰瘍性大腸炎患者に対する糞便移植のランダム化比較試験の結果。Gastroenterology. 2015;149:110-118.e4. doi: 10.1053/j.gastro.2015.03.045. - DOI - PubMed
Paramsothy S, Kamm MA, Kaakoush NO, et al.活動性潰瘍性大腸炎に対するマルチドナー集中糞便微生物移植:無作為化プラセボ対照試験。Lancet. 2017;389:1218-28. doi: 10.1016/S0140-6736(17)30182-4. - DOI - PubMed
Costello SP, Hughes PA, Waters O, et al.潰瘍性大腸炎患者の8週間寛解に対する糞便微生物叢移植の効果:無作為化臨床試験。JAMA. 2019;321:156-64. doi: 10.1001/jama.2018.20046. - DOI - PMC - PubMed
炎症性腸疾患における宿主-微生物叢相互作用。Nat Rev Immunol. 2020;20:411-26。doi: 10.1038/s41577-019-0268-7. - DOI - PubMed
クローン病に対する糞便微生物叢移植による腸内微生物の多様性の増加。Inflamm Bowel Dis. 2016;22:2182-90. doi: 10.1097/MIB.000000000893. - DOI - PMC - PubMed
アトピー性皮膚炎の微生物学。Environ Microbiol. 2016;18:2089-102. doi: 10.1111/1462-2920.13050. - DOI - PubMed
プロバイオティクスによる超早産児または超低出生体重児の壊死性腸炎の予防。Cochrane Database Syst Rev. 2020;10:CD005496... doi: 10.1002/14651858.CD005496.pub5. - DOI - PMC - PubMed
超早産児または超低出生体重児における壊死性腸炎予防のためのシンバイオティクス。Cochrane Database Syst Rev.2022;3:CD014067.doi:10.1002/14651858.CD014067.pub2。- DOI - PMC - PubMed
インド農村部における乳児の敗血症予防のためのシンバイオティクス無作為化試験。Nature. 2017;548:407-12. doi: 10.1038/nature23480. - DOI - PubMed
湿疹治療のためのプロバイオティクス。Cochrane Database Syst Rev. 2018;11:CD006135... doi: 10.1002/14651858.CD006135.pub3. - DOI - PMC - PubMed
乳幼児のアトピー性皮膚炎予防のために周産期に使用される乳酸菌:無作為化試験の系統的レビューとメタアナリシス。Am J Clin Dermatol. doi: 10.1007/s40257-022-00723-x. - DOI - PMC - PubMed
炎症性腸疾患における腸内ビロームの疾患特異的変化。Cell. 2015;160:447-60. doi: 10.1016/j.cell.2015.01.002. - DOI - PMC - PubMed
マレーシアの2つの先住民集団における腸内ビローム。日本人の腸内細菌叢を解析した。- DOI - PMC - PubMed
泌尿器系におけるバクテリオファージ(Bacteriophages of the lower urinary tract)。Nat Rev Urol. 2019;16:422-32. doi: 10.1038/s41585-019-0192-4. - DOI - PMC - PubMed
Zuo T, Lu XJ, Zhang Y, et al. 潰瘍性大腸炎における腸粘膜ビロームの変化。Gut. 2019;68:1169-79. doi: 10.1136/gutjnl-2018-318131. - DOI - PMC - PubMed
Gogokhia L, Buhrke K, Bell R, et al. バクテリオファージの拡大は腸の炎症と大腸炎の悪化に関連している。Cell Host Microbe. 2019;25:285-299.e8. doi: 10.1016/j.chom.2019.01.008. - DOI - PMC - PubMed
炎症性腸疾患におけるウイルスのダークマター(暗黒物質)に光を当てた全ゲノム解析。Cell Host Microbe. 2019;26:764-778.e5. doi: 10.1016/j.chom.2019.10.009. - DOI - PubMed
Moreno-Gallego JL, Chou SP, Di Rienzi SC, et al. Virome diversity correlates with intestinal microbiome diversity in adult monozygotic twins. Cell Host Microbe. 2019;25:261-272.e5. doi: 10.1016/j.chom.2019.01.019. - DOI - PMC - PubMed
ヒト糞便中のバクテリオファージの分布:健常人と内科疾患および白血病患者の連続調査。J Gen Virol. 1983;64:2039-43. doi: 10.1099/0022-1317-64-9-2039. - DOI - PubMed
バングラデシュの小児下痢便からの大腸菌バクテリオファージの分離。J Bacteriol. 2004;186:8287-94. doi: 10.1128/JB.186.24.8287-8294.2004. - DOI - PMC - PubMed
1歳児糞便中の病原性コリファージは温帯性コリファージより少ないが感染力は強い。Nat Commun. 2020;11:378. doi: 10.1038/s41467-019-14042-z. - DOI - PMC - PubMed
マウスが摂取した外来(M13)DNAは腸壁粘膜を介して末梢白血球、脾臓、肝臓に到達し、マウスのDNAと共有結合する。この論文では、M13のDNAは腸管壁粘膜を介して末梢白血球、脾臓、肝臓に到達し、マウスのDNAと共有結合できることを明らかにした。- DOI - PMC - PubMed
Bach MS, de Vries CR, Khosravi A, et al. 糸状バクテリオファージは偽モナス感染創傷の治癒を遅らせる。Cell Rep Med. 2022;3:100656。doi: 10.1016/j.xcrm.2022.100656. - DOI - PMC - PubMed
Sweere、Van Belleghem、Ishak、他 バクテリオファージは抗ウイルス免疫の引き金となり細菌感染のクリアランスを防ぐ。Science. 2019:363. doi: 10.1126/science.aat9691. - DOI - PMC - PubMed
メリルCR、ガイアーMR、ペトリッチアーニJC。ヒト細胞における細菌ウイルス遺伝子の発現。Nature. 1971;233:398-400. doi: 10.1038/233398a0.
コカイン中毒をウイルスで治療する。ウイルスによるコカイン中毒の治療。2004;101:10416-21。doi: 10.1073/pnas.0403795101. - DOI - PMC - PubMed
バクテリオファージとその免疫機構 バクテリオファージと免疫系。Annu Rev Virol. 2021;8:415-35。doi: 10.1146/annurev-virology-091919-074551. - DOI - PubMed
バクテリオファージのエンドサイトーシス。Curr Opin Virol. 2022年;52:229-35. doi: 10.1016/j.coviro.2021.12.009. - DOI - PubMed
粘液に付着したバクテリオファージは非宿主由来の免疫を提供する。日本学術振興会特別研究員(PD)・日本学術振興会特別研究員(PD)・日本学術振興会特別研究員(PD)・日本学術振興会特別研究員(PD)・日本学術振興会特別研究員(PD)。- DOI - PMC - PubMed
バクテリオファージが上皮細胞層を通過するメカニズムを明らかにした。- DOI - PMC - PubMed
免疫応答の調節因子としてのファージ:ファージ療法の実用的意義。この論文では、ファージが免疫応答の調節因子として働くことを明らかにした。- DOI - PubMed
ブリュッソーH, カンチャヤC, ハルトWD. ファージと細菌病原体の進化:ゲノム再編成から溶菌転換まで. 日本農芸化学会誌「日本農芸化学会誌」2004年1月号に掲載。- DOI - PMC - PubMed
プロファージゲノミクス。微生物分子生物学(Microbiol Mol Biol Rev.) 2003;67:238-76, 目次. - DOI - PMC - PubMed
原生生物とファージ間の細菌:捕食戦略から病原性の進化まで。日本微生物学会誌。2007;65:583-9. doi: 10.1111/j.1365-2958.2007.05826.x. - DOI - PubMed
ファージが抗生物質耐性を持つことは稀である。Phages rarely encode antibiotic resistance genes: a cautionary tale for virome analyses. ISME J. 2017;11:237-47. doi: 10.1038/ismej.2016.90. - DOI - PMC - PubMed
Moon、Jeon JH、Kang I、et al. 淡水ウイルスメタゲノームから、ファージが媒介する新規かつ機能的な抗生物質耐性遺伝子が明らかになった。Microbiome. 2020;8:75。doi: 10.1186/s40168-020-00863-4. - DOI - PMC - PubMed
食品小売店のビロームにおける抗生物質耐性遺伝子を持つファージ粒子の優位性。ISME J. 2023;17:195-203. doi: 10.1038/s41396-022-01338-0. - DOI - PMC - PubMed
(1)ゲノムが細胞内でどのように変化しているのか?Science. 2018;362:207-12. doi: 10.1126/science.aat5867. - DOI - PubMed
Fillol-Salom A, Bacigalupe R, Humphrey S, Chiang YN, Chen J, Penadés JR. サルモネラ菌ファージP22のライフサイクルに内在する側方トランスダクション。Nat Commun. 2021;12:6510。doi: 10.1038/s41467-021-26520-4. - DOI - PMC - PubMed
細菌ファージによる治療。抗微生物薬Chemmother。2001;45:649-59. doi: 10.1128/AAC.45.3.649-659.2001. - DOI - PMC - PubMed
日本における細菌性下痢症に対するコリファージ製剤の有効性を検討した。EBioMedicine. 2016;4:124-37. doi: 10.1016/j.ebiom.2015.12.023. - DOI - PMC - PubMed
前立腺の経尿道的切除を受けた患者における尿路感染症治療のための膀胱内バクテリオファージ:無作為化プラセボ対照二重盲検臨床試験。Lancet Infect Dis. 2021;21:427-36. doi: 10.1016/S1473-3099(20)30330-3. - DOI - PubMed
緑膿菌に感染した熱傷に対するバクテリオファージカクテルの有効性と忍容性:無作為化対照二重盲検第1/2相試験。Lancet Infect Dis. 2019;19:35-45. doi: 10.1016/S1473-3099(18)30482-1. - DOI - PubMed
Wright A, Hawkins CH, Anggård EE, Harper DR. 抗生物質耐性緑膿菌による慢性耳炎に対する治療用バクテリオファージ製剤の対照臨床試験。Clin Otolaryngol. 2009;34:349-57. doi: 10.1111/j.1749-4486.2009.01973.x. - DOI - PubMed
多剤耐性菌感染症に対するバクテリオファージ静注療法の米国単一施設における最初の連続10症例から得られた教訓。Open Forum Infect Dis. 2020;7:ofaa389。doi: 10.1093/ofid/ofaa389. - DOI - PMC - PubMed
マイコバクテリウム感染症のファージ療法:薬剤耐性マイコバクテリウム症患者20例におけるファージの思いやりのある使用。Clin Infect Dis. 2023;76:103-12. doi: 10.1093/cid/ciac453. - DOI - PMC - PubMed
このような背景のもと、日本臨床腫瘍学会は、日本臨床腫瘍学会総会(東京)、日本臨床腫瘍学会学術集会(東京)、日本臨床腫瘍学会総会(東京)、日本臨床腫瘍学会学術集会(東京)、日本臨床腫瘍学会学術集会(東京)、日本臨床腫瘍学会学術集会(東京)、日本臨床腫瘍学会学術集会(東京)、日本臨床腫瘍学会学術集会(東京)を開催した。Clin Infect Dis. 2023;76:e1463-6. doi: 10.1093/cid/ciac694. - DOI - PubMed
Fabijan A, Lin RCY, Ho J, Maddocks S, Ben Zakour NL, Iredell JR; Westmead bacteriophage therapy team.重症黄色ブドウ球菌感染症におけるバクテリオファージ療法の安全性。Nat Microbiol. 2020;5:465-72. doi: 10.1038/s41564-019-0634-z. - DOI - PubMed
パンドラッグ耐性のKlebsiella pneumoniaeによる骨折関連感染症に対する前適応バクテリオファージ療法と抗生物質の併用療法。Nat Commun. 2022;13:302. doi: 10.1038/s41467-021-27656-z. - DOI - PMC - PubMed
播種性薬剤耐性膿瘍性マイコバクテリウム患者の治療における工学的バクテリオファージ。Nat Med. 2019;25:730-3. doi: 10.1038/s41591-019-0437-z. - DOI - PMC - PubMed
Friman VP, Soanes-Brown D, Sierocinski P, et al. 寄生虫ファージを病原体に事前適応させることで、緑膿菌嚢胞性線維症菌分離株で病原体クリアランスが増加し、耐性進化が低下する。J Evol Biol. 2016;29:188-98. doi: 10.1111/jeb.12774. - DOI - PubMed
(注1)この論文では、「細菌感染症におけるバクテリオファージ(バクテリオファージ)の発現を制御する方法」について研究している。バクテリオファージの宿主範囲をリプログラミングする:受容体結合タンパク質を工学的に設計するための設計原理と戦略。Curr Opin Biotechnol. 2021;68:272-81. doi: 10.1016/j.copbio.2021.02.006. - DOI - PMC - PubMed
腸内炎症治療のためのファージコンソーシアによるヒトIBD関連腸内細菌叢常在菌の標的化抑制。Cell. 2022;185:2879-2898.e24. doi: 10.1016/j.cell.2022.07.003. - DOI - PubMed
腸内細菌の異所性コロニー形成はT(H)1細胞の誘導と炎症を促進する。Science. 2017;358:359-65. doi: 10.1126/science.aan4526. - DOI - PMC - PubMed
ウイルスカクテルが腸の炎症を鎮める。ネイチャー。2022;612:220-1。- DOI - PubMed
CRISPRは原核生物にウイルスに対する獲得耐性を与える。Science. 2007;315:1709-12. doi: 10.1126/science.1138140. - DOI - PubMed
原核生物におけるCRISPRの有用性を示す。Cell. 2022年;185:4574-4586.e16. doi: 10.1016/j.cell.2022.10.020. - DOI - PubMed
ウイルスがTIR gcADPRシグナルを阻害して細菌防御を克服する。Nature. 2022年;611:326-31. doi: 10.1038/s41586-022-05375-9. - DOI - PubMed
哺乳類とその保護機構の解明を目的とした、哺乳類とその保護機構の解明を目的とした、哺乳類とその保護機構の解明を目的とした、哺乳類とその保護機構の解明。Nature. 2020;583:578-84。DOI: 10.1038/s41586-020-2486-3. - DOI - PMC - PubMed
蝙蝠の適応進化を明らかにする。日本学術振興会特別研究員。2020:9。doi: 10.7554/eLife.51971. - DOI - PMC - PubMed
ヒトアネロウイルス:多様で遍在する常在ウイルス。その結果、アネロウイルスの感染経路が明らかになった。- DOI - PMC - PubMed
慢性ウイルス感染の再定義。Cell. 2009;138:30-50. doi: 10.1016/j.cell.2009.06.036. - DOI - PubMed
COVID-19患者における腸管サンプルのウイルス学的および組織学的評価。World J Gastroenterol. 2022年;28:6282-93. doi: 10.3748/wjg.v28.i44.6282. - DOI - PMC - PubMed
COVID-2019による入院患者のウイルス学的評価。Nature. 2020;581:465-9. doi: 10.1038/s41586-020-2196-x. - DOI - PubMed
フォーゲルG下水道からの信号。科学。2022;375:1100-4. doi: 10.1126/science.adb1874. - DOI - PubMed
Lancet Microbe. 2023;4:e29-37. doi: 10.1016/S2666-5247(22)00289-0. - DOI - PMC - PubMed
SARS-CoV-2のRNAを廃水中に測定し、地域社会の感染動態を追跡した。Nat Biotechnol. 2020;38:1164-7. doi: 10.1038/s41587-020-0684-z. - DOI - PMC - PubMed
2022年3月9日~10月11日にニューヨークで発生した麻痺性ポリオ症例から分離されたウイルスと遺伝的に関連する2型ポリオウイルスの排水検査と検出。MMWR Morb Mortal Wkly Rep. 2022;71:1418-24. doi: 10.15585/mmwr.mm7144e2. - DOI - PMC - PubMed
NCBI文献リソース
MeSH PMC Bookshelf 免責事項
PubMedワードマークおよびPubMedロゴは米国保健社会福祉省(HHS)の登録商標です。これらのマークの無断使用は固く禁じられています。
NCBIをフォローする
NLMとつながる
国立医学図書館
8600 Rockville Pike
ベセスダ、メリーランド州20894
ウェブポリシー
情報公開
HHS脆弱性情報公開
ヘルプ
アクセシビリティ
採用情報
NLM
NIH
保健省
USA.gov
