
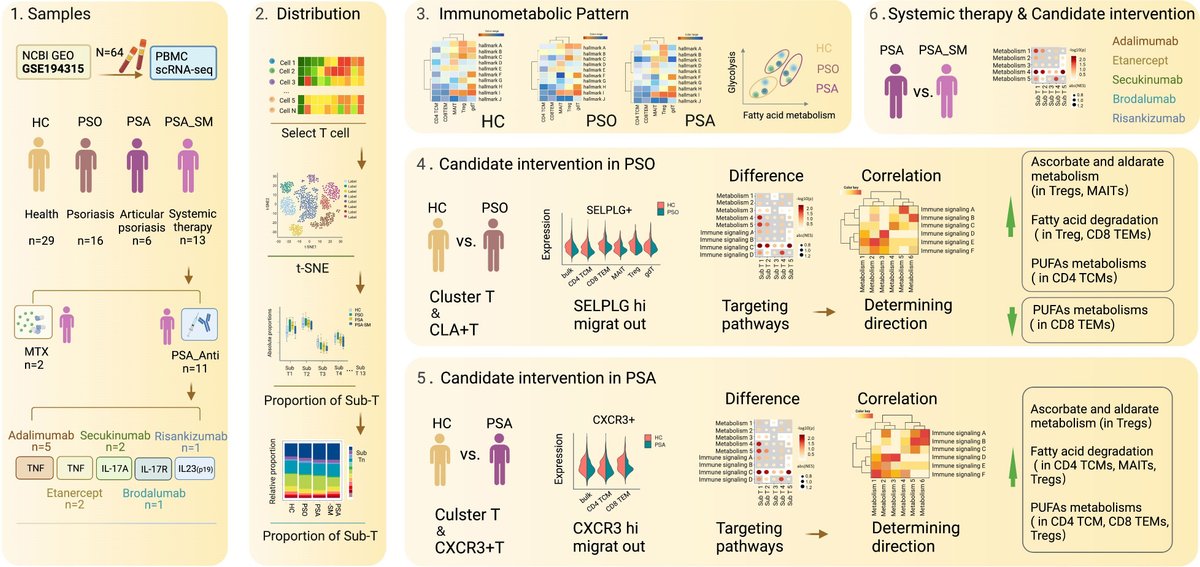
免疫代謝のシングルセル・トランスクリプトーム・ランドスケープから、健常対照、乾癬および関節症性乾癬におけるT細胞サブセットのアスコルビン酸およびアルダル酸代謝、脂肪酸分解およびPUFA代謝の介入候補が明らかになった。
63総閲覧数
11ダウンロード
記事のインパクトを見る
オリジナル研究論文
Front. 免疫学、2023年7月10日
栄養免疫学
第14巻-2023年|https://doi.org/10.3389/fimmu.2023.1179877
この論文は次の研究テーマの一部です
運動、栄養、薬理学的治療に応用される免疫代謝学
すべての論文を見る
免疫代謝のシングルセル・トランスクリプトーム・ランドスケープから、健常対照、乾癬および関節症性乾癬におけるT細胞サブセットのアスコルビン酸およびアルダル酸代謝、脂肪酸分解およびPUFA代謝の介入候補が明らかになった。
Lu Peng1、Ling Chen2、Jianji Wan1、Wenqi Liu1、Shuang Lou1、Zhu Shen1*:1
1広東省人民病院皮膚科、広東省南方医科大学、広州、中国
2陸軍医科大学大坪病院皮膚科、重慶、中国
はじめに 免疫代謝経路の調節は、免疫介在性疾患の有望な治療標的として浮上している。しかし、乾癬性疾患の免疫代謝的特徴や、その病態に関与するさまざまなT細胞サブセットにおける免疫代謝的介入の潜在的標的は、依然として不明である。
方法 本研究では、健常対照(HC)、乾癬(PSO)、関節症性乾癬(PSA)患者の循環血液単細胞データを解析し、T細胞サブセットの代謝的特徴を明らかにした: CD4+中心記憶T細胞(TCM)、CD8+有効記憶T細胞(TEM)、制御性T細胞(Treg)、粘膜関連不変T細胞(MAIT)、γδT細胞である。代謝経路と炎症経路の関連性を調べるために、ピアソン検定を行った。これらの結果に基づき、生物学的治療を受けていないPSA患者と受けたPSA患者の免疫代謝の違いを比較することで、生物学的抗体が代謝経路の違いに及ぼす潜在的影響についても分析した。
結果 その結果、アスコルビン酸代謝およびアルダル酸代謝のアップレギュレーション、ならびに脂肪酸分解が、Tregの免疫抑制を増強する可能性が示唆された。α-リノレン酸、リノール酸、アラキドン酸の代謝亢進は、PSOおよびPSAにおけるCD4+ TCMおよびCD8+ TEMの炎症促進機能を抑制し、PSAにおけるTregの免疫抑制を保護する可能性がある。我々は、アスコルビン酸と脂肪酸の代謝経路をサポートすることが、アダリムマブとエタネルセプト療法との補助的なリプログラミング戦略である可能性を提唱する。
考察 これらの知見は、乾癬性疾患の免疫代謝の特徴に関する洞察を提供するだけでなく、乾癬の補助的治療に対する予備的選択肢を提供するものである。
図解抄録
グラフ抄録 データソース、サンプルのグループ分け、データ解析手順を図式化したもの。
1 はじめに
免疫代謝は、生合成・異化やATP産生のプロセスであるだけでなく、その代謝物が免疫シグナル分子として作用することもある。これらのシグナル分子は、遺伝子の転写や転写後の制御を再プログラムすることで、免疫細胞の機能や分化に直接的または間接的に影響を与えることができる(1, 2)。免疫代謝のリプログラミングは、免疫細胞の生理・病態の中心となる主要なメカニズムの一つとして浮上してきた(1)。異なる状態/機能を持つ免疫細胞サブセットは、生存と機能を維持するために、それぞれ異なる代謝経路を利用していることが示されている。例えば、活性化T細胞と休止期記憶T細胞は、それぞれ主にグルコースの異化と脂肪酸の分解に依存している。
記憶T細胞は自然免疫と獲得免疫の橋渡しをし、生理的条件下では病原性のチャレンジに迅速かつ強力に反応する。しかし、病的な、あるいは制御されていない条件下では、乾癬を含む慢性炎症性疾患の再発に記憶T細胞が関与していることを支持する十分な証拠がある(3)。記憶T細胞は、その機能的特性、増殖能、遊走能によって、中枢性記憶T細胞(TCM)、有効記憶T細胞(TEM)、組織常在記憶T細胞(TRM)といういくつかのサブセットから構成されている。TCMは、細胞内で合成された脂肪酸を使って脂肪酸酸化と酸化的リン酸化をサポートすることが証明されている(4)。静止状態のTEMは脂肪酸を代謝する傾向があるが、機能変換の要求を満たすために活性化されると解糖が開始される(5)。TRMは、その寿命と機能を維持するために、末梢組織(例えば皮膚)に豊富に存在する細胞外脂肪酸の取り込みを促進する(6)。一方、免疫寛容の維持に重要な役割を果たす制御性T細胞(Treg)では、フォークヘッドボックスタンパク質P3(FoxP3)転写因子が、電子呼吸複合体のミトコンドリア成分を増強することにより、酸化的リン酸化と脂肪酸酸化を促進することが示されている(7)。エフェクターT細胞に比べて、Tregは解糖への依存度が低い。このことから、免疫代謝への標的介入が、炎症反応を操作する重要な手段になると期待される。しかし、(乾癬など)さまざまな免疫細胞サブセットの疾患内在性の免疫代謝再プログラミング特性は、まだ十分に理解されていない。
乾癬は、免疫介在性の慢性、再発性の炎症性疾患であり、個人とその家族に身体的、心理的負担をもたらす(8)。乾癬の発症には、TCM、TEM、TRM、Treg、γδT細胞、粘膜関連不変T細胞(MAIT)などの免疫T細胞サブセットの機能不全が関与している(9)。TNF-α、IL-12、IL-17、IL-23に対する生物学的抗体による免疫標的療法は、乾癬の開発に革命をもたらした(8)。しかし、乾癬の免疫代謝特性やリプログラミング介入の標的は、まだ十分に理解されていない。免疫代謝に対する生物学的抗体の効果もまだ不明である。
本研究では、健常対照(HC)、乾癬(PSO)、乾癬性関節炎(PSA)患者の循環T細胞亜集団における免疫代謝のトランスクリプトーム・ランドスケープを提示し(図版要旨)、それらの免疫代謝リプログラミング特性を明らかにした。T細胞サブセット間の免疫代謝の違いと、免疫および代謝経路との関連を解明することにより、アスコルビン酸およびアルダル酸代謝と脂肪酸分解をアップレギュレートすることが、PSOおよびPSAにおけるTregの免疫抑制を増強する可能性を示した。α-リノレン酸、リノール酸、アラキドン酸の代謝を促進することは、PSOとPSAにおけるCD4+ TCMとCD8+ TEMの炎症促進機能を抑制し、PSAにおけるTregの免疫抑制を保護し、疾患の炎症抑制に有益である可能性がある。さらに、生物学的製剤による治療を受けている患者と治療を受けていない患者の免疫代謝を比較することで、アスコルビン酸代謝経路と脂肪酸代謝経路を強化することが、アダリムマブとエタネルセプトによる乾癬治療を支援する友好的なリプログラミング戦略として役立つ可能性があることを提案する。
2 材料と方法
2.1 データソース
末梢血単核球(PBMC)のSingle cell RNA sequencing(scRNA-seq)データは、National Center for Biotechnology Information(NCBI)のGEOリポジトリからダウンロードした(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi, GSE194315)。29名の健常対照者(HC)、16名の全身投薬を受けていない皮膚乾癬患者(PSO)、6名の全身投薬を受けていない関節症性乾癬患者(PSA)、13名の全身投薬を受けている関節症性乾癬患者(PSA_SM)を含む、選択された64名の被験者のデータに基づいて、以降のすべての解析を行った。使用された薬剤の違いにより、PSA_SM群はメトトレキサート(MTX)投与群2名、標的生物学的抗体投与群(PSA_Anti)11名で構成された(Secukinumab 2名、Adalimumab 5名、Brodalumab 1名、Risankizumab 1名、Etanercept 2名)。
2.2 データ処理
得られたscRNA-seq Matrix Fileは、品質管理と細胞タイプのアノテーションのために処理された。正確な手順と基準は発表論文に記載されている(10, 11)。各サブセットの可視化とマーカー遺伝子は、Seurat(バージョン3.1.1)を用いて行った(12)。マーカー遺伝子は閾値パラメーターで同定した: 1. 2.P値≦0.01;3.Log2FC≧0.36。2群間の差の解析は、両側Wilcoxon順位和検定で評価し、P値<0.05を統計的に有意とみなした。
2.3 サブフラクションの定義
SELPLG遺伝子(皮膚リンパ球関連抗原CLAタンパク質をコード)を発現していない/しているPSOのT細胞をCLA-/CLA+と定義し、CLA-サブ分画と皮膚ホーミングCLA+サブ分画に分けた。CXCR3遺伝子を発現していない/しているPSAのT細胞をCXCR3-/+と定義し、CXCR3-サブ分画と共同走化性CXCR3+サブ分画に分けた。
2.4 機能的濃縮
遺伝子セットバリエーション解析(GSVA)は、GSVA Rパッケージ(13)と、50の共通シグナル伝達経路を持つMsigDBの最新HALLMARKパスウェイデータセット(14)を用いて行った。遺伝子セット濃縮解析(GSEA)は、ソフトウェアGSEAとKEGGの遺伝子セットを用いて行い、遺伝子セットが2群間で有意差を示すかどうかを同定した。簡単に説明すると、遺伝子発現行列を入力し、SignaltoNoise正規化法(15)によって遺伝子をランク付けした。エンリッチメントスコアとp値はデフォルトパラメータで計算した。
2.5 免疫代謝連鎖
KEGG 遺伝子セットの遺伝子シグネチャーのスコアは Seurat (version 3.1.1) の AddModuleScore 関数で計算した (12)。代謝パスウェイの遺伝子セットスコアと免疫パスウェイの遺伝子セットスコア間の関連性を調べるためにピアソン検定を行った。
2.6 データ利用声明
本論文の基礎となるデータは、米国国立生物工学情報センター(NCBI)の GEO リポジトリ(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi, GSE:194315)から入手した(10)。本研究で得られたデータは、対応する著者への合理的な要求があれば共有される。
3 結果
3.1 HC、PSO、PSA、PSA_SMにおけるT細胞サブセットの分布
我々の調査では、処理されたデータマトリックスから91,670個のT細胞が解析のために得られ、さらに13のサブセットに分類された: CD4+ TCM(27.62%)、CD4+ TEM(5.43%)、CD8+ TCM(1.37%)、CD8+ TEM(21.46%)、γδT細胞(4.19%)、粘膜関連不変T細胞(MAIT、2.39%)、Treg(3. 51%)、CD4+ Naïve(21.78%)、CD8+ Naïve(9.05%)、CD4+ CTL(2.87%)、CD4+ Proliferating(0.05%)、CD8+ Proliferating(0.04%)、dnT(0.23%)であった(図1A;補足図1)。CD4+TCMとCD8+TEMには特に注意が払われ、循環血液中のメモリー比率が最も高いことが分かった。また、Tregと2つの自然免疫細胞集団、γδT細胞とMAIT(HCより少ない、図1B、C)にも注目した。
図1
図1 HC、PSO、PSA、PSA_SM群におけるT細胞サブセットの可視化と割合。(A) tSNEはT細胞サブセットの次元縮小を示す。(B、C)HC、PSO、PSA、PSA_SM群におけるT細胞サブセットの割合分布。(D)特定の全身投薬群におけるT細胞サブセットの分画分布。
PSA_SMとPSAを比較すると(図1B、C)、PSA_SMではCD8+ TEMの割合が最も明らかに減少した(減少率37.01%)。PSA_SMでは、γδT細胞が69.13%、MAITが62.58%増加した。PSA_SMのほとんどの全身治療で一貫した傾向がみられた: CD8+TEMの抑制とγδT細胞の拡大である(図1C、D)。具体的には、ブロダルマブはCD4+ TCMの有意な抑制を示した;エタネルセプトではTregの明らかな増加が、MTX、アダリムマブ、セクキヌマブではMAITの増加が観察された。アダリムマブ投与後の頻度パターンは、HCの頻度に最も近かった(図1C、D)。
3.2 HC、PSO、PSAにおけるT細胞サブセットの免疫代謝パターン
GSVA(HALLMARK)解析(図2A-C)により、MAITおよびγδT細胞は、PI3K/Akt/mTORシグナル伝達、解糖、脂肪酸代謝、および酸化的リン酸化に富み、疾患の状態とは無関係に代謝的に活性であることが分かった。対照的に、CD4+ TCMはナイーブのように代謝不活性で、上記の経路は明らかにサイレンシングされていた。CD8+ TEMは、PSOでは不活性であり(図2B)、PSAでは脂肪酸代謝優先であった(図2C)。HCと比較して、PSO Tregでは解糖と脂肪酸代謝が活発であった(図2A、B)。PSAトレグでは解糖が優先された(図2A、C)。CD4+TCMのナイーブな代謝不活性とCD8+TEMの脂肪酸代謝の優先性は、サイクリン関連経路の阻害に対応しており、TCMの方が長寿とリコール拡大の可能性が高く、次いでTEMであるという発表結果(16)と一致していた。CD4+ TCMの脂肪酸代謝と解糖は、同じ状態の他のサブセットと比較して不活性なベースラインであったが、PSOとPSAの両方において、そのベースラインはHCよりも高かった(図2D)。
図2
図2 HC(A)、PSO(B)、PSA(C)におけるT細胞クラスターの免疫代謝パターンに関するGSVA(HALLMARK)解析。(D)GSVAスコアに基づき、HC群、PSO群、PSA群のT細胞サブセット間で行われた脂肪酸代謝および解糖系遺伝子セットのパターン。
3.3 PSOにおける免疫代謝の介入候補
3.3.1 PSOとHCの免疫代謝の違い
SELPLG遺伝子にコードされるCLAは、陽性メモリーT細胞が乾癬性病変に多数分布しており、CLAは皮膚病変への細胞走化性を媒介する分子基盤であることが知られている(17, 18)。PSOの免疫代謝リプログラミングの理想的な代謝介入を探るため、Cluster_T細胞と皮膚ホーミングサブフラクションCLA+T細胞のレベルで解析を行い、CD4+TCM、CD8+TEM、Treg、MAIT、γδT細胞のサブセットに焦点を当てた。
着目したサブセットの約4分の1がSELPLG遺伝子を発現し(図3A)、具体的には、PSOではCD4+ TCMの27.1%、CD8+ TEMの24.71%、Tregの28.33%、MAITの26.1%、γδT細胞の24.16%であった。その中で、CLA+CD4+TEMは27.14%、CLA+CD8+TEMは25.79%とCLA+サブフラクションで優勢であった(図3B)。遺伝子SELPLGは、PSOの各集中サブセットで弱い発現ピークを示したのみであり(図3C)、これはHCの2つの発現ピークとは異なっていた。上のピークがないことから、SELPLGが高発現しているCLA+T細胞の一部は、おそらくPSOの末梢皮膚病変に移動していることが示唆された。その後、PSOにおけるCLA+サブ分画の免疫シグナルと代謝経路は、CLA-サブ分画のそれよりも一般的に活発であることが観察された(補足図2)。
図3
図3 PSOのT細胞サブセットにおける免疫代謝経路の決定。(A, B)CLA+およびCLA-サブフラクションの割合と数。(C)SELPLGの遺伝子発現値は、PSOの各集中サブセットにおいて弱い発現ピークのみを示した。(D)GSEAによるPSOとHCのサブセットのClusterとCLA+のレベルでの代謝の違い。灰色の背景は負の正規化濃縮スコア(NES)を示し、明るい背景は正のNESを示す。NESは遺伝子セットの発現低下(負のNES)または発現上昇(正のNES)の程度を反映する。ドットの面積はNESの絶対値に対応する。ドットの色はP値に対応する。(E)GSEAは、PSOのTregにおけるアスコルビン酸とアルダル酸代謝の明らかな増加を示した。PSOのCD4+ TCM(F)、CD8+ TEM(G)、およびTreg(H)におけるα-リノレン酸代謝、リノール酸代謝、アラキドン酸代謝、アスコルビン酸およびアルダル酸代謝、または脂肪酸分解の代謝経路と免疫事象との間の免疫代謝的関連性をClusterレベルで示した。
PSOとHCの間のサブセットの免疫代謝GSEAは、Cluster_T細胞とCLA+T細胞の両方のレベルで行われた(図3D)。明らかに、PSOの各集中サブセットにおいて、イノシトールリン酸代謝のダウンレギュレーションと酸化的リン酸化のアップレギュレーションが、両方のレベルで観察された。どちらのレベルのCD4+ TCMも、α-リノレン酸、リノール酸、アラキドン酸代謝において抑制された活性を示した。CLA+CD8+ TEMは、3つの主要な多価不飽和脂肪酸(PUFA)の代謝が上昇傾向を示し、脂肪酸分解は抑制傾向を示した。TregとMAITは、両レベルでアスコルビン酸代謝とアルダル酸代謝が明らかに増加し、特にクラスタートレグで顕著であった(中核濃縮遺伝子ALDH2、ALDH7A1、UGDH、ALDH1B1で強調表示)(図3D、E)。クラスターTregは脂肪酸分解が亢進していた。両レベルのγδT細胞はα-リノレン酸の減少を示し、CLA+γδT細胞はアラキドン酸代謝の減少を示した。
3.3.2 PSOにおける免疫代謝連関
上記の差分傾向だけでは、観察された代謝の変化が、疾患のストレス反応による防御効果なのか、疾患属性による付随的な結果なのかを判断することは難しい。候補経路の介入方向をさらに特定するために、PSOのT細胞サブセットにおける候補代謝経路と複数の免疫シグナル伝達経路との関連を解析した(図3F-H;補足図3、4)。
酸化的リン酸化とイノシトールリン酸代謝は、介入に理想的な代謝経路ではなかったが、PSOのT細胞サブセットにおける酸化的リン酸化は、IL-17とTNFシグナル伝達経路と逆相関していることがわかった(補足図3)。しかしながら、酸化的リン酸化は、CD4+ TCMおよびCD8+ TEMの細胞接着分子および白血球の経内皮移動と正の相関があった。PSOの酸化的リン酸化を活性化することは、IL-17やTNFの分泌ではなく、細胞接着や遊走の機能を維持するために有益であることが示唆された。CD4+TCMとCD8+TEMにおけるイノシトールリン酸代謝は、mTOR、ケモカイン、JAK-STATシグナル伝達経路と正の相関を示したが、この相関はTregでは相対的に低下した。
PSOにおける候補代謝経路のうち、リノール酸代謝はAMPKおよびPI3-Aktシグナル伝達経路と負の相関を示し、アラキドン酸代謝はTNF、MAPK、JakおよびAMPKシグナル伝達経路と負の相関を示し、α-リノレン酸代謝はCD4+ TCMの両レベルにおいてIL-17、TNF、Jak、PI3-AktおよびNOD様受容体シグナル伝達経路と負の相関を示した(図3F;補足図4A)。3つの主要なPUFAの代謝は、CD8+ TEMの両レベルにおいて、Rasシグナル伝達経路、細胞接着分子、白血球経内皮移動、cAMPおよびケモカインシグナル伝達経路と正の関連を示した(図3G;補足図4B)。さらに、CLA+CD8+TEMでは、アラキドン酸代謝がNF-κBシグナル伝達経路と正の相関を示し、Cluster CD8+ TEMおよびCLA+CD8+ TEMでは、脂肪酸分解が炎症性IL-17およびTNFシグナル伝達経路と負の相関を示した。示されたように、主要なPUFA代謝経路を強化することは、CD4+TCMの炎症性シグナルを抑制する可能性がある。逆に、CD8+ TEMの炎症性シグナル伝達経路の活性化、細胞接着、細胞毒性を増加させる危険性があった。脂肪酸分解のアップレギュレーションは、CD8+ TEMの炎症性経路を抑制する可能性がある。
Tregでは(図3H;補足図4C)、アスコルビン酸およびアルダル酸代謝がIL-17、PIK-3、Jakシグナル伝達経路と負の相関を示し、TGF、HIF-1シグナル伝達経路と正の相関を示すことが観察された。脂肪酸分解は、IL-17、MAPKシグナル伝達経路と負の連関を示し、細胞接着と遊走とは両方のレベルで正の連関を示した。CLA+Tregsのサブ分画では、アスコルビン酸代謝とアルダル酸代謝が、NF-kb、TGF、HIF-1シグナル伝達経路、細胞接着分子、白血球の経内皮移動と強い関連を示した。脂肪酸分解は、細胞接着分子および白血球の経内皮移動により強い関連を示し、mTORシグナル伝達経路とはさらに負の関連を示した。したがって、アスコルビン酸およびアルダル酸代謝と脂肪酸分解を強化することは、Tregの炎症性極性化/可塑性を抑制するだけでなく、免疫抑制機能を安定化させ、細胞接着と遊走を促進することが期待される。
クラスターMAITでは、アスコルビン酸およびアルダル酸代謝が、mTOR、TGF-β、AMPKおよびcGMPシグナル伝達経路と正の相関を示し、IL-17およびJakシグナル伝達経路と負の相関を示すことが示された(補足図4D、E)。対照的に、CLA+MAITでは、アスコルビン酸およびアルダル酸代謝は、IL-17およびTNFシグナル伝達経路、Th17およびTh1/Th2細胞分化と正の相関を示した。HIF-1シグナル伝達経路との関連は陽性から陰性に変化した。したがって、クラスターMAITにおけるアスコルビン酸代謝とアルダル酸代謝のアップレギュレーションは、MAITの免疫抑制機能を高め、接着と遊走を促進すると予想されるが、この介入はCLA+MAITではIL-17関連機能を促進するかもしれない。
γδT細胞では(補足図4F、G)、アラキドン酸代謝と脂肪酸分解は、IL-17とTNFシグナル伝達経路と両レベルで負の相関を示した。α-リノレン酸代謝は、クラスターγδT細胞ではTNF、Jak、AMPKシグナル伝達経路、細胞接着分子と負の相関を示したが、CLA+γδT細胞ではIL-17シグナル伝達経路と正の相関を示した。これらのことから、アラキドン酸代謝と脂肪酸分解のアップレギュレーションは、γδT細胞の炎症性シグナル伝達を弱める可能性がある。
結論として、PSOにおけるT細胞サブセットの免疫代謝学的連関と免疫代謝学的差異の解析を組み合わせると、アスコルビン酸代謝とアルダル酸代謝の亢進は、TregとCluster MAITの免疫抑制集団を安定化させる可能性があると推測される。脂肪酸分解のアップレギュレーションは、これらの免疫抑制機能を安定化させ、Tregの接着と移動を促進し、CD8+ TEMの炎症シグナルを抑制する可能性がある。三大PUFAの代謝促進は、CD4+ TCMの炎症性シグナル伝達と遊走を弱める可能性がある。対照的に、PUFAの代謝阻害は、CD8+ TEMの細胞接着と細胞毒性に有害であった。これらの推測を検証するためには、さらなる実験が必要である。
3.4 PSAにおける免疫代謝の介入候補
3.4.1 PSAとHCの免疫代謝の違い
C-X-Cモチーフケモカインレセプター3(CXCR3)は滑膜CD8+T細胞で有意に発現が上昇していることが確認されている。そのリガンドであるCXCL10は、乾癬患者におけるPSAの予測バイオマーカーと考えられている(9, 19)。具体的には、PSAではCD4+ TCMの6.13%、CD8+ TEMの6.85%、Tregの4.24%、MAITの2.98%、およびγδT細胞の6.42%がCXCR3遺伝子を発現していた(図4A, B)。PSOのCLA+サブ分画と同様に、CXCR3遺伝子の発現値は、PSAでは低い発現ピークしか示さなかった(図4C)。これは、2つの発現ピークを示したHCのそれとは明らかに異なっていた。PSAのCXCR3-サブ分画と比較すると、CXCR3+CD4+ TCMは比較的活発な免疫代謝状態であった(アスコルビン酸代謝とアルダル酸代謝の顕著な抑制を除く)。CXCR3+CD8+ TEMは比較的不活性な代謝状態であり、HIF-1シグナル伝達と解糖/糖新生経路は比較的活発であった(補足図5A, B)。
図4
図4 PSAのT細胞における免疫代謝経路の決定。(A, B)CXCR3+およびCXCR3-サブ分画の割合と数。(C)CXCR3の遺伝子発現値は、PSAの各集中サブセットにおいて高発現ピークの消失を示した。(D)GSEAによるPSAとHCの集束サブセットのClusterおよびCXCR3+レベルの代謝的差異景観。灰色の背景は負の正規化濃縮スコア(NES)を示し、明るい背景は正のNESを示す。NESは遺伝子セットがダウンレギュレート(負のNES)またはアップレギュレート(正のNES)される程度を反映する。ドットの面積はNESの絶対値に対応する。ドットの色はP値に対応する。(E)GSEAは、PSAのTregにおけるアスコルビン酸およびアルダル酸代謝の明らかな増加を示した。PSAのCD4+ TCM(F)、CD8+ TEM(G)、Treg(H)におけるα-リノレン酸代謝、リノール酸代謝、アラキドン酸代謝、アスコルビン酸およびアルダル酸代謝、または脂肪酸分解の代謝経路と免疫イベントとの間の免疫代謝的関連性をClusterレベルで示した。
PSAとHCの間で焦点を当てたサブセットの免疫代謝GSEAは、Cluster_T細胞とCXCR3+T細胞の両方のレベルで行われた(図4D;補足図5C)。PSAでは、各集中サブセットおよびサブ分画において酸化的リン酸化がアップレギュレートされた。クラスターCD4+TCMとクラスターMAITは、α-リノレン酸代謝とリノール酸代謝の減少、アラキドン酸代謝と脂肪酸分解の増加を示した。CXCR3+CD4+ TCMのアラキドン酸代謝は抑制された。クラスターCD8+ TEMは、α-リノレン酸代謝とリノール酸代謝の抑制、アラキドン酸代謝の亢進を示した。CXCR3+CD8+ TEMは、3種類のPUFAの代謝と脂肪酸分解の増加を示した。クラスター・トレグでは、アスコルビン酸代謝およびアルダル酸代謝(中核濃縮遺伝子ALDH2、UGDH、AKR1A1)の極めて明らかな活性化(図4D、E)、脂肪酸分解、α-リノレン酸代謝、リノール酸代謝のアップレギュレーションが観察された。クラスターγδT細胞は、アラキドン酸代謝と脂肪酸分解のアップレギュレーションを示した。
3.4.2 PSAにおける免疫代謝連関
候補代謝経路の介入方向をさらに特定するため、PSAにおけるこれらの代謝経路と免疫シグナル伝達経路との関連を解析した(図4F-H;補足図6、7)。その結果、PSAの注目したサブセットおよびサブ分画において、酸化的リン酸化はIL-17、TNF、Jakシグナル伝達経路と負の相関を示し、細胞接着分子および白血球経内皮移動と正の相関を示した(補足図6)。
CXCR3+CD4+TCM(補足図7A)では、α-リノレン酸とリノール酸代謝はTh17細胞分化およびIL-17シグナル伝達経路と負の相関を示し、アラキドン酸代謝はTNFシグナル伝達経路およびTh17細胞分化と逆の相関を示した。クラスターCD4+ TCMでは、3種のPUFAの代謝と上記の免疫シグナル伝達経路との間に、より弱い負の連関が観察された(図4F)。脂肪酸分解は、クラスター・レベルではIL-17、TNFシグナル伝達経路およびTh17細胞分化と負の相関を示した。この関連は、CXCR3+CD4+ TCMsサブ分画で強化され、さらに細胞接着および遊走経路との負の関連が示された。まとめると、脂肪酸分解とPUFA代謝のアップレギュレーションは、CD4+TCMにおける炎症因子IL-17とTNFの産生を阻止する理想的な介入であろう。
クラスターCD8+ TEM(図4G)では、α-リノレン酸とリノール酸の代謝は、IL17、Jak、TNFシグナル伝達経路と負の相関を示し、Rasシグナル伝達経路、細胞接着分子、白血球経内皮移動と正の相関を示した。IL-17とTNFとの負の連関は、CXCR3+CD8+TEMで増強された(補足図7B)。アラキドン酸代謝は、Cluster CD8+ TEMではほとんどの免疫シグナル伝達経路と負の相関を示したが、CXCR3+CD8+ TEMのレベルでは、TNF、IL-17およびcAMPシグナル伝達経路と正の相関を示した。このように、PUFA代謝の亢進は、クラスターCD8+ TEMの炎症性シグナル伝達を抑制する可能性がある。しかしながら、アラキドン酸代謝のアップレギュレーションは、CXCR3+ CD8+ TEMの小さなサブ分画において、TNF、IL-17およびcAMPシグナル伝達経路を活性化する危険性がある。
クラスターTREG(図4H)では、アスコルビン酸およびアルダル酸代謝は、IL-17およびTNFシグナル伝達経路と負の相関を示した。脂肪酸分解はIL-17シグナル伝達経路と負の相関を示し、白血球の経内皮移動と正の相関を示した。α-リノレン酸は、Th17細胞の分化およびJak、NF-kBシグナル伝達経路と負の連関を示し、白血球の経内皮移動と正の連関を示した。リノール酸はTGF-βシグナル伝達経路と正の相関を示した。アラキドン酸代謝はIL-17、TNF、cAMP、TCRシグナル伝達経路と負の相関を示した。したがって、アスコルビン酸およびアルダル酸代謝、脂肪酸分解および3種のPUFA代謝のアップレギュレーションは、PSAにおける免疫抑制機能の安定化とTregの遊走促進に役立つと考えられる。
Cluster MAITsに関しては(補足図7C)、脂肪酸分解はIL-17、TNF、Jak、cAMPシグナル伝達経路、Th17細胞の分化と負の相関があった。3種のPUFAの代謝は、MAITにおける細胞接着分子および白血球経内皮移動、IL-17およびTNFシグナル伝達経路と正の相関を示した。これらのことから、脂肪酸の分解を促進し、3種類のPUFAの代謝を阻害することで、MAITsの炎症抑制をサポートできる可能性がある。
クラスターγδT細胞(補足図7D)では、アラキドン酸代謝はIL-17、TNF、HIFシグナル伝達経路、白血球経内皮移動と負の連関を示した。脂肪酸分解における連関は逆であった。したがって、アラキドン酸代謝のアップレギュレーションと脂肪酸分解の阻害は、γδT細胞の炎症性機能と遊走を抑制する可能性がある。
まとめると、PSAにおけるT細胞サブセットの免疫代謝学的連関と免疫代謝学的差異の解析を組み合わせると、アスコルビン酸代謝とアルダル酸代謝のアップレギュレーションは、Tregの抗炎症機能を安定化させる可能性があると推測された。脂肪酸の分解を促進することで、CD4+ TCMとMAITの炎症シグナルとTh17細胞分化を抑制し、Tregの抗炎症機能を安定化させ、細胞接着と移動を促進する可能性がある。3種のPUFAの代謝をアップレギュレートすることで、CD4+ TCMとCD8+ TEMの炎症性機能を抑制し、Tregの抗炎症機能を安定化させる可能性がある。これらの推測は、さらなる実験による検証が必要である。
3.5 候補代謝経路に対する全身薬の影響
最後に、全身療法(PSA_SM)によるT細胞サブセットの免疫代謝変化の候補を示すために、GSEAを行った(図5)。MTXは、CD4+ TCMとCD8+ TEMのリノール酸代謝をアップレギュレートする能力があることがわかった。PSA_Antiによる脂肪酸分解と3種類のPUFAの代謝のアップレギュレーションは、CD8+ TEMで認められた。具体的には、エタネルセプト群とセクキヌマブ群のCD8+ TEM、およびブロダルマブ群のCD4+ TCMで、3種類のPUFAの代謝のアップレギュレーションが認められた。アダリムマブ群およびエタネルセプト群では、Tregs細胞のアスコルビン酸代謝およびアルダル酸代謝、CD4+ TCMの脂肪酸分解が阻害された。
図5
図5 全身投薬によるT細胞サブセットにおける候補免疫代謝経路の変化(PSA_SM)。
4 考察
この研究では、乾癬および乾癬性関節炎の循環Treg、CD4+ TCMs、CD8+ TEMsサブセットにおける免疫代謝再プログラミングのシングルセル・トランスクリプトーム・ランドスケープを記述した。また、乾癬と乾癬性関節炎における標的免疫代謝経路に対する現在の生物学的抗体の影響についても発表した。
ここで我々は、メモリーT細胞サブセットCD4+ TCMとCD8+ TEMが、PSOとPSAの循環血液中に占める割合が最も大きく、T細胞全体の約25%を占めることを証明した。CD4+ TCMは代謝が不活発という特徴がある。CD8+ TEMはPSOでは不摂生であり、HCとPSAでは脂肪酸代謝嗜好性であった。即時型エフェクター機能を持つCD8+ TEMは、PSAでは治療後に有意に減少した。TregはPSOとPSAで解糖と脂肪酸代謝に異なる嗜好性を示した。HCと比較して、PSOではこれら2つの代謝要求が同時にアップレギュレートされ、PSAでは解糖が優先された。γδT細胞とMAITは、解糖と脂肪酸代謝に対して同様の嗜好性を示した。PSOおよびPSAにおけるこれらの比率はHC群よりも低く、PSA投与後に上昇した。PSOにおけるMAITとTregの濃縮パターンは類似しており、γδT細胞とCD8+ TEMの濃縮パターンも類似していた。PSAにおけるMAITとγδT細胞は、CD8+ TEMではなくCD8+ TCMと類似していた。これらの所見から、MAITsとγδT細胞は、PSOとPSAでは免疫環境が異なるためか、可塑性の程度と方向性が異なることが示唆された。すなわち、MAITsとγδT細胞は、Treg様、IL-17/IL-1産生、あるいは免疫記憶表現型などの可塑性を持つ多機能性グループである(20-22)。一方、乾癬の発症に関与している可能性や上記の濃縮パターンから、循環MAITやγδT細胞の機能は、局所的な免疫環境によって維持され、主にIL-17を産生する末梢組織(腸、肝臓、肺、乾癬皮膚病変など)の機能とは異なる可能性が高いことが示唆される(22-24)。MAITsとγδT細胞の可塑性の特性、特に免疫記憶表現型は、乾癬の再発研究において包括的に検討する価値がある。
PSO/PSAでは、SELPLG/CXCR3の上方発現ピークが観察されなかったことから、CLA高/CXCR3高T細胞の一部が局所炎症に移動した可能性が示唆された。PSOのCLA-サブフラクション(補足図2)と比較して、CLA+サブフラクションの免疫シグナル伝達と代謝経路がより活発であることから、循環血中のSELPLGの発現が弱いCLA+T細胞は、皮膚ホーミングの予備プールとして機能している可能性が示唆された。PSAにおけるCXCR3-サブ分画と比較すると(補足図5A、B)、CXCR3+CD4+TCMにおける比較的活発な免疫代謝状態、およびCXCR3+CD8+TEMにおける比較的静穏な代謝状態は、CXCR3+CD4+TCMがCXCR3高集団の移動後も優先的に活性化されたサブ分画である一方、残りのCXCR3+CD8+TEMは弱い炎症促進によって特徴づけられていることを示唆している。
介入候補を見つけるために、PSOとHC、PSAとHCの免疫代謝経路を、それぞれCluster_T細胞とCLA+T/CXCR3+T細胞のレベルで比較した。そして、代謝経路と免疫シグナル経路の関連も分析した。PSOの各集中サブセットでは、イノシトールリン酸代謝のダウンレギュレーションと酸化的リン酸化のアップレギュレーションが両方のレベルで観察された。この一致した変化は、疾患状態や炎症病態に対するストレス反応の結果であると考えられる。炎症性T細胞サブセットと抗炎症性T細胞サブセットにおけるこれら2つの代謝経路の上記の変化傾向が一致していることを考慮すると、これらの代謝経路は代謝介入のターゲット候補とはならない。注目すべきは、PSOとPSAのTregにおいて、アスコルビン酸とアルダラー酸の代謝が有意にアップレギュレートされていることである。PSOでは、アスコルビン酸代謝はIL-17およびJakシグナル伝達経路と負の相関を示し、TGFおよびHIF-1とは正の相関を示した;PSAでは、アスコルビン酸代謝はIL-17およびTNFシグナル伝達経路と負の相関を示した。IL-17とTNFの両サイトカインが極めて重要な役割を果たしていることが証明されており、それらの拮抗薬は乾癬の有効な治療薬となっている(25)。加えて、Tregは炎症を抑制する性質があるため、アスコルビン酸代謝とアルダル酸代謝をアップレギュレートすることは、乾癬治療を強化する有望なターゲット候補と思われる。
PSOとHC、PSAとHCそれぞれのCluster_T細胞およびCLA+T/CXCR3+T細胞レベルでの免疫代謝の違いを、代謝と免疫シグナル伝達経路の関連と合わせて解析した。我々は、アスコルビン酸代謝およびアルダル酸代謝のアップレギュレーションと脂肪酸分解が、PSOおよびPSAにおけるTregの免疫抑制を増強する可能性があると推測した。α-リノレン酸、リノール酸、アラキドン酸の代謝亢進は、PSOおよびPSAにおけるCD4+ TCMおよびCD8+ TEMの炎症性機能を抑制し、PSAにおけるTregの免疫抑制を保護する可能性がある。
アスコルビン酸およびアルダル酸代謝は、グルクロン酸経路と密接な関係がある。後者によって産生されたグルクロン酸は、グリコサミノグリカン(ヘパリン、ヒアルロン酸、コンドロイチン硫酸など)の合成に利用され、またアスコルビン酸(ビタミンC)を供給して、アスコルビン酸代謝およびアルダル酸代謝に関与する(26)。アスコルビン酸およびアルダル酸代謝における我々の調査で明らかな変化を示した分子は、主にALDH2、ALDH7A1、ALDH1B1、AKR1A1、GUSBおよびUGDHであった(図2E、5E)。後者の2つ、UGDHとGUSBもそれぞれグリコサミノグリカンの生合成と分解に関与している。ヘパラン硫酸はグリコサミノグリカンの一種であり、細胞外-マトリックス界面で細胞シグナル伝達を調節する。その模倣体であるPG545(pixatimod)は、Th1/Th17エフェクター機能の強力な阻害剤であり、FoxP3+ Tregの誘導剤であることが指摘されている(27)。
アスコルビン酸代謝とアルダラー酸代謝で発現が異なることが判明したALDHは、アルデヒドヒドロゲナーゼのファミリーメンバーである。これら(例えばAKR1A1)は、アルコール代謝や脂質過酸化によって生成されたアルデヒドをアルコールに還元し、解毒機能を果たすことができる。移植片対宿主病のシクロホスファミド治療中にTregの免疫抑制能力を維持できたのは、高発現ALDH1の解毒能力に一因があると推測されている(28)。加えて、ALDHはレチナールからレチノイン酸への変換を触媒する細胞質酵素である(29)。レチノイン酸はTGF-βと協力して、ナイーブT細胞からFoxP3+ Tregへの転換を促進し、炎症条件下でも胸腺由来のTregの安定性を維持することで、免疫寛容を維持することができる(30, 31)。
アスコルビン酸およびアルダル酸代謝は、重要な糖代謝経路であり、細胞を酸化的損傷から守ることができる。アスコルビン酸はアスコルビン酸(ビタミンC)の陰イオンであり、強い抗酸化作用を持つ有機化合物である。ビタミンCは、in vivoにおいて末梢血CD4+FoxP3-T細胞からFoxP3+Tregへの分化を促進することが証明されている。さらに、FoxP3エンハンサーの脱メチル化を促進し、Tregの免疫抑制機能を安定化させる(32-34)。アスコルビン酸誘導体は、炎症性サイトカイン(IL-1βとTNF-α)を抑制することにより、イミキモド誘発乾癬様皮膚炎を改善することが示されている(35)。さらに、乾癬患者には食事療法にビタミンCのような抗酸化物質を導入することが推奨されている(36)。
脂肪酸分解に関しては、その主要なプロセスはβ-酸化とアセチル-CoAの放出である。伝統的にエフェクターT細胞が関与する解糖と同様に、脂肪酸分解も免疫細胞の生存と機能にとって重要な代謝経路であることが証明されている。FoxP3+トレグとCD8+メモリーT細胞は、主に長鎖脂肪酸の分解(パルミチン酸酸化など)に依存して、エネルギー需要を満たしていることが提唱されている(37, 38)。循環血中免疫細胞に加えて、乾癬病変部における組織常在記憶T細胞の生存にも遊離脂肪酸の取り込みと代謝が必要であることが確認されている(6)。我々の研究では、脂肪酸分解のアップレギュレーションが、PSOおよびPSAにおいてTregの免疫抑制機能を安定化させ、接着と遊走を促進することを見出した。同時に、そのアップレギュレーションが、PSOではCD8+ TEM、PSAではCD4+ TCMおよびMAITの炎症性シグナルを抑制することを見出した。
構造の違いにより、脂肪酸は飽和脂肪酸と不飽和脂肪酸に分けられ、後者はさらに一価不飽和脂肪酸と多価不飽和脂肪酸(PUFA)に分けられる(39)。PUFAの間には密接な変換と関連が存在する。α-リノレン酸(ω-3、ω-3)、リノール酸(ω-6)、アラキドン酸(AA、ω-6)を含むPUFAは、遺伝子発現、細胞代謝、シグナル伝達を含む様々なメカニズムを通じて、様々な慢性炎症性疾患や自己免疫疾患に関与している(40)。α-リノレン酸は、エイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)などの高度不飽和脂肪酸(HUFA)を生成する。膜リン脂質の形をしたHUFAは、ホスホリパーゼA2酵素によって加水分解され、リゾリン脂質と遊離脂肪酸を放出する。遊離したAA、EPA、DHAは、リポキシゲナーゼとシクロオキシゲナーゼの作用によりエイコサノイドを産生する。これらのエイコサノイドには、プロスタグランジン(PG)、トロンボキサン、ロイコトリエン(LT)などが含まれる。これらは炎症と血行動態の調節と維持に重要な役割を果たし、乾癬やアトピー性皮膚炎などの炎症性疾患やアレルギー性疾患を媒介する(41, 42)。AAの誘導体であるPGE2は炎症や免疫反応の開始に関与するため、一般にAAの誘導体は炎症促進物質であると考えられているが、これは完全な事実ではない。PGE2は、インターロイキン-6(IL-6)とTNF-αの産生を抑制し、AAからのリポキシンA4産生を誘発し、炎症解消を開始することが示されている(43)。さらに、AAは15-リポキシゲナーゼの触媒作用により、抗炎症作用を持つリポキシゲニンを産生することもできる。EPAとDHAは一般に、体内で抗炎症の役割を果たすと考えられている。まず、EPAはエイコサノイドを産生するが、このエイコサノイドはAAから産生されるエイコサノイドよりも炎症促進作用が低いことが多い。次に、EPAとDHAは、レゾルビンやプロテクチンといった炎症解決メディエーターの発現を促進する(44)。さらに、EPAとDHAは、炎症性転写因子核内因子κBの活性化を収縮させ、転写因子ペルオキシソーム増殖因子活性化受容体γ(PPARγ)を増強し、抗炎症作用(脂肪酸酸化のアップレギュレーションによるTreg反応の強化など)をもたらすことができる(45)。
PUFAの分解(β酸化)は、免疫成熟/機能を改善し、全身性炎症を調節することが示唆されている(46-48)。我々の調査では、PSOのCD4+TCMでは、PUFA代謝がCluster_T細胞とCLA+T細胞それぞれのレベルで阻害された。α-リノレン酸とリノール酸の代謝は、CD4+ TCMとCD8+ TEMの細胞で阻害され、PSAのTregでは活性化された。したがって、PUFAの代謝調節は乾癬性疾患における免疫代謝リプログラミングの標的候補であると考えられる。
α-リノレン酸やリノール酸と比較して、乾癬の発症やT細胞サブセットに対するAAの影響は広く研究されている。AA代謝異常は乾癬において主に障害される代謝経路の一つであった(49, 50)。T細胞上のAAが制御するカルシウム選択的チャネルの刺激により、カルシウムの流入だけでなく、T細胞受容体シグナル伝達カスケードの構成要素のリン酸化が誘導され、マウスモデルにおいて滑膜の炎症につながることが示されている(51)。AAの誘導体であるPGE2は、マウスの実験的自己免疫性脳脊髄炎において、PGE受容体4(EP4)とEP2を介してTh1とTh17細胞の生成を冗長に促進する一方で、EP4を介して血液脳関門を守ることにより、これらのT細胞の脳への侵入を弱めるという二重の役割を果たすことが証明されている(52)。マウス皮膚炎モデルでは、PGE2によって引き起こされるT細胞内在性のEP2/EP4シグナル伝達が、IL-23による病原性Th17細胞の生成に重要であることが示唆された(53)。しかし、この点に関する研究の結論は完全に一致しているわけではない。他の研究では、AA(PGE2)、ジホモ-γ-リノレン酸(PGE1)、EPA(PGE3)から代謝されるプロスタグランジンサブタイプが、Th1サイトカイン産生(IFN-γなど)を有意に減少させ、その結果、循環血液中のTh1/Th2バランスがTh2優位にシフトすることが示された(54, 55)。さらに、PGE2は、紫外線で死滅させた大腸菌を皮内投与したヒト急性炎症モデルにおいて、炎症が収まった後にEP4受容体を介してCD4+組織記憶T細胞の増殖を抑制することが示された(56)。一方、AAのもう一つの誘導体であるPGD2もまた、PGD2/DP1軸を介して炎症の沈静化を促進することが示唆された(57)。
リノール酸は人体の必須脂肪酸である。リノール酸は栄養補助食品として、またコレステロールの低下、知能の発達、バリアの修復に重要な役割を果たすと考えられてきた。多施設共同無作為化比較試験において、リノール酸-セラミドを含む保湿剤は、乾癬におけるグルココルチコイド外用剤の治療効果を増強し、乾癬の再発を遅らせることが示された(58)。血漿中のリノール酸の減少は歯肉炎患者で観察され、IL-17、TGF-β、IL-10のシグナル伝達と関連している。これらはTh17およびTreg経路と密接に関連している(59)。同様に、共役リノール酸(リノール酸の位置的・幾何学的異性体群)は、ジアルジア感染マウスモデルにおいて、IL-10、TGF-β、誘導性一酸化窒素合成酵素の発現を増加させることが示された(60)。マウスの乳腺腫瘍モデルでは、リノール酸がT細胞に取り込まれると、ナイーブT細胞のアポトーシスを促進し、TNF-αの産生を抑制することが示された。機械的には、リノール酸はT細胞においてミトコンドリアの活性酸素種(ROS)と表皮脂肪酸結合タンパク質(E-FABP)の産生増加を誘導し、後者はリノール酸のミトコンドリア輸送とカルジオリピンの取り込みを促進するのに不可欠である(61)。これらを総合すると、リノール酸の摂取は細胞性自己免疫疾患、特に乾癬などIFN-γとTNF-αの過剰産生を特徴とするタイプ1の免疫反応に対して治療効果がある可能性が示唆される。一方、リノール酸の過剰摂取は、IL-4やIL-13の過剰産生を伴うアトピー性皮膚炎に見られるように、タイプ2の免疫反応を悪化させる可能性がある(62)。
α-リノレン酸は、植物の種子油や豆類に広く含まれる必須オメガ3脂肪酸で、心臓血管保護作用、神経保護作用、抗炎症作用、抗酸化作用があることが報告されている(63)。α-リノレン酸は、より長鎖のオメガ3脂肪酸であるEPAとDHAの前駆体である。T細胞に対する効果は、主にEPAとDHAを通じて研究されている。EPAとDHAを魚油の摂取で補い、EPA&DHA/AAの割合を増やす研究が数多く行われている。EPAとDHAは、健常人のPBMCにおける活性化T細胞数を用量依存的に減少させることができる(64)。また、活性酸素やIL-1、TNF-α、IL-6の炎症性サイトカインを減少させ、Th1/Th2不均衡を調整し、いくつかの接着分子の発現を減少させることができる(40, 65)。肥満は乾癬の発症や悪化の危険因子として知られている(66)。痩せた脂肪組織ではなく、肥満の脂肪組織由来の幹細胞がIL-17Aを産生するTh17細胞を促進し、α-リノレン酸がこのプロセスを逆転させることが以前に証明されている(67)。この免疫代謝機構は、IL17Aに関連した炎症性疾患におけるPUFAの有益な効果を説明するのに役立つかもしれない。乾癬におけるエフェクターT細胞の異常な機能に加え、Tregはその抑制機能が損なわれており、Th17/Tregバランスが変化している(68)。DHAプライム樹状細胞は、T細胞増殖を抑制し、CD4+FoxP3+CTLA-4+、CD4+FoxP3+Helios+、またはCD4+FoxP3+PD-1+の発現表現型を持つT細胞の割合を増加させることが報告されている(69)。AAをプライムした樹状細胞にも同様の効果があり、このことはこれらの脂肪酸がTregの誘導を促進することを示している。
乾癬におけるPUFAの適用については多くの研究がなされているが、その結果は時に相反するものであり、結論は出ていない(70, 71)。考えられる理由は、サプリメントの摂取量が不十分であることと、飽和脂肪酸の摂取を制限していないことである。乾癬の治療におけるω-3脂肪酸の有効性を評価した560人の患者を対象としたメタアナリシスでは、臨床パラメータ(紅斑、かゆみ、鱗屑、関節痛など)の改善に対して、ω-3 PUFAサプリメントの高用量(EPA1800mg/日)が支持された(72)。さらに、ω-3脂肪酸の補充療法は乾癬におけるUVB、エトレチナート、タカルシトール外用を補完し、PASI(Psoriasis Area and Severity Index)スコアの低下とDLQI(Dermatology Life Quality Index)の改善に大きく寄与した(73-75)。これらのデータは、PUFAsとの併用療法が乾癬の治療と管理を改善する可能性が高いことを示唆している。
さらに、全身療法を受けた患者におけるT細胞サブセットの免疫代謝的変化について発表した(PSA_SM)。我々は、生物学的抗体(アダリムマブ、セクキヌマブ、リサンキズマブなど)を含む全身療法が、主にCD4+ TCMとCD8+ TEMのリノール酸とα-リノレン酸代謝の増加に焦点を当て、PSA患者の循環T細胞のいくつかの免疫代謝イベントに影響を与える可能性があることを示した。実際、ほとんどの生物学的抗体のT細胞に対する代謝作用は、特定の免疫代謝経路に限られている。さらに、この効果はある亜集団においてはそれほど「完璧」ではない。例えば、PSAに一般的に用いられるアダリムマブは、CD8+ TEMではα-リノレン酸代謝を増加させるが、CD4+ TCMでは脂肪酸分解を、Tregではアスコルビン酸代謝とアルダレート代謝を減少させる可能性がある。しかし、これらの "不完全性 "こそが、乾癬性疾患における治療スケジュールを最適化する余地を与えているのである。T細胞サブセットのこれらの免疫代謝経路の差異解析は、乾癬や関節症性乾癬の病態の理解を深めるだけでなく、特定の患者における生物学的抗体療法の低奏効性、薬剤耐性、二次的失敗の説明の可能性を提供することが期待される。したがって、T細胞と代謝経路の密接な関係を考慮すると、我々の知見に基づく標的介入の開発が、乾癬性疾患における生物学的抗体治療の理想的な補助療法を提供することが期待される。
本研究にはいくつかの限界がある。第一に、生物学的抗体で治療されたサンプルはPSO患者ではなくPSA患者から得られたものである。しかし、2つの疾患の治療における生物学的抗体の重複と共有が大きいことを考慮すると、PSA_SMとPSAの比較を通じて、免疫代謝リプログラミングに対するこれらの生物学的抗体の影響を見ることもできる。次の調査では、系統的な治療によりサンプル数を増やし、薬剤の投与量や治療期間などの因子と組み合わせて、より詳細な解析を行う予定である。第二に、循環T細胞サブセットは、皮膚における炎症性細胞の本拠地あるいは予備軍と考えられており、局所炎症性細胞サブセットの免疫代謝学的特徴をさらに研究することは、今回の結果を補足し、支持するものとなるであろう。最後に、我々の結論は、in vitroでの実験によってさらに確認される必要がある。
まとめて、我々は、GEOデータベースのHC、PSO、PSAおよびPSA_SMの64検体のデータに基づいて、循環CD4+ TCM、CD8+ TEM、Treg、MAIT、γδT細胞サブセットにおける免疫代謝のトランスクリプトーム・ランドスケープを解析し、発表した。T細胞サブセットの免疫代謝の特徴から、CD4+ TCMでは解糖と脂肪酸代謝の二重不耐性、HCとPSAのCD8+ TEMでは脂肪酸代謝依存性、Tregでは免疫代謝可塑性を同定した。さらに、PSOとPSAにおけるT細胞サブセットの免疫代謝リプログラミングのための介入ターゲット候補を、各群の免疫代謝の違いと免疫経路と代謝経路の関連性に従って同定した。我々の解析によると、アスコルビン酸代謝とアルカリ代謝のアップレギュレーションは、PSOとPSAのTreg細胞およびPSOのMAITの免疫抑制機能を安定化させ、その遊走を促進する可能性が示唆された。脂肪酸分解のアップレギュレーションは、PSOとPSAにおけるTregの免疫抑制機能を安定化させ、接着と遊走を促進し、その一方で、PSOのCLA+CD8+ TEM、MAITs、PSAのCD4+ TCMの炎症性シグナル経路を阻害した。3つの主要なPUFA(α-リノレン酸、リノール酸、アラキドン酸)の代謝を促進することで、PSOのCLA+CD4+ TCM、PSAのCluster CD4+ TCM、CD8+ TEMの炎症性機能を抑制し、さらにPSAのTregの免疫抑制を安定化させることができた。T細胞サブセットにおける免疫代謝のトランスクリプトーム・ランドスケープの同定と解析は、病態と発症メカニズムのさらなる理解につながるだけでなく、乾癬性疾患に対する補助療法の有望な候補を提供するものである。
データ利用声明
本論文の基礎となるデータは、米国国立生物工学情報センター(NCBI)のGEOリポジトリから入手した(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi, GSE194315)。
倫理声明
ヒトを対象とした研究については、現地の法律および施設要件に従い、倫理的審査および承認は必要なかった。本研究では、国内法および施設要件に従い、参加に関する書面によるインフォームド・コンセントは不要であった。
著者の貢献
概念化: データキュレーション:LP、ZS: データキュレーション:LP; 形式的分析:LP; 資金獲得:LP: LP;資金獲得: ZS、調査: LC, JW; 方法論: プロジェクト管理: LC, ZS; リソース: リソース:ZS. JW、ソフトウェア: LP; 監督:ZS: ZS; 検証: LC, ZS; 可視化: LP、SL、WL;執筆-原案作成: 執筆-原案作成:LP、LC、ZS;執筆-校閲・編集: 執筆-校閲および編集:LP、LC、ZS。すべての著者が論文に貢献し、提出されたバージョンを承認した。
資金提供
中国国家自然科学基金(第82273537号、第82073444号)、広東省人民病院人材導入科学基金(KJ0120220181)。
謝辞
有意義なデータセットの構築にご尽力いただいたボランティアおよびオリジナルデータセットGSE:194315の著者に感謝する。
利益相反
著者らは、本研究が利益相反の可能性があると解釈されるような商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本論文で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
補足資料
本論文の補足資料は、https://www.frontiersin.org/articles/10.3389/fimmu.2023.1179877/full#supplementary-material。
補足図1|HC群、PSO群、PSA群、PSA_SM群のT細胞サブセット内の差異遺伝子(Top5)のヒートマップクラスタリング。
補足図2|PSO内、およびPSOとHC間のT細胞のイムノメタボリックな違い。(A,B)GSEAによるPSO内のCLA-T細胞とCLA+T細胞のサブ分画間の免疫代謝の違い。(C)GSEAによる、PSOとHC間のClusterとCLA+レベルのサブセットの免疫シグナル伝達の違い。灰色の背景は負の正規化濃縮スコア(NES)を示し、明るい背景は正のNESを示す。NESは遺伝子セットがどの程度ダウンレギュレート(負のNES)またはアップレギュレート(正のNES)されているかを反映している。ドットの面積はNESの絶対値に対応する。ドットの色はP値に対応する。
補足図3|イノシトールリン酸代謝、グリセロ脂質代謝、グリセロリン脂質代謝、解糖/糖新生、ペントースリン酸経路、クエン酸サイクル(TCAサイクル)、または酸化的リン酸化の代謝経路とPSOのT細胞における免疫イベントとの間の免疫代謝的連関。PSOのCD4+ TCM(A, B)、CD8+ TEM(C, D)、Treg(E, F)、MAIT(G, H)、γδT細胞(I, J)におけるクラスターとCLA+のレベルでの免疫代謝連関。
補足図4|α-リノレン酸代謝、リノール酸代謝、アラキドン酸代謝、アスコルビン酸およびアルダル酸代謝の代謝経路間の免疫代謝的連関、 または脂肪酸分解と、CLA+レベルのPSOのCD4+ TCM(A)、CD8+ TEM(B)、Treg(C)、およびClusterとCLA+レベルのPSOのMAIT(D、E)、γδT細胞(F、G)における免疫イベント。
補足図5|PSA内およびPSAとHC間のT細胞のイムノメタボリックな違い。(A,B)GSEAによるPSA内のCXCR3-T細胞とCXCR3+T細胞のサブ分画間の免疫代謝的差異景観。(C)GSEAによる、PSAとHCの間のClusterおよびCXCR3+レベルのサブセットの免疫シグナル伝達の違い。灰色の背景は負の正規化濃縮スコア(NES)を示し、明るい背景は正のNESを示す。NESは遺伝子セットがダウンレギュレート(負のNES)またはアップレギュレート(正のNES)される程度を反映する。ドットの面積はNESの絶対値に対応する。ドットの色はP値に対応する。
補足図6|イノシトールリン酸代謝、グリセロ脂質代謝、グリセロリン脂質代謝、解糖/糖新生、ペントースリン酸経路の代謝経路間のイムノメタボリックリンク、 PSAのCD4+ TCM(A、B)、CD8+ TEM(C、D)ではクラスターおよびCXCR3+のレベルで、PSAのTreg(E)、MAIT(F)、γδT細胞(G)ではクラスターのレベルで、それぞれクエン酸サイクル(TCAサイクル)、または酸化的リン酸化と免疫事象を比較した。
補足図7|α-リノレン酸代謝、リノール酸代謝、アラキドン酸代謝、アスコルビン酸およびアルダル酸代謝、または脂肪酸分解の代謝経路とPSAのT細胞における免疫イベントとの間の免疫代謝リンケージ。CXCR3+レベルのPSAのCD4+ TCM(A)とCD8+ TEM(B)、ClusterレベルのPSAのMAIT(C)、γδT細胞(D)における免疫代謝リンケージ。
参考文献
Makowski L, Chaib M, Rathmell JC. Immunometabolism: from basic mechanisms to translation. Immunol Rev (2020) 295(1):5-14.
PubMedアブストラクト|全文|Google ScholarLercher A, Baazim H, Bergthaler A. 全身性免疫代謝:課題と機会。免疫 (2020) 53(3):496-509. doi: 10.1016/j.immuni.2020.08.012.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar炎症性皮膚疾患の再発における組織常在記憶T細胞とその生物学的特性。細胞分子免疫学(2020)17(1):64-75. doi: 10.1038/s41423-019-0291-4.
PubMed Abstract|クロスリファレンス全文|Google ScholarSullivan DO, Van Der Windt GJW, Huang SC-C, Curtis JD, Chang C-H, Buck MDL, et al. Memory CD8+ T cell use cell intrinsic lipolysis. Immunity (2014) 41(1):75-88. doi: 10.1016/j.immuni.2014.06.005.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar記憶CD8+ T細胞は、最適な機能のためにストレスによって誘導される酢酸濃度の上昇を必要とする。Immunity (2016) 44(6):1312-24. doi: 10.1016/j.immuni.2016.03.016.
PubMed Abstract|クロスリファレンス全文|Google Scholar組織常在記憶T細胞の生存には、外因性脂質の取り込みと代謝が必要である。Nature (2017) 543(7644):252-6. doi: 10.1038/nature21379.
PubMed Abstract|クロスリファレンス全文|Google Scholar非リンパ組織におけるトレグ細胞の代謝と機能の制御。Doi:10.3389/fimmu.2022.909705。
CrossRef 全文|Google Scholar乾癬の病態生理、臨床像、治療:総説。JAMA - J Am Med Assoc (2020) 323(19):1945-60. doi: 10.1001/jama.2020.4006.
CrossRef 全文|Google Scholar乾癬におけるヘルパーT細胞の役割。Doi: 10.3389/fimmu.2021.788940.
クロス・リーフ・フルテキスト|Google Scholar単一細胞のトランスクリプトームと表面エピトープを組み合わせたプロファイリングにより、関節症性乾癬の潜在的バイオマーカーが同定され、機械学習による診断が容易になった。論文タイトル:Front Immunol (2022) 13(March):1-13.
クロス・リーフ・フルテキスト|Google ScholarHao Y, Hao S, Andersen-Nissen E, Mauck WM, Zheng S, Butler A, et al. マルチモーダル単一細胞データの統合解析。Cell [Internet] (2021) 184(13):3573-3587.e29. doi: 10.1016/j.cell.2021.04.048.
CrossRef 全文|Google ScholarButler A, Hoffman P, Smibert P, Papalexi E, Satija R. Integrating single-cell transcriptomic data across different conditions, technologies, and species. Nat Biotechnol (2018) 36(5):411-20. doi: 10.1038/nbt.4096.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarHänzelmann S, Castelo R, Guinney J. GSVA: gene set variation analysis for microarray and RNA-seq data. BMC Bioinf (2013) 14:7. doi: 10.1186/1471-2105-14-7.
クロスレフ・フルテキスト|Google ScholarLiberzon A, Birger C, Thorvaldsdóttir H, Ghandi M, Mesirov JP, Tamayo P. The molecular signatures database hallmark gene set collection. 細胞システム (2015) 1(6):417-25. doi: 10.1016/j.cels.2015.12.004
PubMedアブストラクト|クロスリファレンス全文|Google ScholarGene set enrichment analysis: a knowledge-based approach for interpretting genome-wide expression profiles. 遺伝子セット濃縮解析:ゲノムワイド発現プロファイルを解釈するための知識ベースのアプローチ。
ゲノムワイド発現プロファイルを解析した。T細胞記憶の多様性:豊かさの恥ずかしさ。Immunity Elsevier Inc. (2009) 31:859-71. doi: 10.1016/j.immuni.2009.11.007.
クロスレフ・フルテキスト|Google ScholarSigmundsdóttir H, Gudjónsson JE, Jónsdóttir I, Lúdvíksson BR, Valdimarsson H. 乾癬患者の血中CLA+ CD8+ T細胞の頻度は、重症度と密接に相関する。Clin Exp Immunol (2001) 126(2):365-9. doi: 10.1046/j.1365-2249.2001.01688.x
PubMedアブストラクト|RefRefフルテキスト|Google Scholarde Jesús-Gil C, Sans-de San Nicolàs L, García-Jiménez I, Ferran M, Pujol RM, Santamaria-Babí LF. 乾癬におけるヒトCLA+メモリーT細胞とサイトカイン。Doi: 10.3389/fmed.2021.731911.
CrossRef 全文|Google ScholarPollock RA, Abji F, Liang K, Chandran V, Pellett FJ, Virtanen C, et al. 炎症性関節炎の有無による乾癬患者の遺伝子発現の違い。J Invest Dermatol Nat Pub Group) (2015) 135:620-3. doi: 10.1038/jid.2014.414.
CrossRef Full Text|Google ScholarGao MG, Zhao XS. Gao MG, Zhao XS. Mining the multifunction of mucosal-associated invariant T cells in hematological malignancies and transplantation immunity: a promising hexagon soldier in immunomodulatory. 論文タイトル:Front Immunol (2022) 13(August):1-13.
クロス・リーフ・フルテキスト|Google ScholarPang DJ, Neves JF, Sumaria N, Pennington DJ. マウスとヒトにおけるγδT細胞サブセットの複雑性を理解する。Immunology (2012) 136(3):283-90. doi: 10.1111/j.1365-2567.2012.03582.x.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarQi C, Wang Y, Li P, Zhao J. Gamma delta T cells and their pathogenic role in psoriasis. Doi: 10.3389/fimmu.2021.627139.
CrossRef 全文|Google ScholarDusseaux M, Martin E, Serriari N, Péguillet I, Premel V, Louis D, et al. Human MAIT cells are xenobiotic-resistant, tissue-targeted, CD161 hi IL-17-secreting T cells. 血液 (2011) 117(4):1250-9. doi: 10.1182/blood-2010-08-303339.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar組織常在MAIT細胞によるIL-17産生は、小児の肺炎において局所的に誘導される。Mucosal Immunol (2020) 13(5):824-35. doi: 10.1038/s41385-020-0273-y
PubMed Abstract|全文|Google Scholarリウマチ性疾患におけるIL-23/IL-17経路の役割:概説。Doi: 10.3389/fimmu.2021.637829
CrossRef 全文|Google ScholarL-アスコルビン酸の生合成。ビタミンホルモン (2001) 61:241-66.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarKoliesnik IO, Kuipers HF, Medina CO, Zihsler S, Liu D, Van Belleghem JD, et al. ヘパラン硫酸模倣物質PG545はT細胞応答を調節し、遅延型過敏症を予防する。論文タイトル:「ヘパラン硫酸模倣薬PG545はT細胞応答を調節し、遅延型過敏症を予防する」。
PubMedアブストラクト|クロスリファレンス全文|Google Scholarアルデヒド脱水素酵素の発現は、移植後シクロホスファミドに対するヒト制御性T細胞の耐性を駆動する。(2013)5(211):211ra157.doi:10.1126/scitranslmed.3006960。
パブコメ抄録|クロスリファレンス全文|Google ScholarKedishvili NY. レチノイン酸の合成と分解。サブセル生化学(2016)81:127-61.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarFOXP3+制御性T細胞の生物学におけるオールトランス型レチノイン酸の役割。Cell Mol Immunol (2015) 12:553-7. doi: 10.1038/cmi.2014.133
PubMedアブストラクト|クロスリファレンス全文|Google ScholarRaverdeau M, Mills KHG. レチノイン酸によるT細胞および自然免疫応答の調節。J Immunol (2014) 192(7):2953-8. doi: 10.4049/jimmunol.1303245.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarSasidharan Nair V, Song MH, Oh KI. ビタミンcはtet依存的にFoxp3エンハンサーの脱メチル化を促進する。J Immunol (2016) 196(5):2119-31. doi: 10.4049/jimmunol.1502352.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarTET活性の調節によるFoxp3の安定性の制御。J Exp Med (2016) 213(3):377-97. doi: 10.1084/jem.20151438.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarNikolouli E, Hardtke-Wolenski M, Hapke M, Beckstette M, Geffers R, Floess S, et al. ビタミンcの存在下で生成されたアロ抗原誘導制御性t細胞は、foxp3発現の安定性を高め、皮膚移植の受け入れを促進する。論文タイトル:Front Immunol(2017)8:1-12.doi:10.3389/fimmu.2017.00748。
PubMed Abstract|クロスリファレンス全文|Google Scholarアスコルビン酸誘導体DDH-1は、炎症性サイトカインの発現を抑制することにより、マウスの乾癬様皮膚病変を改善する。J Pharmacol Sci (2018) 138(4):284-8. doi: 10.1016/j.jphs.2018.11.002.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarGarbicz J, Całyniuk B, Górski M, Buczkowska M, Piecuch M, Kulik A, et al. 乾癬患者における栄養療法。栄養(2022)14:1-19。
クロス・リーフ・フルテキスト|Google ScholarエフェクターCD4 + T細胞サブセットと制御性CD4 + T細胞サブセットには、異なる解糖代謝プログラムと脂質酸化代謝プログラムが必須である。J Immunol (2011) 186(6):3299-303. doi: 10.4049/jimmunol.1003613.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarPearce EL, Walsh MC, Cejas PJ, Harms GM, Shen H, Wang LS, et al. 脂肪酸代謝の調節によるCD8 T細胞記憶の増強。Nature (2009) 2(460(7251):103-7. doi: 10.1038/nature08097.
CrossRef 全文|Google Scholar乾癬の病態生理における食事脂質の役割に関する現在の理解。J Dermatol Science Japanese Soc Invest Dermatology) (2019) 94:314-20. doi: 10.1016/j.jdermsci.2019.05.003.
クロス・リーフ・フルテキスト|Google ScholarBalić A, Vlašić D, Žužul K, Marinović B, Mokos ZB. 炎症性皮膚疾患の予防と治療におけるオメガ3系多価不飽和脂肪酸とオメガ6系多価不飽和脂肪酸の比較。本論文は、炎症性皮膚疾患の予防と治療におけるオメガ3系とオメガ6系多価不飽和脂肪酸の比較についてまとめたものである。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar皮膚炎症におけるエイコサノイド。プロスタグランジンロイコエッセント脂肪酸(2013)88(1):131から8。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar皮膚創傷治癒におけるエイコサノイド。Int J Mol Sci (2020) 21(22):1-19. doi: 10.3390/ijms21228435.
CrossRef 全文|Google ScholarDas UN. 必須脂肪酸とその代謝産物による炎症の病態生物学とその解決。バイオモレキュールズ(2021)11(12):1873.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarCalder PC. オメガ3脂肪酸と炎症プロセス:分子から人へ。Biochem Soc Trans (2017) 45(5):1105-15. doi: 10.1042/BST20160474.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarPPARγの活性化は、CD36/CPT1を介した脂肪酸酸化とそれに続くTβRII/IL-2Rαのn-糖鎖分岐のアップレギュレーションを通じて、トレグ応答を増強する。細胞伝達シグナル(2022)20(1):1-22.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarWu D, Lewis ED, Pae M, Meydani SN. 免疫機能の栄養調節:エビデンス、メカニズム、臨床的関連性の分析。Front Immunol (2019) 10(JAN):1-19. doi: 10.3389/fimmu.2018.03160.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarKumar NG, Contaifer D, Madurantakam P, Carbone S, Price ET, Van, et al. Dietary bioactive fatty acids as modulators of immune function: implications on human health. Nutrients (2019) 11(12):1-15. doi: 10.3390/nu11122974.
クロス・リーフ・フルテキスト|Google ScholarEnke U, Seyfarth L, Schleussner E, Markert UR. 早期免疫と胎児の発達にPUFAの影響。Br J Nutr(2008)100(6):1158から68まで。
PubMedアブストラクト|クロスリーフフルテキスト|Google ScholarLi L, Lu CJ, Han L, Deng JW, He ZH, Yan YH, et al. 超高速液体クロマトグラフィー質量分析に基づく尋常性乾癬の非標的血清メタボノミクス研究。Oncotarget (2017) 8(56):95931-44. doi: 10.18632/oncotarget.21562.
PubMed Abstract | CrossRef Full Text | Google Scholar李SS、劉Y、李H、王LP、薛LF、殷GS、他:UPLC-Q-TOF/MSに基づくノンターゲットメタボロミクスによるヒト血漿中の尋常性乾癬バイオマーカーの同定。Eur Rev Med Pharmacol Sci (2019) 23(9):3940-50. doi: 10.26355/eurrev_201905_17823.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar関節リウマチ患者のT細胞におけるアラキドン酸制御カルシウムシグナルは滑膜の炎症を促進する。Nat Commun (2021) 12(1):1-17. doi: 10.1038/s41467-021-21242-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholarマウス実験的自己免疫性脳脊髄炎におけるPGE2-EP4シグナルの二重の役割。日本脳炎学会誌(2010年)107(27):12233-8.
パブコメ抄録|クロスリファレンス全文|Google ScholarT細胞内在性のプロスタグランジンE2-EP2/EP4シグナル伝達は、病原性TH17細胞駆動性炎症において重要である。J Allergy Clin Immunol (2019) 143(2):631-43. doi: 10.1016/j.jaci.2018.05.036
PubMed Abstract|RefRef Full Text|Google ScholarMiles EA, Aston L, Calder PC. ヒト全血培養におけるTヘルパー1型およびTヘルパー2型サイトカイン産生に対する異なる20炭素脂肪酸由来のエイコサノイドのin vitro効果。また、そのようなサイトカイン産生を抑制するために、T-ヘルパー1型とT-ヘルパー2型のサイトカイン産生を阻害する20-炭素脂肪酸由来のエイコサノイドが有効であることを示した。
PubMedアブストラクト|RefRefフルテキスト|Google ScholarDooper MMBW, Wassink L, M'Rabet L, Graus YMF. ヒト末梢血単核球によるサイトカイン産生に対するプロスタグランジン-Eの調節作用は、プロスタグランジンのサブタイプに依存しない。免疫学 (2002) 107(1):152-9. doi: 10.1046/j.1365-2567.2002.01474.x.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarMotwani MP, Newson J, Kwong S, Richard-Loendt A, Colas R, Dalli J, et al. ヒトにおける急性炎症消失後の免疫変化の長期化。PloS One (2017) 12(10):1-16. doi: 10.1371/journal.pone.0186964.
CrossRef 全文|Google ScholarKong D YY. プロスタグランジンD2シグナル伝達と心血管ホメオスタシス。この論文では、プロスタグランジンD2シグナルと心血管系ホメオスタシスの関係を明らかにすることを目的とし、プロスタグランジンD2シグナルと心血管系ホメオスタシスの関係を明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholarリノール酸とセラミドを含む局所保湿剤の尋常性乾癬に対する有効性と安全性:多施設ランダム化比較試験。Dermatol Ther (2020) 33(6):1-7. doi: 10.1111/dth.14263.
CrossRef Full Text|Google ScholarWang W, Wang X, Lu S, Lv H, Zhao T, Xie G, et al. 代謝障害とTh17/Treg不均衡は歯肉炎の進行と関連する。論文タイトル:Front Immunol (2021) 12(6月):1-15.
クロス・リーフ・フルテキスト|Google ScholarReyes-Duarte I, Burgara-Estrella AJ, Bustamante-Córdova L, Moya-Camarena SY, Parra-Sánchez H, Álvarez-Bajo O, et al. 共役リノール酸は、ランブル鞭毛虫感染マウスにおいて、転写サイトカインプロファイルを変化させ、早期特異的分泌性IgA反応を誘導する。Iran J Basic Med Sci (2022) 25(12):1468-76. doi: 10.22038/IJBMS.2022.65796.14471.
パブコメ抄録|クロスリファレンス全文|Google Scholarリノール酸を多く含む食餌性脂肪は、E-FABPを介したミトコンドリア機能障害を誘導することにより、抗腫瘍T細胞応答を障害する。Cancer Res (2021) 81(20):5296-310. doi: 10.1158/0008-5472.CAN-21-0757.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarNamazi MR. 自己免疫疾患におけるリノール酸の有益および有害作用。自己免疫 (2004) 37(1):73-5. doi: 10.1080/08916930310001637968
PubMedアブストラクト|RefRefフルテキスト|Google Scholarα-リノレン酸:栄養補助食品、薬理学的および毒性学的評価。doi: 10.1016/j.fct.2014.05.009.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarロセッティRG、ザイラーCM、デルーカP、ラポサータM、Zurier RB。不飽和脂肪酸の経口投与:ヒト末梢血Tリンパ球増殖に対する影響。J Leukoc Biol (1997) 62(4):438-43. doi: 10.1002/jlb.62.4.438
PubMedアブストラクト|RefRefフルテキスト|Google Scholar分子ドッキングによってスクリーニングされたα-リノレン酸は、オバルブミン誘発アレルギー性鼻炎マウスのTh1/Th2不均衡を制御することによって炎症を抑制する。分子(2022)27(18):1-11.
CrossRef 全文|Google Scholar乾癬と肥満。皮膚科学(2017)232(6):633-9.
CrossRef Full Text|Google ScholarChehimi M, Ward R, Pestel J, Robert M, Pesenti S, Bendridi N, et al. オメガ3多価不飽和脂肪酸は、肥満被験者の脂肪組織から採取した脂肪由来幹細胞と共培養したT細胞において、ICAM-1の発現低下を通じてIL-17Aの分泌を抑制する。Mol Nutr Food Res (2019) 63(11):1-10. doi: 10.1002/mnfr.201801148.
CrossRef Full Text|Google ScholarNussbaum L, Chen YL, Ogg GS. 乾癬の病態と治療における制御性T細胞の役割。Br J Dermatol (2021) 184(1):14-24. doi: 10.1111/bjd.19380.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarCarlsson JA, Wold AE, Sandberg AS, Östman SM. 多価不飽和脂肪酸のアラキドン酸とドコサヘキサエン酸はマウス樹状細胞の成熟を誘導するが、in vitroでのT細胞応答は低下させる。PloS One (2015) 10(11):1-23. doi: 10.1371/journal.pone.0143741
クロス・リーフ・フルテキスト|Google Scholar乾癬患者の疾患重症度に対するオメガ3脂肪酸の効果:系統的レビュー。Int J Rheum Dis (2017) 20(4):442-50. doi: 10.1111/1756-185X.13051.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarKatsimbri P, Korakas E, Kountouri A, Ikonomidis I, Tsougos E, Vlachos D, et al. 乾癬および乾癬性関節炎の表現型に対する食事の抗酸化能および抗炎症能の効果:治療ツールとしての栄養?アンチオキシダント (2021) 10(2):1-28.
CrossRef 全文|Google ScholarClark CCT, Taghizadeh M, Nahavandi M, Jafarnejad S. Efficacy of ω-3 supplementation in patients with psoriasis: a meta-analysis of randomized controlled trials. Clin Rheumatol (2019) 38(4):977-88. doi: 10.1007/s10067-019-04456-x
PubMedアブストラクト|RefRefフルテキスト|Google ScholarGupta AK、Ellis CN、Tellner DC、Anderson TF、Voorhees JJ。乾癬の治療における魚油と低用量UVBの有効性を評価する二重盲検プラセボ対照試験。この試験は、魚油と低用量UVBの乾癬治療における有効性を評価するための二重盲検プラセボ対照試験である。
PubMed Abstract|全文|Google Scholar尋常性乾癬に対する低用量エトレチナートとエイコサペンタエン酸の併用療法。J Dermatol (1998) 25(11):703-5. doi: 10.1111/j.1346-8138.1998.tb02487.x
PubMedアブストラクト|RefRefフルテキスト|Google ScholarMárquez-Balbás G, Sánchez-Regaña M, Millet U. 乾癬治療におけるサプリメントとしてのオメガ3脂肪酸の使用に関する研究。Clin Cosmet Investig Dermatol (2011) 73:73-7. doi: 10.2147/CCID.S17220
CrossRef 全文|Google Scholar
キーワード 中医学、TEM、Treg、免疫代謝、乾癬、関節症性乾癬、シングルセル・トランスクリプトミクス
引用 Peng L, Chen L, Wan J, Liu W, Lou S and Shen Z (2023) 免疫代謝のシングルセル・トランスクリプトミクス・ランドスケープから、健常対照、乾癬、乾癬性関節炎におけるT細胞サブセットのアスコルビン酸とアルダラー酸代謝、脂肪酸分解、PUFA代謝の介入候補が明らかになった。Front. Immunol. 14:1179877.
受理された: 2023年3月05日;受理:2023年6月21日;
発行:2023年7月10日
編集者
ファビオ・リラ、サンパウロ州立大学、ブラジル
査読者
ヘレナ・バタチーニャ(アリゾナ大学、米国
Tayrine Ordonio Filgueira, ペルナンブーコ連邦大学, ブラジル
Copyright © 2023 Peng, Chen, Wan, Liu, Lou and Shen. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*通信欄 Zhu Shen, zhushencq@hotmail.com
免責事項:本論文で表明されたすべての主張は、あくまで著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
こんな人たちも見ています
論説 皮膚感染、自己免疫、癌生物学におけるT細胞の免疫代謝学
ルー・ペン、リン・チェン、ローラ・A・ソルト、ヴェニーナ・マルセラ・ドミニカル、朱申
HFRSを引き起こすハンタウイルスにおけるコドン使用パターンと影響因子の同定と特徴づけ
ファティマ・ヌール、ウスマン・アリ・アシュファク、アブ・バカール、ムハンマド・カシム、ムハンマド・シャリーフ・マスード、アブドゥルラフマン・アルシャマリ、メタブ・アルハービ、ムハンマド・シャヒド・リアズ
メタボロームおよびリピドミクスによる慢性閉塞性肺疾患の中医学的パターンにおける鑑別
李建成、劉新光、史燕民、謝楊、楊建也、杜燕、張安、呉晋岩
ヒト母乳中の細胞外miRNAの測定と発現に及ぼす技術的および母児的要因の影響
Elizabeth A. Holzhausen、Allison Kupsco、Bridget N. Chalifour、William B. Patterson、Kelsey A. Schmidt、Pari Mokhtari、Andrea A. Baccarelli、Michael I. Goran、Tanya L. Alderete
COVID-19患者におけるT細胞受容体βレパートリーから明らかになった疾患重症度の特徴
Jing Xu, Xiao-xiao Li, Na Yuan, Chao Li, Jin-gang Yang, Li-ming Cheng, Zhong-xin Lu, Hong-yan Hou, Bo Zhang, Hui Hu, Yu Qian, Xin-xuan Liu, Guo-chao Li, Yue-dan Wang, Ming Chu, Chao-ran Dong, Fan Liu, Qing-gang Ge, Yue-jin Yang
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
