肝マクロファージと腸内細菌叢のクロストーク。炎症関連肝疾患の重要な構成要素
Front. Cell Dev. Biol.、2022年11月22日
Sec. 分子・細胞病理学
https://doi.org/10.3389/fcell.2022.1070208
この記事は、Research Topicの一部です。
肝臓病学におけるマクロファージ
すべての記事を見る
肝マクロファージと腸内細菌叢のクロストーク。炎症関連肝疾患の重要な構成要素
www.frontiersin.orgZiyuan Zhou, www.frontiersin.orgXiaxia Pan and www.frontiersin.orgLanjuan Li*
浙江大学医学部第一付属病院感染症診断治療国家重点実験室、国立感染症臨床研究センター、感染症診断治療共同イノベーションセンター、杭州、中国

肝マクロファージは、肝炎の主要なセンサーおよびレスポンダーとして認識されている。肝マクロファージは、腸-肝臓軸を通じて、微生物成分や代謝物を含む宿主または外来性の生化学的シグナルを処理することにより、炎症反応の引き金にも調節にもなります。肝マクロファージと腸内細菌叢のクロストークは、肝炎や急性肝障害(ALI)、アルコール性肝疾患(ALD)、非アルコール性脂肪性肝疾患(NAFLD)などの関連肝疾患の重要な構成要素である。本総説では、肝マクロファージと腸内細菌叢のクロストークに関する最近の知見をまとめ、炎症性肝疾患における腸内細菌叢の構成要素である肝マクロファージを標的とした治療の可能性についても言及する。
はじめに
マクロファージは、自然免疫系において重要な役割を担っている。貪食に関与する主要な細胞として、マクロファージはToll様受容体(TLR)やスカベンジャー受容体(SR)を含む多様なパターン認識受容体(PRR)を完全に備え、強力なリソソーム酵素を加えて病原体を係留、認識、排除します(Janeway and Medzhitov, 2002; Nagata, 2018)。マクロファージの機能および表現型は、生理的および/または病理学的状態に応じて大きく変化する(Gordon and Taylor, 2005; Gordon et al.) 例えば、マクロファージは、炎症性古典的活性化マクロファージ(M1)と抗炎症性代替活性化マクロファージ(M2)の2つのサブセットに偏極することができる(Murray and Wynn, 2011; Locati et al.、2020)。
肝臓には、2つの主要なカテゴリーのマクロファージが存在する:肝臓に常駐するクッパー細胞(KC)および循環する単球由来マクロファージ(MoMφ)(Varolら、2015; Douら、2019年)。一般に、KCは、病原体成分、細胞片、内/外来代謝物などの生化学的シグナルを感知し処理する役割を担っている(Diehlら、2020; Li W.ら、2022)。一次炎症を誘発し、ケモカインを分泌して、さらなる炎症反応のためにMoMφをリクルートすることができる(Wenら、2021;Zhou J.ら、2022)。肝マクロファージは、抗炎症因子で刺激されると、炎症反応を制御することもできる。したがって、異なる薬剤によって誘導されるマクロファージ活性および不均一性に関連するシグナル伝達経路は、炎症関連肝疾患において重要な役割を果たす(Douら、2019;Wenら、2021;Li W.ら、2022)。
ここ数十年の研究により、腸由来の微生物剤とマクロファージなどの肝細胞とのクロストークの重要性を強調する腸肝軸の概念が導入されました(Wu and Tian, 2017; Tripathi et al., 2018; De Muynck et al., 2021)。肝マクロファージは、病原体関連分子パターン(PAMP)などの腸由来のシグナルによって刺激されると、肝炎を誘発することがあります(Thevaranjanら、2017; Toubalら、2020; Zhangら、2021b)。一方、短鎖脂肪酸(SCFA)などの多くの微生物因子は、肝マクロファージの活性化を抑制または制御することができます(Baoら、2020;Wang Z.ら、2020;Xiaら、2022)。この腸内細菌叢-マクロファージ-肝炎の軸は、炎症に関連する肝疾患において非常に重要である。
本総説では、肝マクロファージと腸内細菌叢のクロストーク、および特定の微生物と炎症関連肝疾患との関連に焦点を当てます。肝マクロファージや腸内細菌叢をターゲットにすることで、炎症性肝疾患の治療効果が期待できる。
肝マクロファージの起源と特徴
肝マクロファージは、主に組織内常在型KCと循環型MoMφの2つのサブセットからなり、その起源や性質は異なります。一般に、組織常在型のKCは、胚発生時に胎児肝臓に播種される。1つの仮説では、KCsは胚発生中の胎児肝臓に存在するCSF1R+赤血球系前駆細胞(EMPs)に由来するとされている(Gomez Perdiguero et al.、2015)。これらのEMPは、胚8.5日目(E8.5)に卵黄嚢で発生し、その後、胎児肝臓にコロニーを形成した後、単球に発達します。KCsは、E12.5という早い時期に胎児肝単球から発生すると考えられています(Hoeffel et al.、2015)。第二の仮説は、KCはEMPに由来する循環CD45+、Kit-、Lin-マクロファージ前駆体(pMac)に由来し、E9.5から胎児肝臓にコロニーを形成し、CX3CR1に依存して、E12.5という早い時期に組織常在マクロファージを生じるとする(マスら, 2016)。他の組織常在マクロファージと同様に、KCsは自己複製能を持ち、骨髄(BM)由来の前駆細胞からほとんど独立しています(Schulzら、2012;Yonaら、2013;Gomez Perdigueroら、2015)。不安定な状態では、循環単球がKC集団を補充することができます(Hettingerら、2013;Scottら、2016)。
成熟したKCは、CD11やF4/80といった一連の共通のマクロファージ表面マーカーを共有しているが、マウスのKCは独自のマーカーであるC型レクチンドメインファミリー4メンバーF(CLEC4F)を発現する(Krenkel and Tacke, 2017; Li W. et al., 2022)。これらのKCは通常、肝類洞に生息し、そこで老化細胞や様々な腸由来の粒子と継続的に関わり、処理する。一般に、肝臓のKCは3つの主要な活動をしている:病原体やアポトーシスを受けた細胞のクリアランス(Toth and Thomas, 1992; Shi et al, 1996; Horst et al, 2021);抗原提示および炎症の誘導/制御(Liuら、2015;Yuら、2019;Zhangら、2021a;Niら、2021;Li W. ら、2022);および鉄、ビリルビンおよび脂質代謝(Scott and Guilliams, 2018; Diehlら、2020;Bleriotら、2021)と、多岐にわたっています。KCsは、肝ホメオスタシスの維持と肝損傷への対応の両方に不可欠である。
MoMφは、骨髄のCX3CR1+、CD117+、Lin-progenitors(common monocyte progenitors(cMoP)とも呼ばれる)から発生する(Foggら、2006; Hettingerら、2013)。MoMφは、一般的なマクロファージマーカーに加え、独自のCX3CR1およびCCR2マーカーを発現しています。マウスMoMφは、Ly6Cの発現レベルに応じて2つのサブセットに分化させることができる。Ly6C+細胞はケモカインによってリクルートされ、肝臓に浸潤し、そこで炎症促進活性を有するが、多くのLy6C-細胞はスカベンジャーおよび炎症のレギュレーターとして作用する(Carlinら、2013年;Moriasら、2015年;Krenkelら、2018年;Ambadeら、2019年)。CX3CR1+ Ly6C-常駐マクロファージの別のサブセットは、肝莢膜マクロファージ(LCM)として肝莢膜で同定されており、LPSなどの粒子状抗原と拡張樹状突起を有するカプセル内の細菌の両方を直接取り込むことができる。それらは循環単球によって補充され、好中球の浸潤を勧誘することができる(Sierro et al.、2017)。
古典的には、インターフェロンガンマ(IFN-γ)またはインターロイキン4(IL-4)刺激下でのマクロファージ極性化の観察により、それぞれ炎症性M1(主にTNF-αとIL-1βを分泌)および抗炎症性M2マクロファージ(主にIL-10を分泌)間の異なるバイオロジープロファイルが確認されている。(Murray and Wynn, 2011; Murray, 2017)。近年の理解の深まりとともに、肝マクロファージにおける炎症または解消の役割は、織り込み済みで急速に変容していることがわかった(Ramachandranら、2012年;Beattieら、2016年;Mossanenら、2016年)。一部の学者は、複雑な病理学的条件下で肝マクロファージの極性を明らかにする、より特異的かつ動的な方法が必要であると指摘している(Xueら、2014;Tacke、2017;Locatiら、2020)。しかし、肝マクロファージ極性に関する微生物制御のエビデンスは、まだそこまで進んでいない。マクロファージ極性化の古典的な概念は、機能的異質性の一般的な見方を示しており、ここでも肝マクロファージの特徴を説明するのに役立っている。
肝臓の炎症における肝マクロファージ
自然免疫系の一員として、肝マクロファージは肝炎の重要なイニシエーターであり、また肝炎に関与している。彼らは主に様々な傷害に対する炎症反応の引き金となりますが、重度の組織傷害や機能不全を引き起こすこともあります(Koyama and Brenner, 2017; Tacke, 2017; Locati et al., 2020)。
一般に、肝臓の炎症は、KCsとPAMPsおよび損傷関連分子パターン(DAMPs)を含む自然分子パターン(IMPs)との間の関与によって開始される(Dou et al., 2019; Li W. et al.、2022)。TLRなどのPRRは、損傷した肝細胞からの遊離DNAや高移動度グループボックス1(HMGB1)などのDAMPsの認識や、リポ多糖(LPS)、リポタンパク質、ペプチドグリカン(PGN)などのPAMPsの認識で重要な役割を果たす(武田ら、2003;竹内・明、2010;クマールら、2011)。IMPを認識すると、KCsは、炎症性シグナル伝達経路(例えば、NF-κB、PI3K/AKT)を介して炎症性物質(例えば、IL-1β、CCL2)を分泌し、下流の細胞(例えば、MoMφ、T細胞、および血管内皮細胞)を勧誘または活性化できる (Janeway and Medzhitov, 2002; Taylor et al., 2005; Wynn et al., 2013)。
MoMφは通常、肝炎の第2ステージに関与する。Ly6C+ MoMφは、CCL2のようなKCが分泌するケモカインによってリクルートされ、傷ついた肝臓に大量に浸潤して肝マクロファージを補充し、さらなる炎症に関与することができます。多くの炎症関連肝疾患において、Ly6C+ MoMφは強力な炎症性細胞として働き、多数のサイトカインを分泌して組織損傷を誘発する(Krenkelら、2018;Ambadeら、2019;Daiら、2020;Kolodziejczykら、2020)。Ly6C+ MoMφの採用を阻止するCCL2/CCR2シグナルの阻害は、肝炎の治療標的となり得る(Krenkelら, 2018; Ambadeら, 2019)。さらに、常駐するLy6C- MoMφのサブセットは、病原体を感知して好中球をリクルートする役割を担っています(Sierroら、2017年)。
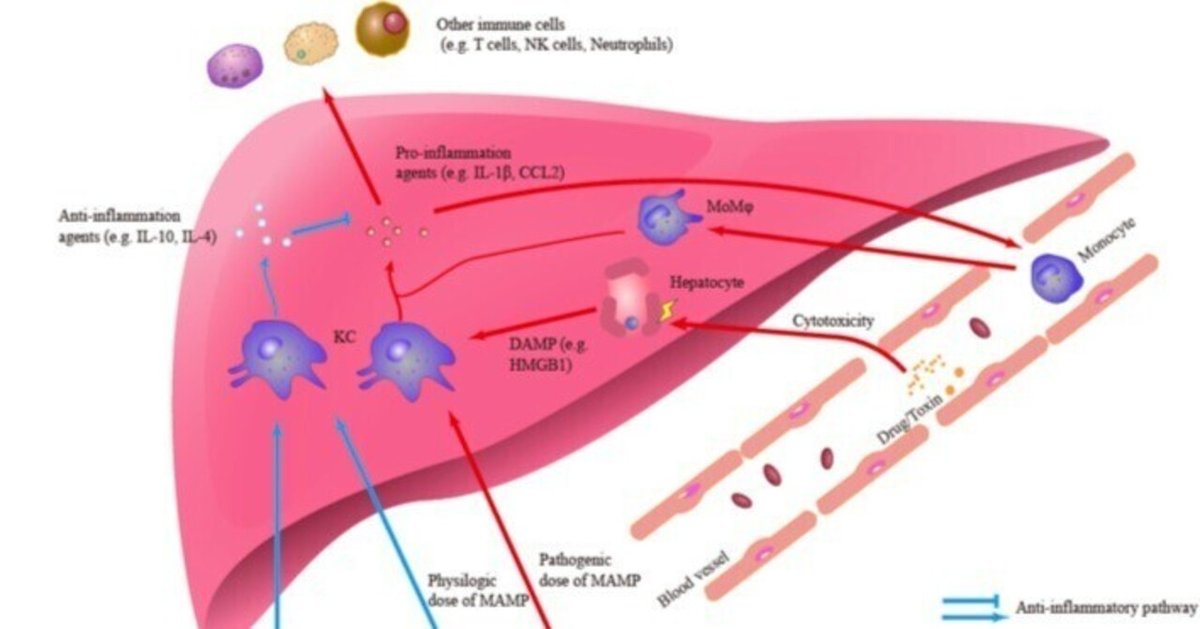
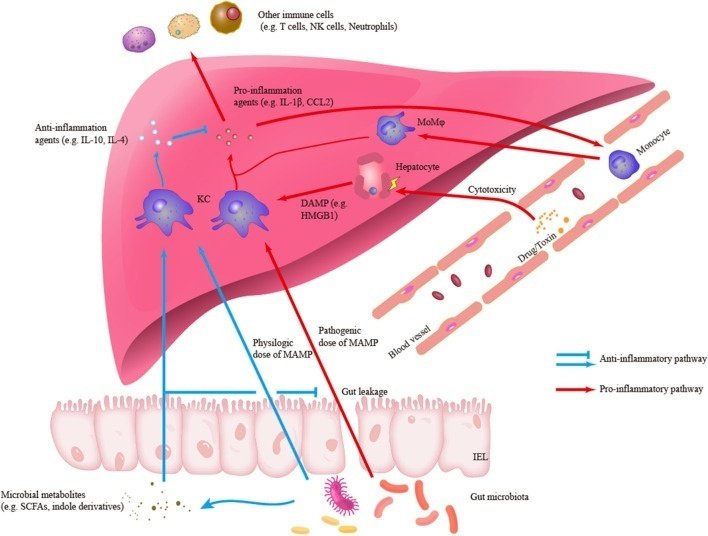
肝炎の解消や肝損傷の修復にも肝マクロファージは不可欠である。マクロファージの数が減少すると、肝細胞の増殖や組織の恒常性の回復が低下します(Tacke, 2017)。Ly6C- MoMφを含む抗炎症表現型の肝マクロファージは、切断型IL-1βなどの炎症促進物質のクリアランスを促進し、IL-4などの抗炎症および創傷治癒効果を有するサイトカインを放出できる(Mosser and Edwards, 2008; Kim and Nair, 2019; Starkey Lewis et al, 2020)。さらに、KCsは肝免疫寛容の確立において重要な構成要素である(Knolleら、1995; Chouら、2015; Doherty、2016)。KCsは、肝がんや急性肝損傷(ALI)において免疫抑制環境を維持するために、活性化することもIL-10を分泌することもできる(Erhardtら、2007; Wuら、2009)。一方、KCsは腸由来のLPS(低用量)に長期間さらされると、インターロイキン-1受容体関連キナーゼMの誘導により、自身のTLR4シグナル経路をダウンレギュレートすることができる。このLPS耐性は、腸-肝臓軸の恒常性維持に必要かもしれない (Liu et al., 2008). 最近の研究では、疾患関連抗原を含む高分子ナノ粒子で処理したKCsが、実験的自己免疫性脳脊髄炎(EAE)における免疫寛容を十分に媒介することも確認されている(Caseyら、2022年)。図1は、肝炎における肝マクロファージの役割の概要を示したものである。
図1
www.frontiersin.org
図1. 肝炎における肝マクロファージの役割の概要。クッパー細胞(KC)は、炎症性の損傷関連分子パターン(DAMP)や微生物関連分子パターン(MAMP)、あるいは抗炎症性のMAMPや微生物代謝物など、さまざまなシグナルに関与し応答することができる。炎症反応において、KCs は IL-1β や CCL2 などの炎症促進物質を分泌し、肝炎の発生や他の免疫細胞の肝浸潤に関与している。肝マクロファージのもう一つの主要なサブセットである単球由来マクロファージ(MoMφ)もまた、炎症性浸潤の重要な構成要素である。さらに、抗炎症反応において、KCsは抗炎症剤を分泌し、炎症シグナル伝達と反応を制御することができる。
炎症関連肝疾患における微生物制御標的としての肝マクロファージ
ヒトの腸には、宿主生理に重要な役割を果たす多数の常在微生物および外部微生物が存在する(Garrett, 2017; Zmora et al, 2019)。微生物成分や代謝物は、門脈系を介して遠隔臓器、特に肝臓に移行することができます(Cani, 2018; Albillos et al., 2020; Jones and Neish, 2020)。ユビオシスまたはディスバイオシスの条件下では、腸由来の微生物シグナルは肝臓に様々な影響を及ぼし、肝マクロファージは腸-肝臓軸の重要なプレイヤーとして作用する(Bruneauら、2021;De Muynckら、2021)。
肝マクロファージを刺激することができる様々な微生物成分の中で、最も典型的な薬剤はおそらくLPSである。腸内細菌は豊富なLPSのプールを構成しており、門脈系を介して継続的に肝マクロファージを刺激する。KCs上のLPS/TLR4シグナルは、エンドトキシンのトランスロケーションを感知し、様々な炎症反応の活性化を開始することができる(Janeway and Medzhitov, 2002; Krenkel and Tacke, 2017; Tripathi et al, 2018; Gu et al, 2021)。腸内細菌叢とエンドトキシンのトランスロケーションによって制御される受容体相互作用プロテインキナーゼ3(RIP3)シグナル伝達も、マクロファージ分泌炎症性物質の鍵となる(Zhang et al.、2020;Zhang et al.、2021b)。生理的な量のLPSは、免疫と耐性の両方の発達に不可欠であるが(Chouら、2015;Zhou W. ら、2022)、腸内細菌異常による過剰なエンドトキシンのトランスロケーションは、肝マクロファージの病原性の活性化を誘発する可能性がある。このような異常な活性化は、非アルコール性脂肪性肝疾患(NAFLD)(Liuら、2015;Wesolowskiら、2017;Hegazyら、2020)およびアルコール性肝疾患(ALD)(Inokuchiら、2011;Szabo、2015;Bajaj、2019)などの多くの肝臓疾患における有害な炎症過程を誘発すると考えられている。さらに、微生物DNAの転座は肝炎の一因となる。肝マクロファージのいくつかのサブセットは、微生物DNAの濃縮をクリアするために不可欠なバリアであるが、肥満はこのバリアを減らし、弱めることができる(Luoら、2021;Luoら、2022)。
プロバイオティクスが産生する一部の微生物代謝産物は、マクロファージの炎症活性化を制御する能力も有している。一般に、SCFAやインドール誘導体などの抗炎症作用を有する代謝産物は、腸内異臭や腸管バリアーを改善し、エンドトキシン転位による肝マクロファージの活性化を抑制できる(Bao他、2020;Wang Y. 他、2021;Xia他、2022)。具体的には、インドール処理は、6-ホスホフルクト-2-キナーゼ/フルクトース-2および6-ビフォスファターゼ3(PFKFB3)に依存する様式で肝マクロファージの炎症性活性化を阻害することができる(Maら、2020)。SCFAによる処理は、肺や脳などの他の組織におけるマクロファージの貪食を変化させ、炎症の調節につながることが判明した(Trompetteら、2014年;Ernyら、2021年)。
肝マクロファージおよび炎症関連肝疾患に影響を及ぼし得る微生物介入を、表1に結論付けた。このレビューの後続のセクションでは、様々な炎症関連肝疾患における腸内細菌叢と肝マクロファージのクロストークを具体的に説明する。その結果、肝マクロファージを標的とすることで、微生物病の治療効果が期待できることが示唆された。
表1
www.frontiersin.org
表1. 微生物介入と肝マクロファージおよび肝疾患への影響
急性肝障害
急性肝損傷(ALI)は、大規模な炎症反応と大規模な肝細胞壊死を特徴とする複数の原因の臨床症候群である(欧州肝臓学会ら、2017;StravitzとLee、2019)。ALIの実験モデルにおいて、肝マクロファージは一般的に疾患発症において共通の役割を担っています。傷害を感知し、サイトカインを放出し、肝組織に浸潤することにより、肝マクロファージは炎症の増悪または解消に重要な役割を果たす(Tacke、2017;Li W. et al.、2022)。
腸内細菌と肝マクロファージの両方がALIに重要であることが示された。薬剤、化学物質、エンドトキシン誘発ALIの疾患表現型は、広域抗生物質治療(ABX)の非存在下よりも存在下で、また、無菌(GF)マウスよりも非GFマウスでよりマイルドであることが明らかにされた。内因性微生物刺激の欠如は、肝臓の炎症とその後の組織傷害を改善することがわかった(Lin et al.) 単一細胞のトランスクリプトーム解析は、無傷のマイクロバイオームを有するマウスと比較して、マイクロバイオーム欠損マウスは、おそらくKCsにおけるTLRシグナルの抑制に起因するLy6C+単球の浸潤が著しく減少することを示した(Kolodziejczykら、2020年)。再灌流/虚血(IR)腸管モデルにおけるDAMPsと微生物関連分子パターン(MAMPs)の両方のトランスロケーションは、M1表現型へのKC極性を誘発し、HMGB1/TLR4/RAGE軸を介して肝炎につながることが分かった(Wen et al.、2020年)。一般的な常在菌であるビフィドバクテリウム・ロンガムおよびB・フラジリスは、in vitroでヒトTHP-1マクロファージから炎症性サイトカインIL-1bの分泌を誘導することが示され、腸内細菌-マクロファージ-ALI相互作用の可能性を示唆している(Shanmugamら、2015年)。また、肝細胞の直接損傷に起因するin situ DAMPsを除くすべての腸管由来MAMPsのトランスロケーションは、肝マクロファージを介してALIを悪化させることが明らかにされた。
逆に、微生物の介入は、ALIの動物モデルにおいて、肝マクロファージの活性を低下させることにより、肝炎を抑制することが示されている。アセトアミノフェン(APAP)誘発ALIのマウスをプロバイオティクスであるアッカーマンシア・ムチニフィラで前処理すると、単球/マクロファージマーカーF4/80およびLy6Gの低レベルによって免疫組織化学的に示され、続いてマクロファージ関連炎症性サイトカインの濃度が減少することから、腸漏れが改善し肝マクロファージの浸潤が減ることが分かった(Xiaら,2022年)。Lactobacillus salivarius Li01も、チオアセトアミド(TAA)誘発ALIのマウスに対して同様の効果を示した(Yangら、2020年)。さらに、L. acidophilus LA14は、マクロファージ炎症性タンパク質1a(MIP-1a)、MIP-3a、および単球化学誘引タンパク質-1(MCP-1)の濃度を下げることにより、d-ガラクトサミン(D-GalN)誘発ALIを軽減することがわかり、マクロファージの活性を下げることが示唆されました(Lv et al., 2021)。毒素誘発ALIを除き、Bifidobacterium animalis ssp. Lactis 420 (B. 420) は、肝マクロファージのRIP3シグナルを調節することにより、S100誘発実験的自己免疫肝炎(EAH)を緩和することが分かった(Zhang et al.、2020年)。さらに、イヌリン食は、糞便中のBacteroides acidifaciensの存在量および門脈中のそのSCFA、特にプロピオン酸(PA)の著しい増加を伴って、IR誘発ALIを改善することが示された(Kawasoe et al.、2022)。さらに、PA単独でもin vitroでHMGB-1/TLR4シグナルを介して活性化されたマクロファージを抑制するのに十分であった(Kawasoe et al.) 腸内細菌叢の代謝物である3,4-ジヒドロキシフェニルプロピオン酸は、IR誘発ALIにおいて同様の役割を果たすことが示された(Li R. et al.、2022年)。
マクロファージを用いた細胞療法は、炎症の解消を誘導するのに有効であることが示されている。例えば、in vitroで誘導したLyc6-マクロファージを中心とするM2マクロファージをマウスに投与すると、肝壊死が成立した後でも肝炎が有意に緩和され、肝細胞の増殖が促進されました。ヒト由来のM2マクロファージを免疫不全マウスに投与した場合も同様の効果が認められ、同様の治療法が臨床の場で有望視される可能性が示唆されました(Starkey Lewisら、2020年)。一方、最近の研究では、マクロファージの分極を制御する微生物介入の能力が示された。腫瘍形成を促進する病原性細菌と炎症を制御する有益な細菌の両方が、M2マクロファージ分極を誘導する能力があった(Liら、2019;Wang Y. ら、2020;Wang Z. ら、2020;Xuら、2021)。しかしながら、ALIの治療における微生物介入の根本的な作用機序を特定するために、さらなる研究が必要である。
非アルコール性脂肪性肝疾患
ライフスタイルや食生活の変化により、NAFLDなどの栄養/代謝の問題を抱える患者が増加しています(Younossi et al.、2018)。NAFLDは慢性的なプロセスであり、初期の脂肪症から始まり、亜急性肝炎を特徴とする進行した脂肪肝炎に至る(Schuster et al.、2018)。肝マクロファージは、脂肪酸の代謝を損ない、線維形成を開始する上で重要な役割を果たし(Tacke、2017;Friedmanら、2018)、腸-肝臓軸はNAFLDの発症に重要な貢献者である(Wesolowskiら、2017;Friedmanら、2018)。
高脂肪食(HFD)の投与は、NAFLD発症における基本的な特徴であるインスリン抵抗性と不顕性炎症を誘発するための一般的な実験的治療法である。ABX処理は、肝臓と脂肪組織の両方へのマクロファージ浸潤の有意な減少を伴う、HFD誘発炎症を軽減することができる。LPSおよびTLR4シグナル活性化の低減は、インスリン抵抗性の改善を伴う(Carvalhoら、2012;Yamadaら、2017)。HFDは、Vsig4+ KCsの数を減少させ、微生物叢由来の細胞外小胞(EV)を除去する能力を損なうことが示された(Luoら、2021年)。Vsig4-/-マウスの肝臓では、細菌DNAの顕著な蓄積が観察されており、このDNAは肝臓の炎症と肝星細胞(HSC)の線維化活性化に関与している(Luoら、2022年)。NAFLD患者60名と健常対照者40名の肝組織の生検では、KC活性化マーカーであるLPSとCD163のレベルが前者で高かった(Hegazy et al.、2020年)。NAFLDの進行とともにLPSとKC活性化が増加したことから、NAFLDの発症に腸管リーケージとマイクロバイオーム・マクロファージ軸が関与していることが確認されました(Hegazy et al.) さらに、メチオニン・コリン欠乏(MCD)食誘発NAFLDマウスでは、微生物の副産物である揮発性有機化合物(VOC)が門脈系を介して肝臓に移行することが明らかになりました(Reidら、2016年)。これらのVOCは肝マクロファージに毒性を示し、さらに炎症性サイトカインの放出を誘導しました(Reidら、2016年)。NAFLD患者34名を対象とした研究では、Faecalibacterium prausnitziiという細菌と門脈のKCの表面マーカーであるCD163+に陽性な細胞との間に負の相関が認められました(r = -0.371; p = 0.022)(Schwenger et al., 2018)。以上のことから、NAFLD/NASHの発症には、腸管由来の微生物成分と肝マクロファージのクロストークが重要であることが示唆されました。
抗炎症剤とマクロファージが微生物の介入を制御する能力は確立されている。例えば、熱殺(HK)または生きたラクトバチルス・ロイテリGMNL-263(Lr263)の投与は、HFD誘発の代謝障害および肝炎を逆転し、さらにMCP-1レベルおよび肝臓のマクロファージ浸潤を低減することが分かった(Hsiehら、2016年)。プレバイオティクスとして作用する食餌性フラクトオリゴ糖は、腸管バリアと腸管ユビオシスの回復、炎症とKC集団の減少に役立つことがわかった(Matsumoto et al.,2017)。イヌリン(Baoら、2020)、ナマコPearsonothuria graeffei由来のフコイダン(Liら、2018)、Sarcodon aspratus多糖(Chenら、2020)などの他のプレバイオティクスおよび機能性食品をHFDマウスに投与した場合、同様の効果が観察されました。これらの知見は、NAFLDにおけるプレバイオティクスまたは機能性食品の治療可能性が、微生物-肝マクロファージ軸への効果に一部起因していることを示唆するものであった。微生物代謝物であるインドールは、PFKFB3依存的にマクロファージの活性化を抑制することにより、HFDまたはMCD誘発NAFLDの重症度を緩和することが示された(Maら、2020;Zhu B.ら、2022)。さらに、GFモデルを用いた研究では、肥満児に生まれた2週齢の乳児(Inf-ObMB)マウスの糞便微生物叢をGFマウスに移植すると、低度の炎症とNAFLDへの感受性が生じることが明らかにされた。さらに、Inf-ObMBマウスの肝マクロファージは、腸管バリアの損傷、マクロファージの貪食、サイトカイン産生などの機能が損なわれていることが示された。これらの知見は、マイクロバイオーム-肝マクロファージ軸が、母親の肥満に関連する小児肥満およびNAFLDにおいて有力なプレーヤーとして作用することを示している(Soderborgら、2018年)。
肝臓のM1/M2マクロファージのバランスは、NAFLD進行における微生物介入の有望な標的である(Murray, 2017; Wang C. et al., 2021)。ビフィドバクテリウム・シュードカテニュレータムCECT 7765の補給は、M1/M2マクロファージのバランスを調節し、Treg集団を増加させることにより、肥満に関連する炎症を軽減することができます(Moya-Perezら、2015)。さらに、Lactobacillus paracaseiおよびL. pentosus strain S-PT84は、NAFLDマウスの腸内細菌症を改善し、M2マクロファージの割合を増加させ、炎症反応を緩和することが明らかになりました(Sohn et al., 2015; Sakai et al., 2020)。また、スリーブ胃瘻造設後に上昇する微生物代謝物、インドール-3-酢酸(I3A)は、in vivoおよびin vitroの両方でM2分化を促進し、肥満関連NAFLDを緩和することが明らかになりました(Wang Y. et al., 2021)。さらに、Clostridium butyricumと水溶性食物繊維の共投与は、TLR4/NF-κBシグナルを抑制することにより、肝臓のKCsの割合とM1マクロファージの活性化を減少させました(Shaoら、2022年)。
肝マクロファージは、抗炎症作用に加えて、オートファジー活性を有しており、NAFLDに影響を与える可能性がある。例えば、HFDはマクロファージオートファジーの障害を誘発し、マクロファージの極性をM1サブセットに偏らせるのに十分であることが分かった(Liu et al.) 一方、M2マクロファージの投与は、肝炎時のオートファジー活性を改善することがわかった(Starkey Lewisら、2020年)。このマクロファージ極性とオートファジーの相互作用は、長期的な微生物介入のターゲットとなる可能性があります。
アルコール性肝疾患
ALDは、世界で最も普及している慢性肝疾患であると考えられます(Rehmら、2013年、Seitzら、2018年)。肝マクロファージは、肝脂肪症から脂肪肝炎へのALDの進行に重要であることが示されています(Krenkel and Tacke, 2017; Tacke, 2017)。エタノール代謝による肝細胞への直接的な傷害に加えて、エタノール、腸-肝臓軸、ALDの密接な関係から、懸念が高まっています。アルコールによる腸の漏出および腸内細菌の異常は、細菌の転座の長期的な刺激とともに、肝マクロファージを活性化し、それによってALDの進行に寄与すると考えられる(Szabo, 2015; Tacke, 2017; Bajaj, 2019)。しかし、Duanらは、KCsの新規サブセットである肝臓のCRIg + マクロファージが、慢性アルコール前提の患者において減少していることを発見しました。さらなる研究は、CRIg +マクロファージが、おそらく細菌の転座を防ぐ能力により、エタノール誘発肝損傷からマウスを保護できることを示した(Duanら、2021年)。最近の包括的なレビュー(Bajaj, 2019)に示されているように、ディスバイオーシスはALDの患者において広く検証されている。一般に、ALD患者は、Bacteroidetesの存在量の減少、bifidobacterialの存在量の増加、およびエンドトキシン血症の増加と疾患進行との間の相関などのいくつかの共通の特徴を示す(Mutluら、2012年;Llopisら、2016年;Dubinkinaら、2017年;Ciocanら、2018年)。
腸管バリアを標的とする微生物介入は、微生物-肝マクロファージ軸を標的とする微生物介入と同様に、ALD患者において治療の可能性がある(Granderら、2018;Seoら、2020;Liら、2021)と思われる。例えば、ラクトバチルス・ラムノサスGG(LGG)の補充は、肝マクロファージの浸潤を有意に減少させ、ステトーシスおよび炎症を緩和することが判明した(Zhu Y. et al.、2022)。Pediococcus pentosaceus CGMCC 7049は、エタノール誘発性腸内環境異常を逆転させ、SCFAsの産生を高めることで、肝臓の炎症と単球/マクロファージのMIP-1およびMCP-1の分泌を軽減することがわかった(Jiangら、2020年)。腸内菌叢は、ALDにおける肝マクロファージとのクロストークも示している。例えば、マウスの慢性アルコール投与により、腸内真菌の過剰増殖とβ-グルカンの転位が認められ、β-グルカンはKCs上のC型レクチン様受容体(CLEC7A)を介して肝炎を増悪させることが明らかになった。抗真菌剤であるアンフォテリシンBによる治療は、このシグナル伝達を遮断し、ALDに関連する炎症を改善することができます(Yangら、2017年)。
これらの知見とは対照的に、最近の臨床研究では、標準治療と比較して、31人のALD患者をABXで7日間治療しても、LPS結合タンパク質(LBP)、肝マクロファージ活性化のマーカー、および全身の炎症レベルには影響がないことが分かった(Støy et al.、2021年)。このような矛盾は、腸管漏出と腸-微生物-肝マクロファージ軸が、確立したALDの患者において役割を低下させることを示したが、ALDにおける腸管漏出の役割を明らかにするためには、さらなる研究が必要である。
ウイルス性肝炎
HBV感染の慢性化は臨床上大きな問題であり、免疫寛容と活性化のバランスが関与していると考えられている。ウイルスクリアランスと寛容には、微生物-肝マクロファージ軸が関与していると考えられている。加齢に伴い免疫寛容から免疫活性化へと正常に発達するのとは対照的に、ABX投与は成体マウスのHBVクリアランスを阻害するが、TLR4変異若齢マウスは急速なHBVクリアランスを示した(Chou et al.、2015)。これらの知見は、KCにおける腸内細菌-TLR4シグナルの安定性と成熟度が、HBV免疫に重要な役割を果たすことを示唆した(Chou et al.、2015)。ABXによるディスバイオーシスは、T細胞の抑制につながるIL-10のKC分泌を誘導し、HBVクリアランスを阻害し、HBV感染の慢性化を促進することが明らかになった(Zhou W. et al.、2022)。これらの研究を総合すると、LPSなどの腸管由来微生物の成分による生理的刺激が、HBV感染に対する活性化KCsの発生と維持に不可欠であることがわかる。さらに、肝内骨髄系細胞のサブセットであるCD14+HLA-DRhiCD206+マクロファージは、転座した微生物成分によって活性化され、慢性ウイルス関連肝疾患における肝炎を促進することができる(Tan-Garciaら、2017年)。
まとめ
腸肝軸の評価により、肝臓における炎症反応は、アルコール、脂質、薬物などの様々な外部化学物質や腸内微生物による侵入により、一般的ではあるが厄介な健康問題であることが分かってきた。肝マクロファージは、肝臓のホメオスタシスや炎症に対する反応に重要な役割を果たすとともに、腸内細菌叢と密接な関係をもっている。肝マクロファージは、生理的な条件下では、腸由来の炎症シグナルを制御し、免疫寛容を維持することができる。しかし、腸内細菌の異常によって腸管バリアーが破壊されると、腸管由来の炎症性シグナルの移行が悪化する。この異常な曝露は、マクロファージに過剰な炎症性表現型を誘導し、炎症に関連する肝疾患の一因となる。したがって、抗生物質による細菌負荷の軽減やプレ/プロバイオティクスによる腸管バリアの改善などの微生物介入は、間接的に肝マクロファージの活性化や浸潤を緩和することができます。しかしながら、エンドトキシンのトランスロケーションを制御する微生物介入の臨床的能力は、いくつかの症例では依然として不明である。肝炎が確立している患者における微生物介入の臨床試験を追加する必要がある。さらに、いくつかの微生物代謝産物は、炎症性シグナル伝達を直接抑制したり、抗炎症表現型(例えば、M2細胞)に向かってマクロファージの極性を誘導したりする可能性を示している。マクロファージの炎症性表現型の制御は、特に慢性炎症反応における微生物介入の有力なターゲットである。図 2 は、主な経路の結論を示しています。
図2
www.frontiersin.org
図 2. 肝マクロファージおよび肝炎の炎症表現型に対する微生物介入の制御経路。
結論として、最近の研究では、肝マクロファージの炎症表現型に対する腸内細菌叢シグナルの重要性が指摘されています。肝マクロファージと腸内細菌叢のクロストークは、炎症反応を制御し、関連する肝疾患を緩和する有望なターゲットである。
著者協力
構想、XPとZZ、執筆、原案作成、ZZ、執筆、レビュー、編集、LL、可視化、ZZとXP、監督、LL。すべての著者が本原稿を読み、同意している。
資金提供
著者は、提出された研究のために受けたすべての資金源を申告している。
謝辞
編集者と査読者の洞察に満ちたコメントと提案に感謝する。
利益相反
著者は、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
出版社からのコメント
本論文で述べられたすべての主張は、著者個人のものであり、必ずしも所属団体、出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品,あるいはそのメーカーによる主張は,出版社によって保証または承認されたものではありません.
参考文献
Albillos, A., de Gottardi, A., and Rescigno, M. (2020). 肝疾患における腸-肝臓軸。治療のための病態生理学的基礎。J. Hepatol. 72 (3), 558-577. doi:10.1016/j.jhep.2019.10.003.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Ambade, A., Lowe, P., Kodys, K., Catalano, D., Gyongyosi, B., Cho, Y., et al.(2019年)。CCR2/5シグナルの薬理学的阻害は、マウスにおけるアルコール誘発性肝障害、脂肪症、および炎症を予防および逆転させる。ヘパトロジー 69 (3), 1105-1121. doi:10.1002/hep.30249
PubMed Abstract|CrossRef Full Text|Google Scholar
バジャジ、J.アルコール、肝疾患、腸内細菌叢。Nat. Rev. Gastroenterol. Hepatol. 16 (4), 235-246. doi:10.1038/s41575-018-0099-1
PubMed Abstract|CrossRef Full Text|Google Scholar
Bao, T., He, F., Zhang, X., Zhu, L., Wang, Z., Lu, H.、他(2020年)。イヌリンは、マウスにおいて、腸内マイクロバイオームを調節し、腸-肝臓Axisを介してリポポリサッカライド-Toll様受容体4-mψ-核因子-κb-Nod様受容体タンパク質3経路の抑制を介して非アルコール性脂肪性肝疾患に有益な効果を発揮する。Front. Pharmacol. 11, 558525.
PubMed Abstract|CrossRef Full Text|Google Scholar
Beattie, L., Sawtell, A., Mann, J., Frame, T. C. M., Teal, B., de Labastida Rivera, F., and al. (2016). 骨髄由来および肝臓常在マクロファージは、ユニークなトランスクリプトームシグネチャーを示すが、生物学的機能は類似している。J. Hepatol. 65 (4), 758-768.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Bleriot, C., Barreby, E., Dunsmore, G., Ballaire, R., Chakarov, S., Ficht, X., et al.(2021年)。クッパー細胞のサブセットは、CD36の発現を介して代謝を制御している。Immunity 54 (9), 2101-2116.e6. doi:10.1016/j.immuni.2021.08.006
PubMed Abstract|CrossRef Full Text|Google Scholar
Bruneau, A., Hundertmark, J., Guillot, A., and Tacke, F. (2021). 肝疾患の進行における腸肝軸の分子的・細胞的メディエーター。Front. Med. 8, 725390.
PubMed Abstract|CrossRef Full Text|Google Scholar
カニ、P. D. (2018). ヒトの腸内マイクロバイオーム。希望、脅威、約束。ガット 67 (9), 1716-1725. doi:10.1136/gutjnl-2018-316723.
PubMed Abstract|CrossRef Full Text|Google Scholar
Carlin, L. M., Stamatiades, E. G., Auffray, C., Hanna, R. N., Glover, L., Vizcay-Barrena, G.、他 (2013). Nr4a1依存性Ly6C(low)単球は内皮細胞を監視し、その廃棄を組織化する。この論文では、このような問題意識を持っている。
PubMed Abstract|CrossRef Full Text|Google Scholar
Carvalho, B. M., Guadagnini, D., Tsukumo, D. M. L., Schenka, A. A., Latuf-Filho, P., Vassallo, J.、他 (2012). 抗生物質による腸内細菌叢のモジュレーションは、高脂肪食マウスのインスリンシグナルを改善する。糖尿病学 55 (10), 2823-2834.
PubMed Abstract|CrossRef Full Text|Google Scholar
ケイシー・L・M・ヒューズ・K・R・サンダース・M・N・ミラー・S・D・ピアソン・R・M・シア・L・D・(2022年). ナノ粒子による抗原特異的免疫寛容におけるクッパー細胞および肝類洞内皮細胞の機構的寄与。バイオマテリアルズ 283, 121457.
PubMed Abstract|CrossRef Full Text|Google Scholar
Chen, J., Liu, J., Yan, C., Zhang, C., Pan, W., Zhang, W.、他 (2020). Sarcodon aspratus多糖類は、高脂肪食を与えたマウスの肥満誘発性代謝障害を改善し、腸内細菌叢のディスバイオーシスを調節した。Food Funct. 11 (3), 2588-2602.
PubMed Abstract|CrossRef Full Text|Google Scholar
Chou, H. H., Chien, W. H., Wu, L. L., Cheng, C. H., Chung, C. H., Horng, J. H., et al.(2015)。B型肝炎ウイルス感染の加齢に伴う免疫クリアランスは、腸内細菌叢の確立を必要とする。Proc. Natl.Acad. Sci. U. S. A. 112 (7), 2175-2180. doi:10.1073/pnas.1424775112.
PubMed Abstract|CrossRef Full Text|Google Scholar
Ciocan, D., Voican, C. S., Wrzosek, L., Hugot, C., Rainteau, D., Humbert, L., et al. (2018). アルコール性肝炎における胆汁酸のホメオスタシスと腸内環境の異変. Aliment. Pharmacol. Ther. 48 (9), 961-974. doi:10.1111/apt.14949
PubMed Abstract | CrossRef Full Text | Google Scholar
Dai, S., Liu, F., Qin, Z., Zhang, J., Chen, J., Ding, W. X., et al.(2020年)。クッパー細胞はCXCL10を産生し、肝類洞内皮細胞の透過性を制限することでT細胞性肝炎を促進する。Theranostics 10 (16), 7163-7177. doi:10.7150/thno.44960
PubMed Abstract|CrossRef Full Text|Google Scholar
De Muynck, K., Vanderborght, B., Van Vlierberghe, H., and Devisscher, L. (2021). 慢性肝疾患における腸-肝臓軸。マクロファージの視点。セルズ 10 (11), 2959.
PubMed Abstract|CrossRef Full Text|Google Scholar
Deppermann, C., Peiseler, M., Zindel, J., Zbytnuik, L., Lee, W. Y., Pasini, E., et al.(2021)。タクロリムスは菌血症を制御するクッパー細胞能力を損なう。移植レシピエントはなぜ感染しやすいのか。ヘパトロジー 73 (5), 1967-1984.doi:10.1002/hep.31499
PubMed Abstract|CrossRef Full Text|Google Scholar
Diehl, K. L., Vorac, J., Hofmann, K., Meiser, P., Unterweger, I., Kuerschner, L., et al.(2020)。クッパー細胞は遊離脂肪酸を感知し、高脂肪食や炎症における肝脂質代謝を制御する。Cells 9 (10), 2258.doi:10.3390/cells9102258。
PubMed Abstract|CrossRef Full Text|Google Scholar
ドハティ、D. G. (2016). 肝臓における免疫、寛容、自己免疫。A comprehensive review. J. Autoimmun. 66, 60-75. doi:10.1016/j.jaut.2015.08.020
PubMed Abstract|CrossRef Full Text|Google Scholar
Dou, L., Shi, X., He, X., and Gao, Y. (2019). 肝障害におけるマクロファージの表現型と機能。Front. Immunol. 10, 3112. doi:10.3389/fimmu.2019.03112
PubMed Abstract|CrossRef Full Text|Google Scholar
Duan, Y., Chu, H., Brandl, K., Jiang, L., Zeng, S., Meshgin, N., et al. (2021). 肝臓マクロファージ上のCRIgは、病原体を除去し、アルコール性肝疾患から保護する。Nat. Commun. 12 (1), 7172. doi:10.1038/s41467-021-27385-3
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Dubinkina, V. B., Tyakht, A. V., Odintsova, V. Y., Yarygin, K. S., Kovarsky, B. A., Pavlenko, A. V., et al.(2017)。腸内細菌叢の組成とアルコール依存症症候群およびアルコール性肝疾患との関連性。マイクロバイオーム 5 (1), 141. doi:10.1186/s40168-017-0359-2
PubMed Abstract|CrossRef Full Text|Google Scholar
Erhardt, A., Biburger, M., Papadopoulos, T., and Tiegs, G. (2007).(エルハルト、A、ビバーガー、M、パパドプロス、T、およびティグス)。IL-10、制御性T細胞、およびクッパー細胞は、マウスのコンカナバリンA誘発肝損傷における耐性を媒介する。このような場合、「肝障害」「肝硬変」「肝疾患」の3つのカテゴリーに分類される。
PubMed Abstract|CrossRef Full Text|Google Scholar
Erny, D., Dokalis, N., Mezö, C., Castoldi, A., Mossad, O., Staszewski, O., et al.(2021)。微生物叢由来の酢酸は、健康時および疾患時の脳自然免疫系の代謝的なフィットネスを可能にする。セル・メタブ. 33 (11), 2260-2276.e7. doi:10.1016/j.cmet.2021.10.010
PubMed Abstract|CrossRef Full Text|Google Scholar
Fogg, D. K., Sibon, C., Miled, C., Jung, S., Aucouturier, P., Littman, D. R., et al.(2006)。マクロファージと樹状細胞に特異的なクローン原性骨髄前駆細胞。サイエンス 311 (5757), 83-87.
PubMed Abstract|CrossRef Full Text|Google Scholar
Friedman, S. L., Neuschwander-Tetri, B. A., Rinella, M., and Sanyal, A. J. (2018). NAFLD発症のメカニズムと治療戦略. Nat. Med. 24 (7), 908-922. doi:10.1038/s41591-018-0104-9
PubMed Abstract|CrossRefフルテキスト|Google Scholar
ギャレット、W. S. (2017). 2016年の腸内細菌叢。腸内細菌叢研究のバナーイヤー。Nat. Rev. Gastroenterol. Hepatol. 14 (2), 78-80. doi:10.1038/nrgastro.2016.207
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Gomez Perdiguero, E., Klapproth, K., Schulz, C., Busch, K., Azzoni, E., Crozet, L., and al. (2015). 組織常在マクロファージは卵黄嚢由来の赤血球・骨髄系前駆細胞に由来する。ネイチャー518(7540)、547-551.doi:10.1038/nature13989
PubMed Abstract|CrossRef Full Text|Google Scholar
Gordon, S., Plüddemann, A., and Martinez Estrada, F. (2014). 組織におけるマクロファージの異質性。表現型の多様性と機能. Immunol. Rev. 262 (1), 36-55. doi:10.1111/imr.12223.
PubMed Abstract|RefRef Full Text|Google Scholar
Gordon, S., and Taylor, P. R. (2005). 単球とマクロファージの異種性。Nat. Rev. Immunol. 5 (12), 953-964.
PubMed Abstract|CrossRef Full Text|Google Scholar
Grander, C., Adolph, T. E., Wieser, V., Lowe, P., Wrzosek, L., Gyongyosi, B., and al. (2018). エタノールによるAkkermansia muciniphilaの枯渇の回復は、アルコール性肝疾患を改善する。ガット 67 (5), 891-901. doi:10.1136/gutjnl-2016-313432
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Gu, Y.-L., Xiao, L.-L., Li, D.-J., Liu, Y.-N., Zhu, C.-J., and Zhang, S.-J. (2021). マクロファージ遊走阻止因子の遺伝子ノックアウトまたは阻害は、炎症反応の抑制を介してリポポリサッカライド誘発性肝障害を軽減する。Hepatobiliary Pancreat. Dis. 20 (5), 469-477.
PubMed Abstract|CrossRef Full Text|Google Scholar
Hegazy, M. A., Mogawer, S. M., Alnaggar, A., Ghoniem, O. A., and Abdel Samie, R. M. (2020).血清LPSとCD163の比較。血清LPSおよびCD163バイオマーカーは、NASHを有する過体重患者における腸内細菌の役割を確認する。Diabetes Metab. Syndr. Obes. 13, 3861-3872.doi:10.2147/DMSO.S249949
PubMed Abstract|CrossRef Full Text|Google Scholar
Hettinger, J., Richards, D. M., Hansson, J., Barra, M. M., Joschko, A. C., Krijgsveld, J., et al.(2013)。単球とマクロファージの起源は、コミットされた前駆細胞である。Nat. Immunol. 14 (8), 821-830.
PubMed Abstract|CrossRef Full Text|Google Scholar
Hoeffel, G., Chen, J., Lavin, Y., Low, D., Almeida, F. F., See, P., et al.(2015年)。C-Myb(+)赤血球骨髄系前駆細胞由来の胎児単球は、成体の組織常在マクロファージを生み出す。免疫 42 (4), 665-678. doi:10.1016/j.immuni.2015.03.011
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Horst, A. K., Tiegs, G., and Diehl, L. (2019). マクロファージのエフェロサイトーシスの肝ホメオスタシスおよび疾患への寄与。Front. Immunol. 10, 2670. doi:10.3389/fimmu.2019.02670.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Hsieh, F. C., Lan, C. C., Huang, T. Y., Chen, K. W., Chai, C. Y., Chen, W. T., et al.(2016)。高脂肪食誘発肥満ラットの代謝機能改善に対して、加熱殺菌したラクトバチルス・ロイテリGMNL-263と生きたラクトバチルス・ロイテリが同様の効果を示す。Food Funct. 7 (5), 2374-2388. doi:10.1039/c5fo01396h
PubMed Abstract|CrossRef Full Text|Google Scholar
井口 聡、塚本 浩、Park, E., Liu, Z.-X., Brenner, D. A., and Seki, E. (2011). Toll-like receptor 4 は、マウスの骨髄由来肝細胞および内因性肝細胞を介してアルコール誘発性脂肪肝炎を媒介する。Alcohol. Clin. Exp. 35, 1509-1518.
PubMed Abstract|CrossRef Full Text|Google Scholar
Janeway, C. A., and Medzhitov, R. (2002). 自然免疫認識。Annu. Rev. Immunol. 20 (1), 197-216. doi:10.1146/annurev.immunol.20.083001.084359.
PubMed Abstract | CrossRef Full Text | Google Scholar
Jiang, X. W., Li, Y. T., Ye, J. Z., Lv, L. X., Yang, L. Y., Bian, X. Y., 他 (2020). ペディオコッカス・ペントサセウスの新菌株は、腸内細菌叢と短鎖脂肪酸代謝の調節によりエタノール誘発性肝障害を緩和する。World J. Gastroenterol. 26 (40), 6224-6240.
PubMed Abstract|CrossRef Full Text|Google Scholar
Jones, R. M., and Neish, A. S. (2020). 腸および肝臓疾患における腸内細菌叢。Annu. Rev. Pathol. 16, 251-275. doi:10.1146/annurev-pathol-030320-095722
PubMed Abstract | CrossRef Full Text | Google Scholar
川添淳一、内田康夫、川本浩司、宮内敏昭、渡辺敏昭、嵯峨宏一、他 (2022). イヌリン食によって腸内に誘導されたプロピオン酸は、炎症を抑制し、マウスの肝虚血・再潅流障害を改善する。Front. Immunol. 13, 862503. doi:10.3389/fimmu.2022.862503
PubMed Abstract|CrossRef Full Text|Google Scholar
Kim, S. Y., and Nair, M. G. (2019). 創傷治癒におけるマクロファージ。活性化と可塑性。Immunol. Cell Biol. 97 (3), 258-267. doi:10.1111/imcb.12236
PubMed Abstract|CrossRef Full Text|Google Scholar
Knolle, P., Schlaak, J., Uhrig, A., Kempf, P., Meyer zum Buschenfelde, K. H., and Gerken, G. (1995). ヒト・クッパー細胞はリポポリサッカライド(LPS)チャレンジに応答してIL-10を分泌する。J. Hepatol. 22 (2), 226-229. doi:10.1016/0168-8278(95)80433-1
PubMed Abstract|CrossRef Full Text|Google Scholar
Kolodziejczyk, A. A., Federici, S., Zmora, N., Mohapatra, G., Dori-Bachash, M., Hornstein, S., et al.(2020年)。急性肝不全は、MYCとマイクロバイオーム依存性のプログラムによって制御されている。Nat. Med. 26 (12), 1899-1911。doi:10.1038/s41591-020-1102-2。
PubMed Abstract|CrossRef Full Text|Google Scholar
小山 陽子、およびブレナー D. A. (2017). 肝臓の炎症と線維化. J. Clin. Invest. 127 (1), 55-64. doi:10.1172/JCI88881
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Krenkel, O., Puengel, T., Govaere, O., Abdallah, A. T., Mossanen, J. C., Kohlhepp, M., and al. (2018). 炎症性単球のリクルートメントの治療的阻害は、脂肪肝炎と肝線維症を軽減する。ヘパトロジー 67 (4), 1270-1283.doi:10.1002/hep.29544
PubMed Abstract|CrossRef Full Text|Google Scholar
Krenkel, O., and Tacke, F. (2017). 組織のホメオスタシスと疾患における肝臓マクロファージ。Nat. Rev. Immunol. 17 (5), 306-321. doi:10.1038/nri.2017.11
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Kumar, H., Kawai, T., and Akira, S. (2011). 自然免疫系による病原体認識。Int. Rev. Immunol. 30 (1), 16-34. doi:10.3109/08830185.2010.529976.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Li, H., Shi, J., Zhao, L., Guan, J., Liu, F., Huo, G., et al.(2021)。ラクトバチルス・プランタラム KLDS1.0344 とラクトバチルス・アシドフィルス KLDS1.0901 混合物は、腸管バリアの保護と腸内細菌叢および肝臓関連経路の調節により、マウスの慢性アルコール肝損傷を予防します。J. Agric. Food Chem. 69 (1), 183-197. doi:10.1021/acs.jafc.0c06346
PubMed Abstract|CrossRef Full Text|Google Scholar
Li, R., Xie, L., Li, L., Chen, X., Yao, T., Tian, Y.、他 (2022a). 腸内細菌代謝物、3, 4-ジヒドロキシフェニルプロピオン酸は、マウスのマクロファージ炎症性活性の緩和を介して肝虚血/再灌流障害を緩和する。Acta Pharm. Sin. B 12 (1), 182-196. doi:10.1016/j.apsb.2021.05.029
PubMed Abstract|CrossRef Full Text|Google Scholar
Li, R., Zhou, R., Wang, H., Li, W., Pan, M., Yao, X., et al(2019)。腸内細菌が刺激するカテプシンKの分泌は、TLR4依存性のM2マクロファージの分極を仲介し、大腸癌の腫瘍転移を促進します。セルデス・ディファー. 26 (11), 2447-2463. doi:10.1038/s41418-019-0312-y
PubMed Abstract|CrossRef Full Text|Google Scholar
Li, S., Li, J., Mao, G., Wu, T., Hu, Y., Ye, X., et al.(2018)。よく再現された構造を持つナマコPearsonothuria graeffei由来のフコイダンは、HFD給餌マウスの腸内細菌叢ディスバイオシスおよび代謝症候群を緩和する。Food Funct. 9 (10), 5371-5380.
PubMed Abstract|CrossRef Full Text|Google Scholar
李、W.、張、N.、および李、L.(2022b)。肝損傷におけるクッパー細胞の異質性と機能。Front. Immunol. 13, 940867.論文番号: 10.3389/fimmu.2022.940867.
PubMed Abstract|CrossRef Full Text|Google Scholar
Lin, Y., Yu, L. X., Yan, H. X., Yang, W., Tang, L., Zhang, H. L.、他 (2012). 腸管由来リポポリサッカライドはToll様受容体4を介してマウスのT細胞性肝炎を促進する。Cancer Prev. 5 (9), 1090-1102. doi:10.1158/1940-6207.CAPR-11-0364
PubMed Abstract|CrossRef Full Text|Google Scholar
Liu, K., Zhao, E., Ilyas, G., Lalazar, G., Lin, Y., Haseeb, M., et al.(2015)。マクロファージのオートファジーの障害は、炎症性マクロファージの極性を促進することにより、肥満マウスの免疫応答を増加させる。オートファジー 11 (2), 271-284. doi:10.1080/15548627.2015.1009787
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Liu, Z.-J., Yan, L.-N., Li, X.-H., Xu, F.-L., Chen, X.-F., You, H.-B., etc. (2008). IRAK-Mのアップレギュレーションは、クッパー細胞において低用量のリポポリサッカライドによって誘導されるエンドトキシン耐性に必須である。J. Surg. このような場合、「臓器移植」を行う必要がある。
PubMed Abstract|CrossRef Full Text|Google Scholar
Llopis, M., Cassard, A. M., Wrzosek, L., Boschat, L., Bruneau, A., Ferrere, G., et al.(2016)。腸内細菌叢はアルコール性肝疾患に対する個人の感受性に寄与している。ガット 65 (5), 830-839. doi:10.1136/gutjnl-2015-310585
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Locati, M., Curtale, G., and Mantovani, A. (2020). マクロファージ可塑性の多様性、メカニズム、および意義。Annu. Rev. Pathol. 15 (1), 123-147. doi:10.1146/annurev-pathmechdis-012418-012718
PubMed Abstract | CrossRef Full Text | Google Scholar
Luo, Z., Ji, Y., Gao, H., Gomes Dos Reis, F. C., Bandyopadhyay, G., Jin, Z., et al.(2021)。CRIg(+)マクロファージは、腸内細菌DNA含有細胞外小胞による組織炎症とインスリン抵抗性を予防する。Gastroenterology 160 (3), 863-874. doi:10.1053/j.gastro.2020.10.042
PubMed Abstract|CrossRef Full Text|Google Scholar
Luo, Z., Ji, Y., Zhang, D., Gao, H., Jin, Z., Yang, M., et al.(2022)。微生物DNAの濃縮は、非アルコール性脂肪性肝炎の経過における肝脂肪および線維化を促進する。Acta Physiol. 235 (3), e13827.
PubMed Abstract|CrossRef Full Text|Google Scholar
Lv, L., Yao, C., Yan, R., Jiang, H., Wang, Q., Wang, K., et al.(2021)。ラクトバチルス・アシドフィルスLA14は肝障害を緩和する。
PubMed Abstract|CrossRef Full Text|Google Scholar
Ma, L., Li, H., Hu, J., Zheng, J., Zhou, J., Botchlett, R.、他(2020年)。インドールは、骨髄系細胞の6-ホスホフルクト-2-キナーゼ/フルクトース-2、6-ビホスファターゼ3が関与する方法で、食事誘発性肝脂肪症および炎症を緩和する。肝細胞の6-ホスホフルクト-2-キナーゼとフルクトース-2, 6-ビフォスファターゼ3が関与する肝脂肪症の病態を明らかにした。
PubMed Abstract|CrossRef Full Text|Google Scholar
Mass, E., Ballesteros, I., Farlik, M., Halbritter, F., Gunther, P., Crozet, L., et al.(2016)。器官形成における組織常在マクロファージの仕様。サイエンス 353 (6304), aaf4238. doi:10.1126/science.aaf4238
PubMed Abstract|CrossRef Full Text|Google Scholar
松本 圭一、市村 正人、常山 圭一、森時 祐子、綱島 宏、大曲 圭一、他 (2017). 非アルコール性脂肪肝炎のメチオニン・コリン欠損マウスモデルにおけるフラクトオリゴ糖と腸管バリア機能. PLoS One 12 (6), e0175406. doi:10.1371/journal.pone.0175406
PubMed Abstract|CrossRef Full Text|Google Scholar
Morias, Y., Abels, C., Laoui, D., Van Overmeire, E., Guilliams, M., Schouppe, E., et al.(2015)。Ly6C-単球は、病原性Ly6C+単球のマクロファージへの分化を誘導することにより、寄生虫による肝炎を制御している。PLoS Pathog. 11 (5), e1004873. doi:10.1371/journal.ppat.1004873
PubMed Abstract|CrossRef Full Text|Google Scholar
Mossanen, J. C., Krenkel, O., Ergen, C., Govaere, O., Liepelt, A., Puengel, T., and al. (2016). ケモカイン(C-Cモチーフ)受容体2陽性単球は、アセトアミノフェン誘発性急性肝障害の初期段階を悪化させる。ヘパトロジー 64 (5), 1667-1682.doi:10.1002/hep.28682
PubMed Abstract|CrossRef Full Text|Google Scholar
Mosser, D. M., and Edwards, J. P. (2008). マクロファージ活性化の全領域を探索する。Nat. Rev. Immunol. 8 (12), 958-969.
PubMed Abstract | CrossRef Full Text | Google Scholar
Moya-Perez、A.、Neef、A.、Sanz、Y. (2015). Bifidobacterium pseudocatenulatum CECT 7765は、高脂肪食摂取マウスにおいてリンパ球-マクロファージバランスと腸内細菌叢構造を回復させることにより、肥満に関連する炎症を抑制する。PLoS One 10 (7), e0126976.doi:10.1371/journal.pone.0126976.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
マレー、P. J. (2017). マクロファージの極性化。Annu. Rev. Physiol. 79 (1), 541-566. doi:10.1146/annurev-physiol-022516-034339
PubMed Abstract|クロスリファレンス|Google Scholar
Murray, P. J., and Wynn, T. A. (2011). マクロファージサブセットの防御および病原性機能。Nat. Rev. Immunol. 11 (11), 723-737.
PubMed Abstract|CrossRef Full Text|Google Scholar
Mutlu, E. A., Gillevet, P. M., Rangwala, H., Sikaroodi, M., Naqvi, A., Engen, P. A., et al.(2012)。アルコール依存症では大腸マイクロバイオームが変化する。Am. J. Physiol. Gastrointest. 302 (9), G966-G978. doi:10.1152/ajpgi.00380.2011
PubMed Abstract|CrossRefフルテキスト|Google Scholar
永田 聡(2018).アポトーシスとアポトーシス細胞のクリアランス. Annu. Rev. Immunol. 36 (1), 489-517. doi:10.1146/annurev-immunol-042617-053010
PubMed Abstract|クロスリファレンス全文|Google Scholar
Ni, M., Zhang, J., Sosa, R., Zhang, H., Wang, H., Jin, D., et al.(2021)。T細胞免疫グロブリンおよびムチンドメイン含有タンパク質-4は、肝虚血再灌流障害の活性化と解消におけるクッパー細胞の恒常性維持機能に重要である。肝炎74 (4), 2118-2132.
PubMed Abstract|CrossRef Full Text|Google Scholar
Ramachandran, P., Pellicoro, A., Vernon, M. A., Boulter, L., Aucott, R. L., Ali, A., et al.(2012)。Ly-6Cの差次的な発現は、マウス肝線維症の退縮を指揮するリクルートマクロファージの表現型を同定する。Proc. Natl. Acad. Sci. U. S. A. 109 (46), E3186-E3195.
PubMed Abstract | CrossRef Full Text | Google Scholar
Rehm, J., Samokhvalov, A. V., and Shield, K. D. (2013). アルコール性肝疾患の世界的負担。J. Hepatol. 59 (1), 160-168.
PubMed Abstract|CrossRef Full Text|Google Scholar
Reid, D. T., McDonald, B., Khalid, T., Vo, T., Schenck, L. P., Surette, M. G., et al.(2016)。マウス非アルコール性脂肪肝疾患における門脈循環中のユニークな微生物由来揮発性有機化合物。Biochim. Biophys. アクタ 1862 (7), 1337-1344. doi:10.1016/j.bbadis.2016.04.005
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Sakai, Y., Arie, H., Ni, Y., Zhuge, F., Xu, L., Chen, G.、他 (2020).L., Y., Arie, H., Ni, Y., Zhuge, F., Xu, L., 陳、他 (2020). Lactobacillus pentosus株S-PT84は腸管透過性を維持することにより脂肪肝炎を改善する。J. Endocrinol. 247 (2), 169-181. doi:10.1530/JOE-20-0105
PubMed Abstract|CrossRef Full Text|Google Scholar
Schulz, C., Gomez Perdiguero, E., Chorro, L., Szabo-Rogers, H., Cagnard, N., Kierdorf, K.他 (2012).K., Schulz, C., Gomez Perdiguero, E., Chorro, L., Cagnard, N., K., 他 (2012). Mybや造血幹細胞から独立した骨髄系細胞の系譜。サイエンス 336 (6077), 86-90.
PubMed Abstract|CrossRef Full Text|Google Scholar
Schuster, S., Cabrera, D., Arrese, M., and Feldstein, A. E. (2018). NASHにおける炎症のトリガーと解消。Nat. Rev. Gastroenterol. Hepatol. 15 (6), 349-364. doi:10.1038/s41575-018-0009-6
PubMed Abstract|CrossRef Full Text|Google Scholar
Schwenger, K. J. P., Chen, L., Chelliah, A., Da Silva, H. E., Teterina, A., Comelli, E. M., et al. (2018). 活性化炎症細胞のマーカーは、非アルコール性脂肪性肝疾患の成人における疾患の重症度および腸内細菌叢と関連している。Int. J. Mol. Med. 42 (4), 2229-2237. doi:10.3892/ijmm.2018.3800.
PubMed Abstract|CrossRef Full Text|Google Scholar
Scott, C. L., and Guilliams, M. (2018). 肝の鉄および脂質代謝におけるクッパー細胞の役割。J. Hepatol. 69 (5), 1197-1199. doi:10.1016/j.jhep.2018.02.013
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Scott, C. L., Zheng, F., De Baetselier, P., Martens, L., Saeys, Y., De Prijck, S., et al(2016)。骨髄由来の単球は、自己複製と完全分化したクッパー細胞を生じさせる。Nat. Commun. 7 (1), 10321.doi:10.1038/ncomms10321
PubMed Abstract|CrossRef Full Text|Google Scholar
Seitz, H. K., Bataller, R., Cortez-Pinto, H., Gao, B., Gual, A., Lackner, C., et al. (2018). アルコール性肝疾患。Nat. Rev. Dis. プリム. 4 (1), 16. doi:10.1038/s41572-018-0014-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Seo, B., Jeon, K., Moon, S., Lee, K., Kim, W.-K., Jeong, H., et al.(2020).。Roseburia spp.の存在量は、ヒトのアルコール摂取と関連し、その投与はマウスのアルコール性脂肪肝を改善する。セルホストマイクロビー 27 (1), 25-40. doi:10.1016/j.chom.2019.11.001
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Shanmugam, N. K., Chen, K., and Cherayil, B. J. (2015). マクロファージが分泌するコメンサル細菌誘発性インターロイキン1β(IL-1β)は、骨形成タンパク質シグナル伝達経路を活性化することにより、肝細胞のヘプシジン発現をアップレギュレートする。J. Biol. Chem. 290 (51), 30637-30647.
PubMed Abstract|CrossRef Full Text|Google Scholar
Shao, J., Ge, T., Wei, Y., Zhou, Y., Shi, M., Liu, H., et al.(2022)。腸内細菌叢を標的としたClostridium butyricumと水溶性食物繊維の共同介入は、Acly/Nrf2/NF-κBシグナル伝達経路を介してMAFLDを改善する。Food Funct. 13 (10), 5807-5819.
PubMed Abstract|CrossRef Full Text|Google Scholar
石洵洵、藤枝宏、小久保義人、和気欣一 (1996). ラット肝臓における好中球のアポトーシスとクッパー細胞による除去。を参照。
PubMed Abstract|CrossRef Full Text|Google Scholar
Sierro, F., Evrard, M., Rizzetto, S., Melino, M., Mitchell, A. J., Florido, M., et al. (2017). 単球由来マクロファージの肝臓莢膜ネットワークは、好中球のリクルートにより腹腔内細菌の肝内播種を制限している。Immunity 47 (2), 374-388. e376. doi:10.1016/j.immuni.2017.07.018.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Soderborg, T. K., Clark, S. E., Mulligan, C. E., Janssen, R. C., Babcock, L., Ir, D., et al. (2018).。肥満の母親の乳児の腸内細菌叢は、炎症とNAFLDへの感受性を増加させる。Nat. Commun. 9 (1), 4462. doi:10.1038/s41467-018-06929-0
PubMed Abstract|CrossRef Full Text|Google Scholar
Sohn, W., Jun, D. W., Lee, K. N., Lee, H. L., Lee, O. Y., Choi, H. S., et al. (2015). Lactobacillus paracaseiは、非アルコール性脂肪肝炎のマウスモデルにおいて、M2優位のクッパー細胞分極を誘導する。Dig. Dis. Sci. 60 (11), 3340-3350.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Starkey Lewis, P., Campana, L., Aleksieva, N., Cartwright, J. A., Mackinnon, A., O'Duibhir, E., et al.(2020)。交互に活性化されたマクロファージは、急性肝損傷後のネクローシスの解消を促進する。J. Hepatol. 73 (2), 349-360. doi:10.1016/j.jhep.2020.02.031
PubMed Abstract|CrossRef Full Text|Google Scholar
Støy, S., Laursen, T. L., Eriksen, L. L., Grønbæk, H., Vilstrup, H., and Sandahl, T. D. (2021). アルコール性肝炎において、腸管選択的な広域抗生物質が細菌の移行や肝および全身の炎症に影響を及ぼさないこと。Clin. Transl. Gastroenterol. 12 (2), e00306. doi:10.14309/ctg.0000000000000306
PubMed Abstract|CrossRef Full Text|Google Scholar
ストラビッツ,R.T.,リー,W.M.(2019).急性肝不全。Lancet 394 (10201), 869-881. doi:10.1016/S0140-6736(19)31894-X
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Szabo, G. (2015). アルコール性肝疾患における腸-肝臓軸。消化器病学 148 (1), 30-36. doi:10.1053/j.gastro.2014.10.042
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Tacke, F. (2017). 肝疾患を治療するための肝マクロファージの標的化。J. Hepatol. 66 (6), 1300-1312. doi:10.1016/j.jhep.2017.02.026
PubMed Abstract|CrossRefフルテキスト|Google Scholar
武田和彦、海城、晶、(2003). Toll様受容体. Annu. Rev. Immunol. 21, 335-376. doi:10.1146/annurev.immunol.21.120601.141126
PubMed Abstract|クロスリファレンス全文|Google Scholar
竹内 修一・櫻井 孝 (2010). パターン認識受容体と炎症. 細胞 140 (6), 805-820.
PubMed Abstract|CrossRef Full Text|Google Scholar
Tan-Garcia, A., Wai, L. E., Zheng, D., Ceccarello, E., Jo, J., Banu, N., and al. (2017). 肝内CD206(+)マクロファージは進行したウイルス関連肝疾患の炎症に寄与している。J. Hepatol. 67 (3), 490-500. doi:10.1016/j.jhep.2017.04.023
PubMed Abstract|CrossRef Full Text|Google Scholar
Taylor, P. R., Martinez-Pomares, L., Stacey, M., Lin, H. H., Brown, G. D., and Gordon, S. (2005). マクロファージレセプターと免疫認識。Annu. Rev. Immunol. 23, 901-944. doi:10.1146/annurev.immunol.23.021704.115816.
PubMed Abstract | CrossRef Full Text | Google Scholar
Thevaranjan, N., Puchta, A., Schulz, C., Naidoo, A., Szamosi, J. C., Verschoor, C. P., et al.(2017)。加齢に伴う微生物ディスバイオーシスは、腸管透過性、全身性炎症、およびマクロファージ機能不全を促進する。セルホストマイクロベ 21 (4), 455-466. doi:10.1016/j.chom.2017.03.002
PubMed Abstract|CrossRefフルテキスト|Google Scholar
トート、C.A.、トーマス、P.(1992)。肝臓のエンドサイトーシスとクッパー細胞。肝細胞のエンドサイトーシスとクッパー細胞(Hepatology 16 (1), 255-266).
PubMed Abstract|CrossRef Full Text|Google Scholar
Toubal, A., Kiaf, B., Beaudoin, L., Cagninacci, L., Rhimi, M., Fruchet, B., et al.(2020)。粘膜関連不変性T細胞は、肥満時の代謝機能不全につながる炎症と腸内異食症を促進する。Nat. Commun. 11 (1), 3755. doi:10.1038/s41467-020-17307-0
PubMed Abstract|CrossRef Full Text|Google Scholar
Tripathi, A., Debelius, J., Brenner, D. A., Karin, M., Loomba, R., Schnabl, B., et al. (2018). 腸-肝臓軸とマイクロバイオームとの交差点。Nat. Rev. Gastroenterol. Hepatol. 15 (7), 397-411. doi:10.1038/s41575-018-0011-z
PubMed Abstract|CrossRef Full Text|Google Scholar
Trompette, A., Gollwitzer, E. S., Yadava, K., Sichelstiel, A. K., Sprenger, N., Ngom-Bru, C., et al.(2014)。食物繊維の腸内細菌叢代謝は、アレルギー性気道疾患と造血に影響する。Nat. Med. 20 (2), 159-166.doi:10.1038/nm.3444を参照。
PubMed Abstract|CrossRef Full Text|Google Scholar
Varol, C., Mildner, A., and Jung, S. (2015). マクロファージの 発生と組織の特殊化. Annu. Rev. Immunol. 33 (1), 643-675. doi:10.1146/annurev-immunol-032414-112220
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, C., Ma, C., Gong, L., Guo, Y., Fu, K., Zhang, Y.、他 (2021a). マクロファージの極性化と肝疾患におけるその役割。Front. Immunol. 12, 803037.
PubMed Abstract|CrossRef Full Text|Google Scholar
Wang, Y., Wang, G., Bai, J., Zhao, N., Wang, Q., Zhou, R., et al.(2021b)。スリーブ状胃切除術後のNAFLD改善におけるインドール-3-酢酸の役割。Obes. Surg. 31 (7), 3040-3052.
PubMed Abstract|CrossRef Full Text|Google Scholar
Wang, Y., Wu, Y., Sailike, J., Sun, X., Abuduwaili, N., Tuoliuhan, H., et al.(2020a)。14種類の複合プロバイオティクスは、db/dbマウスの腸内細菌叢の調節とM1/M2表現型マクロファージの修正を通じて2型糖尿病を緩和する。Pharmacol. Res. 161, 105150.
PubMed Abstract|CrossRef Full Text|Google Scholar
Wang, Z., Zhang, X., Zhu, L., Yang, X., He, F., Wang, T., et al.(2020b)。イヌリンは、マウスのSCFAs誘導によるM1マクロファージの抑制とM2マクロファージの促進を介して、アルコール性肝疾患の炎症を緩和する。Int. Immunopharmacol. 78, 106062. doi:10.1016/j.intimp.2019.106062
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Wen, S., Li, X., Ling, Y., Chen, S., Deng, Q., Yang, L.、他(2020年)。HMGB1関連ネクロプトーシスとクッパー細胞M1分極化は、ラットの腸管虚血/再灌流によって誘発される遠隔肝損傷の根底にある。FASEB J. 34 (3), 4384-4402. doi:10.1096/fj.201900817R
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Wen, Y., Lambrecht, J., Ju, C., and Tacke, F. (2021). 肝ホメオスタシスと疾患における肝マクロファージ-多様性、可塑性、治療の機会。セル. Mol. Immunol. 18 (1), 45-56. doi:10.1038/s41423-020-00558-8
PubMed Abstract | CrossRef Full Text | Google Scholar
欧州肝臓学会臨床実践ガイドラインパネル Wendon, J., Panel, m., Cordoba, J., Dhawan, A., et al.(2017)。急性(劇症型)肝不全の管理に関するEASL臨床実践ガイドライン。J. Hepatol. 66 (5), 1047-1081. doi:10.1016/j.jhep.2016.12.003
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Wesolowski, S. R., Kasmi, K. C., Jonscher, K. R., and Friedman, J. E. (2017). NAFLDの発生的起源:手がかりを持つ子宮。Nat. Rev. Gastroenterol. Hepatol. 14 (2), 81-96. doi:10.1038/nrgastro.2016.160
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Wu, K., Kryczek, I., Chen, L., Zou, W., and Welling, T. H. (2009). ヒト肝細胞癌におけるCD8+ T細胞のクッパー細胞による抑制は、B7-H1/プログラム・デス-1相互作用によって媒介される。Cancer Res. 69 (20), 8067-8075.
PubMed Abstract|CrossRef Full Text|Google Scholar
Wu, X., and Tian, Z. (2017). 腸-肝臓軸。Gut microbiota in shaping hepatic innate immunity(肝臓自然免疫の形成における腸内細菌叢)。Sci. China. Life Sci. 60 (11), 1191-1196. doi:10.1007/s11427-017-9128-3
PubMed Abstract|CrossRef Full Text|Google Scholar
Wynn, T. A., Chawla, A., and Pollard, J. W. (2013). 発生、恒常性、疾患におけるマクロファージの生物学。ネイチャー 496 (7446), 445-455.
PubMed Abstract|CrossRef Full Text|Google Scholar
Xia, J., Lv, L., Liu, B., Wang, S., Zhang, S., Wu, Z.、他(2022年)。Akkermansia muciniphilaは、腸内微生物の組成と代謝を調節することにより、アセトアミノフェン誘発性肝障害を改善する。Microbiol. Spectr. 10 (1), e0159621. doi:10.1128/spectrum.01596-21
PubMed Abstract|CrossRef Full Text|Google Scholar
Xu, C., Fan, L., Lin, Y., Shen, W., Qi, Y., Zhang, Y., et al.(2021)。Fusobacterium nucleatumは、miR-1322/CCL20軸とM2極性化を介して大腸がん転移を促進する。Gut Microbes 13 (1), 1980347. doi:10.1080/19490976.2021.1980347
PubMed Abstract|CrossRef Full Text|Google Scholar
Xue, J., SusanneSander, J., Draffehn, A., Krebs, W., Quester, I., et al.(2014)。トランスクリプトームベースのネットワーク解析により、ヒトマクロファージ活性化のスペクトルモデルを明らかにした。イミュニティ 40 (2), 274-288.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
山田 悟、鎌田 奈津子、網谷 崇、中本 奈津子、中岡 崇、木村 正、他 (2017). 腸内細菌叢を介した飽和脂肪酸の生成は、マウス高脂肪食誘発性脂肪肝炎において肝臓の炎症を惹起する。BMC Gastroenterol. 17 (1), 136. doi:10.1186/s12876-017-0689-3
PubMed Abstract|CrossRef Full Text|Google Scholar
Yang, A. M., Inamine, T., Hochrath, K., Chen, P., Wang, L., Llorente, C., et al.(2017年)。腸内真菌はアルコール性肝疾患の発症に寄与する。J. Clin. Invest. 127 (7), 2829-2841. doi:10.1172/JCI90562
PubMed Abstract|CrossRef Full Text|Google Scholar
Yang, L., Bian, X., Wu, W., Lv, L., Li, Y., Ye, J.、他(2020年)。Lactobacillus salivarius Li01のチオアセトアミド誘発急性肝障害および高アンモニア血症に対する保護効果. Microb. Biotechnol. 13 (6), 1860-1876.
PubMed Abstract|CrossRef Full Text|Google Scholar
Yona, S., Kim, K. W., Wolf, Y., Mildner, A., Varol, D., Breker, M.、他 (2013). Fate mappingにより、恒常性維持下における単球と組織マクロファージの起源と動態が明らかになった。免疫 38 (1), 79-91.
PubMed Abstract|CrossRef Full Text|Google Scholar
Younossi, Z., Anstee, Q. M., Marietti, M., Hardy, T., Henry, L., Eslam, M., et al.(2018)。NAFLDとNASHの世界的負担:傾向、予測、危険因子、予防。Nat. Rev. Gastroenterol. Hepatol. 15 (1), 11-20. doi:10.1038/nrgastro.2017.109.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Yu, Y., Liu, Y., An, W., Song, J., Zhang, Y., and Zhao, X. (2019). クッパー細胞におけるSTINGを介した炎症は、非アルコール性脂肪肝炎の進行に寄与している。J. Clin. Invest. 129 (2), 546-555. doi:10.1172/JCI121842
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhang, H., Chen, T., Ren, J., Xia, Y., Onuma, A., Wang, Y., et al.(2021a)。術前運動療法は、代謝再プログラミングによりクッパー細胞の抗炎症性訓練免疫を誘発する。Nat. Metab. 3 (6), 843-858. doi:10.1038/s42255-021-00402-x
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhang, H., Liu, M., Liu, X., Zhong, W., Li, Y., Ran, Y.、他 (2020). Bifidobacterium animalis ssp. lactis 420は、腸管バリアと肝臓免疫細胞の制御を通じて自己免疫性肝炎を緩和する。Front. Immunol. 11, 569104. doi:10.3389/fimmu.2020.569104
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhang, H., Liu, M., Zhong, W., Zheng, Y., Li, Y., Guo, L.、他 (2021b). Bifidobacterium animalis ssp. lactis 420は腸管バリアと肝免疫細胞の制御を通じて自己免疫性肝炎を緩和する。Front. Immunol. 12, 569104.
PubMed Abstract|CrossRef Full Text|Google Scholar
Zheng, Z., Wu, L., Han, Y., Chen, J., Zhu, S., Yao, Y., et al.(2022)。腸内細菌叢が制御するトリプトファン代謝は、C57bl/6マウスのD-gal/LPS誘発性急性肝不全を改善する。エンジニアリング 14, 134-146. doi:10.1016/j.eng.2020.12.013.
クロスレフフルテキスト|Google Scholar
Zhou, J., Feng, X., Zhu, J., Feng, B., Yao, Q., Pan, Q., and al. (2022a). 間葉系幹細胞治療が肝マクロファージの恒常性を回復させ、マウス急性肝損傷を緩和することを単一細胞解析で明らかにした。Pharmacol. 179, 106229.
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, W., Luo, J., Xie, X., Yang, S., Zhu, D., Huang, H., et al.(2022b)。腸内細菌叢の異常は、マウスのエンドトキシン血症の誘発を通じてクッパー細胞を介したB型肝炎ウイルスの持続性を強化する。J. Clin. Transl. Hepatol. 10 (1), 17-25. doi:10.14218/JCTH.2020.00161
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhu, B., Li, H., Lu, B., Guo, X., Wu, C., Wang, F., et al.(2022a)。インドール補給は、マウスのMCD誘発NASHを改善する。J. Nutr. Biochem. 107, 109041.
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhu, Y., Wang, X., Zhu, L., Tu, Y., Chen, W., Gong, L.、他 (2022b). Lactobacillus rhamnosus GGとイノシンの併用は、腸管バリアとTreg/Th1細胞の制御を介してアルコール誘発肝障害を改善する。Toxicol. Appl. Pharmacol. 439, 115923.
PubMed Abstract|CrossRef Full Text|Google Scholar
Zmora, N., Suez, J., and Elinav, E. (2019). あなたはあなたが食べたものです。食事、健康、腸内細菌叢。Nat. Rev. Gastroenterol. Hepatol. 16 (1), 35-56. doi:10.1038/s41575-018-0061-2
PubMed Abstract|CrossRef Full Text|Google Scholar
キーワード:マクロファージ、腸内細菌叢、炎症、肝臓病、自然免疫、腸-肝臓軸
引用元 Zhou Z, Pan X and Li L (2022) 肝臓マクロファージと腸内細菌叢の間のクロストーク。炎症関連肝疾患の重要な構成要素。Front. Cell Dev. 10:1070208.論文番号: 10.3389/fcell.2022.1070208
Received: 2022年10月14日; Accepted: 2022年11月10日
公開:2022年11月22日
編集者
南京医科大学、中国、饒建華
査読者:李保峰
Bofeng Li, University of Science and Technology of China, China(中国科学技術大学、中国
Wei Ying, カリフォルニア大学サンディエゴ校, 米国
Copyright © 2022 Zhou, Pan and Li. これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文である。原著者および著作権所有者のクレジットを記載し、本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可するもので、学術的に認められた慣行に従ったものである。本規定に従わない使用・配布・複製は認めない。
*Correspondence: Lanjuan Li, ljli@zju.edu.cn
免責事項:本論文で表明されたすべての主張は、著者のものであり、必ずしもその関連組織のもの、または出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはそのメーカーが行う可能性のある主張は、出版社によって保証または承認されるものではありません。
こんな人も見ています
大腸がん免疫療法の予測バイオマーカーの 現在と未来
ホウ・ワンティン、イ・チェン、チュウ・ホン
ディスバイオーシス 消化器系癌のファーストヒット
Si Mei, Zhe Deng, Yating Chen, Dimin Ning, Yinmei Guo, Xingxing Fan, Ruoyu Wang, Yuelin Meng, Qing Zhou and Xuefei Tian (以上、田 学飛
トリメチルアミン-N-オキシド(TMAO)は腸内細菌叢と肝血管ニッチのクロストークを媒介し、非アルコール性脂肪肝炎の肝線維化を緩和させる
Dengcheng Zhou, Jing Zhang, Chengju Xiao, Chunheng Mo, Bi-Sen Ding
新たな治療上の懸念 一般的な慢性疾患における抗生物質耐性遺伝子
潘暁霞、周子遠、劉博文、呉忠文
中国における所得の相対的剥奪と睡眠時間の関連性
彭子健、呉琳
