
ブラストシスチス研究のパラダイムシフトを加速する
寄生虫学の動向
オンラインで入手可能 2024年7月27日
スポットライト
ブラストシスチス研究のパラダイムシフトを加速する
https://www.sciencedirect.com/science/article/pii/S1471492224001983?dgcid=author
著者リンクはオーバーレイパネルを開きます、
https://doi.org/10.1016/j.pt.2024.07.006Get 権利と内容
参考文献
32ヵ国56,989人において、腸内ブラストシスチスはより健康的な食生活とより良好な心代謝系アウトカムに関連している
Cell, オンライン版2024年7月8日, ページ
Elisa Piperni, Long H. Nguyen, Paolo Manghi, Hanseul Kim, Edoardo Pasolli, Sergio Andreu-Sánchez, Alberto Arrè, Kate M. Bermingham, Aitor Blanco-Míguez, Serena Manara, Mireia Valles-Colomer, Elco Bakker, Fabio Busonero, Richard Davies, Edoardo Fiorillo, Francesca Giordano, George Hadjigeorgiou, Emily R. エミリー・リーミング、モニア・ロビーナ、マルコ・マサラ、アンドレア・マスキオ、ローレン・J・マキバー、マウロ・パラ、マリステラ・ピッツァリス、ジョナサン・ウルフ、ジンユアン・フー、アレクサンドラ・チェルナコヴァ、シモーネ・M・カッチョ、フランチェスコ・クッカ、サラ・E・ベリー、ダニーロ・エルコリーニ、アンドリュー・T・チャン、カーティス・ハッテンハワー、ティム・D・スペクター、ニコラ・セガタ、フランチェスコ・アスニカー
要旨
ブラストシスチスは、かつては有害な腸内寄生虫として標的とされていたが、現在では有益な寄生虫である可能性があると考えられている。Piperniらは、ブラストシスチスの存在が腸の健康状態の改善、微生物の多様性の向上、および良好な心代謝系転帰に関連していることを示唆している。
キーワード
腸の健康
腸内マイクロバイオーム
真核生物
メタゲノム
バイオマーカー
疾患予測
本文
約20年前、ブラストシスチスは腸内寄生虫であり、消化器疾患の原因としてメトロニダゾールやその他の抗生物質が疑われる場合、あからさまに無視されるか、特別に標的にされるかのどちらかであった。今では、どちらの行為も見苦しいと思われるかもしれない。
様々な宿主と様々なヒト集団におけるブラストシスチスの調査データが蓄積されるにつれ、この生物とその微生物群の興味深い特徴が明らかになりつつある。これらの結果は、すでに11年前に予告されていたブラストシスチス研究における大きなパラダイムシフトをもたらすものである[1]。われわれのグループは、メタゲノミクスの文脈でブラストシスチスを研究した最初の研究者であり[2]、Krogsgaardら[3,4]の観察結果とともに、ブラストシスチスは腸の症状や疾患を持つ患者よりも健康な対照群でより一般的であると結論づけた。またコロニー形成は、腸内微生物の多様性が高く、肥満度(BMI)が正常値より低いという形で、宿主の腸の健康に良い影響を与えることも示した。これらの知見は、後にメタゲノミックデータセットのメタアナリシス [5]、最近ではPiperniら [6]によって裏付けられた。
Piperniらは、従来の腸内細菌叢の多様性解析と、より洗練された機械学習分類モデルの両方を用いて、30カ国以上のほぼ57,000人(このうち72%は健康な人と分類された)を含む73のデータセットの糞便メタゲノミクスデータを解析した。その結果、これまでに示されていたことが確認されただけでなく、ブラストシスチスの保菌と、より良好な心代謝系アウトカムを関連付けることができた。具体的には、ブラストシスチス保菌者は収縮期血圧、C-ペプチド、トリグリセリド、全身性炎症マーカーが有意に低く、空腹時高密度リポ蛋白質レベルが高いことがわかった。これらの結果を総合すると、ブラストシスチス保菌は心血管系の健康と2型糖尿病発症リスクの減少の両面で好ましい結果を示している。これらの健康上の利点の因果関係を明らかにするためにはさらなる研究が必要であるが、ここで示された結果は、仮説を検証するための前向き研究を計画するための確かな基礎となるはずである。この論文は、ブラストシスチスを駆除するために抗生物質を投与する代わりに、寄生虫を健康な腸内環境、そして健康的な食生活の証とみなす未来を示唆している。
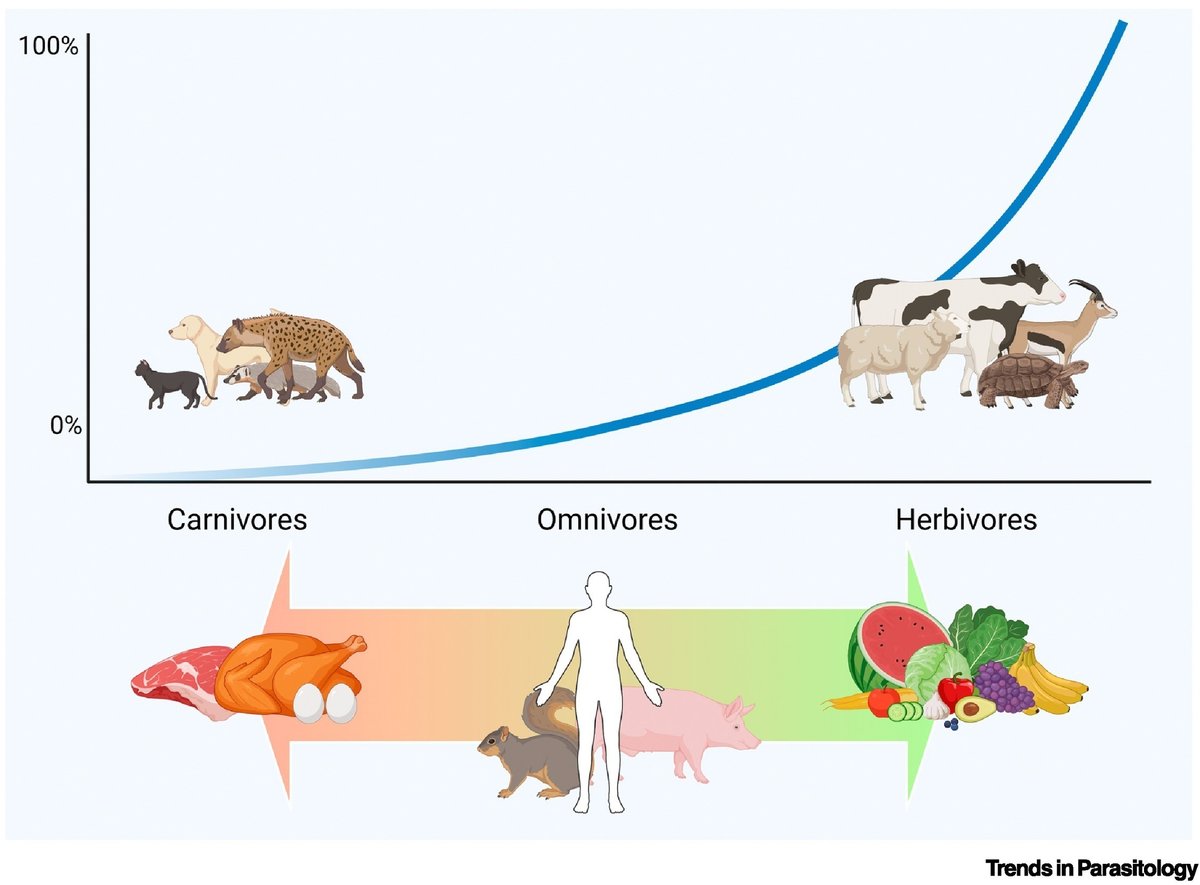
実際、食事に関するデータも解析に含まれており、ブラストシスチスは植物性食品や食物繊維を多く摂取する人により多く出現し、雑食者に比べてベジタリアンやビーガンに多かった。これは、哺乳類や爬虫類のさまざまな目におけるブラストシスチスに関するデータが発表されていることを考えれば、驚くにはあたらない。草食性の宿主(ウシ、シカ、ヒツジ、さらにはカメなど)には、多かれ少なかれ宿主特異的な系統のブラストシスチスが寄生していることが多いが、ネコ、ハイエナ、ヒゲドラゴンなどの厳密な肉食動物に寄生している例は稀である[7,8]。肉食動物に寄生する宿主が陽性であったとしても、検出される系統は非特異的であり、餌動物由来のブラストシスチスである可能性がある [7]。これまでに発表されたデータに基づくと、図1に模式的に示したシナリオからそれほど離れていない可能性がある。食肉消費の影響だけでなく、「欧米化」した集団と「非欧米化」した集団における有病率や亜型保有率の相違も重視されており、これは食生活の違いや加工食品の消費に起因している [9] 。
図1. 異なるクラスの宿主(肉食動物、雑食動物、草食動物)における食行動に従って、ブラストシスチスのコロニー形成の可能性を簡略化して示したもの(0%から100%まで)。
雑食動物はさまざまなレベルのブラストシスチス定着を示し、肉食動物は定着率が低下する。対照的に、ヒツジやジャコウウシなどの草食動物はコロニー形成率が非常に高い。したがって、雑食動物におけるブラストシスチスのコロニー形成率は、食肉と健康的な植物性高繊維質食品の摂取バランスによって決定される可能性がある[6]。この図はBioRenderを用いて作成した。
ブラストシスチスの人獣共通感染症の可能性についても、ヒト宿主に通常見られる亜型に焦点を当てて調査した。そのために研究チームは、214種のヒト以外の宿主から得た4590の腸内メタゲノムのデータを用いた。ヒト以外の霊長類(サブタイプ1、2、3)と鳥類(ST7)のみが、人獣共通感染症に関連する可能性のあるサブタイプを持つことが報告された。ST3はヒトと非ヒト霊長類の両方に共通する可能性があるにもかかわらず、ST3株は霊長類の各グループに特異的で、重複は限定的であるという宿主特異性が明らかにされているという事実を強調したい[10]。Piperniらの研究に見られるような大規模なアプローチだけでなく、満足のいく解決策を導き出すためには、より繊細な実験室での調査が必要である。
ピペルニらの今回のような発表は、科学そのものにとどまらず、政策から政治に至るまで、多くの議論を巻き起こす。ひとつは、ライフサイクルを完結させるために宿主を必要とするが、病原体ではなく共生生物である真核微生物を何と呼ぶかという議論である。腸内共生生物」?公衆衛生や臨床の場では、どの程度通用するのだろうか?もうひとつの、そしてより重要なものは、一般データ保護規則(GDPR)に関連した制限と、データベースやバイオバンクの利用に関するものである。このような大規模なパラダイムの転換(寄生虫から共生生物へ)の引き金となる結果を得るには、DNAデータと営利企業から取得した研究対象者のメタデータを組み合わせることによってのみ可能であった。クッキーやその他の追跡機能を通じて、オンライン上の行動を巨大企業と共有することを受け入れることが一般的な世界では、地域に根ざした通常の公衆衛生研究所を通じて検査用に提出されたサンプル物質が研究目的で使用されることを受け入れることに、少なくとも多少の抵抗があるように思われる。ヒト生物試料や登録データの使用に対する一般市民の態度が変われば、研究分野全般に貢献するだろう。
最後に、このような研究は、医師がブラストシスチス陽性者にメトロニダゾールや類似の薬剤を処方する前にもう一度考えるきっかけとなり、抗菌薬スチュワードシップを遵守することになる。ピペルニたちはこの研究で、長年にわたって確立されてきた医療慣行に挑戦し、ブラストシスチスに対する認識にパラダイムシフトを起こすという課題を達成した。寄生虫から保護者へとブラストシスチスを再生させるために学んだ教訓が、誤解されている常在菌や共生菌の役割を理解しようとする他の研究に刺激を与えることを期待したい。
果たしてブラストシスチスは、単に腸内真菌症の指標に過ぎないのか、それとも実際に腸内微生物環境を改善し、ひいてはヒトの健康を改善することができるのだろうか?
謝辞
J.T.の研究は、ノルウェー研究評議会(Research Council of Norway)からの助成金番号324516(プロジェクト名:「炎症性腸疾患におけるブラストシスチスの役割」)の支援を受けている。両著者はブラストシスチスに関するEU COST Action(CA21105)のメンバーである。
利害関係
著者らは、競合する利益はないと宣言している。
参考文献
1.P.D.スカンラン、C.R.ステンスヴォルド
ブラストシスチス:狡猾なゲストとの付き合い方
Trends Parasitol., 29 (2013), pp.PDFを見る論文を見るScopusで見るGoogleScholarで見る2.L.O. Andersen,et al.
ブラストシスチスを研究するためのメタゲノミクス的アプローチ
FEMS Microbiol. Ecol., 91 (2015), Article fiv072GoogleScholar3.L.R. Krogsgaard,et al.
過敏性腸症候群における一般的な腸内寄生虫と関連した細菌マイクロバイオームの特徴
Clin. Transl. Gastroenterol., 9 (2018), p. 161Viewin ScopusGoogleSchola4.L.R.Krogsgaard、他
過敏性腸症候群患者では腸内寄生虫の有病率は高くない:集団ベースの症例対照研究
Clin Gastroenterol Hepatol., 13 (2015), pp.507-513.e502Viewin ScopusGoogleSchol.F.ベギーニ、他
.ヒト腸内微生物に共通するブラストシスチスの大規模比較メタゲノミクス
eISMEJ., 11 (2017), pp.2848-2863CrossrefViewin ScopusGoogleScho.E.ピペルニ、他
l.腸内ブラストシスチスは、32カ国の56,989人において、より健康的な食生活とより良好な心代謝転帰に関連している
esCell(2024)Published online July 2, 2024.https://doi.org/10.1016/j.cell.2024.06.018Google Scho.C. Sutthikornchai,et
爬虫類のBlastocystisの遺伝的多様性と宿主特異性、タイ東部。
ndV T. Parasitol., 329 (2024), Article 110218PDFを表示記事を表示ScopusGoogleSchoで表示.C. Tantrawatpan,et
タイにおける様々な動物宿主から分離されたBlastocystis亜型の分布。
ndR s. V. T. Sci., 162 (2023), Article 104939PDFを見る記事を見るScopusGoogleSchoで見る.M.E.ニエベス-ラミレス、他
l.原生生物ブラストシスチスの無症候性腸内コロニー形成は、異なるマイクロバイオーム生態学的パターンと強く関連している。
nsmSystems, 3 (2018), pp. e00007-e00018GoogleScho.M.A. Alfellani,et
l.非ヒト霊長類におけるブラストシスチス属亜型の多様性と分布
esParasitology、140(2013)、966-971頁ScopusGoogleSchで表示
引用
(0)
2024 エルゼビア テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものを含む。
es.
このサイトでは
使用しています
。
本サイトに
掲載されている
すべてのコンテンツは te:著作権 © 2024 Elsevier B.V.、そのライセンサー、および貢献者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツについては、クリエイティブ・コモンズのライセンス条項が適用されます。
Skip to main contentSkip to article
Trends in Parasitology
Available online 27 July 2024
In Press, Corrected ProofWhat’s this?
SpotlightAccelerating the paradigm shift in Blastocystis research
Author links open overlay panelJeff Tomiak 1 2, Christen Rune Stensvold 2
Show more
Outline
Share
Cite
https://doi.org/10.1016/j.pt.2024.07.006Get rights and content
Refers to
Cell, Available online 8 July 2024, Pages
Elisa Piperni, Long H. Nguyen, Paolo Manghi, Hanseul Kim, Edoardo Pasolli, Sergio Andreu-Sánchez, Alberto Arrè, Kate M. Bermingham, Aitor Blanco-Míguez, Serena Manara, Mireia Valles-Colomer, Elco Bakker, Fabio Busonero, Richard Davies, Edoardo Fiorillo, Francesca Giordano, George Hadjigeorgiou, Emily R. Leeming, Monia Lobina, Marco Masala, Andrea Maschio, Lauren J. McIver, Mauro Pala, Maristella Pitzalis, Jonathan Wolf, Jingyuan Fu, Alexandra Zhernakova, Simone M. Cacciò, Francesco Cucca, Sarah E. Berry, Danilo Ercolini, Andrew T. Chan, Curtis Huttenhower, Tim D. Spector, Nicola Segata, Francesco Asnicar
Abstract
Blastocystis, once targeted as a harmful intestinal parasite, is now seen as potentially beneficial. Piperni et al. link its presence to improved gut health, higher microbial diversity, and favorable cardiometabolic outcomes, which suggests that Blastocystis might indicate a healthy diet and gut, possibly serving as a symbiont rather than a pathogen.
Keywords
gut health
gut microbiome
eukaryome
metagenomics
biomarkers
disease prediction
Main text
About 20 years ago, Blastocystis was an intestinal parasite that was either blatantly ignored or targeted specifically by metronidazole or other antibiotics as a suspected cause of gastrointestinal disease. It could now seem as if both types of conduct were unseemly.
As survey data accumulate from research into Blastocystis in various hosts and different human cohorts, the intriguing features of this organism and its microbial entourage are becoming evident. These results give cause for a major paradigm shift in Blastocystis research, heralded already 11 years ago [1]. Our group might have been the first to study Blastocystis in a metagenomics context [2], and together with observations from Krogsgaard and colleagues [3,4], we concluded that Blastocystis is more common in healthy controls than in patients with intestinal symptoms/disease. Colonization also indicated a positive effect on gut health in the host in the form of higher gut microbial diversity and low-normal body mass index (BMI). These findings were later corroborated by metanalysis of metagenomic datasets [5], most recently by Piperni and colleagues [6].
Piperni et al. analyzed fecal metagenomics data from 73 datasets representing almost 57 000 individuals (72% of these were classified as healthy individuals) from >30 countries using both conventional gut microbiota diversity analyses and more sophisticated machine-learning classification models. Not only did they confirm what had previously been shown, they were also able to link Blastocystis carriage to more favorable cardiometabolic outcomes. Specifically, Blastocystis carriers were found to have significantly lower systolic blood pressure, levels of C-peptide and triglyceride, and markers of systemic inflammation, while showing higher levels of fasted high-density lipoprotein. Together, these results create a favorable picture of Blastocystis carriage with regard to both cardiovascular health and decreased risk of developing type 2 diabetes. More research is necessary to determine the causation of these health benefits, but the results provided here should form a solid basis for designing prospective studies putting the hypothesis to the test. Thus, the article hints at a future in which – instead of receiving antibiotics to eradicate Blastocystis – one might look upon carriage of the parasite as a sign of a healthy gut, and maybe a healthy diet.
Indeed, data on diet were also included in the analyses, and Blastocystis appeared more frequently in individuals who consume more plant-based foods and fiber, and thus was abundant in vegetarians and vegans compared with omnivores. This is hardly surprising, given the data published on Blastocystis in various orders of mammals and reptiles. While herbivorous hosts – such as cattle, deer, sheep, and even tortoises – are often found colonized with more or less host-specific lineages of Blastocystis, the parasite is a rare finding in strict carnivores such as cats, hyenas, and bearded dragons, to mention some examples [7,8]. Even when carnivorous hosts are found to be positive, the lineages found are nonspecific and may represent Blastocystis from prey animals [7] or contaminated water/feed. Based on data published so far, we suggest a scenario that might not be too far from what is schematically suggested in Figure 1. Beyond the impacts of meat consumption, much emphasis is placed on discrepancies in both prevalence and subtype carriage in ‘Westernized’ versus ‘non-Westernized’ populations, which has been attributed to dietary differences and the consumption of processed foods [9].
Figure 1. Simplified proposed likelihood of Blastocystis colonization (from 0% to 100%) according to dietary behavior across different classes of hosts (carnivore, omnivore, or herbivore).
Omnivores show varying levels of Blastocystis colonization, while carnivorous animals show decreased rates of colonization. By contrast, herbivores, such as sheep and muskoxen, may have very high rates of colonization. Thus, Blastocystis colonization rates in omnivores may be determined by the balance in consumption of meat and healthful plant-based, high-fiber foods [6]. This figure was created using BioRender.
The zoonotic potential of Blastocystis was also surveyed, focusing on subtypes usually found in human hosts. To do so, the team included data from 4590 gut metagenomes from 214 species of nonhuman hosts. Only nonhuman primates (subtypes 1, 2, and 3) and birds (ST7) were reported to have subtypes of potentially zoonotic relevance. We would like to highlight the fact that even though ST3 might be common in both human and nonhuman primates, cryptic host specificity has been demonstrated with ST3 strains specific to each group of primates with limited overlap [10]. The role of zoonotic sources of Blastocystis remains an ongoing question, requiring large-scale approaches as seen in the study by Piperni et al. but also much more subtle laboratory investigations to arrive at a satisfactory solution.
Publications like that of Piperni et al. this one feed into many discussions beyond the science itself, ranging from policy to politics. One is the discussion about what to call eukaryotic microorganisms that require a host to complete their life cycle but that are symbionts rather than pathogens… ‘endosymbionts’? ‘intestinal symbionts’? How well would that go down in public health and clinical settings? Another, and more important one, is the one on General Data Protection Regulation (GDPR)-associated restrictions and the use of databases and biobanks. The acquisition of results that trigger shifts in paradigm of this magnitude (from parasite to symbiont) has only been possible by combining DNA data with metadata from studying individuals acquired from for-profit businesses. In a world where it is common to accept sharing online behavior with megacorporations through cookies and other tracking functions, there seems to be at least some reluctance when it comes to accepting that sample material that has been submitted originally for testing through regular community-based public health laboratories is used for research purposes; nevertheless, such samples are key in large-scale high-quality research that aims to prevent disease and promote health. Shifts in the attitude of the general public towards the use of human biological material and registry data would be conducive to the research field in general.
Finally, studies like this can inspire medical doctors to think twice before prescribing metronidazole and similar drugs to Blastocystis-positive individuals, thus complying with antimicrobial stewardship. With this study Piperni and colleagues have accomplished the task of challenging years of established medical practice, in doing so creating a paradigm shift in the perception of Blastocystis. Let us hope that the lessons learned in the rehabilitation of Blastocystis, from parasite to protector, may inspire other works that seek to understand the role of misunderstood commensals and symbionts.
In the end, at least one big question remains: is Blastocystis merely an indicator of gut eubiosis, or is it actually able to improve the gut microbial environments and thus improve human health?
Acknowledgments
The work of J.T. is supported by grant number 324516 from the Research Council of Norway (Project name: ‘The role of Blastocystis in inflammatory bowel disease’). Both authors are members of the EU COST Action on Blastocystis (CA21105).
Declaration of interests
The authors declare no competing interests.
Recommended articles
References
P.D. Scanlan, C.R. Stensvold
L.O. Andersen, et al.
L.R. Krogsgaard, et al.
L.R. Krogsgaard, et al.
F. Beghini, et al.
E. Piperni, et al.
C. Sutthikornchai, et al.
C. Tantrawatpan, et al.
M.E. Nieves-Ramirez, et al.
M.A. Alfellani, et al.
Cited by (0)
© 2024 Elsevier Ltd. All rights are reserved, including those for text and data mining, AI training, and similar technologies.
Cookies are used by this site. Cookie Settings
All content on this site: Copyright © 2024 Elsevier B.V., its licensors, and contributors. All rights are reserved, including those for text and data mining, AI training, and similar technologies. For all open access content, the Creative Commons licensing terms apply.
