人獣共通感染症ウイルスの病原性: リザーバーホストの研究から得られた教訓
0total views
記事を見る インパクト
仮説と理論 記事一覧
Front. Microbiol.、2023年3月28日
第2章 感染症と病気
第14巻~2023年|https://doi.org/10.3389/fmicb.2023.1151524
この記事は、「研究テーマ」の一部です。
Infectious Agents and Diseaseのインサイト: 2022
18件の記事一覧を見る
人獣共通感染症ウイルスの病原性: リザーバーホストの研究から得られた教訓


Lineke Begeman1 *, Debby van Riel1, Marion P. G. Koopmans1,2, Thijs Kuiken1
1オランダ・ロッテルダム、エラスムス大学医療センター、バイオサイエンス
2パンデミック・災害対策センター、オランダ、ロッテルダム
人獣共通感染症であるウイルス感染症は、人によっては重症化し、死に至ることもあるが、リザーバー宿主では無症状あるいは軽度である。この2つの宿主の病態を比較することで、疾患の違いを説明できる可能性がある。しかし、リザーバーホストにおける感染症は軽視されがちである。そこで、狂犬病ウイルス、マカシンαヘルペスウイルス、ウエストナイルウイルス、プーマラオルソハンタウイルス、サルポックスウイルス、ラッサマンマレナウイルス、H5N1高病原鳥インフルエンザ、マールブルグウイルス、ニパウイルス、中東呼吸器症候群、シミアン/ヒト免疫不全ウイルスの病原性をヒトとリザーバーホストで比較検討しました。その結果、病原体のほとんどの側面が驚くほど類似していることがわかった。その結果、ヒトの重症例における病態を説明するために重要な、病原体の転換点を特定することができた。人獣共通感染症ウイルス感染症のリザーバーホストにおける研究により、これらの転換点をさらに解明することで、人獣共通感染症ウイルス感染症の重症化を抑制する方法を知ることができるかもしれません。
はじめに
新興感染症は人々に深刻な病気を引き起こし、社会を混乱させ、何十億もの費用をかけ、パンデミックになる可能性があります(Taylor et al., 2001; Jones et al., 2008; Karesh et al., 2012; Gortazar et al., 2014; Carroll et al., 2018)。これは、COVID-19のアウトブレイクによって実証されています。過去のアウトブレイクのレビューから、ヒトにおける新興感染症の大部分は動物、多くは野生動物からもたらされ(Jones et al., 2008; Wang and Crameri, 2014)、大部分はウイルスによって引き起こされるという評価がなされている(Woolhouse et al., 2005)。ウイルス)出現の基礎となるメカニズムには、貿易や生息地の破壊による種間接触の人為的な変化が含まれる(Gortazarら、2014;Plowrightら、2017)。コウモリやげっ歯類が人獣共通感染症ウイルスの最初の宿主となることが多いのは、これらの哺乳類目の種が豊富であるためと考えられる(Mollentze and Streicker, 2020)。
動物のリザーバーからウイルスが流出した後の重要な問題は、そのウイルスがヒトの間で感染し、アウトブレイクを拡大させることができるかということである。第二の重要な問題は、潜在的な影響がどうなるかということで、これはウイルスがヒトに病気を引き起こす能力に関連している(Munster et al.、2020)。複合的な特性、感染性、病原性が最終的なインパクトを規定し、それらを評価するには、生態学的、疫学的、臨床的、病理学的研究を組み合わせる必要がある。ここでは、原因ウイルスがどのように人々を病気にするのかを理解する、「病原性」に焦点を当てます。病原体の研究は、治療、ワクチンや抗ウイルス剤の開発、ウイルス感染の防止など、疾病管理の多くの側面で重要である。ウイルス感染症の発症機構は、ヒト、リザーバーホスト、実験動物で研究することができる。しかし、「病原性」という言葉は、それ自体、宿主種間の感染経路の違いやウイルスが病気を引き起こすメカニズムの違いを正しく理解していない、かなり一般的な言葉である。2つの生物種群におけるウイルス感染の病態を比較する場合、一般的な用語である「病原性」は混乱を招きます。そこで、ここでは新しい用語を導入する。ここで研究する人獣共通感染症のウイルス感染症は、ヒトを宿主とする「新型」またはスピルオーバーであるため、ヒトにおけるその病原性を「新型病原性」と呼ぶことにした。また、ヒトの病気を実験的にモデル化した動物で観察される病態を「パラパソジェネシス」と呼び、これは「パラ」という言葉から派生しています。
一般に、ウイルス感染症の病態は、ウイルスが宿主の中でたどる経路によって異なる部分に分けられると言われています。病理学者の立場から、光学顕微鏡を用いて、(1)露出した宿主細胞上の受容体への付着、(2)侵入部位の宿主細胞内での複製、(3)宿主細胞からの放出とその後の宿主内の他の複製部位への拡散、(4)ウイルス増幅に重要な部位の宿主細胞内での複製、(5)新しい宿主に感染できるよう宿主からの排泄に分けることができる。これらのプロセスは、細胞、組織、免疫の反応を決定し、その結果、感染症の臨床結果と環境および新しい宿主にウイルスを拡散する能力に寄与する。倫理的、実用的な理由から、新興のウイルス性疾患の病態を患者さんで直接研究することはできず、代わりに実験室の動物モデルを使用することがよくあります。研究者たちは、実験動物での発症がヒトの宿主での発症を忠実に反映するような、つまり、副病原性と新病原性を反映するような、最適な動物モデルを見つけることに集中する傾向がある。
ネオ・パラパソジェネシスと比較して、オルソパソジェネシスはしばしば無視されます(稀な例外を除いて、例えば、Kuzmin et al.、2017)。これにはいくつかの潜在的な理由があります。リザーバー宿主は私たちの死角になることが多い:内気であったり夜行性であったりするため、一般に私たちの視界の外に住んでいる;少なくともヒトウイルスを研究する研究者の間では、その生態に関する知識が比較的不足しており、監視システムや野外・実験室で研究するための方法・材料が利用できないことが頻繁にある。さらに、ヒトの重篤な疾患転帰を忠実に反映した動物モデルを探す傾向がある一方、リザーバーホストへの感染は無症状であると想定されることが多い。しかし、私たちは、病原体の発生を研究することは、非常に有益であるという仮説を立てています。ウイルスの病原性を理解する上で、そのウイルスが進化したリザーバーホストほど優れた出発点はないと言えるかもしれない。リザーバーホストでの病原性を調べれば、やがてその病原性が人のどの段階で暴走し、重症化するかを知ることができる。このことは、ヒトの重症例における転帰を改善するための新規治療標的の出発点となり得る(Irving et al., 2021)。本研究では、比較的よく研究されているいくつかの人獣共通ウイルス感染症の正病原性と新病原性の比較から、ヒトの重症化に関する洞察を得ることができるかどうかを明らかにすることを目的としています。材料と方法
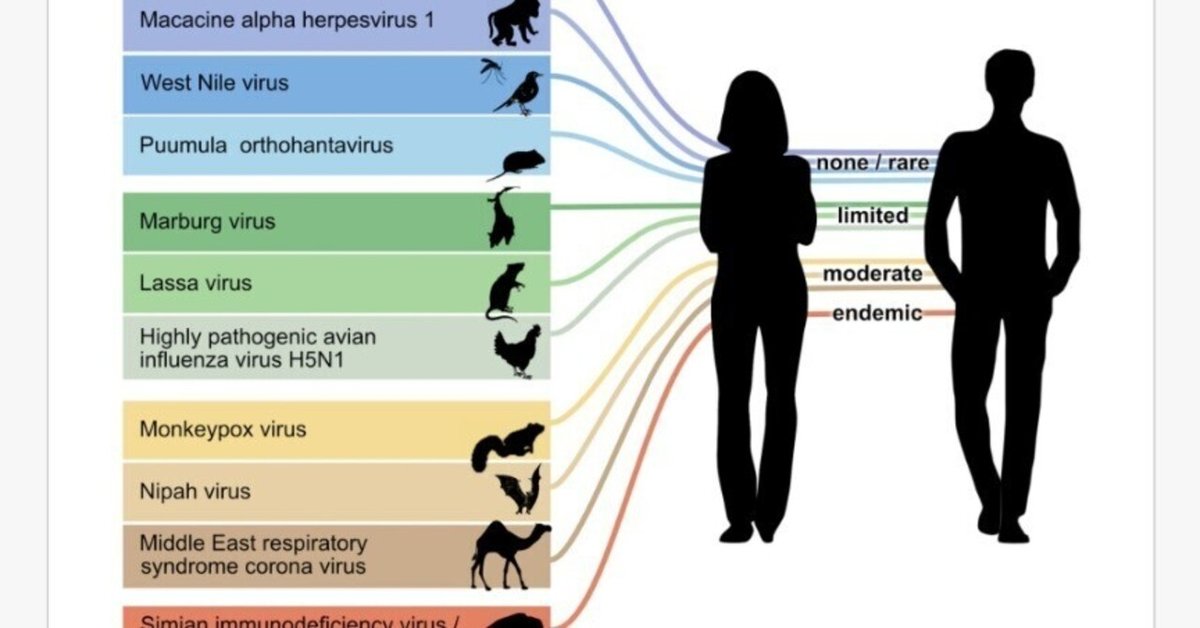
病原体形成と新生病原体形成の比較から得られる可能性のある知見を得るために、一連の人獣共通ウイルス感染症について検討しました。新興感染症の幅広いリストから選択した。また、両宿主グループの病変や細胞タイプ、組織トロピズムに関する情報が得られているウイルス感染症に限定したため、ランダムな選択とはなっていない。SARS-CoV-1、SARS-CoV-2、エボラウイルス感染症のような人獣共通感染症の中には、リザーバー宿主種が特定されていないものもあり、リザーバー宿主種と思われる病原体に関するデータもない。このような知見がないため、これらの疾患を含めることができなかった。一般に医学研究は、ヒトに重篤な疾患をもたらす人獣共通感染症に焦点を当てているため、このリストはヒトに対して強毒なウイルスに偏っている。また、人獣共通感染症ウイルスを保有する鳥類と哺乳類の最も重要な目のリザーバー宿主種を含み(Olival et al., 2017a,b)、ヒト間の異なるレベルの感染性を含むようにウイルス感染症を選択しました(Plowright et al., 2017; 図1)。これらの人獣共通感染症ウイルス感染症のそれぞれについて、正病原性と新病原性、または新病原性の知識がない場合は副病原性を比較しました。
図1
図1. オーソパトジェネシスとネオパトジェネシスの比較のために選択した人獣共通感染症ウイルス。ウイルスはリザーバーホストの異なるグループ(げっ歯類、コウモリ、肉食動物、霊長類、偶蹄類、鳥類のクラス)とヒトへの感染の異なる段階を表している(ヒトからヒトへの感染のレベルはWolfe et al.、2007から適応)。ここで模式的に表したリザーバー宿主種の一般名、学名、哺乳綱、鳥綱については、表1を参照されたい。西ナイルウイルスがアルボウイルスであることを示すために蚊を使用しているが、蚊におけるウイルス感染の病原性については検討されていない。
これらの人獣共通感染症ウイルス感染症について、ウイルス感染の自然経過に沿った組織レベルでの基本的なウイルス-宿主相互作用の概要を説明した(図2)。私たちは、光学顕微鏡を使って比較的容易に研究できるウイルス-宿主間の相互作用に焦点を当てました。ヘマトキシリンとエオシンで組織を染色することにより、病変を可視化し、特徴づけることができる。ウイルスタンパク質は免疫組織化学で組織の細胞内に可視化でき、ウイルスRNAはin situハイブリダイゼーションで可視化することができる。これらの技術により、ウイルスと病変の共局在化、細胞トロピズムの同定が可能となる。そこで、我々が注目したのは、5つのウイルス-宿主相互作用である: (1)ウイルス付着部位、(2)一次複製部位または侵入(感染開始時の細胞種または組織)、(3)宿主内での播種経路、(4)ウイルス増幅(細胞種または組織)、(5)ウイルス排泄を担う細胞種または組織。また、これらのウイルスと宿主の相互作用の最終結果ともいえる感染の結果についても検討した。ウイルス付着部位と侵入は、ウイルス付着が非常に重要なステップであり、別々に研究することができるため、別々に評価しました。例えば、ウイルス付着部位は、感染していない健康な人のホルマリン固定パラフィン包埋組織切片をウイルス組織化学や受容体特異的免疫組織化学で調べ、侵入は感染者の組織を調べて調べることができる。
図2
図2. リザーバーホストとヒトで比較したウイルス-ホスト相互作用(補足資料)、および原稿中で使用したそれらの略語を示す。付着部位:宿主細胞の外側にある部位で、ウイルスが宿主細胞に付着するために利用する細胞分子(受容体)がある場所。入口:ウイルスが新しい宿主に入るために利用する細胞タイプまたは組織で、感染開始部位にあるもの; 播種、感染開始部位から出口の細胞型に広がる最も重要な経路で、さらなる増幅と宿主内ウイルス感染サイクルの完了に不可欠な経路で、血液、リンパ(細胞内または体液中に遊離)、または相互連結した神経細胞であることができる; ウイルス感染による宿主の健康への影響は、ウイルスと宿主の相互作用と宿主の免疫応答の総合的な結果である。
人獣共通感染症のウイルス感染症は、11種類のウイルス属と8種類のウイルス目に分類されている: 狂犬病ウイルス(Lyssavirus属、Mononegavirales目)、マカシンαヘルペスウイルス1(Simplexvirus属、Herpesvirales目)、西ナイルウイルス(Flavivirus属、Amarilloviralis目)、 Puumula orthohantavirus(Orthohantavirus属、Bunyaviralis目)、Marburg virus(Marburgvirus属、Mononegaviralis目)、Lassa virus(Mammarenavirus属、Bunyaviralis目)、 高病原性鳥インフルエンザウイルスH5N1(Alphainfluenzavirus属、Articulaviralis目)、サルポックスウイルス(Orthopoxvirus属、Chitovirales目)、ニパウイルス(Henipavirus属.order Mononegavirales)、中東呼吸器症候群(MERS)コロナウイルス(属 Betacoronavirus, order Nidovirales)、シミアン/ヒト免疫不全ウイルス1(属 Lentivirus, order Ortervirales)(図1; 補足資料)。これらのウイルスは、ヒトへの感染性が5段階に分かれており、感染しないものから蔓延しているものまであります。この最後のカテゴリー(endemic)には、かつて人獣共通感染症であったものの、ヒトの間で流行した時間の間に、もはや人獣共通感染症とはみなされないウイルスに進化してしまった疾患が含まれます。ウイルスの大半である9種類は一本鎖のRNAウイルスで、残りの2種類は二本鎖のDNAウイルスである。9個の一本鎖RNAウイルスのうち、5個はネガセンス、3個はポジセンス、1個はアンビセンスである。宿主は、哺乳類5目(ネズミ目、コウモリ目、霊長目、食肉目、偶蹄目)および鳥類2目(ガリ目、スズメ目)である(表1)。
表1
表1. 比較対象とした11種類のウイルス感染症の特徴および選択したリザーバー宿主の一覧。
宿主種の亜集団の中でも疾患の重症度が異なることがあり、例えば、肥満の男性成人は子供よりも重症化することがあります。したがって、どの亜集団について研究するかという選択をする必要がありました。私たちは、ウイルスと宿主が互いにどのように適応してきたかについて、オルソパトジェネシスが教えてくれることに興味があったので、リザーバー宿主とヒト宿主で異なる選択をしました。したがって、リザーバーホストについては、既知の場合、その種におけるウイルスの維持に最も重要なリザーバーホスト内の亜集団における感染症の病原体(多くの場合、軽症)を選択しました(Swinton et al., 2009)。新病原性については、医学的な理由から重症の人について学びたいと考え、入院患者(多くの場合、併存疾患を持つ成人で、常に重症である)における感染症の病態を選択しました。結果
これら11例の人獣共通感染症ウイルス感染症のそれぞれについて、正病原性と新病原性の比較から、類似点と相違点のいくつかの傾向を確認することができた。類似度の割り当てに関する詳細は、この評価の根拠となる特定の文献と同様に、補足資料に掲載されています。全体として、表中の左から右へ、言い換えれば、感染症の始まりから終わりへ向かって、正病原性と新病原性の類似度は低下している(表2)。
表2
表2. 補足資料の文献レビューに基づき、人獣共通感染症のウイルス感染と本来の宿主の感染とを比較した結果の概要。
最初の3つのウイルス-宿主相互作用(ウイルス付着部位、侵入、拡散)は、最も類似していた。まず、ウイルス付着部位は、リザーバー宿主とヒトで概ね同じであった。例えば、MERSウイルスは、ドロメダリ(Camelus dromedarius)とヒトの両方でジペプチジルペプチダーゼ4(DPP4)とα-2,3-結合シアル酸に付着する。次に、項目も概ね同じで、これは情報があった10例のうち7例で同じである(可能性が高い)と評価された。特に、侵入経路が異なる3例のうち2例(中東呼吸器症候群(MERS)、高病原性鳥インフルエンザ(HPAI)H5N1)でも、侵入経路は呼吸器という同じ臓器系であった。しかし、リザーバーホストの上気道上皮細胞と入院中のヒトの下気道上皮細胞というように、侵入する細胞の種類が異なっていた。第三に、ウイルスの播種もよく保存されており、11例中10例が類似していた。血液や神経細胞を介した播種が正病原性で典型的だった場合、これは新病原性でも同様であった。例外は家禽のHPAI H5N1で、このウイルスは胆道内皮細胞でよく複製できるため、血液を介して豊富に拡散することができる。しかし、ヒトでは、内皮細胞への感染や血液を介した播種はあまり起こらない。これは、生体内のヒト内皮細胞でウイルスが(うまく)複製できないためと考えられる。このように、5つのウイルス-宿主相互作用のうち3つは、今回の事例の大部分(10例中7例から11例)でリザーバー宿主とヒト宿主で同様であった。
残りの2つの相互作用(増幅と退出)は、リザーバー宿主とヒト宿主の間でより多くの違いを示した。増幅については、11の感染症のうち7つが「やや異なる」と評価された。そのうちの4つ(マカシンαヘルペスウイルス1、プーミュラオルソハンタウイルス、マールブルグウイルス、ニパウイルス感染症)については、細胞種そのものではなく、感染細胞数の違いであり、質的ではなく量的な違いであった。感染細胞数の違いは、通常、細胞の量が「少ない」「多い」など分類されている文献から推測された。これら4つの例では、ヒトはリザーバーホストよりも多くの細胞数の割合で感染を示した。残りの3つ(サルポックスウイルス、HPAI H5N1、MERS)については、リザーバー宿主で増幅期に関与した主な細胞型はヒト宿主でも頻繁に重要であったが、ヒト宿主では増幅は他の細胞型にも及んだ。出口については、11の感染症のうち5つが(やや)異なると評価された。そのうちの2つ(西ナイルウイルス感染症、Puumula orthohantaウイルス感染症)は、リザーバー宿主とヒトの両方で同じ細胞タイプが関与していると考えられるが、その結果、リザーバー宿主でのみ感染性ウイルスが検出可能に排泄されており、やはり、質的というより量的に異なることを示唆している。残りの3つ(サル痘ウイルス、HPAI H5N1、MERS)については、ウイルス排出に関与する主な細胞型が異なっており、例えば、リザーバーでは感染した鼻上皮を経由するが、ヒトでは感染部位ではないため、そのようなことはない。この結果、3つのケースとも、ヒトはほとんどウイルスを排泄せず、リザーバーホストは複数の経路で頻繁にウイルスを排泄していました。
リザーバー宿主とヒト宿主の病原体の特徴には多くの類似点があるにもかかわらず、11感染中10感染で感染の結果は異なっていた。この10件のうち9件では、選択バイアスにより予想されるように、ヒト宿主の方がより深刻な結果となりました(「材料と方法」参照)。ただし、HPAI H5N1は例外で、ニワトリに感染するとヒトよりも重症化し、死亡率も高くなる。11の感染症のうち1つである狂犬病ウイルス感染症については、肉食動物とヒトの間で病気の転帰が同じであった。
このような感染症による転帰の違いについては、文献に記載されている顕微鏡検査による定量的・定性的な記述から、3つのパターンがあると思われる。まず、新生児期の増幅期において、細胞の種類は同じでも、感染する細胞の数が多いために生じる違いであり、ここでは量的な違いである。これはマールブルグウイルス、マカシンαヘルペスウイルス1、ニパウイルス、HIV-1、そしておそらくサルポックスウイルスやラッサウイルスに感染した場合、リザーバーホストと比較してヒトで感染した細胞数が多いほど重症化しやすいというものである。第二に、感染開始時の細胞型トロピズムの違いから生じる可能性があるが、ここではその違いは質的なものであった。これはHPAI H5N1ウイルスの場合で、ニワトリの内皮細胞に感染するため、ウイルスが全身に広がることが可能になった。逆に、ヒトでは内皮細胞への感染がないため、宿主はウイルス感染を主に呼吸器系に封じ込めることができる。また、MERSコロナウイルスは上気道に感染するため、ドロメダリーでは上気道感染症を引き起こしますが、MERSコロナウイルスは上気道感染症を引き起こしません。逆に、ヒトのMERSコロナウイルスは気道深部に感染するため、肺に感染し、より重症化する。第三に、例えばウエストナイルウイルスやプーミュラハンタウイルス感染症では、新生児期は正生児期と比較して、感染する細胞の数が同じか、あるいは少ないのに、免疫反応が高まるために、違いが生じる可能性がある。これらの感染症では、リザーバーホストと比較してヒトで観察される浸潤した免疫細胞の数が多いことが、より重症な疾患と関連していた。
今回の比較では、十分な情報を得ることができたが、病原体の基本的な部分に関する知識のギャップが大きく明らかになった。ギャップがある場合、私たちの比較は仮定に基づくものであり、したがって、信頼性は低い(「可能性が高い」)。ギャップ(表2の白いグリットのセル)の多くは、ヒト宿主ではなく、リザーバー宿主のウイルス感染に関する知識不足に起因していた。特に、感染のさまざまな段階で関与する細胞タイプについての知識が不足していた。これは、自然感染または実験的に感染したリザーバーホストの研究において、組織学的分析がほとんど行われていなかったためである。宿主細胞受容体の種類、宿主細胞受容体の分布、ウイルス血症の種類(無細胞性または細胞内)など、いくつかの知識不足は、我々が選んだ例(表3)において非常に一貫していました。
表3
表3. 整形外科の知識格差(文字または*で示す)。考察
このように、任意に選んだ11種類の人獣共通感染症ウイルス感染症の正病原性と新病原性を比較することで、3つの主要な洞察を得ることができる。第一に、ヒトにおける病原性のほとんどの側面は、リザーバー種における病原性と驚くほど類似していることである。このことは、人獣共通感染症になりうる病原体の感染経路を予測するのに役立つため、重要な知見である。第二に、オルトとネオの病原体の違いを明らかにすることで、人への感染による重篤な転帰を部分的に説明できる病原体の特定の側面を特定することができます(表2)。第三に、リザーバーホストにおける病原体の非常に基本的な部分に関する知識には多くのギャップがあり(表3)、これが解決されれば、人の重症化を説明する能力を向上させることができるかもしれない。
ヒトの感染症の重症化については、3つの説明のうち2つが免疫応答の違いに直接関係していると思われる。まず、マールブルグウイルス、マカシンαヘルペスウイルス1、ニパウイルスなどによる感染症の重症化は、リザーバー種よりもヒトで感染する細胞の数が多いことで説明できるかもしれない。このことは、リザーバー宿主とは対照的に、ヒト宿主では感染を少数の細胞にとどめることができず、細胞内の抗ウイルス反応を含むヒトの免疫系が低反応であることを示唆していると思われる。本当にそうなのか、そのメカニズムはどうなのか、興味深いところである。第二に、例えば西ナイルウイルスやPuumula orthohantavirusによる感染症の重篤な転帰は、ヒトではリザーバー種と同じかそれよりも少ない数の細胞が感染することに伴う重度の免疫病理学的変化で説明できる(Medshitovら、2012)。このことは、ヒトの免疫系が過剰に反応することにより、ヒトの宿主が過剰に反応することを示唆しているのかもしれない。つまり、ヒトにおける問題は、病原体の免疫回避反応とヒトの免疫反応とのミスマッチから生じるのである(表4)。リザーバー宿主の免疫反応をより詳細に研究することで、両宿主グループの免疫反応の程度に影響を与える基礎的なメカニズムが何であるかを明らかにすることができる。同様の結論は、リザーバー宿主と人の免疫反応の違いに焦点を当てた文献を検討した他の人たちによっても出されています(Bean et al., 2013)。
表4
表4. 病原体の免疫回避反応とヒトの免疫反応とのミスマッチが、人獣共通感染症であるウイルス性疾患の結果の違いの根底にあるのかもしれない。
前述した理由以外にも、起炎菌を研究する理由はあります。病原体形成の理解が深まれば、特定のウイルスの特徴やその選択的優位性を認識することができるようになる。例えば、我々は以前のリッサウイルス感染症の比較研究から、歯の長さや噛む力の関係から、コウモリに噛まれた後の感染開始部位は皮膚である可能性が高く、肉食動物の場合は骨格筋であると結論付けた。そこで、コウモリのリッサウイルスが皮膚で複製する適応と肉食動物のリッサウイルスが骨格筋で複製する適応を予測した。これらの予測は、肉食動物が獲得したヒト狂犬病とは対照的に、コウモリが獲得したヒト狂犬病の細胞型トロピズムと臨床疾患の違いの観察に対する説明を提供しました(Begeman et al., 2018)。さらに、起炎性は、ウイルスがヒトでどのように振る舞うかについて教えてくれるかもしれません。ラゴスバットウイルスのように、コウモリ宿主の神経細胞に対するトロピズムを持つウイルスは、ヒト宿主でも神経向性である可能性が高いと思われます。さらにもう一歩踏み込むと、新たに出現した人獣共通感染症ウイルスは、ヒト宿主での適応が初期段階にあるため、共進化が進んでいるリザーバー宿主での病原性を知ることで、そのウイルスが将来ヒトで取る可能性のある進化のルートがわかることになる。例えば、MERSコロナウイルスは、ドロメダリーの上気道感染症を引き起こし、ドロメダリーからドロメダリーへ容易に感染します(Adney et al., 2014)。現在、ヒトの気道深部に感染し、感染力が弱いMERSコロナウイルスが、ヒトの上気道に適応すれば、ヒトでもドロメダリーと同様に感染するようになると予想されます。したがって、上気道感染が将来的にヒトにおけるMERSの病態の一部になると予測されます。その結果、SARS-CoV-2で観察されたのと同様の疫学がヒト集団で起こる可能性があります(Munster et al.、2020)。
4人の著者のうち2人が病理学者であることから、我々は、光学顕微鏡を使用して比較的容易に研究できるウイルス-宿主相互作用に焦点を当ててレビューを行った。他の分野の研究者、例えば免疫学者、ウイルス学者、細胞生物学者など、ウイルスと宿主の相互作用の他の側面に焦点を当てた研究者が行った比較から、どのような全体的な洞察を得ることができるか、興味深いところである。
本観点で実施した文献レビューでは、リザーバー宿主の自然感染に関する詳細な記述が不足していることがわかった。このような知識のギャップは、比較的容易に埋められると思われます。例えば、新たに出現した人獣共通感染症ウイルスのリザーバー宿主を特定するためのウイルス学的研究は、ホルマリン固定パラフィン包埋組織を採取することで補完でき、動物を犠牲にすることなく、このウイルス感染の正病原を決定するための病理学的研究が可能になる。
ここでは、私たちの比較をより分かりやすく伝えるために、病原に関する新しい用語を導入しました。しかし、文脈によっては、この用語をさらに区別することが適切かもしれません。例えば、今回は考慮しなかったが、人獣共通感染症がリザーバー宿主から直接感染した場合と、他のヒト宿主から間接的に感染した場合とでは、新病原性が異なるかもしれない。両者を比較する場合、異種新生と同種新生というように、より詳細な用語が適切かもしれない。さらに言えば、人獣共通感染症の病原体が、どの時点でヒトの宿主に適応し、もはや新病原性という言葉を使わなくなるかは、今後の研究課題である。
結論として、リザーバーホストとヒトの人獣共通感染症の比較は、いくつかの共通原則を示唆している。すなわち、正病変と新病変は非常によく似ており、感染サイクルの初期段階は後期段階よりも類似性が高い。したがって、リザーバーホストに注目することは、ヒトにおける人獣共通感染症の理解を深めるための強力な手段となることが期待され、一般的になるべきであろう。
データ提供
本研究で発表された原著は、論文/補足資料に含まれています。さらなる問い合わせは、対応する著者にお願いします。
著者による貢献
LBとTKは本研究の構想・設計に貢献し、データベースを整理し、原稿の第1稿を執筆した。すべての著者が原稿の修正に貢献し、提出されたバージョンに目を通し承認した。
資金提供
TKとLBは、オランダのZonMwプログラムによる非消化性動物由来感染症に関する助成金契約No.522003002(Zoonoses in the Night)の支援を受けた。TKは、欧州連合(EU)のHorizon 2020プログラム助成協定DELTA-FLU no.の支援を受けた。727922. DVRは、オランダ科学研究機構からのフェローシップ(VIDI契約91718308)およびEURフェローシップの支援を受けています。MKは、NWO Stevin Prizeの支援を受けています。
謝辞
最初のコンセプトについて議論し、Puumula orthohantavirusに関する文章の専門知識と批判的なレビューをしてくれたDanny Noackに感謝し、グラフィックに欠かせない助けをしてくれたPieter Crucqに感謝したい。
利益相反
著者らは、本研究が潜在的な利益相反と解釈され得る商業的または金銭的関係がない状態で実施されたことを宣言する。
出版社からのコメント
本記事で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体、出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または承認されるものではありません。
補足資料
本論文の補足資料は、オンラインにてご覧いただけます:https://www.frontiersin.org/articles/10.3389/fmicb.2023.1151524/full#supplementary-material。
参考文献
Adney, D. R., Van Doremalen, N., Brown, V. R., Bushmaker, T., Scott, D., De Wit, E., et al. (2014). 接種したドロメダリーキャメルの上気道におけるMers-CoVの複製と排出。エマージェンシー・インフェクション(Emerg. Infect. Dis. 20, 1999-2005. doi: 10.3201/eid2012.141280.
CrossRef Full Text|Google Scholar
Bean, A. G., Baker, M. L., Stewart, C. R., Cowled, C., Deffrasnes, C., Wang, L. F., et al. (2013). 自然宿主における人獣共通感染症に対する免疫の研究 - 現実を維持する。Nat. Rev. Immunol. 13, 851-861. doi: 10.1038/nri3551
CrossRef Full Text|Google Scholar
Begeman, L., Geurtsvankessel, C., Finke, S., Freuling, C. M., Koopmans, M., Müller, T., et al. (2018). コウモリと肉食動物における狂犬病の比較病原性、およびヒトへの波及の意味。Lancet Infect. Dis. 18, e147-e159. doi: 10.1016/S1473-3099(17)30574-1
CrossRef Full Text|Google Scholar
Carroll, D., Daszak, P., Wolfe, N. D., Gao, G. F., Morel, C. M., Morzaria, S., et al. (2018). グローバル・ヴィローム・プロジェクト。サイエンス 359, 872-874. doi: 10.1126/science.aap7463
CrossRef Full Text|Google Scholar
Gortazar, C., Reperant, L. A., Kuiken, T., De La Fuente, J., Boadella, M., Martinez-Lopez, B., et al. (2014). 種間の壁を越える:人獣共通感染症病原体への扉を開く。PLoS Pathog. 10:e1004129. doi: 10.1371/journal.ppat.1004129.
CrossRef Full Text|Google Scholar
Irving, A. T., Ahn, M., Goh, G., Anderson, D. E., and Wang, L. F. (2021). ユニークなウイルスリザーバーであるコウモリの宿主防御からの教訓。ネイチャー589, 363-370.
CrossRef Full Text|Google Scholar
Jones, K. E., Patel, N. G., Levy, M. A., Storeygard, A., Balk, D., Gittleman, J. L., et al. (2008). 新興感染症の世界的な傾向。Nature 451, 990-993. doi: 10.1038/nature06536
CrossRef Full Text|Google Scholar
Karesh, W. B., Dobson, A., Lloyd-Smith, J. O., Lubroth, J., Dixon, M. A., Bennett, M., etc. (2012). 人獣共通感染症の生態:自然史と非自然史。Lancet 380, 1936-1945. doi: 10.1016/S0140-6736(12)61678-X
CrossRef Full Text|Google Scholar
Kuzmin, I. V., Schwarz, T. M., Ilinykh, P. A., Jordan, I., Ksiazek, T. G., Sachidanandam, R., etc. (2017). フィロウイルスに対するコウモリとヒトの細胞の自然免疫応答:共通点と相違点(Commonalities and distinctions). J. Virol. 91:e02471-16. doi: 10.1128/JVI.02471-16
CrossRef Full Text|Google Scholar
Medzhitov, R., Schneider, D. S., and Soares, M. P. (2012). 防衛戦略としての病害耐性。サイエンス 335, 936-941.
CrossRef Full Text|Google Scholar
Mollentze, N., and Streicker, D. G. (2020). ウイルス人獣共通感染症リスクは、哺乳類および鳥類のリザーバーホストの分類学的オーダーの間で均質である。Proc. Natl. Acad. Sci. U. S. A. 117, 9423-9430. doi: 10.1073/pnas.1919176117.
CrossRef Full Text|Google Scholar
Munster, V. J., Koopmans, M., Van Doremalen, N., Van Riel, D., and De Wit, E. (2020). 中国で出現した新型コロナウイルス-影響評価のための重要な質問。N. Engl. J. Med. 382, 692-694. doi: 10.1056/NEJMp2000929
CrossRef Full Text|Google Scholar
Olival, K. J., Hosseini, P. R., Zambrana-Torrelio, C., Ross, N., Bogich, T. L., and Daszak, P. (2017a). Erratum: 宿主とウイルスの形質が哺乳類からの人獣共通感染症の波及を予測する。ネイチャー 548:612. doi: 10.1038/nature23660
CrossRef Full Text|Google Scholar
Olival, K. J., Hosseini, P. R., Zambrana-Torrelio, C., Ross, N., Bogich, T. L., and Daszak, P. (2017b). 宿主とウイルスの形質が哺乳類からの人獣共通感染症の波及を予測する。ネイチャー 546, 646-650. doi: 10.1038/nature22975
CrossRef Full Text|Google Scholar
Plowright, R. K., Parrish, C. R., Mccallum, H., Hudson, P. J., Ko, A. I., Graham, A. L., et al. (2017). 人獣共通感染症スピルオーバーへの道筋。Nat. Rev. Microbiol. 15, 502-510. doi: 10.1038/nrmicro.2017.45
CrossRef フルテキスト|Google Scholar
Swinton, J. W., Begon, M. E., Dobson, A. P., Ferroglio, E., Grenfell, B. T., Guberti, V., et al. (2009). 「マイクロパラサイトの伝播と持続性」The ecology of wildlife diseases(野生動物の病気の生態学)eds. P. J. R. Hudson and G. B. T. Annapaola (Oxford: Oxford University Press)
Google Scholar
Taylor, L. H., Latham, S. M., and woolhouse, M. E. J. (2001). ヒトの病気出現の危険因子。Philos. Trans. R. Soc. Lond. Ser.B Biol. Sci.356、983-989. doi: 10.1098/rstb.2001.0888
CrossRef Full Text|Google Scholar
Wang, L. F., and Crameri, G. (2014). エマージング・ズーノーティック・ウィルス・ディジーズ(Emerging zoonotic viral diseases)。レヴュー・サイ・テック. 33, 569-581. doi: 10.20506/rst.33.2.2311.
CrossRef Full Text|Google Scholar
Wolfe, N. D., Dunavan, C. P., and Diamond, J. (2007). 主要なヒトの感染症の起源。Nature 447, 279-283.
CrossRef Full Text|Google Scholar
Woolhouse, M. E., Haydon, D. T., and Antia, R. (2005). 新興病原体:種跳びの疫学と進化。Trends Ecol. 20, 238-244. doi: 10.1016/j.tree.2005.02.009
CrossRef Full Text|Google Scholar
用語集
ある種のウイルス感染症の発症における3つの異なる宿主グループの違いを議論するのに役立つ新しい用語を紹介する。本稿では、ヒトのみを新規宿主とし、ヒト以外の脊椎動物をリザーバー宿主として考える。
Neopathogenesis:新規宿主(ウイルスが適応していない、あるいは適応が限定的な宿主)におけるウイルス感染症の発症機構。
Orthopathogenesis:自然リザーバー宿主におけるウイルス感染症の発症[.]。
パラパソジェネシス:対象疾患の実験モデルとして使用される実験動物モデルにおけるウイルス感染症の発症。本論文では、新病原性についての知識がない場合、新病原性を用いた。
キーワード:人獣共通感染症、比較病理学、疾患リザーバー、ウイルス、比較組織学
引用元 Begeman L, van Riel D, Koopmans MPG and Kuiken T (2023) The pathogenesis of zoonotic virals infections: リザーバーホストの研究から得られた教訓。Front. Microbiol. 14:1151524. doi: 10.3389/fmicb.2023.1151524
受理された: 2023年1月27日、受理された: 2023 年 3 月 06 日;
発行:2023年3月28日
編集者
アクセル・クロエカール、フランス国立農業・食料・環境研究所(INRAE)、フランス
レビューした人
Markus Keller, Friedrich-Loeffler-Institute, ドイツ
アンナ・C.米国コロラド州立大学 ファグレ氏
リチャード・アンソニー・コック(英国王立獣医大学(RVC)、英国
Copyright © 2023 Begeman, van Riel, Koopmans and Kuiken. これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを記載し、本誌の原著を引用することを条件に、学術的に認められた慣行に従って、他のフォーラムでの使用、配布、複製が許可されます。本規約を遵守しない使用、配布、複製は許可されません。
*Correspondence: Lineke Begeman、l.begeman@erasmusmc.nl
免責事項:本記事で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または支持されるものではありません。
こんな人も見ています
ペスティウイルス感染による自由行動する子牛集団の群れの健康への影響を特定し、判断する上での問題点
ジュリア・F・リドパス、ジョン・D・ニール
アフリカの教育熱心な若者と都市部の人々における「人工肉」に対する消費者の認識
KOMBOLO MOISE、Sghaier Chriki、Marie-Pierre ELLIES-ORY、Jingjing Liu、Jean-Francois Hocquette
トマトクロロシスウイルスCPmタンパク質は病原性決定因子であり、一本鎖RNAによって誘導されるホストローカルRNAサイレンシングを抑制する
楊暁、羅祥文、張瑜、張湛紅、歐陽、石暁彬、呂暁元、李範、張松柏、劉永、張徳永
腸内寄生虫Giardia duodenalisに対する宿主防御において、特異的なTLRを介したHSP70の活性化が潜在的役割を果たす
リウ・ミン、ヤン・ヨンウー、朱偉寧、呉景雪、ユ・シーラン、リー・ウェイ
PRV変種とBartha-K/61ワクチン株に感染したPK15細胞の比較トランスクリプトーム解析
張宏良、段暁、劉剛、李英光、董紹明、林嘉旭、張瑞華、蔡秀麗、胡珊
類似の記事
仮説と理論
2022年7月11日掲載
COVID-19におけるイベルメクチンのメカニズムに関する微生物学的仮説の発表 イベルメクチンがビフィズス菌の餌となり免疫力を高める
サビーネ・ハザン
doi 10.3389/fmicb.2022.952321
56525ビュー
引用回数 0回
仮説と理論
2016年6月28日に公開
病原性細菌マイコプラズマ・ニューモニエの滑空機構に関する統合情報と展望
宮田 誠
濱口 佑(はまぐち・たすく
doi 10.3389/fmicb.2016.00960
10458ビュー
32の引用
仮説と理論
2016年7月22日に公開
数学的モデリングにおける強い推論: 21世紀のロバストサイエンスのための方法
ヴィタリー・V・ガヌソフ
doi 10.3389/fmicb.2016.01131
9426ビュー
26の引用
仮説と理論
2021年3月16日掲載
SARS-CoV-2「Variolation Hypothesis」について: インデックス症例のウイルス量と二次症例のCOVID-19重症度との間に関連性はない
マッティア・トゥルンフィオ
ビアンカ・マリア・ロンゴ
フランチェスカ・アラディオ
フランチェスコ・ヴェヌーティ
フランチェスコ・セルッティ
ヴァレリア・ギセッティ
ステファノ・ボノラ
ジョバンニ・ディ・ペリ
アンドレア・カルカーニョ
doi 10.3389/fmicb.2021.646679
5530ビュー
5回目の引用
フッター
ガイドライン
エクスプロア
アウトリーチ
接続
フォローする
© 2023 Frontiers Media S.A. All rights reserved.
プライバシーポリシー|ご利用規約
