
cDC1由来のIL-27はマウスの小腸CD4+T細胞のホメオスタシスを制御する
cDC1由来のIL-27はマウスの小腸CD4+T細胞のホメオスタシスを制御する
ファテメ・アフマディ
ORCIDロゴ
フレドリック・ユングス
ORCIDロゴ
クリスチャン・アシュワース
ORCIDロゴ
アマンダ・ラッパライネン
ORCIDロゴ
Urs Mörbe
ORCIDロゴ
クヌート・コタルスキー
ORCIDロゴ
ウィリアム・W・アガチェ
ORCIDロゴ
クロスマーク 更新の確認
著者・論文情報
J Exp Med (2023) 220 (3): e20221090.
https://doi.org/10.1084/jem.20221090
記事履歴
標準表示
PDF
共有
ツール
小腸固有層には多数のIFNγ産生Tヘルパー(Th1)細胞が存在し、腸の恒常性や宿主防御に重要な役割を果たしているが、その発生機序はまだ十分に解明されていない。我々は、離乳後、SI-LPにTh1細胞が蓄積し、長期にわたって維持されることを明らかにした。SI-LPにおけるTh17およびTh1細胞の蓄積は微生物叢に依存するが、Th1細胞の蓄積にはcDC1によるIL-27およびMHCIIの発現が特異的に必要であった。SI-LPでは、cDC1由来のIL-27がTh1-Th17のバランスを保つのに必須であり、その非存在下では、Th1細胞のTh17シグネチャー遺伝子の発現が増強されることが示された。以上より、我々はcDC1由来のIL-27がSI-LPのTh1-Th17細胞恒常性の重要な制御因子であることを明らかにした。
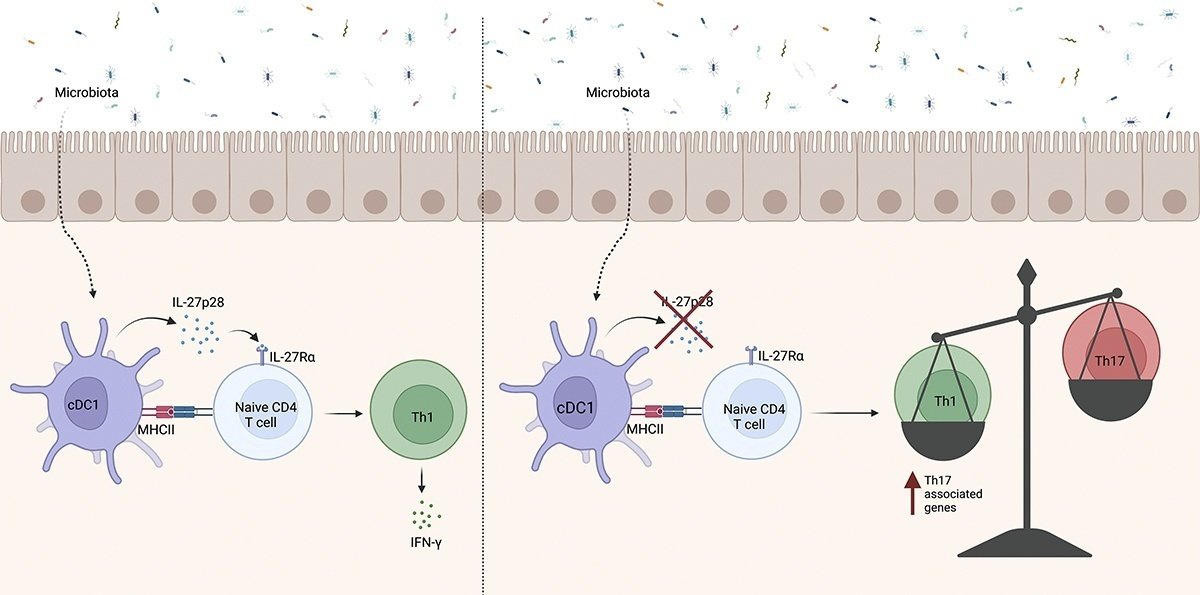
グラフィカルアブストラクト
グラフィック
大きく表示する スライドをダウンロードする
Subjects:粘膜免疫学
はじめに
小腸粘膜固有層(SI-LP)には、IFN-γ産生Tヘルパー1(Th1)細胞やIL-17産生Th17細胞、FoxP3+自然(n)および誘導(i)制御T細胞(Tregs)などの優れた集団とともに、以前に活性化したCD4+T細胞の大規模かつ多様な集団が存在する。これらの細胞は、組織の恒常性の維持と宿主防御に不可欠な役割を担っており、この区画の組成の変化は、免疫介在性病理学と慢性腸炎に関連している(Tindemansら、2020年)。腸のCD4+ T細胞コンパートメントの確立と維持を駆動する細胞および分子メカニズムは、まだ完全に解明されておらず、様々なCD4+ T細胞サブセットで異なっている可能性が高い。これらのプロセスを理解することは、ヒトの健康のためにこのコンパートメントを操作する潜在的な機会を提供する。
従来型樹状細胞(cDC)は、CD4+ T細胞のプライミングおよび分化に不可欠であり、腸管LP全体、ならびに腸間膜リンパ節(MLN)および腸関連リンパ組織を構成する腸管誘導部位に見出される(Joerisら、2017;Lucianiら、2022)。LP内では、cDCは自己抗原と外来抗原のために環境をスキャンし、腸管排出MLNへの移動後に取り込んでT細胞に提示する。cDCは、XCR1の発現によって識別されるIrf8およびBatf3依存性のcDC1と、Irf8およびBatf3に依存せずに発生し、XCR1ではなくSIRPαを発現するcDC2という2つの主要サブセットからなる(Anderson et al.、2021年)。我々および他の研究者は、cDC1およびcDC2が腸管T細胞応答において異なる非冗長な役割を果たすことを示した(Ludaら、2016;Weltyら、2013;Perssonら、2013;Mayerら、2017;Demiriら、2017;Schlitzerら、2013;Lewisら、2011;Ohtaら、2016;Joerisら、2017)。例えば、腸cDC2は、腸のTh2応答の開始(Demiriら、2017;Mayerら、2017)および腸LP Th17恒常性(Perssonら、2013;Schlitzerら、2013;Weltyら、2013;Lewisら、2011)に不可欠であると思われる。一方、腸管cDC1は上皮由来の抗原をCD8+T細胞に交差提示し(Joeris et al., 2021; Cerovic et al., 2015)、交差耐性に重要であり(Joeris et al., 2021)、腸管上皮内リンパ球(IEL)区画の構築を促進します(Luda et al., 2016; Ohta et al.、2016)。また、cDC1を欠損したCd11c-cre.Irf8fl/flマウスを用いた研究により、腸管Th1ホメオスタシスにおけるcDC1の役割が示唆されています(Luda et al.、2016年)。しかしながら、これらのマウスでは、腸管マクロファージおよび形質細胞様DCを含むすべてのCD11c発現細胞においてIrf8が欠失されているため、腸管Th1恒常性におけるcDC1の正確な役割および関与する機構は、依然として決定されないままである。
SI-LP CD4+T細胞コンパートメントは、出生後、子犬がミルクから固形食ベースの食事に移行する離乳期に発達し、微生物の数と多様性が増加する。SI-LP Th17細胞区画の確立は、常在細菌叢を必要とし、分節化糸状菌を含む上皮と直接相互作用できる細菌株によって主に駆動される(Ivanov et al., 2022; Goto et al., 2014; Yang et al., 2014; Ladinsky et al., 2019; Ivanov et al., 2009; Atarashi et al., 2015)。一方、nTregは微生物叢とは無関係に生じ、SI-LP iTreg区画の確立は、主に食事性タンパク質に応答して駆動されるようである(Kimら、2016;Tanoueら、2016)。SI-LP Th1コンパートメントの確立が同様の時間枠で行われるかどうかは、常在菌に依存しており、この期間に生じたTh1細胞がSI-LPで長期的に維持されるかどうかは依然として不明である。
ここでは、Xcr1-cre.DTAマウスを用いて、マイクロバイオータ依存的なSI-LP Th1応答の生成にcDC1が重要な役割を果たすことを示し、このプロセスにおける重要なメディエーターとしてcDC1由来のIL-27とMHCIIを同定した。cDC1由来IL-27の欠失は、SI-LPにおいてTh1細胞の減少およびTh17細胞の増加をもたらし、Th17関連遺伝子の転写の増加など、残りのTh1細胞の転写プロファイルの変化を引き起こした。したがって、cDC1由来のIL-27は、SI-LPのTh1/Th17細胞のホメオスタシスの中心的なレギュレーターであることがわかった。
結果および考察
cDC1とIL-27Rαは、SIのTh1ホメオスタシスにおいて重複しない役割を担っている。
Cd11c-cre.Irf8fl/flマウス(Ludaら、2016)で以前に観察された腸管Th1細胞数の減少がcDC1の欠損に起因するかどうかを評価するために、Xcr1-creマウス(Ohtaら、2016)をROSA-DTAマウスと交配してcDC1発現XCR1選択的に欠失させた。予想通り(Ohta et al., 2016)、Xcr1-cre.DTAマウスは、SI-LPおよび排出MLNの遊走区画と常駐区画でcDC1を欠いていた(図S1、AおよびB)。Xcr1-cre.DTAマウスは、SI-LPのCD4+ T細胞数がCre対照と比較して少ないが有意に減少し(図1 A)、同時にIFN-γ産生Th1が著しく減少したが、IL-17産生Th17やFoxp3+ Treg数は減少しなかった(図1、BおよびC)。このように、cDC1はSI-LP CD4+Th1のホメオスタシスにおいて必須の役割を担っている。
IL-12、1型IFN、及びIL-27を含むいくつかのサイトカインがTh1発生に関与しており(Vignali and Kuchroo, 2012; Trinchieri, 2003; Yoshida and Hunter, 2015; Longhi et al, 2009)、Th1細胞の割合はIl27ra欠損マウスの結腸で減少することが報告されている(Troy et al, 2009)。SI-LP Th1恒常性におけるこれらの因子の役割に取り組むため、IL-12欠損マウス(Il12p35欠損マウス)、タイプ1IFNシグナル伝達欠損マウス(Ifnar欠損マウス)、IL-27受容体シグナル伝達欠損マウス(IL27ra欠損マウス)のSI-LP CD4+ T細胞区画の評価を行なった。Il12p35-およびIfnar欠損マウスは、SI-LP CD4+T細胞ならびにTh1およびTh17細胞の数が正常であったが(図1、DおよびE)、Il27ra欠損マウスはSI-LP CD4+T細胞およびTh17細胞の数が正常であったが、Th1細胞の数が減少した(図1 F)。このように、IL-12やタイプ1 IFNではなく、IL-27シグナルがSI-LPのTh1ホメオスタシスにおいて重複しない役割を担っているのである。
cDC1由来のIL-27は、小腸のTh1細胞とTh17細胞のバランスを制御している
多くの細胞型がIL-27を産生することができるが(Lin et al., 2021; Kilgore et al., 2018, 2020; Hall et al., 2012b)、cDC1-およびIL27ra欠損マウスの両方でSI-LP Th1細胞が減少するのは、腸のSI-LP Th1恒常性にcDC1由来のIL-27が必要だからではないかと推論される。そこで、Xcr1-creマウスとp28fl/flマウスを交配し、IL-27αサブユニット(p28/IL-30)をcDC1特異的に欠失させたマウスを作製した。Xcr1-cre.p28fl/flとp28fl/flのコントロールは、SI-LP CD4+T細胞の総数が同程度であったが(図2 A)、SI-LP Th1細胞の割合と総数がXcr1-cre.p28fl/flマウスで減少し、Th17細胞が増加した(図2、BおよびC)。これらの結果と同様に、Xcr1-cre.p28fl/flマウスのSI-LPでは、T-bet+RORγt-FoxP3- Th1細胞の総数および割合はp28fl/fl対照と比較して減少し、RORγt+T-bet-FoxP3- Th17細胞の数と割合が増加した(図2、D、E)。一方、Xcr1-cre.p28fl/flとp28fl/flマウスのSI-LPでは、RORγt+T-bet+FoxP3- Th細胞とFoxP3+ Tregの数と割合は同等であった(図2 E)。SI-LPと同様に、Xcr1-cre.p28fl/flマウスは、大腸LPにおいてp28fl/flコントロールマウスと同様の総CD4+ T細胞数を有したが、Th1の比率は減少し、Th17細胞の比率は増加した(図S1 C)。SI-LP CD8+およびIFN-γ+ CD8+T細胞数、ならびにIEL数およびサブセット組成は、Xcr1-cre.p28fl/flマウスで変化しなかった(図S1、DおよびE)。これらの結果は、腸管LPにおけるTh1細胞とTh17細胞のバランスを制御する上で、cDC1由来のIL-27が重要な役割を担っていることを浮き彫りにしている。
SI-LPのTh1コンパートメントは離乳後に確立され、微生物叢に依存し、長期に維持される。
離乳後、SI-LPにはTh17細胞やiTregが集積する(Atarashi et al.) この時期にTh1細胞がSI-LPに蓄積されるのか、また同様の動態で蓄積されるのかについては、まだ不明である。そこで、離乳前(生後21日目と24日目)、離乳直後(26日目)、28日目から8週齢までのWTマウスのSI-LPのTh1、Th17、Treg細胞数を評価した(図3 A)。マウスは母親から離れる前にミルクから固形食への離乳を開始するが、分離後のSI-LPではCD4+ T細胞数が増加し、Th17細胞およびFoxP3+ Tregの集団が拡大した(図3 A)。IFN-γ-およびT-bet発現Th1細胞もまた、この期間中にSI-LP内に蓄積した(図3、AおよびB)。したがって、これらのCD4+ Thサブセットは離乳期(d26)からd36までSI-LP内に蓄積し、その後その数はいくらか安定化するようである。注目すべきは、離乳はFoxP3+ Tregの割合の著しい減少、Th17細胞の割合の急激な増加、そして全SI-LP CD4+T細胞プール中のTh1細胞の割合のより緩やかな増加と関連しており(図3 A)、SI-LP Th17区画の拡張がTh1区画の拡張に先行することを示唆していることである。SI-LP Th1細胞の蓄積が微生物叢に依存しているかどうかを評価するために、マウスに異なる抗生物質レジーム(アンピシリン、バンコマイシン、ネオマイシン、メトロニダゾール)を与えて、生後d21から12日間、飲料水中のすべての細菌、グラム陽性細菌(バンコマイシン単独)、またはグラム陰性細菌(ネオマイシン単独)を除去し、生後d33でSI-LP CD4+ T細胞区画を評価した。以前の結果(Ivanovら、2008)と一致し、広域抗生物質とバンコマイシンは共にSI-LPのCD4+ T細胞とTh17細胞数の有意な減少をもたらし、同様のパターンがIFN-γ産生細胞とT-bet+ Th1細胞にも観察された(図3 C)。ネオマイシン投与マウスではTh17細胞数がわずかではあるが有意に減少したが、ネオマイシンはSI-LP CD4+Th細胞数の合計にほとんど影響を与えなかった。このように、微生物叢はSI-LP Th1コンパートメントの初期確立に不可欠である。
離乳後にSI-LPに蓄積するマイクロバイオータ依存性のTh1細胞が長期的に維持されるかどうかを決定するために、T-bet運命マッピングマウス(Yuら、2015)を使用して、36日齢マウスのSI-LPにおけるT-bet発現CD4+T細胞の運命を追跡した。これらのマウスにおいて、ZsGreenは、T-betプロモーターの制御下で発現し、すべてのT-bet発現CD4+ T細胞をZsGreen+とする。これらのマウスへの4-ヒドロキシタモキシフェン(4-OHT)の投与は、ZsGreen+ CD4+T細胞におけるCre媒介tdTomato発現を駆動し、注入時に存在するT-bet発現細胞の運命を経時的に追跡することを可能にする(Yuら、2015年)。36日齢のT-bet運命マッピングマウスへの4-OHT投与2日後、SI-LPのZsGreen+ CD4+T細胞の大きな割合がtdTomatoも発現し、全SI-LP ZsGreen+CD4+T細胞中のtdTomato+ZsGreen+細胞の割合はその後10週にわたって減少した(図3、D-F)。この比例した減少は、SI-LPのtdTomato-ZsGreen+ CD4+T細胞の数の相対的増加によるもので、絶対数が安定したtdTomato+ZsGreen+ T細胞の損失ではない(図3 G)。したがって、離乳後のSI-LPに蓄積するTh1細胞は、より多くのこの種の細胞が後の時期にも到着し続けるが、長期的に維持される。
マイクロバイオータによるSI-LPのTh1コンパートメントの確立には、cDC1による抗原提示とIL-27の産生が必要である
離乳後のSI-LPにおけるTh1細胞の蓄積がcDC1に依存しているかどうかを調べるために、36日齢のXcr1-cre.DTAマウスのSI-LP CD4+T細胞コンパートメントを評価した。成体Xcr1-cre.DTAマウスで観察されたように(図1 A)、36日齢のXcr1-cre.DTAマウスはCre-コントロールと比較して、SI-LP CD4+T細胞の総数が減少し、SI-LP Th1細胞の著しい減少が見られ、Th17数は高い傾向を示したが、これは有意ではなかった(図4 A)。SI-LP CD4+T細胞の最適な蓄積は、cDC1によるMHCII発現にも依存し(図4 B)、より具体的にはTh17ではなくTh1の細胞数が36日齢のXcr1-cre.MHCIIfl/flマウスで著しく減少したことからTh1細胞にも依存していた(図4 B)。成体Xcr1-cre.p28fl/flマウスで観察されたように、36日齢のXcr1-cre.p28fl/flマウスは、p28fl/flコントロールマウスと比較して、SI-LP CD4+T細胞数は同様であるが、SI-LP Th1細胞が著しく減少、SI-LP Th17細胞が著しく増加した(図4 C)。Xcr1-cre.p28fl/flマウスは、この年齢でMLNにおけるcDCサブセット数及び構成が正常であり(図S2 A)、組織学、血清リポカリン2レベル及びSI-LPの好中球数で評価すると、SI-LP炎症の兆候は認められなかった(図S2、B-E)。したがって、cDC1によるMHCIIとIL-27の両方の発現が、マイクロバイオータ依存的なSI-LP Th1コンパートメントの確立に必要であることが示された。
MLNにおけるT細胞のプライミング中のT細胞におけるIL-27およびIL-27シグナルの役割を評価するために、我々はまずMLN cDCによるp28の発現を調査した。脾臓または皮膚排出LN cDCを分析した以前の報告(Kilgoreら、2018;Kilgoreら、2020)と一致して、MLN cDCは定常状態でp28を発現しなかったが、抗CD40およびLPSまたはポリイノシン-ポリシチジル酸(ポリ[I:C])、特にcDC1(図S2 F)のi.p.投与後p28がアップレギュレートされた。Th1プライミング中のT細胞におけるIL-27シグナルの役割を評価するために、OVA特異的OT-II(CD45.1+CD45.2+)およびOT-II.Il27ra-/-(CD45.1+CD45.2-)細胞をC57BL/6(CD45.1-CD45.2+)マウスに1対1の割合で共注し、その受領者にOVA、LPSおよびαCD40を1日後にi.p.(免疫化した(図4、DとE))。免疫後 4 日目にレシピエントマウスを犠牲にし、フローサイトメトリーにより MLN におけるドナー OT-II 細胞の数およびサイトカインプロファイルを評価した。予想通り、移植されたOT-II細胞は、免疫のない状態では増殖もサイトカインの産生もできなかったが、免疫によりOT-II細胞が著しく増殖し、IFN-γ産生とIL-17産生の両方のOT-II細胞が生成した(図S2、G-I)。免疫化後、同数のOT-IIおよびIl27ra欠損OT-II細胞がレシピエントマウスのMLNから回収され(図4 F)、CD4+ T細胞のプライミングがこれらの細胞におけるIL-27シグナルの欠如によって影響を受けないことが実証された。一方、IL-17産生細胞ではなくIFN-γ産生細胞の割合は、WT OT-II細胞と比較してIl27ra欠損OT-II細胞で著しく減少した(図4のGおよびH)。このように、プライミングされたCD4+ T細胞によるIL-27Rαの発現は、Th1細胞への分化を極性化するのに必要である。
SI-LPのTh1細胞の長期滞留を考慮し、我々は次にIL27シグナルがSI-LPに到着後、これらの細胞の維持に重要であるかどうかを決定した。これを評価するために、7-8週齢のT-bet運命マッピングマウスに4-OHTを注射し、10日間休ませた後、抗IL-27p28またはアイソタイプコントロール抗体を2週間にわたり隔日で注射し、最終注射の2日後にSI-LPにおけるtdTomato+ZsGreen+細胞の数を決定した(図S2 J)。抗IL-27p28は、OVA、抗CD40、およびLPSによるi.p.免疫後のMLNにおけるTh1細胞へのOT-II分化を阻害し(図S2 K)、その中和活性をin vivoで実証した。しかしながら、抗IL-27p28は、SI-LPのtdTomato+ZsGreen+ CD4+T細胞の数に影響を与えなかった(Fig. 4 I)。これらの結果は、IL-27の主要な役割はTh1細胞の初期極性化であり、SI-LPに到着した後の維持には関与しないことを示している。
cDC1由来のIL27は、SI-LPのTh細胞サブセットの転写プロファイルを制御する
SI-LPのCD4+T細胞の特性に対するcDC1由来のIL-27の幅広い影響を評価するために、これらの細胞をXcr1-cre.p28fl/flマウスおよびp28fl/flコントロールから選別し(4マウス/群)、単一細胞RNA配列決定(scRNA-sequ)に供した。バイオインフォマティクス的にナイーブCD4+ T細胞を除去した後、Xcr1-cre.p28fl/flマウスから39,013個のSI-LP CD4+T細胞、p28fl/flマウスから35,915個の細胞について配列を得ている。Louvainクラスタリングにより、10のCd4+Trac (TCRα constant)+ クラスターが同定され(図5 Aおよび図S3 A)、これらはThサブセット系譜遺伝子の発現差に基づくCD4+ T細胞の異なる集団からなる(図S3 B)。これらのクラスターの相対的割合は、Xcr1-cre.p28fl/flとp28fl/flマウスの間で異なっており、前者はTh1様細胞の割合が減少しTh17様細胞の割合が増加した(図5、BおよびC)、以前のフローサイト解析(図2)と一致している。対照的に、他のSI-LP CD4+T細胞クラスターの比率は、これらのマウス間で差がなかった(図5 B)。これらの結果は、Th1の促進及びTh17応答の抑制におけるIL-27の役割を示す以前の研究(Meiら、2021;Hallら、2012b;Yoshida and Hunter、2015)と一致し、腸内のこれらのプロセスにおけるcDC1由来のIL-27の必須の役割を強調するものであった。注目すべきは、Xcr1-cre.p28fl/flマウスとは対照的に、Xcr1-cre.DTAおよびIL27ra欠損マウスでは、SI-LP Th17数の増加は観察されなかった(図1、CおよびF)。IL-27とcDC1の生物学の複雑さを考えると、これらの一見矛盾した所見の根底にあるメカニズムを解明するためには、さらなる研究が必要であろう。
予想通り、個々のTh1およびTh17シグネチャー遺伝子の発現レベルを解析したところ、Th17様細胞はTh17関連シグネチャー遺伝子を高レベルで発現していたが、Th1関連シグネチャー遺伝子は低レベルで、これらのシグネチャー遺伝子の発現レベルは、Xcr1-cre. p28fl/fl マウスと p28fl/fl コントロール間で差がなかった(図5 D)。一方、Xcr1-cre.p28fl/flマウスのTh1様細胞は、p28fl/flマウスのTh1様細胞と同レベルのTh1シグネチャー遺伝子を発現したが、Th17様細胞で認められるレベルまでではないものの、Xcr1-cre.p28fl/flマウスのTh1様細胞はp28fl/flマウスのTh1様細胞より高レベルなTh17シグナル遺伝子を発現した (Fig.5 D)。分化発現遺伝子(DEG)解析は、いくつかのSI-LP CD4+T細胞サブセットの転写プロファイルが、Xcr1-cre.p28fl/flマウスとp28fl/fl対照間で異なることを示した(図5 Eおよび図S3、C-H)。これらのDEGのほとんどは、Th1様、Tエフェクターメモリー様、および増殖CD4+T細胞を含むクラスター内に集中していたため、これらのサブセット間で共有されているアップレギュレートまたはダウンレギュレートされた遺伝子があるかどうかを評価した(図5 F)。各サブセットは、ダウンレギュレートされた遺伝子と比較して、Xcr1-cre.p28fl/flマウスでより多くのアップレギュレートされた遺伝子を発現し、これらのうち23はすべてのサブセットで共有され、さらに29はTh1様細胞とTエフェクターメモリー様または増殖CD4+T細胞のどちらかで共有されていた(図5 F)。一方、Xcr1-cre.p28fl/flマウスでダウンレギュレートされた遺伝子のうち、異なるサブセットで共有されているものはほとんどなかった(図5 F)。一方、Xcr1-cre.p28fl/flマウスでは、ダウンレギュレーションされた遺伝子はほとんどなく(図5 F)、アップレギュレーションされた遺伝子の多くはTh17細胞の分化と機能に関連する遺伝子であった(図5 G)。このように、cDC1由来のIL-27は、腸内のTh1/Th17バランスを制御することに加えて、Th1細胞の発達に伴うTh17関連遺伝子の発現を抑制する重要な役割を担っていることがわかった。
Tregの生成と機能におけるIL-27の役割が示唆される報告が多数あるため(Zhang et al., 2020; Hall et al., 2012b; Do et al., 2016; Hall et al., 2012a)、さらに、腸内Tregサブセットの構成と転写に対するcDC1由来のIL-27の役割について検討した。このために、Xcr1-cre.p28fl/flおよびp28fl/fl SI-LPからのTreg様細胞を生物情報学的に再分離し、サブクラスターを作成した(図5、HおよびI)。すなわち、Ikzf2hiGata3hi nTreg様細胞の主要クラスター、Il-10hiLag3hiCcr2hi iTreg様細胞の主要クラスター、増殖Tregの小クラスター、および脾臓、肺および結腸で見つかった最近報告されたIfng+ Tregの集団と同じくIfngおよびCxcr6も選択的に発現したCcl5発現Tregの小クラスターが確認された (Lu et al., 2020)。これらのサブクラスターの割合は、Xcr1-cre.p28fl/flマウスとp28fl/flマウスの間で差がなく(図5 J)、nTregsとCcl5 Tregsのみが、Xcr1-cre.p28fl/flマウスとp28fl/flマウスの間で何らかのDEGs(それぞれ5つと1遺伝子)を示していることが確認された。このように、cDC1由来のIL-27は、SI-LP Tregサブセットのホメオスタシスや転写に影響を与えないことがわかった。
以上の結果から、cDC1由来のIL-27は、SI-LPのTh1/Th17ホメオスタシスの重要な決定因子であり、cDC1由来のIL-27の主な機能の1つは、腸リンパ組織におけるマイクロバイオータ依存性のT細胞プライミングにおいてTh1分化を促進しTh17関連転写プログラムを抑制することが示唆された。cDC1由来IL-27の欠損が腸のホメオスタシスや腸の炎症/感染に対する反応に及ぼす長期的な影響については、さらなる研究が必要である。
材料と方法
マウス
T-bet-ZsGreen-cre (T-bet-ZsGreen-T2A-CreERT2; Yu et al., 2015), Rosa26lsl-Tomato/+ (Säwen et al., 2018), Il12p35-/- (B6.129S1-Il12atm1Jm/J [#002692; JAX stock]; Mattner et al, 1996)、Il27ra-/-(B6N.129P2-Il27ratm1Mak/J[#018078;JAX株];Yoshida et al.、2001)、C57Bl/6NRj(ジャンビエ研究所)、Xcr1-cre (B6-Xcr1tm2Ciphe;Wohn et al, 2020)、ROSA-DTA(B6.129P2-Gt(ROSA)26Sortm1(DTA)Lky/J;#009669;JAX株;Voehringerら、2008)、MHCIIfl/fl(B6.129X1-H2-AB1tm1Koni/J;Hashimotoら、, 2002)、Ifnar-/-(B6(Cg)-Ifnar1tm1.2Ees/J)、C57BL/6-Gt(ROSA)26Sortm1(FLP1)Dym(Flp欠失)およびC57BL/6-Tg(TcraTcrb)425Cbn(OT-II)はルンド大学生物医学センターまたはマルメのクリニカル・リサーチセンターにて飼育・管理されたものである。Xcr1-cre.p28fl/flマウスの作製には、ホモ接合型Il27tm1a(EUCOMM)Wtsi精子(ヨーロッパマウス変異体アーカイブ)を用いてヘテロ接合型Il27tm1a(EUCOMM)Wtsi子孫を生成し、ネオマイシンカセットを除去したFlp欠失マウスと交差させた。その後、得られたp28fl/flマウスをXcr1-creマウスと交配した。動物実験はLund/Malmö動物倫理委員会に従って行われた。Ifnar-/-マウスを含む実験以外は同腹子を使用し、Ifnar-/-マウスと対照のC57Bl/6マウスは使用前に10-14日間同腹子を使用した。
マウスジェノタイピング
耳生検から抽出したDNAを以下のプライマーを用いてジェノタイピングを行った。Xcr1-cre、fw 5′-CCTCTCCTACGACATTCTGAC-3′およびrev 5′-ACTTCACCTTCACGATGCC-3′。ROSA-DTA、fw 5′-AAAGTCGCTCTGAGTTGTTAT-3′、5′-GCGAAGAGTTTGTCCTCAACC-3′およびrev 5′-GGAGCGGGAGAAATGATGATG-3′; ZsGreen、fw 5′-CAGAGAAAGCCCAGGAGCAG-3′およびrev 5′-CCTGAAGGGGTAGCCGATG-3′。tdTomato、fw 5′-GGCATTAAAGCAGCGTATCC-3′およびrev 5′-CTGTTCCTGTACGGCATGG-3′を有する。Il12p35、WT fw 5′-ACGGCTATGCCCGTTTCAC-3′およびrev 5′-GGTACTGACCTCCCTCCACA-3′、KO fw 5′-TGCCGAATCATGTGGAAAAT-3′およびrev 5′-TCGTCAAGAAGGCGATAGAAGGCG-3′; Il27ra、WT fw 5′-CAAGACCTTGTGCAGGTG-3′およびrev 5′-GTCACCATCTTGAGCCCAGT-3′、KO fw 5′-CTTGGGTGAGGCTATTC-3′およびrev 5′-AGGTGGATGACAGGAGATC-3′.p28、WT、floxed、およびdeleted alleles、fw 5′-TCTCTGTAAGTGAACGGCAAGG-3′、fw 5′-AAGGCGCATAACGATACCAC-3′および rev 5′-CCACTCCCATCACAGTCGTC-3′; およびMHCIIフロックス化および欠失型アリル、fw 5′-CATTTCCTTTGGGTTGCAGT-3′およびrev 5′-CTCACCCCAGGTATGTATCA-3′である。
細胞の分離
LP細胞懸濁液を、以前に記載されたように生成した(Ludaら、2016)。簡潔には、パイエル板と脂肪を除去した後、組織を縦方向に1cmの断片に切断し、Hepes(15mM;Gibco)、EDTA(2mM)、及びFBS(2%;Sigma-Aldrich)を含むHBSS中で、37℃で10分間、結腸組織については370rpmで撹拌しながらインキュベートした。このステップを37℃で15分間インキュベートしながら2回繰り返した。上皮細胞および残骸は、各洗浄後にナイロンフィルター(250μm)で濾過することにより除去した。残りの組織を洗浄し、2-ME(50μM、Gibco)、DNase I(30μg/ml、Sigma-Aldrich)、およびLiberase(0.5μm)を含むR10媒体(RPMI 1640、FBS[10%]、Hepes(10mM)、ピルビン酸ナトリウム[1mM]、ペニシリン[100U/ml]、ストレプトマイシン[100μg/ml];Gibco)中20-35分インキュベーションした。 3 Wuensch U/ml; Sigma-Aldrich)を含む磁気攪拌プレート上に、37℃、5%CO2で静置した。得られた細胞懸濁液を、40-70%Percoll(GE Healthcare)による密度勾配遠心分離の前に、セルストレーナー(100μm;Thermo Fischer Scientific)を通して濾過した。MLNおよび脾臓細胞懸濁液の生成には、臓器を70μmのセルストレーナーですりつぶした。
フローサイトメトリー
フローサイトメトリーは、以下の抗体を用いて標準的な手順で実施した。CD45 (1372.3 or 30-F11), TCRβ (H57-597), CD4 (RM4-5), IA/IE (MHCII, M5/114.15.2), and RORγt (Q31-378) was from BD Bioscience; CD45.1 (A20), CD45.2 (A20), CD45.3 (A20), CD45.3 (A20)。 1(A20)、CD45.2(104)、TCR Vα2(B20.1)、CD4(GK1.5)、CD8α(53-6.7)、CD19(6D5)、CD64(X54-5/7. 1)、B220(RA3-6B2)、NK1.1(PK136)、XCR1(ZET1)、IFN-γ(XMG1.2)、IL-17A(TC11-18H10.1)は BioLegendから、CD11c(N418 )、FoxP3(FJK-16s)、T-bet(eBio4B10)はeBioscienceから、CD11b(M1/70)は Invitrogenからであった。細胞内染色はFoxP3 Fixation/Permeabilization Kit (eBioscience)を用いて行った。細胞内サイトカインおよびFoxP3染色では、細胞を表面抗原で染色し、室温(RT)で20分間固定し、非特異的な抗体結合をブロックするために2%ラット血清を含む洗浄バッファーを用いてRTで15分間インキュベートした。その後、細胞をサイトカイン抗体およびFoxP3抗体とともに4℃で一晩インキュベートした。データはFortessaまたはLSRII(BD Bioscience)またはCytek Auroraで取得し、FlowJoソフトウェア(Tree Star)を使用して解析した。細胞凝集体はそのFSC-AとFSC-Wに基づいて除外し、死細胞はヨウ化プロピジウム(Sigma-Aldrich)、Fixable Viability Dye eFluor 450(Thermo Fisher Scientific)、Fixable Viability Dye eFlour 780(Thermo Fisher Scientific)による陽性染色に基づいて、あるいはLIVE/ DEAD Fixable Aqua Dead Cell Stain Kit(Thermo Fisher Scientific)により、排除した。
MLN cDCサブセットによるp28発現の評価
FACSAria III Cell Sorter(BD Bioscience)を用いて、定常状態のWTマウスのMLNから、またはαCD40(25μg;Biolegend)およびLPS(20μg;Sigma-Aldrich)またはポリ(I:C)(100μg;InvivoGen)のi.p.注入後にcDCサブセットをソーティングした。簡単に言うと、MLN CD11c+細胞は、抗CD11c磁気細胞分離ビーズ(Miltenyi Biotec)を用いて濃縮し、そしてソーティングの前に表面マーカーについて染色した。RNA Nano-prep kit(Agilent)を用いてトータルRNAを分離し、Ovation Pico WTA systemV2(TECAN)を用いてcDNAを調製・増幅し、Kapa SYBR FAST(Sigma-Aldrich)を用いてp28発現量を定量する定量PCRを実施した。プライマーは以下のものを使用した。b-アクチンセンス、5′-CCGGGACCTGACAGACTA-3′;b-アクチンアンチセンス、5′-GTTTCATGGATGCCACAGGAT-3′。p28センス、5′-ATCTCGATTGCCAGGAGTGA-3′;およびp28アンチセンス、5′-GTGGTAGCGAGGAAGCAGAGT-3′(Hooper et al. , 2017).
インビボ研究
系統追跡実験のために、T-bet運命マッピングマウスに、Kolliphor(25%;Sigma-Aldrich)及びエタノール(25%;Thermo Fischer Scientific)を含むPBS中の4-OHT(1.3mg/マウス;Sigma-Aldrich)を、130μl/マウスの総容量で注射した。IL-27中和研究のために、T-bet運命マッピングマウスに、抗マウスIL-27p28(MM27-B1)またはマウスIgG2aアイソタイプコントロール(C1.18.4)抗体(250μg/注射;BioXCell)を2d毎に2週間、i.p.注射した。微生物叢を枯渇させるため、マウスは飲料水中の広域抗生物質(アンピシリン[1 g/リットル]、バンコマイシン[0.5 g/リットル]、ネオマイシン[1 g/リットル]、メトロニダゾール[1 g/リットル])、バンコマイシン単独(0.5 g/リットル)またはネオマイシン単独(1 g/リットル)を指示期間、抗生物質溶液は2-3日ごとに交換し、対照群は清水のみ投与させた。
養子縁組T細胞移植
Naive CD4+ T細胞は、EasySep Mouse Naive CD4+ T cell isolation Kit(Stem Cell Technologies)を用いて、OT-IIおよびOT-II.Il27ra-/-マウスのMLNおよび脾臓から製造者の指示に従い精製された。OT-II細胞(1×106細胞/マウス)をC57/BL6レシピエントにi.v.注射し、レシピエントを24時間後にOVA(0.5mg、グレードV;Sigma-Aldrich)、抗CD40(25μg)およびLPS(20μg)のi.p.注射により免疫化した。免疫の1日および3日後に、レシピエントは、MLNからのリンパ球の脱出を防ぐためにFTY720(フィンゴリモド、20μg;Cayman)をi.p.注入された。マウスは、免疫化から4日後に犠牲にし、分析のためにMLNを単離した。抗体処理研究のために、抗マウスIL-27p28またはマウスIgG2aアイソタイプコントロール抗体を、免疫化時および免疫化2日後にi.p.(250μg)注射した。
Ex vivo T細胞刺激
SI-LPまたはMLN細胞を、PMA(25ng/ml;Sigma-Aldrich)およびイオノマイシン(500ng/ml;Sigma-Aldrich)を補充したR10培地(1ml)中の5ml丸底チューブ(1〜1.2×107細胞/チューブ)中で37℃、5%CO2で4時間インキュベートした。最後の3時間はGolgi Stop(1 μl; BD Bioscience)をチューブに加え、タンパク質の輸送を阻害した。細胞数は、Sysmex セルカウンター(Sysmex kx-21n、Sysmex)または、指示された場合にはSPHERO AccuCount蛍光粒子(Sherotech)を用いて各実験で算出した。前者については、細胞数はT細胞刺激前のSysmexカウントに基づき、後者については、T細胞刺激後に各サンプルに20,000個のAccuCount蛍光粒子を添加し、細胞表面染色、固定、フローサイトメトリーによる細胞内染色後のビーズ数に基づいて細胞数をカウントした。
scRNA-seqのための細胞調製
CD4+T細胞は、製造者の指示に従ってEasySep Mouse CD4+ T cell isolation Kit(Stem Cell Technologies)を使用してSI-LP細胞懸濁液から濃縮し、CD4+TCRαβ+T細胞はFACSAria II Cell Sorter(BD Bioscience)を使用して選別し、製造者の指示に従ってChromium Single Cell 3′ Reagent Kit v3を使用して液滴ベースのscRNA-sequに付した(10x Genomics)。10x Chromium Controllerは、各細胞を特定のバーコードで、各転写物を固有の分子識別子(UMI)で標識したGel Bead-In Emulsionsを生成した。RT時にGel Bead-In Emulsionを分解し、バーコード付きのcDNAをDynabeads MyOne Silane beads (Thermo Fisher Scientific)で精製し、PCRで増幅させた。増幅されたcDNAはSPRIselect (Beckman Coulter)でクリーンアップした。Chromium i7 Sample Index (10x Genomics)を用いた2回目の最終PCR増幅の前に、酵素的断片化、エンドリペア、A-tailingによりインデックスシーケンスライブラリーを構築し、イルミナR2配列、ユニークなサンプルインデックス(多重シーケンスが可能)、P5/P7イルミナシーケンスアドプターをそれぞれのライブラリへ導入した。マルチプレックスライブラリーをプールし、ウプサラのNational Genomic Infrastructure SNP&SEQ Technology Platformで、S1フローセル、NovaSeq 6000システム、v1.5 sequencing chemistry (Illumina, Inc.) を用いてシーケンシングを実施した。
scRNA-seq解析
参照ゲノムmm10に対するscRNA-seqデータのアライメントは、CellRanger(バージョン3.1.0;Dobinら、2013;Zhengら、2017)を用いて実施した。その後、サンプルをSeuratオブジェクト(バージョン4.1.1;Haoら、2021)としてR(バージョン4.1.3;R Core Team、2022)に読み込ませた。データの処理中に、UMIが異常に低いか高い細胞、およびデブリとダブレットを示す遺伝子数を持つ細胞を除去した。また、ミトコンドリア遺伝子含量が5%を超える細胞も除去された。閾値は、現在のベストプラクティス(Luecken and Theis, 2019)に従って、ミトコンドリア遺伝子含量と同様にUMIおよび遺伝子数を評価することによって設定された。DoubletFinder (version 2.0.3; McGinnis et al., 2019)を用いてダブレットと同定された細胞も除去した。
データは、関数NormalizeData(Seurat)を使用して正規化した。可変遺伝子は、選択方法を "vst" に設定した FindVariableFeatures 関数 (Seurat) を使用して検出した。遺伝子発現は、細胞周期、UMI数、ミトコンドリア遺伝子量の影響を除外してスケーリングした。細胞周期遺伝子セットは、Seuratが提供する細胞周期遺伝子リストから取得し、Musculusのホモログに変換した。次元削減のために主成分分析と Uniform Manifold Approximation and Projection (UMAP) を行い、Louvain algorithm (Seurat) を用いてクラスタリングを行った。最初のクラスタリング後、汚染されたセルを除去し、残りのセルに対してクラスタリングと次元削減の追加ラウンドが行われた。DEGは、FindAllMarkers機能(Seurat)を用いて、テスト設定ノンパラメトリックWilcoxon Rank Sum Testで同定された。クラスターは、同定されたDEGsに基づいて半教師付き方法で結合された。各クラスタの上位5つのDEGを使用して、AddModuleScore(Seurat)関数で遺伝子シグネチャを生成した。各サンプルについて擬似バルクデータセットを生成した後、DESeq2(バージョン1.34.0)を用いて擬似バルク差分遺伝子発現解析を行った(Love et al.、2014)。解析は、scRNA-seqデータの解析により生成された各クラスタに対して行った。log2倍変化の縮小は、LfcShrink関数(DESeq2)を用いて、typeを「apeglm」(Zhu et al.、2019)に設定し実施した。遺伝子発現差の結果のボルケーノプロットは、EnhancedVolcano(バージョン1.12.0;Bligheら、2022)を使用して生成した。有意なDEGは、調整P値<0.05およびlog2 fold change <-0.58 or >0.58と定義した。これらの遺伝子のヒートマップは、有意な遺伝子を入力として用い、異なるグループのすべてのマウスについて発現したスケールの平均を取り、scRNA-seqデータセット上でAverageExpression関数(Seurat)を使用して生成した。
データの配置
scRNA-seqデータのアクセッション番号。GSE218311。
統計解析
統計的有意性は、GraphPad Prismソフトウェア(GraphPad)を用いたMann-Whitney U検定により決定した。
オンライン補足資料
図S1は、Xcr-cre.DTAおよびROSA-DTAマウスのMLNおよびSI-LPにおけるcDCサブセット組成の代表的フローサイトメトリープロット、ならびにXcr1-cre.p28fl/flおよびp28fl/flマウスにおける腸内CD4+/CD8+ T細胞サブセット数の追加解析を示す。図S2は、36日齢のXcr1-cre.p28fl/flおよびp28fl/flマウスにおけるMLN cDCサブセット組成、腸の組織学、血清リポカリン2レベル、および腸内好中球の数を示す図である。定常状態、αCD40とPoly(I:C)またはLPSのin vivo投与後5時間および12時間におけるMLN cDCサブセットによるp28発現を示す図である。免疫の非存在下、またはOVA、αCD40、LPSによる免疫後のレシピエントマウスのMLNにおけるサイトカイン発現OT-II細胞の数および比率を示す。インビボαIL-27p28中和研究の実験概要を示し、αIL-27p28が、OVA、αCD40、及びLPSで免疫したマウスのMLNにおけるIFNγ-発現OT-II細胞の割合を減少させることを示す図である。図S3は、系統関連遺伝子発現解析を用いて同定されたSI-LP CD4+T細胞scRNA-seq UMAP内のThサブセット位置を示す。また、Xcr1-cre.p28fl/flマウスとp28fl/flマウス間で異なる各SI-LP CD4+T細胞クラスター内の差遺伝子のヒートマップを示している。
謝辞
Xcr1-creマウスはDr. B. Malissen(Aix-Marseille Université, Marseille, France)の好意により、T-bet-ZsGreen-T2A-CreERT2マウス(Yu et al, 2015)によるJ. Zhuマウス(National Institutes of Health, Bethesda, Maryland, USA)、B. Johansson-Lindbom博士(Lund University, Lund, Sweden)によるIfnar-/-マウス、D. Bryder博士(Lund University, Lund, Sweden)によるRosa26lsl-Tomato/+マウス、E. Sitnicka Quinn博士(Lund University, Lund, Sweden)によるFlp欠損マウスであった。原稿作成時にコメントをいただいたA. Mowat博士(グラスゴー大学)、ジェノタイピングに協力いただいたA. Selbergに感謝する。配列決定は、ウプサラのNational Genomics Infrastructure and Science for Life Laboratory SNP&SEQ Technology Platformで行った(Swedish Research Council and the Knut and Alice Wallenberg Foundationによる助成を受けた)。グラフィカルなアブストラクトはBioRender.comで作成。
本研究は、スウェーデン医学研究評議会(2017-02072)、スウェーデン癌財団(18 0598、211661 Pj)、デンマーク研究評議会(Sapere Aude III上級研究者助成金1331-00136B)、デンマークLundbeck財団(R155-2014-4184)からのW.W. Agaceへの助成金によって支援されました。
著者による寄稿。W.W. Agace と F. Ahmadi が研究の構想を練った。F. Ahmadi、C. Ashworth、A. Lappalainen、K. Kotarskyは実験を行った。U.M. MörbeとF. Ahmadiは10×シークエンス実験を行った。F. JunghusはscRNA-seqデータセットを解析した。W.W. Agace、F. Ahmadi、F. Junghusが原稿を執筆し、全著者の意見を取り入れて修正した。
参考文献
Anderson, D.A., III, C.-A. Dutertre, F. Ginhoux, and K.M. Murphy. 2021. ヒトおよびマウス樹状細胞の発生と機能に関する遺伝学的モデル。Nat. Rev. Immunol. 21:101–115. https://doi.org/10.1038/s41577-020-00413-x
Google ScholarCrossref PubMed
アタラシ, K., 田之上 崇, 安藤 正, 鎌田 直樹, 長野 良, 成島 悟, 須田 和彦, 今岡 明, 瀬戸山 博, 永森 智也, 他 2015. 腸管上皮細胞への微生物の接着によるTh17細胞の誘導。Cell. 163:367–380. https://doi.org/10.1016/J.CELL.2015.08.058
Google ScholarCrossref PubMed
アタラシ, K., タノウエ, シマ, イマオカ, クワハラ, モモセ, チェン, ヤマサキ, サイトウ, オオバ, 他. 2011年. クロストリジウム属菌による大腸制御性T細胞の誘導。Science. 331:337–341. https://doi.org/10.1126/science.1198469
Google ScholarCrossref PubMed
を、"li "と "li "の間に挟む。2022. を使用した。このような場合、「このような場合、どのようにすればよいですか?Rパッケージバージョン1.14.0, https://github.com/kevinblighe/EnhancedVolcano.
Google Scholar
Cerovic, V., S.A. Houston, J. Westlund, L. Utriainen, E.S. Davison, C.L. Scott, C.C. Bain, T. Joeris, W.W. Agace, R.A. Kroczek, et al. 2015. リンパ系CD8α+樹状細胞は、腸管上皮細胞から獲得した抗原でCD8+T細胞をクロスプライミングするユニークな能力を有する。Mucosal Immunol. 8:38–48. https://doi.org/10.1038/mi.2014.40
Google ScholarCrossref PubMed
Demiri, M., K. Müller-Luda, W.W. Agace, and M. Svensson-Frej. 2017. Distinct DC subsets regulate adaptive Th1 and 2 responses during Trichuris muris infection. Parasite Immunol. 39:e12458. https://doi.org/10.1111/pim.12458
Google Scholar
Do, J.S., A. Visperas, Y.O. Sanogo, J.J. Bechtel, N. Dvorina, S. Kim, E. Jang, S.A. Stohlman, B. Shen, R.L. Fairchild, et al.2016年. IL-27/Lag3軸は、Foxp3+制御性T細胞の抑制機能と治療効果を高める。Mucosal Immunol. 9:137–145. https://doi.org/10.1038/mi.2015.45
Google ScholarCrossref PubMed
Dobin, A., C.A. Davis, F. Schlesinger, J. Drenkow, C. Zaleski, S. Jha, P. Batut, M. Chaisson, and T.R. Gingeras. 2013. STAR: 超高速ユニバーサルRNA-seqアライナー。バイオインフォマティクス。29:15-21. https://doi.org/10.1093/bioinformatics/bts635
Google ScholarCrossref PubMed
Goto, Y., C. Panea, G. Nakato, A. Cebula, C. Lee, M.G. Diez, T.M. Laufer, L. Ignatowicz, and I.I. Ivanov. 2014. 腸管樹状細胞が提示する分節化糸状菌抗原は粘膜のTh17細胞分化を促進する。Immunity. 40:594–607. https://doi.org/10.1016/j.immuni.2014.03.005
Google ScholarCrossref PubMed
Hall, A.O.H., D.P. Beiting, C. Tato, B. John, G. Oldenhove, C.G. Lombana, G.H. Pritchard, J.S. Silver, N. Bouladoux, J.S. Stumhofer, et al.2012a.(2012年) サイトカインであるインターロイキン27とインターフェロンγは、感染症誘発性病態を抑制するために必要な異なるTreg細胞集団を促進する。Immunity. 37:511–523. https://doi.org/10.1016/j.immuni.2012.06.014
Google ScholarCrossref PubMed
Hall, A.O.H., J.S. Silver, and C.A. Hunter. 2012b. IL-27の免疫生物学。2012b. The immunobiology of IL-27. 115:1–44. https://doi.org/10.1016/B978-0-12-394299-9.00001-1
Google ScholarCrossref PubMed
Hao, Y., S. Hao, E. Andersen-Nissen, W.M. Mauck III, S. Zheng, A. Butler, M.J. Lee, A.J. Wilk, C. Darby, M. Zager, 他 2021. マルチモーダルなシングルセルデータの統合解析 Cell. 184:3573–3587.e29. https://doi.org/10.1016/j.cell.2021.04.048
Google ScholarCrossref PubMed
橋本和彦、S.K.Joshi、P.A.Koni. 2002. A conditional null allele of the major histocompatibility IA-beta chain gene. Genesis. 32:152–153. https://doi.org/10.1002/gene.10056
Google ScholarCrossref PubMed
Hooper, K.M., J.-H. Yen, W. Kong, K.M. Rahbari, P.-C. Kuo, A.M. Gamero, and D. Ganea. 2017. マウス樹状細胞におけるプロスタグランジンE2によるIL-27産生抑制。IRF1が関与する新規メカニズム。J. Immunol. 198:1521–1530. https://doi.org/10.4049/jimmunol.1601073
Google ScholarCrossref PubMed
Ivanov, I.I., K. Atarashi, N. Manel, E.L. Brodie, T. Shima, U. Karaoz, D. Wei, K.C. Goldfarb, C.A. Santee, S.V. Lynch, et al.2009 年. セグメント化された糸状菌による腸管Th17細胞の誘導。Cell. 139:485–498. https://doi.org/10.1016/j.cell.2009.09.033
Google ScholarCrossref PubMed
Ivanov, I.I., R.L. Frutos, N. Manel, K. Yoshinaga, D.B. Rifkin, R.B. Sartor, B.B. Finlay, and D.R. Littman.(イワノフ、イワノフ、リフキン、R.L. フルータス、N. マネル、吉永和彦)。2008. 小腸粘膜におけるIL-17産生T-ヘルパー細胞の分化を特異的微生物相が誘導する。Cell Host Microbe. 4:337–349. https://doi.org/10.1016/j.chom.2008.09.009
Google ScholarCrossref PubMed
Ivanov, I.I., T. Tuganbaev, A.N. Skelly, and K. Honda.(イワノフ、イワノフ、トゥガンバエフ、スケリー、本田)。2022. 微生物叢に対するT細胞応答。Annu. Rev. Immunol. 40:559–587. https://doi.org/10.1146/annurev-immunol-10132010.1146/annurev-immunol-101320-011829
Google ScholarPubMed
Joeris, T., C. Gomez-Casado, P. Holmkvist, S.J. Tavernier, A. Silva-Sanchez, L. Klotz, T.D. Randall, A.M. Mowat, K. Kotarsky, B. Malissen, and W.W. Agace.(日本学術振興会特別研究員、東京大学名誉教授)。2021. 腸管cDC1は、FoxP3+CD8+ Tregの誘導を介して、上皮由来抗原に対する交差寛容を駆動する。Sci. Immunol. 6:eabd3774。https://doi.org/10.1126/sciimmunol.abd3774。
Google Scholar
Joeris, T., K. Müller-Luda, W.W. Agace, and A.M.I. Mowat. 2017. 腸管単核食細胞の多様性と機能. Mucosal Immunol. 10:845–864. https://doi.org/10.1038/mi.2017.22
Google ScholarCrossref PubMed
Kilgore, A.M., N.D. Pennock, and R.M. Kedl. cDC1 IL-27p28 production predicts vaccine-elicited CD8+ T cell memory and protective immunity.2020年。J. Immunol. 204:510–517. https://doi.org/10.4049/jimmunol.1901357
Google ScholarCrossref PubMed
Kilgore, A.M., S. Welsh, E.E. Cheney, A. Chitrakar, T.J. Blain, B.J. Kedl, C.A. Hunter, N.D. Pennock, and R.M. Kedl.(キルゴア、A.M.)。2018. XCR1+樹状細胞および単球によるIL-27p28産生は、アジュバント誘発CD8+ T細胞応答を効果的に予測する。Immunohorizons. 2:1–11. https://doi.org/10.4049/immunohorizons.1700054
Google ScholarCrossref PubMed
Kim, K.S., S.W. Hong, D. Han, J. Yi, J. Jung, B.G. Yang, J.Y. Lee, M. Lee, and C.D. Surh.(以下、K.S.と略す)。2016. 食事性抗原は、小腸の制御性T細胞を誘導することで粘膜免疫を制限する。サイエンス. 351:858–863. https://doi.org/10.1126/science.aac5560
Google ScholarCrossref PubMed
Ladinsky, M.S., L.P. Araujo, X. Zhang, J. Veltri, M. Galan-Diez, S. Soualhi, C. Lee, K. Irie, E.Y. Pinker, S. Narushima, et al. 2019. 腸管上皮細胞による常在抗原のエンドサイトーシスは、粘膜T細胞のホメオスタシスを制御する。Science. 363:eaat4042. https://doi.org/10.1126/science.aat4042
Google Scholar
ルイス、K.L.、M.L.キャトン、M.ボグノビッチ、M.グレター、L.T.グラジュコウスカ、D.ン、A.クリナキ、 I.F.Charo 、S.ユング、J.L. ゴマン、他2011. Notch2受容体シグナルは、脾臓と腸における樹状細胞の機能分化を制御する。Immunity. 35:780–791. https://doi.org/10.1016/j.immuni.2011.08.013
Google ScholarCrossref PubMed
2021. 腸管上皮IL-27は、上皮内リンパ球の誘導を介して腸管免疫を付与する。J. Exp. Med. 218:e20210021. https://doi.org/10.1084/jem.20210021
Google Scholar
Longhi, M.P., C. Trumpfheller, J. Idoyaga, M. Caskey, I. Matos, C. Kluger, A.M. Salazar, M. Colonna, and R.M. Steinman. 2009. 樹状細胞が成熟し、ポリICをアジュバントとしてCD4+ Th1免疫を誘導するためには、全身性のI型インターフェロン応答を必要とする。J. Exp. Med. 206:1589–1602. https://doi.org/10.1084/jem.20090247
Google ScholarCrossref PubMed
ラブ、M.I.、W.フーバー、およびS.アンダース。2014. DESeq2によるRNA-seqデータのフォールドチェンジと分散のモデレートされた見積もり。Genome Biol. 15:550。https://doi.org/10.1186/s13059-014-0550-8。
Google ScholarCrossref PubMed
Lu, D.R., H. Wu, I. Driver, S. Ingersoll, S. Sohn, S. Wang, C.M. Li, and H. Phee. 2020. マウスIL-2ムテインによる制御性T細胞の不均一性と機能の動的な変化。Life Sci. Alliance. 3:e201900520. https://doi.org/10.26508/lsa.201900520
Google Scholar
Luciani, C., F.T. Hager, V. Cerovic, and H. Lelouard. 2022. 腸管免疫の誘導部位とエフェクター部位における樹状細胞機能。Mucosal Immunol. 15:40–50. https://doi.org/10.1038/s41385-021-00448-w
Google ScholarCrossref PubMed
Luda, K.M., T. Joeris, E.K. Persson, A. Rivollier, M. Demiri, K.M. Sitnik, L. Pool, J.B. Holm, F. Melo-Gonzalez, L. Richter, et al.2016.(英語) IRF8転写因子依存性古典的樹状細胞は、腸管T細胞のホメオスタシスに不可欠である。Immunity. 44:860–874. https://doi.org/10.1016/j.immuni.2016.02.008
Google ScholarCrossref PubMed
Luecken, M.D., and F.J. Theis. 2019. シングルセルRNA-seq解析における現在のベストプラクティス。チュートリアル(A tutorial). モル. Syst. Biol. 15:e8746。https://doi.org/10.15252/msb.20188746。
Google Scholar
このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。1996. インターロイキン12を欠く遺伝子抵抗性マウスは、Leishmania majorの感染に感受性があり、偏光Th2細胞応答をマウントする。Eur. J. Immunol. 26:1553–1559. https://doi.org/10.1002/eji.1830260722
Google ScholarCrossref PubMed
Mayer, J.U., M. Demiri, W.W. Agace, A.S. MacDonald, M. Svensson-Frej, and S.W. Milling. 2017. CD11b+樹状細胞の異なる集団は、小腸と大腸でTh2応答を駆動する。Nat. Commun. 8:15820. https://doi.org/10.1038/ncomms15820
Google ScholarCrossref PubMed
McGinnis, C.S., L.M. Murrow, and Z.J. Gartner. 2019. DoubletFinder: 人工最近傍を用いた単一細胞RNAシーケンスデータにおけるダブレット検出。Cell Syst. 8:329–337.e4. https://doi.org/10.1016/j.cels.2019.03.003
Google ScholarCrossref PubMed
Mei, Y., Z. Lv, L. Xiong, H. Zhang, N. Yin, and H. Qi. 2021. CD4+T細胞におけるIL-27の二重の役割。Mol. Immunol. 138:172–180. https://doi.org/10.1016/j.molimm.2021.08.001
Google ScholarCrossref PubMed
太田 崇、杉山 正、辺見 浩、山崎 千春、大倉 悟、佐々木 郁、福田 泰、折茂 崇、石井 浩司、星野 圭、他 2016. XCR1発現樹状細胞とXCR1-XCL1ケモカイン軸が腸管免疫恒常性維持に果たす重要な役割. Sci. Rep. 6:23505。https://doi.org/10.1038/srep23505。
Google ScholarCrossref PubMed
Persson, E.K., H. Uronen-Hansson, M. Semmrich, A. Rivollier, K. Hägerbrand, J. Marsal, S. Gudjonsson, U. Håkansson, B. Reizis, K. Kotarsky, and W.W. Agace. 2013. IRF4転写因子依存性CD103(+)CD11b(+)樹状細胞は粘膜Tヘルパー17細胞の分化を促進する。Immunity. 38:958–969. https://doi.org/10.1016/j.immuni.2013.03.009
Google ScholarCrossref PubMed
R Core Team. 2022. R: A language and environment for statistical computing. R Foundation for Statistical Computing, https://www.R-project.org/.
Säwen, P., M. Eldeeb, E. Erlandsson, T.A. Kristiansen, C. Laterza, Z. Kokaia, G. Karlsson, J. Yuan, S. Soneji, P.K. Mandal, et al.2018年。マウス造血幹細胞はネイティブな造血に活発に寄与するが、加齢に伴い分化能が低下する。Elife. 7:e41258. https://doi.org/10.7554/eLife.41258
グーグルシュラー
Schlitzer, A., N. McGovern, P. Teo, T. Zelante, K. Atarashi, D. Low, A.W.S. Ho, P. See, A. Shin, P.S. Wasan, et al.2013.。IRF4転写因子依存性のCD11b+樹状細胞は、ヒトとマウスで粘膜のIL-17サイトカイン応答を制御している。Immunity. 38:970–983. https://doi.org/10.1016/j.immuni.2013.04.011
Google ScholarCrossref PubMed
田之上 崇、アタラシ カズオ、本田 圭一. 2016. 腸管制御性T細胞の発生と維持。Nat. Rev. Immunol. 16:295–309. https://doi.org/10.1038/nri.2016.36
Google ScholarCrossref PubMed
Tindemans, I., M.E. Joosse, and J.N. Samsom. 2020. Dissecting the heterogeneity in T-cell mediated inflammation in IBD(IBDにおけるT細胞媒介性炎症の不均一性を解明する)。Cells. 9:110. https://doi.org/10.3390/cells9010110
Google ScholarCrossref PubMed
Trinchieri, G. 2003. Interleukin-12 and the regulation of innate resistance and adaptive immunity(インターロイキン12と自然免疫と適応免疫の調節)。Nat. Rev. Immunol. 3:133–146. https://doi.org/10.1038/nri1001
Google ScholarCrossref PubMed
Troy, A.E., C. Zaph, Y. Du, B.C. Taylor, K.J. Guild, C.A. Hunter, C.J.M. Saris, and D. Artis. 2009. IL-27は、腸のCD4+エフェクターT細胞プールのホメオスタシスを制御し、大腸炎のマウスモデルにおける腸の炎症を制限する。J. Immunol. 183:2037–2044. https://doi.org/10.4049/jimmunol.0802918
Google ScholarCrossref PubMed
Vignali, D.A.A., and V.K. Kuchroo. 2012. IL-12ファミリーサイトカイン。免疫学的プレイメーカー。Nat. Immunol. 13:722–728. https://doi.org/10.1038/ni.2366
Google ScholarCrossref PubMed
Voehringer, D., H.-E. Liang、およびR.M. Locksley。2008. Voehringer, D., H.-E. Liang, and R.M. Locksley, 2008. 構成的T細胞欠失マウスにおけるリンパ球減少による「記憶様」T細胞の恒常性とエフェクター機能。J. Immunol. 180:4742–4753. https://doi.org/10.4049/jimmunol.180.7.4742
Google ScholarCrossref PubMed
ウェルティ、N.E.、C.ステイリー、N.ギラルディ、M.J.サドウスキー、B.Z.イジャルトー、およびD.H.カプラン. 2013. 腸管固有樹状細胞は、T細胞のホメオスタシスを維持するが、交接には影響を与えない。J. Exp. Med. 210:2011–2024. https://doi.org/10.1084/jem.20130728
Google ScholarCrossref PubMed
Wohn, C., V. le Guen, O. Voluzan, F. Fiore, S. Henri, and B. Malissen. 2020. cDC1樹状細胞上のMHCクラスIIの欠如は、交差提示された自己抗原に対して致命的な自己免疫を誘発する。Sci. Immunol. 5:eaba1896. https://doi.org/10.1126/sciimmunol.aba1896
Google Scholar
Yang, Y., M.B. Torchinsky, M. Gobert, H. Xiong, M. Xu, J.L. Linehan, F. Alonzo, C. Ng, A. Chen, X. Lin, et al.2014. 常在菌抗原に対する腸管TH17細胞の集中的な特異性。Nature. 510:152–156. https://doi.org/10.1038/nature13279
Google ScholarCrossref PubMed
吉田秀雄、濱野聡、G. セナルディ、T. コビー、R. ファッジョーニ、S. ミュー、M. シャ、A. C. ウェイクハム、仁科裕、J. ポッター、他 2001年。WSX-1は、Th1応答の開始とL. major感染に対する抵抗性に必要である。Immunity. 15:569–578. https://doi.org/10.1016/S1074-7613(01)00206-0
Google ScholarCrossref PubMed
ヨシダ ヒロシ、C.A.ハンター. 2015. インターロイキン-27の免疫生物学(The immunobiology of interleukin-27). Annu. Rev. Immunol. 33:417–443. https://doi.org/10.1146/annurev-immunol-032414-112134
Google ScholarCrossref PubMed
Yu, F., S. Sharma, J. Edwards, L. Feigenbaum, and J. Zhu. 2015. 制御性T細胞による転写因子T-betおよびGATA-3の動的な発現は、免疫寛容を維持する。Nat. Immunol. 16:197–206. https://doi.org/10.1038/ni.3053
Google ScholarCrossref PubMed
Zhang, H., A. Madi, N. Yosef, N. Chihara, A. Awasthi, C. Pot, C. Lambden, A. Srivastava, P.R. Burkett, J. Nyman, et al.2020年。IL-27駆動の転写ネットワークは、Tヘルパー細胞サブセット全体でIL-10発現の制御因子を特定する。Cell Rep. 33:108433。https://doi.org/10.1016/j.celrep.2020.108433。
Google ScholarCrossref PubMed
Zheng, G.X.Y., J.M. Terry, P. Belgrader, P. Ryvkin, Z.W. Bent, R. Wilson, S.B. Ziraldo, T.D. Wheeler, G.P. McDermott, J. Zhu, and al. 2017年。単一細胞の超並列デジタル転写プロファイリング。Nat. Commun. 8:14049. https://doi.org/10.1038/ncomms14049
Google ScholarCrossref PubMed
Zhu, A., J.G. Ibrahim, and M.I. Love. 2019. シーケンスカウントデータの重尾型事前分布。ノイズを除去し、大きな差異を保存する。バイオインフォマティクス. 35:2084–2092. https://doi.org/10.1093/bioinformatics/bty895
Google ScholarCrossref PubMed
著者ノート
開示。著者らは、競合する利害関係が存在しないことを宣言している。
