
ミミウイルスからミルスウイルスへ: 隠れた巨人の探求
MDPIオープンアクセスジャーナル
zoom_out_map検索メニュー
雑誌 ウイルス 第15巻 第8号 10.3390/v15081758
設定論文別刷り注文
オープンアクセスレビュー
ミミウイルスからミルスウイルスへ: 隠れた巨人の探求
https://www.mdpi.com/1999-4915/15/8/1758
モルガン・ガイア1,2,*およびパトリック・フォルテール3,4,*著
1
ジェノスコープ、フランソワ・ジャコブ研究所、CEA、CNRS、エブリ大学、パリ・サクライ大学、91000エブリ、フランス、代謝生物学
2
地球海洋システム生態進化研究連合、FR2022/Tara GOSEE、75012 Paris, France
3
細胞統合生物学研究所(I2BC)、CNRS、パリ・サクライ大学、91190 ジフ・シュル・イヴェット、フランス
4
微生物学部門、パスツール研究所、75015パリ、フランス
*
著者宛先
Viruses 2023, 15(8), 1758; https://doi.org/10.3390/v15081758 (DOI登録)
受理された: 2023年7月26日/改訂:2023年8月14日/受理:2023年8月16日/発行:2023年8月17日 2023年8月16日 / 公開:2023年8月17日
(本稿は、特集「巨大ウイルスの研究進展」に属する: ジャン=ミシェル・クラベリ教授に捧げるテーマ号)
ダウンロード 閲覧 図 レビュー レポート バージョン ノート
要旨
100年以上前にウイルス学の分野が始まって以来、私たちのウイルスに対する認識は劇的に進化してきた。特にヌクレオサイトウイルス門の巨大ウイルスの発見は、極めて重要な出来事であった。これまで隠されていたその多様性と豊富さは、ウイルスの世界に前例のない複雑さをもたらし、その複雑さは新たな定義と概念を必要とした。これらの巨大ウイルスは、ウイルスと宿主の間で長い時間をかけて繰り広げられる複雑な相互作用を強調するものであり、それ自体がこの細胞領域の黎明期以来、真核生物の進化の原動力として重要な役割を果たしてきたと疑われている。宿主との特別な関係を持つにせよ、小さなウイルスに隠されていたウイルスと細胞との進化のつながりの深さを明らかにするにせよ、巨大ウイルスは科学界だけでなく、世界中の人々を惹きつけてやまない。しかし、巨大ウイルスにはまだ驚きが隠されている。実際、最近発見されたミルスウイルスは、巨大ウイルスとヘルペスウイルスを結びつけている。この発見は、ヌクレオサイトウイルスの進化的展望を大きく広げるものである。間違いなく、今後数年間は驚きの連続であろう。
キーワード:巨大ウイルス;Nucleocytoviricota;ウイルス真核発生;進化
成熟しつつあるウイルス学の分野
19世紀後半に登場した、細菌とは異なる感染因子としてのウイルスに関する最初の近代的提案[1,2]は、新しい生物学分野であるウイルス学の基礎を築いたが、同時に残念なことに、ほぼ1世紀にわたって持続した偏った視点を確立した。実際、ウイルス学は、ウイルスを極めて小さな病原体(限外濾過を通過できる)として特徴づけ、感染症、すなわち特にヒト、家畜、農業における疾病を伝播させた。このように、しばしば単純さと混同される大きさの基準は、細胞とウイルスを区別するための基本的なものとなり、その研究は主にウイルスが引き起こす可能性のある病気を中心に展開された。ウイルス粒子(ビリオン)の最初の観察[3,4]では、感染を伝播することができる極めて小さく静的な幾何学的構造が描写されており、この描写によって生物学者はさらに、ウイルスとそのビリオンを同一視するようになった。ビリオンは、小さなゲノムを保護する受動的なタンパク質の殻であり、細胞への感染を通じてのみ間接的に進化することができた。その結果、ウイルスは生命の外にある単純な存在として認識されるようになった。ウイルスのタンパク質の結晶化に初めて成功したスタンレーでさえ、1946年に生理学・医学賞ではなく化学賞を受賞した。さらに、「ウイルス」という用語は真核生物に感染するものに限定され、細菌に感染するものは「ファージ」と呼ばれた。これは、1960年代に顕著になった、真核生物と原核生物という二項対立的な生命の分類を反映している[5]。生命が3つの細胞ドメイン(真核生物、古細菌、細菌)[6]に分類され、それぞれがウイルス球の特定の部分に関連することが明らかになったにもかかわらず[7]、この命名法は変更されることなく、今日に至るまで、細菌ウイルスは一般的にバクテリオファージと呼ばれている。
20世紀後半に行われた環境研究は、ウイルスに対する私たちの認識を一変させるきっかけとなった。事実上、あらゆるバイオームにわたって、ウイルスが極めて豊富で多様であることを明らかにしたからである [8,9,10]。ヒトや動物の組織だけでなく、海、湖、土壌、そして細胞生命体が生息するあらゆる場所に、ウイルスは豊富に存在している。実際、ウイルス粒子の数は、最も豊富な細胞性生物であるバクテリアの数を、さまざまな大きさで上回っていると推定されている [10,11]が、蛍光顕微鏡で見ると細胞外膜小胞に似ていることから、過大評価されていることもある [12]。1970年代以降、ウイルスはボルチモア分類の中で、ゲノムの種類(例えば、二本鎖DNAウイルスや正電荷を持つ一本鎖RNAウイルスなど)のみから定義されるクラスで整理され、その結果、進化的に無関係な様々なウイルスがグループ化された。しかし、時間の経過とともに、ウイルスはICTV(国際ウイルス分類委員会)分類において、遺伝子の保存、配列、構造の類似性に基づく分類学から徐々に分類されるようになってきた[13]。しかし、ウイルスの比類なき多様性は、このアプローチを複雑にし、多くの未分類ウイルスを生み出している。1971年には、当時の分類学上の最高ランクである2つの科しか記載されていなかった(国際ウイルス分類委員会(ICTV): https://ictv.global/taxonomy/、2023年7月3日にアクセス)。それから50年以上経った2022年には、ウイルスは6領域、10界、64目、169科に整理された[14]。ウイルスの極端な多さと多様性は、病気を引き起こすというウイルスの潜在的な役割だけに焦点を当てることが、生物圏におけるウイルスの位置づけに対する理解を狭めていたことを浮き彫りにしている。このパラダイムから解き放たれ、一部の科学者は、生態学から進化まで、特に細胞進化という観点から、ウイルスが果たすであろう多様な役割を探求し始めた。例えば、20年以上前、DNAとDNA複製タンパク質はDNAウイルスから発生した可能性があると提唱された[15,16,17]。一方、竹村とベルは、複雑なポックスウイルスのようなDNAウイルスが真核の出現を促した可能性を示唆するウイルス真核発生仮説を独自に展開した[18,19]。巨大ウイルスの発見 従来の常識を覆す
2003年、アメーバから分離された真核生物の二本鎖DNAウイルスであるミミウイルスが発見され、ウイルスに対する我々の理解が徐々に進展する転機が訪れた[20]。ミミウイルスの粒子径は約700nmで、ウイルスがいくつかの小さな細菌と同程度の大きさになりうることを証明し、極端に小さいという100年来の概念を打ち砕いた。ミミウイルスのゲノムの解析からも大きな発見があった。約1.2MbのDNAゲノムには、1000近い推定遺伝子がコードされており、その中には、特に翻訳機構など、以前は細胞生物にしかないと考えられていた機能に関連するものも多く含まれていた。
この画期的な発見を契機に、関連するウイルスの探索が活発に行われ(表1を参照)、ゲノムが2.5 Mbに達するパンドラウイルス[22](いくつかの寄生真核生物に類似)から、頭のしっぽの形をしたツパンウイルス[23]、あるいは粒子サイズ1.5 µmを誇る、これまでに同定された中で最大のウイルスであるピトウイルス[24]に至るまで、巨大ウイルスの新たな多様性が発見された。系統発生学的および系統発生学的解析により、これらのウイルスはその多様性にもかかわらず、真核生物の多様性全体に感染する大型dsDNAウイルスのグループであるNucleocytoviricota門[25](以前はNucleoCytoplasmic Large DNA Virus assemblage[26]として知られていた)内で互いに関連していることが示された[27]。ビリオンのサイズとゲノムの長さが細胞性生物とほぼ重なり、遺伝子の内容が宿主との未知の進化的関係を示唆していることから、巨大ウイルスの発見は、ウイルスの起源と進化に関する議論だけでなく、ウイルスを生命体と見なすべきかどうかという論争を含む、ウイルスの定義そのものに関する議論を再び活性化させた [21,28,29,30,31]。
この後者の疑問は、2008年にミミウイルスに感染できるウイルス、すなわちヴィロファージが発見されたことで特に顕著になった[32]。これらの小さなウイルス(長さ50~75 nm、17~30 kbのdsDNAゲノムを持つ粒子)は、単独では感染を伝播することができない。その代わり、ミミウイルスと一緒にアメーバ宿主に感染する。ヴィロファージは、ほとんどの巨大ウイルスの感染と同時に形成される細胞質コンパートメントであるヴィリオンファクトリー内で複製し、新しい粒子を形成する。ヴィロファージの発見は、細胞とウイルスの相互作用における新たな複雑さに光を当て、ウイルス自身が他のウイルスに標的にされる可能性があることを明らかにした。このことから、ウイルスが病気になることができるのであれば、ウイルスも生きているとみなすべきだという意見も出てきた [33]。この挑発的な発言は、ウイルスとその細胞宿主との境界が、明確な線引きから、より複雑な連続体へと変化し、新しい概念と定義が必要となったことを強調している。
表1. 過去20年間のウイルス学分野を特徴づける発見、観察、提案の要約。パラダイムの変化
初期の頃、巨大ウイルスは、コア遺伝子マーカーの系統学的推論に基づき、真核生物、細菌、古細菌とは別の起源(おそらく絶滅した細胞ドメインからの減少)を持つ、別個の第4の生命ドメインを構成するものとして提唱された [21,39] 。しかし、これらの系統解析は、技術的なバイアスの可能性について議論された [28,40,41,42]。しかし、世界的には、第4ドメイン仮説は、バリドナビリアウイルス領域内にヌクレオサイトウイルス門(大型で巨大なdsDNAウイルスの門)が含まれることを証明した大規模な進化学的研究により、基本的に無視された [25,43,44,45]。この領域には、真核生物に感染するdsDNAウイルスの他の関連グループ(アデノウイルス科やラヴィダウイルス科など)や、古細菌や細菌に感染するウイルス(Tectiliviricetes目)が含まれる。この領域は、ビリオンの形態形成モジュール、すなわちウイルス粒子の形成に関連する遺伝子(主要カプシドタンパク質とパッケージングATPアーゼ)が世界的に保存されていることが特徴である。重要なことは、ヌクレオサイトウイルスを除くすべてのバリドナウイルスが、より従来型の粒子サイズとゲノムサイズを示すことである。したがって、巨大ウイルスと小型のバリドナウイルスとの間に共通の起源があることは、巨大ウイルスだけに限定された第4のドメインという考え方とは矛盾し、その代わりにヌクレオサイトウイルスの巨大化への特異的な進化経路を示唆している。このシナリオは、このウイルス門における巨大化のいくつかの出現を強調した、より最近の進化的分析によって支持されている[44,46]。
ウイルスを単なる不活性な部外者として排除することなく、包括的な生命の概念を提案するために、2008年、特に私たちの一人により、特定の遺伝子の含有量に基づく定義が提案された。この定義では、細胞ドメインについてはリボソームをコードする生物とは対照的に、ウイルスはキャプシドをコードする生物に分類されるとした[47]。その後、この定義は、パンドラウイルス[22,50]のような奇妙なものも含め、ビリオンを形成するために使用されるあらゆるタイプのタンパク質構造に対応するために、ビリオンをコード/産生する生物と呼ばれるようになった[48,49]。この提案の背後にある意図は、ウイルスを細胞と同等の地位に引き上げ、単一の特異的な特徴によって区別される2つの主要なグループに分割された生物界にすることであった。しかし、この提案は、ほとんどの生物学者が歴史的に細胞に対して保留してきた用語である「生物」としてウイルスを定義したため、重要な課題に直面した [51]。巨大ウイルスは遺伝子を多く含み、小型ウイルスに感染しやすいにもかかわらず、ウイルスの生物学的特徴は、その粒子への頻繁な同化のため、実にあいまいなままであった。1983年、クラウディウ・バンデア(Claudiu Bandea)は、ウイルスは生理的に活性な細胞内相を持つ生物として認識されるべきであると提唱した [52]。ミミウイルスの発見後、クラベリーはウイルス工場(感染サイクルの間に宿主の細胞質内に形成される複雑な小器官のような構造体)を実際のウイルス生物とみなすべきだと提案した[53]。実際、非感染細胞には存在しないこの構造体は、ウイルスによる感染に厳密に特異的であり、ウイルスゲノムの複製からビリオンの組み立てに至るまで、ウイルスサイクルのかなりの部分がこの中で起こる。しかし、この提案は本質的に、感染によってウイルス工場(巨大ウイルスに限定されない戦略)を形成するウイルスにのみ適用されるものであり、ウイルス球のかなりの部分、特に細菌や古細菌ウイルスの大部分を除外するものである。
50年以上前、ルウォフが1965年のノーベル賞受賞講演の際に述べた、バクテリオファージに感染した細菌は完全にウイルス工場に変化するという発言に触発され[54]、私たちの一人は、ウイルスの活性型はウイルス工場だけでなく、むしろウイルス細胞、すなわち「ウイルス細胞」として働く感染細胞全体であるべきだと再度提案した[30,49,55]。多数のウイルスが感染する際に産生されるウイルス工場は、ウイルス細胞のウイルス核の一形態に例えることができる。ヴィロセル概念」のもとでは、ウイルスは、不活性な細胞外形態に相当するヴィリオン、宿主ゲノムに潜在的に統合可能なウイルスゲノム、および感染細胞または「ヴィロセル」という、いくつかの一過性の状態によって説明することができる。この後者の状態は、ウイルスの生物学的段階とみなすことができ、ウイルスタンパク質の発現が宿主細胞の生理機能を大きく変化させ(時には根本的に)、ウイルスゲノムの複製を確実にし、新しいビリオンの産生を最大化する。virocell」という用語は、現在ではウイルス感染によって引き起こされる形質転換を掘り下げた出版物で定期的に使われており[37,56,57]、特に環境研究においては、virocellを非感染細胞、すなわちリボ細胞と区別することの重要性が強調されている[55]。興味深いことに、代謝がないことは長い間ウィルスの特徴的な特徴であり、非生物に分類される根拠の一つでもあった [28]。しかしながら、ウイルス細胞代謝は、ウイルスにコードされた代謝酵素および/または細胞経路の制御因子の発現後に生じる新しい代謝状態を表している[57]。そのため、ウイルス細胞という概念は、付随的にウイルスが生物であるという概念を強化することになる。同様に、ウイルスは宿主の進化の単なる副産物として認識される進化のために、生命の枠外で認識されることが多かった [28]。しかし、感染細胞をウイルスの定義に組み込むことは、ウイルスが自ら進化することを意味する。実際、このファージの間、ウイルスゲノムは複製され、変異と淘汰を受け、しばしばリボ細胞で観察されるような複製過程のエラーによって駆動され[58,59]、そしておそらく新しい遺伝子が徐々にde novoに由来するようになる。その結果、ウイルス遺伝子はウイルス内でゆっくりと、しかし継続的に出現している可能性が高く、ウイルスゲノム中のORFanの割合の多さを説明し、機能未知の大きな貯蔵庫を構成している可能性がある。
この観点からすると、細胞ゲノムで同定され、しばしば他の最初の宿主から移入されたと推定されるウイルス遺伝子は、実際には厳密にウイルス起源である可能性がある。この可能性は、ウイルスが細胞領域の進化に果たしたかもしれない役割を、単なる遺伝子転移の代理人から、遺伝的新奇性の積極的な供給源へと高めるものである [30]。ウイルスが宿主に与える強力で永続的な淘汰圧を超えて、ウイルスは変異を誘発し、生命進化の主要な原動力として機能するのである[60]。その意味で、巨大ウイルスは現代の真核生物の出現に重要な役割を果たしたと思われる。巨大ウイルスとウイルス真核発生仮説
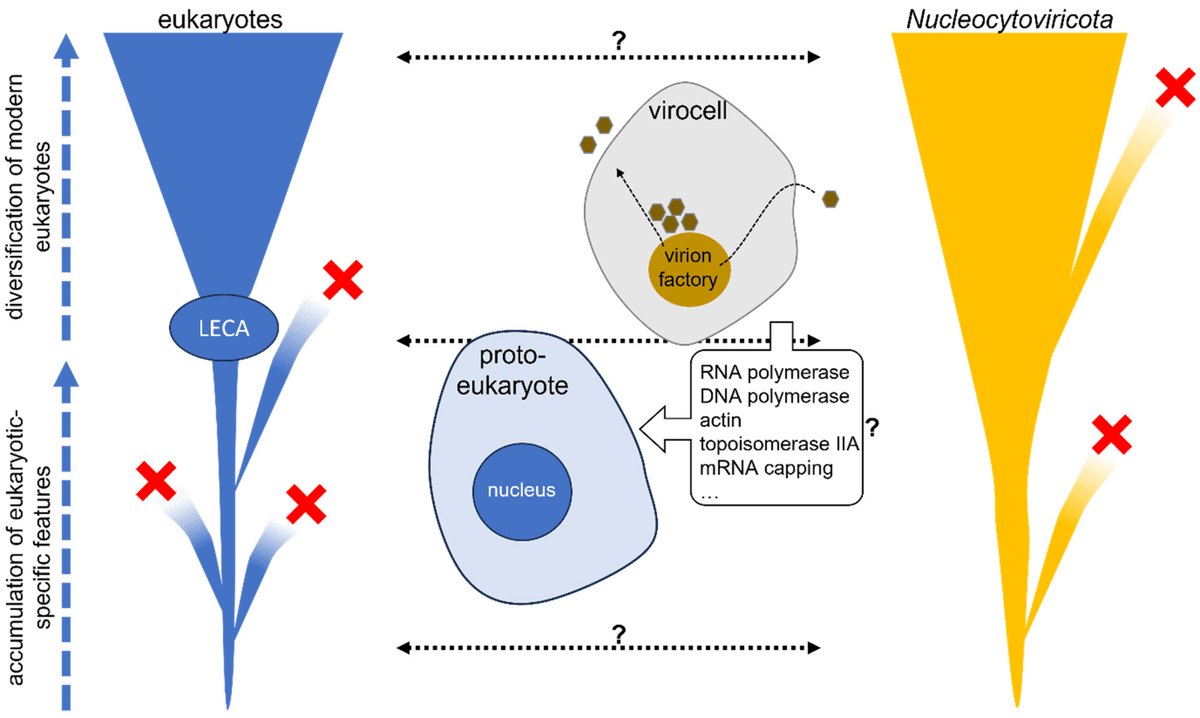
竹村とベルは、20年以上前に、ポックスウイルスに関連する複雑なDNAウイルスが真核の出現に関与しているのではないかという仮説を独自に立てた[18,19]。この仮説は「ウイルス真核発生仮説」と呼ばれ、主に核とポックスウイルスの感染サイクルのメカニズム的類似性に基づいていた。これらの共通点には、転写と翻訳の非連結性、すなわちオルガネラで保護されたゲノムの複製と、関連するmRNAの細胞質への移行が含まれ、そこで翻訳される。偶然にも、ポックスウイルスはヌクレオサイトウイルス門に属し、数年後に巨大ウイルスも含まれることが明らかになった[25,26]。核全体とヌクレオサイトウイルス門のビリオンファクトリーとの間に進化的関係があることを示す明確な証拠は得られていないが、後者にはそれを強く示唆する興味深い要素が蓄積されている(図1)。構造的には、巨大ウイルスのビリオン工場は、核との顕著な類似性を示している [61,62,63,64,65,66]。多くのウイルスは、小胞体膜の一部を利用して工場を形成し、時には核分裂のように微小管組織化中心の近くに集合する。ミミウイルスの場合、ビリオン工場は、核膜の侵入に由来すると思われる膜小胞の融合から直接形成されることさえある [67]。このような類似性だけでなく、巨大ウイルスのゲノムには、重要な情報伝達過程に関与する真核生物特有の遺伝子のホモログが多数存在する。これらには、ヒストン、トポイソメラーゼ、ヘリカーゼ、DNA依存性DNAおよびRNAポリメラーゼ、mRNAキャッピング酵素、そして場合によってはアミノアシルtRNA合成酵素のような翻訳装置に関連する遺伝子が含まれる(図1)[68,69,70,71,72,73]。興味深いことに、これらの遺伝子の系統学的解析は、ウイルスが単に遺伝子をハイジャックしているという一般的な仮定とは対照的に、ウイルスから細胞への指向性のある転移を示唆している[46,70,74,75,76]。重要なことは、これらの遺伝子の移動は特に古く、現代の真核生物が出現する以前から行われていた可能性が高いことである。特にDNA依存性RNAポリメラーゼ(RNAP)酵素がそうである [46]。その2つの最も大きなサブユニットは酵素の構造的、機能的中核を担っており、細菌、古細菌、真核生物に普遍的に存在し、ほとんどのヌクレオサイトウィルス菌にも存在する。しかしながら、真核生物は3つ(あるいはそれ以上)のRNAPを持ち、それぞれがRNAの種類に特異的であるという、さらに謎めいた複雑さを示している(おおよそ、RNAP-IはrRNAに、RNAP-IIはmRNAに、RNAP-IIIはtRNAに関連している)。我々が行った詳細な系統学的解析によると、原始真核生物(その性質にかかわらず、現代の真核生物が誕生した祖先細胞系譜)は当初単一のRNAPを持っており、最終的にRNAP-IIIへと進化した。この祖先酵素はヌクレオサイトウイルスの祖先によって獲得され、その後新たな特異性を獲得したウイルスの特定の系統から原始真核生物に再移植され、原始真核生物でRNAP-IIを生み出した。RNAP-Iは、祖先の原始真核生物RNAPの1つのサブユニットが複製され、ヌクレオサイトウイルスの別のグループから獲得されたサブユニットと融合して出現したのであろう。ヌクレオサイトウィルコータの祖先から原始真核生物への古代の移行の同様のシナリオは、従来の真核生物のアクチンにつながる可能性のあるアクチン遺伝子のホモログについて提唱された [75]、そしてトポイソメラーゼIIAについて提唱された [76]。これらの発見は、宿主に関してすでに仮説されていたこのウイルス群の祖先を立証するものであり、現代の真核生物の出現において、核を越えてウイルスが大きな役割を果たしたことを強く支持するものである。実際、系統学的解析により、真核生物からヌクレオサイトウィルス属へ、また後者から前者へ、遺伝子の移行範囲が特に重要であり、多くの機能グループが関与していることが明らかになっている [77]。注目すべきは、統合されたヌクレオサイトウィルコータは、その受容体の遺伝子含量のかなりの部分を占めることがあり、ある種の緑藻では10%に達する。この割合は、過去の相互作用が宿主の生物学に及ぼした影響の程度について、正当な疑問を投げかけている。
ウイルス 15 01758 g001図1. 図1.原始真核生物から現代真核生物まで、ヌクレオサイトウィルス属とその宿主との間で起こりうる数多くの遺伝子交換の図。外側の2つの木のような図は、真核生物とヌクレオサイトウィリトカの垂直進化を表し、中央の部分は、真核生物の核と感染細胞(ウィロセル)のビリオン工場との類似性を大まかに示している。ウイルス真核発生仮説は、ウイルスと宿主との間の長期にわたる相互作用が、現代の真核生物の出現に大きく寄与しており、その核にも潜在的に寄与していると仮定している。クエスチョンマーク付きの点線の矢印は、ヌクレオサイトウィルスと宿主の間で、遺伝子が双方向に、場合によっては複数回にわたって移動した可能性を示している。これらの転移には、最後の真核生物の共通祖先であるLECA以前に原始真核生物によって獲得され、その後、現代真核生物のすべて、あるいはほとんどに保存されている重要な中核機能が含まれている可能性がある。この転移には、現在では絶滅してしまった細胞系やウイルス系が関与している可能性がある(図では赤い十字で示されている)。
巨大ウイルスにとどまらず、ウイルスと真核生物の間の潜在的なつながりは、細菌宿主に核のような構造を誘導することができ、細胞内のCRISPR抗ウイルス活性からウイルスDNAを保護することができる大型バクテリオウイルス(ジャンボファージ、ゲノムが大きい)の発見によって、さらに裏付けられた[79,80]。これらのウイルス擬似核は、ウイルスにコードされた真核生物のようなチューブリンによって、ウイルス細胞内の中心位置に配置されている。さらに、その膜もウイルスがコードするタンパク質によって形成されている。これらのウイルス核が真核生物の対応物に類似しているだけだとしても、核のようなオルガネラを形成する能力がウイルスゲノムに生じうることを示唆している。同様に、コロナウイルスのビリオン工場に相当する部分(複製オルガネラ)の二重膜を横切る分子孔の観察 [81]は、おそらくウイルスのmRNAを細胞質に転送するために使われるもので、真核生物の核とウイルスの間の潜在的なつながりと共鳴する。これらのウイルス孔は、真核生物の核孔と構造的に大きな類似性を示しているが、ウイルスによってコードされている。これらのウイルスの特徴は、進化的には真核生物核とは関係がないが、一般的に細胞に関連する複雑な特徴を進化させるウイルスの能力を浮き彫りにしている。その結果、現在では細胞領域に特徴的と考えられている形質も、実際には程度の差こそあれ、ウイルスが起源である可能性がある。とはいえ、ヌクレオサイトウイルス門の巨大ウイルスほど、真核生物と複雑かつ古い進化的関係を持つウイルスはないように思われる。より小さなウイルスも同様に宿主と深い共進化の歴史を持っている可能性はあるが、ウイルスのゲノムは平均的に短いため、追跡できないかもしれない。巨大ウイルスは、おそらく生命の歴史におけるウイルスと宿主の共進化をよりよく理解するための最良のターゲットの一つである。巨大ウイルスはどこにでもいる
ヌクレオサイトウイルスの祖先と、原始真核生物から現代の真核生物に至るまで、宿主との長年にわたる相互作用は、真核生物領域の多様性全体に感染することから、その宿主スペクトルを確かに説明している[27,82]。2010年頃から、ヌクレオサイトウイルスは多種多様な環境 [23,83,84,85]、特に水中において非常に豊富で多様であることが明らかになっている [86,87,88,89,90,91,92,93]。Nucleocytoviricota門の中でも、Algavirales目とImitervirales目は、特にこれらの水生環境において代表的であり、ウイルスは、Mamiellialesや、ブルームを形成する球石藻Emilianiaや藻類Heterosigmaなどのプランクトン内の豊富な真核生物集団に感染することが顕著である[87,93,94]。近年のウイルスメタゲノミクスの台頭により、Nucleocytoviricotaの既知の多様性は大幅に拡大している[36,37,38]。最近、TARA海洋調査から得られたメタゲノミクスデータからヌクレオサイトウイルス科のウイルスを調査したところ、驚くべき新種の関連ウイルス群であるミルスウイルスを同定し、その特徴を明らかにすることができた[38]。これらのウイルスは、コア情報モジュールの遺伝子のほとんどを含め、ヌクレオサイトウイルスと多くの遺伝子を共有している。しかし、ビリオンの形態形成モジュール(すなわち、ビリオンの形成に関連する遺伝子)を欠いている。これは、ヌクレオサイトウイルス科だけでなく、これらのウイルスが属するウイルス領域全体(バリドナウイルス領域)に特徴的である。この二本鎖DNAウイルスの領域は、3つの細胞ドメインに感染するウイルスを含むDuplodnaviria領域を除けば、数少ない領域の一つであり、独立した太古の起源を持つと考えられている。驚くべきことに、ミルスウイルスはデュプロドナウィリア領域のビリオン形態形成モジュールの遺伝子をすべて持っているが、それ以上の遺伝子は持っておらず、ヌクレオサイトウイルス科に関連する遺伝子を多く持っているにもかかわらず、分類学的にはこれに属する。例えば、ヌクレオサイトウイルスが属するバリドナウイルスは、カプシドタンパク質の特徴的な構造と、関連するパッケージングATPアーゼを共有しているだけである[14]。リボウィリア領域(RNAウィルスのグループ化)が複製機構によって定義されるのに対し、dsDNAウィルスの領域はビリオン形態形成モジュールの遺伝子によって特徴付けられ、多くの場合、ウィルスの定義要素としてビリオン構造に重点が置かれている。Varidnaviria領域のNucleocytoviricotaと多くの共通点があるにもかかわらず、Duplodnaviria領域の中で高い分類学的ランク(門)を構成するミルスウイルスの発見は、この分類の頑健性に疑問を投げかけている。巨大ウイルスがビリオンの形態形成モジュールをデュプロドナウィリアウイルス(この領域で唯一の真核ウイルス群であるヘルペスウイルスの祖先である可能性が高い)のそれと置き換えたのか、あるいはヘルペスウイルスの祖先が巨大ウイルスから多くの遺伝子を蓄積したのか、おそらく同じような宿主内で密接な相互作用があったためであろう。いずれのシナリオにせよ、ミルスウイルスは、ウイルスがウイルスの世界における進化のギャップを埋めることもできることを証明している。したがって、この発見は、巨大ウイルスの起源と進化、そして巨大ウイルス、ミルスウイルス、宿主間の遺伝子の流れについての理解に新たな知見を与えてくれるかもしれない。
今後の研究によって、ウイルスの進化や生物圏における位置づけに関する我々の理解が再び変わるような、さらに多くの未知のウイルスが発見されるに違いない。
著者貢献
執筆-原案作成: 執筆-原案作成:M.G.、P.F.、執筆-校閲・編集:M.G.、P.F.: 執筆-原案作成:M.G.およびP.F.、執筆-校閲および編集:M.G.およびP.F.。
資金提供
本研究は外部資金援助を受けていない。
施設審査委員会声明
該当なし。
インフォームド・コンセントに関する声明
該当なし。
データの利用可能性に関する声明
本研究で新たに作成または分析されたデータはない。データ共有はこの論文には適用されない。
利益相反
著者らは利益相反がないことを宣言する。
参考文献
Ivanosky, D. Über Die Mosaikkrankheit Der Tabakspflanze. St. Petersb. Acad. Imp. Sci. Bul. 1892, 35, 67-70. [Google Scholar].
Beijerinck, M.W. Über Ein Contagium Vivum Fluidum Als Ursache Der Fleckenkrankheit Der Tabaksblätter. In Verhandelingen der Koninklyke Akademie van Wettenschappen te Amsterdam; Nabu Press: In Verhandelingen der Koninkke Akademie vanettenschappen te Amsterdam; Nabu Press: USA, 1898. [Google Scholar].
タバコモザイクウイルスの性質を持つ結晶性タンパク質の単離。Science 1935, 81, 644-645. [Google Scholar] [CrossRef] [PubMed].
タバコモザイクウイルスの性質. Naturwissenschaften 1939, 27, 292-299. [Google Scholar] [CrossRef].
Stanier, R.Y.; Niel, C.B. バクテリアの概念. Archiv. Mikrobiol. 1962, 42, 17-35. [Google Scholar] [CrossRef].
Woese, C.R.; Fox, G.E. 原核生物領域の系統構造: 原核生物領域の系統的構造:原始キングダム。Proc. Natl. Acad. Sci. USA 1977, 74, 5088-5090. [Googleスカラー] [クロスリーフ] [PubMed].
古細菌のウイルス:統一的見解. (共著) 微生物学(Rev. Microbiol. 2006, 4, 837-848. [Google Scholar] [CrossRef] [PubMed].
水生環境におけるウイルスの多さ. Nature 1989, 340, 467-468. [Google Scholar] [CrossRef].
Hendrix, R.W.; Smith, M.C.M.; Burns, R.N.; Ford, M.E.; Hatfull, G.F. 多様なバクテリオファージとプロファージ間の進化的関係: 世界はすべてファージである。Proc. Natl. Acad. Sci. USA 1999, 96, 2192-2197. [Google Scholar] [CrossRef] [PubMed].
地球上には1031個のウイルス粒子が存在するのか?J. Bacteriol. 2020, 202, e00052-20. [Google Scholar] [CrossRef]。
López-García, P.; Gutiérrez-Preciado, A.; Krupovic, M.; Ciobanu, M.; Deschamps, P.; Jardillier, L.; López-Pérez, M.; Rodríguez-Valera, F.; Moreira, D. Metagenome-Derived Virus-Microbe Ratios across Ecosystems. ISME J. 2023. [Google Scholar] [CrossRef].
フォルテール、P.; ソレール、N.; クルポヴィッチ、M.; マルゲ、E.; アッカーマン、H.-W. 蛍光顕微鏡で作成した偽ウイルス粒子。Trends Microbiol. 2013, 21, 1-5. [Google Scholar] [CrossRef] [PubMed].
ウイルス分類学: 国際ウイルス分類学委員会(ICTV)のデータベース。Nucleic Acids Res. 2018, 46, D708-D717. [Google Scholar] [CrossRef] [PubMed].
Walker, P.J.; Siddell, S.G.; Lefkowitz, E.J.; Mushegian, A.R.; Adriaenssens, E.M.; Alfenas-Zerbini, P.; Dempsey, D.M.; Dutilh, B.E.; García, M.L.; Curtis Hendrickson, R.; et al. International Committee on Taxonomy of Viruses (2022) によって承認されたウイルス分類学の最近の変更。Arch. Virol. 2022, 167, 2429-2440. [Google Scholar] [CrossRef] [PubMed].
DNAゲノムとDNA複製タンパク質の起源. Curr. Opin. Microbiol. 2002, 5, 525-532. [Google Scholar] [CrossRef] [PubMed].
真核生物の複製タンパク質の起源としてのDNAウイルスの仮説. J. Virol. 2000, 74, 7079-7084. [Google Scholar] [CrossRef].
プラスミドやウイルスからの機能的類似体による細胞内タンパク質の置換は、多くのDNA情報タンパク質の不可解な系統性を説明しうる。Mol. Microbiol. 1999, 33, 457-465. [Google Scholar] [CrossRef].
ポックスウイルスと真核の起源. J. Mol. Evol. 2001, 52, 419-425. [Google Scholar] [CrossRef].
Bell, P.J.L. Viral Eukaryogenesis: 核の祖先は複雑なDNAウイルスだったのか?J. Mol. Evol. 2001, 53, 251-256. [Google Scholar] [CrossRef].
Scola, B.L.; Audic, S.; Robert, C.; Jungang, L.; De Lamballerie, X.; Drancourt, M.; Birtles, R.; Claverie, J.-M.; Raoult, D. アメーバにおける巨大ウイルス。Science 2003, 299, 2033. [Google Scholar] [CrossRef].
Raoult,D.、Audic,S.、Robert,C.、Abergel,C.、Renesto,P.、Ogata,H.、La Scola,B.、Suzan,M.、Claverie,J.-M. ミミウイルスの1.2メガバースのゲノム配列。Science 2004, 306, 1344-1350. [Google Scholar] [CrossRef].
Philippe, N.; Legendre, M.; Doutre, G.; Couté, Y.; Poirot, O.; Lescot, M.; Arslan, D.; Seltzer, V.; Bertaux, L.; Bruley, C.; et al. パンドラウイルス: 寄生真核生物のゲノムに達する最大2.5MBのゲノムを持つアメーバウイルス。Science 2013, 341, 281-286. [Google Scholar] [CrossRef].
アブラハオ、J.; シルバ、L.; シルバ、L.S.; カリル、J.Y.B.; ロドリゲス、R.; アランテス、T.; アシス、F.; ボラット、P.; アンドラーデ、M.; クルーン、E.G.; 他. テイルジャイアントツパンウイルスは既知のウイルス球の中で最も完全な翻訳装置を持つ。Nat. Commun. 2018, 9, 749. [Google Scholar] [CrossRef] [PubMed].
Legendre, M.; Bartoli, J.; Shmakova, L.; Jeudy, S.; Labadie, K.; Adrait, A.; Lescot, M.; Poirot, O.; Bertaux, L.; Bruley, C.; et al. パンドラウイルスの形態を持つ巨大正20面体DNAウイルスの3万年前の遠縁種。Proc. Natl. Acad. Sci. USA 2014, 111, 4274-4279. [Google Scholar] [CrossRef].
Koonin, E.V.; Dolja, V.V.; Krupovic, M.; Varsani, A.; Wolf, Y.I.; Yutin, N.; Zerbini, F.M.; Kuhn, J.H. Virus World. Microbiol. Mol. Biol. Rev. 2020, 84, e00061-19. [Google Scholar] [CrossRef] [PubMed].
また、このようなウイルスの感染経路の解明は、ウイルスの感染経路の解明だけでなく、ウイルスの感染経路の解明にも有効であることが示唆された。ウイルス研究 2006, 117, 156-184. [Google Scholar] [CrossRef] [PubMed].
真核生物巨大ウイルスの宿主域とコード可能性. Viruses 2020, 12, 1337. [Google Scholar] [CrossRef].
生命の樹からウイルスを除外する10の理由。Nat. Rev. Microbiol. 2009, 7, 306-311. [Google Scholar] [CrossRef].
Claverie, J.-M.; Ogata, H.; Audic, S.; Abergel, C.; Suhre, K.; Fournier, P.-E. Mimivirus and the Emerging Concept of "Giant" Virus. Virus Res. 2006, 117, 133-144. [Google Scholar] [CrossRef].
Forterre, P. Giant Viruses: ウイルス概念の再検討における対立。Intervirology 2010, 53, 362-378. [Google Scholar] [CrossRef].
Claverie, J.-M.; Abergel, C. Mimivirus: Mimivirus: The Emerging Paradox of Quasi-Autonomous Viruses. Trends Genet. 2010, 26, 431-437. [Google Scholar] [CrossRef].
ラ・スコラ(La Scola, B)、デスヌー(Desnues, C)、パニエ(Pagnier, I)、ロベール(Robert, C)、バラッシ(Barrassi, L)、フルヌー(Fournous, G)、メルシャ(Merchat, M)、スザン=モンティ(Suzan-Monti, M)、フォルテール(Forterre, P)、クーニン(Koonin, E)、他 巨大ミミウイルスのユニークな寄生体としてのビロファージ。Nature 2008, 455, 100-104. [Google Scholar] [CrossRef] [PubMed].
ウイルスが生きていることを示唆する "ビロファージ"。Nature 2008, 454, 677. [Google Scholar] [CrossRef] [PubMed].
ビロファージファミリーLavidaviridae. Curr. (株)廣済堂出版. 2021, 40, 1-24. [Google Scholar] [CrossRef].
Fischer, M.G.; Hackl, T. 宿主ゲノム統合とビロファージ・マウイルスのジャイアントウイルス誘導再活性化. Nature 2016, 540, 288-291. [Google Scholar] [CrossRef] [PubMed].
Schulz,F.、Roux,S.、Paez-Espino,D.、Jungbluth,S.、Walsh,D.A.、Denef,V.J.、McMahon,K.D.、Konstantinidis,K.T.、Eloe-Fadrosh,E.A.、Kyrpides,N.C.、他。 グローバルメタゲノミクスによる巨大ウイルスの多様性と宿主相互作用。Nature 2020, 578, 432-436. [Google Scholar] [CrossRef].
Moniruzzaman、M.; Martinez-Gutierrez, C.A.; Weinheimer, A.R.; Aylward, F.O. Dynamic Genome Evolution and Complex Virocell Metabolism of Globally-Distributed Giant Viruses. Nat. Commun. 2020, 11, 1710. [Google Scholar] [CrossRef].
緒方裕之、Krupovic, M.; et al. ヘルペスウイルスと巨大ウイルスをつなぐミルスウイルス。Nature 2023, 616, 783-789. [Google Scholar] [CrossRef].
ボワイエ、M.; マドゥイ、M.-A.; ギメネス、G.; ラ・スコラ、B.; ラウル、D. ゲノム中の情報遺伝子の系統学的および系統学的研究は、巨大ウイルスを含む第4の生命ドメインの存在を浮き彫りにする。PLoS ONE 2010, 5, e15530. [Google Scholar] [CrossRef].
情報遺伝子の系統樹は、核細胞質性大型DNAウイルスの第4の生命ドメインを支持しない。PLoS ONE 2011, 6, e21080. [Google Scholar] [CrossRef].
ウイルスと細胞の進化: ウイルスと細胞の進化:真核生物の起源を説明するために第4の生命の領域は必要か?Phil. Phil. Trans. R. Soc. B 2015, 370, 20140327. [Google Scholar] [CrossRef].
真核生物の起源を説明するためには、第4の生命の領域が必要なのか?Front. Microbiol. 2018, 9, 2668. [Google Scholar] [CrossRef].
Koonin, E.V.; Dolja, V.V.; Krupovic, M. Origins and Evolution of Viruses of Eukaryotes: 究極のモジュール性。Virology 2015, 479-480, 2-25. [Google Scholar] [CrossRef].
Koonin, E.V.; Yutin, N. Evolution of the Large Nucleocytoplasmic DNA Viruses of Eukaryotes and Convergent Origins of Viral Gigantism. Advances in Virus Research; Elsevier: Amsterdam, The Netherlands, 2019; 第103巻, pp.167-202. ISBN 978-0-12-817722-8。[Google Scholar].
Woo, A.C.; Gaia, M.; Guglielmini, J.; Da Cunha, V.; Forterre, P. Varidnaviria形態形成モジュールの系統学: 生命の樹とウイルス分類学との一致と不一致。Front. Microbiol. 2021, 12, 704052. [Google Scholar] [CrossRef].
Guglielmini, J.; Woo, A.C.; Krupovic, M.; Forterre, P.; Gaia, M. Diversification of Giant and Large Eukaryotic DsDNA Viruses Predated the Origin of Modern Eukaryotes. Proc. Natl. Acad. Sci. USA 2019, 116, 19585-19592. [Google Scholar] [CrossRef].
Raoult, D.; Forterre, P. Redefining Viruses: ミミウイルスからの教訓。Nat. Rev. Microbiol. 2008, 6, 315-319. [Google Scholar] [CrossRef] [PubMed].
細胞ドメインとウイルス系統. Trends Microbiol. 2014, 22, 554-558. [Google Scholar] [CrossRef] [PubMed].
Forterre, P. To Be or Not to Be Alive: How Recent Discoveries Challenge the Traditional Definitions of Viruses and Life. Stud. Hist. Philos. サイエンスパートC Stud. Hist. Philos. 生物学 Biomed. Sci. 2016, 59, 100-108. [Google Scholar] [CrossRef].
Krupovic, M.; Yutin, N.; Koonin, E. Evolution of a Major Virion Protein of the Giant Pandoravirus from an Inactivated Bacterial Glycoside Hydrolase. Virus Evol. 2020, 6, veaa059. [Google Scholar] [CrossRef].
Lwoff, A. Principles of Classification and Nomenclature of Viruses. Nature 1967, 215, 13-14. [Google Scholar] [CrossRef] [PubMed].
ウイルスの起源と性質に関する新理論. J. Theor. 1983, 105, 591-602. [Google Scholar] [CrossRef] [PubMed].
Claverie, J.-M. ウイルスは細胞進化の中心的役割を果たす。Genome Biol. [Google Scholar] [CrossRef]。
Lwoff, A. Virus, Cell, and Organism. Available online: https://www.nobelprize.org/prizes/medicine/1965/lwoff/lecture/ (accessed on 24 July 2023).
Forterre, P. 細胞合成の操作とウイルスの性質: ヴィロセル・コンセプト。C. R. Chim. 2011, 14, 392-399. [Google Scholar] [CrossRef].
Howard-Varona、C.; Roux、S.; Bowen、B.P.; Silva、L.P.; Lau、R.; Schwenck、S.M.; Schwartz、S.; Woyke、T.; Northen、T.; Sullivan、M.B.; et al. 海洋シアノバイロセル代謝における原生生物の影響。ISME Commun. 2022, 2, 94. [Google Scholar] [CrossRef].
Rosenwasser, S.; Ziv, C.; Creveld, S.G.V.; Vardi, A. Virocell Metabolism: Virocell Metabolism: Metabolic Innovations During Host-Virus Interactions in the Ocean. Trends Microbiol. 2016, 24, 821-832. [Google Scholar] [CrossRef].
Carvunis, A.-R.; Rolland, T.; Wapinski, I.; Calderwood, M.A.; Yildirim, M.A.; Simonis, N.; Charloteaux, B.; Hidalgo, C.A.; Barbette, J.; Santhanam, B.; et al. プロト遺伝子とデノボ遺伝子誕生。Nature 2012, 487, 370-374. [Google Scholar] [CrossRef] [PubMed].
ショウジョウバエにおけるデノボORFは生物のフィットネスに重要であり、以前の非コード配列から急速に進化した。PLoS Genet. 2013, 9, e1003860. [Google Scholar] [CrossRef].
Forterre, P. Darwin's Goldmine Is Still Open: Variation and Selection Run the World. Front. Cell. Infect. Microbiol. 2012, 2, 106. [Google Scholar] [CrossRef] [PubMed].
(1)細胞外マトリックス(細胞外マトリックス)、(2)細胞外マトリックス(細胞外マトリックス)、(3)細胞外マトリックス(細胞外マトリックス)、(4)細胞外マトリックス(細胞外マトリックス)、(5)細胞外マトリックス(細胞外マトリックス)。PLoS ONE 2007, 2, e328. [Google Scholar] [CrossRef].
ウイルス複製時に生成されるウイルス封入体、膜再配列、ファクトリー、ビロプラズムのガイド。In Advances in Virus Research; Elsevier: Amsterdam, The Netherlands, 2007; 第70巻, pp. ISBN 978-0-12-373728-1. [Google Scholar]
動物細胞で生成されるウイルス工場、二重膜小胞およびビロプラスム。Curr. Opin. Virol. 2011, 1, 381-387. [Google Scholar] [CrossRef].
Mutsafi, Y.; Shimoni, E.; Shimon, A.; Minsky, A. Giant Mimivirusの感染サイクルにおける膜アセンブリー。PLoS Pathog. 2013, 9, e1003367. [Google Scholar] [CrossRef].
Novoa, R.R.; Calderita, G.; Arranz, R.; Fontana, J.; Granzow, H.; Risco, C. Virus Factories: ウイルス複製と形態形成における細胞小器官の関連性。Biol. Cell 2005, 97, 147-172. [Google Scholar] [CrossRef] [PubMed].
Abergel, C.; Legendre, M.; Claverie, J.-M. 急速に拡大する巨大ウイルスの宇宙: Mimivirus, Pandoravirus, Pithovirus and Mollivirus. FEMS Microbiol. Rev. 2015, 39, 779-796. [Google Scholar] [CrossRef] [PubMed].
Kuznetsov, Y.G.; Klose, T.; Rossmann, M.; McPherson, A. Mimivirus and Its Viral Factories: 感染細胞の原子間力顕微鏡による研究。J. Virol. 2013, 87, 11200-11213. [Google Scholar] [CrossRef] [PubMed].
Brandes, N.; Linial, M. Giant Viruses-Big Surprises. Viruses 2019, 11, 404. [Google Scholar] [CrossRef].
Yutin, N.; Koonin, E.V. Hidden Evolutionary Complexity of Nucleo-Cytoplasmic Large DNA Viruses of Eukaryotes. Virol. J. 2012, 9, 161. [Google Scholar] [CrossRef].
温泉水から発見された新規大型DNAウイルスMedusavirus. J. Virol. 2019, 93, e02130-18. [Google Scholar] [CrossRef].
Benarroch, D.; Qiu, Z.R.; Schwer, B.; Shuman, S. Characterization of a Mimivirus RNA Cap Guanine-N2 Methyltransferase. RNA 2009, 15, 666-674. [Google Scholar] [CrossRef].
Decroly,E.、Ferron,F.、Lescar,J.、Canard,B. Viral MRNAをキャップする従来型と非従来型のメカニズム。Nat. Rev. Microbiol. 2012, 10, 51-65. [Google Scholar] [CrossRef].
真核生物と巨大ウイルスの初期の共進化を明らかにする古代の遺伝子転移の解明. [Google Scholar] [CrossRef].
真核のウイルス起源を支持する証拠. Virus Res. 2020, 289, 198168. [Google Scholar] [CrossRef].
ダ・クーニャ、V.; ガイア、M.; 緒方博之; ジャイヨン、O.; デルモント、T.O.; フォルテール、P. 巨大ウイルスはアクチン関連タンパク質をコードする。Mol. Biol. 2022、39、msac022。[Google Scholar] [CrossRef] [PubMed].
真核生物IIA型DNAトポイソメラーゼのウイルス起源(Guglielmini, J.; Gaia, M.; Da Cunha, V.; Criscuolo, A.; Krupovic, M.; Forterre, P.). Virus Evol. 2022, 8, veac097. [Google Scholar] [CrossRef].
真核生物とウイルス間の遺伝子水平転移の系統的評価。Nat. Microbiol. 2021, 7, 327-336. [このような研究は、生物多様性保全の観点からも非常に重要である。
巨大ウイルスの広範な内在化が緑藻類のゲノムを形成する。Nature 2020, 588, 141-145. [Google Scholar] [CrossRef].
Chaikeeratisak、V.; Nguyen、K.; Khanna、K.; Brilot、A.F.; Erb、M.L.; Coker、J.K.C.; Vavilina、A.; Newton、G.L.; Buschauer、R.; Pogliano、K.; et al. 細菌におけるウイルス複製時の核様構造の組み立て。Science 2017, 355, 194-197. [Google Scholar] [CrossRef] [PubMed].
バクテリオファージ核様コンパートメントがCRISPRヌクレアーゼからDNAを保護する。Nature 2020, 577, 244-248. [Google Scholar] [CrossRef] [PubMed].
コロナウイルス複製オルガネラの二重膜に分子孔が存在する。Science 2020, 369, 1395-1398. [Google Scholar] [CrossRef].
真核生物の核-細胞質性大型DNAウイルス(NCLDV)。John Wiley & Sons, Ltd.: Hoboken, NJ, USA, 2012; ISBN 978-0-470-01617-6. [Google Scholar].
Pagnier, I.; Reteno, D.-G.I.; Saadi, H.; Boughalmi, M.; Gaia, M.; Slimani, M.; Ngounga, T.; Bekliz, M.; Colson, P.; Raoult, D.; et al. A Decade of Improvements in Mimiviridae and Marseilleviridae Isolation from Amoeba. Intervirology 2013, 56, 354-363. [Google Scholar] [CrossRef].
Schulz、F.; Alteio、L.; Goudeau、D.; Ryan、E.M.; Yu、F.B.; Malmstrom、R.R.; Blanchard、J.; Woyke、T. 土壌巨大ウイルスの隠れた多様性。Nat. Commun. 2018, 9, 4881. [Google Scholar] [CrossRef].
Bäckström, D.; Yutin, N.; Jørgensen, S.L.; Dharamshi, J.; Homa, F.; Zaremba-Niedwiedzka, K.; Spang, A.; Wolf, Y.I.; Koonin, E.V.; Ettema, T.J.G. Virus Genomes from Deep Sea Sediments Expand the Ocean Megavirome and Support Independent Origins of Viral Gigantism. [Google Scholar] [CrossRef].
Larsen, J.B.; Larsen, A.; Bratbak, G.; Sandaa, R.-A. 主要キャプシドタンパク質遺伝子の増幅断片を用いたフィコドナウイルス科ウイルスの系統解析。Appl. Environ. Microbiol. 2008, 74, 3048-3057. [Google Scholar] [CrossRef].
Hingamp、P.; Grimsley、N.; Acinas、S.G.; Clerissi、C.; Subirana、L.; Poulain、J.; Ferrera、I.; Sarmento、H.; Villar、E.; Lima-Mendez、G.; et al. タラ海洋微生物メタゲノムにおける核-細胞質大DNAウイルスの探索。ISME J. 2013, 7, 1678-1695. [Google Scholar] [CrossRef] [PubMed].
メガウイルス科の分類群数は海洋の細菌と古細菌の分類群数を上回る. Microbes Environ. 2018, 33, 162-171. [Google Scholar] [CrossRef] [PubMed].
Li, Y.; Hingamp, P.; Watai, H.; Endo, H.; Yoshida, T.; Ogata, H. Degenerate PCR Primers to Reveal the Diversity of Giant Viruses in Coastal Waters. Viruses 2018, 10, 496. [Google Scholar] [CrossRef] [PubMed].
Li,Y.、Endo,H.、Gotoh,Y.、Watai,H.、Ogawa,N.、Blanc-Mathieu,R.、Yoshida,T.、Ogata,H. The Earth Is Small for "Leviathans": 水生環境における巨大ウイルスの長距離拡散。Microb. Environ. 2019, 34, 334-339. [Google Scholar] [CrossRef].
Endo, H.; Blanc-Mathieu, R.; Li, Y.; Salazar, G.; Henry, N.; Labadie, K.; De Vargas, C.; Sullivan, M.B.; Bowler, C.; Wincker, P.; et al. Biogeography of Marine Giant Viruses Reveals Their Interplay with Eukaryotes and Ecological Functions. Nat. Ecol. Evol. 2020, 4, 1639-1649. [Google Scholar] [CrossRef].
海洋ウイルス群集の塩基配列解析から、関連する藻類ウイルス群が自然界に広く分布していることが明らかになった。Appl. Environ. Microbiol. 2002, 68, 1290-1296. [Google Scholar] [CrossRef].
真核藻類に感染するウイルスの多様性。Curr. 問題 Mol. Biol. 2020, 39, 29-62. [Google Scholar] [CrossRef].
Zhang, Q.-Y.; Ke, F.; Gui, L.; Zhao, Z. Recent Insights into Aquatic Viruses: 水生ウイルスの最新知見:新興・再興病原体、分子的特徴、生物学的影響、新規調査アプローチ。Water Biol. Secur. 2022, 1, 100062. [Google Scholar] [CrossRef].
免責事項/発行者注:すべての出版物に含まれる声明、意見およびデータは、著者および寄稿者個人のものであり、MDPIおよび/または編集者のものではありません。MDPIおよび/または編集者は、コンテンツで言及されたアイデア、方法、指示、製品に起因する人または財産の損害について、一切の責任を負いません。
著者による© 2023。ライセンシー MDPI, Basel, Switzerland. 本論文は、クリエイティブ・コモンズ 表示(CC BY)ライセンス(https://creativecommons.org/licenses/by/4.0/)の条項および条件の下で配布されるオープンアクセス論文である。
共有と引用
MDPIおよびACSスタイル
ミミウイルスからミルスウイルスへ: 隠れた巨人の探求。Viruses 2023, 15, 1758. https://doi.org/10.3390/v15081758
AMAスタイル
ミミウイルスからミルスウイルスへ: 隠された巨人の探求。Viruses. 2023; 15(8):1758. https://doi.org/10.3390/v15081758
シカゴ/チュラビアンスタイル
ガイア、モルガン、パトリック・フォルテール。2023. 「ミミウイルスからミルスウイルスへ: The Quest for Hidden Giants" Viruses 15, no. 8: 1758. https://doi.org/10.3390/v15081758
他のスタイルを探す
出版社名、ジャーナル名、フォーマット名を入力してください。
なお、2016年創刊号より、本誌ではページ番号の代わりに論文番号を使用しています。詳細はこちらをご覧ください。
論文指標
引用
この記事の引用は見つかりませんでしたが、Google Scholarで確認することができます。
論文アクセス統計
記事アクセス統計
記事閲覧数
17. 8月
18. 8月
0
50
100
150
200
ジャーナル統計の詳細については、こちらをクリックしてください。
同一IPアドレスからの複数のリクエストは1ビューとしてカウントされます。
Viruses, EISSN 1999-4915, MDPI発行 RSSコンテンツアラート
詳細情報
論文処理料金
請求書を支払う
オープンアクセスポリシー
MDPIへのお問い合わせ
MDPIの求人
ガイドライン
著者の方へ
査読者の方へ
編集者の方へ
ライブラリアンの方へ
出版社の方へ
学会の方へ
学会主催者の方へ
MDPIの取り組み
サイフォーラム
MDPI書籍
Preprints.org
サイリット
サイプロファイルズ
百科事典
JAMS
プロシーディングスシリーズ
MDPIをフォローする
LinkedIn
フェイスブック
ツイッター
MDPIジャーナルからの発行通知やニュースレターを購読する
オプションを選択
メールアドレスを入力してください
購読する
© 1996-2023 MDPI (スイス、バーゼル) 特に断りのない限り免責事項 ご利用規約 プライバシーポリシー
