共生ファーミキューテス菌は自然寛容と抵抗性を介して宿主との相互作用を確立し、全身免疫を制御する
細胞宿主と微生物
オンラインで入手可能 2023年8月14日
In Press, Corrected Proofこれは何ですか?
論文
共生ファーミキューテス菌は自然寛容と抵抗性を介して宿主との相互作用を確立し、全身免疫を制御する
https://www.sciencedirect.com/science/article/pii/S1931312823003037?via%3Dihub
著者リンク オーバーレイパネルを開くChristine K.I. Jordan 1, Rebecca L. Brown 1, Max L.Y. Larkinson 1, Richard P. Sequeira 1, Andrew M. Edwards 1, Thomas B. Clarke 1 2
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.chom.2023.07.008
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
腸内ファーミキューテスは全身免疫を制御している
固形細胞の細胞壁糖鎖はIL-34-MØ-mTORC1を介して免疫を制御する
IL-34は抵抗性による糖鎖の全身蓄積-ホメオスタシスを防ぐ
アルブミンが糖鎖の炎症影響を緩衝する-耐性による恒常性維持
まとめ
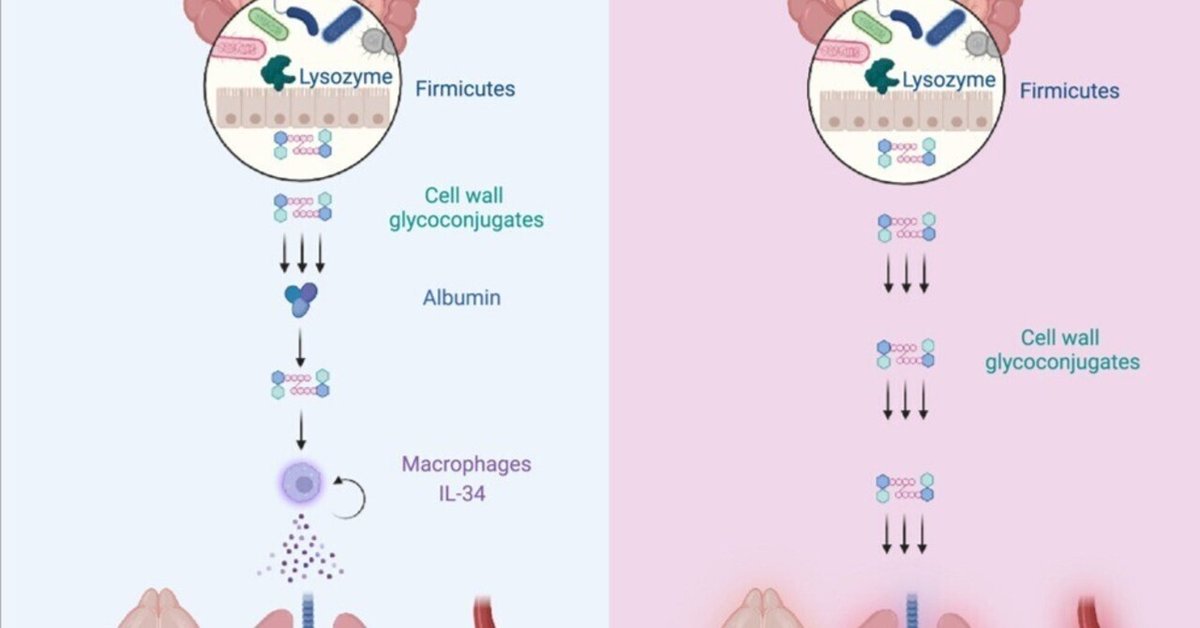
腸内細菌叢は臓器系全体の免疫を制御している。どの共生細菌が全身免疫を制御しているのか、どのようなメカニズムで制御しているのか、そしてどのようにして広範な炎症性障害を回避しているのかは不明である。我々は、ヒト微生物叢のファーミキューテス類が免疫病理学を誘導することなく全身免疫を制御することを可能にする、宿主の寛容性と抵抗性のメカニズムを明らかにした。腸内処理によって放出されたファーミキューテス菌の糖鎖複合体が播種されると、マクロファージを刺激するサイトカインIL-34が放出され、肺炎、敗血症、髄膜炎に対する防御が強化される。ファーミキューテスの全身への浸透にもかかわらず、マクロファージにおけるIL-34を介したmTORC1活性化により、末梢組織から高分子糖鎖複合体が除去されるフィードバック制御により、免疫恒常性は維持されている。このクリアランス機構を回避した小さな糖鎖は、アルブミンによって隔離され、免疫学的影響を抑制する炎症性緩衝剤として働く。このような抵抗性と耐性のメカニズムがなければ、ファーミキューテス菌はIL-1βを介して壊滅的な臓器障害と悪液質を引き起こす。このことから、宿主の生存能力を脅かすことなく感染から守るために、ファーミキューテス菌がどのようにして安全に全身性免疫に同化しているかが明らかになった。

図解抄録
ダウンロード 高解像度画像のダウンロード(149KB)
ダウンロード フルサイズ画像のダウンロード
キーワード
微生物全身性免疫寛容感染症
はじめに
哺乳類は微生物に支配された環境の中で進化してきた。1 ヒトをはじめとする哺乳類が対処しなければならない最大の、分類学的に最も多様で構造的に複雑な微生物群集は腸内細菌叢である。腸内共生生物は、脳、13,14骨髄、15,16,17肝臓、18,19脾臓、17,20,21膵臓、22,23骨格筋、24心臓、25胸腺、26肺など、無数の組織における免疫細胞の産生、機能成熟、死滅を制御している27,28。腸内細菌叢と免疫系の共同発達により、全身の組織で感染症に対する免疫学的バリアが確立される。7,29,30 このように宿主防御にとって重要であるにもかかわらず、腸内細菌叢のどのメンバーが全身的に免疫を制御しているかは、まだ十分に定義されていない。
対照的に、腸内細菌叢の全身的な影響には、腸内の共生生物と末梢の免疫細胞との間の長距離コミュニケーションが必要である12,35。腸内共生細菌が全身に及ぼす影響は、微生物やその産物の侵入に対して鋭敏な宿主の体内環境36を介し、内臓に蔓延する炎症を引き起こすことなく、細胞の代謝速度や機能的優先順位が大きく異なる組織37,38を標的として作用しなければならない。ここでは、宿主に炎症性損傷を与えることなく、共生するファーミキューテス属菌が全身性免疫を制御できる耐性と抵抗性のメカニズムを明らかにする。これらのメカニズムがなければ、宿主と微生物叢の相互作用は崩壊し、ファーミキューテスの全身への影響は病的なものとなり、壊滅的な組織炎症、臓器障害、悪液質を引き起こす。
結果
腸内細菌叢はIL-34とマクロファージを介して肺炎、敗血症、髄膜炎から身を守る
われわれは、どの腸内共生細菌が全身的に免疫防御を制御しているのか、そのメカニズム、そして全身性の免疫病理学を引き起こすことなく免疫防御を行う方法を明らかにしたいと考えた。骨髄系細胞は宿主と微生物叢の相互作用に重要であることから41、我々はまず、微生物叢を持つ従来の野生型(WT)マウスの腸管外組織と、微生物叢を持たない無菌WTマウスの組織とで、骨髄系細胞の生物学的役割で知られているサイトカインの基礎発現を比較した(図1Aおよび1B)。微生物叢は、基礎腫瘍壊死因子(TNF)、顆粒球マクロファージコロニー刺激因子インターロイキン3(GM-CSF IL-3)、IL-1α、IL-1β、IL-36β、IL-36γ、IL-23、 またはIL-18を誘導し、IL-6、IL-17A、G-CSF、IL-12/IL-23 p40、IL-17F、およびマクロファージコロニー刺激因子(M-CSF)を限られたレパートリーの組織で誘導した(図1B)。対照的に、IL-34は試験したすべての組織で微生物叢によって誘導された唯一のサイトカインであり、すべての組織で最も顕著な微生物叢依存性の発現増加を示した(図1B;表S1)。このことから、コロニー刺激因子1レセプター(CSF1R)42のリガンドであるIL-34が、微生物叢の全身的な免疫効果を仲介している可能性が示唆された。そこでわれわれは、IL-34の細胞性供給源を明らかにし、微生物叢が全身的に免疫力を高めるためにIL-34が必要かどうかを調べたいと考えた。その結果、微生物叢は重症複合免疫不全(SCID)マウスにおいても全身的にIL-34を誘導することができ、IL-34は自然細胞に由来することが示唆された(図S1AおよびS1B)。次に、マクロファージまたは好中球がIL-34の供給源であるかどうかを調べた。その結果、好中球ではなく全身のマクロファージを枯渇させると、全身組織で微生物によって誘導されたIL-34が消失することがわかった(図S1C-S1E)。全身性免疫の制御における微生物叢誘導IL-34の役割を調べるために、微生物叢を持つマウスと微生物叢を持たないマウスで、抗生物質投与による腸外感染に対する宿主の防御を比較した。その結果、微生物叢はヒトの主要な病原体である肺炎球菌(Streptococcus pneumoniae)による肺炎、敗血症、髄膜炎に対する抵抗性を増強し、これはIL-34に依存するが、適応免疫には依存しないことがわかった(図1Cと1D)。対照的に、微生物叢の効果は代替CSF1RリガンドであるM-CSFとは無関係であった(図S1FとS1G)。次に、IL-34の効果が腸内の宿主の優勢な微生物叢によってもたらされるかどうかを調べた。これを検証するために、肺炎球菌感染前に、抗生物質非投与マウスの腸内細菌叢を抗生物質投与マウスに経口接種した。この結果、12時間以内に全身にIL-34が誘導され(図S1H)、微生物叢の枯渇によって引き起こされた病原体クリアランスと感染誘導性IL-1βおよびII型インターフェロンプログラムの欠損を救済するのに十分であったこと、これはIL-34に依存し(図1E-1H)、腸内微生物叢を熱で死滅させた後も維持された(図1H)ことがわかった。次に、IL-34を回復させるだけで、微生物叢の枯渇による全身防御の欠損を回復させることができるかどうかを調べた。その結果、抗生物質を投与したマウスに組換えIL-34を投与すると、微生物叢の枯渇による抗菌防御の欠損が救済されること(図1I)、これはマクロファージに依存すること(図1I)、そして病原体のクリアランスが回復するだけでなく、肺炎時の宿主の生存率も向上することがわかった(図1Jおよび1K)。次に、IL-34がマクロファージを介した防御をどのように増強しているかを調べたいと考えた。私たちは、IL-34が組織マクロファージによる病原体の殺傷をサポートしているという仮説を検証した。その結果、抗生物質で治療したマウスにIL-34を投与すると、肺炎や敗血症を予防する主要な組織マクロファージ集団である肺胞マクロファージとクッパー細胞による肺炎球菌の殺傷が促進されることがわかった(図1L)。このように、マクロファージを介して作用するIL-34は、腸内細菌叢からのシグナルを感染に対する全身の自然免疫の増強に変換する。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図1. 腸内細菌叢は自然免疫IL-34を介して肺炎、敗血症、髄膜炎を予防する。
(A)図1の模式図。
(B)無菌マウスおよび従来のWTマウス(n = 5-7/群)におけるサイトカインレベル。
(C-E、H、I)肺炎球菌負荷量。
(F、G、K)(E)および(I)のマウスにおける感染誘発サイトカイン。
(J)経鼻肺炎球菌チャレンジ後のWTマウスの生存率。
(肺胞マクロファージとクッパー細胞による肺炎球菌の殺傷。
(B)-(C)および(E)-(L)はWTマウス、(D)はSCIDマウス。エラーバーは平均±SD。比較は,(A)では偽発見率(FDR)補正(5%)を加えた二元配置分散分析,(C)-(E)および(I)ではダンの多重比較検定を加えたクラスカル・ワリス検定,(F)および(G)ではシダックスの一元配置分散分析,(H)および(I)ではマン・ホイットニー,(K)および(L)ではt検定,(I)ではマンテル・コックス検定を用いて群間生存率を比較した。 05、**p<0.01、**p<0.001。
腸内ファーミキューテス類は、その細胞壁糖鎖の全身への到達を通して、IL-34を介して組織免疫を支配的に制御している
次に、IL-34を介して全身性免疫を制御している腸内共生細菌を同定したいと考えた(図2A)。そのために、抗生物質を投与したマウスに、腸の主要な門に属するヒトの共生細菌を経口接種し、IL-34の全身性誘導と宿主の防御力を調べた: ファーミキューテス、バクテロイデーテス、放線菌、プロテオバクテリア。我々は、46種のヒト共生細菌のin vivoにおける個々の影響を調べ、これらのマウスにおける全身性のIL-34誘導が、肺炎球菌による敗血症に対する防御と相関していること、そして、ファーミキューテス属のメンバーが、IL-34の支配的な誘導者であり、敗血症に対して最も防御的であることを見出した(図2B-2EおよびS2A)。ファーミキューテス属の中では、バチルス属とクロストリジウム属の両方が全身的にIL-34を誘導することができ、この性質は腸内ファーミキューテス属の中で広く保存されていることが示された(図2F)。そこでわれわれは、ファーミキューテス属がIL-34産生の主要なドライバーである理由を解明したいと考えた。腸内細菌叢が熱殺後に全身的に免疫をプライミングしたことから(図1H)、ファーミキューテスの構造的構成要素がIL-34産生を促進することが示された。そこで、IL-34の誘導と、共生細菌がこれらの細胞壁糖鎖に対する自然受容体を活性化する能力との間に関係があるかどうかを調べた。しかし、IL-34の誘導や敗血症に対する防御と、共生微生物が糖鎖NOD2、TLR4、TLR2に対する個々のNOD様受容体(NLR)やToll様受容体(TLR)を刺激する能力との間に関連は見られなかった(相関式により決定)、 およびTLR2を活性化する能力(循環IL-34レベルと、これらのPRRを個々に発現するHEKレポーター細胞を活性化する共生体の能力との相関によって決定)(図2Cおよび2E)、またはTLRおよびNLRを集合的に活性化する能力(循環IL-34レベルと、各共生体がマクロファージにおいて誘導するMyd88およびRip2依存性TNF産生量との相関によって決定)(図2Cおよび2E)。そこで次に、IL-34を誘導し、全身防御を制御するファーミキューテスの能力は、細胞壁糖鎖が本来持っている免疫学的能力のためではなく、細胞壁糖鎖が全身組織に到達する能力によって決定されるのかどうかを調べた。このことを調べるために、我々はHEKレポーター細胞を用いて循環中の細胞壁糖鎖レベルを測定することにより、腸から末梢への細胞壁糖鎖の拡散を追跡した。我々の仮説を支持するように、IL-34レベルと肺炎球菌による敗血症に対する防御は、個々の共生生物によってコロニー形成されたマウスの血漿がNOD2とTLR2を活性化する程度と相関していた(図2C-2E)。敗血症時のIL-34誘導と肺炎球菌クリアランスと同様に、ファーミキューテス属にコロニー形成されたマウスの血漿は、他の門の共生細菌にコロニー形成されたマウスの血漿よりも、NOD2とTLR2の両方をより強力に活性化した(図2F)。この特性もまた、クロストリジウム属とバチルス属に共通するものであった(図2F)。このことから、IL-34の誘導や感染防御能力を支配しているのは、ファーミキューテス菌の免疫賦活力そのものではなく、むしろその細胞壁糖鎖の遠位組織への到達のしやすさが、全身的な効果を決定していることが示唆される。
ダウンロード 高解像度画像ダウンロード(2MB)
ダウンロード フルサイズ画像をダウンロード
図2. ファーミキューテス属の細胞壁糖鎖はIL-34を介して全身性免疫を促進する。
(A)図2の模式図。
(B)抗生物質処理したWTマウスをコロニー形成した腸内共生細菌のクラドグラム。
(C)ヒートマップ: IL-34、共生細菌にコロニー形成されたWTマウスにおけるIL-34レベルの平均値(n = 3-6/群);敗血症、感染後12時間後に示した共生細菌にコロニー形成されたWTマウスにおける全身性肺炎球菌負荷量(n = 3-6/群);リゾチーム感受性、リゾチーム処理後の共生細菌のΔOD600nmの平均値(n = 3、二重); 共生体NOD2、TLR2、TLR4、PRR、HEK293細胞によるPRR依存性分泌胚性アルカリホスファターゼ(SEAP)産生の平均値、および共生体により刺激されたマクロファージによるMyd88およびRip2依存性TNF産生の平均値(n = 4、二重); 共生生物によってコロニー形成されたマウスの血漿で刺激した後のHEK293細胞による血漿NOD2、TLR2、TLR4、平均PRR依存性SEAP産生(n = 3-6、二重)。
(D)共生菌にコロニー形成されたWTマウスにおける平均肺炎球菌負荷量と共生菌コロニー形成により誘導された全身性IL-34レベルとの相関(ピアソン検定によるR2)。
(E)IL-34誘導と(C)のパラメータとの相関。(C)のデータを門とクラスでグループ化したドットプロット。各データ点は、個々の生物種に関する所与のパラメーターの平均値を示す。
(F-H)肺炎球菌の負荷(n = 5/群)。E)の相関行列は、FDR補正(5%)をかけたスピアマンの検定によって作成した。比較は、(F)ではKruskal-Wallis検定とDunnの多重比較検定、(G)と(H)では一元配置分散分析とポストホックシダックスによった;*p<0.05、**p<0.01、**p<0.001。
このことをさらに検討するために、我々は、ファーミキューテス菌の細胞壁糖鎖がどのようにして末梢に到達するのかを調べ、ファーミキューテス菌が全身的に免疫を制御する能力を、この全身的な到達が支えているのかどうかを実験的に検証した。我々は、ほとんどのファーミキューテス属菌は外膜を持たないため47、腸管リゾチームがより容易にファーミキューテス属菌に作用し、免疫学的に活性な細胞壁複合糖質を遊離させ、それが全身に広がってIL-34を活性化するという仮説を立てた。このことを裏付けるように、ファーミキューテス菌は他の共生菌よりもリゾチームの活性を受けやすく(図2F)、共生菌のリゾチーム感受性と循環NOD2およびTLR2リガンドレベル、全身へのIL-34誘導、敗血症からの保護との間には相関関係があることがわかった(図2E)。リゾチームによるファーミキューテ細胞壁の粘膜処理が、全身性免疫の制御に果たす役割を実験的に調べるために、我々はいくつかのアプローチを用いた。まず、腸内のファーミキューテス、バクテロイデーテス、アクチノバクテリア、プロテオバクテリアからなるコンソーシアムを作り(図S2B)、自然免疫受容体を活性化する能力が同等であることを確認した。腸内では、IL-34誘導(図S2CおよびS2D)、コンソシアムコロニーゼーション(図S2E)、およびコンソシアム由来の細胞壁複合糖質(図S2F)が同等であった。腸内のコンソシアムコロニーゼーションとコンソシアム由来の細胞壁糖鎖のレベルはIL-34中和の影響を受けなかった(図S2GとS2H)。対照的に、ファーミキューテス属のコンソシアのみが全身にIL-34を誘導し(図S2I)、IL-34を介して全身の防御を増強することができた(図2GおよびS2J-S2L)。我々の仮説に沿って、リゾチームはファーミキューテス属コンソーシアムのみから細胞壁糖鎖を遊離させ(図S2M)、ファーミキューテス属にコロニー形成されたマウスの血漿のみがバックグラウンドレベル以上のNOD2を誘導した(図S2N)ことから、ファーミキューテス属細胞壁糖鎖の全身へのアクセスとIL-34を介した免疫の全身制御の関係が支持された。我々は、これらのコンソーシアムから生きた細菌が全身に散布されないことを確認した(図S2OおよびS2P)。これがファーミキューテス属の一貫した性質であることを確認するため、異なる種組成の代替共生細菌コンソーシアムを構築し、全身性免疫に対するそれらの影響を試験した。我々の仮説を裏付けるように、バクテロイデーテス属ではなく、ファーミキューテス属の代替コンソーシアムは、全身の宿主防御を増強した(図S2Q)。細胞壁糖鎖の全身的アクセスがIL-34の全身的誘導の主要な決定因子であるかどうかを直接調べるために、熱で殺したファーミキューテス属コンソーシアムを循環投与したマウスと、熱で殺したバクテロイデーテス属コンソーシアムを同じ経路で投与したマウスのIL-34レベルを比較した。腸関門を回避することで、IL-34誘導はもはやファーミキューテス属に限定されないことがわかった(図S2RおよびS2S)。さらに、ファーミキューテス属がNLRを介してIL-34を誘導するのに対し、バクテロイデーテス属コンソーシアムはNLRとTLRの両方を通してIL-34を誘導したことから、多様な自然経路がIL-34を活性化しうることが示された(図S2RおよびS2S)。次に、ファーミキューテス属細菌の腸管処理によって生成された細胞壁糖鎖が、単独で全身性免疫を制御するのに十分であるかどうかを調べるために、我々はコンソーシアムからペプチドグリカンを精製し、IL-34を介して全身性防御を増強する能力を調べた。抗生物質を投与したマウスに、ファーミキューテス属のペプチドグリカンを経口接種したところ、バクテロイデーテス属のペプチドグリカンよりも効果的に、IL-34を介して全身性の抗菌性免疫が増強された(図2H)。バクテロイデス菌ペプチドグリカンが全身性免疫を制御できないことは、経口接種の前に、リゾチームと同じ結合を切断するが、細菌がリゾチームに抵抗するために用いるペプチドグリカン修飾の影響を受けないペプチドグリカンヒドロラーゼ48,49であるムタノライシンで前処理することで克服された(図2H)。これらのデータは、細胞壁糖鎖の腸内プロセッシングが全身への影響を決定するという命題をさらに強固なものにしている。このことをより正確に調べるために、リゾチームに感受性のある堅果類(Enterococcus faecalis [E. faecalis]とLactobacillus johnsonni)とリゾチームに耐性のある細菌類(Bacteroides fragilisとBacteroides caccae)の蛍光標識ペプチドグリカンの腸上皮を通過する動きを追跡した(図3A)。リゾチームは、バクテロイデーテス類ではなく、ファーミキューテス類のペプチドグリカンの腸管上皮通過を促進した(図3B)。同様に、E. faecalisのペプチドグリカンはより容易に末梢組織へ播種し(図3C)、IL-34依存的に抗菌免疫と感染誘発性サイトカイン産生を全身的に制御することができた(図3Dおよび3E)。全身組織内のファーミキューテス属ペプチドグリカンの大部分は3 kDa未満であり、広範囲に解重合されていることが示された(図S2T)。B.fragilisのペプチドグリカンをムタノリシン処理すると、ペプチドグリカンが全身に拡散して免疫を制御することができなくなる(図3Dおよび3E)。最後に、リゾチームの役割を明確にするために、リゾチームに対する耐性を制御できるファーミキューテ属のペプチドグリカンの播種と免疫学的影響を調べた。そのために、リゾチームに耐性を示すペプチドグリカンを脱アセチル化する酵素であるPgdAを過剰発現するL. lactisから単離したペプチドグリカンと、リゾチームに感受性を示す同種の空プラスミドコントロールを持つ同系株から単離したペプチドグリカンの全身への影響を比較した50,51。我々は、リゾチームがL. lactisのリゾチーム感受性株からのペプチドグリカンの移動を促進するが、耐性株からのペプチドグリカンの移動を促進しないことを見出した(図3F)。同様に、リゾチーム感受性のL. lactis株からのペプチドグリカンは、より容易に播種された(図3G)。重要なことは、リゾチーム感受性ペプチドグリカンだけが、自然受容体を刺激する能力は同等であったにもかかわらず、IL-34を介して全身的に抗菌防御を制御することができたことである(図3Hおよび3I)(図S2UおよびS2V)。リゾチーム耐性L. ラクティス由来のペプチドグリカンが全身性免疫を制御できなかったことは、やはり、ムタノライシン前処理によって克服することができた(図3Hおよび3I)。このように、ファーミキューテス属の腸内プロセッシングは、IL-34を介して肺炎、敗血症、髄膜炎に対する抵抗性を増強するように全身的に作用する細胞壁糖鎖を遊離する。
ダウンロード 高解像度画像ダウンロード(1009KB)
ダウンロード フルサイズ画像のダウンロード
図3. 腸内ファーミキューテス属細菌の粘膜処理により、IL-34を介して全身性免疫を促進する細胞壁糖鎖が遊離される。
(A)図3の模式図。
(BとF)腸上皮を横断するフルオレセインイソチオシアネート(FITC)-ペプチドグリカンの移動。
(CおよびG)腸から末梢(iLN、鼠径リンパ節)へのFITC-ペプチドグリカンの播種(n = 3-5/群)。
(DおよびH)WTマウスにおける肺炎球菌負荷量。
(EおよびI)(I)および(M)のマウスにおける感染誘発サイトカイン。(B)と(F)ではt検定、(D)と(H)ではKruskal-Wallis検定とDunnの多重比較検定、(E)と(I)では一元配置分散分析とSidakのポストホック検定。
抵抗性による恒常性-IL-34-マクロファージ-mTOR軸は、播種された高分子細胞壁糖鎖を微生物叢から除去し、全身性の炎症を防ぐ
腸内ファーミキューテス菌由来の細胞壁複合糖質が、感染に対する免疫防御をどのように促進するのかを明らかにした後、過剰になると宿主に毒性を示すこれらの微生物分子が、全身組織に付随的な炎症性障害を引き起こすことなく、全身性免疫をどのように制御しているのかを理解したいと考えた。抵抗機構は微生物の量を減らすことでその影響を制御し、一方、寛容機構は微生物の量は変化させないが、宿主への悪影響を減らすことでホメオスタシスを促進する55,56。抵抗機構と寛容機構は主に急性感染時の病原体の制御という観点から検討されてきたが、52,53,54 我々は微生物叢から播種された細胞壁糖鎖の量と影響の制御にも同じ原理が当てはまるかどうかを理解したいと考えた。IL-34はマクロファージを介して作用するため、IL-34を誘導する播種細胞壁糖鎖のレベルはIL-34-マクロファージ経路によって制御され、末梢への蓄積を防ぐという負のフィードバックループが働くという仮説を立てた(図4A)。これを裏付けるように、IL-34を持続的に阻害すると、循環中の微生物叢由来の細胞壁糖鎖レベルが上昇し(図4B)、これは微生物叢依存性の全身性炎症と関連していた(図4C)。同様に、マクロファージの枯渇は循環中の微生物叢由来細胞壁糖鎖の増加と微生物叢依存性の全身性炎症を引き起こした(図4Dおよび4E)。このことをさらに調べるために、共生生物細胞壁糖鎖の全身組織からのクリアランスを追跡した。その結果、微生物叢はIL-34とマクロファージを介して、循環系(図4F-4H、S3A-S3D、S3F、S3G)と肝臓(図S3H-S3K)から高分子細胞壁糖鎖(高分子ペプチドグリカン、LPS、リポテイコ酸[LTA])のクリアランスを促進することがわかった。一方、部分的に解重合したペプチドグリカン、完全に解重合したペプチドグリカン、および単量体ペプチドグリカン断片であるムラミルジペプチド(MDP)のクリアランスを追跡したところ、ペプチドグリカンの断片化が進むにつれて(図S3E)、IL-34とマクロファージによる微生物叢を介したクリアランスの効果が低下することがわかった(図4I-4N、S3K-S3O)。次に、IL-34がどのようにしてこれらの糖鎖のクリアランスを促進するのか、そのメカニズムをより深く検討したいと考えた。IL-34によるCSF1RのライゲーションはmTOR(mammalian target of rapamycin)を活性化する57,58。mTORはマクロファージの生存、捕捉、貪食を制御しているので59,60、IL-34を介した高分子細胞壁糖鎖のクリアランスに必要であるかどうかを検討した。この考えを支持するように、トーリン1によるmTOR、mTORC1、mTORC2の複合体の阻害、あるいはラパマイシンによるmTORC1の単独阻害は、循環系における微生物由来の細胞壁糖鎖の蓄積を引き起こした(図4OおよびS3P)。IL-34の下流でトーリン1またはラパマイシンによるmTOR阻害も末梢からの高分子糖鎖クリアランスを消失させ(図4PおよびS3Q)、これは全身性の炎症と関連していた(図4Q)。さらに、IL-34の下流におけるmTORの役割は細胞壁の糖鎖クリアランスに限定されるものではなく、肺炎、敗血症、髄膜炎の際にもIL-34が病原体のクリアランスを促進するのに必須であることがわかった(図S4A-S4C)。このように、腸から末梢へと細胞壁糖鎖が持続的に播種される中で、負のフィードバック回路は、抵抗機構として働くことによって免疫恒常性を促進する。すなわち、微生物叢から播種された細胞壁成分(主に高分子糖鎖)の組織負荷を軽減し、炎症への影響を制御するのである。
ダウンロード 高解像度画像のダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図4. IL-34-マクロファージ-mTOR軸は播種された高分子細胞壁糖鎖を微生物叢から優先的に除去し、全身性炎症を予防する。
(A)図4の模式図。
(BおよびD)WTマウスの血漿で刺激したHEK293細胞によるPRR依存的SEAP産生。
(CおよびE)(B)および(D)のマウスにおけるサイトカインレベル。
(F-K)FITC標識プロテオバクテリアLPS、ファーミキューテLTA、高分子ファーミキューテPG、部分的に解重合したファーミキューテPG、完全に解重合したファーミキューテPG、およびMDPの全身クリアランス。
(LとM)完全に解重合したファーミキューテPGとMDPのクリアランス。
(N)重合したファーミキュートPG、部分的に解重合したファーミキュートPG、完全に解重合したファーミキュートPGの2時間後のクリアランスの比較(H、I、Jを再プロット)。
(O)WTマウスの血漿で刺激したHEK293細胞によるPRR依存性SEAP産生。
(P)FITC標識Proteobacteria LPSおよび高分子Firmicute投与の全身クリアランス。
(Q) WTマウスにおける糖鎖投与24時間後のサイトカインレベル。エラーバーは平均値±SD;(A)-(Q)のn = 3-5/群;比較は一元配置分散分析(one-way ANOVA)と事後シダック検定;*p < 0.05、**p < 0.01、***p < 0.001。
アルブミンによる微生物叢から播種された細胞壁糖鎖の寛容による恒常性維持は、全身性炎症を制限する。
IL-34-マクロファージ-mTOR軸は高分子細胞壁成分を優先的に除去することから、次に我々は、宿主が細胞壁糖鎖の免疫学的影響を制御する新たな制御機構を持っているかどうかを理解したかった。播種された細胞壁糖鎖は循環系に入り、血管の多い末梢組織を浸潤するので(図3Cと3G)、血流の中にその活性を制御するメカニズムがあるのではないかと考えた(図5A)。この仮説を検証するため、異なる共生分類群の細胞壁複合糖質を血流成分とインキュベートし、生得的レセプターを刺激する能力が減弱するかどうかを調べた。その結果、ヒトおよびマウス由来の白血球を含む血漿は、細胞壁糖鎖がその同族自然受容体を活性化するのを阻害することがわかった(図5Bおよび5C)。この阻害効果は血漿から白血球、脂質、抗体を除去しても維持されたが、細胞壁糖鎖とインキュベートする前に熱処理すると消失した(図5Bと5C)。このことは、血漿中の非抗体タンパク質が阻害の原因であることを示唆している(図5Bと5C)。決定的に重要なことは、インキュベーションの2時間後(すなわち、阻害効果が明白になった時点)に血漿と細胞壁糖鎖の混合物をプロテアーゼ処理すると、血漿による阻害が緩和されたことである(図5Bと5C)。これを裏付けるように、血漿処理によって、SDS-PAGEゲル上でのLPSやLTAの遊走やバンド形成パターン(図5Dと5E)や、薄層クロマトグラフィー(TLC)で分析したMDP(図5F)は変化しなかったことから、血漿はこれらの細胞壁成分を分解していないことがさらに示された。同様に、ペプチドグリカンポリマー分解のマーカーとして、サイズ排除クロマトグラフィー(SEC)で放出されたペプチドグリカン断片をモニターしたところ、血漿はペプチドグリカンを分解しなかった(図5G)。血漿は分解によって細胞壁の糖鎖レベルを低下させるのではなく、免疫系による糖鎖の認識を制限していたことから、血漿は耐性機構というよりもむしろ寛容機構として働くことによって免疫恒常性を維持していることが示唆された。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図5. アルブミンによる隔離を介した微生物叢からの播種細胞壁糖鎖の耐性は全身性炎症を抑制する。
(A)図5A-5Rの模式図。
(BおよびC)マウス(B)およびヒト(C)血漿による共生微生物細胞壁糖鎖のPRR活性化の阻害。WBC、白血球;H.I.血漿(pre)、細胞壁糖鎖とインキュベートする前に熱不活性化した血漿;血漿-抗体、SCIDマウスの血漿;Prot. K.(post)、細胞壁糖鎖を血漿と2時間インキュベートし、プロテイナーゼKで処理した後、HEK293細胞を刺激するために用いた(n = 4-5、二重)。
(D)血漿とインキュベートしたLTAのSDS-PAGE。
(E)血漿とインキュベートしたプロテオバクテリアLPSのSDS-PAGE。
(F)血漿とインキュベートしたMDPのTLC。
(G)高分子ペプチドグリカンから放出された可溶性FITC標識ペプチドグリカンのSEC。
(H) SECで分画したヒト血漿による共生生物細胞壁糖鎖のPRR活性化の阻害。クロマトグラムは示されたクロマトグラムピークの連続精製を表す。SECIIの挿入図はIIIAとIIIBのアルブミンレベルとIIIBのSDS-PAGE。凡例は、試験したレセプターとリガンドの組み合わせ(n = 4、二重)を示す。
(I)IIIBのシブラコンブルー精製のSDS-PAGE。
(J)IIIBのCibracon Blue精製画分による共生生物細胞壁糖鎖のPRR活性化の阻害(n=4、二重)。
(K)アルブミンを除去したヒト血漿による共生生物細胞壁糖鎖のPRR活性化の阻害(n = 5、二重)。
(L)市販のヒトアルブミン製剤による共生生物細胞壁糖鎖のPRR活性化の阻害。凡例は、(K)および(L)で試験したレセプターとリガンドの組み合わせを示す(n = 4、二重)。
(MおよびN) アルブミン枯渇の前後にマウス(M)およびヒト血漿(N)で刺激したHEK293細胞によるPRR依存性SEAP産生(n = 5/グループ)。
(O)WTおよびAlb-/-マウスの血漿による共生細胞壁糖鎖のPRR活性化の阻害(n = 4、二重)。
(P) 抗生物質処理および非抗生物質処理WTマウスのアルブミンレベル(n = 5/群)。
(QおよびR)組換えヒトアルブミンドメインI-IIおよびドメインIIIによる共生生物細胞壁糖鎖のPRR活性化の阻害。(n=4、二重)。
(S)図5T-5Xの模式図。
(T)WTおよびAlb-/-マウスにおけるサイトカインレベル。
(U)WTおよびAlb-/-マウスの血漿で刺激したHEK293細胞によるPRR依存性SEAP産生(n=5/群)。
(V) WTおよびAlb-/-マウスにFirmicutes consortiaペプチドグリカンを経口投与したときのサイトカインレベル。
(W)WTおよびAlb-/-マウスの血漿で刺激したHEK293細胞によるPRR依存性SEAP産生。
(X)腸から末梢へのFITC-ペプチドグリカンの播種(n = 5/群)。エラーバーは平均±SD。比較はすべてt検定で行ったが、(T)と(W)は一元配置分散分析(one-way ANOVA)とポストホックシダックの検定で比較した;*p<0.05、**p<0.01、***p<0.001。
このことをさらに詳しく調べるために、細胞壁糖鎖の生得的認識をマスクする血漿成分を同定したいと考えた。そのために、ヒト血漿をSECで分離し、同等のタンパク質濃度で細胞壁糖鎖による自然免疫受容体の活性化を阻害する血漿画分の能力を比較することにより、阻害成分の溶出を追跡した。SECを3回繰り返した結果、アルブミンが支配する単一のクロマトグラフィーピークが、多様な腸管分類群由来の全ての細胞壁糖鎖を阻害し、それらの同族自然免疫受容体を活性化した(図5H)。アルブミンが阻害因子であるかどうかを調べるため、固定化シバクロンブルーを用いてこのピークをさらに分画し、アルブミンを特異的に精製した(図5I)。予想通り、アルブミン画分はすべての細胞壁糖鎖による自然免疫活性化を阻害する役割を担っていた(図5J)。このことは、アルブミンが、IL-34-マクロファージ-mTORC1軸によって効果的に除去されないものも含めて、微生物叢由来の構造的に多様な糖鎖複合体の免疫系への影響を制御していることを示している。そこで我々は、アルブミンの役割を明確にするために、いくつかのアプローチをとった。第一に、アルブミンの枯渇によって、細胞壁糖鎖の自然免疫受容体活性化に対する血漿の抑制効果が消失することを確認した(図5K)。第二に、市販のヒトアルブミン製剤が細胞壁糖鎖による自然免疫受容体の活性化を阻害することを確認した(図5L)。第三に、アルブミンが生体内で隔離物質であるかどうかを調べるために、血漿中のアルブミンが減少すると、それに伴って血漿中の微生物叢由来の細胞壁複合糖質レベルが減少するかどうかを調べた。その結果、ヒトおよびマウスの血漿は、NOD2、TLR2、およびTLR4レポーター細胞を活性化し、アルブミン枯渇後の血漿は、レポーター細胞をあまり活性化しないことがわかった(図5Mおよび5N)。重要なことは、この循環細胞壁成分の枯渇は、アルブミン除去に用いたクロマトグラフィーマトリックスに対する親和性によるものではなかったことで、循環糖鎖複合体の枯渇はアルブミンによる封鎖によるものと考えられる(図S5AおよびS5B)。その結果、WTマウスとは対照的に、Alb-/-マウスの血漿は細胞壁糖鎖による自然免疫受容体の活性化を抑制しなかった(図5O)。第五に、微生物叢がアルブミン合成を刺激するかどうかを調べた。その結果、アルブミンレベルは微生物叢の影響を受けなかったことから(図5P)、アルブミンは播種された細胞壁複合糖質の炎症への影響を制御するための構成的緩衝剤であることが示された。アルブミンが複数の細胞壁糖鎖を同時に封鎖する仕組みを理解するために、これらの構造的に多様な分子が異なるアルブミンドメインと相互作用するという仮説を検証した。アルブミンには3つのドメインがあり62、これらのドメインの組換え調製物を用いると、ドメインI-IIはペプチドグリカンがNOD2を活性化する能力を阻害するのに対し(図5Q)、ドメインIIIはLTAとLPSが受容体を活性化するのを阻害することがわかった(図5R)。このことは、脂質結合型糖鎖と非脂質結合型糖鎖がアルブミンの異なる部分と相互作用し、異なる細胞壁糖鎖を同時に封じ込めることを可能にしていることを示唆している。最後に、アルブミンが生体内で微生物由来の細胞壁糖鎖の免疫学的活性を制御する役割を果たすかどうかを検証した(図5S)。Alb-/-マウスを用いると、アルブミンがないと微生物叢は全身性の炎症を引き起こすことがわかった(図5T)。重要なことに、微生物叢由来の細胞壁糖鎖レベルはWTマウスとAlb-/-マウスで同等であり(図5U)、アルブミンが播種された糖鎖を排除するのではなく、宿主が許容するために必要であるという仮説を支持した。同様に、抗生物質で治療したAlb-/-マウスでは、WTマウスとは異なり、播種されたファーミキューテス類のペプチドグリカンに耐性を示さなかったが(図5V)、これだけでも、全身性炎症を引き起こすのに十分であった。このように、アルブミンの異なるドメインにより、微生物叢から構造的に多様な循環糖鎖を封じ込め、これらの微生物産物のレベルを変えることなく、宿主に対する炎症性の影響を寛容-制限することにより、免疫恒常性を維持することができる。
耐性機構と抵抗性機構の協力により、腸内ファーミキューテス菌がIL-1βを介して全身性臓器障害と悪液質を引き起こすのを防いでいる。
我々のデータから、宿主は耐性と寛容の両方の機構を利用して、微生物叢由来の細胞壁糖鎖産物が免疫に及ぼす全身的影響を制御していることが示唆された。そこで次に、これらのメカニズムの協調的な作動が、腸内細菌叢との相互作用をどのように維持しているかを調べた(図6A)。我々は、抗生物質を投与したマウスに様々な濃度のファーミキューテス属ペプチドグリカンを経口投与したところ、どちらか一方の経路を欠損させるだけでは、炎症性サイトカインの増加(図6Bと6H)によって特徴づけられる全身性の炎症は誘発されたが、全身組織への好中球の流入(図6Cと6I)、臓器障害(図6Dと6J)、体重減少(図6Eと6K)によって決定されるような全身性の免疫病理は誘発されなかった。対照的に、両経路の切除後、Firmicute peptidoglycanは悪液質を誘発し、循環中の炎症マーカーの顕著な増加(図6Bと6H)、全身組織への好中球流入(図6Cと6I)、臓器損傷(図6Dと6J)、体重減少(図6Eと6K)、筋力消耗(図6Fと6L)、中枢神経系の炎症(図6Gと6M)を特徴とした。抗生物質を投与したマウスに、ファーミキューテス属のペプチドグリカンよりも播種しにくいバクテロイデーテス属のペプチドグリカンを経口接種しても、両経路の遮断は悪液質を引き起こさなかった(図6N-6S)。重要なことは、組換えアルブミンの全身投与が、ファーミキューテスによる悪液質を予防したことである(図S6A-S6G)。このように、我々が同定した耐性機構と寛容機構が並行して働くことで、ファーミキューテスの全身への到達が制御され、免疫学的活性が制約され、生体全体の炎症性組織傷害を防ぐことができる。次に、IL-34がこのモデルにおいて、播種されたファーミキューテス菌のペプチドグリカンのレベルを制御することによって、すなわち耐性機構として働くことによって、相互主義を維持していることを確認したかった。IL-34が耐性機構として機能していることを裏付けるために、経口的にファーミキューテス菌ペプチドグリカンを接種したマウスの播種ペプチドグリカン量を測定したところ、我々の仮説に沿って、IL-34をブロックすると循環中のペプチドグリカンが増加することがわかった(図6T)。アルブミンが耐性機構として機能していることを確認するため、相互作用の破綻の指標として体重減少を循環ペプチドグリカン濃度に対してプロットした。反応ノルムの下降勾配が急であればあるほど、宿主は播種されたファーミキューテのペプチドグリカン濃度の増加に対して耐性が低いことになる。これは急性感染時の耐性を定義するのに使われるアプローチと同じで、体重減少などの宿主の健康状態を示す指標を病原体の負荷量に対してプロットし、耐性の低い宿主ほど、病原体の負荷量が増加するにつれて宿主の健康状態が急激に低下することを示す。その結果、アルブミン無添加のマウスでは、体重減少と循環ペプチドグリカン濃度との反応ノルムプロットの勾配が、アルブミン添加マウスよりも急であることがわかった(図6U)。最後に、我々はファーミキューテス菌がどのようにして悪液質を引き起こしているのかを知りたかった。微生物叢との相互作用を維持する抵抗性と耐性のメカニズムが存在しない場合、ファーミキューテス菌ペプチドグリカンは全身的にIL-1βを誘導した(図5Vと4C)。IL-1βはガンの悪液質を促進することから66、我々はこの系におけるIL-1βの役割を検証した。その結果、抵抗性と寛容性の両方が破壊されたマウスでは、IL-1βの中和によって、悪液質を引き起こすペプチドグリカンが阻止されることがわかった(図6V-6AA)。このように、免疫抵抗性と寛容性のメカニズムがなければ、ファーミキューテスの全身的な作用は、自然防御の有益なプライミングから、IL-1βを介した病的な炎症と悪液質の促進へと移行する。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図6. IL-34が介在する抵抗性とアルブミンが介在する寛容性の協調により、IL-1βを介して炎症性悪液質を促進する腸内ファーミキューテス属菌が予防される。
(A-AA)図6の模式図。WTおよびAlb-/-マウスにおける血漿TNF(B、G、H、M、N、S、V、AA)、脾臓および肝臓MPO(C、I、O、W)、血漿アラニントランスアミナーゼ(ALT)(D、J、P、X)、体重(E、K、Q、Y)、筋肉重量(F、L、R、Z)、および脳TNF(G、M、S、AA)。(T)WTおよびAlb-/-マウスの血漿で刺激したHEK293細胞によるNOD2依存性SEAP産生。(U)同じマウスの血漿で刺激したHEK293によるNOD2依存性SEAP産生に対するファーミキューテスPG投与マウスの体重の反応標準プロット。
データは、アイソタイプコントロール抗体(B、D、E、H、J、K、N、P、Q、X、Y)で処理した微生物叢のないWTマウスに対する相対値である。データは、アイソタイプコントロール抗体で処理した微生物叢を持つWTマウス(C、F、G、I、L、M、O、R、S、W、Z、AA)との相対値。エラーバーは平均±SD。比較は共分散分析(ANCOVA)により比較した(W)を除き、すべてシダックの一元配置分散分析またはt検定により行った;*p<0.05、**p<0.01、***p<0.001。
考察
腸内細菌叢は、事実上すべての臓器・組織における免疫を支配している。我々は、肺炎、敗血症、髄膜炎に対する防御を強化する全身性免疫へのファーミキューテ細胞壁糖鎖の統合を促進する寛容性と抵抗性のメカニズムを明らかにした。ファーミキューテスとの相互作用を確立するためのこの寛容性と抵抗性の機構がなければ、ファーミキューテスの全身への同化はうまくいかず、IL-1βを介した炎症性悪液質につながる。従って、恒常性維持の間、これらの機構は自然免疫系の「調子」を整え、播種された細胞壁糖鎖の免疫学的活性を厳密な範囲内に制約し、生命を脅かす感染症に対する免疫防御を促す臓器間シグナルとして働くことを可能にするが、宿主の重要な臓器の炎症性破壊を通して宿主の生存能力を損なうことを防ぐ。
宿主と微生物との相互作用の管理における宿主の耐性と寛容のメカニズムに関する我々の理解は、主に急性感染時にそれらがどのように働くかを調べることに焦点を当ててきた。抵抗性、特に耐性システムがどのように宿主と微生物叢の相互作用を管理するかは、あまりよく理解されていない。さらに、宿主と微生物の相互作用を管理するために、耐性システムと寛容システムがどのように協調的に機能するかについては、ほとんど理解されていない。耐性に関するこの限られたメカニズム的理解は、一つには、主に免疫系の領域である耐性機構とは対照的に、理論的にはどのような生理学的システムも微生物に対する耐性を促進することができるという事実に起因している。微生物叢と耐性のこれまでの関連性から、微生物叢が急性感染時の病原体に対する宿主の耐性をどのように高めるかが解明されている67。これとは対照的に、我々は、アルブミンによる循環細胞壁糖鎖の隔離が、宿主が微生物叢そのものに直接耐性を示すために用いるメカニズムであることを示している。アルブミンは、最もよく研究されているタンパク質の一つであり、その生化学的特徴の一つは、リガンド結合能の多様性である。それゆえ、アルブミンがなぜこれほど粘着性があるのかは、依然として不明である。我々は、アルブミンがこのようにリガンド結合に貪欲なのは、腸内細菌叢から播種された微生物産物を封じ込めることができ、細胞壁糖鎖の炎症性危険性に対する普遍的な免疫学的緩衝剤として働くことを可能にするためであると提唱している。
腸内細菌叢が宿主に及ぼす全身的な影響についての認識が高まっているにもかかわらず、腸内細菌叢のどのメンバーが全身免疫を制御しているのかは不明であった。ここで、ヒトの共生微生物群の免疫学的影響を調べることにより、我々は、ファーミキューテス属が全身性免疫を制御していることを発見した。このことは、骨髄細胞の寿命の制御、肺抗菌・抗ウイルス免疫の増強、27,45敗血症に対する抵抗性の向上、70癌治療に対する反応性の改善など、様々な全身的効果にファーミキューテスが関係していることを示す、動物モデルやヒトを対象とした一連の研究結果と一致する。われわれが概説した経路を通じて、ファーミキューテス菌が全身性の免疫を制御していることは、ファーミキューテス菌が全身性の生理機能を制御しているとする様々な研究を統一的に説明するものである。
我々の研究は、微生物叢由来の細胞壁複合糖質の構造が、宿主に与える影響を、これまで考えられていたよりも微妙な形で規定していることを強調している。IL-34-マクロファージ-mTORクリアランスシステムとアルブミンが提供する免疫バッファーの協調的な作動は、分類学的に多様な共生生物由来の様々な化学組成、サイズ、電荷、疎水性の度合いの細胞壁糖鎖の活性を制御する巨大な柔軟性を示している。細胞壁糖鎖の構造が免疫原性にどのような影響を及ぼすかは、数多くの研究で明らかにされている74,75。しかし、ここでは免疫原性だけでなく、細胞壁糖鎖の物理的構造がその薬物動態学的プロフィールを決定し、それが宿主内での免疫学的影響を決定することを示す。これは2つのレベルで起こる。第一に、リゾチームによるファーミキューテス属菌のペプチドグリカンの腸内分解が、ペプチドグリカンの粘膜バリアーを越えた移動を促進し、宿主全体に拡散することを見出した。したがって、ファーミキューテス属が全身的に免疫を制御する能力は、そのペプチドグリカンが自然免疫レセプターをより強力に活性化するという本質的な能力によって規定されるのではなく、むしろその細胞壁の粘膜処理によって、宿主の全身性コンパートメントにより容易にアクセスできるペプチドグリカン断片が生成されることによって規定されるのである。しかしながら、これはペプチドグリカンが本来持っている自然免疫受容体を刺激する力が重要ではないということを意味するものではない。例えば、2種類のファーミキューテス菌のペプチドグリカンが同等に播種されるとすれば、IL-34誘導の程度は、自然免疫受容体を活性化するそれぞれの能力を反映していると考えられる。物理的構造が重要である第二のレベルは、IL-34-マクロファージを介したクリアランスである。我々は、やはりクリアランスの結果を決定するのは細胞壁糖鎖の高分子性であることを見出した。具体的には、IL-34を介したクリアランスは、ペプチドグリカンが解重合するにつれて、次第に効かなくなる。つまり、ファーミキューテス菌の細胞壁複合糖質は、より容易に遠くの組織まで到達し、一度到達すると長く持続するため、解剖学的、時間的に、全身的に免疫を支配する範囲が広がるのである。
IL-34はCSF1Rのリガンドであることから、宿主生理におけるIL-34の役割はマクロファージの機能を制御することであると考えられている42。微生物叢とIL-34の下流でmTORC1が制御する正確な細胞機能は現在のところ不明であるが、マクロファージの生存、走化性、貪食活性を制御するその能力は、我々の系における病原体の制御と細胞壁複合糖質のクリアランスの両方に大きく関係していると考えられる59,76,77。さらに、IL-34の下流のmTORシグナル伝達が、NF-κBやp38 MAPキナーゼ78のようなIL-34によって活性化される他の重要なシグナル伝達経路とどのように統合しているのかも不明である。mTOR阻害剤であるラパマイシンは抗炎症剤として臨床的に使用されているが、ラパマイシン治療の副作用として、肺炎、口内炎、関節炎、大腸炎など、様々な炎症性疾患の発症という、不合理で理解されていないものがある79,80,81,82。ラパマイシンが、適切に制御されなければ有害な炎症反応を引き起こす微生物叢からの細胞壁複合糖質の全身的蓄積を引き起こすことを証明することにより、我々の研究は、ラパマイシンに関連するこの逆説的な臨床問題の病因について、メカニズム論的な説明を提供するものである。
哺乳類の健康と病気は微生物によって規定される。われわれの研究は、腸内ファーミキューテス菌がいかに宿主に深く組み込まれ、事実上すべての臓器系において免疫防御のコントロールを確立しているかを明らかにした。宿主が微生物管理に対する主要なアプローチである抵抗性と耐性の両方を用いて、これらの共生生物と相互主義を確立し、免疫系の日常的な運用にシームレスに溶け込み、最も危険なタイプの感染症に対する防御の呼び水となっていることを明らかにした。相互主義を維持するためのこれらの制御機構がなければ、有益なファーミキューテス菌の全身的な影響は破壊的なものとなり、圧倒的な炎症性悪液質を引き起こすことになる。
STAR★メソッド
主要資源表
試薬またはリソースのソース IDENTIFIER
抗体
抗IL-34 R&D Systems AF5195
抗IL-1β(クローン7E3)。 InvivoGen mil1b-mab9
抗 Tlr2 (クローン C9A12) InvivoGen mabg-mtlr2
抗Tlr4抗体(クローンMTS510) eBioscience 14-9924-82
抗Ly-6G抗体(1A8) Biolegend 127602
細菌・ウイルス株
ビフィドバクテリウム・アドレッセンティス BEI Resources N/A
ビフィドバクテリウム・アングラタム BEI Resources N/A
ビフィドバクテリウム・ブレーベ BEI Resources N/A
Eggerthella lenta A. Abdolrasouliによる。
Abdolrasouli N/A
バクテロイデス・フラジリス A. Abdolrasouliによる寄贈
アブドラソウリ N/A
Bacteroides vulgatus BEIリソース N/A
BEIリソース N/A
BEIリソース N/A
バクテロイデス カッカエ PHE N/A
Bacteroides cellulosilyticus BEIリソース N/A
Bacteroides dorei BEI Resources N/A
Bacteroides eggerthii PHE N/A
Bacteroides finegoldii BEI Resources N/A
Bacteroides ovatus PHE N/A
バクテロイデス テタイオタミクロン PHE N/A
バクテロイデス ユニフォーミス PHE N/A
Parabacteroides johnsonii BEI Resources N/A
Bacteroides intestinalis DSMZ N/A
Bacteroides stercoris DSMZ N/A
Parabacteroides merdae DSMZ N/A
Parabacteroides goldsteinii DSMZ N/A
バクテロイデス・サリエルシエDSMZ N/A
バクテロイデス・キシラニソルベンスDSMZ N/A
バクテロイデス・ノルディDSMZ N/A
クロストリジウム・ラモサムDSMZ N/A
ラクトコッカス・ラクティス
(LysRES)は、pgdA遺伝子を含むpWV01の誘導体を持つ。
pgdA遺伝子を持つ。 S.Kulakauskasより提供。
Kulakauskas N/A
pgda遺伝子を持たないpWV01の誘導体を持つLactococcus lactis (LysSEN)
pgda遺伝子を含まないpWV01の誘導体を持つLactococcus lactis(LysSEN)。 S.Kulakauskasより提供
Kulakauskas N/A
Clostridium histolyticum A. Abdolrasouliより提供
Abdolrasouli N/A
Clostridium orbiscindens BEI Resources N/A
クロストリジウム・シンビオサム BEI Resources N/A
エンテロコッカス・フェカリス
マウスの糞便から分離 N/A
Enterococcus faecium PHE N/A
エンテロコッカス・ラフィノサス A. Abdolrasouliによる寄贈
Abdolrasouli N/A
Eubacterium infirmum BEIリソース N/A
Eubacterium limosum A. Abdolrasouliによる寄贈
Abdolrasouli N/A
ラクトバチルス・クリスパタス BEIリソース N/A
Lactobacillus jensenii BEIリソース N/A
ラクトバチルス・ジョンソニイ BEIリソース N/A
ラクトバチルス・ロイテリ BEIリソース N/A
ラクトバチルス・ラムノサス BEIリソース N/A
パエニバチルス・バレンゴルツィイ BEIリソース N/A
ペプトストレプトコッカス・アネロビウス BEIリソース N/A
Weisella cibaria BEIリソース N/A
Streptococcus pneumoniae J.N.によって与えられた。
Weiser N/A
Anaerococcus lactolyticus BEI Resources N/A
ルミノコッカス・ラクタリス BEI Resources N/A
クロストリジウム・シンデンス DSMZ N/A
クロストリジウム・イノキュウム DSMZ N/A
クロストリジウム・インテスティナールDSMZ N/A
クロストリジウム・レプタム N/A
Hafnia alvei BEI Resources N/A
大腸菌 プロメガ N/A
Citrobacter braakii A. Abdolrasouliより提供
Abdolrasouli N/A
シトロバクター・コゼリ N/A
エンテロバクター・クロアカイ PHE N/A
Escherichia hermannii DSMZ N/A
化学物質、ペプチド、組換えタンパク質
メトロニダゾール Sigma M3761-5G
ネオマイシン Sigma N1876-25G
アンピシリン Sigma A9393-5G
バンコマイシン Alfa Aesar J62790
GSK583 シグマ SML1960-25MG
ヒトアルブミン Sigma A1653
マウスアルブミン Sigma A3139
リコンビナントヒトアルブミン、ドメインIII アルブミンバイオサイエンス 9903
組み換えヒトアルブミン、ドメイン I-II アルブミン Bioscience 9905
MyD88 阻害ペプチド InvivoGen tlrl-pimyd
重要な市販アッセイ
AlbuSorb キット バイオテックサポートグループ A185-1
E.Z.N.A便DNAキット Omega Bio-Tek D4015-02
qPCRBIO SyGreen Mix PCR Biosystems Ltd PB20.12
ミエロペルオキシダーゼ(MPO)活性測定キット Abcam ab105136
アラニントランスアミナーゼ比色活性測定キット Cayman Chemical 700260
Pierce アルブミン血清除去キット Thermo Scientific 85160
TNF バイオレンド 430901
IL-6 バイオレジェンド 431301
GM-CSF バイオレジェンド 432201
IL-17A バイオレンド 432501
IL-12/IL-23 p40 バイオレジェンド 431601
IL-17F バイオレジェンド 436107
IL-1β バイオレジェンド 432601
IL-3 バイオテクネ DY403
IL-1a バイオレジェンド 433401
IL-1β バイオレジェンド 432601
IL-23 バイオレジェンド 433704
M-CSF バイオテクネ DY416
G-CSF バイオテクネ DY414
IL-34 Bio-Techne DY5195-05
IL-36γ Aviva Systems Biology OKEH03002
IL-18 Abcam ab216165
IL-36β Invitrogen EM46RB
実験モデル 細胞株
ヒト NOD2 発現 HEK 293 細胞 InvivoGen hkb-hnod2
ヒト TLR2 発現 HEK 293 細胞 InvivoGen hkb-htlr2
ヒト TLR4 発現 HEK 293 細胞 InvivoGen hkb-htlr4
マウスマクロファージ J774A.1 ATCC TIB-67TM
実験モデル 生物/株
マウス C57BL/6 Envigo (UK) ストレイン #:044
マウス C57BL/6J-Albem8Mvw/MvwJ JAX Strain #:025200
マウス CB17 SCID チャールズリバー(英国)系統番号:236
マウス:無菌スイスウェブスターマウス Taconic社(デンマーク)系統番号:SW-M/SW-F
オリゴヌクレオチド
16s フォワード 5'-ACTCCTACGGGGAGGCAGCAGT-3 Sigma N/A
16s reverse 5'-ATTACCGCGCTGGCTGGC-3 Sigma N/A
ファーミキューテス フォワード 5'-GGAGYATGTGGTTTAATTCGAAGCA-3'; Sigma N/A
Firmicutes reverse 5'-AGCTGACGACAACCATGCAC-3' Sigma N/A
バクテロイデーテス フォワード 5'-GGARCATGTGGTTTAATTCGATGAT-3 シグマ N/A
Bacteroidetes reverse 5'-AGCTGACGACAACCATGCAG-3'。 シグマ N/A
放線菌フォワード 5'-TACGGCCGCAAGGCTA-3' シグマ N/A
放線菌 逆方向 5'-TCRTCCACCTTCCTCCG-3' シグマ N/A
フソバクテリア フォワード 5'- AAGCGCGTCTAGGTGGTTATGT-3' シグマ N/A
Fusobacteria reverse 5'- TGTAGTTCCGCTTACCTCCAG-3' Sigma N/A
ガンマプロテオバクテリア フォワード 5'- TCGTCAGCTCGTGTYGTGA-3' Sigma N/A
ガンマプロテオバクテリア・リバース 5'- CGTAAGGGCCATGATG-3' Sigma N/A
クロストリジウム・ヒストリチカム フォワード 5'-AGAAGCAAGACCGT
GAGGTG-3' シグマ N/A
クロストリジウム・ヒストリチカム・リバース 5'-CGGACTTCGGGTGTTACCAA-3' Sigma N/A
ペプトストレプトコッカス・アネロビウス フォワード 5'-CGATGAGTACTAGG
TGTCGGG-3' シグマ N/A
ペプトストレプトコッカス・アネロビウス・リバース 5'-AGCCCCGAAGGGAA
GGTGTG-3' シグマ N/A
パエニバチルス フォワード 5'-CAGGGAAGA ACGCTATGGA
-3' シグマ N/A
パエニバチルスリバース 5'- CGATGCGAC
CCGGAGTT -3' シグマ N/A
腸球菌フォワード 5'- TGCTCCACCGGAAAAAGA -3' Sigma N/A
腸球菌リバース 5'- CACCAACTAGCTAATGCA-3' Sigma N/A
ラクトバチルス・ロイテリ フォワード 5'-GTGCTTGCACCTGATTGTC Sigma N/A
ラクトバチルス・ロイテリ・リバース 5'-TCCCAAAGTGATAGCCAAA Sigma N/A
ソフトウェアとアルゴリズム
GraphPad Prism 9.3.1 グラフパッド N/A
SPSS バージョン 26 IBM N/A
FigTree v1.4.4 N/A N/A
Matlab_R2019a MathWorks N/A
リソースの有無
連絡先
リソースおよび試薬に関する詳細情報およびリクエストは、主担当者 Thomas Clarke (thomas.clarke@imperial.ac.uk) に直接連絡のこと。
材料の入手可能性
本研究では、新規の試薬は使用していない。
実験モデルおよび研究参加者の詳細
細菌株
本研究で使用した細菌とその増殖条件の概要は表S2に示す。NCBIのTaxonomyデータベースを用いて系統樹を作成し、FigTree v1.4.4を用いて可視化した。
マウス
この研究の倫理審査はImperial College London Animal Welfare and Ethical Review Bodyによって行われ、1986年のAnimals (Scientific Procedures) Act (PPL 70/7969およびPF93C158E)に概説されている英国内務省の権限に基づき、マウスの使用が許可された。野生型C57BL/6マウスはEnvigo社(英国)から、Alb-/-(C57BL/6)マウスはJackson Laboratories社(米国)から、CB17 SCIDマウスはCharles River社(英国)から、無菌スイス・ウェブスターマウスはTaconic社(デンマーク)から購入した。雌雄ともに6週齢から10週齢のマウスを用いた。マウスは無作為に実験群に割り付けられ、アスペンチップ2の寝具で1ケージあたり5匹以下で飼育された。マウスは12時間明期・12時間暗期サイクル、20~22℃で飼育された。水と餌は自由に与えられ、マウスにはRM1(特別食サービス)を与えた。
方法の詳細
微生物叢およびサイトカイン操作
広域抗生物質(メトロニダゾール1g/L、硫酸ネオマイシン1g/L、アンピシリン1g/L、バンコマイシン0.5g/L)を14日間飲水投与し、微生物叢を減少させた15,27,43,83。腸内細菌叢を死滅させるため、減菌PBS中の糞便懸濁液を遠心分離でペレット化し、ペレットを減菌PBSに再懸濁した後、95℃で30分間加熱した。共生細菌の投与は、抗生物質投与マウスに、抗生物質投与中止後、1×108 CFUの共生細菌を経口接種した。すべての共生生物は、表S2に概説した培地と条件で対数期中期まで増殖させた。嫌気性生物は接種前にあらかじめ還元したPBSに懸濁し、好気性生物は接種前にPBSに懸濁した。マウスに共生生物コンソシアを与えた実験では、コンソシアは1×108 CFUで、それぞれの種が同数であった。図2G、S4C~S4L、およびS4Nで生きたまま、図S4PおよびS4Qで熱不活化したコンソーシアムを用いたのは、以下のBacteroidetesコンソーシアムである: B. vulgatus、B. dorei、B. thetaiotaomicron、B. fragilis、P. melaninogenica;ファーミキューテス属コンソーシアム: ファーミキューテス属コンソーシアム:C. histolyticum、L. reuteri、P. anaerobius、P. barengoltzii、E. faecium;放線菌コンソーシアム:B. adolescentis、E: また、プロテオバクテリア・コンソーシアムでは、大腸菌、C: プロテオバクテリア・コンソーシアム:E. coli、C. baraaki、E. cloacae、C. koseri、H. alvei。これらのコンソシアムの生きたメンバーの全身への移行を調べるため、コンソシアムを投与したマウスの組織をコンソシアム投与3日後に採取し、ホモジナイズしてBHI+5%(v/v)血液上にプレーティングし、37℃で好気的に24時間、嫌気的に72時間インキュベートした。これらのコンソシアムからペプチドグリカンを抽出し、図2H、5V、5W、6、S11に示した時点で等しい割合で使用した。腸粘膜を迂回する実験では、これらのコンソーシアムの1×107 CFUを熱死させ、腹腔内注射で投与した。図S4Oに示す実験では、代替Bacteroidetesコンソーシアムは以下の通りであった: P.goldsteinii、B.salyersiae、B.xylanisolvens、B.nordii: C.innocuum、C.intestinale、A.lactolyticus、C.leptumであった。コンソーシアムは1×108 CFUで、それぞれの種が同数であった。サイトカイン中和のため、マウスに抗IL-34(R&D Systems社製)またはアイソタイプコントロールを20μg/マウスで腹腔内注射した。IL-1βを中和するために、ペプチドグリカン投与の1日前に、抗IL-1β(InvivoGen)抗体を20μg/マウスで腹腔内注射した。全身のマクロファージ集団を枯渇させるために、クロドロネート含有リポソーム(FormuMax Scientific)を前述のように腹腔内注射で投与し84、肺胞マクロファージを枯渇させるために、クロドロネート含有リポソームを前述のように鼻腔内経路で投与した27。図1I、1K、4P、4Q、S7P、およびS9A-S9Cでは、組換えIL-34(R&Dシステムズ)を、腹腔内注射で10μg/マウス、または鼻腔内経路で5μg/マウスで全身投与した。ラパマイシンは80μg/マウス、トーリン1は25μg/マウスを、図に示した時点で腹腔内注射により投与した。Tlr2およびTlr4を中和するために、マウスに抗Tlr2抗体(InvivoGen社製)および抗Tlr4抗体(eBiosciences社製)をともに100μg/マウス、または適切なアイソタイプコントロールとして腹腔内注射し、GSK583(Sigma社製)を用いて保存されている下流アダプターRip2を阻害することにより、Nod1およびNod2の活性をin vivoでブロックした。組換えマウスアルブミン(Sigma)を30 mg/マウスで腹腔内注射により全身投与した。
微生物叢解析のため、E.Z.N.A Stool DNA kit(Omega Bio-Tek)を用い、製造者の指示に従って糞便からDNAを抽出した。便サンプルは200mgのビーズと一緒にし、FastPrep-24装置(MP Biomedicals)を用いて、20秒間のボルテックスと2分間の回復期間を15回繰り返してホモジナイズした。DNA抽出工程には、グラム陽性菌の溶解を促進するオプション工程と、100μgのRNase Aを用いて37℃で3分間RNAを除去する工程が含まれていた。抽出されたDNAは、16S rRNA遺伝子の定量(q)PCRに使用された。qPCRには、1×SYBR Green PCR Master Mix(PCR Biosystems Ltd)、200nMのフォワードプライマーおよびリバースプライマー、2μlの鋳型DNAを含む合計10μlの反応混合物を調製した。qPCRはApplied Biosystems StepOnePlus装置で、95℃で15秒、61℃で1分の増幅を40サイクル行った。16S rRNA 遺伝子のコピー数を算出するために、定量する生物種または指示した門の代表的な細菌種からクローニングした 16S rRNA 遺伝子を含むプラスミドを用いて標準曲線を作成した。プラスミドコピー数は以下の式で計算した: (プラスミドコピー数は、(プラスミド量(ng)×6.0221×1023分子mol-1)/((4,500×660g mol-1)×1×109ng g-1)の式で算出した。ここで、4,500は16S rRNA遺伝子を挿入したプラスミドの推定長さ、660g mol-1は二本鎖DNAの1塩基の平均質量である。この標準曲線を用いて、便1gあたりの16S rRNA遺伝子コピー数を求めた。使用したプライマーは主要リソース表にある。
細菌感染
肺炎をモデル化するために、マウスを以前に記載されたように感染させた27,85。簡単に言えば、マウスをイソフルランで麻酔し、PBS 50 μL中に約1×105 CFUのS. pneumoniaeを経鼻接種した。敗血症と髄膜炎をモデル化するため、マウスに200μLのPBS中1×105CFUの肺炎球菌を腹腔内注射で感染させた。感染から12時間後にマウスを殺し、組織を取り出し、PBS中でホモジナイズし、トリプティックソイブロス(TSB)+5%(v/v)脱脂ウマ血液にプレーティングして細菌負荷を測定した。肺炎時の生存率を分析する際、マウスは次の徴候のうち2つ以上を示したときに殺された:動きの減少、猫背姿勢、毛孔形成、震え、呼吸困難、旋回。これらの感染徴候を24時間以上示した動物はいなかった。
ペプチドグリカンの調製
86に概説されている方法に従って、高分子ペプチドグリカンを腸内共生細菌から調製した。細菌はログ相中期まで増殖させ、16,636×gで25分間遠心分離して回収した。このペレットを氷冷dH2Oに0.2gの細菌ペレット対1mLのdH2Oの割合で再懸濁した。この懸濁液を等容量の沸騰した8%(v/v)SDSに滴下した。この溶液を撹拌しながら1時間以上煮沸し、室温まで冷却した。懸濁液を78,000×gで30分間遠心分離した。ペレットをdH2Oで3回洗浄し、SDSを除去した。ペレットを10mM Tris, pH7.5, 10mM NaCl, 50mg/mL トリプシンに懸濁し、37℃で2時間インキュベートした。その後、細胞壁物質を78,000×g、4℃で25分間ペレット化した。この処理後も細胞壁ペレットが白色のままであれば、半透明のペレットが得られるまでこの処理を繰り返した。その後、このペレットを8 mM LiCl2に再懸濁し、続いて78,000×g、4℃で25分間遠心した。これを3回繰り返し、その後dH2Oで洗浄した。洗浄したペレットをアセトンに懸濁し、78,000×g、4℃で25分間遠心した。このアセトン洗浄を3回繰り返し、最終ペレットをdH2Oに懸濁し凍結乾燥した。図5Bおよび5Cのムラミルジペプチドを用いた実験では、N-アセチルムラミル-L-アラニル-D-イソ-グルタミン(Sigma)を用いた。図4Kおよび4Mのクリアランス実験では、FITC-ムラミルジペプチドはFITC標識N-アセチルムラミル-L-アラニル-D-イソ-グルタミン(InvivoGen)、図S3Gのクリアランス実験では、ムラミルジペプチドはN-アセチルムラミル-L-アラニル-D-イソ-グルタミン(Sigma)を用いた。図5FのTLCアッセイでは、ムラミルジペプチドはN-アセチルムラミル-L-アラニル-D-グルタミン酸であった。
LPSの調製
LPSは、87に概説された方法に従って、指示された腸内細菌から調製された。その後、細菌を10 mM Tris、pH 8.0、2 mM MgCl2、100 mg/mL 膵臓DNアーゼに再懸濁し、Qsonica 700 Wattソニケーターを用いて、プローブ強度75%で、20秒の冷却を挟んで4×30秒のバーストで超音波処理することにより破砕した。超音波処理後、サンプルを冷却し、さらにDNaseを最終濃度200mg/mLまで添加し、37℃で2時間絶え間なく攪拌しながらインキュベートした。インキュベーション後、10 mM Tris, pH 8.0中のEDTAとSDSを、最終濃度0.1M EDTAと2%(w/v) SDSでこの懸濁液に加えた。これをボルテックスし、48,384×gで30分間、室温で遠心分離して不溶性の細胞壁物質を除去した。上清を保持し、最終濃度が200mg/mLになるようにトリプシンを添加し、37℃で一晩、絶え間なく撹拌しながらインキュベートした。上清を1,000×g、5分間の遠心分離で清澄化した。LPSを沈殿させるため、上清を375mM MgCl2を含む2容量の95%(v/v)エタノールと合わせ、0℃に冷却し、9,795×g、4℃で15分間遠心した。ペレットを10mM Tris, pH 8.0, 100mM EDTAおよび2%(v/v)SDSに再懸濁し、前と同様に超音波処理した。懸濁液を85℃で15分間インキュベートした後、室温まで冷却し、最終濃度25mg/mLになるようにトリプシンを添加し、37℃で一晩、絶え間なく撹拌しながらインキュベートした。懸濁液中のLPSを375mM MgCl2を含む2容量の95%(v/v)エタノールで沈殿させ、0℃に冷却した後、9,795×gで4℃、15分間遠心した。ペレットを10 mM Tris, pH 8.0に再懸濁し、前と同様に超音波処理し、1,000×gで5分間遠心分離して破片を除去した。上清を110,509×gで1.5時間遠心し、LPS含有ペレットを凍結乾燥した。
LTA精製
LTAは、88,89に概説された方法に従って、示された腸内細菌から調製した。細菌はログ相中期まで増殖させ、16,636×gで25分間遠心分離して回収した。細胞ペレットを50mMクエン酸ナトリウム緩衝液pH4.7で洗浄し、0.5mmジルコニアシリカビーズを用いたビーズビートで破砕した。ジルコニアシリカビーズを200×gの遠心分離で除去した。ビーズ除去後、48,384×g、30分間、室温で遠心して細胞包をペレット化し、50mMクエン酸ナトリウム緩衝液pH4.7に再懸濁し、1-ブタノールと1:1で混合し、室温で1時間インキュベートした。48,384×g、室温、30分間の遠心分離で相を分離し、50mMクエン酸ナトリウム緩衝液pH4.7、15%(v/v)1-プロパノールで平衡化したオクチルセファロース4樹脂を用いた疎水性相互作用クロマトグラフィー用に水相を回収した。50mMクエン酸ナトリウムpH4.7中1-プロパノール65%(v/v)までの直線勾配でLTAを溶出した。
ペプチドグリカン、LPSおよびLTAのFITC標識
ペプチドグリカンは90. 標識された細胞壁は、遊離FITCを除去するために少なくとも3回dH2Oで洗浄した。LPSを蛍光標識するために、精製LPSとFITCを、精製LPS1mgあたり5mLの100mM H3BO3および25mM Na2B4O7、pH8.6中、1:4(w/w)の割合で合わせ、37℃で3時間インキュベートした。標識LPSを110,509×gで1.5時間遠心分離してペレット化し、dH2Oでさらに2回洗浄して残留FITCを除去した。LTAはLPSと同様に標識し、1-ブタノールと疎水性相互作用クロマトグラフィーで再精製した。
組織解剖
失血後、脾臓、肝臓、肺、骨髄、大腸、小腸、鼠径リンパ節を解剖し、滅菌PBS中で組織ホモジナイザーを用いてホモジナイズし、残った残屑を沈殿させ、ホモジネートをセルストレーナーに通した。ホモジネートはその後、ELISA、MPOおよびALTレベルを測定する比色酵素アッセイ、またはFITC標識細胞壁糖鎖の拡散を追跡するために使用された。FITC蛍光は494 nmで励起、525 nmで発光し、FITC標識細胞壁糖鎖を投与していないコントロールマウスの同じ組織のバックグラウンド自家蛍光は差し引いた。腸内のペプチドグリカン量を調べるために、0.2 gの腸組織を1 mLの滅菌PBSでホモジナイズした腸ホモジネートのアリコートを用いて、PRR依存性SEAP HEK293レポーター細胞を24時間刺激した。筋肉の消耗を調べるため、大腿四頭筋を解剖し、重量を測定した。
血液と血漿
健康なボランティアからのヒト血液の使用について、地域倫理委員会とImperial NHS Trust Tissue Bankから倫理的承認を得た(REC Wales承認番号12/WA/0196、ICHTB HTAライセンス番号12275)。マウスおよびヒトの血液は、抗凝固剤としてEDTAを含むチューブに採取し、直ちに使用するか、血液成分を分離するために処理した。赤血球、血漿、白血球を含むバフィーコートは、1,500×g、10分間の遠心分離により全血から分離した。血漿は、65℃で5分間熱処理するか、プロテイナーゼK(100μg/mL)で6時間処理することにより不活化した。プロテイナーゼKは65℃で20分間熱処理することにより不活性化した。血漿を、ブタノール-ジイソプロピルエーテル(40:60、(v/v))と1:2(v/v)の比率で混合することにより脱脂した。混合物を室温で30分間インキュベートした。水相と溶媒相を2,000×gで5分間遠心分離して分離した。脂質を含む溶媒相は捨てられ、残った血漿を含む水相は保存された。血漿が細胞壁糖鎖の自然免疫受容体を活性化する能力を阻害するかどうかを決定するために、細胞壁糖鎖を最終濃度80%(v/v)の血漿と2時間インキュベートし、これらの混合物のアリコートを用いて、示されたPRR依存性SEAP HEK293レポーター細胞を24時間刺激した。阻害率は、PRR依存性SEAP HEK293レポーター細胞を刺激する0時間の細胞壁糖鎖:血漿混合物の能力に対する相対値で表した。これらの血漿阻害アッセイにおいて、Proteobacteria PGは大腸菌ペプチドグリカン(2 μg/mL)、Firmicute PGは高分子E. faecalisペプチドグリカン(すなわち、非マルタノリシン処理PG、2 μg/mL)、Bacteroidetes PGは高分子B. fragilisペプチドグリカン(すなわち、非マルタノリシン処理PG、2 μg/mL)であった。プロテオバクテリアLPSは大腸菌LPS(500 ng/mL)、バクテロイデーテスLPSはB. fragilis LPS(500ng/mL)、ファーミキューテスLTAはE. faecalis LTA(500ng/mL)であった。阻害/活性化は、PRR依存性SEAP HEK293レポーター細胞を刺激する0時間の細胞壁糖鎖:血漿混合物の能力に対する相対値で表した。
タンパク質/細胞壁糖鎖分析
タンパク質、LPSおよびLTAの分離には、Tris-Glycine緩衝液系を用いたSDS-PAGEを用いた。タンパク質の可視化のために、ゲルを50% (v/v) メタノール、10% 酢酸 (v/v)、40% dH2O、10 mg/L Coomassie Brilliant Blue R-250中で約1-2時間インキュベートした。脱染は、50%(v/v)メタノール、10%(v/v)酢酸、40%(v/v)dH2O中で行った。血漿がLPSを分解するかどうかを分析するため、最終濃度10μg/mLのLPSを80%(v/v)血漿とともに37℃で2時間インキュベートした。上記のLPS単離プロトコールを用いてLPSを再抽出した。血漿がLTAを分解するかどうかを分析するため、最終濃度10μg/mLのLTAを80%(v/v)血漿とともに37℃で2時間インキュベートした。上記のLTA単離プロトコールを用いてLTAを再抽出した。LPSの可視化には銀染色を用いた。LPSの電気泳動後、ゲルを40%(v/v)エタノール、5%(v/v)酢酸、0.7%(w/v)NaIO4の酸化溶液に移し、室温で絶え間なく攪拌しながらインキュベートした。その後、ゲルをdH2Oで30秒間3回、0.02% (v/v) Na2S2O3・5H2Oで1分間1回、再びdH2Oで30秒間3回洗浄した。その後、ゲルを0.025% (v/v) ホルムアルデヒドと12.5 mM AgNO3に30分間浸し、dH2Oで短時間洗浄した。ゲルを367mM Na2CO3-10H2O、0.009%(v/v)ホルムアルデヒド、0.00125%(w/v)Na2S2O3-5H2Oに浸し、約45℃に加熱して現像した。60mM酢酸を用いて現像を停止した。図5Eの「H.I.血漿」は、LPSとのインキュベーションに先立ち、65℃で5分間熱不活化した血漿である。LTAはアルシアンブルー(0.1%(w/v)アルシアンブルー、5%(v/v)酢酸、40%(v/v)エタノール)を用いて可視化した。図5Cの「H.I.血漿」は、LTAとインキュベートする前に65℃で5分間熱不活性化した血漿であり、「HCL」は95℃で5分間1N塩酸で処理したLTAである。
ペプチドグリカンのTLCおよびFPLCアッセイ
血漿がムラミルジペプチドを分解しているかどうかを分析するために、薄層クロマトグラフィー(TLC)を用いた。ムラミルジペプチド(N-アセチルムラミル-L-アラニル-D-グルタミン酸、MDP)(5mg/mL)およびL-Ala、D-Glu標準物質(5mg/mL)を、80%(v/v)血漿とともに37℃で2時間インキュベートした。反応混合物のアリコートをシリカゲル60 F254薄層クロマトグラフィープレートにロードし、乾燥させた。クロマトグラフィーは、ブタノール-エタノール-水(50:32:18)溶媒系で行った。その後、TLCプレートを乾燥させ、アセトン中0.25%ニンヒドリン(w/v)をスプレーし、100℃に加熱して標識アミン基を可視化した。血漿が高分子ペプチドグリカンを分解するかどうかを分析するために、蛍光標識ペプチドグリカンの可溶性断片が高分子ペプチドグリカンから遊離するのをサイズ排除クロマトグラフィーで追跡した。最終濃度175μg/mLのFITC標識高分子ペプチドグリカンを、80%(v/v)血漿、熱不活性化血漿、またはムタノライシン(100μg/mL)と37℃で2時間インキュベートした。この反応混合物を10倍に希釈し、4℃で78,000×g、25分間遠心分離し、蛍光標識ペプチドグリカンの遊離断片と分離して高分子ペプチドグリカン断片をペレット化した。反応混合物の上清のアリコートを、ÄKTA PurifierのHiLoad® 26/600 Superdex® 75 pgカラムを用いたサイズ排除クロマトグラフィーで分離した。このクロマトグラフィーから得られたフラクションのFITCシグナルは、494 nmで励起、525 nmで発光して測定された。クロマトグラムは、Savitzky-Golayフィルターの2回の繰り返しで平滑化した。1回目は次数5、フレーム長55、2回目は次数2、フレーム長45で、MATLAB sgolayfilt関数を使用した。陽性対照として、ムタノライシン(100 mg/mL)で処理したFITC標識高分子ペプチドグリカンを用いた。
血漿分画とアルブミン除去
血漿の分画には、ÄKTA PurifierのHiLoad® 16/600 Superdex® 200 pgカラムを用いたサイズ排除クロマトグラフィーを用いた。カラムはpH7.0のPBSで予め平衡化し、血漿は1mL/分の流速で分離した。サイズ排除クロマトグラフィーを3ラウンド行った後、HiTrap® Blue HPカラムを用いたシブラコンブルー精製により、ヒト血漿の指示画分からアルブミンを精製した。図5Hでは、1ラウンドのサイズ排除クロマトグラフィーの後、フラクションを以下のようにプールした: 40 mL - 49 mL, 50 mL - 59 mL, 60 mL - 69 mL, 70 mL - 79 mL, 80 mL - 89 mL。細胞壁複合糖質をプールした血漿画分(10 mg/mL)と2時間インキュベートし、これらの混合物を用いてPRR依存性SEAP HEK293レポーター細胞を24時間刺激した。さらに2回のサイズ排除クロマトグラフィーで、2つの主要ピークからのフラクションを、ピーク頂点の±5mLと合わせた。PRR活性化に対する分画血漿の阻害効果は、PRR依存性SEAP HEK293レポーター細胞を刺激する0時間の細胞壁糖鎖:血漿混合物の能力に対する相対的なものである(n=4、二重)。ヒト血漿からアルブミンを除去するには Pierce Albumin Depletion Kit を、マウス血漿からアルブミンを除去するには AlbuSorb(Biotech Support Group)を、メーカーの指示に従って使用した。ヒトアルブミン(Sigma)および組換えアルブミンドメイン(Albumin Biosciences)は最終濃度10 mg/mLで使用した。
リゾチームアッセイ
細菌を適切な培地と条件下で対数期中期まで増殖させ、ペレット化し、洗浄後、リゾチーム(100 μg/mL)を添加した最終NaCl 300 mMのPBSに再懸濁した。600nmの光学密度(OD600nm)を、時間ゼロで測定し、37℃で2時間インキュベートした後に再度測定した。リゾチーム処理した共生コンソシアからの細胞壁複合糖質の遊離を調べるために、示したコンソシアの約5×107 CFUをリゾチーム(100 μg/mL)と37℃で2時間インキュベートした。コンソシアを遠心分離でペレット化し、上清を凍結乾燥した。凍結乾燥物を1mLのエンドトキシンフリー水に再懸濁し、10μLをヒトNOD2、TLR2、およびTLR4を発現するHEK Blue細胞の刺激に使用した。
細胞壁糖鎖クリアランス
全身組織からの細胞壁糖鎖のクリアランスを追跡するために、指定群のマウスにFITC標識細胞壁糖鎖を腹腔内注射し、2時間後または4時間後に犠牲にした。その後、血漿中および肝臓中のFITC標識細胞壁糖鎖レベルを測定した。クリアランスは、図4F-4N、4PおよびS7A-S7Hでは全身投与2時間後または4時間後の指示組織におけるFITC-細胞壁糖鎖依存性蛍光の相対的減少として、図S7IおよびS7Nでは全身投与2時間後に採取したマウス血漿で刺激したHEK293細胞によるPRR依存性SEAP産生の相対的減少として表した。図4およびS7において、重合したファーミキュートPGは、投与前にメタノライシンで処理されていないFITC-E. faecalisペプチドグリカンであり、部分的に解重合したファーミキュートPGは、FITC-E. faecalisペプチドグリカンは、投与前にミュータノリシン(10μg/mL)で15分間処理した後、100℃で5分間加熱してミュータノリシンを不活性化したものであり、完全に解重合したFirmicute PGは、投与前にミュータノリシン(100μg/mL)で一晩処理したFITC-E. FITC標識ペプチドグリカンの解重合度を測定するため、ムタノリシン処理ペプチドグリカンを78,000×gで1時間遠心分離し、上清中のFITC蛍光を494nmで励起、525nmで発光させて測定した。高分子ペプチドグリカンはこの条件下でペレット化されるが、解重合したペプチドグリカンの断片は上清中に見出される。組織中のペプチドグリカン断片の大きさを調べるため、FITC-ペプチドグリカンを投与したマウスの肝臓および脾臓ホモジネート1mlを一晩プロテアーゼK処理(100μg/mL)した後、熱不活化した。その後、分子量3 kDaのフィルターを備えた遠心フィルターユニットにかけ、>3 kDa画分および<3 kDa画分のFITC蛍光を494 nmでの励起および525 nmでの発光により測定し、分画前のサンプル蛍光との相対値で表した。FITC標識細胞壁糖鎖を投与していないコントロールマウスの同じ組織のバックグラウンド自家蛍光を差し引いた。
細胞壁糖鎖の散布
FITC標識および非標識細胞壁糖鎖の調製物をPBS中で経口投与した。図3C-3Eおよび3G-3Iでは、抗生物質で処置したWTマウスに、B. fragilis、E. faecalis、L. lactis(LysSEN)またはL. lactis(LysRES)由来のFITC-ペプチドグリカン(2回投与×175μg/mL)を経口投与した(n=5/群)。2回目の投与の4時間後にマウスを犠牲にした。示された組織からの平均FITC-PG依存相対蛍光単位(RFU)シグナルが示される。ペプチドグリカンを完全に分解するために、ペプチドグリカン調製物を37℃で一晩、ムタノライシン(100μg/mL)で処理した。
細胞培養
ヒトNOD2、TLR2、およびTLR4(InvivoGen)を発現するHEK Blue細胞を、10%(v/v)ウシ胎児血清(Invitrogen)、100単位/mLペニシリン、100mg/mLストレプトマイシン、30mg/mLブラストサイジン、100mg/mLゼオシン、およびプラスモシン50μg/mLを添加したDMEM中、5%(v/v)CO2、37℃で培養した。刺激の前に、細胞を約2.5×104個/ウェルで96ウェルプレートに播種し、一晩接着させた。全細菌で細胞を刺激するために、対数期半ばまで増殖させた細菌を熱殺菌し、HEK Blue細胞と1:10の感染倍数でインキュベートした。パターン認識受容体のライゲーションに応答して、HEK Blue細胞は胚性アルカリホスファターゼ(SEAP)を分泌する。細胞培養上清中のSEAP活性は、QuantiBlue検出試薬(InvivoGen)を用いて測定することができる。SEAP活性を測定するには、HEK Blue細胞の培養上清を除去し、65℃で5分間インキュベートして増殖培地中の内因性アルカリホスファターゼ活性を不活性化し、QuantiBlueアルカリホスファターゼ検出試薬に1:4の割合で添加した。30分間インキュベートした後、620nmの吸光度を測定し、SEAPレベルを報告した。腸内共生細菌によるHEK Blue刺激では、刺激後24時間後にSEAP活性を測定した。ヒトおよびマウス血清中のNOD2、TLR2、およびTLR4リガンドの検出のために、HEK Blue細胞を、15に記載したように、熱不活性化血清で30時間刺激した。J774A.1マクロファージ細胞株は、10%(v/v)ウシ胎児血清、100ユニット/mLペニシリン、100mg/mLストレプトマイシンを添加したDMEM中、5%(v/v)CO2、37℃で培養した。全細菌で細胞を刺激する前に、マクロファージを約2.5×104個/ウェルで96ウェルプレートに播種し、一晩接着させた。その後、中ログ相まで増殖させ、熱殺菌した細菌で、感染倍率1:10で刺激した。刺激の24時間後に上清を除去し、サイトカイン産生をELISAで測定した。阻害剤で処理するために、マクロファージは常在菌刺激の前に1時間、指示された阻害剤とインキュベートした。使用した阻害剤は、Rip2阻害剤GSK583(Sigma)とMyd88阻害剤Pepinh-MYD(InvivoGen)で、いずれも最終濃度は5mMであった。Caco-2細胞は、ダルベッコ改変イーグル培地、10%(v/v)ウシ胎児血清、100ユニット/mlペニシリン、100ユニット/mlストレプトマイシン中で培養した。極性上皮細胞層は、トランスウェルインサート(コーニング・ライフサイエ ンス社製)上で液液界面培養として増殖させたCaco-2細胞であった91 。トランス ウェルインサートは、1%(v/v)酢酸中、ラット尾部コラーゲンとエタノールを等 量の25μLでコラーゲンコーティングし、37℃で一晩インキュベートし、半透 過性膜のコーティングを確実にした。コラーゲンが乾燥したら、Caco-2を5×105 cells/mLで播種した。Caco-2は、単層膜の経上皮抵抗が少なくとも300 Ohm/cm3に達するまで、5%(v/v)CO2、37℃で維持した。B. fragilis、E. faecalis、L. lactis(LysSEN)またはL. lactis(LysRES)由来のFITC-ペプチドグリカン(175μg/mL)を、分化したCaco-2細胞の単層で覆われた先端トランスウェルリザーバーに接種し、2時間後に基底リザーバーの蛍光シグナルを測定した。ペプチドグリカンの標識製剤は、接種前にリゾチーム(100μg/mL)で一晩処理した。肺胞マクロファージとクッパー細胞は、既述の方法で単離した。85,92 殺菌アッセイは、MOI 1:10で85と同様に行った。細菌の生存率はマクロファージと3時間インキュベートした後に測定し、細菌の生存率はアッセイにおける最初の細菌数に対する相対値で表した。
サイトカインと酵素の定量
サイトカインレベルは、TNF、IL-6、GM-CSF、IL-17A、IL-12/IL-23 p40、IL-17F、IL-1β、IL-3、IL-1α、IL-1β、IL-23(すべてBiolegend)、M-CSF、G-CSF、IL-34(すべてBio-Techne)、IL-36γ(Aviva Systems Biology)、IL-18(Abcam)、およびIL-36β(Invitrogen)のELISAキットを用いて測定した(主要リソース表を参照)。全身組織への好中球流入のマーカーとしてのMPOレベル(Abcam)、および臓器損傷のマーカーとしてのアラニントランスアミナーゼ(ALT)レベル(Caymen Chemical)を測定するための比色酵素アッセイは、主要リソース表を参照のこと。
定量化と統計解析
統計とデータ解析
2群間の差を比較するために、Studentのt検定またはMann-Whitney検定を適宜使用した(いずれも両側検定)。多重比較には、一元配置分散分析または二元配置分散分析(post-hoc Sidakの検定)、あるいはKruskal-Wallis検定とDunnの多重比較検定を適宜用いた。相関はSpearmanの検定またはPearsonの検定を用い、多重比較はBenjamini-HochbergのFalse Discovery Rate法を用いて5%で補正した。耐容反応規範の勾配の差を評価するためにANCOVAを用いた。エラーバーはすべて標準偏差を示す。分析されたすべてのデータは、最低3つの生物学的複製からのものであり、すべての複製からのデータが統計分析に含まれ、除外されたデータはなかった。統計的比較は、SPSSバージョン26(IBM)を用いて行ったANCOVAを除き、Prism9.3.1(GraphPad Software, Inc)を用いて行った。動物は実験前に無作為に群(ケージ)に割り付けた。可能な限り、公表されている研究および我々の予備実験から得られた検出力分析を用いて、我々の実験で使用した群に最低限必要なサンプルサイズを決定した。
謝辞
この研究は、Wellcome TrustとRoyal Societyの共同助成によるSir Henry Dale Fellowship (107660/Z/15Z)、MRC (MC_PC_17162)とUKRI (MR/X502959/1)の助成を受けた。T.B.C.とC.K.I.J.はインペリアル・カレッジ・ロンドンのPhD学生研究費、R.L.B.とM.L.Y.L.はMRCの学生研究費(MR/J006874/1とMR/P028225/1)の支援を受けた。A.M.E.はNIHR Imperial BRCの支援を受けた。イラストはBioRender.comで作成した。
著者の貢献
T.B.C.は本研究を発案し、C.K.I.J.、R.L.B.、M.L.Y.L.、R.P.S.およびT.B.C.は実験を行い、A.M.E.は重要なリソースを提供し、T.B.C.およびC.K.I.J.はデータを解析し、T.B.C.は原稿を執筆した。
利害関係
著者らは、競合する利益はないと宣言している。
補足情報
すべての補足ファイルをダウンロードする
これは何?
ダウンロード: Acrobat PDFファイルのダウンロード (383KB)
ドキュメントS1。表S1、S2、図S1-S6。
ダウンロード アクロバットPDFファイルのダウンロード(5MB)
資料S2。論文と補足情報。
データとコード
本論文で報告されたすべてのデータは、要求があればリードコンタクトが共有する。
本論文ではオリジナルのコードは報告しない。
本論文で報告されたデータを再分析するために必要な情報は、要求があれば主担当者から入手可能である。
参考文献
1
M. McFall-Ngai, M.G. Hadfield, T.C. Bosch, H.V. Carey, T. Domazet-Lošo, A.E. Douglas, N. Dubilier, G. Eberl, T. Fukami, S.F. Gilbert, et al.
細菌の世界における動物、生命科学への新たな要請
Proc. Natl. Acad. USA., 110 (2013), pp.3229-3236, 10.1073/pnas.1218525110
スコープで見るGoogle Scholar
2
I. チョー、M.J.ブレイザー
ヒトマイクロバイオーム:健康と病気の接点で
Nat. Rev. Genet., 13 (2012), 260-270頁, 10.1038/nrg3182
Scopusで見るGoogle Scholar
3
G.P.ドナルドソン、S.M.リー、S.K.マズマニアン
細菌叢の腸内生物地理学
Nat. Rev. Microbiol., 14 (2016), pp.20-32, 10.1038/nrmicro3552
グーグル・スカラー
4
F. ゾンマー、F. ベッケド
腸内細菌叢--宿主の発生と生理のマスター
Nat. Rev. Microbiol., 11 (2013), 227-238頁, 10.1038/nrmicro2974
スコープで見るGoogle Scholar
5
V. トレマローリ、F. ベッケド
腸内細菌叢と宿主代謝の機能的相互作用
Nature, 489 (2012), 242-249頁, 10.1038/nature11552
Scopusで見るGoogle Scholar
6
L.H.モライス、H.L.t.シュライバー、S.K.マズマニアン
行動と脳疾患における腸内細菌叢-脳軸
Nat. Rev. Microbiol., 19 (2021), 241-255頁, 10.1038/s41579-020-00460-0
Scopusで見るGoogle Scholar
7
R.L.ブラウン、T.B.クラーク
微生物叢による感染に対する宿主防御の制御
Immunology, 150 (2017), pp.1-6, 10.1111/imm.12634
スコープで見るGoogle Scholar
8
R.B.S.パンワー、R.P.セケイラ、T.B.クラーク
微生物叢を介した抗生物質耐性病原体からの防御
Genes Immun., 22 (2021), 255-267頁, 10.1038/s41435-021-00129-5
スコープで見るGoogle Scholar
9
S.C.ガナル・ヴォナルバーグ、M.W.ホルネフ、A.J.マクファーソン
哺乳類の初期生活における微生物-宿主分子交換とその機能的帰結
サイエンス, 368 (2020), 604-607頁, 10.1126/science.aba0478
スコープで見るGoogle Scholar
10
L.V.フーパー、D.R.リットマン、A.J.マクファーソン
微生物叢と免疫系の相互作用
Science, 336 (2012), 1268-1273頁, 10.1126/science.1223490
スコープで見るGoogle Scholar
11
K. 本田、D.R.リットマン
感染症および炎症におけるマイクロバイオーム
Annu. Rev. Immunol., 30 (2012), 759-795頁, 10.1146/annurev-immunol-020711-074937
スコープで見るGoogle Scholar
12
T.B.クラーク
全身性自然免疫の微生物プログラミングと感染抵抗性
PLoS Pathog., 10 (2014), Article e1004506, 10.1371/journal.ppat.1004506
Google Scholar
13
B.D.ニーダム、R.カドゥラー・ダウク、S.K.マズマニアン
行動および神経変性疾患における腸内微生物分子
Nat. Rev. Neurosci., 21 (2020), 717-731頁, 10.1038/s41583-020-00381-0
スコープで見るGoogle Scholar
14
D. Erny, A.L. Hrabě de Angelis, D. Jaitin, P. Wieghofer, O. Staszewski, E. David, H. Keren-Shaul, T. Mahlakoiv, K. Jakobshagen, T. Buch, et al.
宿主微生物叢は、中枢神経系におけるミクログリアの成熟と機能を絶えず制御している
Nat. Neurosci., 18 (2015), 965-977頁, 10.1038/nn.4030
スコープで見るGoogle Scholar
15
T.B.クラーク、K.M.デイビス、E.S.リセンコ、A.Y.周、Y.ユー、J.N.ワイザー
Nod1による微生物叢からのペプチドグリカンの認識は、全身の自然免疫を増強する。
Nat. Med., 16 (2010), 228-231頁, 10.1038/nm.2087
スコープで見るGoogle Scholar
16
H.S. Deshmukh、Y. Liu、O.R. Menkiti、J. Mei、N. Dai、C.E. O'Leary、P.M. Oliver、J.K. Kolls、J.N. Weiser、G.S. Worthen
微生物叢は新生児マウスにおける好中球ホメオスタシスと大腸菌K1敗血症に対する宿主抵抗性を制御する
Nat. Med., 20 (2014), pp.524-530, 10.1038/nm.3542
スコープで見るGoogle Scholar
17
C.B.ハーゴット、A.M.ロッシュ、玉代英紀、T.B.クラーク、A.G.ベイリー、A.ラフリン、F.D.ブッシュマン、J.N.ワイザー
腸内細菌叢由来のペプチドグリカンは、恒常性において循環食細胞の寿命を支配する
Blood, 127 (2016), 2460-2471頁, 10.1182/blood-2015-10-675173
PDFで記事を見るScopusで記事を見るGoogle Scholar
18
A.J.マクファーソン、M.ハイケンワルダー、S.C.ガナル・ヴォナルバーグ
宿主と微生物の相互作用の結節点にある肝臓
細胞宿主微生物, 20 (2016), 561-571頁, 10.1016/j.chom.2016.10.016
PDFで記事を見るScopusで記事を見るGoogle Scholar
19
J.C. Leinwand, B. Paul, R. Chen, F. Xu, M.A. Sierra, M.M. Paluru, S. Nanduri, C.G. Alcantara, S.A. Shadaloey, F. Yang, et al.
肝内微生物はNKT細胞をプログラムすることにより肝免疫を支配する
J. Clin. Invest., 132 (2022), Article e151725, 10.1172/JCI151725
スコープで見るGoogle Scholar
20
R.K. Mandal、J.E. Denny、R. Namazzi、R.O. Opoka、D. Datta、C.C. John、N.W. Schmidt
原虫感染時の腸内細菌による脾臓胚中心反応の動的調節
Cell Rep., 35 (2021), Article 109094, 10.1016/j.celrep.2021.109094
PDFで記事を見るScopusで記事を見るGoogle Scholar
21
P. コリペトリ、リュー、L.M.コックス、藤原正彦、ラヘヤ、ギッツァ、ソン、ダーツェラー、ウィロック、ワイナー、H.L.ワイナー
腸内微生物産物による脾単球ホメオスタシスと機能の制御
iScience, 24 (2021), Article 102356, 10.1016/j.isci.2021.102356
PDFで記事を見るScopusで記事を見るGoogle Scholar
22
R.M.トーマス、C.ジョバン
膵臓の健康と疾患における微生物叢:マイクロバイオーム研究の次のフロンティア
Nat. Rev. Gastroenterol. Hepatol., 17 (2020), 53-64頁, 10.1038/s41575-019-0242-7
Scopusで見るGoogle Scholar
23
J. Sun、L. Furio、R. Mecheri、A.M. van der Does、E. Lundeberg、L. Saveanu、Y. Chen、P. van Endert、B. Agerberth、J. Diana
膵β細胞は、腸内細菌叢の影響下で発現する免疫調節抗菌ペプチドを介して自己免疫性糖尿病を制限する
Immunity, 43 (2015), 304-317頁, 10.1016/j.immuni.2015.07.013
PDFで記事を見るScopusで記事を見るGoogle Scholar
24
A.O.マン、B.S.ハンナ、A.R.ムニョス-ロハス、I.サンドロック、I.プリンツ、C.ベノイスト、D.マティス
IL-17A産生γδT細胞は微生物叢依存的に筋再生を促進する
J. Exp. Med., 219 (2022), Article e20211504, 10.1084/jem.20211504
スコープで見るGoogle Scholar
25
T.W.H. Tang, H.C. Chen, C.Y. Chen, C.Y.T. Yen, C.J. Lin, R.P. Prajnamitra, L.L. Chen, S.C. Ruan, J.H. Lin, P.J. Lin, et al.
腸内細菌叢の喪失は免疫系の構成を変化させ、梗塞後の心臓修復を不具にする
Circulation, 139 (2019), 647-659頁, 10.1161/CIRCULATIONAHA.118.035235
Scopusで見るGoogle Scholar
26
D.F. Zegarra-Ruiz、D.V. Kim、K. Norwood、M. Kim、W.H. Wu、F.B. Saldana-Morales、A.A. Hill、S. Majumdar、S. Orozco、R. Bell、他。
腸内細菌特異的T細胞の胸腺発生
Nature, 594 (2021), 413-417頁, 10.1038/s41586-021-03531-1
スコープで見るGoogle Scholar
27
R.L.ブラウン、R.P.セケイラ、T.B.クラーク
微生物叢はGM-CSFシグナルを介して呼吸器感染から身を守る
Nat. Commun., 8 (2017), Article 1512, 10.1038/s41467-017-01803-x
Scopusで見るGoogle Scholar
28
A. Trompette、E.S. Gollwitzer、C. Pattaroni、I.C. Lopez-Mejia、E. Riva、J. Pernot、N. Ubags、L. Fajas、L.P. Nicod、B.J. Marsland
食物繊維は、Ly6c-パトロール単球の造血とCD8+T細胞の代謝を形成することにより、インフルエンザからの保護をもたらす
Immunity, 48 (2018), 992-1005.e8頁, 10.1016/j.immuni.2018.04.022
PDFで記事を見るScopusで記事を見るGoogle Scholar
29
Y. ベルカイド、T.W.ハンド
免疫と炎症における微生物叢の役割
Cell, 157 (2014), pp.121-141, 10.1016/j.cell.2014.03.011
PDFを見る記事を見るScopusで見るGoogle Scholarで見る
30
Y. ベルカイド、O.J.ハリソン
恒常性免疫と微生物叢
Immunity, 46 (2017), pp.562-576, 10.1016/j.immuni.2017.04.008
PDFで記事を見るScopusで記事を見るGoogle Scholar
31
Y. 内村、T. Fuhrer、H. Li、M.A. Lawson、M. Zimmermann、B. Yilmaz、J. Zindel、F. Ronchi、M. Sorribas、S. Hapfelmeier、他。
抗体は微生物代謝物の侵入とその結果としての哺乳類宿主応答を制限する境界を設定する
Immunity, 49 (2018), pp.545-559.e5, 10.1016/j.immuni.2018.08.004
PDFで記事を見るScopusで記事を見るGoogle Scholar
32
G.シャロン、N.ガルグ、J.デベリウス、R.ナイト、P.C.ドーレスタイン、S.K.マズマニアン
健康と疾患におけるマイクロバイオームからの特殊な代謝産物
Cell Metab., 20 (2014), 719-730頁, 10.1016/j.cmet.2014.10.016
PDFで記事を見るScopusで記事を見るGoogle Scholar
33
M.S. Ladinsky, L.P. Araujo, X. Zhang, J. Veltri, M. Galan-Diez, S. Soualhi, C. Lee, K. Irie, E.Y. Pinker, S. Narushima, et al.
腸管上皮細胞による常在抗原エンドサイトーシスが粘膜T細胞のホメオスタシスを制御する
Science, 363 (2019), Article eaat4042, 10.1126/science.aat4042
スコープで見るGoogle Scholar
34
Q. Zhang、Y. Pan、R. Yan、B. Zeng、H. Wang、X. Zhang、W. Li、H. Wei、Z. Liu
常在細菌は選択的なカーゴソーティングを行い、共生を促進する
Nat. Immunol., 16 (2015), 918-926頁, 10.1038/ni.3233
スコープで見るGoogle Scholar
35
M.J.モロイ、N.ブーラドゥー、Y.ベルカイド
腸内細菌叢:局所的・全身的免疫応答の形成
Semin. Immunol., 24 (2012), pp.58-66, 10.1016/j.smim.2011.11.008
PDFで記事を見るScopusで記事を見るGoogle Scholar
36
J.M.ブランダー、L.E.サンダー
パターン認識を超えて:微生物の脅威を拡大する5つの免疫チェックポイント
Nat. Rev. Immunol., 12 (2012), 215-225頁, 10.1038/nri3167
スコープで見るGoogle Scholar
37
R. センダー、R. ミロ
人体における細胞交替の分布
Nat. Med., 27 (2021), 45-48頁, 10.1038/s41591-020-01182-9
Scopusで見るGoogle Scholar
38
D. アーレント
動物における細胞型の進化:分子研究から見えてきた原則
Nat. Rev. Genet., 9 (2008), 868-882頁, 10.1038/nrg2416
Scopusで見るGoogle Scholar
39
L.V.フーパー、A.J.マクファーソン
腸内細菌叢との恒常性を維持する免疫適応
Nat. Rev. Immunol., 10 (2010), 159-169頁, 10.1038/nri2710
スコープで見るGoogle Scholar
40
E. Slack, S. Hapfelmeier, B. Stecher, Y. Velykoredko, M. Stoel, M.A. Lawson, M.B. Geuking, B. Beutler, T.F. Tedder, W.D. Hardt, et al.
自然免疫と適応免疫は柔軟に協調し、宿主と微生物叢の相互作用を維持する
Science, 325 (2009), 617-620頁, 10.1126/science.1172747
スコープで見るGoogle Scholar
41
S. ゴルジファード、R.S.ゴールズミド
腸を超えた微生物叢とミエロイド細胞のクロストーク
J. Leukoc. Biol., 100 (2016), pp.865-879, 10.1189/jlb.3RI0516-222R
スコープで見るGoogle Scholar
42
I. Lelios, D. Cansever, S.G. Utz, W. Mildenberger, S.A. Stifter, M. Greter
健康と疾患におけるIL-34の新たな役割
J. Exp. Med., 217 (2020), Article e20190290, 10.1084/jem.20190290
スコープで見るGoogle Scholar
43
R.P.セケイラ、J.A.K.マクドナルド、J.R.マルケージ、T.B.クラーク
常在細菌はIL-36シグナルを介して肺炎桿菌のコロニー形成と感染を防ぐ
Nat. Microbiol., 5 (2020), 304-313頁, 10.1038/s41564-019-0640-1
スコープで見るGoogle Scholar
44
H. チュー、S.K.マズマニアン
自然免疫による微生物叢の認識は宿主と微生物の共生を促進する
Nat. Immunol., 14 (2013), 668-675頁, 10.1038/ni.2635
スコープで見るGoogle Scholar
45
T. 一戸、I.K.パン、熊本雄大、D.R.ピーパー、J.H.ホー、T.S.マーレイ、岩崎明彦
微生物叢は気道インフルエンザAウイルス感染に対する免疫防御を制御する
Proc. Natl. Acad. Sci. USA., 108 (2011), pp.5354-5359, 10.1073/pnas.1019378108
スコープで見るGoogle Scholar
46
M.L. Balmer, C.M. Schürch, Y. Saito, M.B. Geuking, H. Li, M. Cuenca, L.V. Kovtonyuk, K.D. McCoy, S. Hapfelmeier, A.F. Ochsenbein, et al.
微生物叢由来化合物はMyD88/TICAMシグナルを介して定常状態の顆粒球増加を促進する
J. Immunol., 193 (2014), 5273-5283頁, 10.4049/jimmunol.1400762
スコープで見るGoogle Scholar
47
N. Taib、D. Megrian、J. Witwinowski、P. Adam、D. Poppleton、G. Borrel、C. Beloin、S. Gribaldo
ファーミキューテス類のゲノムワイド解析から、真皮と単胚葉の移行が明らかになった。
Nat. Ecol. Evol., 4 (2020), 1661-1672頁, 10.1038/s41559-020-01299-7
スコープで見るGoogle Scholar
48
W. フォルマー
細菌ペプチドグリカンの糖鎖における構造変異
FEMS Microbiol. Rev., 32 (2008), pp. 287-306, 10.1111/j.1574-6976.2007.00088.x
スコープで見るGoogle Scholar
49
D. Nakimbugwe, B. Masschalck, D. Deckers, L. Callewaert, A. Aertsen, C.W. Michiels
6種類のリゾチームの細胞壁基質特異性と細菌抽出物のリゾチーム阻害活性
FEMS Microbiol. Lett., 259 (2006), pp. 41-46, 10.1111/j.1574-6968.2006.00240.x
スコープで見るGoogle Scholar
50
A. Solopova, C. Formosa-Dague, P. Courtin, S. Furlan, P. Veiga, C. Péchoux, J. Armalyte, M. Sadauskas, J. Kok, P. Hols, et al.
ラクトコッカス・ラクティスにおけるヌクレオチド代謝による細胞壁可塑性の制御
J. Biol. Chem., 291 (2016), 11323-11336頁, 10.1074/jbc.M116.714303
PDFで記事を見るScopusで記事を見るGoogle Scholar
51
P. Veiga, C. Bulbarela-Sampieri, S. Furlan, A. Maisons, M.P. Chapot-Chartier, M. Erkelenz, P. Mervelet, P. Noirot, D. Frees, O.P. Kuipers, et al.
ラクトコッカス・ラクティスのペプチドグリカンの加水分解に対するO-アセチル化依存的耐性を制御するSpxB
J. Biol. Chem., 282 (2007), 19342-19354頁, 10.1074/jbc.M611308200
PDFで記事を見るScopusで記事を見るGoogle Scholar
52
R. マルティンス、A.R.カルロス、F.ブラザ、J.A.トンプソン、P.バストス-アマドール、S.ラモス、M.P.ソアレス
免疫の固有要素としての疾病耐性
Annu. Rev. Immunol., 37 (2019), 405-437頁, 10.1146/annurev-immunol-042718-041739
Scopusで見るGoogle Scholar
53
R. メジトフ、D.S.シュナイダー、M.P.ソアレス
防御戦略としての耐病性
Science, 335 (2012), pp.936-941, 10.1126/science.1214935
スコープで見るGoogle Scholar
54
J.S.エアーズ、D.S.シュナイダー
感染症の耐性
Annu. Rev. Immunol., 30 (2012), 271-294頁, 10.1146/annurev-immunol-020711-075030
スコープで見るGoogle Scholar
55
L. ローベリ、A.L.グラハム、A.F.リード
健康の分解:動物の寄生虫に対する耐性と抵抗性
Philos. Trans. R. Soc. B Biol. Sci., 364 (2009), pp.37-49, 10.1098/rstb.2008.0184
スコープで見るGoogle Scholar
56
L. Råberg, D. Sim, A.F. Read
動物の感染症に対する抵抗性と耐性の遺伝的変異の分離
Science, 318 (2007), pp.812-814, 10.1126/science.1148526
スコープで見るGoogle Scholar
57
J. ムニョス-ガルシア、D.コショノー、S.テレチャ、E.モラントン、D.ラノエ、R.ブリオン、F.レゾー、M.F.ヘイマン、D.ヘイマン
双子のサイトカイン、インターロイキン-34とCSF-1:マクロファージのホメオスタシスの優れた伝導体
Theranostics, 11 (2021), 1568-1593頁, 10.7150/thno.50683
スコープで見るGoogle Scholar
58
Z. Zhao、G. Pan、C. Tang、Z. Li、D. Zheng、X. Wei、Z. Wu
IL-34はクッパー細胞M2分極を誘導することにより、ラット肝移植の急性拒絶反応を抑制する
Transplantation, 102 (2018), pp.e265-e274, 10.1097/TP.000000002194
スコープで見るGoogle Scholar
59
T. ヴァイヒハルト、M.ヘングシュトラーガー、M.リンケ
mTORによる自然免疫細胞機能の制御
Nat. Rev. Immunol., 15 (2015), 599-614頁, 10.1038/nri3901
スコープで見るGoogle Scholar
60
J.H.リー、P.フェラン、M.シン、B.C.オー、X.ハン、S.S.イム、T.F.オズボーン
SREBP-1a刺激による脂質合成は、TLR4によるmTORC1下流のマクロファージ貪食に必要である。
Proc. Natl. Acad. Sci. USA., 115 (2018), pp. E12228-E12234, 10.1073/pnas.1813458115
Scopusで見るGoogle Scholar
61
D.C. Roopenian、B.E. Low、G.J. Christianson、G. Proetzel、T.J. Sproule、M.V. Wiles
ヒトアルブミンの代謝およびアルブミンベースの薬剤の薬物動態を研究するためのアルブミン欠損マウスモデル
MAbs (2015), 344-351ページ
CrossRefScopusで見るGoogle Scholarで見る
62
M. ドッカル、D.C.カーター、F.リューカー
ヒト血清アルブミンの3つの組み換えドメイン。構造解析とリガンド結合特性
J. Biol. Chem., 274 (1999), 29303-29310頁, 10.1074/jbc.274.41.29303
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
63
J.S.エアーズ
成功のための微生物の服装:耐性か抵抗性か?
Trends Microbiol., 25 (2017), pp.1-3, 10.1016/j.tim.2016.11.006
PDFを見る記事を見るScopusGoogle Scholarで見る
64
J.F.シェーファー
植物病害に対する耐性
Annu. Rev. Phytopathol., 9 (1971), pp. 235-252, 10.1146/annurev.py.09.090171.001315
Google Scholar
65
E.L.シムズ
反応規範としての耐性の定義
Evol. Ecol., 14 (2000), 563-570頁, 10.1023/A:1010956716539
スコープで見るGoogle Scholar
66
B.J.レアード、D.マクミラン、R.J.E.スキップワース、M.T.ファロン、D.R.パヴァル、I.マクニッシュ、I.J.ギャラガー
癌性悪液質におけるインターロイキン1β(IL-1β)の新たな役割
炎症, 44 (2021), 1223-1228頁, 10.1007/s10753-021-01429-8
スコープで見るGoogle Scholar
67
A.M. Schieber、Y.M. Lee、M.W. Chang、M. Leblanc、B. Collins、M. Downes、R.M. Evans、J.S. Ayres
マイクロバイオーム大腸菌が介在する疾患耐性には、インフラマソームとIGF-1シグナルが関与する
Science, 350 (2015), 558-563頁, 10.1126/science.aac6468
スコープで見るGoogle Scholar
68
M. Fasano、S. Curry、E. Terreno、M. Galliano、G. Fanali、P. Narciso、S. Notari、P. Ascenzi
ヒト血清アルブミンの並外れたリガンド結合特性
IUBMB Life, 57 (2005), 787-796頁, 10.1080/15216540500404093
スコープで見るGoogle Scholar
69
U. Kragh-Hansen
血清アルブミンへのリガンド結合の分子的側面
Pharmacol. Rev., 33 (1981), pp.
スコープで見るGoogle Scholar
70
P. P. Panigrahi, S. Parida, N.C. Nanda, R. Satpathy, L. Pradhan, D.S. Chandel, L. Baccaglini, A. Mohapatra, S.S. Mohapatra, P.R. Misra, et al.
インド農村部における乳児の敗血症予防のためのシンバイオティクス無作為化試験
Nature, 548 (2017), 407-412頁, 10.1038/nature23480
スコープで見るGoogle Scholar
71
S. S. Viaud, F. Saccheri, G. Mignot, T. Yamazaki, R. Daillère, D. Hannani, D.P. Enot, C. Pfirschke, C. Engblom, M.J. Pittet, et al.
腸内細菌叢はシクロホスファミドの抗がん免疫効果を調節する
Science, 342 (2013), 971-976頁, 10.1126/science.1240537
スコープで見るGoogle Scholar
72
H.R.パーキンス
細菌細胞壁の化学構造と生合成
Bacteriol. Rev., 27 (1963), pp.18-55, 10.1128/br.27.1.18-55.1963
スコープで見るGoogle Scholar
73
C.R.レーツ
エンドトキシンの生化学
Annu. Rev. Biochem., 59 (1990), 129-170頁, 10.1146/annurev.bi.59.070190.001021
スコープで見るGoogle Scholar
74
H. 高田秀樹、辻本稔彦、加藤和彦、小谷晋一郎、楠本修一郎、稲毛正明、柴貴志、矢野一彦、河田聡、横川和彦
細菌細胞壁および関連合成化合物によるマクロファージ活性化
Infect. Immun., 25 (1979), 48-53頁, 10.1128/iai.25.1.48-53.1979
スコープで見るGoogle Scholar
75
D.E.スチュワート-タル
細菌ペプチドグリカンの免疫学的活性
Annu. Rev. Microbiol., 34 (1980), 311-340頁, 10.1146/annurev.mi.34.100180.001523
スコープで見るGoogle Scholar
76
L. リュー、C.A.ペアレント
総説シリーズ: TORキナーゼ複合体と細胞遊走
J. Cell Biol., 194 (2011), 815-824頁, 10.1083/jcb.201102090
スコープで見るGoogle Scholar
77
M. アブデルヌール、J.ツァリキス、D.クラインマン、S.E.ジラルダン
抗菌免疫におけるmTORシグナルの新たな役割
Immunol. Cell Biol., 92 (2014), 346-353頁, 10.1038/icb.2014.3
スコープで見るGoogle Scholar
78
M. バグダディ、梅山恭子、濱 直樹、小林崇司、韓 暢、和田博之、清野和人
インターロイキン-34、包括的レビュー
J. Leukoc. Biol., 104 (2018), 931-951頁, 10.1002/JLB.MR1117-457R
スコープで見るGoogle Scholar
79
E. E.マヘ、E.モレロン、S.レシャトン、K.H.サン、R.マンスーリ、M.F.デュカス、M.F.マンザー・ブリュネル、Y.ド・プロスト、H.クライス、C.ボーデマー
シロリムスベースの治療を受けた腎移植患者における皮膚有害事象
Transplantation, 79 (2005), pp.476-482, 10.1097/01.tp.0000151630.25127.3a
スコープで見るGoogle Scholar
80
J.S.ラナ、J.シェイク
シロリムス溶出ステント留置後の血清病様反応
Ann. Allergy Asthma Immunol., 98 (2007), 201-202頁, 10.1016/S1081-1206(10)60699-0
PDFで記事を見るScopusで記事を見るGoogle Scholar
81
M. Molinari、F. Al-Saif、E.A. Ryan、J.R. Lakey、P.A. Senior、B.W. Paty、D.L. Bigam、N.M. Kneteman、A.M. Shapiro
膵島移植患者におけるシロリムス誘発小腸潰瘍:2例の報告
Am. J. Transplant., 5 (2005), pp.2799-2804, 10.1111/j.1600-6143.2005.01082.x
PDFを見る記事を見るScopusで見るGoogle Scholar
82
L. Champion、M. Stern、D. Israël-Biet、M.F. Mamzer-Bruneel、M.N. Peraldi、H. Kreis、R. Porcher、E. Morelon
短信:シロリムス関連肺炎:腎移植レシピエントにおける24症例
Ann. Intern. Med., 144 (2006), 505-509頁, 10.7326/0003-4819-144-7-200604040-00009
スコープで見るGoogle Scholar
83
R.L.ブラウン、M.L.Y.ラーキンソン、T.B.クラーク
腸内感染と炎症を治療するための常在コミュニティの免疫学的デザイン
PLoS Pathog., 17 (2021), Article e1009191, 10.1371/journal.ppat.1009191
スコープで見るGoogle Scholar
84
N.V.ヴァン・ロイエン、A.サンダース
リポソームを介したマクロファージの枯渇:作用機序、リポソームの調製と応用
J. Immunol. Methods, 174 (1994), pp.83-93, 10.1016/0022-1759(94)90012-4
Google Scholar
85
T.B.クラーク
肺の細菌感染に対する初期自然免疫は、nod様受容体リガンドを介して常在細菌叢により全身的に制御される
Infect. Immun., 82 (2014), 4596-4606頁, 10.1128/IAI.02212-14
スコープで見るGoogle Scholar
86
T.B.クラーク、河合文雄、S.Y.パーク、J.R.テーム、C.G.ダウソン、D.I.ローパー
大腸菌ペニシリン結合タンパク質4の基質特異性に関する突然変異解析
生化学, 48 (2009), 2675-2683頁, 10.1021/bi801993x
スコープで見るGoogle Scholar
87
R.P.ダーボー、R.E.ハンコック
緑膿菌(Pseudomonas aeruginosa)およびサルモネラ菌(Salmonella typhimurium)の平滑株および粗面株からリポ多糖を分離する手順
J. Bacteriol., 155 (1983), 831-838頁, 10.1128/jb.155.2.831-838.1983
スコープで見るGoogle Scholar
88
K. Kho, T.C. Meredith
細菌のテイコ酸の抽出と分析
Bio Protoc., 8 (2018), Article e3078, 10.21769/BioProtoc.3078
グーグル スカラー
89
K. Kho, T.C. Meredith
塩類誘発ストレスは黄色ブドウ球菌のリポテイコ酸特異的3成分糖鎖形成システムを刺激する
J. Bacteriol., 200 (2018), Article e00017-18, 10.1128/JB.00017-18
グーグル スカラー
90
C.J. Harding、S.G. Huwiler、H. Somers、C. Lambert、L.J. Ray、R. Till、G. Taylor、P.J. Moynihan、R.E. Sockett、A.L. Lovering
基質特異性を変化させたリゾチームが、ペリプラズム捕食者Bdellovibrio bacteriovorusによる餌細胞退出を促進する
Nat. Commun., 11 (2020), Article 4817, 10.1038/s41467-020-18139-8
Scopusで見るGoogle Scholar
91
T.B.クラーク、N.フランセラ、A.ヒューゲル、J.N.ワイザー
侵入性細菌病原体は、TLRを介したタイトジャンクション成分のダウンレギュレーションを利用して、上皮を通過するトランスロケーションを促進する。
Cell Host Microbe, 9 (2011), 404-414頁, 10.1016/j.chom.2011.04.012
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
92
P.Z.リー、J.Z.リー、M.リー、J.P.ゴン、K.ヘー
マウスクッパー細胞の効率的分離培養法
Immunol. Lett., 158 (2014), 52-56頁, 10.1016/j.imlet.2013.12.002
PDFで記事を見るScopusで記事を見るGoogle Scholar
93
Y. ベンジャミニ、Y. ホッホバーグ
偽発見率のコントロール:多重検定への実用的で強力なアプローチ
J. R. Stat. Soc. B, 57 (1995), pp.289-300, 10.1111/j.2517-6161.1995.tb02031.x
Google Scholar
引用者: (0)
2
リードコンタクト
© 2023 The Author(s). 発行:エルゼビア社
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
Copyright © 2023 Elsevier B.V. or its licensors or contributors. ScienceDirect®はElsevier B.V.の登録商標です。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
