認知のシグナル伝達:腸内細菌叢と視床下部-下垂体-副腎軸
詳細はこちら: PMC免責事項|PMC著作権表示
frontendoのロゴ
Front Endocrinol(ローザンヌ)。2023; 14: 1130689. オンライン公開2023年6月19日。
PMCID: PMC10316519PMID: 37404311
認知のシグナル伝達:腸内細菌叢と視床下部-下垂体-副腎軸
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10316519/






ジョディ・A. Rusch,corresponding author 1 , 2 , * Brian T. Layden, 3 , 4 and Lara R. Dugas 5 , 6
著者情報 論文ノート 著作権およびライセンス情報 PMC免責事項
このページのトップへ
要旨
ヒトの認知機能は、視床下部-下垂体-副腎(HPA)軸を含む複数の身体システム間の複雑な相互作用に依存している。腸内細菌叢は、ヒトの細胞よりもはるかに数が多く、ヒトゲノムを超える遺伝的潜在能力を有しており、この相互作用において重要な役割を果たしている。微生物叢-腸-脳(MGB)軸は、神経、内分泌、免疫、代謝経路を介した双方向のシグナル伝達経路である。ストレスに反応する主要な神経内分泌系のひとつが、ヒトではコルチゾール、げっ歯類ではコルチコステロンなどのグルココルチコイドを産生するHPA軸である。適切な濃度のコルチゾールは、正常な神経発達と機能、および学習や記憶などの認知過程に不可欠であり、微生物が生涯を通じてHPA軸を調節することが研究で示されている。ストレスは、HPA軸やその他の経路を介してMGB軸に大きな影響を与える可能性がある。動物実験により、これらのメカニズムや経路に関する理解が進み、ヒトの健康や疾患に対する微生物叢の影響に関する概念的なパラダイムシフトが起こっている。現在、これらの動物モデルがヒトにどのように反映されるかを明らかにするために、前臨床試験とヒト臨床試験が進行中である。この総説では、腸内細菌叢、HPA軸、認知の関係についての現在の知見を要約し、この広範な分野における主な知見と結論を概観する。
キーワード:微生物叢-腸-脳軸、視床下部-下垂体-副腎軸、ストレス、コルチゾール、グルココルチコイド、認知機能
次へ
1. はじめに
ヒトは、ヒト微生物叢と総称される微生物と長年にわたる親密な関係を生涯にわたって築いており、この微生物叢は、ヒトの健康と疾病に関わる身体システムに影響を与える重要な役割を担っている(1-4)。腸内細菌叢(GM)は、細菌、古細菌、真菌、原虫、ウイルス、寄生虫を含む微生物の複雑で異質な生態系からなり、ヒト微生物叢の重要な構成要素である(5-9)。細菌集団は、微生物叢の中で最も広範に特徴づけられたサブセットである。当初、微生物細胞はヒト細胞を10対1の割合で上回っていると考えられていたが、現在の推定では約1.3対1である(10)。注目すべきことに、ヒト腸内細菌叢(HRGM)は最近、5,414の代表的な原核生物種の232,098の冗長でないゲノムを含むように拡張され、1億300万以上のユニークなタンパク質が含まれるようになった(11)。ヒトのゲノムは基本的に安定しており、宿主の寿命に対して柔軟性に限界があるのに対し、微生物の膨大な遺伝的可能性はダイナミックで、環境に敏感に反応する。このことは、宿主の代謝、免疫、発育、行動において進化的に保存された役割を持つ微生物が、ヒトにとって重要な環境因子であることを示唆している(2, 12-17)。最近では、内分泌や神経の発達と機能における極めて重要な役割が解明され始めている(18, 19)。
新たな証拠によると、迷走神経、神経伝達物質と代謝物の産生、免疫系と血液脳関門の調節、ホルモン代謝などの複数の経路を介して、GM、視床下部-下垂体-副腎(HPA)軸、認知プロセスが双方向に関連していることが示唆されている。食事、抗生物質、その他の要因のいずれによるものであれ、GMの変化は、ストレス反応、HPA軸活性、および全体的な認知の健康に影響を及ぼす可能性がある。本総説は、腸脳軸の重要な構成要素であるHPA軸の調節におけるGMの役割に関する現在の理解を要約することを目的としている。本総説ではさらに、HPA軸への影響と認知への影響に重点を置きながら、GMが腸-脳コミュニケーションを変化させるメカニズムと経路を探る。
次へ
2. 微生物叢-腸-脳軸
MGB軸とは、中枢神経系(CNS)、自律神経系(ANS)、内分泌系、免疫系、そして腸内細菌叢(GM)の間の双方向コミュニケーションネットワークを指す(20-23)。このシステムにより、微生物は脳と情報を共有し、脳は腸とコミュニケーションをとることができる(24, 25)。動物実験やヒトを対象とした研究から、MGB軸におけるGMの役割を支持するデータが数多く得られているにもかかわらず、GMがヒトの脳に影響を与えるメカニズムはまだ完全には解明されていない。知られていることは、主に無菌動物モデルを用いた研究や、特定の微生物種、プロバイオティクス、抗生物質、感染症の影響を調べた研究から得られたものである。さらに、シークエンシングとメタボロミクスの技術的進歩により、科学者たちはこのトピックをより徹底的に探求することができるようになった。
重要な制御因子として、遺伝子組換え体はいくつかの提案されているメカニズムを通して宿主の生理学的プロセスを調節することができる(25, 26)。そのメカニズムには、微生物成分[リポ多糖(LPS)やペプチドグリカン(PG)など](25)、微生物産物[酵素、短鎖脂肪酸(SCFA)、神経伝達物質など](27、28)、ホルモン放出(グルココルチコイドなど)(29)、基質代謝[胆汁酸(BA)やトリプトファンなど](30、31)などがある。腸内では、遺伝子組み換え食品とその代謝物が、腸管透過性(32-35)、粘膜免疫機能(36-38)、腸管運動と感受性(39, 40)、腸神経系(ENS)(21, 24, 25, 41)に対する影響を介して、消化管機能を調節することが示されている。遺伝子組み換え食品は、腸内分泌細胞からのペプチドやホルモンの放出を刺激し、直接的または間接的に中枢に作用することがある(22, 39)。さらに神経内分泌および代謝経路が、GMとCNSを結びつけている(21)。
GMはCNSの発達と機能にとって重要である。動物における研究では、神経支配細胞が宿主の神経発達や神経化学に影響を及ぼし、ストレス系、行動、認知に影響を与えることが実証されている(42-47)。逆に脳は、例えばHPA軸が介在するストレスに対する免疫のグルココルチコイド修飾によって、腸の働きや遺伝子組み換えに影響を与える可能性がある(29)。
2.1. MGB軸におけるHPA軸の役割
HPA軸は、ストレス反応を媒介し、GM、腸、脳の相互作用を調節する上で中心的な役割を果たしている(42)。
機序的には、コルチゾールは複数の経路を通じてMGB軸に影響を与える。コルチゾール受容体は、上皮細胞、免疫細胞、腸内分泌細胞など、腸の様々な細胞に発現しており、コルチゾールが腸の機能に直接作用していることを示している(21、29、48)。コルチゾールはまた、腸管通過時間、腸管透過性、栄養素の利用可能性を変化させることによって腸内細菌叢に影響を与え、その結果、腸内細菌叢の組成と多様性に影響を与える可能性がある(48)。さらに、コルチゾールは、海馬、扁桃体、前頭前皮質など様々な脳部位に存在するグルココルチコイド受容体(GR)に結合することにより、脳に影響を与える可能性がある。また、腸内に生息する微生物が迷走神経やENSの感覚ニューロンを介してCNSのストレス回路を活性化することから、GMとCNS間のシグナル伝達についても証拠がある(21, 49-54)。
慢性的または長期的なストレスは、HPA軸の調節不全を引き起こし、MGB軸を含む様々な身体系に悪影響を及ぼす可能性がある(55)。コルチゾールレベルの上昇は、GM組成の変化や腸透過性の亢進と関連しており、炎症を引き起こし、脳機能障害や様々な中枢神経系障害の一因となる可能性がある(56)。
HPA軸の調節異常の影響は、主に様々なストレス様式を用いて研究されてきた。前臨床研究では、脳の生化学、ストレスに対する反応、痛みの解釈、摂食、情動行動、認知などの脳プロセスの調節に、MGBを介したメカニズムが関与している可能性が高いことが示唆されている(57-64)。MGB相互作用に関する最初の臨床的証拠は、主に、自閉症、不安抑うつ行動、機能性胃腸障害などの中枢神経系疾患とディスバイオシスとの関連から得られている(63, 65-72)。さらに最近の研究では、アルツハイマー病、パーキンソン病、多発性硬化症、統合失調症患者の腸内細菌叢が劇的に変化していることが示されている(73-77)。糞便微生物叢移植(FMT)研究では、無菌動物でこれらの疾患の症状の多くを誘発することで、因果関係を示す証拠が追加された(78)。
2.2. MGB軸の発達とライフコース
出生前の微生物への曝露と胎児の発育に対するその重要性については、論争がある(79, 80)。しかし、微生物の獲得は主に出生時に起こり、産道を通る分娩によって乳児は母親の微生物叢にさらされ、その結果、最初の母親のシグニチャーの垂直伝播が起こる(81)。帝王切開による出産は、初期の微生物組成を変化させる(82)。出生後、母乳育児、栄養、感染症や抗生物質の使用、環境ストレス要因、宿主の遺伝など、いくつかの要因が生後早期の微生物組成に影響を与える(83)。初期の微生物多様性は低いが、食事と環境の関数として急速に拡大し、厳格嫌気性菌の相対的構成比が上昇する(84)。より安定した複雑な、成人に近い微生物叢が、早ければ1~3歳で出現し始めるが、この発達は思春期前まで続くこともある(85, 86)。生後1年間は、細菌叢が環境の影響を受けやすく、宿主の全体的な健康に大きな影響を及ぼす可能性のある、発達の重要な「窓際の時期」である。GMの発達のこの重要な窓は、免疫系、HPA軸、脳の発達など、環境からの入力に対してより敏感で脆弱な他のシステムの発達の重要な窓と一致している。
小児のGMは、ビタミンの生合成や多糖類・異種物質の代謝など、ヒトの発育をサポートする機能を持つ遺伝子を持つ微生物が比較的多いという特徴がある(84)。思春期は、性的発達と成長の激しい時期であり、最近のデータによると、この時期には、ホルモンの急増、ストレス要因、その他の加齢に関連した要因のためと思われるが、GMが徐々に変化することが示されている(87)。成人期には、核となるGMは比較的安定しており、その構成に影響を及ぼす主な因子は、食事、運動、ストレス、疾患、薬物である(88)。中年期の認知機能における腸内細菌の役割を確認するために、Meyerらは597人の中年成人を対象に、腸内細菌群集の組成と認知機能の関係を調査し、β多様性とテストしたすべての高次認知機能との間に有意な正の相関を見出した(89)。
宿主の加齢過程は、GMの連続的な老化進行と類似している(90)。加齢とともに安定性が低下し始め、高齢者では若年者(65歳未満)よりも個人差が大きいことが研究で示唆されている(91, 92)。また、加齢によってGMの多様性レベルが異なるという証拠もあり、存在する異なる細菌種の数が減少し、異なる細菌門の相対的存在量が変化し、ビフィズス菌のような有益な細菌が減少し、プロテオバクテリアのような潜在的に有害な細菌が増加する(93-96)。微生物組成は、ヒトの年代を比較的正確に予測することができる(97)。18〜90歳の健康な4,000人以上のメタゲノミックプロファイルを用いた研究で、著者らは、実年齢から約6歳以内の年齢を予測するアルゴリズムを構築することができた(98)。機能的には、免疫機能の低下とともに、より炎症性の状態への移行が指摘されており、高齢者は感染症やその他の病気にかかりやすくなる(96, 99)。高齢者のGMは、特定の栄養素の代謝効率が低下している可能性があり、これが健康全般に影響を及ぼす可能性がある(92)。これらの変化は、加齢に関連した炎症、酸化ストレス、神経変性に関与している可能性があり、虚弱や認知機能低下といった加齢に関連した健康問題と関連している(92, 100, 101)。
加齢に伴う微生物叢の変化が、認知機能の低下やその他の神経変性疾患に関与している可能性があるという証拠が増えつつある(102, 103)。認知障害を患う高齢者と健常者のGM組成を比較したヒトの研究では、GM組成の著しい変化が示されている。具体的には、炎症性分類群の増加と抗炎症性分類群の減少がみられる(104-109)。
HPA軸はまた、コルチゾールによる負のフィードバックに対する視床下部と下垂体の感受性と反応性の変化、循環コルチゾールのレベルと概日リズムの変化、視床下部におけるCRHとグルココルチコイド受容体の発現と機能の変化など、加齢に関連した変化を受ける、 視床下部、海馬、前頭前皮質におけるCRHおよびグルココルチコイド受容体の発現と機能の変化、扁桃体、海馬、前頭前皮質などストレス調節に関与する脳領域の活性と結合性の変化、微生物叢の変化などが、HPA軸の機能に影響を与え、炎症や酸化ストレスの一因となる可能性がある(110)。基本的に、HPA軸は加齢とともに反応性が低下し、ストレス反応の調節不全や、その結果としての認知機能低下の一因となるようである(111, 112)。
加齢と同様に、腸内細菌異常もコルチゾール分泌の増加、視床下部レベルでのネガティブフィードバックの減少、コルチゾール分泌の概日リズムの変化と関連している(113)。
2.3. 神経発達に対する腸内細菌叢の影響
動物実験から、腸内細菌叢は初期の脳の発達を制御する上で重要な役割を果たしていることが示唆されている(19, 45, 60, 114-117)。生前・生後の重要な時期において、神経発達はMGB軸分子シグナルなどの環境的手がかりの統合に依存している(116)。ニューロンネットワークの成熟は、発達中の神経系が機能的な神経回路を形成するために不可欠である。脳の自然免疫細胞であるミクログリア細胞は、この成熟過程に必要な不必要なシナプス結合の除去に重要な役割を果たしている(118, 119)。GMはミクログリアの発達と成熟に影響を与えるようであり(120, 121)、動物モデルでは神経認知機能の様々な側面に下流の影響があることが証明されている(19, 45, 60, 114, 115)。対照的に、腸内コロニー形成の早期破壊はCNSの変化に関連している(122)。
無菌動物モデルは、神経発達において腸管が果たす役割を理解する上で極めて重要である(123)。無菌動物の神経系は、従来のコロニー形成された動物とは異なる発達を示し、複数の神経伝達系とその受容体において重要な違いを示す(25)。神経新生、海馬と扁桃体の体積、髄鞘形成、前頭前皮質におけるミエリン可塑性関連遺伝子の増加が見られる(25)。樹状突起は長く、スパインは密だが、シナプス結合は少ない。扁桃体では、シナプス可塑性関連遺伝子と神経可塑性関連遺伝子が増加し、神経細胞活性関連遺伝子も増加している(124)。未熟なミクログリアが見られ、免疫系関連遺伝子は減少している。タイトジャンクションタンパク質の発現が減少しているため、血液脳関門(BBB)の透過性が高い。それに応じて、免疫システムの障害、ホルモンシグナルの調節障害、代謝の変化、神経伝達の違いが見られる(25)。最後に、無菌動物実験により、GMは正常なストレス応答性、不安様行動、社交性、認知に必要であることが証明されている(123)。
次へ
3. MGB軸のメカニズムと経路
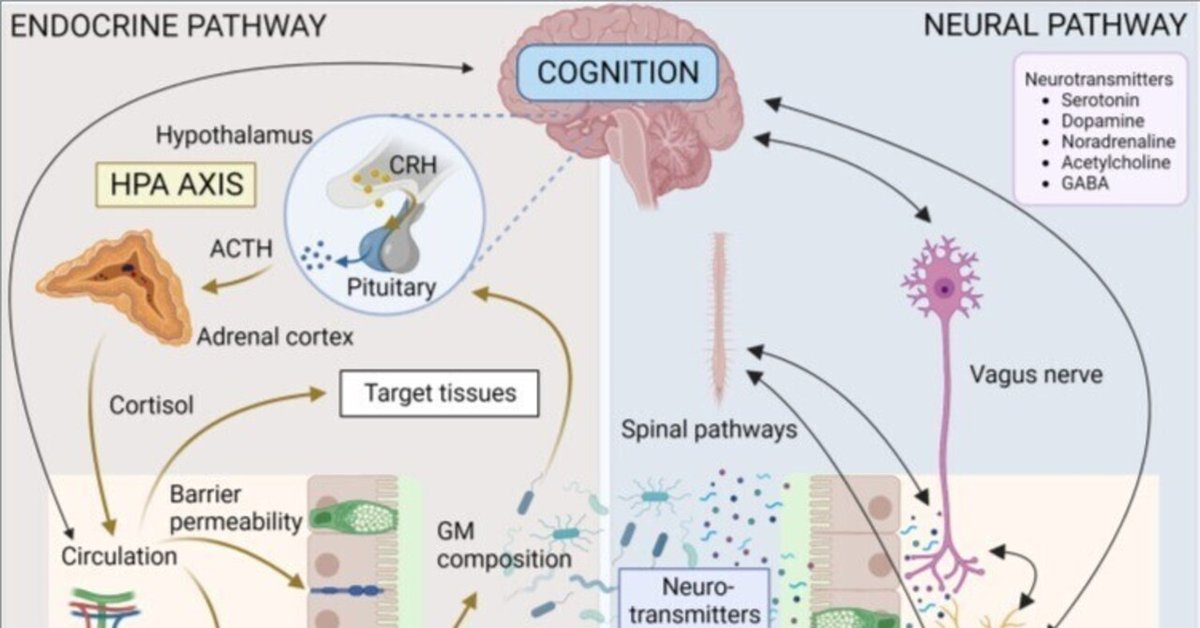
GMと脳のクロストークに関与する正確なメカニズムはまだ完全には解明されていないが、いくつかの推定されるメカニズムと経路がある(125)。微生物は神経系(52)、内分泌系(51, 126)、免疫系(120)を調節し、神経伝達物質(127-129)を合成し、代謝産物(127, 130-132)を産生する能力を介して、中枢神経系のプロセスに影響を与える(図1)。これらの機序と経路を合わせると、肉芽組織と脳の複雑な相互作用が明らかになり、健康と疾患におけるMGB軸を理解することの重要性が浮き彫りになる。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はfendo-14-1130689-g001.jpg。
図1
微生物叢-腸-脳軸の概要。MGB軸の双方向コミュニケーション機構には、内分泌、神経、代謝、免疫系の経路が含まれる。視床下部-下垂体-副腎軸はストレスに反応する主要な神経内分泌系で、視床下部からコルチコトロピン放出ホルモン(CRH)が放出され、それに続いて下垂体からACTHが放出され、さらに副腎皮質からコルチゾールが放出される。コルチゾールは循環を通じて標的組織に到達し、免疫系を調節し、GM組成と腸透過性に影響を与える。コルチゾールは今度はストレス反応に影響を与えることができる(例えば、細菌が移動した後に増加した循環サイトカインに反応してHPA軸が活性化することがある)。様々なGMと腸内分泌細胞の相互作用の結果、循環を介して、局所または脳などの標的組織に作用するホルモンが放出される。迷走神経、腸神経系、脊髄経路は、迅速な神経伝達経路を提供し、神経伝達物質またはその前駆体は、微生物によって産生されたり代謝されたりする。SCFA、BA、eCBなどの代謝産物は、微生物によって産生または修飾され、腸内の特定の細胞受容体と結合することもあれば、循環中に吸収されて標的組織に影響を及ぼすこともある。微生物やその産物は、免疫細胞と相互作用し、下流で炎症促進作用や抗炎症作用をもたらす可能性がある。ACTH、副腎皮質刺激ホルモン;BA、胆汁酸;BCAA、分岐鎖アミノ酸;CCK、コレシストキニン;CRH、コルチコトロピン放出ホルモン;eCB、エンドカンナビノイド;GABA、γ-アミノ酪酸;GLP-1、グルカゴン様ペプチド1;GM、腸内細菌叢;HPA、視床下部-副腎-下垂体;IL、インターロイキン; ILC、自然リンパ球;LPS、リポ多糖;PYY、ペプチドYY;NPY、神経ペプチドY;PAMP、病原体関連分子パターン;PG、ペプチドグリカン;SCFA、短鎖脂肪酸;Th、Tヘルパー細胞;TJPC、タイトジャンクションタンパク質複合体;T reg、制御性T細胞;TNF-α、腫瘍壊死因子α。図はBioRender.comで作成。
3.1. HPA軸、グルココルチコイド、ストレス反応
HPA軸は、ストレスに反応して視床下部室傍核(PVN)のニューロンがコルチコトロピン放出ホルモン(CRH)と抗利尿ホルモン(ADH)を合成・分泌する、体内の主要なストレス反応系である(133)。これらのペプチドは、下垂体前葉の副腎皮質刺激細胞から副腎皮質刺激ホルモン(ACTH)の放出を刺激し、このACTHは副腎皮質の筋膜帯を標的として、ヒトではコルチゾール、げっ歯類ではコルチコステロンなどのグルココルチコイドを産生する(133-135)。コルチゾールは視床下部と下垂体に負のフィードバックループで作用し、反応を調節する(133)。PVNの活動は、交感神経系(SNS)や副交感神経系(PNS)、大脳辺縁系回路など、様々な求心性システムによって調節されている(136)。中枢系と末梢系の相互作用により、ストレスに対する特徴的な行動、内分泌、自律神経、免疫反応が生じる(135, 137)。コルチゾールの放出は、概日性と60~90分の振動の両方で特徴づけられる(138)。ACTHとコルチゾールの正常な24時間プロファイルは、早朝にピークを迎え、1日を通して濃度が低下し、深夜に底を打ち、そして深夜の睡眠中に急激に上昇し、早朝にピークを迎えるというものである(138)。
グルココルチコイドは、代謝、成長、分化、アポトーシスなどの細胞プロセスの制御に不可欠であり、核内受容体スーパーファミリーの細胞内受容体を介して作用する(139)。グルココルチコイドは、ホメオスタシスを維持する臓器系において標的遺伝子の転写を調節し、身体が身体的、心理的ストレスに対処するのを助ける(134, 135)。グルココルチコイドは、免疫や炎症だけでなく、代謝、成長、心血管系機能、水分と電解質のバランス、生殖、気分や認知など、宿主防御に関連するいくつかの過程に関与している(49, 140-148)。
脳はグルココルチコイドの重要な標的臓器であり、その作用は、転写因子として働き、非ゲノム的ステロイド作用を媒介するミネラルコルチコイド受容体(MR)とGRによって媒介される(149)。急性ストレスの初期段階では、MRの活性化が評価過程と記憶の検索に必要であり、GRは記憶の定着と行動の適応を促進する(150)。グルココルチコイドは中枢神経系(CNS)の発達にも重要な役割を果たしており、正常な成熟に必要である(139)。成人期には、神経細胞の可塑性に寄与し、神経変性過程にも関与している。
HPA軸の調節不全は、高コルチゾール血症や低コルチゾール血症、ストレス因子に対する過剰反応や減弱反応、概日リズム異常などを引き起こす(17)。HPA軸の機能不全は、認知機能の低下、老化、免疫系の機能不全、全身性の炎症と関連している(135)。また、HPA軸の機能が変化している人は、心血管疾患、糖尿病、炎症性腸疾患(IBD)などの代謝障害を発症しやすい(142, 151)。うつ病、躁病、不安、神経認知障害などの精神神経症状は、高コルチゾール血症および低コルチゾール血症の両方と関連している(143, 144)。HPA軸の機能不全はまた、自閉症、不安障害、うつ病、統合失調症、その他の認知障害など、多くの主要な精神病理とも関連している(145)。
3.2. 神経系
3.2.1. 自律神経系 ANSは、骨格筋を除く全身の不随意の生理的プロセスを制御し、神経制御を行う(152)。消化管系では、SNSとPNSの両方が、管腔から発生する求心性信号を(腸管、脊髄、迷走神経経路を介して)CNSに伝達し、求心性信号をCNSから腸管構造に伝達する(153)。迷走神経を含むPNSは、胃、腸、膵臓の機能に対して興奮性と抑制性の両方の制御を行う(154)。一方、SNSは、主に胃腸の筋肉と粘膜の分泌を抑制し、神経依存性の血管収縮を介して血流を調節する。ENSは、ANSの3番目で最大の構成要素である。MGB軸の各構成要素は、ANS内で双方向に連絡を取り合う。さらに、HPA軸や神経内分泌シグナリン グと組み合わせることで、ANSは中枢神経系によっ て調節された腸の変化を引き起こすことができる (155)。
3.2.1.1. 腸神経系 ENSは、消化管系の内膜に埋め込まれた2~6億個のニューロンからなる網目状のシステムであり、脳と消化管との間の情報伝達を促進する(53)。ENSには、食物推進、栄養処理、血流調節、免疫防御など、いくつかの機能がある(37, 153, 156)。ENSは、腸管免疫系、内分泌系、そして消化管と協力しながら、ホメオスタシスと安定した腸内微小環境を維持する上で極めて重要である(53)。構造的には、粘膜下神経叢(マイスナー神経叢)と腸管神経叢(アウエルバッハ神経叢)の2つの神経叢に分かれており、一酸化窒素依存性腸管神経細胞とアセチルコリン依存性腸管神経細胞から構成されている(53)。
ENSは、内在性の反射微小回路を備えているため、消化管機能を独立して管理することができる(157, 158)。さらに、ENSは30種類以上の神経伝達物質を産生し、ENSが循環中に放出するホルモンやペプチドは、血液脳関門(BBB)を通過し、迷走神経と相乗的に作用することができる(159)。最近発見された腸内分泌細胞の一種であるニューロポッド細胞は、ENSからのシグナルを感覚ニューロンに伝達することができる(160)。神経伝達物質、シグナル伝達経路、解剖学的特性など、ENSとCNSには多くの共通点があり(53)、ENSが「小さな脳」と呼ばれる所以である(161)。ENSは消化管機能を独立して制御しているが、CNSは迷走神経、胸腰髄、腰仙髄を介して、これらの機能を調節、調整、統合する外因性神経入力を提供している(154)。
GMとENSの相互作用は、過去10年間に大きな注目を集めた。ENS、GM、腸管免疫系および内分泌系の協調的相互作用により、宿主のホメオスタシスが維持されている(53)。GMはENSの発達と機能に直接的、間接的に影響を与える可能性がある。例えば、腸内微生物への早期暴露は、生後のENSの発達と組織化に極めて重要である(53)。無胚葉マウスでは、腸管ニューロンの減少などENSの構造に異常が見られ、それに伴って腸管運動にも障害が見られる(53)。また、固有感覚シグナルの減弱、腸管グリア細胞の腸粘膜への流入不全、神経化学の変化も見られる(114, 162, 163)。
ENSのエンテロクロマフィン細胞は、GMとのコミュニケーションを促進するもう一つの仲介役である(164)。腸クロム親和細胞によるセロトニンの生合成は、GMによって促進、増強され、粘膜や血小板の機能に必要である(164)。GMはまた、セロトニン、γ-アミノ酪酸(GABA)、ヒスタミン、カテコールアミン、アセチルコリンなどの神経伝達物質を産生することができ、ENSの活動にさらに影響を及ぼす(18)。さらに、腸管ニューロンはtoll様受容体(TLR)を発現しており、微生物分子(LPSやPGなど)やウイルスRNAを認識して反応する(54)。
最近の研究では、高度な技術を用いて、腸管ニューロンが環境からの合図を感知し、その情報をCNSに送ることによって、神経プログラムをどのように制御しているかを調べている(165, 166)。例えば、Mullerらによる代表的な研究では、神経細胞追跡技術を用いて、微生物がMGB軸の神経経路を調節していることを示した(165)。特に、腸管運動を制御するアリール炭化水素受容体の活性化を通じて、腸管ニューロンの機能に影響を与えることが示された(166)。
ENSは、腸管ホルモン、神経ペプチド、サイトカインの制御を通じてHPA軸に影響を与え、HPA軸の活性を刺激または抑制することができる(155)。逆に、HPA軸は腸の運動や分泌を変化させ、腸ニューロンやグリア細胞の活性を調節することで、ENSに影響を与えることができる(21)。この双方向コミュニケーションは、ENSとHPA軸が密接に関連し、ストレス反応の調節と恒常性の維持に重要な役割を果たしていることを示唆している。
3.2.1.2. 迷走神経 迷走神経は第10脳神経であり、脳幹の起始部から内臓器官まで伸びている(159)。PNSの重要な構成要素であり、脳と腸をつないで恒常性と認知領域の機能を調節している(21)。迷走神経は求心性ニューロンと求心性ニューロンの両方から構成されており、脳と腸をつなぐ最も速く直接的な経路となっている。炎症、食欲、気分、ストレス反応の調節に重要な役割を果たしていることを裏付ける証拠がある(167)。
迷走神経終末の一部はENSのニューロンにシナプスし、神経脚細胞はグルタミン酸を神経伝達物質として迷走神経求心性神経と高速興奮性シナプスを形成する(78, 168)。このように迷走神経が伝達できる信号の範囲が増えることで、迷走神経のさまざまな機能を発揮する能力が高まる。迷走神経求心性神経は、栄養素、ペプチド、サイトカイン、ホルモン、内毒素など様々な分子を感知する多数の受容体を発現している(78)。これらの感覚的な合図は、脳内の腸管迷走神経求心性神経の主要な投射部位である脳幹の孤束核(NTS)に速やかに伝達される(78)。
そして迷走神経脳幹核は、ストレスや認知に関与する核を含む脳のいくつかの領域に投射する(167)。例えば、迷走神経からの信号を中継する重要なハブである視床下部PVNは、覚醒、不安、抑うつなどのストレス誘発性胃腸反応に関与している(169)。迷走神経の下垂体および腹側被蓋野(VTA)への投射は、それぞれHPA軸および認知を直接調節する手段を提供する。さらに弧状核への迷走神経投射は、胃腸機能の内分泌と行動の側面を統合し、食物摂取と満腹感を調節する(167)。バリントン核は認知行動に同化し、一方、軌跡状核は覚醒と注意を維持し、ストレスと認知入力を統合する。前脳では、扁桃体が情動と嫌悪の入力を学習と記憶と統合する。終末線条体は情動と行動を処理・統合し、HPA軸とストレスに対する自律神経反応を調節する。大脳皮質は情動、感情、記憶を自律神経機能と統合する(167)。
腸は免疫系の重要なコントロールセンターであり、迷走神経は腸、脳、炎症の複雑な関係において免疫調節特性を示す(170)。サイトカインや内毒素に反応して、迷走神経は脳幹に信号を送り、発熱や発病行動、食欲や気分に影響を与える(171-174)。HPA軸は抗炎症反応を調節することで反応する(175-177)。さらに、コリン作動性抗炎症経路は主に迷走神経を介してシグナルを送り、「炎症反射」のエフェクターとして機能し、神経系と免疫系を連動させる(50, 170, 178-182)(図1)。
動物実験では、迷走神経を障害すると、神経新生、ストレス反応性、認知、不安や恐怖に関連した行動に異常が生じることが示されている(183)。一方、迷走神経を刺激すると、記憶が促進され(184、185)、海馬の神経新生が促進され、脳由来神経栄養因子(BDNF)の発現が増加し(186、187)、シナプスの可塑性が高まることがわかっている(188)。BDNFは、神経細胞の成長、発達、生存を促進し、学習、記憶、気分調節に重要な役割を果たす重要な可塑性関連タンパク質である。BDNF発現の変化は、認知機能の障害と関連している(189)。これらの知見は、迷走神経が神経原性および神経栄養性のシグナル伝達を促進することを示唆している。実際、迷走神経刺激は、難治性てんかん、クローン病、難治性うつ病、慢性疼痛などの治療に用いられている(159)。
このセクションでは、迷走神経を通して脳機能を調節するGMの役割に焦点を当てる。動物およびヒトの研究から、迷走神経が迷走神経と脳の間の主要かつ最も直接的なシグナル伝達経路として機能していることが実証されている(60, 78, 115, 190)。迷走神経は、神経活性メディエーターを放出したり、迷走神経が感知する分子の管腔濃度に影響を与えたりすることで、直接的または間接的に迷走神経を活性化することができる(28, 78)。特定の細菌株が迷走神経のシグナル伝達に影響を及ぼし、脳と交信し、認知を変化させることが示されている。例えば、病原体であるCitrobacter rodentiumをマウスに投与すると不安様行動が増加するが、Bifidobacterium longum(NC3001)は迷走神経依存的に抗不安作用を示す(191、192)。同様に、カンピロバクター・ジェジュニ(Campylobacter jejuni)を投与すると、不安関連行動のレベルが上昇し、迷走神経求心性が活性化した(178)。さらに、迷走神経切断により、ヒト乳オリゴ糖の投与によるラットの長期増強、学習、記憶に対するポジティブな効果が阻害されることが示されている(193)。
3.2.2. 神経伝達物質 神経伝達物質は、GMと神経系間の付加的な情報伝達機構を提供する(図2)。微生物は、ドーパミン、ノルアドレナリン、セロトニン、アセチルコリン、ヒスタミン、GABAなど、いくつかの神経伝達物質を合成・代謝する(28)。しかし、これらの神経伝達物質はBBBを通過しないようであり、迷走神経やENSを介して間接的に脳機能を調節している可能性が高い(78)。腸内で合成された神経伝達物質前駆体の中には、循環を介してCNSに到達し、活性トランスポーターを介してBBBを通過できるものもある(194)。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はfendo-14-1130689-g002.jpg。
図2
シグナル伝達メカニズム - 微生物産物、代謝産物、神経伝達物質。腸の細胞は様々な受容体を発現しており、腸管内腔や粘膜からのシグナルを感知し、伝達することができる。シグナル伝達のために、GMはいくつかの微生物産物、eCB、BA、SCFA、神経伝達物質を含む因子を使用する。LPSやPGなどのPAMPsは低分子の微生物モチーフで、TLRによって認識され、このシグナルはMYD88によって細胞内シグナル伝達経路(免疫細胞の活性化など)に伝達される。eCBシステムはCB1とCB2の活性に限定されるものではなく、eCBは他のGPCR、TRPV1、核内受容体PPAR-αとPPAR-γとも相互作用することができる。腸の機能を調節するために、BAsは2つの主要な受容体、TGR5というGPCRと核内受容体FXRと相互作用する。腸内では、SCFAはFFA2、FFA3、GPR109a、Olfr78を活性化するが、トランスポーターや受動拡散を介して細胞内に入り、いくつかの酵素や転写因子の活性を調節したり、細胞のエネルギー源となったりする。少量のSCFAは循環系に取り込まれ、肝臓、膵臓、脳などの標的組織に運ばれる。これらのGM由来分子がそれぞれの受容体と結合すると、細胞内シグナル伝達経路が活性化され、細胞活性や遺伝子発現が変化し、宿主の生理学的プロセスに下流から影響を及ぼす。AhR、アリール炭化水素受容体;AMPK、AMP活性化プロテインキナーゼ;BA、胆汁酸;CB1およびCB2、カンナビノイド受容体タイプ1および2;eCB、エンドカンナビノイド;ENS、腸神経系;FFA2およびFFA3、遊離脂肪酸受容体2および3; FXR、ファルセノイドX受容体;GABA、γ-アミノ酪酸;GLP-1、グルカゴン様ペプチド1;GNG、糖新生;GPR119およびGPR109a、Gタンパク質共役受容体119および109a;HDAC、ヒストン脱アセチル化酵素;LPS、リポ多糖;MCT、モノカルボン酸トランスポーター; MYD88、骨髄分化一次応答88;Olfr78、嗅覚受容体78;PAMP、病原体関連分子パターン;PG、ペプチドグリカン;PPARα/γ、ペルオキシソーム増殖因子活性化受容体α/γ;PRR、パターン認識受容体;PYY、ペプチドYY; SCFA、短鎖脂肪酸;SMCT、ナトリウム依存性モノカルボン酸トランスポーター;TGR5、武田Gタンパク質共役型受容体5;TJPC、タイトジャンクションタンパク質複合体;TLR、toll様受容体;TPRV1、transient receptor potential cation channel subfamily V member 1。図はBioRender.comで作成。
動物実験から、微生物によるこれらの神経伝達物質の調節が宿主の生理機能に影響を与える可能性があることが証明されており、ヒトを対象とした予備的研究では、微生物叢に基づく介入が神経伝達物質濃度を変化させる可能性があることが示されている(28)。無菌マウスの研究では、脳のいくつかの領域において、複数の神経伝達物質系とその受容体に有意な変化があることが示されている(124)。同様に、抗生物質を投与してGMを枯渇させると、腸や血液中の神経伝達物質レベルが変化する可能性がある(195、196)。さらに、微生物量が脳内の神経伝達物質受容体の発現を変化させることが示されている(51、189、191)。したがって、遺伝子組み換え食品が最終的に脳内の神経伝達物質のレベルに影響を与え、脳機能と認知を変化させることを示唆する証拠が増えつつある。
3.2.2.1. トリプトファン代謝 トリプトファンは必須アミノ酸である。微生物による合成についてはよく知られている(197)。腸内では、GMによる直接的または間接的な制御のもとでさらに代謝され、セロトニン、キヌレニン、トリプタミン、インドール化合物など、MGBコミュニケーションに関与するいくつかの化合物が生じる(197, 198)。
トリプトファンはセロトニン合成に必須であるが、生理学的経路の主流はキヌレニン経路である(図3)。キヌレニンは、肝酵素であるトリプトファン-2,3-ジオキシゲナーゼ(TDO)またはユビキタスなインドールアミン-2,3-ジオキシゲナーゼ(IDO)の作用によってトリプトファンから産生される(199)。グルココルチコイドとトリプトファンはTDOを誘導し、サイトカインはIDOを誘導する(200)。キヌレニンはBBBを通過することができ、さらにキヌレン酸かキノリン酸、さらにナイアシンとニコチンアミドアデニンジヌクレオチド(NAD+)に代謝される(197)。キヌレニン経路の最終産物が神経伝達、炎症、免疫に関わる生物学的プロセスの制御に関与していることから(197)、これら2つの代謝産物のバランスは神経の健康と疾患において重要であるように思われる(31)。さらに、キヌレン酸は腸の粘膜保護作用と免疫調節作用を発揮するようである(201)。ストレス応答性TDOまたは免疫応答性IDOの活性化は、セロトニン合成のためのトリプトファンの利用可能性を制限し、神経毒性代謝産物または神経保護代謝産物の下流産生を増加させる可能性がある(31)。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はfendo-14-1130689-g003.jpg。
図3
トリプトファンの代謝。トリプトファンの代謝は、セロトニン経路またはキヌレニン経路を介して行われ、生理活性産物を産生する。セロトニン経路では、トリプトファンはエンテロクロマフィン細胞ではTPH1、ENSやCNSのニューロンではTPH2によって5-HTPに変換される。AAADは、5-HTPをセロトニンに変換し、セロトニンは一連のステップを経て、さらにメラトニンに代謝される。実際、トリプトファンの大部分はキヌレニン経路で利用され、トリプトファンは肝臓のTDO(大部分)、またはIDO(腸、脳、肝臓を含む)を介して至る所でキヌレニンに変換される。キヌレニンは、KAT酵素、キノール酸、さらにNAD+、またはXAによってキヌレン酸に変換される。インドール経路では、腸内微生物がトリプトファンをインドールとインドール誘導体に代謝する。3-HAA、3-ヒドロキシアントラニル酸;3-HK、3-ヒドロキシキヌレニン;5-HIAA、5-ヒドロキシインドール酢酸;5-HT、5-ヒドロキシトリプタミン;5-HTP、5-ヒドロキシトリプトファン; AAAD、芳香族アミノ酸脱炭酸酵素;IA、アンホロサイクリック酸;IAA、インドール-3-酢酸;IAAld、インドール-3-アセトアルデヒド;IAld、インドール-3-アルデヒド; IAM、インドール-3-アセトアミド;IDO、インドールアミン2,3-ジオキシゲナーゼ;ILA、インドール-3-乳酸;IPA、インドール-3-プロピオン酸;IPYA、インドール-3-ピルビン酸;KAT、キヌレニンアミノトランスフェラーゼ;MAO、モノアミンオキシダーゼ;NAD+、ニコチンアミドアデニンジヌクレオチド;TDO、トリプトファン2,3-ジオキシゲナーゼ;XA、キサントウレン酸。図はBioRender.comで作成。
最近の研究では、セリアック病患者において、トリプトファンをアリール炭化水素受容体リガンドに代謝し、腸の炎症を調節するGMの能力の重要性が示された(202)。いくつかの細菌群も、増殖に直接利用したり、トリプトファナーゼの発現を介してトリプトファンレベルに影響を与えることがあり(28, 203, 204)、これらの細菌は自閉症スペクトラム障害を含む神経精神疾患の発症に関連している(205)。GMがトリプトファンとキヌレニン経路を調節し、CNSレベルでの認知に影響を及ぼす可能性のある体液性経路であることを示唆する証拠が増えている(206-210)。
3.2.2.2. セロトニン セロトニンは、認知、概日リズム、侵害受容、血液凝固、心血管ホメオスタシス、消化管分泌および蠕動など、多面的な生理学的プロセスを制御している(211)。セロトニンの作用は、セロトニンGタンパク質共役受容体(GPCR)ファミリーによって媒介される(212)。セロトニンは、中枢と末梢の両方で制御を行う。セロトニンの大部分はCNSの外に存在し、90-95%は腸に存在し、そのほとんどがエンテロクロマフィン細胞内にある(213, 214)。
セロトニン作動性ニューロンは神経内分泌機能に大きな影響を及ぼし、セロトニン作動性系とHPA軸の間には、ダイナミックな相互作用と広範なクロストークが存在する(215)。セロトニンは、標的細胞や受容体のタイプによっ て、ストレス反応全体に複雑な影響を及ぼす(216)。セロトニンは、視床下部PVNのセロトニン2C受容体の活性化を介して、上流のCRHシグナル伝達系を制御する(217)。HPA軸の活性化を伴う妊娠前や早期のストレスは、セロトニン作動性システムの変化と関連しており、脳の発達や認知の阻害につながっている(218-220)。実際、MGB軸内のセロトニン作動性システムの発達は、ストレスの少ない環境に依存しており、早期のライフイベントが重要である可能性がある。
生殖細胞はさらに、トリプトファン水酸化酵素の発現を介してセロトニンを産生するように腸クロム親和細胞にシグナルを送ることによって、またセロトニン産生に影響を与えうるSCFAsとBAsのレベルを変化させることによって、セロトニンの利用可能性を調節することができる(46, 164, 221-223)。無菌マウスでは、大腸セロトニン産生が減少し、血中濃度が低下しているが、これは微生物のコロニー形成によって正常化する(164, 223)。さらに、オスの無菌マウスは海馬のセロトニンレベルが上昇しており、離乳直後のコロニー形成ではこのレベルは元に戻らない(124)。ラットにB. infantisを投与すると、前頭皮質の5-HIAA(セロトニン代謝産物)濃度が低下し、トリプトファンとキヌレン酸の血中濃度が著しく上昇する(224)。このように、GMは間接的にセロトニン作動系の活性に影響を及ぼし、その結果、HPA軸とストレス反応に影響を及ぼす可能性がある。
3.2.2.3. カテコールアミン ドーパミンやノルアドレナリンなどのカテコールアミンは、認知、気分、腸の運動性と完全性など、さまざまな身体機能を調節している(225)。ドーパミンは報酬動機づけ行動における主要な神経伝達物質であり、ノルアドレナリンやアドレナリンのような他のカテコールアミンの前駆体である。ノルアドレナリンは、覚醒、覚醒状態、感覚信号の検出、行動、認知、急性ストレス反応に関与している(226)。脳幹のカテコールアミン作動性中枢がHPA軸の制御に重要な役割を果たしていることはよく知られており(227)、ノルアドレナリン作動性ニューロンは、様々なストレス因子に反応して正常に活性化するのに必要である。ノルアドレナリンは、急性ストレスで交感神経系が活性化する際に腸壁内で放出され、腸管運動や経上皮イオン輸送の調節など、腸粘膜で多様な作用を示す(228)。
GMはまた、カテコールアミンを合成し、それに応答する。例えば、細菌はクオラムセンシング分子としてノルアドレナリンを産生し、ノルアドレナリンとアドレナリンは病原体の発生と増殖を促進する(229, 230)。無菌マウスでは、糞便内腔と組織中のノルアドレナリンが減少しているが、これはコロニー形成によって回復する(231)。さらに、脳内のドーパミン、ノルアドレナリン、セロトニンのターンオーバー率が上昇している(124)。
3.2.2.4. γ-アミノ酪酸 γ-アミノ酪酸(GABA)は、脳内のGABA作動性ニューロンによってグルタミン酸から合成される抑制性神経伝達物質である。GABAは様々な生理的プロセスを調節し、海馬の神経細胞シグナル伝達を調節・同期させることにより、認知において中心的な役割を果たしていることが示されている(232)。HPA軸もまたCRHレベルのGABA作動性シグナルによって制御されており、PVNの全シナプスの50%近くがGABA作動性である(233)。CRHニューロンは複数の神経伝達系が関与する多くの異なる脳領域からの情報を統合しているが、CRHニューロンの活性は最終的にはGABAA受容体を介するGABA作動性抑制によって調節されている(234)。HPA軸はGABAの産生とシグナル伝達にも影響を及ぼす。GABA作動性プロファイルの変化は、認知症やうつ病などの認知機能障害を伴う複数の疾患と関連している。
GMはGABAを代謝することができ、最近の研究では、ある種の微生物が増殖に必要なGABAを産生することが示されている(235)。さらに、GMの組成の変化は、GABA受容体の発現や脳内のGABAレベルの変化と関連している(191)。無菌動物では便中および血液中のGABA濃度が低下しているが、糞便中のGABA濃度は抗生物質で変化させることができる。驚くべきことに、健康な女性を対象とした研究では、GABAの主要な産生微生物として同定されたバクテロイデスの濃度が、脳の小脳、海馬、前頭部の灰白質の増加、不安、苦痛、過敏性のレベルの低下と関連していた(236)。GABAはBBBを通過しないため、微生物由来のGABAがCNSに影響を及ぼすには、ENSや迷走神経に局所的に作用する必要がある。しかし、酢酸などのSCFAはBBBを通過し、GABAの代謝サイクルに組み込まれる可能性がある(237)。
3.2.3. エンドカンナビノイド系 エンドカンナビノイド系(ECS)は、全身に存在する複雑なシグナル伝達系である。ECSは、エンドカンナビノイド(eCB)、カンナビノイド受容体、エンドカンナビノイドの合成と分解に関与する酵素で構成されている。2つの主要なエンドカンナビノイドは、アナンダミド(AEA)と2-アラキドノイルグリセロール(2-AG)である(238)。これらの生理活性脂質メディエーターは、共通のリン脂質前駆体であるアラキドン酸から産生され、神経細胞、免疫細胞、脂肪細胞など、体内の様々な細胞から放出される(239)。それらは、カンナビノイド受容体1型(CB1)および2型(CB2)を含む高親和性GPCRと結合する(238)。神経調節物質として、eCBはしばしば逆行性に作用し、シナプス後細胞から放出されてシナプスを逆行し、シナプス前末端からの抑制性GABAまたは興奮性グルタミン酸の放出を一過性に抑制する(240)(図4)。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はfendo-14-1130689-g004.jpg。
図4
エンドカンナビノイド系。神経系では、シナプス前の電気的インパルスが細胞内へのカルシウムの侵入を引き起こし、シナプスへの神経伝達物質の放出を促す。その後、シナプス後ニューロンの神経伝達物質受容体が活性化され、活動電位が前進する。eCBシステムは、神経系を含む全身で機能し、細胞シグナル伝達を調節する、どこにでもある神経調節システムである。DAGとNAPEはリン脂質前駆体から産生され、それぞれDAGLとNAPE-PLDによってエンドカンナビノイド(eCB)2-AEとAEAに変換される。逆行性シグナル伝達において、これらのeCBはシナプス後ニューロンから動員され、シナプス前CB1受容体を標的として、ACを阻害することで神経伝達物質の放出を抑制し、cAMPを減少させ、細胞内へのカルシウムイオンの流入を減少させるか、あるいはβ-アレスチンを介して受容体の感受性と内在化に影響を与える。CNSにおけるeCBシグナル伝達は、サイトカインと神経伝達物質の放出をそれぞれ調節することで、ミクログリアとアストロサイトの機能にも影響を与える。腸内では、ある種の微生物(または宿主細胞)が分泌するeCBは、微生物-上皮クロストークで相互作用し、免疫系と神経系、代謝、内分泌、バリア機能を含む。2-AG、2-アラキドノイルグリセロール;AA、アラキドン酸;AEA、N-アラキドノイルエタノールアミン(別名アナンダミド);AC、アデニル酸シクラーゼ;CNS、中枢神経系;cAMP、サイクリックAMP;DAG、ジアシルグリセロール;DAGL、ジアシルグリセロールリパーゼ;EA、エタノールアミン;FAAH、脂肪酸アミドヒドロラーゼ;GLP-1、グルカゴン様ペプチド1; GPCR MAGL(モノアシルグリセロールリパーゼ);MGB(微生物-腸-脳);NAPE(N-アシル-ホスファチジルエタノールアミン);NAPE-PLD(NAPEホスホリパーゼD);PIP2(ホスファチジルイノシトール4,5-ビスホスフェート);PLC(ホスホリパーゼC);PYY(ペプチドYY);TPRV1(transient receptor potential cation channel subfamily V member 1)。図はBioRender.comで作成。
ECSは、HPA軸(241)、認知、学習、記憶(242)、腸管バリア機能(243)、炎症(244)、エネルギー代謝(245)など、数多くの生理学的プロセスを調節している(最近、総説が発表された(239))。ストレスに応答して、eCBシグナルは脳内のグルココルチコイドとCRHシグナルを調節し、ホメオスタシスの回復に重要である(241, 246, 247)。ECSはまた、腸の神経組織にも広く発現しており、腸の恒常性の維持に決定的に関与している。ECSは、免疫系、上皮タイトジャンクションタンパク質、粘液分泌を通して、バリア機能と透過性を調節している(248)。さらに、腸管神経活動、SNSおよび迷走神経機能、グレリン、レプチン、オレキシンなどの神経ペプチドの放出を調節する(249)。
ECSとGMは相互作用して腸のホメオスタシスを調節し、その結果、腸と中枢神経系に関連した機能的効果をもたらす(238, 246, 248, 250)。ディスバイオシスはeCBシグナル伝達に影響を及ぼし、逆もまた同様である(243)。無胚芽動物では、CB1とCB2、そして合成酵素と分解酵素の発現が腸全体で著しく変化していることが示されている(251)。Vijayらは、ヒトに6週間の運動介入を行い、ECS、炎症性サイトカイン、GMの関係を研究した(252)。eCBsの変化は、酪酸レベルの上昇、TNF、IL-6、IL-10の減少と相関していた。したがって、SCFAの抗炎症作用は、部分的にECSによって媒介されている可能性がある。カンジダ・アルビカンスにコロニー形成された健康なマウスは、著明な不安様行動を示し、コルチコステロン濃度が増加し、前脳AEAと逆相関を示したことから、ECSの調節異常によるHPA軸の破壊が証明された(253)。動物実験でもヒトでの研究でも、ECSとGMが認知機能の低下に関与していることが示されている(254)。微生物はeCBを分泌するが、宿主の生理機能におけるその役割は不明なままである(255)。
3.3. 免疫系
免疫系の主な責務は、「有害な」シグナルと「無害な」シグナルを区別し、適切に対応することである。これは、免疫細胞が常に微生物と接触している腸内において特に重要である。そのためGMは免疫系と密接な関係にあり、両者はいくつかの方法で相互作用している[最近、総説(256, 257)]。さらに、免疫系、HPA軸、中枢神経系、GMは密接に関連している。
重要な相互作用のひとつに、微生物関連分子パターン(MAMP)による、TLRを含むパターン認識受容体(PRR)の活性化がある(54)。これらの分子シグネチャーは、内毒素LPSや多糖類A(グラム陰性菌の細胞表面に存在)、PG(グラム陽性菌に存在)などの微生物産物から構成されている(258)。各MAMPは、免疫系細胞(マクロファージ、ナチュラルキラー細胞)や神経系細胞(腸管神経細胞、腸グリア細胞)など、様々な細胞種に発現する特異的PRRによって検出される(53)。
サイトカインとケモカインは、免疫系、消化管、中枢神経系(HPA軸を含む)が相互作用するもう一つのメカニズムである(259)。腸の免疫細胞は、腸の恒常性を維持するためにサイトカインを産生し、そのサイトカインが局所の微生物濃度に影響を与える(260)。サイトカインはまた、CNSで局所的に産生されることもあれば、全身循環からBBBを通過して脳機能に直接影響を及ぼすこともある。
上皮の完全性は、消化管および神経系のホメオスタシスの重要な特徴である。上皮の完全性は、必要な分子の輸送を可能にする一方で、バリア越しに生成物が無秩序に漏出するのを防ぐために不可欠である。さらに、腸上皮の完全性は、GMの常在微生物との共生関係を維持するためにも重要である。この物理的バリアには、粘膜、上皮細胞、そしてオクルディン、クローディン、ゾヌラ・オクルデンスなどのタイトジャンクションタンパク質が含まれる(261)。これらのタイトジャンクションタンパク質複合体は、細胞内シグナル伝達系や、サイトカイン、低分子GTPase、翻訳後修飾を含むいくつかの細胞外刺激によって動的に調節されている。これらの調節機構が破綻すると、バリアの完全性が損なわれる可能性がある。傷害、感染症、自己免疫疾患は、腸管やBBBの透過性に影響を及ぼす可能性がある(262)。その結果、微生物や微生物産物が循環に入り込み、CNSへのアクセスが容易になる可能性がある(262)。さらに、GMの影響下で放出される微生物産物、サイトカイン、その他の免疫分子は、BBBの完全性にさらに影響を与え、BBBの輸送速度を変化させ、BBBの細胞からの神経免疫分子の放出を促進する可能性がある(262)。GMはまた、オクルディンやクローディン5の発現を変化させることにより、BBBの透過性を変化させる可能性がある(263)。これらの因子は、脳機能を形成する重要なプロセスである神経炎症につながる可能性がある。
肉芽腫とCNSの間のクロストークもまた、自然免疫系と適応免疫系の正常な発達と恒常性維持に不可欠である(256)。免疫細胞の活性化とサイトカイン産生は、生理的な摂動時にはCNSへの影響は軽微であるが、慢性的な全身性の炎症は、主に感染症の形で、行動変化や認知機能障害と長い間関連してきた(264-266)。抗生物質処理マウスや無菌マウスでは、全身およびCNSの免疫系が炎症反応を起こしている(120, 267)。抗菌薬による微生物の多様性の乱れは、中枢神経系における炎症性サイトカインの分泌に影響を与え、ミクログリアの形態を変化させることが示されている(268-270)。
3.4. 微生物代謝産物
これまで述べてきたような、遺伝子組換え体と宿主の免疫系および神経系との間の複雑な情報伝達経路に加えて、ヒトの機能に影響を与える低分子の産生を伴うメカニズムがいくつか存在する(271, 272)。
3.4.1. 短鎖脂肪酸 短鎖脂肪酸(SCFA)は、大腸内で難消化性多糖類を細菌が発酵させることにより産生される小さな有機モノカルボン酸である。主なSCFAは、酪酸(C4)、プロピオン酸(C3)、酢酸(C2)である(132)。SCFAは、モノカルボン酸トランスポーター(MCT)を介して、あるいは上皮を介した非イオン拡散を介して、結腸細胞に吸収される(131, 273)。
SCFAは、結腸や肝臓の細胞にとってエネルギー源であり、栄養因子でもある(274)。さらに、SCFAは腸内分泌細胞、免疫細胞、神経細胞など全身に存在するGPCR、特に遊離脂肪酸受容体FFA2、FFA3、Olfr78、GPR109aと結合することができる(275-278)。このことは、SCFAが神経-免疫-内分泌の調節に重要な役割を果たしていることを示唆している(279-282)(図4)。実際、腸や中枢神経系を含むいくつかの宿主臓器や系に影響を及ぼすSCFAの多面的な役割は、広範な証拠によって裏付けられている(127, 131, 132)。SCFAには、腸の健康を改善するいくつかの局所的作用があり、これには腸管バリアの完全性の維持、粘液産生、炎症からの保護などが含まれる(250)。これらのプロセスは、腸の第一次防衛ラインにとって極めて重要である。SCFAは、リンパ球、T細胞、B細胞などの免疫細胞を制御することにより、免疫力を促進し、腸や他の臓器における炎症反応を抑制する(283-285)。
また、SCFAはヒストン脱アセチル化酵素(HDAC)活性を阻害することで、宿主細胞のヒストンアセチル化と遺伝子発現を促進し、全身機能を調節する(250)。このエピジェネティックなメカニズムは、消化管、免疫、神経細胞で報告されている[総説(131)]。
SCFAはMGBコミュニケーションにおいて重要な役割を果たしているようである(286)。研究によると、SCFAは腸神経叢、門脈神経、自律神経節および感覚神経節におけるFFA3の発現を通じて、間接的にPNSを調節することができる(131)。迷走神経細胞上のFFA3受容体の活性化は、視床下部ニューロン回路の動的制御を含むCNSの様々なニューロンの活性化をもたらす可能性がある(287)。
SCFAによって腸内分泌細胞上の受容体が活性化されると、グルカゴン様ペプチド1(GLP1)やペプチドYY(PYY)などのホルモンや、GABAやセロトニンなどの神経伝達物質を誘導することにより、腸-脳間のシグナル伝達を促進することができる(276)。SCFAシグナルは、脂肪細胞からのレプチンや膵β細胞からのインスリンなど、他のホルモンも誘導することができる(288)。さらに、SCFAは神経伝達物質や神経栄養因子のレベルを調節し、セロトニンの合成に関与する酵素であるトリプトファン5水酸化酵素や、ドーパミン、ノルアドレナリン、アドレナリン合成の律速段階に関与する酵素であるチロシン水酸化酵素の発現を調節することができる(18, 132, 164, 222)。
さらに、内皮細胞上にMCTが豊富に発現していることから、SCFAはBBBを通過することができ、これはヒトの脳脊髄液(CSF)中および脳への取り込み研究(286)におけるSCFAの存在によって裏付けられている。SCFAはCNSの恒常性維持、学習や認知、報酬に関連した行動に必要であるという考えを支持する証拠が蓄積されている(25)。SCFAはまた、タイトジャンクションタンパク質の発現をアップレギュレートすることにより、BBBの完全性に影響を与える(263)。
SCFAはまた、神経成長因子、グリア細胞由来神経栄養因子、BDNFなどの神経栄養因子に影響を与えることで、神経細胞の恒常性と機能を改善する可能性がある(119-122)。これらの因子は、中枢神経系におけるニューロンやシナプスの成長、生存、分化を調節し、学習や記憶に重要である。SCFAはグリア細胞の形態や機能に影響を与えることで、神経炎症を修飾することができる(120, 286, 289, 290)。無胚芽マウスにSCFAを投与することで、Ernyらはミクログリアの未熟さと形態における欠損を救済することができた(120)。
SCFAがHPA軸を調節することを示唆する証拠もある。ストレスマウスにおいて、SCFA投与はHPA軸の過活動と腸透過性を減少させた(291)。ヒトでは、最近の三重盲検無作為化プラセボ対照介入試験で、男性における大腸SCFA混合物投与が心理社会的ストレスと恐怖課題に対する反応に及ぼす効果が検討された(292)。SCFAの補給は、コルチゾール反応を有意に減弱させることにより、HPA軸をダウンレギュレートすることが示された。
SCFA産生の変化は、様々な神経病理学的にも証明されている(42, 116, 127, 130, 132, 292-295)。これらの知見から、SCFAは直接的・間接的なメカニズムを通じて中枢神経系のプロセスを制御し、最終的には宿主の認知やストレスに対する反応に影響を及ぼす可能性が示唆される。
3.4.2. 胆汁酸 胆汁酸(BA)は、主に肝臓で一次BAとして産生されるコレステロール代謝産物であり、脱共役、ジヒドロキシル化、脱水素化、異性化などの過程を経て、GMによって二次BAに修飾される(図5)(30, 296, 297)。脂質消化のためのデタージェントとしての腸肝循環における役割はよく知られているが、最近の研究では、ファルネソイドX受容体(FXR)や武田Gタンパク質共役型受容体5(TGR5)などの受容体を介したホルモンとしての機能も明らかにされ、重要な調節活性やシグナル伝達活性を持つことが明らかになっている(298)。BAはまた、プレグナンX受容体、ビタミンD受容体、グルココルチコイド受容体を活性化することができる(299)。BAsの機能は、腸の運動、感覚、分泌機能、腸管バリア透過性、炎症反応、および脂質代謝、糖代謝、肝グルコネシン生成を含むいくつかの代謝過程の制御に及ぶ(300)。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はfendo-14-1130689-g005.jpg。
図5
胆汁酸、BA受容体、およびシグナル伝達経路。肝臓では、胆汁酸(BA)合成の古典的な経路は、律速酵素であるコレステロール7α-ヒドロキシラーゼ(7α-OHase;CYP7A1)によるコレステロールの7α-ヒドロキシコレステロールへの変換から始まる。7α-ヒドロキシコレステロールはその後、一連の酵素反応によってコール酸(CA)とチェノデオキシコール酸(CDCA)に代謝される。いったん合成されたBAは、グリシンまたはタウリンと抱合され、溶解度を高めて毒性を低下させる。抱合されたBAは胆管に分泌され、胆嚢に貯蔵され、食後に小腸に放出される。役目を終えたBAsの約95%は回腸で再吸収され、腸肝循環を経て肝臓に戻る。BAsが消化管を通過する際、多様な腸内細菌集団に遭遇し、微生物による生体内変換の結果、二次BAsの合成が大腸で起こる。二次BAは、体内のBAプール全体を維持するために重要であり、コレステロールの恒常性、エネルギー代謝、免疫系の調節に寄与している。BAはまた、核内受容体FXRや細胞膜受容体TGR5(肝臓、消化管、腸神経系、中枢神経系、副腎など様々な組織で発現)などの特異的受容体と相互作用し、グルコース代謝、脂質代謝、腸脳軸の調節など、多くの生理的プロセスの調節に関与するシグナル伝達分子としても働く。消化管では、BAが腸細胞でFXRと結合し、これがFGF19の発現を活性化し、FGF19が血流に分泌され、MGBコミュニケーションに重要な役割を果たす。FGF19は内分泌シグナルとして作用し、BBBを通過してCNSに達し、同族受容体であるFGFR4と共受容体β-Klothoに結合する。この相互作用により、MAPK経路やPI3K/Akt経路などの細胞内シグナル伝達カスケードが活性化される。これらのシグナル伝達経路は、細胞の成長、分化、代謝など様々なプロセスを制御し、腸脳軸の調節に寄与している。さらに、BAによるTGR5の活性化は、インスリン分泌とグルコースホメオスタシスを調節するインクレチンホルモンであるGLP-1の放出につながる。中枢神経系では、TGR5の活性化がエネルギーバランスの調節、神経炎症、神経保護に関与していることが示唆されている。BAsは、CNSおよび副腎のシグナル伝達経路に関与する直接的および間接的なメカニズムを通じて、HPA軸に影響を及ぼす可能性がある。CNSでは、BAsは、視床下部や海馬を含む様々な脳領域で発現しているFXRやTGR5と相互作用することで、HPA軸を調節することができる。BAsによるこれらの受容体の活性化は、視床下部からのCRHおよび下垂体からのACTHの放出に影響を及ぼし、副腎皮質からのコルチゾール分泌の調節につながる。さらに、BAsは副腎に直接作用し、コルチゾールの放出に影響を及ぼす。BAは、HSL、StAR、チトクロームP450酵素(例えば、CYP11A1、CYP11B1、CYP11B2)など、コルチゾールの生合成に関与する主要酵素の発現および活性を調節することにより、副腎のステロイド生成を変化させることができる。さらに、BAsはFXRおよびTGR5を活性化することによって副腎細胞の機能に影響を与え、ステロイドホルモン産生、炎症、酸化ストレスに関連する細胞内シグナル伝達経路および遺伝子発現パターンを制御する可能性がある。一次胆汁酸:CA、コール酸;CDCA、チェノデオキシコール酸;GCA、グリコール酸;TCA、タウロコール酸;GCDCA、グリココネデオキシコール酸;TCCDA、タウロチェノデオキシコール酸。二次胆汁酸: DCA、デオキシコール酸;G/T-DCA、グリコ/タウロデオキシコール酸;G/T-LCA、グリコ/タウロリトコール酸;G/T-UDCA、グリコ/タウロウルソデオキシコール酸;UDCA、ウルソデオキシコール酸;LCA、リトコール酸;UDCA、ウルソデオキシコール酸。ACTH、副腎皮質刺激ホルモン;Akt、プロテインキナーゼB;BA、胆汁酸;BBB、血液脳関門;CNS、中枢神経系;CRH、コルチコトロピン放出ホルモン;FGF19、線維芽細胞成長因子19;FGFR1~4、線維芽細胞成長因子受容体1~4;FXR、ファルネソイドX受容体; GLP-1、グルカゴン様ペプチド1、GLP-1R、グルカゴン様ペプチド1受容体、HSL、ホルモン感受性リパーゼ、MAPK、マイトジェン活性化プロテインキナーゼ、MGB、微生物叢-腸-脳、PI3K、ホスファチジルイノシトール3-キナーゼ、StAR、ステロイド生成急性調節タンパク質、TGR5、武田Gタンパク質共役受容体5。図はBioRender.comで作成。
BAの作用は腸を超えて、宿主全体の様々な組織に影響を及ぼす。BA受容体は脳に存在し、BAは局所的に合成されるか、あるいは循環からBAトランスポーターによってBBBを越えて能動的に輸送される(297, 301, 302)。その結果、循環BAレベルはCNSのBAプロファイルに大きく影響する(303)。FXRノックアウトマウスは、BAと神経伝達物質濃度の異常を示し、その結果、認知と運動協調が損なわれる(304)。TGR5は、脳や末梢神経細胞、グリア細胞やミクログリア細胞に発現しており、いくつかのニューロステロイドによって活性化される(305)。特定のBAsは、細胞モデルや動物モデルで神経保護効果を示し、ヒトでの臨床試験も進行中である(306-308)。
BAsは、HPA軸の調節に一役買っている。BAsは、視床下部に発現するFXRの活性化を通じてCRHの放出を阻害することにより、HPA軸の活性を調節する(309)。さらに、BAsは視床下部のPVNに発現するTGR5と相互作用し、CRHを増加させることによりHPA軸を刺激することができる(310, 311)。胆汁うっ滞は、脳内のグルココルチコイド受容体とBAとの相互作用によると思われるHPA軸の抑制と関連している(299, 312)。副腎におけるFXRとTGR5受容体の発見は、さらにBAとグルココルチコイド代謝を結びつける(311, 313-315)。BAsはTGR5を介して、cAMP/プロテインキナーゼA(PKA)依存的にリン酸化し、ステロイド生成急性調節タンパク質(StAR)とホルモン感受性リパーゼ(HSL)を活性化する(316)。FXRの活性化は、リポタンパク質受容体やトランスポーター、ステロイド生成経路の酵素を制御することが知られており、マウスではコルチコステロン濃度を上昇させることが示されている(311)。
GMはBAの代謝に影響を与え、BAはGMの組成に影響を与える(296)。特定の微生物が直接BAの変換に寄与し、BAプールの組成とサイズに影響を与える(317)。BAの中には、腸内微生物の基質となるものもあれば、抗菌性を示すものもあり、分類学的に最も高いレベルで、細菌叢を積極的に形成している(318)。BA-微生物叢軸は、腸に沿った免疫調節環境を調節する(303)。BAと腸内細菌叢との間にこのような密接な双方向的関係があることから、これらの代謝産物は、ENSや脳のBA受容体を介して直接的に、あるいはGLP-1やFXR-FGF15/19軸を介して間接的に機能する、MGB軸の重要な調節因子として浮上してきた(297, 319)。GMの組成の変化は、血中および脳のBAプロファイルの変化に対応し、特定のBAリガンドの異なる物理化学的特性がBA受容体の活性化の効力を決定するため、これは不可欠である(320-323)。
BAプロファイルの変化は、アルツハイマー病などの認知機能低下に関連するいくつかの神経病理学的病態で観察されている(302, 324)。BA障害は神経症状とも関連している(300)。BA類は、GABAやNMDA受容体だけでなく、ムスカリン受容体にも親和性を示すことから、認知機能に大きな影響を及ぼす可能性がある(325)。無胚葉マウスは野生型マウスに比べ、糞便中のBA排泄量が少なく、BAプールが大きく、BA代謝に関与する遺伝子発現プロファイルが異なる(323)。新生児マウスの生後のGMの成熟はBAに依存していることが示され、新生児胆汁うっ滞は乳児のdysbiosisと関連している(326, 327)。胆管結紮はGM組成を変化させ、BBBの透過性を増加させる(328, 329)。うつ病と不安症の患者を対象とした研究では、GM組成の変化に関連するBAプロファイルは、症状がより重い患者で有意に異なっており、特定のBAパラメータによって治療失敗者と寛解者を区別することができた(330)。
3.4.3. 分岐鎖アミノ酸 分岐鎖アミノ酸(BCAA)は、ロイシン、イソロイシン、バリンを含む必須アミノ酸であり、エネルギー産生、タンパク質合成、インスリン分泌、脳内アミノ酸取り込み、免疫など、様々な生化学的機能に関与している(331)。遺伝子組み換え食品は、他のアミノ酸に比べ、特定のBCAA(バレレート、イソ酪酸、イソバレレート)を高い割合で産生し、上皮や粘膜のホメオスタシスに影響を与えることが示されている(332)。さらに、BCAAは微生物によって利用され、腸内微生物の種、多様性、代謝を調節する可能性がある(333, 334)。
BCAAは、主要なシグナル伝達経路、特に細胞の成長と増殖のマスターレギュレーターとして機能するmTOR(mechanistic target of rapamycin)の活性化を調節する(331)。BCAAを強化したカクテルを摂取したマウスは、身体的持久力が向上し、寿命が延長した(335)。
中枢神経系では、BCAAはタンパク質合成、食物摂取調節の役割を果たし、細胞間シャトリングや神経伝達物質であるグルタミン酸とGABA(どちらもHPA軸を調節する)の合成に関与する窒素供与体として機能する(336)。ロイシンを欠乏させたマウスでは、CRH発現を介してHPA軸の活性化が増加した(337)。過剰なBCAA濃度は毒性があると考えられており、特に中枢神経系において組織障害を引き起こす可能性がある(338)。探索的研究はまだ始まったばかりであるが、BCAAの調節が認知障害に有用であることを示唆する証拠がある(339-341)。GM、BCAA、HPA軸、認知の関係を明らかにするためには、さらなる研究が必要である。
次へ
4. 微生物叢、HPA軸、認知の関係
4.1. HPA軸と腸内細菌叢のストレス関連相互作用
4.1.1. 動物実験からの証拠 微生物叢とHPA軸は、生後最初の数年間に急速かつ大きく発達し、環境ストレス因子は両者に影響を及ぼす可能性がある(146-148)。人生のさまざまな時期に経験するストレスは、さまざまな生理学的結果をもたらす可能性がある。生後早期のストレス因子や胎内のストレス因子は、HPA軸の発達や機能に影響を及ぼす可能性がある(149)。妊娠中のストレスは、母親から子孫への微生物の垂直的伝達を阻害し、母親の微生物叢に変化をもたらし、それが子孫に伝達される(342)。Jašarevićらは、これらの子孫のマイクロバイオームにおける変化と、腸と脳のメタボロームにおける変化を示した(343)。その後の研究で、ストレスにさらされた子孫に観察される表現型を植え付けるには、ストレスにさらされたダムからストレス未経験の無菌マウスへのFMTで十分であることが示された(344)。
母体分離のような生後早期のストレスは、HPA軸を活性化し、それに伴って発育中の微生物叢にも変化をもたらし、最終的にGMのバランスを崩し、不適切なストレス反応を引き起こす(18)。いくつかの研究で、新生児期のストレスが、短期的・長期的に微生物叢の多様性と組成に変化をもたらすことが示されている(345-347)。興味深いことに、これらの結果は年齢に依存するようである。生後間もないラットはストレスに応答して、神経新生が増加し、BDNF IVプロモーターのヒストンメチル化が減少し、海馬のBDNF濃度が相補的に増加し、それに伴って空間学習と非空間学習が改善した(348)。対照的に、中年ラットでは、海馬依存性認知課題の障害と同時に、相反する変化が示された。これらの相反する結果は、初期ストレスの二相性の結果を示しており、BDNF発現のエピジェネティックな修飾の役割を示している。さらに、曝露後の慢性抗うつ薬投与は、中年ラットで観察された神経学的低下を救うことができた(348)。
須藤らによる画期的な論文は、特定病原体フリー(SPF)マウスと比較した場合の無菌マウスのHPA軸ホルモンとレセプターの違いを示すことによって、ストレス反応のプログラムにおけるGMの重要な役割を証明した(51)。無菌マウスでは、急性ストレス後にアセチルコリン、ACTH、コルチコステロン反応が増加し、HPA軸の活性が亢進していることが示された。さらに、これらのマウスでは、大脳皮質でNMDA受容体サブユニット(NR-1)の発現が減少し、大脳皮質と海馬ではNR-2aの発現が減少した。慢性拘束ストレスの後、無菌マウスはHPA軸活性が有意に高かったが、SPFマウスは同じストレス下でより不安様行動を示した(349)。これらの所見はその後再現され、オスとメスの両方のマウスが、新しい環境ストレッサーに対するストレス反応性の亢進を示した(189, 350, 351)。実際、生殖細胞を持たない動物は、中枢神経系におけるモノアミン神経伝達の変化と関連した、広範な神経発達の変化を示す(189)。
慢性ストレスの動物モデルでは、分泌状態と透過性が亢進し、腸の生理機能とGM組成が変化していることが示されている(352-355)。腸管バリアの完全性が変化すると、細菌(および微生物産物)が粘膜や上皮を横切って移動し、免疫細胞や神経細胞と相互作用するようになる(356, 357)。慢性的な相互作用が、自己免疫疾患、代謝性疾患、認知障害の発症に寄与する全身性の低悪性度炎症を引き起こす可能性があることを示唆する証拠が増えている(358)。さらに、慢性的なストレスにさらされ、GMの安定性が損なわれると、宿主が感染症にかかりやすくなることが示されている。長時間の拘束ストレスにさらされたマウスは、細菌の過剰増殖や多様性・豊富性の減少など、遺伝子組換え体組成の変化を示した(359)。腸内病原体C. rodentiumを経口投与すると、慢性ストレスマウスは病原体負荷が増加し、大腸TNF-α発現が増加した。プロバイオティクスは、GMのこれらの変化と関連する宿主-微生物相互作用を改善した。Allenらの研究では、ストレス誘発性の免疫調節にGMが必要であることが示され、脾臓マクロファージ反応性の亢進は、社会的混乱ストレスに応答して、コロニー形成された対照マウスでは起こるが、無菌マウスでは起こらないことが示された(360)。
HPA軸に対する遺伝子組み換えの影響については、意図的な介入を行うことでさらに調べることができる。抗生物質を慢性的に投与すると、ラットの脳内のCRH受容体mRNAレベルが低下した(361)。病原性細菌の導入は認知能力を低下させ、不安様行動を高めた(362, 363)。新生児動物を低用量のエンドトキシンに曝露すると、TLRが活性化された(364, 365)。さらに、グルココルチコイドのパルス頻度と振幅が増加した結果、平均グルココルチコイド濃度が上昇し、長期的なHPA軸活性の変化が見られた。食事誘発性肥満の動物モデルでは、不安や抑うつ様行動は、海馬のグルココルチコイド受容体レベルの低下と、急性の身体的・社会的ストレスに対するHPA軸を介したストレス反応の誇張と関連していた(366)。プロバイオティクスB. pseudocatenulatum(CECT 7765)は、グルココルチコイド受容体とストレス反応の異常を、神経行動学的表現型とともに逆転させた。乳酸菌によるプロバイオティクス投与は、生後早期の母子分離ストレスと同時に、HPA活性を正常化することができた(346)。同様に、L. farciminisの前処置は、拘束ストレスに起因するHPA過反応、腸透過性、神経炎症を抑制した(367)。L.ラムノサスをマウスに投与したところ、脳のGABA受容体発現の部位依存的変化が、ストレス誘発性グルココルチコイドレベルの低下と並行して認められた(191)。注目すべきは、迷走神経を切断したマウスでは神経化学的効果が見られなかったことで、迷走神経経路が関与していることが示唆された。最近、迷走神経はHPA軸やグルココルチコイドの末梢代謝に関与するタンパク質をコードする遺伝子の発現に影響を与えることが示された(368)。Muddらの研究では、若齢豚の糞便中ルミノコッカスレベル、血清コルチゾール、脳内N-アセチルアスパラギン酸の予測関係が報告されている(126)。
4.1.2. ヒト研究からのエビデンス ヒト研究からのエビデンスはまだ乏しいが、34人の健康な乳児を対象とした最近のパイロット研究では、1ヵ月時のGM組成(α多様性として測定)が、痛みを伴うストレス要因後のHPA軸反応性と正の相関があることが明らかになった(369)。生後2.5ヶ月の乳児193人を対象とした大規模コホートでは、コルチゾールのストレス反応とアルファ多様性との関連は弱かった(370)。健康な成人では、ランダム化比較試験(RCT)でLPSを実験的に投与すると、一過性の生理的ストレス反応が起こり、コルチゾール、ノルアドレナリン、体温、脈拍数、サイトカインが用量に関連して増加した(371)。このストレス反応は不安の増大と抑うつ気分と関連していた。認知機能の変化は短期的、長期的の両方でみられ、急性炎症性ストレス時の認知機能の促進と抑制の両方のメカニズムが確認された。
別のRCTでは、健康なボランティアにプロバイオティクス(L. helveticus(R0052)とB. longum(R0175)の組み合わせ)を投与したところ、参加者に有益な心理的効果が認められ、24時間尿中コルチゾールが減少したことから、ストレス要因に対するHPA軸の減衰が示唆された(372)。健常人のストレスに対するプロバイオティクスの有効性に焦点を当てたRCTの最近のメタアナリシスでは、プロバイオティクスの使用は一般的に主観的ストレスレベルを低下させ、ストレスに関連した閾値以下の不安や抑うつを緩和するようであることが示された(373)。しかし、コルチゾールレベルには有意な変化は見られなかった。食物繊維と発酵食品が、ストレスや健康全般を含むGMプロファイルと機能に果たす役割を調査した、小規模だが詳細な4週間の研究では、GM組成の微妙な変化が、いくつかの糞便脂質と尿中トリプトファン代謝物の有意な変化と関連していた(374)。参加者は知覚ストレスの減少を報告したが、対照群との有意差はなく、ストレスマーカーも影響を受けなかった。しかし、知覚ストレスの軽減は用量依存的であり、食事順守率が高いほどストレスの軽減は大きかった。
4.2. 腸内細菌叢と認知のHPA軸関連相互作用
4.2.1. 認知 認知とは、思考、経験、感覚を通じて情報を獲得、理解、保存する複雑な精神的プロセスと定義される。基本的には、知覚と反応、処理と理解、保存と検索、意思決定と適切な反応を生み出す能力である。認知は単一の概念ではなく、いくつかの構成要素を持つさまざまな「領域」(機能)が特定されている。認知機能障害は通常、記憶、言語、視空間、実行、計算、理解、判断などの1つまたは複数の側面の障害として現れる。前臨床およびヒトでのエビデンスの蓄積により、MGB軸が認知の様々な構成要素の発達と維持に重要な役割を果たしていることが証明されつつある(191, 362, 375)。
4.2.2. 動物実験による証拠 無菌マウスを用いた研究では、微生物が存在しない場合、脳は著しい影響を受け、学習、記憶の形成と認識、社会的・感情的行動に障害を示すことが示されている(58, 123, 124, 362)。Gareauらは、5~6週齢の無菌マウスでは、従来飼育されていたマウスと比較して、短期認識とワーキングメモリーに障害があることを示した(362)。無菌マウスの行動学的な違いとしては、SPF対照と比較した場合の抗不安様行動が挙げられるが、異なる種で不安様行動の増加が報告されている研究もある(124、189、351、376)。微生物コロニー形成はこれらの認知の要素を救済することが示されているが、それは生後早期に投与された場合のみである(124, 350)。無胚芽マウスは社会的認知障害を示すが、これは記憶に重要な海馬のBDNFやc-FOSの発現低下などの生化学的変化と関連している可能性がある(124, 362, 376, 377)。さらなる研究では、認知機能の低下はBDNF mRNAレベルと逆相関することが示されている(124, 350)。
いくつかのメタボローム研究では、ドーパミン系とセロトニン系の変化が示されている(124, 189, 350, 378-380)。これらの変化には、海馬のドーパミンD1受容体mRNAレベルの増加と線条体および側坐核のドーパミンD1受容体の減少、また血液中および海馬のセロトニンの増加とセロトニン受容体発現の減少がそれぞれ含まれる。
生殖不能動物のセロトニン作動性システムにおける性特異的差異を記録した研究がいくつかあることから、性的二型性の役割に注意しなければならない(350)。メスの子どもは、出生前のストレスで認知障害や不安様行動が増加し、妊娠中のメスにおけるGMの変化や、胎内でのIL-1βの増加やBDNFレベルの低下と関連していた(381)。対照的に、雄の子供では社会的認知にのみ障害がみられ、他の行動や認知のパラメーターには障害がみられなかった(146)。
広域抗生物質の使用は、dysbiosisによって誘発される認知障害を研究するための別の手段を提供する。投与により、トリプトファン代謝、BDNF、NMDA受容体サブユニット2B、セロトニントランスポーター、ニューロペプチドY、オキシトシン、ノルアドレナリン、バソプレシンの発現が変化することが示されている(382, 383)。Möhleらは、成体マウスに抗生物質を長期投与したところ、海馬の神経新生と記憶保持が低下した(384)。GMの役割を確認するため、プロバイオティクスによる腸内細菌叢の再構成と自発的な運動を併用したところ、これらの障害は回復した。腸内細菌叢の機能は、抗生物質投与マウスと無菌マウスを恐怖の消滅学習に関して比較した最近の研究でさらに実証された(385)。複雑な微生物叢がないと、どちらのタイプのマウスも恐怖に関連した行動の変化、脳細胞における遺伝子発現の変化、ニューロンの発火パターンや再配線能力の変化を示した。選択的コロニー形成により、重要な発達時期が明らかになり、正常な学習には、生後早期から成体にかけて微生物叢由来のシグナルが必要であることが示された。グルココルチコイドと記憶形成との間に確立された関係があることを考えると、このような研究は、GM、HPA軸、認知過程の間に複雑な関係があることを示唆している(386)。
免疫マーカー、海馬のシナプス効果、トリプトファン代謝の変化に伴う抑うつ、不安、ストレスの変化など、認知や行動に対するプレバイオティクスやプロバイオティクスの役割を探るために、動物モデルをさらに利用することができる(376、387)。一過性の常在微生物であるMycobacterium vaccaeをプロバイオティクスまたはワクチンとして若齢成体マウスに投与すると、認知テスト中の行動、学習、記憶が改善され、MGB経路における免疫系とセロトニン作動系の役割が確認された(388, 389)。プロバイオティクスB. longum (NCC3001)は、マウスにおいて迷走神経経路を介した抗不安作用を示し、B. longum (1714)は11週間の補給で学習と記憶の改善を示した(192, 390)。様々なラクトバチルス属の乳酸菌を補給すると、認知能力と社会的欠損が改善され、これらの変化は、脳内のGABA発現の変化、オキシトシンと迷走神経経路の有意な変化と同時に起こることが示された(191, 391)。プロバイオティクスのClostridium butyricumを6週間投与すると、血管性認知症モデルマウスの認知機能が回復し、糞便中および脳サンプル中の酪酸レベルが上昇し、海馬のBDNF-PI3K/Akt経路が活性化した(392)。
感染研究も有用な方法である。C. rodentiumの投与と急性ストレスの組み合わせは、若い成体の無菌マウスに記憶機能障害をもたらした(362)。この障害は、感染前にラクトバチルス属のプロバイオティクスの組み合わせを毎日投与することで予防された。Humannらは、微生物のPGがマウスの胎盤を通過することができ、母体に投与されたPGが胎児の脳で検出されることを示した(64)。胎児は、大脳皮質におけるFoxG1誘導を介したTLR-2介在性の神経増殖に関連して、認知機能の低下を示した。新生児期のLPS曝露は、同様の認知障害を引き起こす(393)。Bilboらは、新生児期の大腸菌感染が成体ラットの記憶を障害することを明らかにした(394)。興味深いことに、この障害は、学習時にLPSチャレンジが投与された場合にのみ観察され、新生児ラットの基礎HPA軸活性を有意に変化させる毎日のハンドリングによって防ぐことができた(395)。
動物およびヒトの研究から、出生前の細菌やウイルスへの曝露と、その後の様々な障害の発症との関連が示されている。ウイルス感染を模倣するために、低用量の免疫刺激性ポリイノシン酸:ポリシチジル酸(ポリI:C)を母マウスに妊娠中期に注射すると、3週齢と9週齢の子供の非空間記憶、学習、運動活動が有意に障害された(396)。感染および/または感染因子を模倣したものに対する免疫応答は、子孫の認知能力に長期的な影響を及ぼす可能性がある。ヒトの場合、母体感染による子孫の微生物叢への影響や、それに関連した認知異常については不明な点が多く、さらなる調査が必要である。これらのデータは、微生物、HPA軸、認知の相互関係を浮き彫りにしている。
4.2.3. ヒト研究からのエビデンス
4.2.3.1. 微生物コロニー形成と微生物叢の発達 これまでは、認知は中枢神経系(CNS)のみが制御していると考えられていた。しかし、GMを含む他の多くの非CNS因子も認知機能を制御し、影響を与えていることが明らかになってきた(397)。実際、ヒトにおける高次の認知機能の発達は、微生物が存在しなければ進化しなかった可能性があると考えられている(398)。最近、微生物群、ヒトの脳、認知機能が相互に関連するメカニズムの解明に、かなりの注目が集まっている(図6)。Carlsonらは、磁気共鳴画像法(MRI)による大脳容積と局所脳容積、およびクラスター分析を用いた認知結果テストによって特徴づけられた1歳児の3つのグループにおいて、微生物叢組成を評価した(399)。バクテロイデスが最も豊富なグループは、Mullen Scales of Early Learningの評価で他の2グループより優れていた。また、帝王切開による出産が少なかった。他の研究でも、分娩様式と神経認知発達や長期的な免疫・代謝の健康転帰不良が関連しており、出生時の微生物コロニー形成の重要性が強調されている(400, 401)。新しい研究では、HPA軸も帝王切開による出産とその後の健康転帰不良との関連に重要である可能性が示唆されている。136人の乳児を対象とした縦断的研究では、帝王切開で出産した乳児は、ベースライン時および6ヵ月後の追跡調査時の痛みを伴うストレステストに対するコルチゾール濃度が低く、これはHPA軸が変化していることを示している(402)。7,000人以上の新生児のコホートにおいて、Kiilerichらは、経膣分娩の乳児と比較して、分娩前に帝王切開で出産した乳児では、炎症マーカーとストレスマーカーのレベルが低く、成長因子のレベルが高いことを発見した(403)。興味深いことに、帝王切開が分娩中に行われた場合には、これらの差は有意ではなかった。このことは、分娩過程そのものが、新生児の免疫系とストレス反応に関連する重要な内分泌的、生理学的、生化学的プロセスを開始することを示唆している。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はfendo-14-1130689-g006.jpg。
図6
腸内細菌叢、HPA軸、認知。腸内細菌叢、HPA軸、認知の関係を模式的にまとめた図。腸内細菌叢は、代謝産物(SCFA、胆汁酸など)、神経伝達物質(セロトニン、GABA、カテコールアミンなど)の産生、免疫系の調節を通じて、HPA軸と認知に影響を及ぼす。視床下部、下垂体、副腎からなるHPA軸は、コルチゾールの放出を調節し、これが腸内細菌叢と認知機能の両方に影響を及ぼす。認知プロセスには、さまざまな脳領域(海馬、扁桃体、前頭前皮質など)、神経伝達物質、可塑性が関与しており、腸内細菌叢とHPA軸の相互作用によって調節される。ACTHは副腎皮質刺激ホルモン、CRHはコルチコトロピン放出ホルモン。図はBioRender.comで作成。
4.2.3.2. 抗生物質の使用 抗生物質の使用が重要であり、必要な場合には必要であることはよく知られている。しかし、不適切な使用は、抗菌薬耐性の出現など、いくつかの健康上の悪い結果と関連している。確かに、MGB軸にはオフターゲット活性を示す部位が複数あり、その結果、下流で神経認知にプラスあるいはマイナスの影響を及ぼす可能性があり、抗生物質スチュワードシップの重要性が強調されている(404-407)。高用量または長期間の抗菌薬投与は、腸および脳の両レベルにおいて、重篤または不可逆的な変化を引き起こす可能性がある(408, 409)。
乳児の微生物叢は、ストレスや抗菌薬などの様々な擾乱に対して非常に敏感である(408)。様々なクラスの抗生物質への周産期の曝露が、新生児と乳児の微生物叢の確立を大幅に変化させることが研究で示されており、帝王切開分娩の抗菌薬予防は日常的に行われている。40組の母子を対象としたRCTでは、予防的抗生物質の投与はへその緒を切る前と後で行われ、そのタイミングが微生物叢の発達に重要であることが判明した(410)。800人以上の小児を対象とした研究では、生後1年間の抗生物質の使用は、その後の神経認知的転帰の低下と関連していた(411)。実際、遺伝子組換え体組成に関連した行動上の困難は、少なくとも10歳まで続く可能性がある(412)。したがって、生後早期の抗生物質への暴露は、微生物叢のコロニー形成と成熟を破壊し、その結果、子供の健康上の不利益をもたらすようである(413)。
リスクがあるのは乳幼児や小児だけではない。14,542人の参加者からなる大規模な前向きコホートでは、中年期の慢性的な抗生物質の使用は、後年の認知障害と関連しており、抗生物質の使用は、抗生物質への曝露がない人と比較して、さらに3年の老化と関連していた(407)。
一方、抗生物質が生物学的GM異常に関連した症状の治療に有用な場合もある。例えば、肝性脳症に起因する認知障害は微生物の障害によってもたらされ、抗生物質の経口投与によって回復することがよく知られている(414-417)。肝性脳症と軽度認知障害の患者に非吸収性抗生物質を投与すると、認知能力、皮質下脳活動、前頭-頭頂連結、血清メタボローム・プロファイルが改善する(418, 419)。
4.2.3.3. 外因性グルココルチコイドとその他の薬物 抗生物質がGMの組成と機能を変化させることはよく知られているが、GMに影響を及ぼし、認知機能障害のリスクとなる可能性のある薬物は他にもいくつかある(420, 421)。外因性グルココルチコイドは、免疫系を抑制し炎症を減少させる作用があるため、多くの疾患の治療に頻繁に処方されている(422)。私たちは、グルココルチコイドがGMに与える影響や、短期的・長期的な認知機能への影響についてざっと理解しているが、より詳細な理解が決定的に必要である。いくつかの研究で、これらの薬物が認知に及ぼす悪影響が強調されている(423-428)。CNSのニューロンで発現するMRとGRに対する内因性、外因性グルココルチコイド過剰は、脳の構造と機能を直接変化させることが示されている(429-431)。さらに、グルココルチコイドは、免疫系、代謝、睡眠、他のホルモン、GMへの作用を通して、間接的に脳を調節する可能性がある(432, 433)。
グルココルチコイドが微生物叢の構成と機能に及ぼす影響については、微生物叢の破壊を示した研究もあれば、有益な効果を示した研究もあり、これはおそらく曝露の程度(量と期間)と研究されたグルココルチコイドの種類に依存するものと思われる(434-437)、 外因性コルチコステロイドの使用は、常に認知に対する有害な影響と関連しているわけではなく、動物やヒトを対象とした研究の中には、関連性を示せなかったものもあれば、コルチコステロイドによる認知機能亢進の証拠を示したものもある(438-443)。グルココルチコイドの生理学的作用は、いくつかの認知システムに曲線的、あるいは「逆U字型」に作用し、中程度の濃度が最適である一方、非常に低濃度または高濃度では、認知に明確な悪影響があるようである(444, 445)。MGB関連疾患におけるコルチコステロイド治療の有害作用と潜在的有用性を明らかにするためには、さらなる研究が必要である。
また、プロトンポンプ阻害薬(PPI)も、認知機能低下と関連することが示されている薬剤群である(446, 447)。結果は様々で、関連性を示さない研究もある。興味深いことに、ヒスタミン2受容体拮抗薬による胃酸の抑制は、慢性的な使用、ディスバイオシス、認知機能低下との関連をより確実に示している(448)。
腸はしばしば化学療法剤の不当な標的であり、粘膜炎は一般的な合併症である(449)。化学療法を受けている乳がんと診断された女性は、GMの多様性および組成の崩壊、認知障害、不安や抑うつなどのストレス症状を経験している(450)。
4.2.3.4. 感染への暴露 当然のことながら、細菌感染とウイルス感染の両方が、ヒトの認知障害や機能低下と関連している(451-453)。C.difficile感染は、急性腸内細菌異常症を越えて、このような健康への悪影響を示す重要な例である(454)。神経変性疾患(例:パーキンソン病、アルツハイマー病)、多発性硬化症、自閉症スペクトラム障害などの脳病態にC. difficileが関与している可能性に関するエビデンスが出てきている(455)。C.ディフィシルはドーパミンの代謝を変化させ、意欲や記憶の定着など、ドーパミンの神経調節作用が関与する認知機能を阻害することが示されている(456)。ヒトにおける2つの症例報告では、FMTはアルツハイマー病患者のC. difficileの除菌とともに、胃腸症状、認知、気分を改善した(457, 458)。
細菌性およびウイルス性の複数の感染性病原体への数年にわたる曝露の累積効果は、認知機能の変化だけでなく、臨床疾患が明らかになる前の多系統の生物学的機能障害と関連していることを示唆する証拠がある(459, 460)。大規模な多民族コホートでは、5つの特定の一般的な病原体(サイトメガロウイルス、ヘリコバクター・ピロリ、単純ヘルペスウイルスなど)への曝露を血清学的に測定した複合指標として定義される感染負荷の上昇が、ミニメンタルステート検査で評価される認知機能障害と関連していた(461, 462)。このように、過去の感染症が後の認知機能障害につながるという累積効果があるようである。さらに、出生前の感染症曝露が認知障害やその他の神経発達障害と関連することを示すヒトにおける広範な証拠がある(463, 464)。
4.2.3.5. プロバイオティクスとプレバイオティクス プロバイオティクス、プレバイオティクス、およびそれらの組み合わせの潜在的な価値が認識されるようになって久しい。これらの介入は、ディスバイオーシスの患者だけでなく、他の特異的な愁訴を呈する患者や予防的に摂取している患者にも有益であろう。
健康な被験者を対象としたいくつかの研究では、認知テストの成績、ストレスの認識、不安、気分の改善とともに、ストレスによって誘発されるコルチゾールレベルと炎症性サイトカインの減少が実証されている(465-469)。数種類のプロバイオティクスを含む発酵乳製品を摂取した健康な女性グループでは、認知に関連する特定の領域で脳活動が亢進していることが判明した(470)。あるRCTでは、多種類のプロバイオティクスの補給は、fMRIを用いた前頭皮質の神経変化から測定すると、健康な女性において急性ストレスの神経認知的影響から保護した(471)。これらの知見は、ストレス、認知、MGB軸の関係を探求する研究によって再現され、さらに拡大されている。これらの研究では、腸および脳における組成的および機能的変化、ならびにストレスを調節することが知られている領域における脳形態、安静時脳機能、脳活動および機能的結合性における明確な変化が同定されている(472, 473)。メカニズム研究により、ストレス反応、認知、MGB軸がさらに関連付けられ、SCFAを産生する繊維分解菌の相対的な多さが示されるとともに、セロトニンとドーパミン-ノルエピネフリン経路の変化が示された(474, 475)。
プロバイオティクスは、アルツハイマー病(476)、線維筋痛症(477、478)、過敏性腸症候群(IBS)(479)など、さまざまなディスバイオシス関連疾患の参加者において、認知症状や生化学的マーカーを改善することが示されている。臨床研究では、プロバイオティクスが不安や抑うつを減少させる可能性も示唆されている(480)。非肥満および肥満の人を対象とした研究では、GM組成は、特定の脳領域(視床、視床下部、扁桃体)における神経活動の有意な変化とともに、認知速度、注意力、柔軟性のスコアと関連していることが判明した(481)。肥満の男女うつ病患者に、L. rhamnosus、B. animalis、塩化マグネシウムを含むプロバイオティクスを9週間共同投与したところ、認知、気分、腸内環境の変化は改善されなかったが、CRP値は低下した(482)。熱殺菌したM.vaccaeを末期の肺がん患者に投与すると、感情的健康と認知機能が改善することが示されたが、これは微生物産物に対する免疫反応の一環として、セロトニンなどの神経伝達物質の放出が促進された結果であると考えられている(483)。
健康な人にプレバイオティクスであるイヌリンを摂取させた研究では、一連の記憶課題のスコア向上とともに、主観的な気分の改善が認められた(484)。別の研究では、健康な被験者にB-GOSサプリメントをプラセボと比較し、起床時の唾液中コルチゾール濃度を低下させ、ドットプローブ課題における情報のポジティブな処理を増加させることが判明した(485)。したがって、プレバイオティクスはHPA軸を調節し、認知に役立つ可能性がある。
Barrioらは、GMと神経認知障害を伴う疾患との関連を検討し、ディスバイオーシスがこれらの疾患の発症を予測し、その病態に影響を及ぼす可能性があることを見出している(486)。さらに、食物繊維の補給やプロバイオティクス(乳酸菌)などの介入は、認知機能を改善し、HPA軸の活性を調節する(コルチゾール反応を低下させる)ことが示されている。
多くのプロバイオティクスの試験では、特に健康な集団で行われた場合、有意な効果が認められないことに注意することが重要である。例えば、L. rhamnosusは、ストレス、HPA反応、炎症、認知機能の改善においてプラセボより優れているとは認められず、著者らは、動物における有望な前臨床研究を臨床に進めることに伴う課題を強調している(487)。注目すべきは、参加者が健康な成人男性であり、ストレス関連疾患の患者ではなかったことである。認知機能と情動行動を向上させるための小児と青年の介入に関する最近の系統的レビューでは、これらの発育中の集団における一貫した効果は限られたものであったが、研究の異質性が主要な要因と考えられた(488)。プレバイオティクス、プロバイオティクス、発酵食品の認知機能への介入の有用性を評価した別の系統的レビューでは、否定的な所見が得られたが、これはおそらく、小規模で短期間の研究の数が限られていたことと、集団、認知検査、介入に関する臨床的不均一性のためであろう(489)。したがって、十分な検出力をもったサンプルと標準化されたプロトコルを用いたさらなる臨床研究が必要である。
4.2.3.6. ストレス 慢性ストレスは、様々な認知障害、全身性炎症、早期老化、免疫系機能障害、糖尿病、心血管疾患、IBDなどの代謝障害に罹患する可能性が高くなることと関連している(490-492)。IBSや機能性ディスペプシアなどの機能性胃腸障害、潰瘍性大腸炎やクローン病などのIBD患者では、ストレスが引き金になると考えられている(493)。これらの疾患では、認知や行動に変化が見られ、生物学的GMプロファイルの異常も認められる。
3T MRIを用いた研究では、健常対照群と比較して、IBD群では視床容積が小さいことが判明した(494)。山岡らは最近、機能的近赤外分光法を用いて、健常人の視床GMとストレス関連脳機能の関係を調べた(495)。その結果、前頭前野のストレス反応とGM微生物の相対的な存在量に相関があり、ストレス反応の高い健常者では、うつ病に関連する微生物の存在量が増加していることがわかった。
IBS患者では認知機能に変化がみられることがあり、海馬を介した視空間記憶障害に特異的な変化が関係するという証拠が得られつつあるが、これはHPA軸機能の指標と関連している(20, 496-498)。IBS患者はまた、認知の柔軟性テストに障害を示し、脳の前頭領 域の脳活動に異常がみられる(499)。
4.3. HPA軸とは独立した腸内細菌叢と認知の関係
腸内細菌叢が認知に重大かつ深い影響を及ぼすことは明らかである。HPA軸は、MGB軸の様々な構成要素と認知機能との関連において中心的な位置を占めているが、研究により、HPA軸とは独立した認知に対するGMの影響が実証されている。さらに、迷走神経、免疫系、微生物代謝産物、ホルモン、神経伝達物質が関与するGMシグナル伝達経路やメカニズムが、HPA軸を介して直接または間接的に認知に影響を及ぼす可能性はあるが、それらの関与は必ずしもHPA軸を必要としないかもしれない(223)。
例えば、Gareauらは無菌マウスにおいて、ストレスの有無にかかわらず、T迷路テストや新奇物体テストにおける記憶の欠如を示した(362)。Frohlichらは、成体マウスに抗生物質を投与し、その結果生じる認知障害は、BDNF、NMDA受容体サブユニット2B、セロトニントランスポーター、NPYの脳領域特異的変化と関連していることを示した(383)。迷走神経刺激は認知プロセスを改善することが示されており、中枢のノルアドレナリン系とGABA系の調節、および扁桃体、海馬、前頭前皮質内のニューロン適応に起因している(500)。微生物はまた、D-乳酸、ホモシステイン、アンモニアなどの神経毒性物質を作り出し、これらはBBBを通過して認知に影響を及ぼす可能性がある(321)。
神経変性疾患の動物モデルでは、HPA軸とは無関係と思われるMGB軸と認知機能との関連が示されている。アルツハイマー病では、CCAAT/エンハンサー結合タンパク質β/アスパラギンエンドペプチダーゼ(C/EBPβ/AEP)シグナルが、βアミロイド前駆体タンパク質とタウの両方を切断することにより、疾患の進行を媒介する。最近の研究では、5xFADアルツハイマー病モデルマウスの脳において、腸内細菌異常がC/EBPβ/AEPのメッセージ伝達と正の相関があり、加齢に伴う疾患の重症度進行と関連していることが示された(501)。抗生物質の慢性投与は、C/EBPβ/AEPシグナル伝達を抑制し、アミロイド形成過程を減少させ、認知機能を回復させた。D-ガラクトース/塩化アルミニウム誘発アルツハイマー病モデルにおいて、セレンナノ粒子を濃縮したL. casei(ATCC 393)を13週間投与すると、認知機能障害が有意に改善し、Akt/cAMP応答エレメント結合タンパク質/BDNFシグナル伝達経路を調節することによって、βアミロイド凝集、Tauタンパク質のリン酸化亢進を最小化し、神経細胞死を予防した(502)。この介入により、腸管バリア機能障害が緩和され、ミクログリアの活性化が抑制され、脳神経細胞が酸化ストレスや神経炎症から保護されることが示された。いくつかの微生物種はアミロイドタンパク質を産生する。アミロイドタンパク質は、炎症によって透過性が高まると腸管やBBBを通過し、脳内でのβアミロイドタンパク質の形成と蓄積を促進し、高齢者のアルツハイマー病発症を促進する(503)。
Sampsonらは、α-シヌクレインというタンパク質を過剰発現させてパーキンソン病を発症させたマウスモデルにおいて、MGB軸シグナル伝達が運動障害、ミクログリアの活性化、シヌクレイン障害に必要であることを示すことができた(75)。無菌のα-シヌクレインマウスにSCFAを経口投与すると、神経炎症と運動機能障害が促進され、パーキンソン病罹患患者とのFMTは、健常人ドナーからのFMTと比較して、パーキンソニズムを増強した。Liuらによる研究では、SCFA酪酸エステルの投与が血管性痴呆モデルマウスの認知障害を改善した(392)。ハンチントン病もまた、精神症状、認知症状、運動症状を伴う神経変性疾患である。野生型マウスからハンチントン病モデルマウスへのFMTは、特に女性において認知機能を改善した(504)。興味深いことに、老化したラットの遺伝子幹細胞を若いラットに移植するだけで、脳の構造的・機能的変化が誘発され、認知機能低下を示す行動変化も誘発された(505)。
食事と食習慣がGMに及ぼす影響は広範なテーマであり、GMの組成と機能の主要な決定要因である。このトピックの包括的なレビューは本総説の範囲を超えているが、GMに好ましい食事を摂取することがGMにプラスの影響を与え、健康状態を改善し、認知機能を向上させることを示す証拠は数多くある(506-510)。これは、プレバイオティクス、プロバイオティクス、SCFA、ポリフェノールが利用できるためと考えられる。逆に、不摂生な食生活や肥満は、遺伝子組み換え食品の変化、認知機能障害、認知症リスクの上昇と関連している[(511)で総説]。提唱されているメカニズムとしては、GMの組成と機能の変化、微生物代謝産物の変化、バリアの完全性の低下、末梢および中枢の炎症プロセス、さらにホルモン、糖調節、心血管系の変化などがある(502, 511, 512)。
肥満では、海馬の機能障害、記憶障害、注意力や実行機能の低下などの認知機能の変化とディスバイオーシスが関連している(513)。注目すべきことに、体重増加や肥満は、食事誘発性の認知機能障害や加齢に伴う認知機能低下には必要ないようである(514, 515)。高脂肪食を与えたドナーのGMをコロニー形成したマウスでは、体重に有意差がないにもかかわらず、微生物叢の組成が異なり、生化学的マーカーが変化し、探索行動、認知行動、定位行動に障害が生じた(516)。食事誘発性肥満マウスでは、抗菌薬投与により代謝パラメーター、脳内のインスリンシグナル伝達、不安や抑うつを示す神経行動学的変化が改善された(517)。これらの変化は、トリプトファン、GABA、BDNF、アミノ酸、アシルカルニチンのレベルの変化と関連していたが、これらの効果はFMTによって無菌マウスに移行可能であった。このように、FMTは、HPA軸とは無関係に、認知機能障害における細菌叢異常の役割について、より直接的な証拠を提供した。
食餌以外にも、他の環境因子がGMの組成や不均一性、さらには行動表現型や認知機能を変化させる可能性がある。Jaricらは、マウスの飼育施設などの微妙な環境変化でも、神経細胞遺伝子のエピジェネティックパターンにクロマチン組織レベルで有意な影響を及ぼし、ヌクレオソームアセンブリ、神経細胞分化、シナプス可塑性、行動制御に影響を及ぼすことを示した(518)。Guoらは、環境中の低線量放射線に被曝したマウスは、認知機能、海馬シナプスの超微細構造、Akt/mTOR経路を介したシグナル伝達に長期的な障害を示すことを示した(519)。実際、GM組成の異常は、がん治療でみられる放射線療法誘発性の認知機能低下に寄与している可能性がある(520)。
次へ
5. 今後の展望
ヒトにおける高次認知機能の発達と維持は、MGB軸の複雑な相互作用の中で、双方向性のHPA軸とGMのメカニズムによって影響を受け、調節されていることは明らかである。これらの関連を認識することで、新たなメカニズムや、GMを基盤とした診断・治療法の可能性について、多くの機会が開かれることになる。現在のエビデンスは有望なものであるが、その根底にあるメカニズムや、認知機能障害を伴う疾患の治療における臨床応用の可能性をよりよく理解するためには、さらなる研究の必要性を認識することが不可欠である。
GMに基づく治療法はエキサイティングな分野であり、注目されているが、GM、HPA軸、神経系の発達のための重要な窓と同様に、そのメカニズム的経路を理解するために厳密な配慮が不可欠である。さまざまな神経疾患においてGMを調節し、認知機能を改善する可能性のある治療戦略としては、FMT、プレバイオティクスやプロバイオティクスの補充、食事介入などが考えられる。
GMは、HPA軸の活性を含む脳機能の形成に重要な役割を果たしているが、HPA軸の明確な構造に関するGMの役割は、まだ十分に研究されていない。最近になってようやく、少数の研究が詳細な機序的洞察を提供し始めた。Xiangらは、GM由来のヌクレオチド結合オリゴマー化ドメイン1(Nod1)リガンドがカテコールアミンの貯蔵と分泌を調節すること、したがって腸内細菌がクロマフィン細胞におけるNod1感知を介して副腎髄質反応を調節することを示した(521)。
副腎皮質外グルココルチコイド産生は、腸や他の組織で起こることが知られており、これらのグルココルチコイドは、局所のホメオスタシス、細胞の発達、免疫活性化を調節する上で非常に特異的な役割を果たしている(522-526)。しかしながら、基礎的な条件下では、GMが腸管グルココルチコイド産生の調節に寄与していることを示す予備的な証拠しか得られていない(527, 528)。
さらに、副腎機能不全とクッシング症候群に関するGMに基づく研究も著しく不足しているが、この総説を通して明らかにされているように、重要な関連性が明らかになる可能性があると考えられる機序的理由はある。副腎不全の最も一般的な原因は自己免疫性アジソン病であり、これは影響を受けやすい遺伝と環境因子の不運な組み合わせであると考えられている。GMが自己免疫性アジソン病の発症や病態に影響を及ぼすかどうかは現在のところ不明である。多くの病原体が副腎皮質に感染することが知られており、そのうちのいくつか(例えば結核菌)は副腎不全を引き起こすことがある(529)。慢性副腎不全患者を対象とした研究では、参加者の30%が、IBSのRome IV基準に一致するような、頻繁に起こる無力な腸の症状に苦しんでおり、QOLが低下していることが強調されている(530)。しかし、この研究ではGMの評価は行われなかった。これら2つのHPA軸疾患については、GMに基づくさらなる研究を優先すべきである。
最後に、多くのヒト疾患がGMの変化と関連していることが次第に明らかになってきている。しかし、これらの変化が因果的なものなのか、結果的なものなのか、あるいは付随的なものなのかは、まだ解明されていない。微生物が宿主の発育や機能にどのような影響を及ぼすかを理解する上で、動物モデルは極めて重要であり、無菌モデルは微生物の擾乱から生じる変化を研究するための礎石であるが、ヒトの機能モデルには直接移行できない可能性がある。ヒトの微生物群集を無菌動物に導入することで、より臨床に即したモデルになる可能性がある。この分野を前進させるためには、厳密かつ批判的なアプローチによってヒトにおける因果関係を明らかにすることに焦点を移し、動物実験や前臨床試験のヒト試験への移植性をさらに高めることが必要である。
結論として、本総説は、微生物とHPA軸を含む内分泌系および神経系との相互作用が、ヒトにおける最適な認知機能にとって不可欠であることを確認した。
次へ
著者寄稿
総説はJRとLDが執筆し、BLが編集した。すべての著者が論文に貢献し、提出されたバージョンを承認した。
次へ
謝辞
LDはNIHのR01DK111848、R01HL148271およびAXA Research Fundの助成を受けた。BLは、2R01 DK104927、R01HL148271およびVA Merit1I01BX00382-01A1の支援を受けている。
こちらへ
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
このページのトップへ
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、あるいはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
次へ
参考文献
D'Argenio V, Salvatore F. The role of the gut microbiome in the healthy adult status. クリンチムアクタ(2015)451:97-102.DOI:10.1016/J.CCA.2015.01.003 [PubMed] [クロスリーフ] [Google Scholar].
Clemente JC, Ursell LK, Parfrey LW, Knight R. The impact of the gut microbiota on human health: an integrative view. セル (2012) 148:1258-70. doi: 10.1016/j.cell.2012.01.035 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Herrema H, IJzerman RG, Nieuwdorp M. Emerging role of intestinal microbiota and microbial metabolites in metabolic control. Diabetologia (2017) 60:613-7. doi: 10.1007/s00125-016-4192-0 [PubMed] [CrossRef] [Google Scholar].
ヒト疾患における腸内細菌叢の役割とメカニズム。また、そのような病態は、腸内細菌叢がヒトの疾病に深く関与していることが示唆された。
Eckburg PB, Bik EM, Bernstein CN, Purdom E, Dethlefsen L, Sargent M, et al. ヒト腸内細菌叢の多様性。Science (2005) 308:1635-8. doi: 10.1126/science.1110591 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ターンボーPJ、レイRE、ハマディM、フレイザー-リゲットCM、ナイトR、ゴードンJI。ヒトマイクロバイオームプロジェクト。Nature (2007) 449:804-10. doi: 10.1038/nature06244 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ヒトマイクロバイオームプロジェクト:健康なヒトマイクロバイオームのためのコミュニティリソース。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
腸内細菌叢は宿主の発生と生理の支配者である。Nat Rev Microbiol (2013) 11:227-38. doi: 10.1038/nrmicro2974 [PubMed] [CrossRef] [Google Scholar].
ウォーカーAW、ダンカンSH、ルイスP、フリントHJ. ヒト腸内細菌叢の系統、培養、メタゲノミクス。トレンド微生物学 (2014) 22:267-74. doi: 10.1016/j.tim.2014.03.001 [PubMed] [CrossRef] [Google Scholar].
Sender R, Fuchs S, Milo R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell (2016) 164:337-40. doi: 10.1016/j.cell.2016.01.013 [PubMed] [CrossRef] [Google Scholar].
キム CY、リー M、ヤン S、キム K、ヨン D、キム HR、et al. ヒトの参照腸内細菌叢のカタログ(アジアの代表的なメタゲノムから新たにアセンブルしたゲノムを含む)。ゲノム医学 (2021) 13:134. doi: 10.1186/s13073-021-00950-7 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Boulangé CL, Neves AL, Chilloux J, Nicholson JK, Dumas ME. 炎症、肥満、代謝性疾患に対する腸内細菌叢の影響。Genome Med (2016) 8:1-12. doi: 10.1186/s13073-016-0303-2 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Nieuwdorp M, Gilijamse PW, Pai N, Kaplan LM. エネルギー調節と代謝におけるマイクロバイオームの役割。Gastroenterology (2014) 146:1525-33. doi: 10.1053/j.gastro.2014.02.008 [PubMed] [CrossRef] [Google Scholar].
Fujimura KE, Lynch SV. アレルギーや喘息における微生物叢と腸内細菌叢との新たな関係。Cell Host Microbe (2015) 17:592-602. doi: 10.1016/j.chom.2015.04.007 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Lane ER, Zisman TL, Suskind DL. 炎症性腸疾患における微生物叢:現状と治療的洞察。J Inflammation Res (2017) 10:63-73. doi: 10.2147/JIR.S116088 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Yurkovetskiy LA, Pickard JM, Chervonsky AV. 微生物叢と自己免疫:新たな道を探る。Cell Host Microbe (2015) 17:548-52. doi: 10.1016/j.chom.2015.04.010 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
de Weerth C. Do bacteria shape our development? crosstalk between intestinal microbiota and HPA axis. Neurosci Biobehav Rev (2017) 83:458-71. doi: 10.1016/j.neubiorev.2017.09.016 [PubMed] [CrossRef] [Google Scholar].
Clarke G, Stilling RM, Kennedy PJ, Stanton C, Cryan JF, Dinan TG. ミニレビュー:腸内細菌叢:無視された内分泌器官。モル内分泌(2014)28:1221-38. doi: 10.1210/me.2014-1108 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
腸内微生物と脳:神経科学のパラダイムシフト。J Neurosci (2014) 34:15490-6. doi: 10.1523/JNEUROSCI.3299-14.2014 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Mayer EA. 腸の感情:腸脳コミュニケーションの新興生物学。Nat Rev Neurosci (2011) 12:453-66. doi: 10.1038/nrn3071 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Carabotti M, Scirocco A, Maselli MA, Severi C. The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems. Ann Gastroenterol(2015)28:203-9。[PMC free article] [PubMed] [Google Scholar].
Burokas A, Moloney RD, Dinan TG, Cryan JF. Microbiota regulation of the mammalian gut-brain axis. (2015) 91:1-62. doi: 10.1016/bs.aambs.2015.02.001 [PubMed] [CrossRef] [Google Scholar].
Chakrabarti A, Geurts L, Hoyles L, Iozzo P, Kraneveld AD, La Fata G, et al. 微生物叢-腸-脳軸:より良い脳の健康への道。我々は何を知っているか、我々は何を調査する必要があり、知識を実践する方法についての視点。この論文では、脳と微生物がどのような関係にあるのか、また、脳と微生物がどのような関係にあるのかを明らかにすることを目的としている。
Rhee SH, Pothoulakis C, Mayer EA. 脳-腸-腸内細菌叢軸の原理と臨床的意義。Nat Rev Gastroenterol Hepatol (2009) 6:306-14. doi: 10.1038/nrgastro.2009.35 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Cryan JF, O'riordan KJ, Cowan CSM, Sandhu KV, Bastiaanssen TFS, Boehme M, et al. 微生物叢-腸-脳軸。Physiol Rev (2019) 99:1877-2013. doi: 10.1152/physrev.00018.2018 [PubMed] [CrossRef] [Google Scholar].
Dinan TG, Cryan JF. 健康および疾患における微生物-腸-脳軸。Gastroenterol Clin North Am (2017) 46:77-89. doi: 10.1016/j.gtc.2016.09.007 [PubMed] [CrossRef] [Google Scholar].
Mirzaei R, Bouzari B, Hosseini-Fard SR, Mazaheri M, Ahmadyousefi Y, Abdi M, et al. 神経系疾患における微生物叢由来の短鎖脂肪酸の役割。BioMed Pharmacother (2021) 139:111661. doi: 10.1016/j.biopha.2021.111661 [PubMed] [CrossRef] [Google Scholar].
Strandwitz P. Neurotransmitter modulation by the gut microbiota. Brain Res (2018) 1693:128-33. doi: 10.1016/j.brainres.2018.03.015 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Tetel MJ, de Vries GJ, Melcangi RC, Panzica G, O'Mahony SM. ステロイド、ストレス、腸内細菌-脳軸。J Neuroendocrinol (2018) 30:e12548. doi: 10.1111/jne.12548 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Staley C, Weingarden AR, Khoruts A, Sadowsky MJ. 腸内細菌叢と胆汁酸代謝との相互作用と疾患状態への影響。Appl Microbiol Biotechnol (2017) 101:47-64. doi: 10.1007/s00253-016-8006-6 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
O'Mahony SM, Clarke G, Borre YE, Dinan TG, Cryan JF. セロトニン、トリプトファン代謝と脳-腸-マイクロバイオーム軸。Doi: 10.1016/j.bbr.2014.07.027 [PubMed] [CrossRef] [Google Scholar].
肥満に伴う低悪性度炎症と2型糖尿病の発症における腸内細菌叢の関与。腸内細菌 (2012) 3:279-88. doi: 10.4161/gmic.19625 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Rutsch A、Kantsjö JB、Ronchi F。腸脳軸:微生物叢と宿主インフラマソームが脳の生理・病理にどのように影響するか。また、そのような病態は、腸内細菌叢と宿主インフラマソームが脳の生理や病態にどのように影響するのかを明らかにした。
Frazier TH, DiBaise JK, McClain CJ. 腸内細菌叢、腸透過性、肥満誘発性炎症、および肝障害。JPEN J Parenter Enteral Nutr (2011) 35:14S-20S. doi: 10.1177/0148607111413772 [PubMed] [CrossRef] [Google Scholar].
Fasano A. 腸透過性、肥満、代謝異常:誰が鶏で誰が卵か?Am J Clin Nutr (2017) 105:3-4. doi: 10.3945/ajcn.116.148338 [PubMed] [CrossRef] [Google Scholar].
Round JL, Mazmanian SK. 腸内細菌叢は健康時と疾患時の腸管免疫応答を形成する。Nat Rev Immunol (2009) 9:313-23. doi: 10.1038/nri2515 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
腸管上皮の病態を解明する。腸管上皮:粘膜免疫の中心的コーディネーター。Trends Immunol (2018) 39:677-96. doi: 10.1016/j.it.2018.04.002 [PubMed] [CrossRef] [Google Scholar].
Wlodarska M, Kostic AD, Xavier RJ. 炎症性腸疾患における微生物-宿主相互作用の統合的見解。Cell Host Microbe (2015) 17:577-91. doi: 10.1016/j.chom.2015.04.008 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
腸内細菌叢、腸内分泌機能と代謝。Curr Opin Pharmacol (2013) 13:935-40. doi: 10.1016/j.coph.2013.09.008 [PubMed] [CrossRef] [Google Scholar].
Valdez-Morales EE, Overington J, Guerrero-Alba R, Ochoa-Cortes F, Ibeakanma CO, Spreadbury I, et al. 下痢優位の過敏性腸症候群患者の大腸生検から得られたメディエーターによる末梢知覚神経の感作:PAR2の役割。下痢優位の過敏性腸症候群患者の大腸生検からのメディエーターによる末梢感覚神経の感作:PAR2の役割。
Forsythe P, Kunze WA. 内側からの声:腸内細菌と中枢神経系。セルモルライフサイ(2013)70:55-69.DOI:10.1007/S00018-012-1028-z [PubMed] [クロスリーフ] [Google Scholar].
Dinan TG, Cryan JF. Gut instincts: Microbiota as a key regulator of brain development, aging and neurodegeneration. J Physiol (2017) 595:489-503. doi: 10.1113/JP273106 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Moloney RD, Desbonnet L, Clarke G, Dinan TG, Cryan JF. マイクロバイオーム:ストレス、健康、病気。Mamm Genome (2014) 25:49-74. doi: 10.1007/s00335-013-9488-5 [PubMed] [CrossRef] [Google Scholar].
善玉菌と中枢神経系の相互作用:認知的側面とメカニズム的考察。論文番号:10.3389/fnins.2021.613120 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
サンプソンTR、マズマニアンSK。マイクロバイオームによる脳の発達、機能、行動の制御。Cell Host Microbe (2015) 17:565-76. doi: 10.1016/j.chom.2015.04.011 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Vuong HE, Yano JM, Fung TC, Hsiao EY. マイクロバイオームと宿主行動。Annu Rev Neurosci (2017) 40:21-49. doi: 10.1146/annurev-neuro-072116-031347 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
(注1)本データはこの書籍が刊行された当時に掲載されていたものです。加齢に伴う認知機能低下と認知症の危険因子としての微生物由来代謝産物。Doi: 10.1186/s13024-022-00548-6 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
メイヤーEA。ストレスと胃腸疾患の神経生物学。腸 (2000) 47:861-9. doi: 10.1136/gut.47.6.861 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Lyte M, Li W, Opitz N, Gaykema RPA, Goehler LE. マウス大腸過形成の原因菌citrobacter rodentiumの感染初期におけるマウスの不安様行動の誘発。このような実験から、大腸肥大症の原因菌であるcitrobacter rodentium(シトロバクター ロデンティウム)の感染初期における不安様行動の誘導を明らかにした。
ゲーラーLE、パークSM、オピッツN、ライテM、ゲイケマRPA. カンピロバクター・ジェジュニの感染はホールボードにおける不安様行動を増加させる:探索行動の粘性感覚調節の解剖学的基質の可能性。このような背景のもと、カンピロバクター・ジェジュニの感染により、ホールボードにおける不安様行動が増加することが示唆された。
須藤直樹、千田陽子、相羽雄一、園田順一、大山直樹、Yu XN, et al. 出生後の微生物コロニー形成は、マウスの視床下部-下垂体-副腎系のストレス応答をプログラムする。J Physiol (2004) 558:263-75. doi: 10.1113/jphysiol.2004.063388 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Forsythe P, Bienenstock J, Kunze WA. 微生物-脳-腸軸コミュニケーションのための迷走神経経路 BT - 微生物内分泌学:健康と疾患における微生物叢-腸-脳軸。Lyte M, Cryan JF, editors. New York, NY: Doi: 10.1007/978-1-4939-0897-4_5 [PubMed] [CrossRef] [Google Scholar].
Geng ZH, Zhu Y, Li QL, Zhao C, Zhou PH. 腸神経系:腸内細菌叢と神経疾患の橋渡し役。また、腸内細菌叢と神経疾患との関連性についても検討した。
Hyland NP, Cryan JF. 微生物と宿主の相互作用:腸内神経系に対する腸内細菌叢の影響。Dev Biol (2016) 417:182-7. doi: 10.1016/j.ydbio.2016.06.027 [PubMed] [CrossRef] [Google Scholar].
ケリーJR、ボレY、オブライエンC、パターソンE、エルアイディS、ディーンJ、ら。憂うつを移す:うつ病に関連する腸内細菌叢は、ラットの神経行動学的変化を誘導する。J Psychiatr Res (2016) 82:109-18. doi: 10.1016/j.jpsychires.2016.07.019 [PubMed] [CrossRef] [Google Scholar].
Mangiola F, Ianiro G, Franceschi F, Fagiuoli S, Gasbarrini G, Gasbarrini A. 自閉症と気分障害における腸内細菌叢。World J Gastroenterol (2016) 22:361-8. doi: 10.3748/wjg.v22.i1.361 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Stilling RM, Dinan TG, Cryan JF. 微生物遺伝子、脳と行動 - 腸脳軸のエピジェネティック制御。Genes Brain Behav (2014) 13:69-86. doi: 10.1111/gbb.12109 [PubMed] [CrossRef] [Google Scholar].
Foster JA, Rinaman L, Cryan JF. ストレスと腸脳軸:マイクロバイオームによる制御。Neurobiol Stress (2017) 7:124-36. doi: 10.1016/j.ynstr.2017.03.001 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Cryan JF, Dinan TG. 腸内細菌叢が脳と行動に及ぼす影響。Nat Rev Neurosci (2012) 13:701-12. doi: 10.1038/nrn3346 [PubMed] [CrossRef] [Google Scholar].
Bercik P, Collins SM, Verdu EF. 微生物と腸脳軸。DOI:10.1111/J.1365-2982.2012.01906.x【PubMed】【CrossRef】【Google Scholar】。
Alcock J, Maley CC, Aktipis CA. 食行動は消化管微生物叢によって操作されるか? 進化的圧力と潜在的メカニズム。Bioessays (2014) 36:940-9. doi: 10.1002/bies.201400071 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Lam YY, Maguire S, Palacios T, Caterson ID. 摂食障害の病因、疾患の進行および治療における腸内細菌叢の役割を見直す。Nutrients (2017) 9(6):602. doi: 10.3390/nu9060602 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Foster JA, McVey Neufeld KA. 腸脳軸:マイクロバイオームが不安やうつにどのように影響するか。トレンド神経科学(2013)36:305-12. doi: 10.1016/j.tins.2013.01.005 [PubMed] [CrossRef] [Google Scholar].
Humann J, Mann B, Gao G, Moresco P, Ramahi J, Loh LN, et al. 細菌ペプチドグリカンは胎盤を通過し、胎児の神経増殖と出生後の異常行動を誘導する。Cell Host Microbe (2016) 19:388-99. doi: 10.1016/j.chom.2016.02.009 [PubMed] [CrossRef] [Google Scholar].
Mayer EA, Padua D, Tillisch K. Altered brain-gut axis in autism: comorbidity or causative mechanisms? Bioessays (2014) 36:933-9. doi: 10.1002/bies.201400075 [PubMed] [CrossRef] [Google Scholar].
宋 毅(Song Y)、劉 慈(Liu C)、ファインゴールド(Finegold SM)。自閉症児の糞便中のクロストリジウムのリアルタイムPCR定量。また、そのような微生 物は、その菌種や性状に依存する可能性があるため、その菌種や性状を特定することは困難である。
Hsiao EY, McBride SW, Hsien S, Sharon G, Hyde ER, McCue T, et al. 微生物叢は、神経発達障害に関連する行動的・生理的異常を調節する。細胞 (2013) 155:1451-63. doi: 10.1016/j.cell.2013.11.024 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Naseribafrouei A, Hestad K, Avershina E, Sekelja M, Linløkken A, Wilson R, et al. ヒトの糞便微生物叢とうつ病との相関。Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc (2014) 26:1155-62. doi: 10.1111/nmo.12378 [PubMed] [CrossRef] [Google Scholar].
Du Y, Gao XR, Peng L, Ge JF. 微生物叢-腸-脳軸とうつ病のクロストーク。また、そのような研究成果は、日本学術振興会特別研究員(PD)、日本学術振興会特別研究員(PD)、日本学術振興会特別研究員(PD)、日本学術振興会特別研究員(PD)、日本学術振興会特別研究員(PD)、日本学術振興会特別研究員(PD)、日本学術振興会特別研究員(PD)、日本学術振興会特別研究員(PD)、日本学術振興会特別研究員(PD)。
腹痛症候群における脳腸軸。doi: 10.1146/annurev-med-012309-103958 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ベリルJW、ギャラッカーJ、フードK、グリーンJT、マシューズSB、キャンベルAK、他。過敏性腸症候群と炎症性腸疾患患者における認知機能の観察研究。神経胃腸薬MotilオフJ欧州胃腸薬学会(2013)25:918-e704.DOI:10.1111/NMO.12219 [PubMed] [クロスリーフ] [Google Scholar].
Simrén M, Barbara G, Flint HJ, Spiegel BMR, Spiller RC, Vanner S, et al. 機能性腸疾患における腸内細菌叢:ローマ財団報告書。腸(2013)62:159-76. doi:10.1136/gutjnl-2012-302167 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Haran JP, Bhattarai SK, Foley SE, Dutta P, Ward DV, Bucci V, et al. アルツハイマー病のマイクロバイオームは、抗炎症性p-糖タンパク質経路の調節障害と関連している。MBio (2019) 10:e00632-19. doi: 10.1128/mBio.00632-19 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
パーキンソン病腸内細菌叢のメタアナリシスから、腸内炎症に関連する変化が示唆された。この論文では、パーキンソン病の腸内細菌叢のメタアナリシスから、腸内炎症に関連する変化が示唆されている。
Sampson TR, Debelius JW, Thron T, Janssen S, Shastri GG, Ilhan ZE, et al. 腸内細菌叢は、パーキンソン病モデルにおける運動障害と神経炎症を制御する。Cell (2016) 167:1469-1480.e12. doi: 10.1016/j.cell.2016.11.018 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Correale J, Hohlfeld R, Baranzini SE. 多発性硬化症における腸内細菌叢の役割。Nat Rev Neurol (2022) 18:544-58. doi: 10.1038/s41582-022-00697-8 [PubMed] [CrossRef] [Google Scholar].
鄭P、曾B、劉M、陳J、潘J、韓Y、他。統合失調症患者の腸内細菌叢は、マウスのグルタミン酸-グルタミン-GABAサイクルと統合失調症関連行動を調節する。Sci Adv (2019) 5:eaau8317. doi: 10.1126/sciadv.aau8317 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Fülling C, Dinan TG, Cryan JF. 腸内微生物から脳へのシグナル伝達:迷走神経で何が起こるか。Neuron (2019) 101:998-1002. doi: 10.1016/j.neuron.2019.02.008 [PubMed] [CrossRef] [Google Scholar].
Jiménez E, Marín ML, Martín R, Odriozola JM, Olivares M, Xaus J, et al. 健康な新生児から採取された糞便は実は無菌なのか?Res微生物(2008)159:187-93. doi: 10.1016/j.resmic.2007.12.007 [PubMed] [CrossRef] [Google Scholar].
ヒトの腸内コロニー形成は胎盤と羊水中の異なる微生物群集によって胎内で開始される可能性がある。Sci Rep (2016) 6:1-13. doi: 10.1038/srep23129 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Frese SA, Mills DA. 乳児腸内細菌叢の誕生:母親は2回出産する!Cell Host Microbe (2015) 17:543-4. doi: 10.1016/j.chom.2015.04.014 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Zeng S, Wang S, Ross RP, Stanton C. The road not taken: host genetics in shaping intergenerational microbiomes. また、そのような遺伝子発現を制御するためには、遺伝子発現を制御する遺伝子の発現を制御する遺伝子の発現を制御する遺伝子の発現を制御する遺伝子の発現を制御する遺伝子の発現を制御する遺伝子の発現を制御する必要がある。
Tamburini S, Shen N, Wu HC, Clemente JC. 早期生活におけるマイクロバイオーム:健康転帰への影響。doi: 10.1038/nm.4142 [PubMed] [CrossRef] [Google Scholar].
ケーニッヒJE、スポールA、スカルフォンN、フリッカーAD、ストンボーJ、ナイトR、ら。発育中の乳児の腸内細菌叢における微生物コンソーシアムの連続性。ProcNatlAcadSciU.S.A.(2011年)108:4578-85. doi: 10.1073/pnas.1000081107 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Yatsunenko T, Rey FE, Manary MJ, Trehan I, Dominguez-Bello MG, Contreras M, et al. ヒトの腸内細菌叢は、年齢や地域によって異なる。Nature (2012) 486:222-7. doi: 10.1038/nature11053 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Hollister EB, Riehle K, Luna RA, Weidler EM, Rubio-Gonzales M, Mistretta T-A, et al. 健康な思春期前の小児腸内細菌叢の構造と機能。doi: 10.1186/s40168-015-0101-x [PMC free article] [PubMed] [CrossRef] [Google Scholar].
腸内細菌叢:思春期の影響。BMC Microbiol (2020) 20:334. doi: 10.1186/s12866-020-02021-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
微生物叢は、ゆりかごから墓場まで生涯にわたって継承される。Nat Rev Microbiol (2022) 20:707-20. doi: 10.1038/s41579-022-00768-z [PubMed] [CrossRef] [Google Scholar].
Meyer K, Lulla A, Debroy K, Shikany JM, Yaffe K, Meirelles O, et al. 中年期の認知機能と腸内細菌叢の関連性。JAMA Netw Open (2022) 5(2):e2143941. doi: 10.1001/jamanetworkopen.2021.43941 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Xu C, Zhu H, Qiu P. ヒト腸内細菌叢の老化進行。BMC Microbiol (2019) 19:236. doi: 10.1186/s12866-019-1616-2 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Jeffery IB, Lynch DB, O'Toole PW. 高齢者における腸内細菌叢の組成と時間的安定性。ISME J (2016) 10:170-82. doi: 10.1038/ismej.2015.88 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Claesson MJ, Jeffery IB, Conde S, Power SE, O'Connor EM, Cusack S, et al. 腸内細菌叢の組成は、高齢者の食事と健康に相関する。Nature (2012) 488:178-84. doi: 10.1038/nature11319 [PubMed] [CrossRef] [Google Scholar].
ClaessonMJ、Cusack S、O'Sullivan O、Greene-Diniz R、de Weerd H、Flannery E、et al. 高齢者の腸内細菌叢の組成、変動性、時間的安定性。ProcNatlAcadSciU.S.A.(2011)108 Suppl 1:4586-91. doi: 10.1073/pnas.1000097107 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
O'Toole PW, Jeffery IB. 腸内細菌叢と老化。Science (2015) 350:1214-5. doi: 10.1126/science.aac8469 [PubMed] [CrossRef] [Google Scholar].
加齢に伴う腸内細菌の変化。新生児から百歳代までの腸内細菌叢組成の加齢変化:横断的研究。BMC Microbiol (2016) 16:90. doi: 10.1186/s12866-016-0708-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Biagi E、Nylund L、Candela M、Ostan R、Bucci L、Pini E、ら。老化を通して、そして超えて:高齢者と百寿者の腸内細菌叢と炎症状態。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Chen Y, Wang H, Lu W, Wu T, Yuan W, Zhu J, et al. ヒト腸内細菌叢の加齢時計は、分類学的および機能的シグネチャーに基づき、多視点学習によって作成された。また、その結果、腸内細菌叢は、ヒトの腸内細菌叢と比較して、その機能的な特徴を明らかにすることができた。
Galkin F, Mamoshina P, Aliper A, Putin E, Moskalev V, Gladyshev VN, et al. また、その結果、腸内細菌叢の老化は、腸内細菌叢の老化を促進し、腸内細菌叢の老化を抑制することが明らかとなった。
Franceschi C, Campisi J. 慢性炎症(inflammaging)とその加齢性疾患への潜在的寄与。J Gerontol A Biol Sci Med Sci (2014) 69 Suppl 1:S4-9. doi: 10.1093/gerona/glu057 [PubMed] [CrossRef] [Google Scholar].
O'Toole PW, Jeffery IB. 高齢者における微生物と健康の相互作用。Cell Mol Life Sci (2018) 75:119-28. doi: 10.1007/s00018-017-2673-z [PubMed] [CrossRef] [Google Scholar].
Jackson MA, Jeffery IB, Beaumont M, Bell JT, Clark AG, Ley RE, et al. 腸内細菌叢における早期虚弱の徴候。Genome Med (2016) 8:8. doi: 10.1186/s13073-016-0262-7 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Liu S, Gao J, Zhu M, Liu K, Zhang H-L. アルツハイマー病における腸内細菌叢とディスバイオシス:病態と治療への示唆。また、そのような病態は、アルツハイマー病と密接に関連していることが示唆されている。
Gorecki AM, Preskey L, Bakeberg MC, Kenna JE, Gildenhuys C, MacDougall G, et al. パーキンソン病における腸内細菌叢の変化と、ヒトαシヌクレイン過剰発現マウスモデルにおけるリポ多糖の影響。Front Neurosci (2019) 13:839. doi: 10.3389/fnins.2019.00839 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Cattaneo A, Cattane N, Galluzzi S, Provasi S, Lopizzo N, Festari C, et al. 認知障害高齢者における脳アミロイドーシスと炎症性腸内細菌分類群および末梢炎症マーカーとの関連。Neurobiol Aging (2017) 49:60-8. doi: 10.1016/j.neurobiolaging.2016.08.019 [PubMed] [CrossRef] [Google Scholar].
Vogt NM, Kerby RL, Dill-McFarland KA, Harding SJ, Merluzzi AP, Johnson SC, et al. アルツハイマー病における腸内細菌叢の変化。Sci Rep (2017) 7:13537. doi: 10.1038/s41598-017-13601-y [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Manderino L, Carroll I, Azcarate-Peril MA, Rochette A, Heinberg L, Peat C, et al. 神経学的に健康な高齢者における腸内細菌叢の組成と認知機能との関連性に関する予備的証拠。J Int Neuropsychol Soc (2017) 23:700-5. doi: 10.1017/S1355617717000492 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Zhuang Z-Q, Shen L-L, Li W-W, Fu X, Zeng F, Gui L, et al. アルツハイマー病患者における腸内細菌叢の変化。J Alzheimers Dis (2018) 63:1337-46. doi: 10.3233/JAD-180176 [PubMed] [CrossRef] [Google Scholar].
佐治直樹、仁井田聡、室谷和彦、久田哲也、都築哲也、杉本哲也、他.腸内細菌叢と認知症の関連性の解析:日本で実施された横断的研究. Sci Rep (2019) 9:1008. doi: 10.1038/s41598-018-38218-7 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Sheng C, Lin L, Lin H, Wang X, Han Y, Liu S-L. 認知機能が低下した成人における腸内細菌叢の変化:SILCODE研究。J Alzheimers Dis (2021) 82:513-26. doi: 10.3233/JAD-210259 [PubMed] [CrossRef] [Google Scholar].
グプタD、モーリーJE。視床下部-下垂体-副腎(HPA)軸と老化。Compr Physiol (2014) 4:1495-510. doi: 10.1002/cphy.c130049 [PubMed] [CrossRef] [Google Scholar].
Lupien SJ, de Leon M, de Santi S, Convit A, Tarshish C, Nair NP, et al. ヒトの加齢に伴うコルチゾールレベルは、海馬の萎縮と記憶障害を予測する。Nat Neurosci (1998) 1:69-73. doi: 10.1038/271 [PubMed] [CrossRef] [Google Scholar].
Hinkelmann K, Moritz S, Botzenhardt J, Muhtz C, Wiedemann K, Kellner M, et al. 大うつ病患者における抗うつ治療中のコルチゾール分泌の変化と認知機能の改善:縦断的研究。PubMed】【CrossRef】【Google Scholar】。
Farzi A, Fröhlich EE, Holzer P. Gut microbiota and the neuroendocrine system. Neurotherapeutics (2018) 15:5-22. doi: 10.1007/s13311-017-0600-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Collins J, Borojevic R, Verdu EF, Huizinga JD, Ratcliffe EM. 腸内細菌叢は腸管神経系の生後早期の発達に影響する。Neurogastroenterol Motil (2014) 26:98-107. doi: 10.1111/nmo.12236 [PubMed] [CrossRef] [Google Scholar].
Borre YE, Moloney RD, Clarke G, Dinan TG, Cryan JF. The impact of microbiota on brain and behavior: mechanisms & therapeutic potential. doi: 10.1007/978-1-4939-0897-4_17 [PubMed] [CrossRef] [Google Scholar].
シャロンG、サンプソンTR、ゲシュウィンドDH、マズマニアンSK。中枢神経系と腸内マイクロバイオーム。Cell (2016) 167:915-32. doi: 10.1016/j.cell.2016.10.027 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Sarkar A, Harty S, Johnson KVA, Moeller AH, Carmody RN, Lehto SM, et al. 社会的行動の神経生物学におけるマイクロバイオームの役割。また、そのような微生物が、社会的行動における神経生物学的役割の一端を担っていることも明らかとなった。
ホン・エス(Hong S)、ベジャ・グラッサー(Beja-Glasser)VF、ンフォノイム(Nfonoyim)BM、フロアン(Frouin)A、リー・エス(Li S)、ラマクリシュナン(Ramakrishnan)S、他。補体とミクログリアは、アルツハイマー病モデルマウスにおける早期のシナプス喪失を媒介する。Science (2016) 352:712-6. doi: 10.1126/science.aad8373 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Wilton DK, Dissing-Olesen L, Stevens B. Neuron-glia signaling in synapse elimination. Annu Rev Neurosci (2019) 42:107-27. doi: 10.1146/annurev-neuro-070918-050306 [PubMed] [CrossRef] [Google Scholar].
Erny D, Hrabě de Angelis AL, Jaitin D, Wieghofer P, Staszewski O, David E, et al. Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci (2015) 18:965-77. doi: 10.1038/nn.4030 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Abdel-Haq R, Schlachetzki JCM, Glass CK, Mazmanian SK. Microbiome-microglia connections via the gut-brain axis. J Exp Med (2019) 216:41-59. doi: 10.1084/jem.20180794 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Borre YE, O'Keeffe GW, Clarke G, Stanton C, Dinan TG, Cryan JF. 微生物叢と神経発達の窓:脳疾患への影響。Trends Mol Med (2014) 20:509-18. doi: 10.1016/j.molmed.2014.05.002 [PubMed] [CrossRef] [Google Scholar].
Luczynski P, Neufeld KAMV, Oriach CS, Clarke G, Dinan TG, Cryan JF. バブルの中で育つ:無菌動物を用いて腸内細菌叢が脳と行動に及ぼす影響を評価する。Int J Neuropsychopharmacol (2016) 19:1-17. doi: 10.1093/ijnp/pyw020 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Heijtz RD, Wang S, Anuar F, Qian Y, Björkholm B, Samuelsson A, et al. 正常な腸内細菌叢は脳の発達と行動を調節する。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
また、そのような疾患に対する治療法として、「腸内細菌叢と腸-脳軸:中枢神経系における新たな治療デザインへの示唆」(eBioMedicine (2022) 77:103908)[PMC free article] [PubMed] [CrossRef] [Google Scholar] がある。
Mudd AT, Berding K, Wang M, Donovan SM, Dilger RN. Serum cortisol mediates the relationship between fecal ruminococcus and brain n-acetylaspartate in the young pig. Gut Microbes (2017) 8:589-600. doi: 10.1080/19490976.2017.1353849 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Fung TC, Olson CA, Hsiao EY. 健康と病気における微生物叢、免疫系、神経系の相互作用。Nat Neurosci (2017) 20:145-55. doi: 10.1038/nn.4476 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Sherwin E, Dinan TG, Cryan JF. 脳の健康と疾患における腸内細菌叢の役割を理解するための最近の進展。Ann N Y Acad Sci (2018) 1420:5-25. doi: 10.1111/nyas.13416 [PubMed] [CrossRef] [Google Scholar].
Calvani R, Picca A, Lo Monaco MR, Landi F, Bernabei R, Marzetti E. Of microbes and minds: a narrative review on the second brain aging. Doi: 10.3389/fmed.2018.00053 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
健康および疾患における短鎖脂肪酸の役割。DOI:10.1016/B978-0-12-800100-4.00003-9【PubMed】【CrossRef】【Google Scholar】。
Stilling RM, van de Wouw M, Clarke G, Stanton C, Dinan TG, Cryan JF. 酪酸の神経薬理学:微生物叢-腸-脳軸のパンとバター?Neurochem Int (2016) 99:110-32. doi: 10.1016/j.neuint.2016.06.011 [PubMed] [CrossRef] [Google Scholar].
Dalile B, Van Oudenhove L, Vervliet B, Verbeke K. The role of short-chain fatty acids in microbiota-gut-brain communication. Nat Rev Gastroenterol Hepatol (2019) 16:461-78. doi: 10.1038/s41575-019-0157-3 [PubMed] [CrossRef] [Google Scholar].
Rifai N, Horvath AR, Wittwer CT. Tietz textbook of clinical chemistry and molecular diagnostics. Sixth Edit. St: Elsevier, Inc; (2018). [Google Scholar].
Buckingham JC, Christian HC, Gillies GE, Philip JG, Taylor AD. 免疫の生理学。In: In: Progress in Brain Research (1996), 331-54. [Google Scholar]
バッキンガムJC。グルココルチコイド:マルチタスクの例。このような場合、脳神経外科の専門医は、脳卒中、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞の治療法について、詳しく解説しています。
スミスSM、ベールWW。ストレスに対する神経内分泌反応における視床下部-下垂体-副腎軸の役割。このようなストレスに対する神経内分泌学的反応には、視床下部-下垂体-副腎軸が関与していることが示唆されている。
Koning ASCAM, Buurstede JC, Van Weert LTCM, Meijer OC. 脳におけるグルココルチコイドおよびミネラルコルチコイド受容体:転写の視点。J Endocr Soc (2019) 3:1917-30. doi: 10.1210/js.2019-00158 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Oster H, Challet E, Ott V, Arvat E, de Kloet ER, Dijk DJ, et al. 循環グルココルチコイドの24時間リズムの機能的および臨床的意義。Endocr Rev (2017) 38:3-45. doi: 10.1210/er.2015-1080 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Strehl C、Ehlers L、Gaber T、Buttgereit F。Glucocorticoids-All-Rounders tackling the versatile players of the immune system. Front Immunol (2019) 10:1744. doi: 10.3389/fimmu.2019.01744 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Tsigos C, Chrousos GP. 視床下部-下垂体-副腎軸、神経内分泌因子とストレス。J Psychosom Res (2002) 53:865-71. doi: 10.1016/S0022-3999(02)00429-4 [PubMed] [CrossRef] [Google Scholar].
Meijer OC, Buurstede JC, Schaaf MJM. Corticosteroid receptors in the brain: transcriptional mechanism for specificity and context-dependent effects. Cell Mol Neurobiol (2019) 39:539-49. doi: 10.1007/s10571-018-0625-2 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Mawdsley JE, Rampton DS. IBDにおける心理的ストレス:発症および治療的意義に関する新たな知見。Gut (2005) 54:1481 LP - 1491. doi: 10.1136/gut.2005.064261 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Pivonello R、Simeoli C、デ-マルティーノMC、コッツォリーノA、デ-レオM、Iacuaniello D、ら。クッシング症候群における精神神経疾患。Doi: 10.3389/fnins.2015.00129 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Anglin RE, Rosebush PI, Mazurek MF. アジソン病の精神神経学的プロフィール:忘れられた現象を再考する。J Neuropsychiatry Clin Neurosci (2006) 18:450-9. doi: 10.1176/jnp.2006.18.4.450 [PubMed] [CrossRef] [Google Scholar].
Misiak B、Łoniewski I、Marlicz W、Frydecka D、Szulc A、Rudzki L、ら。重度の精神疾患におけるHPA軸の調節障害:我々は、腸内細菌叢に責任をシフトすることができますか?Prog Neuropsychopharmacol Biol Psychiatry (2020) 102:1-9. doi: 10.1016/j.pnpbp.2020.109951 [PubMed] [CrossRef] [Google Scholar].
Gur TL, Palkar AV, Rajasekera T, Allen J, Niraula A, Godbout J, et al. 出生前のストレスは、成人男性の子孫における社会的行動、皮質神経生物学、および常在微生物を破壊する。Behav Brain Res (2019) 359:886-94. doi: 10.1016/j.bbr.2018.06.025 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Zijlmans MAC, Korpela K, Riksen-Walraven JM, de Vos WM, de Weerth C. Maternal prenatal stress is associated with the infant intestinal microbiota. Psychoneuroendocrinology (2015) 53:233-45. doi: 10.1016/j.psyneuen.2015.01.006 [PubMed] [CrossRef] [Google Scholar].
Jang H-M, Lee K-E, Lee H-J, Kim D-H. Immobilization stress-induced escherichia coli caused anxiety by induced NF-κB activation through gut microbiota disturbance. Sci Rep (2018) 8:1-14. doi: 10.1038/s41598-018-31764-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
マニアムJ、アントニアディスC、モリスMJ。早生期のストレス、HPA軸の適応、および後の健康転帰に寄与するメカニズム。Doi: 10.3389/fendo.2014.00073 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
de Kloet ER, Joëls M, Holsboer F. Stress and the brain: from adaptation to disease. Nat Rev Neurosci (2005) 6:463-75. doi: 10.1038/nrn1683 [PubMed] [CrossRef] [Google Scholar].
グルココルチコイドレセプターは、グルココルチコイドの受容体である。The glucocorticoid receptor in cardiovascular health and disease. Cells (2019) 8:1227. doi: 10.3390/cells8101227 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Karemaker JM. 自律神経機能入門。Physiol Meas (2017) 38:R89-R118. doi: 10.1088/1361-6579/aa6782 [PubMed] [CrossRef] [Google Scholar].
Wehrwein EA, Orer HS, Barman SM. 自律神経系の解剖学、生理学、薬理学の概要。Compr Physiol (2016) 6:1239-78. doi: 10.1002/cphy.c150037 [PubMed] [CrossRef] [Google Scholar].
Browning KN, Travagli RA. 消化管運動と分泌の中枢神経系制御と消化管機能の調節。In: Comprehensive physiology (2014) 4(4):1339-68. doi: 10.1002/cphy.c130055 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
腸/脳軸と微生物叢。J Clin Invest (2015) 125:926-38. doi: 10.1172/JCI76304 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Rao M, Gershon MD. 腸とその先:神経疾患における腸神経系。Nat Rev Gastroenterol Hepatol (2016) 13:517-28. doi: 10.1038/nrgastro.2016.107 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Furness JB, Callaghan BP, Rivera LR, Cho H-J. 腸神経系と消化管神経支配:統合された局所および中枢制御 BT - 微生物内分泌学:健康と疾患における微生物叢-腸-脳軸。In: 実験医学と生物学の進歩Lyte M、Cryan JF、編集者。New York, NY: 論文名:「微生物内分泌学:健康-腸-脳軸と疾患」(PubMed) [CrossRef] [Google Scholar].
フレミングMA、エハンL、ムーアSR、レビンDE。腸神経系と治療標的としての新たな役割。また、そのような疾患は、その病態や病態に応じた適切な治療が必要であり、そのような病態は、その病態や病態に応じた適切な治療が必要である。
精神疾患および炎症性疾患における脳腸軸のモジュレーターとしての迷走神経。Doi: 10.3389/fpsyt.2018.00044 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Bohórquez DV, Shahid RA, Erdmann A, Kreger AM, Wang Y, Calakos N, et al. 感覚性腸内分泌細胞の神経支配によって形成される神経上皮回路。J Clin Invest (2015) 125:782-6. doi: 10.1172/JCI78361 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
腸神経系: 「腸の中の小さな脳。Neuroforum (2020) 26:31-42 doi: 10.1515/nf-2019-0027 [CrossRef] [Google Scholar].
McVey Neufeld KA, Perez-Burgos A, Mao YK, Bienenstock J, Kunze WA. 腸内細菌叢は、無菌マウスにおいて、カルビンジンの変化を伴う固有および外在神経機能を回復させる。Neurogastroenterol Motil (2015) 27:627-36. doi: 10.1111/nmo.12534 [PubMed] [CrossRef] [Google Scholar].
Kabouridis PS, Lasrado R, McCallum S, Chng SH, Snippert HJ, Clevers H, et al. Microbiota controls the homeostasis of glial cells in the gut lamina propria. Neuron (2015) 85:289-95. doi: 10.1016/j.neuron.2014.12.037 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
矢野JM、Yu K、Donaldson GP、Shastri GG、Ann P、Ma L、et al. 腸内細菌叢の常在細菌は宿主のセロトニン生合成を制御する。Cell (2015) 161:264-76. doi: 10.1016/j.cell.2015.02.047 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Muller PA, Schneeberger M, Matheis F, Wang P, Kerner Z, Ilanges A, et al. 微生物叢は、腸-脳回路を介して交感神経ニューロンを調節する。Nature (2020) 583:441-6. doi: 10.1038/s41586-020-2474-7 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
小畑由美子、カスタニョ、ボーイングS、ボン=フラウシュAC、ファングC、ファレセンT、他。微生物叢による神経細胞プログラミングが腸の生理機能を制御している。Nature (2020) 578:284-9. doi: 10.1038/s41586-020-1975-8 [PubMed] [CrossRef] [Google Scholar].
Browning KN, Verheijden S, Boeckxstaens GE. 食欲調節、気分、腸の炎症における迷走神経。Gastroenterology (2017) 152:730-44. doi: 10.1053/j.gastro.2016.10.046 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Kaelberer MM, Buchanan KL, Klein ME, Barth BB, Montoya MM, Shen X, et al. 栄養感覚伝達のための腸脳神経回路。Science (2018) 361:eaat5236. doi: 10.1126/science.aat5236 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Bonaz B, Sinniger V, Pellissier S. The vagus nerve in the neuro-immune axis: implications in the pathology of the gastrointestinal tract. Doi: 10.3389/fimmu.2017.01452 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Goverse G, Stakenborg M, Matteoli G. The intestinal cholinergic anti-inflammatory pathway. J Physiol (2016) 594:5771-80. doi: 10.1113/JP271537 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ハンセンMK、オコナーKA、ゲーラーLE、ワトキンスLR、マイアーSF。インターロイキン-1β誘発発熱における迷走神経の寄与は投与量に依存する。このような場合、「熱中症」と呼ばれることが多いようです。
Marquette C, Linard C, Galonnier M, van Uye A, Mathieu J, Gourmelon P, et al. 部分照射後のラット脳におけるIL-1β、TNFαおよびIL-6の誘導:迷走神経求心性の役割。Int J Radiat Biol (2003) 79:777-85. doi: 10.1080/09553000310001610998 [PubMed] [CrossRef] [Google Scholar].
de La Serre CB, de Lartigue G, Raybould HE. 低用量の細菌性リポ多糖への慢性曝露は、迷走神経求心性ニューロンにおけるレプチンシグナル伝達を阻害する。Physiol Behav (2015) 139:188-94. doi: 10.1016/j.physbeh.2014.10.032 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Goehler LE, Gaykema RPA, Hansen MK, Anderson K, Maier SF, Watkins LR. 迷走神経免疫-脳連絡:内臓化学感覚経路。このような脳内情報伝達の仕組みは、免疫系と脳内の情報伝達経路をつなぐ重要な役割を担っている。
サイトカインと神経免疫内分泌相互作用:視床下部-下垂体-副腎回転軸の役割。J Neuroimmunol (2002) 133:1-19. doi: 10.1016/S0165-5728(02)00357-0 [PubMed] [CrossRef] [Google Scholar].
Silverman MN, Pearce BD, Biron CA, Miller AH. ウイルス感染時の視床下部-下垂体-副腎(HPA)軸の免疫調節。ウイルス免疫 (2005) 18:41-78. doi: 10.1089/vim.2005.18.41 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ベリンジャーDL、ミラーBA、ペレスS、カーターJ、ウッドC、ThyagaRajan S、ら。免疫の交感神経調節:疾患との関連性。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
迷走神経求心性および中枢自律神経経路の活性化:カンピロバクター・ジェジュニの腸内感染に対する初期反応。脳行動免疫 (2005) 19:334-44. doi: 10.1016/j.bbi.2004.09.002 [PubMed] [CrossRef] [Google Scholar].
Cailotto C, Costes LMM, van der Vliet J, VAN Bree SHW, VAN Heerikhuize JJ, Buijs RM, et al. 腸における迷走神経性抗炎症反射の存在を示す神経解剖学的証拠。このような、腸における迷走神経性抗炎症反射の存在を示す神経解剖学的証拠。
ボロビコバLV、イワノバS、張M、ヤンH、Botchkina GI、ワトキンスLR、ら。迷走神経刺激はエンドトキシンに対する全身性炎症反応を減衰させる。Nature (2000) 405:458-62. doi: 10.1038/35013070 [PubMed] [CrossRef] [Google Scholar].
Tracey KJ. 炎症反射。Nature (2002) 420:853-9. doi: 10.1038/nature01321 [PubMed] [CrossRef] [Google Scholar].
Tracey KJ. 免疫の反射制御。Nat Rev Immunol (2009) 9:418-28. doi: 10.1038/nri2566 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Suarez AN, Hsu TM, Liu CM, Noble EE, Cortella AM, Nakamoto EM, et al. 腸迷走神経感覚シグナルは、多次経路を介して海馬機能を制御する。Nat Commun (2018) 9:2181. doi: 10.1038/s41467-018-04639-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
クラークKB、スミスDC、ハサートDL、ブラウニングRA、成徳DK、ジェンセンRA。迷走神経求心性神経の訓練後電気刺激と迷走神経遠心性神経の不活性化を併用すると、ラットの記憶保存過程が促進される。このような場合、脳神経外科医に相談する必要がある。
クラークKB、成徳DK、スミスDC、ブラウニングRA、ジェンセンRA。ヒト被験者における迷走神経刺激後の認識記憶の増強。このような場合、「神経科学」(Nat Neurosci)(1999)2:94-8.
Follesa P, Biggio F, Gorini G, Caria S, Talani G, Dazzi L, et al. 迷走神経刺激は、ラット脳におけるノルエピネフリン濃度とBDNFおよびbFGFの遺伝子発現を増加させる。脳科学 (2007) 1179:28-34. doi: 10.1016/j.brainres.2007.08.045 [PubMed] [CrossRef] [Google Scholar].
ビッジョF、ゴリーニG、Utzeri C、Olla P、Marrosu F、Mocchetti I、ら。慢性迷走神経刺激は、ラットの海馬におけるニューロン可塑性を誘導する。Doi: 10.1017/S1461145709000200 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
NobleEE、Billington CJ、Kotz CM、Wang C. The lighter side of BDNF. Am J Physiol Integr Comp Physiol (2011) 300:R1053-69. doi: 10.1152/ajpregu.00776.2010 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Neufeld KM, Kang N, Bienenstock J, Foster JA. 神経性胃腸症(Neurogastroenterol):神経性胃腸症は、神経性胃腸症が原因で発症すると考えられている。Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc (2011) 23:255-64, e119. doi: 10.1111/j.1365-2982.2010.01620.x [PubMed] [CrossRef] [Google Scholar].
Bravo JA, Julio-Pieper M, Forsythe P, Kunze W, Dinan TG, Bienenstock J, et al. 消化管細菌と神経系のコミュニケーション。この論文では、胃腸細菌と神経系のコミュニケーションについて解説している。
Bravo JA, Forsythe P, Chew MV, Escaravage E, Savignac HM, Dinan TG, et al. 乳酸菌の摂取は、迷走神経を介してマウスの情動行動と中枢性GABA受容体の発現を制御する。この論文では、乳酸菌の摂取が迷走神経を介してマウスの情動行動と中枢性GABA受容体の発現を制御することを明らかにした。
Bercik P, Park AJ, Sinclair D, Khoshdel A, Lu J, Huang X, et al. ビフィズス菌NCC3001の抗不安作用は、腸と脳のコミュニケーションに迷走神経経路が関与している。また、腸内環境の改善により、腸内環境が改善される可能性があります。
バスケスE、バランコA、ラミレスM、Gruart A、デルガド-ガルシアJM、ヒメネスML、ら。食餌性2'-フコシラクトースは、げっ歯類の迷走神経を介した腸-脳コミュニケーションを介して、オペラント条件付けと長期増強を増強する。PLoS ONE (2016) 11(11):e0166070. doi: 10.1371/journal.pone.0166070 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
血液脳関門を通過するアミノ酸の輸送。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Gao K, Pi Y, Mu C-L, Peng Y, Huang Z, Zhu W-Y. Antibiotics-induced modulation of large intestinal microbiota altered aromatic amino acid profile and expression of neurotransmitters in the hypothalamus of piglets. J Neurochem (2018) 146:219-34. doi: 10.1111/jnc.14333 [PubMed] [CrossRef] [Google Scholar].
藤坂 聡、Avila-Pacheco J、Soto M、Kostic A、Dreyfuss JM、Pan H、et al. Diet, genetics, and the gut microbiome drive dynamic changes in plasma metabolites. Cell Rep (2018) 22:3072-86. doi: 10.1016/j.celrep.2018.02.060 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Agus A, Planchais J, Sokol H. Gut microbiota regulation of tryptophan metabolism in health and disease. Cell Host Microbe (2018) 23:716-24. doi: 10.1016/j.chom.2018.05.003 [PubMed] [CrossRef] [Google Scholar].
Kennedy PJ, Cryan JF, Dinan TG, Clarke G. Kynurenine pathway metabolism and the microbiota-gut-brain axis. Neuropharmacology (2017) 112:399-412. doi: 10.1016/j.neuropharm.2016.07.002 [PubMed] [CrossRef] [Google Scholar].
Stone TW, Forrest CM, Darlington LG. 神経保護の治療戦略としてのキヌレニン経路阻害。FEBS J (2012) 279:1386-97. doi: 10.1111/j.1742-4658.2012.08487.x [PubMed] [CrossRef] [Google Scholar].
ラディックJP、エバンスAK、ナットDJ、ライトマンSL、ルックGAW、ローリーCA。中枢神経系におけるトリプトファン代謝:医学的意義。この論文では、中枢神経系におけるトリプトファンの代謝とその医学的意義について解説している。
Gao J, Xu K, Liu H, Liu G, Bai M, Peng C, et al. トリプトファン代謝が介在する腸管免疫における腸内細菌叢の影響。Front Cell Infect Microbiol (2018) 8:13. doi: 10.3389/fcimb.2018.00013 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Lamas B, Hernandez-Galan L, Galipeau HJ, Constante M, Clarizio A, Jury J, et al. セリアック病では腸内細菌叢によるアリール炭化水素受容体リガンド産生が低下し、腸炎を引き起こす。Sci Transl Med (2020) 12:eaba0624. doi: 10.1126/scitranslmed.aba0624 [PubMed] [CrossRef] [Google Scholar].
微生物群集における細胞間シグナルとしてのインドール。FEMS Microbiol Rev (2010) 34:426-44. doi: 10.1111/j.1574-6976.2009.00204.x [PubMed] [CrossRef] [Google Scholar].
Li G, Young KD. インドール産生酵素TnaAによるインドール産生は外因性トリプトファンの量によって決定される。Microbiology (2013) 159:402-10. doi: 10.1099/mic.0.064139-0 [PubMed] [CrossRef] [Google Scholar].
Roth W, Zadeh K, Vekariya R, Ge Y, Mohamadzadeh M. Tryptophan metabolism and gut-brain homeostasis. Int J Mol Sci (2021) 22:2973. doi: 10.3390/ijms22062973 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Bosi、Banfi D、Bistoletti M、Giaroni C、Baj A.微生物叢-腸-脳軸に沿ってトリプトファン代謝産物:健康と疾患における腸に影響を与える細胞間コミュニケーションシステム。トリプトファンの代謝産物:健康・疾病における腸内環境を左右する細胞間情報伝達システム」(Int J Tryptophan Res (2020) 13:1178646920928984.
Kiser D, Steemers B, Branchi I, Homberg JR. セロトニンと社会的行動の相互作用。神経生物学 (2012) 36:786-98. doi: 10.1016/j.neubiorev.2011.12.009 [PubMed] [CrossRef] [Google Scholar].
Homberg JR. セロトニンと意思決定プロセス。神経科学 (2012) 36:218-36. doi: 10.1016/j.neubiorev.2011.06.001 [PubMed] [CrossRef] [Google Scholar].
Schwarcz R, Bruno JP, Muchowski PJ, Wu H-Q. 哺乳類の脳におけるキヌレニン:生理学と病理学が出会うとき。Nat Rev Neurosci (2012) 13:465-77. doi: 10.1038/nrn3257 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Szalardy L, Zadori D, Toldi J, Fulop F, Klivenyi P, Vecsei L. 脳内のキヌレン酸レベルの操作-神経保護と認知機能障害の境界で。Doi:10.2174/1568026611209061797[PubMed][CrossRef][Googleスカラー]。
Serotonergic Signaling: Multiple Effectors and Pleiotropic Effects. Wiley Interdiscip Rev Membr Transp Signal (2012) 1:685-713. doi: 10.1002/wmts.50 [CrossRef] [Google Scholar].
Mawe GM, Hoffman JM. 腸におけるセロトニンシグナル伝達-機能、機能障害、治療標的。Nat Rev Gastroenterol Hepatol (2013) 10:473-86. doi: 10.1038/nrgastro.2013.105 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Fung TC, Vuong HE, Luna CDG, Pronovost GN, Aleksandrova AA, Riley NG, et al. 腸内セロトニンとフルオキセチン曝露は、腸内細菌のコロニー形成を調節する。Nat Microbiol (2019) 4:2064-73. doi: 10.1038/s41564-019-0540-4 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
秦 毅、浅野恭子、吉原和彦、木村戸谷哲也、宮田直樹、Zhang X-T, et al. マウスにおける常在細菌叢による腸管内腔セロトニンの制御. PloS One (2017) 12:e0180745. doi: 10.1371/journal.pone.0180745 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
セロトニンの拡張生物学. セロトニンの拡大生物学。
Carrasco GA, Van de Kar LD. ストレスの神経内分泌薬理学。Eur J Pharmacol (2003) 463:235-72. doi: 10.1016/s0014-2999(03)01285-8 [PubMed] [CrossRef] [Google Scholar].
Heisler LK, Pronchuk N, Nonogaki K, Zhou L, Raber J, Tung L, et al. セロトニンは、セロトニン2C受容体刺激を介して視床下部-下垂体-副腎軸を活性化する。このような背景から、セロトニン2C受容体刺激による視床下部-下垂体-副腎軸の活性化作用が注目されている。
太田紘一、三木俊一、割田和彦、鈴木聡、日下俊一、矢倉俊一、他.長期の母子分離は初期脳発達におけるセロトニン作動系を乱す。Int J Dev Neurosci Off J Int Soc Dev Neurosci (2014) 33:15-21. doi: 10.1016/j.ijdevneu.2013.10.007 [PubMed] [CrossRef] [Google Scholar].
Sood A, Pati S, Bhattacharya A, Chaudhari K, Vaidya VA. 母子分離後の5-HT(2A)受容体誘発行動、神経活性化、遺伝子発現の変化の早期出現。Int J Dev Neurosci Off J Int Soc Dev Neurosci (2018) 65:21-8. doi: 10.1016/j.ijdevneu.2017.10.005 [PubMed] [CrossRef] [Google Scholar].
Huang Y, Xu H, Li H, Yang H, Chen Y, Shi X. 妊娠前ストレスは胎仔ラットの脳における5-HTに対する5-HIAAの比率と5-HT1A受容体およびセロトニントランスポーターの発現を低下させる。また、妊娠前ストレスが5-HT1A受容体およびセロトニントランスポーターの発現を低下させることも示唆されている。
Gershon MD, Tack J. セロトニンシグナル伝達系:機能性消化管障害の基礎的理解から薬剤開発まで. Gastroenterology (2007) 132:397-414. doi: 10.1053/j.gastro.2006.11.002 [PubMed] [CrossRef] [Google Scholar].
Reigstad CS, Salmonson CE, Rainey JF, 3rd, Szurszewski JH, Linden DR, Sonnenburg JL, et al. 腸の微生物は、エンテロクロマフィン細胞上の短鎖脂肪酸の効果を通じて大腸セロトニン産生を促進する。FASEB J Off Publ Fed Am Soc Exp Biol (2015) 29:1395-403. doi: 10.1096/fj.14-259598 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, et al. Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites. この論文では、腸内細菌が哺乳類の血中代謝産物に与える影響について、メタボロミクス解析により明らかにした。
Desbonnet L, Garrett L, Clarke G, Bienenstock J, Dinan TG. プロバイオティクスのビフィズス菌:ラットにおける潜在的抗うつ特性の評価。J Psychiatr Res (2008) 43:164-74. doi: 10.1016/j.jpsychires.2008.03.009 [PubMed] [CrossRef] [Google Scholar].
Eisenhofer G, Kopin IJ, Goldstein DS. カテコールアミンの代謝:生理学と医学に示唆する現代の見解。Doi: 10.1124/pr.56.3.1 [PubMed] [CrossRef] [Google Scholar].
Borodovitsyna O, Flamini M, Chandler D. Noradrenergic modulation of cognition in health and disease. Neural Plast (2017) 2017:6031478. doi: 10.1155/2017/6031478 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Herman JP, McKlveen JM, Ghosal S, Kopp B, Wulsin A, Makinson R, et al. 視床下部-下垂体-副腎皮質ストレス応答の制御。Compr Physiol (2016) 6(2):603-21. doi: 10.1002/cphy.c150015 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Lyte M, Vulchanova L, Brown DR. 腸管表面におけるストレス:カテコールアミンと粘膜-細菌相互作用。細胞組織研究 (2011) 343:23-32. doi: 10.1007/s00441-010-1050-0 [PubMed] [CrossRef] [Google Scholar].
Sperandio V, Torres AG, Jarvis B, Nataro JP, Kaper JB. 細菌と宿主のコミュニケーション:ホルモンの言語。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
カテコールアミンによるグラム陰性菌の増殖。Life Sci (1992) 50:203-12. doi: 10.1016/0024-3205(92)90273-r [PubMed] [CrossRef] [Google Scholar].
浅野恭子、平本哲也、西野亮廣、相羽洋一、木村哲也、吉原和彦、他.マウスの腸管内腔における生物学的に活性な遊離カテコールアミンの産生における腸内細菌叢の重要な役割。また、腸内細菌叢はカテコールアミンの産生に重要な役割を担っていることを明らかにした。
Jiménez-Balado J, Eich TS. ヒトの老化とアルツハイマー病におけるGABA作動性機能障害、神経ネットワーク亢進と記憶障害。また、そのような疾患は、神経回路網の亢進や記憶障害に関与していることが示唆されている。
Miklós IH, Kovács KJ. コルチコトロピン放出ホルモン(CRH)分泌傍細胞ニューロンのGABA神経支配とその可塑性を定量的免疫電子顕微鏡で示す。神経科学 (2002) 113:581-92. doi: 10.1016/s0306-4522(02)00147-1 [PubMed] [CrossRef] [Google Scholar].
HPA軸とHPG軸のGABA作動性制御と生殖機能に対するストレスの影響。J Steroid Biochem Mol Biol (2016) 160:196-203. doi: 10.1016/j.jsbmb.2015.11.019 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Strandwitz P, Kim KH, Terekhova D, Liu JK, Sharma A, Levering J, et al. ヒト腸内細菌叢のGABA調節細菌。Nat Microbiol (2019) 4:396-403. doi: 10.1038/s41564-018-0307-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ティリッシュK、メイヤーEA、グプタA、ギルZ、Brazeilles R、ルネヴェB、ら。健康な女性における腸内細菌プロファイルと関連した情動刺激に対する脳構造と反応。Psychosom Med (2017) 79:905-13. doi: 10.1097/PSY.000000000493 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Frost G, Sleeth ML, Sahuri-Arisoylu M, Lizarbe B, Cerdan S, Brody L, et al. 短鎖脂肪酸酢酸は、中枢性恒常性維持機構を介して食欲を低下させる。Nat Commun (2014) 5:3611. doi: 10.1038/ncomms4611 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Cani PD, Plovier H, Van Hul M, Geurts L, Delzenne NM, Druart C, et al. エンドカンナビノイド-腸内細菌叢と宿主代謝の間の交差点で。Nat Rev Endocrinol (2016) 12:133-43. doi: 10.1038/nrendo.2015.211 [PubMed] [CrossRef] [Google Scholar].
Cristino L, Bisogno T, Di Marzo V. Cannabinoids and the expanded endocannabinoid system in neurological disorders. Nat Rev Neurol (2020) 16:9-29. doi: 10.1038/s41582-019-0284-z [PubMed] [CrossRef] [Google Scholar].
Alger BE. シナプス伝達の制御における逆行性シグナル:エンドカンナビノイドを中心に。このような研究は、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学、神経生物学の分野で広く行われている。
Micale V, Drago F. Endocannabinoid system, stress and HPA axis. Eur J Pharmacol (2018) 834:230-9. doi: 10.1016/j.ejphar.2018.07.039 [PubMed] [CrossRef] [Google Scholar].
Zanettini C, Panlilio LV, Alicki M, Goldberg SR, Haller J, Yasar S. Effects of endocannabinoid system modulation on cognitive and emotional behavior. この論文では、「認知行動と情動行動におけるカンナビノイド系調節の効果」(PMC free article) [PubMed] [CrossRef] [Google Scholar] をテーマに、認知行動と情動行動におけるカンナビノイド系調節の効果について考察している。
ムッチョリGG、ナスレンD、Bäckhed F、Reigstad CS、ランバートDM、デルゼンヌNM、ら。エンドカンナビノイド系は、腸内細菌叢と脂肪形成を結びつける。この論文では、腸内カンナビノイドシステムが脂肪形成と腸内細菌叢を結びつけていることを明らかにした。
ドヌヴィートG、ナスSR、ウィルカーソンJL、カリーZA、シュルマンLD、キンゼイSG、ら。内因性カンナビノイド系:炎症性疼痛および神経因性疼痛を治療するための標的の芽生え。Neuropsychopharmacol Off Publ Am Coll Neuropsychopharmacol (2018) 43:52-79. doi: 10.1038/npp.2017.204 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Wang J, Ueda N. 代謝制御におけるエンドカンナビノイド系の役割. Curr Opin Nephrol Hypertens (2008) 17:1-10. doi: 10.1097/MNH.0b013e3282f29071 [PubMed] [CrossRef] [Google Scholar].
ストレス応答と代謝の制御におけるマイクロバイオームと腸内カンナビノイド系。また、そのような病態は、「病態」と「病態の関連性」、「病態と病態の関連性」、「病態と病態の関連性」、「病態と病態の関連性」、「病態と病態の関連性」、「病態と病態の関連性」、「病態と病態の関連性」の3つの観点から評価することができる。
Endocannabinoid signaling and the hypothalamic-Pituitary-Adrenal axis. Compr Physiol (2016) 7:1-15. doi: 10.1002/cphy.c160005 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Cuddihey H, MacNaughton WK, Sharkey KA. 腸管ホメオスタシスの制御におけるエンドカンナビノイド系の役割。また、そのような病態を改善するために必要な治療法も紹介されています。
Zou S, Kumar U. Cannabinoid receptors and the endocannabinoid system: signaling and function in the central nervous system. Int J Mol Sci (2018) 19:833. doi: 10.3390/ijms19030833 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
de Vos WM, Tilg H, Van Hul M, Cani PD. 腸内細菌と健康:メカニズム的洞察。Gut (2022) 71:1020-32. doi: 10.1136/gutjnl-2021-326789 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Manca C, Boubertakh B, Leblanc N, Deschênes T, Lacroix S, Martin C, et al. ジャームフリーマウスは、腸内カンナビノイドームシグナル伝達の腸内細菌叢依存的な深い変化を示す。J Lipid Res (2020) 61:70-85. doi: 10.1194/jlr.RA119000424 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Vijay A, Kouraki A, Gohir S, Turnbull J, Kelly A, Chapman V, et al. 細菌性短鎖脂肪酸の抗炎症作用は、部分的にエンドカンナビノイドによって媒介される。腸内細菌 (2021) 13:1997559. doi: 10.1080/19490976.2021.1997559 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Markey L, Hooper A, Melon LC, Baglot S, Hill MN, Maguire J, et al. 常在菌であるカンジダ・アルビカンスのコロニー形成は、エンドカナビノイドシグナル伝達の調節異常を通じて腸脳軸を撹乱する。この論文では、カンジダ・アルビカンスによる腸内細菌コロニー形成が、エンドカンナビノイドシグナル伝達異常を介して腸脳軸を変化させることを明らかにした。
Bisogno T, Lauritano A, Piscitelli F. エンドカンナビノイド系:アルツハイマー病と腸内細菌叢の架け橋。ライフ(2021)11:1-18. doi: 10.3390/life11090934 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Cohen LJ, Esterhazy D, Kim S-H, Lemetre C, Aguilar RR, Gordon EA, et al. 常在細菌は、ヒトのシグナル伝達分子を模倣したGPCRリガンドを作る。Nature (2017) 549:48-53. doi: 10.1038/nature23874 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
健康および疾患における微生物叢と免疫の相互作用。Cell Res (2020) 30:492-506. doi: 10.1038/s41422-020-0332-7 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
乳幼児における腸内細菌叢と免疫系との複雑な関連と疾患。また、そのような疾患は、腸内細菌叢と免疫系との間に複雑な関連性があることが示唆された。
ネギ S、ダス DK、パハリ S、ナディーム S、アグレワラ JN. 自然免疫記憶の誘導と制御における腸内細菌叢の潜在的役割。Front Immunol (2019) 10:2441. doi: 10.3389/fimmu.2019.02441 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Mou Y, Du Y, Zhou L, Yue J, Hu X, Liu Y, et al. 腸内細菌叢は全身性慢性炎症を通じて脳と相互作用する:神経炎症、神経変性、老化への影響。また、「脳と腸の相互作用」については、「脳と腸の相互作用」、「脳と腸の相互作用」、「脳と腸の相互作用」、「脳と腸の相互作用」、「脳と腸の相互作用」、「脳と腸の相互作用」、「脳と腸の相互作用」、「脳と腸の相互作用」の3つの研究論文がある。
Cahenzli J, Balmer ML, McCoy KD. 微生物と免疫のクロストークと免疫系の制御。Immunology (2013) 138:12-22. doi: 10.1111/j.1365-2567.2012.03624.x [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Chelakkot C, Ghim J, Ryu SH. 腸管バリアの完全性を制御するメカニズムとその病理学的意義。Exp Mol Med (2018) 50:1-9. doi: 10.1038/s12276-018-0126-x [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Logsdon AF, Erickson MA, Rhea EM, Salameh TS, Banks WA. 腸の反応:血液脳関門がマイクロバイオームと脳をどうつなぐか。Exp Biol Med (Maywood) (2018) 243:159-65. doi: 10.1177/1535370217743766 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Braniste V, Al-Asmakh M, Kowal C, Anuar F, Abbaspour A, Tóth M, et al. 腸内細菌叢はマウスの血液脳関門透過性に影響する。Sci Transl Med (2014) 6:263ra158. doi: 10.1126/scitranslmed.3009759 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
全身感染と炎症は慢性神経変性に影響する。Nat Rev Immunol (2007) 7:161-7. doi: 10.1038/nri2015 [PubMed] [CrossRef] [Google Scholar].
神経変性疾患の進行における全身感染の影響。Nat Rev Neurosci (2003) 4:103-12. doi: 10.1038/nrn1032 [PubMed] [CrossRef] [Google Scholar].
Sankowski R, Mader S, Valdés-Ferrer SI. 全身性炎症と脳:神経変性のドライバーとしての遺伝的、分子的、環境的手がかりの新たな役割。Doi:10.3389/fncel.2015.00028【PMCフリー記事】【PubMed】【CrossRef】【Google Scholar】。
Stanisavljević S, Čepić A, Bojić S, Veljović K, Mihajlović S, gedović N, et al. 新生児期の抗生物質経口投与は腸内細菌叢を乱し、ダークアグーティラットの中枢神経系自己免疫を悪化させる。Sci Rep (2019) 9:918. doi: 10.1038/s41598-018-37505-7 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ミンターMR、チャンC、レオーネV、リングスDL、チャンX、オイラー-カストリロP、ら。抗生物質による腸内微生物の多様性の擾乱は、アルツハイマー病のマウスモデルにおける神経炎症とアミロイドーシスに影響を及ぼす。Sci Rep (2016) 6:30028. doi: 10.1038/srep30028 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
MinterMR、Hinterleitner R、Meisel M、Zhang C、Leone V、Zhang X、et al. 生後発生における微生物多様性の抗生物質誘発性摂動は、アルツハイマー病OPENの老化APP SWE /PS1 ΔE9マウスモデルにおけるアミロイド病理を変化させる。Sci Rep (2017) 7(1):10411. doi: 10.1038/s41598-017-11047-w [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Jang H-M, Lee H-J, Jang S-E, Han MJ, Kim D-H. マウスにおける抗菌薬誘発腸内細菌叢障害、神経炎症、不安の相互作用の証拠。Mucosal Immunol (2018) 11:1386-97. doi: 10.1038/s41385-018-0042-3 [PubMed] [CrossRef] [Google Scholar].
Nicholson JK, Holmes E, Kinross J, Burcelin R, Gibson G, Jia W, et al. 宿主と腸内細菌叢の代謝的相互作用。Sci (80- ) (2012) 336:1262-7. doi: 10.1126/science.1223813 [PubMed] [CrossRef] [Google Scholar].
Holmes E, Li JV, Marchesi JR, Nicholson JK. 腸内細菌叢の組成および活性と宿主の代謝表現型および疾患リスクとの関係。このように、腸内細菌叢の組成と活性は、宿主の代謝表現型と疾患リスクに関連している。
Charney AN, Micic L, Egnor RW. ラット結腸における短鎖脂肪酸の非イオン拡散。このような場合、膵臓の胆汁酸血症は、膵臓の胆汁酸血症を引き起こす可能性があります。
ケリーCJ、鄭L、キャンベルEL、Saeedi B、ショルツCC、ベイレスAJ、ら。微生物叢由来の短鎖脂肪酸と腸上皮HIFのクロストークは組織バリア機能を増強する。Cell Host Microbe (2015) 17:662-71. doi: 10.1016/j.chom.2015.03.005 [PMC free article] [PubMed] [Ref] [Google Scholar].
Sina C, Gavrilova O, Förster M, Till A, Derer S, Hildebrand F, et al. Gタンパク質共役型受容体43は、腸炎症時の好中球のリクルートに必須である。J Immunol (2009) 183:7514 LP - 7522. doi: 10.4049/jimmunol.0900063 [PubMed] [CrossRef] [Google Scholar].
Tolhurst G, Heffron H, Lam YS, Parker HE, Habib AM, Diakogiannaki E, et al. 短鎖脂肪酸は、Gタンパク質共役型受容体FFAR2を介してグルカゴン様ペプチド-1の分泌を刺激する。Diabetes (2012) 61:364-71. doi: 10.2337/db11-1019 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Nøhr MK, Egerod KL, Christiansen SH, Gille A, Offermanns S, Schwartz TW, et al. 自律神経節および体性感覚神経節における短鎖脂肪酸受容体GPR41/FFAR3の発現。Neuroscience (2015) 290:126-37. doi: 10.1016/j.neuroscience.2015.01.040 [PubMed] [CrossRef] [Google Scholar].
Lu VB, Gribble FM, Reimann F. 腸内分泌細胞における遊離脂肪酸受容体。Endocrinology (2018) 159:2826-35. doi: 10.1210/en.2018-00261 [PubMed] [CrossRef] [Google Scholar].
Priyadarshini M, Kotlo KU, Dudeja PK, Layden BT. Role of short chain fatty acid receptors in intestinal physiology and pathophysiology. Compr Physiol (2018) 8:1091-115. doi: 10.1002/cphy.c170050 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Priyadarshini M, Navarro G, Layden BT. 腸内細菌叢: 膵島へのFFAR到達効果。Endocrinology (2018) 159:2495-505. doi: 10.1210/en.2018-00296 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Chun E, Lavoie S, Fonseca-Pereira D, Bae S, Michaud M, Hoveyda HR, et al. メタボライト感知受容体Ffar2は、大腸3群自然リンパ球と腸管免疫を制御する。Immunity (2019) 51:871-884.e6. doi: 10.1016/j.immuni.2019.09.014 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Priyadarshini M, Lednovich K, Xu K, Gough S, Wicksteed B, Layden BT. 腸内細菌群のFFAR: T1D病態におけるSCFA受容体。Metabolites (2021) 11:302. doi: 10.3390/metabo11050302 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
スミスPM、ハウィットMR、パニコフN、ミショーM、ガリーニCA、Bohlooly-Y M、ら。微生物の代謝産物である短鎖脂肪酸は、大腸トレグ細胞のホメオスタシスを制御する。この論文では、大腸細胞のホメオスタシスを制御する微生物の代謝産物である短鎖脂肪酸について、大腸細胞のホメオスタシスを制御する微生物の代謝産物である短鎖脂肪酸について解説している。
常在細菌が産生する代謝産物は、末梢制御性T細胞の生成を促進する。Nature (2013) 504:451-5. doi: 10.1038/nature12726 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Kim CH. 腸内細菌叢由来の短鎖脂肪酸によるリンパ球機能の制御。Cell Mol Immunol (2021) 18:1161-71. doi: 10.1038/s41423-020-00625-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Silva YP, Bernardi A, Frozza RL. 腸-脳コミュニケーションにおける腸内細菌叢由来の短鎖脂肪酸の役割。Doi: 10.3389/fendo.2020.00025 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Li Z, Yi C-X, Katiraei S, Kooijman S, Zhou E, Chung CK, et al. 酪酸は食欲を減退させ、腸脳神経回路を介して褐色脂肪組織を活性化する。Gut (2018) 67:1269-79. doi: 10.1136/gutjnl-2017-314050 [PubMed] [CrossRef] [Google Scholar].
Puddu A, Sanguineti R, Montecucco F, Viviani GL. 糖尿病を改善する重要な病態生理学的分子としての腸内細菌叢短鎖脂肪酸の証拠。Mediators Inflammation (2014) 2014:162021. doi: 10.1155/2014/162021 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Patnala R, Arumugam TV, Gupta N, Dheen ST. HDAC阻害剤である酪酸ナトリウムを介したエピジェネティックな制御は、虚血性脳卒中におけるミクログリアの神経保護機能を増強する。Mol Neurobiol (2017) 54:6391-411. doi: 10.1007/s12035-016-0149-z [PubMed] [CrossRef] [Google Scholar].
Wang P, Zhang Y, Gong Y, Yang R, Chen Z, Hu W, et al. Sodium butyrate triggers akt-small RhoGTPase activation and HDACs inhibition via microglial process of functional elongation. Neurobiol Dis (2018) 111:12-25. doi: 10.1016/j.nbd.2017.12.006 [PubMed] [CrossRef] [Google Scholar].
van de Wouw M, Boehme M, Lyte JM, Wiley N, Strain C, O'Sullivan O, et al. 短鎖脂肪酸:ストレス誘発脳腸軸の変化を緩和する微生物代謝産物。J Physiol (2018) 596:4923-44. doi: 10.1113/JP276431 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Dalile B, Vervliet B, Bergonzelli G, Verbeke K, Van Oudenhove L. Colon-delivered short-chain fatty acids attenuate the cortisol response to psychosocial stress in healthy men: a randomized, placebo-controlled trial. 神経精神薬理学(2020)45:2257-66. doi: 10.1038/s41386-020-0732-x [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Wang L, Christophersen CT, Sorich MJ, Gerber JP, Angley MT, Conlon MA. 自閉症スペクトラム障害児における糞便中短鎖脂肪酸およびアンモニア濃度の上昇。doi: 10.1007/s10620-012-2167-7 [PubMed] [CrossRef] [Google Scholar].
Ho、Ono K、Tsuji M、Mazzola P、Singh R、Pasinetti GM. アルツハイマー病型βアミロイド神経病理学的メカニズムにおける腸内細菌叢由来短鎖脂肪酸の保護的役割。Expert Rev Neurother (2018) 18:83-90. doi: 10.1080/14737175.2018.1400909 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Skonieczna-Żydecka K, Grochans E, Maciejewska D, Szkup M, Schneider-Matyka D, Jurczak A, et al. 糞便短鎖脂肪酸プロファイルは、ポリッシュうつ病の女性で変更されます。Nutrients (2018) 10:1939. doi: 10.3390/nu10121939 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Ramírez-Pérez O, Cruz-Ramón V, Chinchilla-López P, Méndez-Sánchez N. 胆汁酸代謝における腸内細菌叢の役割。Ann Hepatol (2017) 16:s15-20. doi: 10.5604/01.3001.0010.5494 [PubMed] [CrossRef] [Google Scholar].
Mertens KL, Kalsbeek A, Soeters MR, Eggink HM. 腸肝循環から中枢神経系への胆汁酸シグナル伝達経路。Doi: 10.3389/fnins.2017.00617 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
健康、疾患、老化における胆汁酸シグナリングの分子生理学。Physiol Rev (2020) 101:683-731. doi: 10.1152/physrev.00049.2019 [PubMed] [CrossRef] [Google Scholar].
McMillin M, Frampton G, Quinn M, Divan A, Grant S, Patel N, et al. 胆汁うっ滞時のHPA軸の抑制は、視床下部の胆汁酸シグナル伝達に起因することができる。Doi:10.1210/me.2015-1087【PMCフリー記事】【PubMed】【CrossRef】【Google Scholar】。
Monteiro-Cardoso VF, Corlianò M, Singaraja RR. 胆汁酸:腸脳軸における通信チャネル。神経分子医学 (2021) 23:99-117. doi: 10.1007/s12017-020-08625-z [PubMed] [CrossRef] [Google Scholar].
Trauner M, Boyer JL. 胆汁酸塩トランスポーター:分子特性、機能、および制御。Physiol Rev (2003) 83:633-71. doi: 10.1152/physrev.00027.2002 [PubMed] [CrossRef] [Google Scholar].
Baloni P, Funk CC, Yan J, Yurkovich JT, Kueider-Paisley A, Nho K, et al. 代謝ネットワーク解析により、アルツハイマー病における胆汁酸合成と代謝の変化が明らかになった。この論文では、アルツハイマー病における胆汁酸の合成と代謝の変化を、メタボリックネットワーク解析によって明らかにした。
アルツハイマー病における脳-腸-微生物叢軸の重要な調節因子としての胆汁酸。J Alzheimer's Dis (2021) 84:461-77. doi: 10.3233/JAD-210608 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Huang F, Wang T, Lan Y, Yang L, Pan W, Zhu Y, et al. マウスFXR遺伝子の欠失は、複数の神経伝達系を乱し、神経行動を変化させる。Doi: 10.3389/fnbeh.2015.00070 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Keitel V, Görg B, Bidmon HJ, Zemtsova I, Spomer L, Zilles K, et al. 胆汁酸受容体TGR5(Gpbar-1)は、脳内で神経ステロイド受容体として働く。グリア (2010) 58:1794-805. doi: 10.1002/glia.21049 [PubMed] [CrossRef] [Google Scholar].
趙Y、李S、メイA、ら。ウルソデオキシコール酸(UDCA)の覚醒作用には、ヒスタミンとGABAA受容体のブロックが関与する。また、その作用機序を解明するため、その作用機序を解析した。
Huang F, Pariante CM, Borsini A. 神経疾患、神経変性疾患、神経精神疾患の前臨床モデルにおける、脳の細胞アポトーシス、酸化ストレス、炎症に対する胆汁酸の効果の系統的レビュー。脳行動免疫 (2022) 99:132-46. doi: 10.1016/j.bbi.2021.09.021 [PubMed] [CrossRef] [Google Scholar].
Yanguas-Casás N, Barreda-Manso MA, Nieto-Sampedro M, Romero-Ramírez L. TUDCA: an agonist of the bile acid receptor GPBAR1/TGR5 with anti-inflammatory effects in microglial cells. J Cell Physiol (2017) 232:2231-45. doi: 10.1002/jcp.25742 [PubMed] [CrossRef] [Google Scholar].
神経機能と疾患に対する胆汁酸の影響。FASEB J (2016) 30:3658-68. doi: 10.1096/fj.201600275R [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Duboc H, Taché Y, Hofmann AF. 胆汁酸TGR5膜受容体:基礎研究から臨床応用まで。Dig肝臓病(2014)46:302-12. doi: 10.1016/j.dld.2013.10.021 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
胆汁酸と健康および疾患におけるグルココルチコイド代謝. Biochim Biophys Acta - Mol Basis Dis (2019) 1865:243-51. doi: 10.1016/j.bbadis.2018.08.001 [PubMed] [CrossRef] [Google Scholar].
ペリーRJ、リーS、マーL、チャンD、シュレシンジャーJ、シュルマンGI。FGF1とFGF19は、視床下部-下垂体-副腎軸の抑制によって糖尿病を逆転させる。Nat Commun (2015) 6:6980. doi: 10.1038/ncomms7980 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Forman BM, Goode E, Chen J, Oro AE, Bradley DJ, Perlmann T, et al. ファルネソール代謝産物によって活性化される核内受容体の同定。このような研究は、日本ではほとんど行われていない。
Gタンパク質共役型レセプターに応答するGタンパク質共役型レセプター。胆汁酸*に応答するGタンパク質共役型受容体. J Biol Chem (2003) 278:9435-40. doi: 10.1074/jbc.M209706200 [PubMed] [CrossRef] [Google Scholar].
Baptissart M, Vega A, Martinot E, Baron S, Lobaccaro J-MA, Volle DH. ファルネソイドX受容体α:胆汁酸とステロイドシグナル伝達の分子的リンク?Cell Mol Life Sci (2013) 70:4511-26. doi: 10.1007/s00018-013-1387-0 [PubMed] [CrossRef] [Google Scholar].
Stocco DM, Clark BJ. ステロイド生成細胞におけるステロイドの急性産生の制御。Endocr Rev (1996) 17:221-44. doi: 10.1210/edrv-17-3-221 [PubMed] [CrossRef] [Google Scholar].
Schoeler M、シーザーR.食事脂質、腸内細菌叢と脂質代謝。Rev Endocr Metab Disord (2019) 20:461-72. doi: 10.1007/s11154-019-09512-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Peter K, Koji K, Kanako M, Atsushi Y. 乳酸菌およびビフィズス菌の遊離胆汁酸による増殖阻害機構. J Bacteriol (2006) 188:1979-86. doi: 10.1128/JB.188.5.1979-1986.2006 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
胆汁酸-FXR-FGF15/19シグナル軸の分子基盤. 胆汁酸-FXR-FGF15/19シグナル軸の分子基盤.
神経変性および神経疾患における胆汁酸シグナル伝達. Int J Mol Sci (2020) 21:5982. doi: 10.3390/ijms21175982 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Jia W, Rajani C, Kaddurah-Daouk R, Li H. アルツハイマー病と肝性脳症の発症と進行における腸内細菌-胆汁酸-脳軸の潜在的役割。医学 Res Rev (2020) 40:1496-507. doi: 10.1002/med.21653 [PubMed] [CrossRef] [Google Scholar].
槇島真紀子、岡本AY、Repa JJ、Tu H、Learned RM、Luk A、et al. 胆汁酸核内受容体の同定。(1999)284:1362-5.doi:10.1126/science.284.5418.1362[PubMed] [CrossRef] [Google Scholar].
Sayin SI, Wahlström A, Felin J, Jäntti S, Marschall H-U, Bamberg K, et al. 腸内細菌叢は、天然由来のFXRアンタゴニストであるタウロ-β-ムリコール酸のレベルを低下させることにより、胆汁酸代謝を調節する。セル-メタブ(2013)17:225-35.doi:10.1016/j.cmet.2013.01.003 [PubMed] [クロスリーフ] [Google Scholar].
Bin WZ, Chen YR, Lv JT, Wang MX, Chen ZY, Zhou W, et al. 認知機能障害関連疾患における胆汁酸代謝とシグナル伝達に関する総説。(2022)2022:4289383。 doi: 10.1155/2022/4289383 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
シュブリングSR、フライシャーW、リンJS、ハースHL、セルゲイバOA。胆汁ステロイドであるチェノデオキシコール酸塩は、NMDAおよびGABA(A)受容体において強力なアンタゴニストである。このような胆汁酸ステロイドは、NMDAおよびGABA(A)受容体において強力な拮抗作用を示す。
van Best N, Rolle-Kampczyk U, Schaap FG, Basic M, Olde Damink SWM, Bleich A, et al. 胆汁酸は新生児の腸内細菌叢の成熟を促進する。Nat Commun (2020) 11:3692. doi: 10.1038/s41467-020-17183-8 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Li M, Liu S, Wang M, Hu H, Yin J, Liu C, et al. 新生児胆汁うっ滞症における胆汁酸代謝に関連する腸内細菌叢の異常。また、胆汁酸代謝に関連する腸内細菌叢の異常は、新生児胆汁うっ滞症における胆汁酸代謝と関連していることが示唆された。
胆汁酸はRac1依存的機序を介してラットの胆管結紮後に血液脳関門を透過不安定化する。Dig肝臓病(2014)46:527-34. doi: 10.1016/j.dld.2014.01.159 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Cabrera-Rubio R, Patterson AM, Cotter PD, Beraza N. Cholestasis induced by bile duct ligation promotes changes in the intestinal microbiome in mice. Sci Rep (2019) 9:12324. doi: 10.1038/s41598-019-48784-z [PMC free article] [PubMed] [CrossRef] [Google Scholar].
マフムディアンデホコルディS、バタチャリヤS、ブライジスCR、ジャW、フィーンO、ラッシュAJ、ら。不安の有無にかかわらず、大うつ病の病態生物学における腸内細菌関連代謝産物-胆汁酸の役割。このような背景のもと、本論文では、うつ病の病態における腸内細菌関連代謝物の役割について、胆汁酸の役割を中心に解説する。
分岐鎖アミノ酸の新規代謝・生理機能:総説。J Anim Sci Biotechnol (2017) 8:10. doi: 10.1186/s40104-016-0139-z [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Blachier F, Mariotti F, Huneau JF, Tomé D. アミノ酸由来の管腔代謝産物の大腸上皮への影響と生理病理学的帰結。Amino Acids (2007) 33:547-62. doi: 10.1007/s00726-006-0477-9 [PubMed] [CrossRef] [Google Scholar].
Dai Z-L, Zhang J, Wu G, Zhu W-Y. ブタ小腸内細菌によるアミノ酸の利用。Amino Acids (2010) 39:1201-15. doi: 10.1007/s00726-010-0556-9 [PubMed] [CrossRef] [Google Scholar].
楊 Z、黄 S、鄒 D、董 D、何 X、劉。N, et al. 中高齢マウスにおける分岐鎖アミノ酸補給に伴う代謝シフトと腸内細菌叢の構造変化。Amino Acids (2016) 48:2731-45. doi: 10.1007/s00726-016-2308-y [PubMed] [CrossRef] [Google Scholar].
D'Antona G, Ragni M, Cardile A, Tedesco L, Dossena M, Bruttini F, et al. 分岐鎖アミノ酸の補給は、中年齢マウスの生存を促進し、心筋および骨格筋のミトコンドリア生合成をサポートする。セル-メタブ(2010)12:362-72. doi: 10.1016/j.cmet.2010.08.016 [PubMed] [CrossRef] [Google Scholar].
スペリンガーJE、アディントン、ハトソンSM。分岐鎖アミノ酸と脳代謝。Neurochem Res (2017) 42:1697-709. doi: 10.1007/s11064-017-2261-5 [PubMed] [CrossRef] [Google Scholar].
ロイシン欠乏は、脳を刺激する。ロイシン欠乏は、視床下部におけるCRH発現の増加と交感神経系の活性化を介して脂肪減少を刺激する。また、このような研究は、日本ではまだほとんど行われていない。
O'Reilly D, Crushell E, Hughes J, Ryan S, Rogers Y, Borovickova I, et al. メープルシロップ尿症:アイルランド共和国における新生児血液スポットスクリーニングの40年後のスクリーニング集団における臨床転帰、代謝制御、および遺伝子型。J Inherit Metab Dis (2021) 44:639-55. doi: 10.1002/jimd.12337 [PubMed] [CrossRef] [Google Scholar].
分岐鎖アミノ酸は、骨粗鬆症の発症を抑制することが知られている。分岐鎖アミノ酸はTHAラットの高い学習能力表現型を支配する。このような遺伝子発現を解析することで、遺伝子発現を制御することが可能となる。
Elliott JE, Keil AT, Mithani S, Gill JM, O'Neil ME, Cohen AS, et al. 外傷性脳損傷の退役軍人の睡眠を改善するための分岐鎖アミノ酸の食事補充:無作為化二重盲検プラセボ対照パイロットおよび実現可能性試験。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Siddik MA, Mullins CA, Kramer A, Shah H, Gannaban RB, Zabet-Moghaddam M, et al. 分岐鎖アミノ酸はアルツハイマー病関連病態および認知障害と関連している。細胞 (2022) 11:3523. doi: 10.3390/cells11213523 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Dinan TG, Cryan JF. 腸内細菌叢によるストレス応答の制御:精神神経内分泌学への示唆。Dai:10.1016/j.psyneuen.2012.03.007【PubMed】【CrossRef】【Google Scholar】。
Jašarević E, Howerton CL, Howard CD, Bale TL. 母親のストレスによる膣マイクロバイオームの変化は、子孫の腸と脳の代謝再プログラミングと関連している。内分泌学(2015)156:3265-76. doi:10.1210/en.2015-1177 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Jašarević E, Howard CD, Morrison K, Misic A, Weinkopff T, Scott P, et al. 母親の膣マイクロバイオームは、子孫の腸と視床下部に対する出生前ストレスの影響を部分的に媒介する。Nat Neurosci (2018) 21:1061-71. doi: 10.1038/s41593-018-0182-5 [PubMed] [CrossRef] [Google Scholar].
Gareau MG, Jury J, Yang PC, MacQueen G, Perdue MH. 新生児期の母体分離は、宿主抵抗性の低下を含むラットの仔の大腸機能障害を引き起こす。小児科研究(2006)59:83-8. doi: 10.1203/01.pdr.0000190577.62426.45 [PubMed] [CrossRef] [Google Scholar].
Gareau MG, Jury J, MacQueen G, Sherman PM, Perdue MH. ラット仔ラットにプロバイオティクスを投与すると、コルチコステロン放出が正常化し、母体分離によって誘発される大腸機能障害が改善する。腸 (2007) 56:1522-8. doi: 10.1136/gut.2006.117176 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
O'Mahony SM, Marchesi JR, Scully P, Codling C, Ceolho AM, Quigley EMM, et al. 早期生ストレスはラットの行動、免疫、微生物叢を変化させる:過敏性腸症候群と精神疾患への影響。バイオ精神医学(2009)65:263-7. doi: 10.1016/j.biopsych.2008.06.026 [PubMed] [CrossRef] [Google Scholar].
スーリ D、ヴィーニット V、サルカー A、ティアガラジャン D、クマール A、ネスラー EJ、他。初期ストレスは、海馬の神経新生、BDNF発現、認知において年齢依存的な二相変化を引き起こす。このようなストレスは、海馬の神経新生、BDNFの発現、および認知において、年齢依存的な二相変化を引き起こす。
Huo R, Zeng B, Zeng L, Cheng K, Li B, Luo Y, et al. 微生物叢は視床下部-下垂体-副腎軸の不安様行動と内分泌異常を調節する。Doi: 10.3389/fcimb.2017.00489 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Clarke G, Grenham S, Scully P, Fitzgerald P, Moloney RD, Shanahan F, et al. 幼少期の微生物-腸-脳軸は、性依存的に海馬のセロトニン作動性システムを制御する。また、このような研究は、日本ではあまり行われていない。
Crumeyrolle-Arias M, Jaglin M, Bruneau A, Vancassel S, Cardona A, Daugé V, et al. 腸内細菌叢の欠如は、ラットの急性ストレスに対する不安様行動と神経内分泌反応を増強する。心理神経内分泌学(2014)42:207-17. doi: 10.1016/j.psyneuen.2014.01.014 [PubMed] [CrossRef] [Google Scholar].
Söderholm JD, Yang P-C, Ceponis P, Vohra A, Riddell R, Sherman PM, et al. 慢性ストレスはマスト細胞依存性の細菌接着を誘導し、ラット腸における粘膜炎症を開始する。Gastroenterology (2002) 123:1099-108. doi: 10.1053/gast.2002.36019 [PubMed] [CrossRef] [Google Scholar].
Cameron HL, Perdue MH. ストレスによるマウス腸管バリア機能の障害:グルカゴン様ペプチド-2による改善。J Pharmacol Exp Ther (2005) 314:214-20. doi: 10.1124/jpet.105.085373 [PubMed] [CrossRef] [Google Scholar].
(1)ストレスによるコルチコトロピン産生促進作用(2)ストレスによるコルチコトロピン産生促進作用(3)ストレスによるコルチコトロピン産生促進作用(4). ストレスによるコルチコトロピン放出ホルモンを介したNLRP6インフラマソーム阻害とマウスの伝達性腸炎。また、このようなストレスが腸炎を発症させる可能性もあることが示唆された。
Lutgendorff F, Akkermans LMA, Söderholm JD. ストレス誘発性胃腸障害における微生物叢とプロバイオティクスの役割。Curr Mol Med (2008) 8:282-98. doi: 10.2174/156652408784533779 [PubMed] [CrossRef] [Google Scholar].
Gareau MG, Silva MA, Perdue MH. ストレスによる腸管障害の病態生理学的メカニズム。このようなストレスによる腸管障害の病態生理学的機序を解明するために、腸管障害の病態生理学的機序を解明することを目的とし、腸管障害の病態生理学的機序を解明することを目的とし、腸管障害の病態生理学的機序を解明することを目的とし、腸管障害の病態生理学的機序を解明することを目的とした。
Teitelbaum AA, Gareau MG, Jury J, Yang PC, Perdue MH. コルチコトロピン放出因子の慢性末梢投与は心理的ストレスに類似した大腸バリア機能障害を引き起こす。
Martel J, Chang S-H, Ko Y-F, Hwang T-L, Young JD, Ojcius DM. 腸管バリア障害と慢性疾患。Trends Endocrinol Metab (2022) 33:247-65. doi: 10.1016/j.tem.2022.01.002 [PubMed] [CrossRef] [Google Scholar].
Bailey、Dowd SE、Parry NMA、Galley JD、Schauer DB、Lyte M. ストレッサー暴露は腸内の常在微生物集団を破壊し、citrobacter rodentiumによるコロニー形成を増加させる。この論文では、腸内の常在微生物集団を破壊し、シトロバクター・ロデンティウムによるコロニー形成を増加させるストレッサー暴露の実態を明らかにした。
Allen RG, Lafuse WP, Galley JD, Ali MM, Ahmer BMM, Bailey MT. 腸内細菌叢は、脾マクロファージの殺微生物活性のストレス誘発性増強に必要である。脳行動免疫 (2012) 26:371-82. doi: 10.1016/j.bbi.2011.11.002 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Hoban AE, Moloney RD, Golubeva AV, McVey Neufeld KA, O'Sullivan O, Patterson E, et al. ラットにおける成体期の慢性的な腸内細菌叢減少の行動学的および神経化学的結果。Neuroscience (2016) 339:463-77. doi: 10.1016/j.neuroscience.2016.10.003 [PubMed] [CrossRef] [Google Scholar].
Gareau MG, Wine E, Rodrigues DM, Cho JH, Whary MT, Philpott DJ, et al. 細菌感染は、マウスにおいてストレス誘発性の記憶機能障害を引き起こす。Gut (2011) 60:307-17. doi: 10.1136/gut.2009.202515 [PubMed] [CrossRef] [Google Scholar].
蒋PF、朱T、高JD、高F、毛SS、趙WT、ら。母体感染が新生児ラットの認知発達と海馬神経細胞のアポトーシス、増殖、分化に及ぼす影響。神経科学 (2013) 246:422-34. doi: 10.1016/j.neuroscience.2013.04.021 [PubMed] [CrossRef] [Google Scholar].
Shanks N, Larocque S, Meaney MJ. 新生児エンドトキシン曝露は視床下部-下垂体-副腎軸の発達を変化させる:初期疾患とストレスに対する後の反応性。J Neurosci Off J Soc Neurosci (1995) 15:376-84. doi: 10.1523/JNEUROSCI.15-01-00376.1995 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Shanks N, Windle RJ, Perks PA, Harbuz MS, Jessop DS, Ingram CD, et al. エンドトキシンへの早期暴露は、視床下部-下垂体-副腎機能と炎症への素因を変化させる。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
アグスティA、モヤ-ペレスA、カンピージョI、モンセラット-デ-ラ-パスS、セルードV、ペレス-ビラルバA、ら。Bifidobacterium pseudocatenulatum CECT 7765 ameliorates neuroendocrine alterations associated with an exaggerated stress response and anhedonia in obese mice. Mol Neurobiol (2018) 55:5337-52. doi: 10.1007/s12035-017-0768-z [PubMed] [CrossRef] [Google Scholar].
Ait-Belgnaoui A, Durand H, Cartier C, Chaumaz G, Eutamene H, Ferrier L, et al. プロバイオティクスによる腸管漏出の予防は、ラットの急性心理的ストレスに対するHPA反応を減弱させる。心理神経内分泌学 (2012) 37:1885-95. doi: 10.1016/j.psyneuen.2012.03.024 [PubMed] [CrossRef] [Google Scholar].
Vodička M, Ergang P, Hrnčíř T, Mikulecká A, Kvapilová P, Vagnerová K, et al. 微生物叢は、慢性的な心理社会的ストレスにおけるHPA軸の調節とグルココルチコイドの局所代謝に関与する遺伝子の発現に影響を与える。Brain Behav Immun (2018) 73:615-24. doi: 10.1016/j.bbi.2018.07.007 [PubMed] [CrossRef] [Google Scholar].
Rosin S, Xia K, Azcarate-Peril MA, Carlson AL, Propper CB, Thompson AL, et al. 健康な乳児における腸内細菌叢の変動とHPA軸反応性の予備的研究。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Keskitalo A, Aatsinki AK, Kortesluoma S, Pelto J, Korhonen L, Lahti L, et al. 腸内細菌叢の多様性は、組成ではなく、生後2.5ヶ月の唾液コルチゾールストレス反応と関連している。Stress (2021) 24:551-60. doi: 10.1080/10253890.2021.1895110 [PubMed] [CrossRef] [Google Scholar].
Grigoleit J-S, Kullmann JS, Wolf OT, Hammes F, Wegner A, Jablonowski S, et al. ヒトの神経行動機能に対するエンドトキシンの用量依存的影響。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Messaoudi M, Lalonde R, Violle N, Javelot H, Desor D, Nejdi A, et al. ラットおよびヒト被験者におけるプロバイオティクス製剤(ラクトバチルス・ヘルベティカスR0052およびビフィドバクテリウム・ロンガムR0175)の向精神薬様特性の評価。また、そのようなプロバイオティクス製剤を摂取することで、精神薬理学的な効果を得ることができる。
プロバイオティクスのストレスに対する有効性。健康なボランティアにおけるストレスに対するプロバイオティクスの有効性:ランダム化比較試験に基づく系統的レビューとメタ分析。脳行動 (2020) 10:e01699. doi: 10.1002/brb3.1699 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Berding K、Bastiaanssen TFS、モロニーGM、Boscaini S、ストレインCR、Anesi A、ら。ストレスに対処するためにあなたの微生物を養う:サイコバイオティックダイエットは、健康な成人集団における微生物の安定性と知覚ストレスに影響を与えます。モル精神医学(2022)28:601-10. doi: 10.1038/s41380-022-01817-y [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
デスボネL、ギャレットL、クラークG、キーリーB、クライアンJF、ディナンTG。うつ病の母体分離モデルにおけるプロバイオティクスbifidobacterium infantisの効果。神経科学 (2010) 170:1179-88. doi: 10.1016/j.neuroscience.2010.08.005 [PubMed] [CrossRef] [Google Scholar].
Bercik P, Denou E, Collins J, Jackson W, Lu J, Jury J, et al. 腸内細菌叢は、脳由来神経刺激因子の中枢レベルとマウスの行動に影響を与える。消化器病学 (2011) 141:599-609. doi: 10.1053/j.gastro.2011.04.052 [PubMed] [CrossRef] [Google Scholar].
Desbonnet L, Clarke G, Shanahan F, Dinan TG, Cryan JF. 微生物叢はマウスの社会性の発達に必須である。Mol Psychiatry (2014) 19:146-8. doi: 10.1038/mp.2013.65 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Lukić I, Getselter D, Koren O, Elliott E. Role of tryptophan in microbiota-induced depressive-like behavior: evidence from tryptophan depletion study. Front Behav Neurosci (2019) 13:123. doi: 10.3389/fnbeh.2019.00123 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Lyte JM, Gheorghe CE, Goodson MS, Kelley-Loughnane N, Dinan TG, Cryan JF, et al. 急性ストレス曝露に対する腸脳軸セロトニン作動性応答は微生物に依存する。Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc (2020) 32:e13881. doi: 10.1111/nmo.13881 [PubMed] [CrossRef] [Google Scholar].
松本真由美、木部亮、大賀貴之、相羽洋一、澤木英治、古賀由美子、他.腸内細菌叢が大脳低分子代謝産物に及ぼす影響:パイロット研究. また、腸内細菌叢が脳内低分子代謝産物に及ぼす影響についても検討した。
Gur TL、シェイL、Palkar AV、フィッシャーS、Varaljay VA、ダウドS、ら。出生前のストレスは、胎盤のサイトカインや神経トロフィン、常在微生物、成人女性の子孫における不安様行動に影響を与える。Brain Behav Immun (2017) 64:50-8. doi: 10.1016/j.bbi.2016.12.021 [PubMed] [CrossRef] [Google Scholar].
Desbonnet L, Clarke G, Traplin A, O'Sullivan O, Crispie F, Moloney RD, et al. マウスの思春期早期からの腸内細菌叢の減少:脳と行動への影響。doi: 10.1016/j.bbi.2015.04.004 [PubMed] [CrossRef] [Google Scholar].
Fröhlich EE, Farzi A, Mayerhofer R, Reichmann F, Jačan A, Wagner B, et al. 抗生物質誘発性腸内細菌異常症による認知障害:腸内細菌叢-脳コミュニケーションの解析。Brain Behav Immun (2016) 56:140-55. doi: 10.1016/j.bbi.2016.02.020 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Möhle L, Mattei D, Heimesaat MM, Bereswill S, Fischer A, Alutis M, et al. Ly6Chi単球は、抗生物質によって誘導された腸内細菌叢の変化と成体海馬の神経新生との間のリンクを提供する。Cell Rep (2016) 15:1945-56. doi: 10.1016/j.celrep.2016.04.074 [PubMed] [CrossRef] [Google Scholar].
神経細胞は微生物叢によって制御されている。微生物叢は神経細胞機能と恐怖消滅学習を制御する。Nature (2019) 574:543-8. doi: 10.1038/s41586-019-1644-y [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ジョエルスM、バラムTZ。ストレスの神経シンフォニー。Nat Rev Neurosci (2009) 10:459-66. doi: 10.1038/nrn2632 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Burokas A, Arboleya S, Moloney RD, Peterson VL, Murphy K, Clarke G, et al. Microbiota-Gut-Brain axis: prebiotics have anxiolytic and antidepressant-like effects and reverse the impact of chronic stress in mice. Biol Psychiatry (2017) 82:472-87. doi: 10.1016/j.biopsych.2016.12.031 [PubMed] [CrossRef] [Google Scholar].
Matthews DM, Jenks SM. Mycobacterium vaccaeの摂取はマウスの不安関連行動を減少させ、学習を改善する。また、このような行動変容を抑制するためには、「行動変容」を抑制することが重要であることが示唆された。
Lowry CA, Hollis JH, de Vries A, Pan B, Brunet LR, Hunt JRF, et al. 免疫応答性中辺皮質セロトニン作動性システムの同定:情動行動の制御における潜在的役割。神経科学 (2007) 146:756-72. doi: 10.1016/j.neuroscience.2007.01.067 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Savignac HM, Tramullas M, Kiely B, Dinan TG, Cryan JF. Bifidobacteria modulate cognitive processes in an anxious mouse strain. Doi: 10.1016/j.bbr.2015.02.044 [PubMed] [CrossRef] [Google Scholar].
Buffington SA, Di Prisco GV, Auchtung TA, Ajami NJ, Petrosino JF, Costa-Mattioli M. Microbial reconstitution reverses maternal diet-induced social and synaptic deficits in offspring. Cell (2016) 165:1762-75. doi: 10.1016/j.cell.2016.06.001 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Liu J, Sun J, Wang F, Yu X, Ling Z, Li H, et al. 酪酸代謝を介してマウスの血管性痴呆に対するクロストリジウム酪酸の神経保護効果。BioMed Res Int (2015) 2015:412946. doi: 10.1155/2015/412946 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Wang K-C, Fan L-W, Kaizaki A, Pang Y, Cai Z, Tien L-T. 新生児期のリポ多糖曝露は、成体ラットにおいて長期にわたる学習障害、不安様反応の減少、海馬傷害を引き起こす。このような研究は、日本ではほとんど行われていない。
Bilbo SD, Biedenkapp JC, Der-Avakian A, Watkins LR, Rudy JW, Maier SF. 新生児感染によって誘発される成人期のリポ多糖後の記憶障害は、カスパーゼ-1阻害によって予防される。
Bilbo SD, Newsum NJ, Sprunger DB, Watkins LR, Rudy JW, Maier SF. 新生児期のハンドリングが、成人期における初期感染による認知の変化に及ぼす影響の違い。脳行動免疫 (2007) 21:332-42. doi: 10.1016/j.bbi.2006.10.005 [PubMed] [CrossRef] [Google Scholar].
ラトナヤケU、クインTA、カスティーヨ-メレンデスM、ディキンソンH、ウォーカーDW。妊娠中期に母親をウイルス模倣型ポリI:Cで処理したトゲマウスの新生児における行動と海馬特異的変化。
Zhu S, Jiang Y, Xu K, Cui M, Ye W, Zhao G, et al. 脳疾患に関連する腸内マイクロバイオーム研究の進展。J Neuroinflamm (2020) 17:25. doi: 10.1186/s12974-020-1705-z [PMC free article] [PubMed] [CrossRef] [Google Scholar].
微生物叢-腸-脳軸:神経行動学的相関、健康と社会性。Doi:10.3389/fnint.2013.00070[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Carlson AL, Xia K, Azcarate-Peril MA, Goldman BD, Ahn M, Styner MA, et al. 認知発達に関連する乳児腸内細菌叢。Biol Psychiatry (2018) 83:148-59. doi: 10.1016/j.biopsych.2017.06.021 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Polidano C, Zhu A, Bornstein JC. 帝王切開出産と子どもの認知発達の関係。Sci Rep (2017) 7:11483. doi: 10.1038/s41598-017-10831-y [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Blustein J, Liu J. Time to consider the risks of caesarean delivery for long term child health. BMJのBrメドJ(2015)350:h2410。
マルティネスLD、グリンLM、サンドマンCA、ウィングDA、デイビスEP。帝王切開分娩と乳児のコルチゾール調節。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Kiilerich P, Cortes R, Lausten-Thomsen U, Borbye-Lorenzen N, Holmgaard S, Skogstrand K. Delivery modality affect neonatal levels of inflammation, stress, and growth factors. Doi:10.3389/fped.2021.709765【PMCフリー記事】【PubMed】【CrossRef】【Googleスカラー
神経認知および精神疾患における腸内微生物。Ann Med (2020) 52:423-43. doi: 10.1080/07853890.2020.1808239 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Dinan K, Dinan T. Antibiotics and mental health: the good, the bad and the ugly. J Intern Med (2022) 292:858-69. doi: 10.1111/joim.13543 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Liu Z, Wei S, Chen X, Liu L, Wei Z, Liao Z, et al. 小児および青年期における抗生物質の長期または反復使用が、中高年成人における認知障害に及ぼす影響:コホート研究。このような研究は、日本ではほとんど行われていない。
Mehta RS, Lochhead P, Wang Y, Ma W, Nguyen LH, Kochar B, et al. 女性における中年期の抗生物質使用とその後の認知機能との関連。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Bokulich NA, Chung J, Battaglia T, Henderson N, Jay M, Li H, et al. Antibiotics, birth mode, and diet shape microbiome maturation during early life. Sci Transl Med (2016) 8:343ra82-343ra82. doi: 10.1126/scitranslmed.aad7121 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
マイクロバイオームと抗生物質の影響の概要。J Nurse Pract (2014) 10:445-50. doi: 10.1016/j.nurpra.2014.05.005 [CrossRef] [Google Scholar].
Bossung V, Lupatsii M, Dashdorj L, Tassiello O, Jonassen S, Pagel J, et al. 帝王切開の抗菌薬予防投与のタイミングは、正期産児の腸内細菌叢の発達にとって重要である。Gut Microbes (2022) 14:2038855. doi: 10.1080/19490976.2022.2038855 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Slykerman RF, Thompson J, Waldie KE, Murphy R, Wall C, Mitchell EA. 生後1年間の抗生物質とその後の神経認知アウトカム。Acta Paediatr (2017) 106:87-94. doi: 10.1111/apa.13613 [PubMed] [CrossRef] [Google Scholar].
Ou Y, Belzer C, Smidt H, de Weerth C. Development of the gut microbiota in healthy children in the first ten years of life: associations with internalizing and externalizing behavior. 腸内細菌(2022)14:2038853. doi: 10.1080/19490976.2022.2038853 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
腸内細菌叢の抗生物質による破壊と乳児期のレジストーム動態。細胞宿主微生物(2022)30:675-83. doi: 10.1016/j.chom.2022.03.013 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Bajaj JS, Betrapally NS, Gillevet PM. 肝硬変とマイクロバイオームの解釈。Nature (2015) 525:E1-2. doi: 10.1038/nature14851 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Patidar KR, Bajaj JS. 肝性脳症治療のための抗生物質。Doi:10.1007/s11011-013-9383-5【PMCフリー記事】[PubMed] [クロスリーフ] [Googleスカラー]。
Sung CM, Lin Y-F, Chen K-F, Ke H-M, Huang H-Y, Gong Y-N, et al. 肝性脳症を有する肝硬変患者の臨床転帰を糞便マイクロバイオームから予測する。Cell Mol Gastroenterol Hepatol (2019) 8:301-318.e2. doi: 10.1016/j.jcmgh.2019.04.008 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Festi D, Mazzella G, Parini P, Ronchi M, Cipolla A, Orsini M, et al. 非吸収性抗生物質による肝性脳症の治療。イタリアJ Gastroenterol(1992)24:14-6。[PubMedの] [Googleスカラー]。
肝性脳症における機能的結合の亢進、作業性脳症における機能的結合の亢進、作業性脳症における機能的結合の亢進、作業性脳症における機能的結合の亢進、作業性脳症における機能的結合の亢進。肝硬変におけるリファキシミンによるマルチモーダル脳MRイメージングでの機能的結合、ワーキングメモリー、抑制性制御の増強:腸-肝-脳軸への示唆。Doi:10.1007/s11011-014-9507-6【PMCフリー記事】【PubMed】【CrossRef】【Googleスカラー
Bajaj JS, Heuman DM, Sanyal AJ, Hylemon PB, Sterling RK, Stravitz RT, et al. 肝硬変および最小肝性脳症患者におけるリファキシミンによるメタバイオームの調節。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Stark CM, Susi A, Nylund CM. 微生物に作用する薬物への早期の暴露は、小児期の向精神薬の処方と関連している。小児科 (2021) 147:1036-7. doi: 10.1542/peds.147.3MA11.1036 [CrossRef] [Google Scholar].
全身麻酔は腸をいじめる:ディスバイオシスと認知機能障害との有害な関係。Doi:10.1007/s00213-022-06096-7【PubMed】【CrossRef】【Google Scholar】。
Judd LL, Schettler PJ, Brown ES, Wolkowitz OM, Sternberg EM, Bender BG, et al. グルココルチコイド投薬の有害な結果:心理学的、認知的、行動的影響。Doi: 10.1176/appi.ajp.2014.13091264 [PubMed] [CrossRef] [Google Scholar].
バーニーNR、アレキサンダーB、マッキンドーJH。ステロイド精神病を伴わない患者における可逆的ステロイド痴呆。このような患者には、ステロイド精神病を伴わない可逆的なステロイド認知症がある。
Stoudemire A, Anfinson T, Edwards J. 副腎皮質ステロイド誘発性せん妄と依存症。Gen Hosp Psychiatry (1996) 18:196-202. doi: 10.1016/0163-8343(96)00005-9 [PubMed] [CrossRef] [Google Scholar].
Newcomer JW, Craft S, Hershey T, Askins K, Bardgett ME. グルココルチコイドによる成人ヒトの宣言的記憶能力の障害。
Newcomer JW, Selke G, Melson AK, Hershey T, Craft S, Richards K, et al. ストレスレベルのコルチゾール投与によって誘発される健常人の記憶能力の低下。アーチ Gen Psychiatry (1999) 56:527-33. doi: 10.1001/archpsyc.56.6.527 [PubMed] [CrossRef] [Google Scholar].
Bender BG, Lerner JA, Kollasch E. 副腎皮質ステロイドを投与されている喘息児における気分と記憶の変化。J Am Acad Child Adolesc Psychiatry (1988) 27:720-5. doi: 10.1097/00004583-198811000-00010 [PubMed] [CrossRef] [Google Scholar].
Savas M, Vinkers CH, Rosmalen JGM, Hartman CA, Wester VL, van den Akker ELT, et al. 全身的および局所的なコルチコステロイドの使用は、実行認知の低下、および気分障害と不安障害と関連している。Neuroendocrinology (2020) 110:282-91. doi: 10.1159/000501617 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Dekkers AJ, Amaya JM, van der Meulen M, Biermasz NR, Meijer OC, Pereira AM. 脳におけるグルココルチコイド過剰の長期的影響。J Neuroendocrinol (2022) 34:e13142. doi: 10.1111/jne.13142 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
プラドCE、クロウSF。副腎皮質ステロイドと認知:メタアナリシス。Neuropsychol Rev (2019) 29:288-312. doi: 10.1007/s11065-019-09405-8 [PubMed] [CrossRef] [Google Scholar].
Lupien SJ, Fiocco A, Wan N, Maheu F, Lord C, Schramek T, et al. ストレスホルモンと生涯にわたるヒトの記憶機能。Doi:10.1016/j.psyneuen.2004.08.003[PubMed] [CrossRef] [Google Scholar].
Bauduin SEEC, den Rooijen ILB, Meijer M, van der Werff SJA, Keo A, Dzyubachyk O, et al. 長期寛解したクッシング病患者における免疫シグナル遺伝子、不活性化ミクログリア、オリゴデンドロサイトと皮質灰白質減少との関連性の可能性。この論文では、クッシング病患者の大脳皮質灰白質喪失と免疫シグナル遺伝子との関連性を明らかにした。
ヘンリーM、トーマスKGF、ロスIL。アジソン病における睡眠、認知、コルチゾール:メカニズム的関係。PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Wu T, Yang L, Jiang J, Ni Y, Zhu J, Zheng X, et al. 慢性グルココルチコイド投与による概日時計障害は、ラットの脂質代謝と腸内細菌叢の変化をもたらす。Life Sci (2018) 192:173-82. doi: 10.1016/j.lfs.2017.11.049 [PubMed] [CrossRef] [Google Scholar].
Schepper JD, Collins F, Rios-Arce ND, Kang HJ, Schaefer L, Gardinier JD, et al. グルココルチコイド誘発性骨粗鬆症における腸内細菌叢とバリア機能の関与。J Bone Miner Res (2020) 35:801-20. doi: 10.1002/jbmr.3947 [PubMed] [CrossRef] [Google Scholar].
Wang M, Zhu Z, Lin X, Li H, Wen C, Bao J, et al. 関節リウマチの治療において、腸内細菌叢はプレドニゾンの治療効果と副作用を媒介した。Arthritis Res Ther (2021) 23:1-10. doi: 10.1186/s13075-021-02620-w [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Huang EY, Inoue T, Leone VA, Dalal S, Touw K, Wang Y, et al. 副腎皮質ステロイドを用いた腸内細菌叢の再構築:炎症性腸疾患への影響。炎症性腸疾患(2015)21:963-72. doi: 10.1097/MIB.000000000332 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Lupien SJ, McEwen BS. 認知におけるコルチコステロイドの急性効果:動物とヒトモデル研究の統合。脳科学研究 (1997) 24:1-27. doi: 10.1016/S0165-0173(97)00004-0 [PubMed] [CrossRef] [Google Scholar].
ラットの受動的回避行動に対する海馬の副腎皮質ステロイドの影響。このような場合、"哺乳類 "であることが重要である。
水迷路における空間記憶形成に対するコルチコステロンの経験依存的促進効果。Eur J Neurosci (1997) 9:637-42. doi: 10.1111/j.1460-9568.1997.tb01412.x [PubMed] [CrossRef] [Google Scholar].
サンディC、ローズSPR。コルチコステロンは、弱い受動的回避学習パラダイムで訓練された生後1日のヒナの長期記憶を増強する。脳科学 (1994) 647:106-12. doi: 10.1016/0006-8993(94)91404-4 [PubMed] [CrossRef] [Google Scholar].
Buchanan TW, Lovallo WR. ヒトにおけるストレスレベルのコルチゾール処理後の感情的材料に対する記憶の増強。心理神経内分泌学 (2001) 26:307-17. doi: 10.1016/S0306-4530(00)00058-5 [PubMed] [CrossRef] [Google Scholar].
Lupien SJ, Wilkinson CW, Brière S, Ménard C, Ng Ying Kin NMK, Nair NPV. 認知における副腎皮質ステロイドの調節効果:若年ヒト集団における研究。心理神経内分泌学 (2002) 27:401-16. doi: 10.1016/S0306-4530(01)00061-0 [PubMed] [CrossRef] [Google Scholar].
ベックウィズBE、ペトロスTV、スカリオーネC、ネルソンJ.ヒト男性における記憶に対するヒドロコルチゾンの用量依存的効果。Physiol Behav (1986) 36:283-6. doi: 10.1016/0031-9384(86)90017-x [PubMed] [CrossRef] [Google Scholar].
Lupien SJ, McEwen BS, Gunnar MR, Heim C. 脳、行動、認知における生涯を通じたストレスの影響。Nat Rev Neurosci (2009) 10:434-45. doi: 10.1038/nrn2639 [PubMed] [CrossRef] [Google Scholar].
ブルーノG、ザッカーリP、ロッコG、スカレーゼG、パネッタC、ポロフスカB、ら。プロトンポンプ阻害薬とdysbiosis:現在の知識と解明されるべき側面。World J Gastroenterol (2019) 25:2706-19. doi: 10.3748/wjg.v25.i22.2706 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Lochhead P, Hagan K, Joshi AD, Khalili H, Nguyen LH, Grodstein F, et al. 女性におけるプロトンポンプ阻害薬の使用と認知機能との関連。Gastroenterology (2017) 153:971-979.e4. doi: 10.1053/j.gastro.2017.06.061 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
胃酸分泌抑制薬と胃酸分泌抑制薬との関連. 認知障害の有無にかかわらず、胃酸分泌抑制剤と認知機能低下。この論文では、胃酸抑制薬と認知機能低下について、認知機能障害の有無にかかわらず検討した。
Bajic JE, Johnston IN, Howarth GS, Hutchinson MR. ボトムアップから:化学療法と腸脳軸の調節障害。Front Behav Neurosci (2018) 12:104. doi: 10.3389/fnbeh.2018.00104 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Bilenduke E, Sterrett JD, Ranby KW, Borges VF, Grigsby J, Carr AL, et al. 乳がんと化学療法が腸内細菌叢、認知機能、気分に及ぼす影響(健常対照との比較)。SciのRep(2022)12:19547. doi:10.1038/s41598-022-23793-7 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Benros ME, Sørensen HJ, Nielsen PR, Nordentoft M, Mortensen PB, Petersen L. The association between infections and general cognitive ability in young men - a nationwide study. PloS One (2015) 10:e0124005. doi: 10.1371/journal.pone.0124005 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Muzambi R, Bhaskaran K, Brayne C, Smeeth L, Warren-Gash C. Common bacterial infections and risk of incident cognitive decline or dementia: a systematic review protocol. BMJ Open (2019) 9:e030874. doi: 10.1136/bmjopen-2019-030874 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Damiano RF, Guedes BF, de Rocca CC, de Pádua Serafim A, Castro LHM, Munhoz CD, et al. 急性ウイルス感染後の認知機能低下:文献レビューとCOVID-19後の予測。Eur Arch Psychiatry Clin Neurosci (2022) 272:139-54. doi: 10.1007/s00406-021-01286-4 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Fernandez-Cotarelo M-J, Nagy-Agren SE, Smolkin ME, Jimenez-Diez-Canseco L, Perez-Pomata M-T, Shenal BV, et al. 入院高齢者のクロストリジウム・ディフィシル感染における機能的および認知的状態:2施設の後方視的研究。J Gen Intern Med (2019) 34:1392-3. doi: 10.1007/s11606-019-04935-6 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Biazzo M, Allegra M, Deidda G. Clostridioides difficile and neurological disorders: new perspectives. PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Vinithakumari AA, Piyush P, Belen H, Je-Han LS, Aaron D-K, Lucas S, et al. クロストリジオイデス・ディフィシル感染は脳内ドーパミン代謝を調節する。また、そのような感染症を発症させる原因として、脳内ドーパミンの代謝異常が挙げられている。
Hazan S. 便微生物叢移植後のアルツハイマー病症状の急速な改善:症例報告。J Int Med Res (2020) 48:300060520925930. doi: 10.1177/0300060520925930 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Park S-H, Lee JH, Shin J, Kim J-S, Cha B, Lee S, et al. アルツハイマー型認知症患者における糞便微生物叢移植後の認知機能改善:症例報告。この論文では、アルツハイマー型認知症患者における糞便微生物移植後の認知機能改善について検討した。
Tarter KD, Simanek AM, Dowd JB, Aiello AE. 第3回国民健康栄養調査におけるライフコースにわたる持続性ウイルス病原体と認知障害。J Infect Dis (2014) 209:837-44. doi: 10.1093/infdis/jit616 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
NoppertGA、Aiello AE、O'Rand AM、Cohen HJ. Investigating pathogen burden in relation to a cumulative deficits index in a representative sample of US adults. Epidemiol Infect (2018) 146:1968-76. doi: 10.1017/S095026881800153X [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Katan M, Moon YP, Paik MC, Sacco RL, Wright CB, Elkind MSV. 感染負担と認知機能:北マンハッタン研究。Neurology (2013) 80:1209-15. doi: 10.1212/WNL.0b013e3182896e79 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ライトCB、ガーデナーH、ドンC、ヨシタM、デカルリC、サッコRL、ら。北マンハッタン研究における感染負担と認知機能低下。J Am Geriatr Soc (2015) 63:1540-5. doi: 10.1111/jgs.13557 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Lee YH, Papandonatos GD, Savitz DA, Heindel WC, Buka SL. 出生前の細菌感染が幼児期の認知能力に及ぼす影響。doi: 10.1111/ppe.12603 [PubMed] [CrossRef] [Google Scholar].
O'Connor TG, Ciesla AA, Sefair AV, Thornburg LL, Brown AS, Glover V, et al. 母親の出生前の感染と不安は、中年期の神経発達の転帰を予測する。J Psychopathol Clin Sci (2022) 131:422-34. doi: 10.1037/abn0000746 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Allen AP, Hutch W, Borre YE, Kennedy PJ, Temko A, Boylan G, et al. Bifidobacterium longum 1714 as a translational psychobiotic: modulation of stress, electrophysiology and neurocognition in healthy volunteers. Transl Psychiatry (2016) 6:e939. doi: 10.1038/tp.2016.191 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Chung Y-C, Jin H-M, Cui Y, Kim DS, Jung JM, Park J-I, et al. ラクトバチルス・ヘルベティカスIDCC3801の発酵乳は、健康な高齢者の認知疲労テスト中の認知機能を改善する。J Funct Foods (2014) 10:465-74. doi: 10.1016/j.jff.2014.07.007 [CrossRef] [Google Scholar].
Lew(ルー)L-C、Hor(ホー)Y-Y、Yusoff(ユーソフ)NAA、Choi(チョイ)S-B、Yusoff(ユーソフ)MSB、Roslan(ロスラン)NS、et al. プロバイオティクス乳酸菌プランタラムP8は、ストレスを受けた成人の記憶と認知を強化しながら、ストレスと不安を緩和した:無作為化二重盲検プラセボ対照試験。Clin Nutr (2019) 38:2053-64. doi: 10.1016/j.clnu.2018.09.010 [PubMed] [CrossRef] [Google Scholar].
Steenbergen L、Sellaro R、van Hemert S、Bosch JA、Colzato LS。悲しい気分に対する認知反応性に対する多種類のプロバイオティクスの効果を検証するランダム化比較試験。Doi: 10.1016/j.bbi.2015.04.003 [PubMed] [CrossRef] [Google Scholar].
Dahiya D, Nigam PS. プロバイオティクス食品、飲料、およびシンバイオティクスサプリメントの発酵に使用される微生物株の臨床的可能性は、腸脳シグナル伝達を介して認知治療のためのサイコバイオティクスとして。また、そのような微生物株は、腸-脳シグナル伝達を介した認知治療のためのサイコバイオティクスとして、プロバイオティクス食品、シンバイオティクスサプリメントに使用されている。
Tillisch K、Labus J、キルパトリックL、江Z、ステインJ、Ebrat B、ら。プロバイオティクスと発酵乳製品の消費量は、脳の活動を調節する。消化器病学(2013)144:1394-401、1401.e1-4. doi: 10.1053/j.gastro.2013.02.043 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
パパリーニS、ミケルスF、コーンN、ウェグマンJ、ファン・ヘマートS、Roelofs K、ら。ストレスの問題:神経認知に対するプロバイオティクスの効果に関するランダム化比較試験。Neurobiol Stress (2019) 10:100141. doi: 10.1016/j.ynstr.2018.100141 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Rode J, Edebol Carlman HMT, König J, Hutchinson AN, Thunberg P, Persson J, et al. マルチストレイン・プロバイオティクス混合物は、健常被験者の脳形態と安静時脳機能に影響を与える:RCT。Cells (2022) 11:2922. doi: 10.3390/cells11182922 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Edebol Carlman HMT, Rode J, König J, Repsilber D, Hutchinson AN, Thunberg P, et al. ラクトバチルス・ヘルベティカス、ビフィドバクテリウム・ロンガムおよびラクチプランタラムを含むプロバイオティクス混合物は、健常被験者の算数ストレス課題に対する脳反応に影響を与える:無作為化臨床試験および概念実証試験。doi: 10.3390/nu14071329 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Bloemendaal M, Szopinska-Tokov J, Belzer C, Boverhoff D, Papalini S, Michels F, et al. プロバイオティクスによる腸内細菌組成の変化とストレス後の認知能力への影響:探索的分析。この論文では、プロバイオティクスによる腸内細菌組成の変化と、ストレス後の認知パフォーマンスへの影響について検討した。
Liu G, Chong H-X, Chung FY, Li Y, Liong M-T. ストレスの多い成人において、乳酸菌DR7は腸の動きと腸内細菌叢を調節し、ドーパミンとセロトニンの経路に関連した。また、このような腸内細菌叢は、ストレスの影響を受けやすいと考えられている。
Akbari E, Asemi Z, Daneshvar Kakhaki R, Bahmani F, Kouchaki E, Tamtaji OR, et al. アルツハイマー病における認知機能と代謝状態に対するプロバイオティクス補給の効果:無作為化二重盲検比較試験。Front Aging Neurosci (2016) 8:256. doi: 10.3389/fnagi.2016.00256 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Roman P, Estévez AF, Miras A, Sánchez-Labraca N, Cañadas F, Vivas AB, et al. 線維筋痛症におけるプロバイオティクスの認知的および感情的効果を探索するためのパイロットランダム化比較試験。Sci Rep (2018) 8:10965. doi: 10.1038/s41598-018-29388-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
マラトジーBG、メイソンS、ミエニーLJ、ウェヴァースRA、マイヤーH、ファン・リーネンM、他。線維筋痛症候群患者におけるGC-MSメタボロミクスシグネチャーは、FMS病態生理の一因としてのディスバイオーシスを示唆する。Metabolomics (2019) 15:54. doi: 10.1007/s11306-019-1513-6 [PubMed] [CrossRef] [Google Scholar].
Pinto-Sanchez MI, Hall GB, Ghajar K, Nardelli A, Bolino C, Lau JT, et al. プロバイオティクス・ビフィドバクテリウム・ロンガムNCC3001は、抑うつスコアを低下させ、脳活動を変化させる:過敏性腸症候群患者におけるパイロット研究。Gastroenterology (2017) 153:448-459.e8. doi: 10.1053/j.gastro.2017.05.003 [PubMed] [CrossRef] [Google Scholar].
Dinan TG、Cryan JF。メランコリック微生物:腸内細菌叢とうつ病の関連性?Neurogastroenterol Motil (2013) 25:713-9. doi: 10.1111/nmo.12198 [PubMed] [CrossRef] [Google Scholar].
Fernandez-Real J-M, Serino M, Blasco G, Puig J, Daunis-i-Estadella J, Ricart W, et al. 腸内細菌叢は脳の微細構造と機能に相互作用する。J Clin Endocrinol Metab (2015) 100:4505-13. doi: 10.1210/jc.2015-3076 [PubMed] [CrossRef] [Google Scholar].
Mahboobi S, Ghasvarian M, Ghaem H, Alipour H, Alipour S, Eftekhari MH. プロバイオティクスとマグネシウムの共同補給が、肥満と抑うつ気分を有する人の気分、認知、腸管バリア機能、炎症に及ぼす影響:無作為化二重盲検プラセボ対照臨床試験。Doi:10.3389/fnut.2022.1018357[PMCフリー記事] [PubMed][クロスリーフ] [Googleスカラー]。
O'Brien MER, Anderson H, Kaukel E, O'Byrne K, Pawlicki M, Von Pawel J, et al. 進行非小細胞肺癌患者において、標準化学療法に追加したSRL172(殺マイコバクテリウム・ヴァカエ)は、生存期間に影響を与えることなくQOLを改善した:第III相試験結果。Ann Oncol Off J Eur Soc Med Oncol (2004) 15:906-14. doi: 10.1093/annonc/mdh220 [PubMed] [CrossRef] [Google Scholar].
Smith AP, Sutherland D, Hewlett P. An investigation of the acute effects of oligofructose-enriched inulin on subjective wellbeing, mood and cognitive performance. Nutrients(2015)7:8887-96。 doi:10.3390/nu7115441 [PMCフリー記事] [PubMed] [クロスリーフ] [Google Scholar] 。
シュミットK、コーウェンPJ、ハーマーCJ、Tzortzis G、エリントンS、バーネットPWJ。プレバイオティクスの摂取は、覚醒時のコルチゾール反応を低下させ、健康なボランティアにおける感情の偏りを変化させる。心理薬理学(2015)232:1793-801. doi: 10.1007/s00213-014-3810-0 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
腸内細菌叢-脳軸、サイコバイオティクスと脳と行動への影響:システマティックレビュー。Doi:10.1016/j.psyneuen.2021.105640[PubMed] [CrossRef] [Google Scholar].
Kelly JR, Allen AP, Temko A, Hutch W, Kennedy PJ, Farid N, et al. 潜在的な精神生物学的ラクトバチルス・ラムノサス(JB-1)は、健康な男性被験者のストレスや認知能力を調節できない。Brain Behav Immun (2017) 61:50-9. doi: 10.1016/j.bbi.2016.11.018 [PubMed] [CrossRef] [Google Scholar].
バッソM、ジョンストンN、Knytl P、ナウタA、Groeneveld A、コーエンKadosh K.認知機能と感情的行動を強化するために、子供や青少年における精神生物学的介入のシステマティックレビュー。Doi:10.3390/NU14030614 [PMCフリー記事] [PubMed] [クロスリーフ] [Googleスカラー]。
マルクスW、Scholey A、ファースJ、D'クーニャNM、レーンM、ホッケーM、ら。プレバイオティクス、プロバイオティクス、発酵食品と認知アウトカム:ランダム化比較試験のメタアナリシス。神経科学 Biobehav Rev (2020) 118:472-84. doi: 10.1016/j.neubiorev.2020.07.036 [PubMed] [CrossRef] [Google Scholar].
Sweis BM, Veverka KK, Dhillon ES, Urban JH, Lucas LR. 慢性ストレスが記憶に及ぼす影響の個人差:回復力の行動学的および神経化学的相関。神経科学 (2013) 246:142-59. doi: 10.1016/j.neuroscience.2013.04.052 [PubMed] [CrossRef] [Google Scholar].
RoosのLG、Janson J、Sturmbauer SC、ベネットJM、Rohleder N.高い形質再評価は、繰り返しストレスに対する強いHPA軸の慣れを予測する。Psychoneuroendocrinology (2019) 101:12-8. doi: 10.1016/j.psyneuen.2018.10.018 [PubMed] [CrossRef] [Google Scholar].
微生物叢と視床下部-下垂体-副腎皮質(HPA)軸、不安とストレス障害への影響。Curr Opin Neurobiol (2020) 62:76-82. doi: 10.1016/j.conb.2019.12.003 [PubMed] [CrossRef] [Google Scholar].
Ge L, Liu S, Li S, Yang J, Hu G, Xu C, et al. 炎症性腸疾患における心理的ストレス:双方向性腸脳コミュニケーションへの心理神経免疫学的洞察。Front Immunol (2022) 13:1016578. doi: 10.3389/fimmu.2022.1016578 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Skrobisz K, Piotrowicz G, Rudnik A, Naumczyk P, Sabisz A, Markiet K, et al. 非特異的消化器疾患患者における皮質下構造体積の評価。Doi: 10.3390/diagnostics12092199 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
心理社会的ストレスによる健常人の前頭前野活動と腸内細菌叢の関係-機能的近赤外分光法による研究-.
Kennedy PJ, Clarke G, O'Neill A, Groeger JA, Quigley EM, Shanahan F, et al. 過敏性腸症候群(IBS)における認知機能の評価:視覚-空間記憶の障害は、ストレスに関連し、キヌレニン経路に沿ってトリプトファン代謝によって媒介されるか?Gastroenterology (2012) 142:S-548. doi: 10.1016/S0016-5085(12)62105-2 [CrossRef] [Google Scholar].
Kennedy PJ, Clarke G, Quigley EMM, Groeger JA, Dinan TG, Cryan JF. 腸の記憶:過敏性腸症候群の認知神経生物学に向けて。Neurosci Biobehav Rev (2012) 36:310-40. doi: 10.1016/j.neubiorev.2011.07.001 [PubMed] [CrossRef] [Google Scholar].
Kennedy PJ, Clarke G, O'Neill A, Groeger JA, Quigley EMM, Shanahan F, et al. 過敏性腸症候群における認知能力:視空間記憶におけるストレス関連障害の証拠。心理医学(2014)44:1553-66. doi: 10.1017/S0033291713002171 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
相澤恵子、佐藤康晴、小知山哲也、齋藤直樹、泉山正明、森下潤一郎、他.過敏性腸症候群患者におけるエラーフィードバック時の前頭前野の認知機能の変化、FMRIと動的因果モデリングに基づく。Gastroenterology (2012) 143:1188-98. doi: 10.1053/j.gastro.2012.07.104 [PubMed] [CrossRef] [Google Scholar].
Klarer M, Weber-Stadlbauer U, Arnold M, Langhans W, Meyer U. Cognitive effects of subdiaphragmatic vagal deafferentation in rats. Neurobiol Learn Mem (2017) 142:190-9. doi: 10.1016/j.nlm.2017.05.006 [PubMed] [CrossRef] [Google Scholar].
アルツハイマー病モデルマウスにおけるC/EBPβ/AEPシグナル活性化に関連した腸内細菌異常症がアミロイド病態に寄与している。また、そのような病態は、アルツハイマー病モデルマウスにおけるC/EBPβ/AEPシグナリングの活性化と関連していることが示唆されている。
マウスにおける記憶・学習行動は、食事によって誘発される腸内細菌の変化と時間的に関連している。また、「食餌によって腸内細菌が変化すると、マウスの記憶と学習行動が時間的に変化する」とも報告されている。
アルツハイマー病における脳-腸-微生物叢軸。J Neurogastroenterol Motil (2019) 25:48-60. doi: 10.5056/jnm18087 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Gubert C, Choo JM, Love CJ, Kodikara S, Masson BA, Liew JJM, et al. 糞便微生物叢移植は、ハンチントン病マウスにおける腸内細菌異常症と認知障害を改善する。脳内細菌叢移植によるハンチントン病マウスの腸内細菌叢異常と認知障害の改善.
Li Y, Ning L, Yin Y, Wang R, Zhang Z, Hao L, et al. 加齢に伴う腸内細菌叢のシフトは、高齢ラットの認知機能低下に寄与する。Aging (2020) 12:7801-17. doi: 10.18632/aging.103093 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ティルグH、モッシェンAR。食品、免疫、マイクロバイオーム。消化器病学(2015)148:1107-19. doi: 10.1053/j.gastro.2014.12.036 [PubMed] [CrossRef] [Google Scholar].
ルチアーノM、コーリーJ、コックスSR、バルデスエルナンデスMC、クレイグLCA、ディッキーDA、ら。スコットランドのコホートにおける73歳から76歳までの地中海食と脳構造の変化。Neurology (2017) 88:449 LP - 455. doi: 10.1212/WNL.000000003559 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Ghosh TS, Rampelli S, Jeffery IB, Santoro A, Neto M, Capri M, et al. 地中海食介入は高齢者の腸内細菌叢を変化させ、虚弱を軽減し、健康状態を改善する:欧州5カ国にわたるNU-AGE 1年間の食事介入。腸(2020)69:1218-28. doi:10.1136/gutjnl-2019-319654 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Horn J, Mayer DE, Chen S, Mayer EA. 精神疾患の病態生理における食事と腸内細菌叢への影響の役割。Doi:10.1038/s41398-022-01922-0【PMCフリー記事】【PubMed】【CrossRef】【Google Scholar】。
栄養、腸内細菌叢、およびアルツハイマー病。フロント精神医学(2021)12:712673. doi: 10.3389/fpsyt.2021.712673 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
リーS-J、モリスMJ。食事、炎症、腸内細菌叢:肥満に伴う認知機能障害のメカニズム。Doi: 10.1016/j.bbadis.2020.165767 [PubMed] [CrossRef] [Google Scholar].
オーランドCL、キシュL、ベルH、ティーセンA、ホッテN、パンキフE、ら。マウス行動に対するラクトバチルス・ヘルベティカスの効果は、食餌と遺伝子型に依存し、腸内細菌叢の変化と相関する。
Agustí A、García-Pardo MP、López-Almela I、Campillo I、Maes M、Romaní-Pérez M、他。腸脳軸、肥満、認知機能の相互作用。Doi: 10.3389/fnins.2018.00155 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Proctor C, Thiennimitr P, Chattipakorn N, Chattipakorn SC. 食事、腸内細菌叢と認知。Metab Brain Dis (2017) 32:1-17. doi: 10.1007/s11011-016-9917-8 [PubMed] [CrossRef] [Google Scholar].
Otaegui-Arrazola A、Amiano P、Elbusto A、Urdaneta E、Martínez-Lage P.ダイエット、認知、アルツハイマー病:思考のための食品。Eur J Nutr(2014)53:1-23。
Bruce-Keller AJ, Salbaum JM, Luo M, Blanchard E4, Taylor CM, Welsh DA, et al. 肥満型腸内細菌叢は、肥満がない状態で神経行動学的変化を誘導する。Biol Psychiatry (2015) 77:607-15. doi: 10.1016/j.biopsych.2014.07.012 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Soto M, Herzog C, Pacheco JA, Fujisaka S, Bullock K, Clish CB, et al. 腸内細菌叢は、脳のインスリン感受性と代謝の変化を通じて神経行動を調節する。Mol Psychiatry (2018) 23:2287-301. doi: 10.1038/s41380-018-0086-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Jaric I, Voelkl B, Clerc M, Schmid MW, Novak J, Rosso M, et al. 飼育環境はマウスの表現型を分子レベルから行動レベルまで持続的に変化させる。この論文では、マウスの飼育環境を分子レベルから行動レベルまで持続的に変化させることを明らかにした。
郭P、雷M、胡S、徐Z、周Y、周P、ら。長期的なLDR曝露は認知障害を誘発する可能性がある:腸内細菌叢-腸-脳軸を標的とした関連性の可能性。このような環境下での長期的なLDR曝露は、認知機能障害を引き起こす可能性がある。
Luo X-X, Yang C, Zhan G-F, Li S, Hua D-Y, Luo A-L, et al. 全脳放射線療法によるマウスの認知機能障害:腸内細菌叢の重要な役割。
Xiang C, Chen P, Zhang Q, Li Y, Pan Y, Xie W, et al. 腸内細菌叢はクロマフィン細胞におけるNod1感知を介して副腎髄質反応を調節する。
Kostadinova F, Schwaderer J, Sebeo V, Brunner T. なぜ腸はグルココルチコイドを合成するのか?Ann Med (2014) 46:490-7. doi: 10.3109/07853890.2014.932920 [PubMed] [CrossRef] [Google Scholar].
Noti M, Sidler D, Brunner T. 腸管上皮における副腎外グルココルチコイド合成:大海の一滴以上?Semin Immunopathol (2009) 31:237-48. doi: 10.1007/s00281-009-0159-2 [PubMed] [CrossRef] [Google Scholar].
Huang J, Jia R, Brunner T. 腸管上皮における免疫抑制性グルココルチコイドの局所合成は、抗ウイルス免疫応答を制御する。Cell Immunol (2018) 334:1-10. doi: 10.1016/j.cellimm.2018.08.009 [PubMed] [CrossRef] [Google Scholar].
Merk VM, Phan TS, Brunner T. Regulation of tissue immune responses by local glucocorticoids at epithelial barriers and their impact on interorgan crosstalk. また、そのような免疫反応を制御するために、免疫細胞間相互作用の解析が重要であることも指摘されている。
Talabér G, Jondal M, Okret S. 副腎外グルココルチコイド合成:免疫制御と局所臓器ホメオスタシス上の側面。Doi:10.1016/j.mce.2013.05.007【PubMed】【CrossRef】【Google Scholar】。
Ergang P, Vagnerová K, Hermanová P, Vodička M, Jágr M, Šrůtková D, et al. 腸内細菌叢はマウス小腸におけるコルチコステロン産生に影響する。この論文では、腸内細菌叢がマウス小腸におけるコルチコステロン産生に影響を及ぼすことを明らかにした。
Mukherji A, Kobiita A, Ye T, Chambon P. 腸管上皮の恒常性は、概日時計とTLRによって伝達される微生物叢の合図によって調整される。Cell (2013) 153:812-27. doi: 10.1016/j.cell.2013.04.020 [PubMed] [CrossRef] [Google Scholar].
Paolo WFJ, Nosanchuk JD. 副腎感染症。PMC無料記事] [PubMed][CrossRef][Googleスカラー] [PMC無料記事] [PMC無料記事] [PubMed][CrossRef][Googleスカラー]。
Quénéhervé L, Drui D, Blin J, Péré M, Coron E, Barbara G, et al. 慢性副腎不全患者の日常生活における消化器症状は、過敏性腸症候群の症状と類似している。Sci Rep (2021) 11:8077. doi: 10.1038/s41598-021-87158-2 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Frontiers in Endocrinologyの記事はFrontiers Media SAの好意により提供されています。
NCBIをフォローする
NLMとつながる
国立医学図書館
8600 Rockville Pike
ベセスダ、メリーランド州20894
ウェブポリシー
情報公開
HHS脆弱性情報公開
ヘルプ
アクセシビリティ
採用情報
NLM
NIH
保健省
USA.gov
ご意見をお聞かせください!
