
寒冷曝露による脳ペプチドームと腸内細菌叢の変化はマウスのエネルギー恒常性と関連している
分子細胞プロテオミクス
第22巻 第4号 2023年4月 100525号
研究論文コレクション 神経生物学プロテオミクス
寒冷曝露による脳ペプチドームと腸内細菌叢の変化はマウスのエネルギー恒常性と関連している
https://www.sciencedirect.com/science/article/pii/S153594762300035X
著者リンク オーバーレイパネルを開くXue Wang 1 2 ‡, Qianqian Wang 1 ‡, Mingxin Zhao 1, Ying Xu 1, Bin Fu 1, Li Zhang 3, Shuai Wu 3, Danfeng Yang 3, Chenxi Jia 1
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.mcpro.2023.100525Get 権利と内容
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
寒さに応答する脳ペプチドームと腸内マイクロバイオームの相互作用
ProSAAS由来ペプチドは乳酸菌と正の相関を示した。
視床下部-下垂体軸は敏感な反応を示す。
寒冷適応微生物群はニューロキニンBを減少させ、エネルギー消費を変化させる。
概要
寒冷暴露下における哺乳類のエネルギー恒常性維持には、複雑な神経制御が関与しており、腸内細菌叢の影響を受けている。しかし、その制御機構は、関与するシグナル伝達分子に関する包括的な知見が不足しているため、部分的には不明なままである。本研究では、寒冷曝露モデルマウスを用いて、脳ペプチドームの領域分解可能な定量的プロファイリングを行い、寒冷に対する腸内細菌と脳ペプチドの相互作用を調べた。脳ペプチドームの領域特異的な変化は、慢性的な寒冷曝露中に観察され、腸内細菌叢の組成と相関していた。いくつかのproSAAS由来ペプチドは乳酸菌と正の相関を示した。視床下部-下垂体軸は寒冷曝露に対して敏感な反応を示した。寒冷によるエネルギー恒常性の制御に関与する可能性のある生理活性ペプチドの候補プールを得た。マウスの寒冷適応微生物叢への介入は、視床下部のニューロキニンBの量を減少させ、その後、エネルギー消費の燃料源を脂質からグルコースへとシフトさせることに貢献した。以上のことから、本研究は、腸内細菌がエネルギー代謝に寄与する脳内ペプチドを調節することを実証し、寒冷曝露時のエネルギー恒常性調節機構を理解するためのデータ資源を提供するものである。
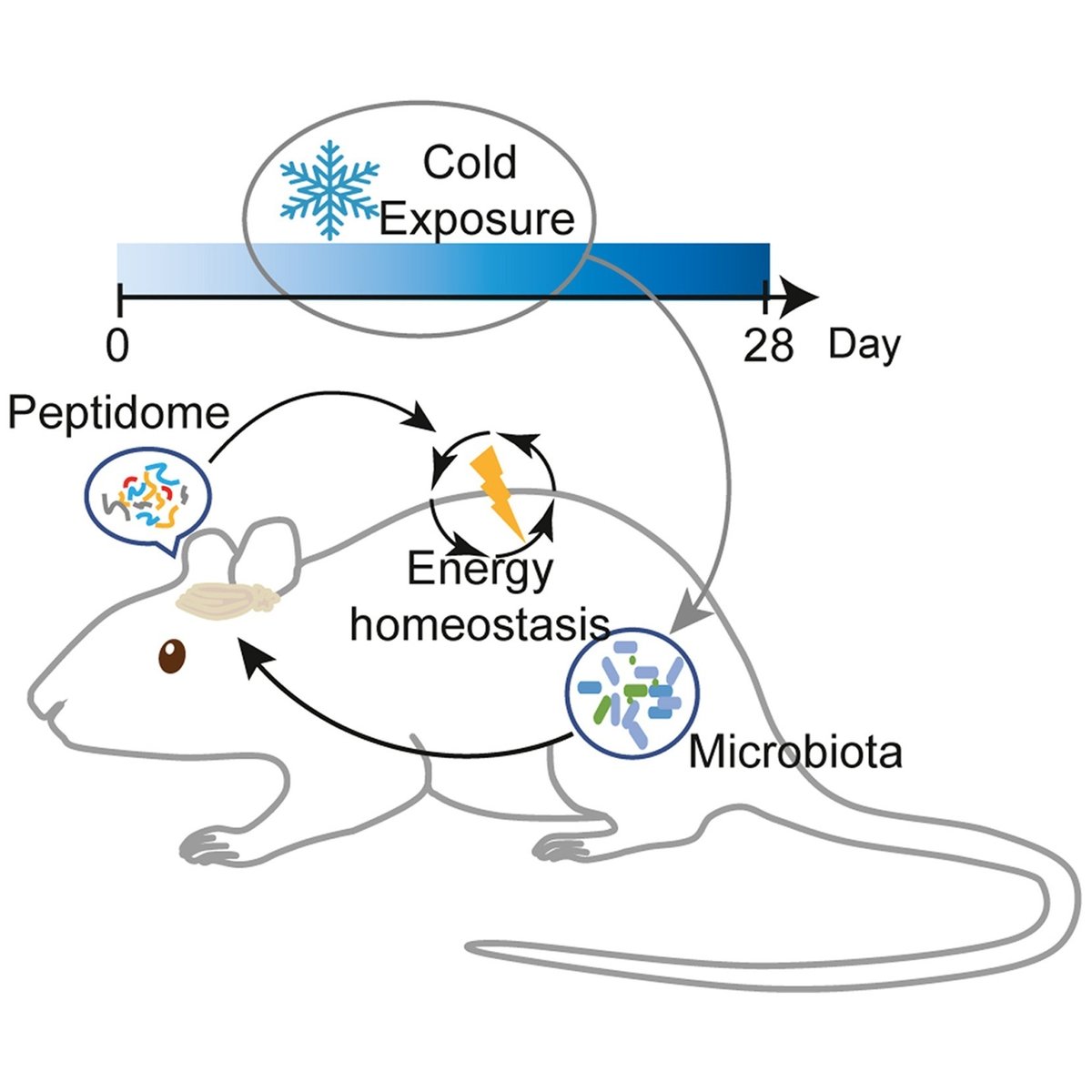
グラフィカルアブストラクト
ダウンロード 高解像度画像ダウンロード(198KB)
ダウンロード フルサイズ画像のダウンロード
前の記事
次の記事
キーワード
ニューロペプチドミクス
神経ペプチド
腸内マイクロバイオーム
寒冷曝露
エネルギー代謝
腸脳軸
略語
ACE
急性寒冷曝露
BAT
褐色脂肪組織
CCE
慢性寒冷曝露
CLAMS
包括的実験動物モニタリングシステム
FA
ギ酸
GLP-1
グルカゴン様ペプチド-1
HP
視床下部-下垂体
ICV
脳室内
LC-MS/MS
タンデム質量結合液体クロマトグラフィー
MS
質量分析
NK3R
ニューロキニン3受容体
PRM
パラレルリアクションモニタリング
RER
呼吸交換比
RT
室温
神経ペプチドは、シナプスの末端から分泌され、受容体に結合して、生殖、摂食、痛み、記憶、気分、不安、報酬、概日リズムなど、多くの機能を発揮する、一群の正規の内因性細胞間シグナル伝達分子である(1, 2, 3, 4, 5)。このような生理学的プロセスに加え、神経ペプチドはエネルギーのホメオスタシスと密接な関係がある(6, 7, 8, 9)。例えば、サブスタンスP(10)とニューロペプチドY(11)は、マウスの体重増加とエネルギー貯蔵を促進する、オレキシジェニック調節における強力なモジュレーターである。グルカゴン様ペプチド-1(GLP-1)は、視床背内側下部のGLP-1受容体をトリガーとして、褐色脂肪組織(BAT)の熱産生と肝トリグリセリド動員を増加させる(12)。代謝性疾患の治療標的となりうるGLP-1は、生物のエネルギー恒常性を調節する神経ペプチドとして、深く研究される意義がある。
環境温度が低い場合、哺乳類では摂食亢進とBAT熱発生がエネルギー恒常性を維持するための2つの適応反応である。従来、寒冷による食欲亢進は、寒冷による熱産生がもたらす負のエネルギーバランスに対する二次的な反応であると考えられてきた。最近、Deemら(14)は、寒冷による摂食亢進はAgRPニューロンの活性化を通じて制御され、熱発生とは無関係に起こることを報告した。さらに、BATの熱産生は、主に視索前野、視床下部背内側、淡蒼球背外側で活性化する経路を介して起こる(15)。Fengら(16)は最近、視床下部背内側ニューロンが寒冷に敏感で、恒常性体温発生を調節することを発見した。この2つの生理学的プロセスの根底にある複雑な神経回路を完全に解明するには、機能分子に関する包括的な知識が必要である。現在までのところ、寒冷曝露が中枢神経系のペプチドームをどのように再形成するかは、ほとんど解明されていない。
腸内細菌叢は、消化管内の常在菌で構成され、宿主とともに発達し、宿主のエネルギー代謝に寄与している(17)。一方、腸内細菌叢の異常は、肥満、2型糖尿病、肝硬変、脂質異常症などの様々な代謝性疾患を引き起こす可能性がある(17)。臨床的関連性に関しては、腸内細菌叢は代謝性疾患の管理を改善するための新たな診断・予後マーカーあるいは治療標的として浮上している(18)。最近、Chevalierら(19)は、寒冷曝露によりマウスの微生物叢組成が変化すること、また、寒冷曝露したドナーマウスの微生物叢を移植することで、無菌レシピエントマウスにおいてインスリン感受性、褐変、エネルギー消費、耐寒性を高めるのに十分であることを明らかにした。Zietakら(20)はさらに、寒冷適応微生物叢が宿主の胆汁酸分泌とエネルギー代謝を改善し、無菌レシピエントマウスにおける食事誘発性肥満を抑制することを示した。このように、腸内細菌叢は、寒冷によるエネルギー恒常性の神経循環および神経内分泌調節に関する研究において、無視できない因子である。Perryら(21)は、微生物叢-脳-β細胞軸が酢酸によって制御され、メタボリックシンドロームを促進することを報告している。Hamamahら(22)は、腸内細菌叢が視床下部神経ペプチドの欠損を回復させ、マウスのエネルギー代謝を調節することを発見した。これらの証拠は、微生物叢-腸-脳軸がエネルギー代謝に関与していることを示唆している。したがって、腸内細菌叢は脳ペプチドームと相互作用して、寒冷環境から身を守るためのエネルギー恒常性を調節しているのではないかと推測される。
本研究では、寒冷曝露マウスモデルを構築し、質量分析(MS)ベースのペプチドーム解析と16S rRNAシーケンス解析に基づいて、エネルギー恒常性に関連する脳ペプチドームと腸内細菌叢の相互作用を調べた。その結果、寒冷による脳ペプチドームの変化が腸内細菌叢の構成と関連していることが示された。寒冷適応微生物群(慢性寒冷曝露(CCE)後のマウスの糞便)を経口投与すると、マウスの視床下部のニューロキニンBの量が減少し、代謝状態の変化にさらに寄与した。寒冷曝露に応答する脳ペプチドームの領域分解可能なデータセットは、寒冷誘導性エネルギー恒常性の神経循環および神経内分泌制御の研究に貴重なリソースを提供し、ペプチドと微生物との間に新たに同定されたつながりは、腸-脳コミュニケーションを理解するための大きな洞察を提供する。
実験手順
実験デザインと統計的根拠
特に断りのない限り、動物番号と統計学的検定は図の凡例に明記した。寒冷曝露動物実験では、各群9~10匹のマウスを用い、ペプチド解析と16S rRNA配列決定を行った。代謝パラメータの動物実験では、各群3~4匹のマウスを用いた。パラレル・リアクション・モニタリング(PRM)解析では、各群5匹のマウスを用いた。統計学的有意性は両側対応のないstudent t testを用いて算出し、多重比較にはBenjamini-Hochberg調整を用いた。
動物と寒冷曝露処理
8週齢のSPFグレードC57BL/6雄性マウス(SPFバイオテクノロジー社製)を1ケージ2匹として、12時間/12時間の明暗サイクル、湿度50~60%の環境下で飼育した。2週間馴化させた後、マウス(各群n = 10)を室温群(RT群)、急性寒冷曝露群(ACE群)、CCE群の3群に分けた。全治療期間は28日間である。RT群のマウスは全治療期間中、室温(25℃)で飼育した。ACE群のマウスは26日間室温で飼育し、最後の2日間は12℃のコールドチャンバーに移してACEを行った。CCE群のマウスは全投与期間中12℃のコールドチャンバーで飼育した。投与期間中、すべてのマウスは餌と水を自由に摂取できた。各マウスの体重は、最初の4日間と最後の3日間は毎日モニターした以外は、投与期間中3日ごとにモニターした。環境温度以外は3群間で同じ条件とした。他の要因によるばらつきを避けるため、動物への操作は毎日決まった時間に同じ研究者が行った。動物実験は、北京国家蛋白質科学センター動物倫理委員会(IACUC-20200911-33M)および天津市環境運用医学研究所動物倫理委員会(AMMS-04-2022-027)の承認を得た。
組織解剖、糞便採取、ペプチド抽出
投与後、28日目にすべてのマウスを犠牲にし、視床下部、海馬、下垂体を直ちに解剖した。各動物の組織採取は3分以内に終了した。新鮮な組織を氷上に置き、0.1%プロテアーゼ阻害剤(Roche)を含むリン酸緩衝生理食塩水(Gibco、pH7.4)で2回洗浄した後、750kWの電子レンジで15秒間加熱した(23, 24)。最後に、組織は将来の使用のために-80℃で保存した。最後の新鮮な糞便は処理直後に採取し、-80℃で保存した。
組織をガラス粉砕機で冷酸性化メタノール(90%メタノール、1%酢酸、9%水、v/v)でホモジナイズし、2分間超音波処理した。混合物を14,000g、10分間、4℃で遠心分離し、不溶性ペレットを除去した。不溶性ペレットを冷たい酸性化メタノールでホモジネート状態に再懸濁し、上記のステップを3回繰り返した。すべての上清を合わせ、SpeedVacで乾燥させた。ペプチドサンプルを0.1%ギ酸(FA)に懸濁し、C18 ZipTip(Agilent)で脱塩し、タンデム質量分析(LC-MS/MS)分析に用いた。各動物の組織および糞便のサンプルは、独立に採取、調製、分析した。
LC-MS/MS分析
LC-MS/MS分析は、Orbitrap Q Exactive HF質量分析計(Thermo Fisher Scientific)とEASY-nLC 1200ナノ高性能LCシステム(Thermo Fisher Scientific)を接続して行った。500ngのペプチドサンプルをC18プレカラム(粒径1.9μm、長さ2cm×内径100μm)にロードし、C18分析カラム(粒径1. 9μm、長さ15cm、内径150μm)を用いて、流速600nl/min、65分間のグラジエントで分離した:溶媒Bを4~9%で1分間、9~15%で8分間、15~28%で33分間、28~40%で10分間、40~69%で10分間、69~95%で3分間(溶媒Aは0.1%FAを含む水、溶媒Bは0.1%FAを含む80%アセトニトリル、v/v)。溶出したペプチドは、加熱キャピラリー温度320℃、スプレー電圧2.2kVのナノESIスプレーでイオン化した。質量スペクトルは、データ依存の取得モードで、フルスキャンモードで120,000、MS/MSモードで15,000の分解能で収集した。フルスキャンはOrbitrapでスキャン範囲250から1800 m/zで処理した。各スキャンで上位20個の高強度イオンを選択し、規格化衝突エネルギー29%の高エネルギー衝突解離フラグメンテーションを行い、Orbitrapで測定した(23)。自動ゲインコントロールのターゲットは、フルスキャンで3×e6イオン、MS/MSスキャンで2×e5イオン、最大注入時間はフルスキャンで80ms、MS/MSスキャンで80ms、ダイナミック排除は13秒とした。
ティア3のPRM分析では、すべてのターゲットペプチドのm/zとリテンションタイムの値をXcaliburソフトウェアのインクルードリストにアップロードした。その他のパラメータはすべて前述と同じである。標的ペプチド定量は、Skylineソフトウェアv.21.2.0.568 (25)を用いて行った。ペプチドの設定は以下の通り: C末端アミド化。トランジション設定は以下の通り:プリカーサーの電荷は2, 3, 4, 5, 6、イオンの電荷は1または2、イオンのタイプはy, b、プロダクトイオンは3番目から最後のイオン、イオンのマッチング許容値は0.02 m/z、MS/MSスキャンのリテンションタイムは2分。ペプチドライブラリは、RAWデータをアップロードして作成し、同じRAWデータからPEAKS Studio v8.5で検索した結果、同定されたペプチドのリストを作成した。PEAKS Studioから得られたトータルイオンクロマトグラムは、PRM結果の正規化に使用した。各ペプチドについて標準偏差を算出した。
糞便サンプルの16S rRNA分析
MoBio PowerSoil Kit (26)を用いてマウスの糞便細菌ゲノムDNAを抽出した。16S rRNA遺伝子をポリメラーゼ連鎖反応により可変領域V3およびV4をターゲットとして増幅し、Illumina Hiseq 2500ハイスループットプラットフォームで塩基配列を決定した。ペアエンドリード間のオーバーラップは、Flash (27)ソフトウェアを用いてスプライスした。オーバーラップしたリードの品質はQ値>25を適用。Uclust Method of Quantitative Insights Into Microbial Ecology (28)を用いて、97%配列類似度による操作的分類単位のクラスタリング解析を行った。フィルタリングされた配列は、SILVAデータベース(29)を用いてα多様性とβ多様性を分類し、重み付きUniFrac(30)距離行列に基づいて計算した。
データベース検索とバイオインフォマティクス解析
質量分析RAWデータをPEAKS Studio v8.5で検索し、2020年7月にダウンロードされた一般にアクセス可能なデータベースを集約・濾過したペプチドデータベースと比較した: Neuropeptides.nl(31)(106件)、SwePep(15)(132件)、Neuropred.com(32)(188件)、Neuropedia.com(33)(58件)から冗長な配列を削除し、十分なヘッダー情報を追加した。データベース検索のパラメータ設定は、前駆体質量の最大偏差10ppm、フラグメントイオンの偏差0.02 Da、酵素消化なし。Qからのピロglu、Eからのピロglu、酸化(M)、C末端アミド化、リン酸化(STY)、アセチル化(K)などの動的修飾。各ペプチドは最大3つの可変修飾を持つことができる。ペプチドレベルでのFDR<1%は、デコイ融合アプローチ(34)を用いて推定した。3つ以上の生物学的複製で同定されたペプチド(-10logP≥20)を,効果的な同定とみなした.C末端がアミド化され,次の残基がノングリシンであるペプチドは除外した.5および6アミノ酸のペプチドについては、フラグメントイオンに連続する3つ以上のbまたはyイオンの配列タグが含まれているかどうかを調べることにより、さらなるキュレーションを行った。
抽出したイオンクロマトグラムに基づくラベルフリーの定量は、PEAKS Qモジュールを用いて行った。設定は、-10logP≥20、quality≥0.2、FDR <1%(ペプチドレベル)。定量情報は.csvファイルとしてエクスポートされ、さらにバイオインフォマティクス処理が行われた。少なくとも1つのグループで有効な定量値が70%以上のペプチドを保持した。欠損値のインピュテーションは最小値の10%とした。すべてのデータはRパッケージでプロットした。遺伝子オントロジー濃縮解析はRパッケージorg.Mm.eg.dbを用いて行った。
マウスの代謝パラメータ
Comprehensive Lab Animal Monitoring System (CLAMS, Columbus Instruments)は、実験開始前にガスセンサーでO2 (20.9%)とCO2 (0.05%)の標準含有量で校正された。室内空気は0.5LPMの流量でチャンバーに通された。酸素消費量(VO2)と二酸化炭素発生量(VCO2)はセンサーで検出した。呼吸交換比(RER)はVCO2/VO2の比として計算された。熱産生は交換された気体の体積に基づいて計算された。食物摂取量は食物センサーでモニターした。8週齢の雄マウスをCLAMSチャンバーで2日間馴化させた後、25mgの糞便(寒冷曝露群のもの)を生理食塩水と混合した懸濁液600μlを胃内投与した。9時間の回復後、マウスの放熱量、熱産生および摂餌量をモニターした。CLAMSチャンバーから取り出した後、マウスを犠牲にし、直ちに視床下部を解剖した。ペプチドサンプルはPRM分析用に調製した。
脳定位手術と脳室内処置
2週間馴化した8週齢のSPFグレードC57BL/6雄性マウスをペントバルビタール(50mg/kg)腹腔内注射により麻酔し、ペプチド注入および代謝記録用のステンレス製カニューレ(RWD Life Science Co, Ltd)を移植した。カニューレの位置は、以前の報告(35)に従って、背側第三脳室(脳弓から2mm後方、大脳皮質表面から2.2mmの深さまで挿入)に定位固定した。インジェクター内カニューレのサイズは、脳室内インナーカニューレが26ゲージ、マイクロインジェクションカニューレが30ゲージであった。手術後、マウスは個別に飼育され、2週間回復した。マウスにはまず、ポンプ(LONGER)により2μlの生理食塩水に20μgのニューロキニンBを3分間で注射し、注射直後に代謝パラメータを記録した。
結果
CCEはマウスの摂食行動を変化させる
本研究では、CCEとACEの2つのモデルマウスを別々に作製した。具体的には、CCE群に属するマウスは28日間12℃で飼育し、ACE群に属するマウスは26日間室温で飼育し、最後の2日間は12℃の環境に移した(図1A)。室温で維持したマウスを対照群(RT群)とした。28日後、各動物の脳組織を採取してペプチドーム解析を行い、糞便サンプルを16S rRNA解析に用いた。実験期間中、摂餌量と体重の測定に基づいて、エネルギー恒常性の表現型を常にモニターした。
ダウンロード 高解像度画像ダウンロード(677KB)
ダウンロード フルサイズ画像のダウンロード
図1. 寒冷曝露マウスの表現型変化と脳内ペプチドの同定。A、マウスへの寒冷曝露の影響。BとCは体重と摂餌量。左のパネルは時間経過値を示し、右のパネルは28日間の平均値または累積値を示す。統計解析は、左のパネルでは二元配置分散分析を、右のパネルでは両側無対スチューデントt検定を用いて行った。∗∗p<0.01、***p<0.001。平均値±SD。D、エネルギー恒常性。E、3領域における脳内ペプチドの分布。棒グラフは各脳領域における同定されたペプチド数(上段)と成熟ペプチド数(中段)を示す。複数の領域に存在するペプチドのサブセットはマトリックスに記されている(下図)。円グラフは、1、2、3の脳領域に局在する同定脳ペプチドの割合を示している。詳細情報は補足データS1に示す。各ケージ2匹ずつ。ACE、急性寒冷曝露;CCE、慢性寒冷曝露;RT、室温。
12℃で28日間処理した後、CCE群のマウスの摂餌量は、RT群およびACE群と比較して有意に増加した(図1B)のに対し、CCE群は他の2群と比較して体重に変化を示さなかった(図1C)。増加を可視化するために、CCE/RTおよびACE/RT比較における食物摂取量と体重の比を計算し、各時点についてプロットした。CCE/RT比較における摂餌量の増加は、実験4日目に統計的有意性を示した。この増加はその後 25 日間維持されたが、ACE/RT 比較では有意な増加は観察されなかった。体重の増加は、CCE/RT比較でもACE/RT比較でも観察されなかった(補足図S1、AおよびB)。哺乳類におけるエネルギーの恒常性維持には、摂取、消費、貯蔵のバランスが必要である。我々の実験では、食物摂取がエネルギー摂取の主要な源であり、エネルギー貯蔵は主に体重変化で示される(図1D)。CCE群では、摂取エネルギーは投与時間と共に増加し、貯蔵エネルギーは変化せず、エネルギー消費が顕著であった。従って、CCEはマウスのエネルギーホメオスタシスに影響を与え、重要なことは摂食行動を変化させることである。対照的に、ACEの影響は軽微である。
ペプチドミクスで数千の脳内ペプチドを同定
寒冷曝露がマウスの脳内ペプチドにどのような影響を与えるかを調べるために、1時間LC-MS/MSペプチドミクス法(26)を用いて、海馬、視床下部、下垂体のペプチドームを解析した。これらのシグナル伝達分子の大規模な定量的プロファイリングには、正確な同定が必須条件である。ここでは、RT群を代表的なデータセットとし、視床下部1894個、海馬858個、下垂体4493個を含む3つの領域から5607個の脳ペプチドを同定した(補足データS1)。ペプチドームは異なる領域で非常にダイナミックな発現を示した(補足図S2)。脳内ペプチドの存在量の差を2つの領域間でプロットしたところ、約半数のペプチドが2つの脳領域間でダイナミックレンジに1桁以上の差を示した(補足図S3)。次に、複数の領域にまたがる脳内ペプチドの共局在を解析した(図1Eおよび補足データS1)。ペプチドの78%は1つの領域にのみ局在し、15%は2つの領域に局在し、7%は3つの領域すべてに局在していた。したがって、ペプチドームの発現は領域特異的な属性を示し、領域解決可能な定量分析が適切である。
寒冷曝露は脳ペプチドームの構造を変化させる
われわれの結果は、寒冷暴露がマウスのエネルギー恒常性を変化させることを示した。この過程には複雑な神経循環と神経内分泌の制御が関与しており、神経ペプチドやペプチドホルモンがシグナル伝達因子として重要な役割を果たしている。そこで我々は、寒冷曝露が脳ペプチドームにどのような影響を与えるかを調べるため、3つの脳領域のペプチドームについてラベルフリーの定量解析を行った。定量可能なペプチドを決定するために厳格な基準を適用し(詳細は実験手順に示す)、その結果、視床下部、海馬、下垂体でそれぞれ2171、1118、4031のペプチドが定量された。3つの脳領域のペプチドームを主成分分析した結果、CCE群はRT群と明らかに分離していた(図2、A-C)。ACE群は分離傾向を示したが、わずかにRT群と重なった。この結果は、特にCCE群において、低温曝露がペプチドーム構造を変化させたことを示している。さらに、CCE群とACE群は視床下部でのみ分離し、他の2つの領域では分離しなかったことから、ペプチドームの変化は脳領域特異的であった。グローバルな視点を提供するために、すべてのペプチドームデータを主成分分析で処理し、各群の中心値をグラフにプロットした(図2D)。CCE群とACE群は、プロットの中心方向に沿ってRT群から分離しており、これは寒冷曝露の影響によるものであった。従って、寒冷による脳ペプチドームの変化は領域特異的な属性を示し、CCEはペプチドームを再形成した。
ダウンロード 高解像度画像ダウンロード(585KB)
ダウンロード フルサイズ画像のダウンロード
図2. 寒冷暴露は脳ペプチドーム組成を変化させる。A-C、寒冷暴露下での(A)海馬、(B)視床下部、(C)下垂体ペプチドームのPCAプロット。D、各群の中心値を示すペプチドームのみのPCAプロット。E-G、(E)海馬、(F)視床下部、(G)下垂体における存在量変化ペプチドの2層ボルケーノプロット。Benjamini-Hochberg較正を用いた両側対応のないスチューデントt検定。H, 寒冷暴露下で存在量が変化したペプチドの数を示すレーダー図。詳細情報は補足データS2に示す。ACE、急性寒冷曝露;CCE、慢性寒冷曝露;CPON、NPYのC-フランキングペプチド;GLP-1[7-36]、グルカゴン様ペプチド-1[7-36];MCH、メラニン濃縮ホルモン;RT、室温。
低温暴露下での脳内ペプチドの存在量の変化を示すために、ACE対RTおよびCCE対RTのペプチドームデータセットを3つの2層ボルケーノグラフにプロットした(図2、E-Gおよび補足データS2)。海馬、視床下部、下垂体におけるCCE対RTの3つのボルケーノグラフでは、それぞれ16、388、328のペプチドが存在量の変化を示し、ACE対RTの3つのボルケーノグラフでは、それぞれ8、11、45のペプチドが存在量の変化を示した。さらにCCE対ACEのペプチドームをボルケーノグラフにプロットすると、視床下部と下垂体でそれぞれ212と53のペプチドが変化していることが示された(補足図S4と補足データS2)。ほとんどのペプチドはCCEによって視床下部と下垂体でダウンレギュレートされた(図2H)。さらに、これらの変化したペプチドをGene Ontology解析にかけたところ、そのほとんどがホルモン活性とGタンパク質共役型受容体結合に富んでおり(補足図S5)、これらのシグナル伝達因子の機能的特性を示していた。したがって、寒冷暴露は脳内ペプチドの存在量に時間依存的に劇的な変化を引き起こし、視床下部と下垂体は比較的敏感な反応を示した。
寒冷曝露により視床下部と下垂体間のペプチドが相関する
視床下部-下垂体(HP)軸は重要な神経内分泌系であり、エネルギー代謝において重要な役割を果たしている。視床下部-下垂体軸は、脂肪関連および栄養関連のシグナルを入力し、ペプチドホルモンの分泌を誘発し、エネルギー恒常性、食物摂取、燃料代謝を調節する(21)。ここでは、寒冷曝露によって視床下部と下垂体で変化する脳内ペプチドをさらに調べた。CCE群においてのみ存在量の変化を示すペプチドを示すために、2つのヒートマップをプロットした(図3、AおよびB、補足データS3)。これらのペプチドのほとんどは、エネルギー代謝と食物摂取に関連するグラニン(16)とプロSAAS(36)ファミリーに属していた(図3C)。さらに、リポトロピンガンマ(37)、GLP-1[7-39](38)、メラニン濃縮ホルモン(39)、コルチコトロピン様中間体ペプチド(40)など、重要な機能が報告されている成熟ペプチドの多くが、CCEにより発現低下を示した(図3、DとE、補足データS4)。成熟ペプチドとは、生物学的活性が確認されているペプチドであり、切断ペプチドやプロセシング中間体ではなく、インタクトな形である。寒冷誘導性エネルギー恒常性に関与する可能性のあるペプチド候補をスクリーニングするために、二塩基特異性残基ルールに従って、これらの存在量変化ペプチドに割り当てた(補足表S1とS2)。この基準には、N末端-1残基のK/R、C末端+1残基と+2残基のK/R、あるいはC末端アミド化に続いて+1残基のGが含まれる(14, 32)。
ダウンロード 高解像度画像のダウンロード (1MB)
ダウンロード フルサイズ画像のダウンロード
図3. 寒冷曝露は視床下部と下垂体におけるペプチドームを変化させる。AおよびBは、(A)視床下部と(B)下垂体における慢性寒冷曝露下で存在量が変化したペプチドを示すヒートマップ。CCE群でのみ変化したペプチドを枠で囲んだ。一元配置分散分析、p<0.05。詳細情報は補足データS3に示す。C、視床下部と下垂体における上位5つのペプチドファミリー。DとEは、(D)視床下部と(E)下垂体における、慢性寒冷曝露下で存在量が変化した成熟ペプチドのスクリーニング曲線(CCE/RTのp値は0.05未満)。Benjamini-Hochbergキャリブレーションを用いた両側対応のないstudent t検定。詳細情報は補足データS4に示す。F、視床下部と下垂体における存在量変化ペプチドのスピアマンの相関係数(r)のマトリックスを示すヒートマップ、ペプチドの少なくとも1つについてr < -0.6またはr > 0.6。詳細情報は補足データS5に示す。ACE、急性寒冷曝露;CCE、慢性寒冷曝露群;RT、室温群。
HP軸は複雑なホルモンシグナリングカスケードと視床下部と下垂体間のクロストークから構成されている(21)。視床下部と下垂体間のこれらのシグナル伝達分子の潜在的関連性を調べるために、全サンプルにわたって両領域間のスピアマンの相関解析を行った。下垂体では8個の成熟ペプチド、視床下部では14個の成熟ペプチドが強い正または負の相関を示した(図3Fおよび補足データS5)。特に下垂体のPENは、摂食を制御する視床下部のPEN 19および大きなPEN-LENと高い相関があった(36)。下垂体の大きなLENは、異なる修飾を受けたNPYのC-フランキングペプチド、PEN 20、PEN、セクレトニューリンなど、視床下部のほとんどのペプチドと高い相関があった(図3F)。HP軸を介したエネルギー代謝の調節は複雑であり、典型的には感覚、概日、快楽因子からの他のシグナルと統合される必要がある(21)。これらの新たに同定された相関ペプチド対は、寒冷曝露に応答するシグナル伝達因子のレベルで、視床下部と下垂体間のクロストークの可能性を示唆している。
寒冷曝露は腸内細菌叢の構成を変化させる
寒冷曝露がマウスの腸内細菌叢にどのような影響を及ぼすかを調べるため、RT群、CCE群、ACE群の糞便サンプルから得られた16S rRNAデータセットの比較解析を行った。α多様性の変化は観察されなかったが(補足図S6A)、加重UniFrac距離に基づくβ多様性の主座標分析(図4A)により、CCE群とACE群がRT群から分離していることが明らかになり、CCEとACEの両方がマウスの腸内細菌叢を変化させることが示唆された。動物門相対存在量の上位6種に基づく累積ヒストグラム(補足図S6B)では、ファーミキューテス(Firmicutes)とバクテロイデーテス(Bacteroidetes)が通常、総存在量の93%以上を占めていた。さらに異なる分類レベルで解析した結果、4つの細菌科と5つの細菌属(図4、B-E)が寒冷曝露によって変化することが明らかになった。ACE群はCCE群と同様のプロフィールを示した。Lactobacillaceae(乳酸桿菌科)と Erysipelotrichaceae(エリシペロトリカス科)の相対存在量は寒冷曝露によって減少したが、Rikenellaceae(リケネル科)とBacteroidaceae(バクテロイデス科)の相対存在量は増加した(図4D)。代表的に、乳酸桿菌科の存在量は、RT群では24.50%であったのが、ACE群では0.10%、CCE群では0.04%に減少し(図4D)、属レベルでの乳酸桿菌の減少が示された(図4E)。LEfSe分析ではさらに、乳酸桿菌科や乳酸桿菌などの微生物成分の存在量が、ファミリーレベルおよび属レベルで寒冷曝露によって変化することが確認された(補足図S7およびS8)。従って、腸内細菌叢は寒冷曝露によって変化し、12℃で2日間曝露しただけでも劇的な変化を起こした。
ダウンロード 高解像度画像のダウンロード(840KB)
ダウンロード フルサイズ画像のダウンロード
図4. 寒冷暴露は腸内細菌叢の構成要素を変化させる。A、寒冷暴露による腸内細菌叢の変化を示す重み付けOTUに基づくPCoAプロット。BおよびC、寒冷暴露によって変化したマイクロバイオームの相対量を(B)ファミリーおよび(C)属のレベルで示した棒グラフ。DおよびE、寒冷曝露により変化した微生物を(D)科および(E)属のレベルで示した列散布図。両側対なしのスチューデントt検定。∗p<0.05、**p<0.01、**p<0.001。各群n = 9または10。ACE:急性寒冷曝露;CCE:慢性寒冷曝露;OTU:操作分類単位;PCoA:主座標分析;RT:室温。
乳酸菌は視床下部におけるproSAAS由来ペプチドの存在量を変化させる
今回のデータは、寒冷曝露下で脳ペプチドームと腸内マイクロバイオームが変化することを示した。脳ペプチドームと腸内細菌叢との関連性をさらに調べるため、変化した5つの細菌属を用いて、全サンプルにわたって脳ペプチドとのスピアマンの相関解析を行った。その結果、エネルギー代謝に関与するGLP-1[7-36](38, 41)、オレキシンB(42, 43)、ニューロペプチドY(44)、ニューロキニンB(45)など、19種類の相関性の高い脳ペプチドが得られた(図5、AおよびB、補足データS5)。驚くべきことに、乳酸菌は、タンパク質前駆体proSAASに由来するPEN、PEN 18、PEN 19、PEN 20、GAV、および大きなPEN-LENと相関していた。これらの結果は、代謝過程におけるproSAAS由来ペプチドと乳酸菌の潜在的な関連性を示している。この知見に触発され、プロバイオティクス乳酸菌NS 9をマウスに経口投与した既報のデータセット(26)を再分析した。視床下部におけるPEN 18、PEN 19、コルチコトロピン様中間体ペプチドの発現は、L. fermentum NS 9の投与によって増強された(図5C)。したがって、これらの存在量の変化したペプチドは、寒冷暴露下における腸内細菌叢の変化と密接に関連しており、乳酸菌はproSAAS由来ペプチドと正の相関があった。
ダウンロード 高解像度画像ダウンロード(729KB)
ダウンロード フルサイズ画像のダウンロード
図5. 乳酸菌は視床下部ペプチドの存在量を変化させる。A、視床下部と下垂体における存在量の変化したペプチドと5つの変化した微生物属とのスピアマンの相関係数(r)の行列をそれぞれ示すヒートマップ。5つの微生物属のうち少なくとも1つについて、r < -0.6またはr > 0.6であった。詳細は補足データS5に示す。B, 乳酸菌の相対的存在量に対するPEN 18とPEN 19の存在量の関係をそれぞれ示す散布図。C、L. fermentum NS 9を1ヶ月間経口投与した後のPEN 18、PEN 19およびCLIPの強度を示す列プロット。両側対応のないstudent t test、∗p < 0.05。各群n = 7または8。CLIP、コルチコトロピン様中間体ペプチド。
寒冷適応微生物叢介入とニューロキニンB注射は代謝過程に影響する
寒冷曝露に応答する脳内ペプチドと腸内微生物との潜在的な関連を検証するために、寒冷適応微生物叢(CCEマウスの糞便)を用いてマウスを治療し、エネルギー代謝と脳内ペプチドームにおける表現型の可能な変化を測定した。具体的には、CCEマウスとRTマウスから得た糞便を胃内投与することで、マウスへの糞便介入を行った。熱産生(図6A)および摂餌量(補足図S9)の変化は、CCE糞便処理マウスではRT糞便処理マウスと比較して観察されなかったが、CCE糞便処理マウスでは最初の10時間の間にRER値が上昇し(図6B)、グルコース消費が促進されたことが示された。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図6. 糞便介入とニューロキニンB注射は代謝プロセスに影響を与える。AおよびBは、RTマウスまたはCCEマウスの糞便懸濁液で処理したマウスの(A)熱産生および(B)放熱量の値を示す曲線図である。IGによる1匹あたり600μl。RT糞便処理ではn=3;CCE糞便処理ではn=4。C、糞便介入後の視床下部における標的ペプチドの変化を示すカラムプロット。詳細は補足データS6に示す。D、ニューロキニンBまたは生理食塩水で処理したマウスの熱産生およびRERの値を示す曲線プロット。動物あたり10μgをICV投与。曲線図は反復測定二元配置ANOVA、列図は両側無対スチューデントt検定。∗p<0.05、*p<0.01、nsは有意差なし。各群n = 6。CCEは慢性寒冷曝露群、ICVは脳室内投与、IGは胃内投与、RERは呼吸交換比、RTは室温。
ペプチドミクス実験では、PRMモードでLC-MS/MS分析を行い、変化した腸内微生物と相関性の高い9種類の視床下部ペプチドを定量した。RT糞便処理マウスと比較して、CCE糞便処理マウスではニューロキニンBの存在量が減少した(図6Cおよび補足データS6)が、ほとんどのペプチドは存在量に変化を示さなかった(補足図S10)。同様に、ニューロキニンBもCCEによって発現が低下した(図3D)。これらの結果から、ニューロキニンBは代謝過程の変化に関連している可能性が示唆された。この仮説を検証するため、マウスの背側第三脳室にニューロキニンBを脳室内(ICV)注射した。予想通り、注射3時間後にRER値は減少したが、熱産生に変化はなかった(図6Dおよび補足図S11)。このことから、ニューロキニンBがCCEに伴う脂質からグルコースへの消費変化を抑制する作用を持つことがさらに確認された。全体として、今回のデータは、寒冷にさらされたマウスにおける腸内細菌叢と脳ペプチドームとの相互作用と、エネルギー恒常性を調節する能力を実証した。具体的には、寒さに適応した微生物叢は視床下部におけるニューロキニンBレベルを低下させ、それによって寒冷環境から身を守るためのエネルギー消費を変化させることが示唆された(図7)。
ダウンロード 高解像度画像ダウンロード(259KB)
ダウンロード フルサイズ画像のダウンロード
図7. 寒冷曝露に対する神経ペプチドと微生物叢の相互作用を示す模式図。寒冷曝露はマウスの寒冷適応腸内細菌叢の形成を促進し、その結果、視床下部のニューロキニンBの発現が抑制され、エネルギー消費の燃料源が脂質からグルコースに移行する。NKB、ニューロキニンB。
考察
哺乳類は寒冷暴露に対して体温を維持するために、複数の代謝プロセスを活性化する。エネルギー摂取、貯蔵、消費の間の動的平衡を調節することによって、エネルギー恒常性に関与する神経ペプチドやペプチドホルモンの数が増えていることが判明している(9)。我々は、腸内細菌叢が脳ペプチドームと相互作用して、寒冷環境におけるエネルギー恒常性を調節していると仮定した。実際、我々のオミックスデータセットは、脳ペプチドームが寒冷曝露によって部位特異的に再形成され、いくつかの脳ペプチドは腸内細菌叢の組成と相関していることを示している。驚くべきことに、いくつかのproSAAS由来ペプチドは乳酸菌と正の相関があった。マウスに寒冷適応微生物叢を経口投与すると、視床下部におけるニューロキニンBの存在量が減少し、その後、寒さから身を守るためのエネルギー消費に影響を与えた。
我々は、寒冷曝露によりバクテロイデス科の相対存在量が増加し、うどんこ病菌の相対存在量が減少することを観察した。Yangら(46)は、バクテロイデス科の代表的な仲間であるバクテロイデス・アシディファシエンス(Bacteroides acidifaciens)をマウスに投与したところ、精巣上体脂肪組織でペルオキシソーム増殖剤活性化受容体α(PPARα)のmRNAレベルの増加が認められた。PPARαは、胆汁酸によって活性化されるTGF5の発現を活性化し、エネルギー消費をさらに刺激する(47)。さらに、うどんこ病菌の存在量は肝脂肪と正の相関があり、消化管コレステロール誘導体によって抑制されることが以前の報告で示された(48, 49)。ツツガムシ科のいくつかの仲間は、脂質およびグルコース代謝障害と明確に関連しており、メタボリックシンドロームの高齢者では存在量が増加している(16)。したがって、本実験におけるバクテロイデス科の相対的存在量の増加とうどんこ病科の相対的存在量の減少は、エネルギーの恒常性を維持するためのコレステロールとグルコース代謝の調節に関連している可能性がある。
我々の結果は、乳酸菌が寒冷曝露によって、PEN、PEN18、PEN19、PEN20、GAV、および大きなPEN-LENを含むいくつかのproSAAS由来ペプチドと正の相関を示すことを示している。以前の報告によると、これらのペプチドは摂餌量と体重の調節に強力であり、PEN抗体とbig LEN抗体をICV注射すると、絶食マウスの摂餌量が有意に減少した(36)。乳酸菌は宿主に良い影響を与えるプロバイオティクスであり、エネルギー恒常性と脂質代謝に密接に関係している(50)。我々はさらに、L. fermentum NS 9を経口投与すると、視床下部におけるペプチドPEN 18とPEN 19の存在量が増加することを発見した。この新たな証拠は、腸内微生物が脳内ペプチドに影響を与える可能性を示唆しており、プロSAAS由来ペプチドにおける乳酸菌媒介性変化の潜在的経路を強調している。
重要な発見は、マウスに寒冷適応微生物叢を経口投与すると視床下部のニューロキニンBの存在量が減少し、ニューロキニンBを注射するとマウスのエネルギー消費の燃料源が変化することである。ニューロキニンBはTac2遺伝子によってコードされ、女性の生殖軸の制御における重要なプレーヤーとして浮上してきた(51)。3つのタキキニン受容体を標的とするにもかかわらず、ニューロキニンBはニューロキニン3受容体(NK3R)に対して最も高い親和性を示す(51, 52)。ニューロキニンB-NK3Rシグナル伝達経路は、雌マウスの思春期成熟における代謝障害に敏感である(45)。Sucquartら(53)は、NK3Rを介したニューロキニンBシグナル伝達の拮抗作用が多嚢胞性卵巣症候群モデルマウスに及ぼす影響を調べ、NK3R拮抗薬による治療が動物の代謝状態を変化させることを示した。驚くべきことに、彼らは、総エネルギー消費量に変化を与えることなく、RER値が上昇することを観察した。雄マウスにニューロキニンBをICV注射した実験でも、一貫した結果が得られた。ニューロキニンBとその受容体に関するこれまでの研究では、主に雌の生殖における機能的役割に焦点が当てられてきた(51)。私たちの研究は、生殖への機能的関連性に加えて、ニューロキニンBが雄マウスのエネルギー代謝調節に関与する可能性を初めて示した。その基礎となる制御メカニズムについては、さらに詳細な研究が必要である。
海馬は主に学習と記憶において機能しているが、内分泌および神経ペプチド性シグナル伝達によって制御される食物摂取においても役割を果たしている(54)。海馬のレプチンシグナル伝達は、食物摂取と食物に関連した記憶処理を制御していることがわかった(55)。Sweeneyら(56)は、腹側海馬から外側中隔に由来する食欲不振神経回路を同定した。さらに、海馬の活動がメタボリックシンドロームと関連していることを示す新たな証拠もある(57, 58)。今回の結果では、CCE後に摂食量の増加が観察されたことから、海馬の脳内ペプチドの変化は、寒冷曝露時の摂食量や代謝の変化に関連している可能性がある。
結論として、本研究は、寒冷曝露に応答する腸内微生物と脳内ペプチドの相互作用を明らかにし、エネルギー恒常性の神経回路および神経内分泌制御、ならびに腸脳軸の潜在的役割に関する疑問に取り組むための貴重なデータ資源を提供した。寒冷適応微生物叢とニューロキニンBが代謝状態を変化させるという新たな知見は、寒冷によるエネルギー恒常性維持のメカニズム解明に新たなアイデアを提供する。
データの利用可能性
質量分析プロテオミクスデータはiProXパートナーリポジトリ(59)を通じてProteomeXchange Consortiumにデータセット識別子IPX0004014000で寄託されている。16S rRNAシーケンスデータは、アクセッションコードPRJNA806700でNational Center for National Center for Biotechnology Information (NCBI)データベースに寄託されている。
補足データ
本論文は補足データを含む。
利益相反
著者らは、競合する利益はないと宣言している。
謝辞
装置の利用および技術サポートをしていただいた北京国家蛋白質科学センター(PHOENIXセンター)の質量分析施設および動物実験プラットフォームに感謝する。
資金援助と追加情報
本研究は、中国国家重点研究開発計画(2021YFA1302601)、国家重点実験室基金(SKLP-O202004)、重点研究プログラム(BWS17J025)の支援を受けている。
著者貢献
C. X.W.調査、X.W.可視化、X.W.検証、X.W.、Y.X.、L.Z.、S.W.リソース、X.W.、Q.W.、M.Z.正式解析、X.W.とC.J.原稿執筆、Q.W.編集、C.J.とD.Y.資金獲得。
補足データ
すべての補足ファイルをダウンロードする
これは何?
ダウンロード: スプレッドシートのダウンロード(451KB)
補足データS1
ダウンロード スプレッドシートのダウンロード(2MB)
補足データS2.
ダウンロード ダウンロード : スプレッドシート (83KB)
補足データS3.
ダウンロード スプレッドシートのダウンロード(17KB)
補足データS4.
ダウンロード スプレッドシートのダウンロード(21KB)
補足データS5.
ダウンロード ダウンロード : スプレッドシート (14KB)
補足データS6.
ダウンロード ダウンロード : Acrobat PDFファイル(3MB)
補足図S1〜S11、表S1、S2。
特集記事推薦記事
参考文献
1
L.D.フリッカー、A.K.田島、A.K.ファキラ、U.ホッホゲシュヴェンダー、W.C.ウェッツェル、L.A.デヴィ
マウスの脳と下垂体における遺伝的に定義された細胞タイプの神経ペプチド解析
Cell Chem. Biol., 28 (2021), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
2
E.V.ロマノワ、J.V.スウィードラー
神経ペプチドとホルモンの探索と特性解析のためのペプチドミクス
Trends Pharmacol. Sci., 36 (2015), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
3
A.B.ハモン、A.アマレ、J.V.スウィードラー
質量分析を用いた新しい無脊椎動物神経ペプチドの発見
Mass Spectrom. Rev., 25 (2006), pp.
CrossRefScopusで見るGoogle Scholarで見る
4
A. メリギ
哺乳類中枢神経系における神経ペプチドの貯蔵と共存
Prog. 神経生物学, 66 (2002), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
5
D. シャルマ、K.クマール、G.S.ビシュト
将来の治療薬としての神経ペプチドの可能性に関するミニレビュー
Int. J. Pept. Res. Therapeut., 28 (2022), p. 39
Scopusで見るGoogle Scholar
6
J.D.ホワイト
神経ペプチドY:エネルギー恒常性の中心的調節因子
Regul. Pept., 49 (1993), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
7
K. Loh, H. Herzog, Y.C. Shi
NPY系によるエネルギー恒常性の制御
Trends Endocrinol. Metab., 26 (2015), 125-135頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
8
M.J.ウォーターソン、T.L.ホーバス
エネルギー恒常性のニューロン制御:視床下部と摂食を超えて
Cell Metab., 22 (2015), 962-970頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
9
J. Sanchez-Gurmaches, Y. Tang, N.Z. Jespersen, M. Wallace, C. Martinez Calejman, S. Gujja, et al.
褐色脂肪AKT2は、ChREBPを介したde novo脂肪生成を刺激し、燃料貯蔵と熱発生を最適化する寒冷誘導キナーゼである
Cell Metab., 27 (2018), 195-209.e6頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
10
I. カラギアニデス、D. トーレス、Y.-H. Tseng, C. Bowe, E. Carvalho, D. Espinoza, et al.
新規抗肥満標的としてのサブスタンスP
消化器病学, 134 (2008), 747-755頁
スコープで見るGoogle Scholar
11
B. ベック
正常摂食および遺伝的・食事誘発性肥満における神経ペプチドY
Philos. Trans. R. Soc. Lond. B Biol. Sci., 361 (2006), pp.
CrossRefScopusで見るGoogle Scholarで見る
12
S.J. Lee, G. Sanchez-Watts, J.-P. Krieger, A. Pignalosa, P.N. Norell, A. Cortella, et al.
視床下部背内側GLP-1シグナル伝達の喪失はBAT熱産生を低下させ、脂肪率を増加させる。
Mol. Metab., 11 (2018), 33-46ページ
PDFを見るCrossRef記事を見るScopusで見るGoogle Scholar
13
T.D.フィリッパトス、T.V.パナギオトプルー、M.S.エリサフ
GLP-1受容体作動薬の副作用
Rev. Diabet. Stud., 11 (2014), 202-230頁
CrossRefScopusで見るGoogle Scholarで見る
14
J.D. Deem, C.L. Faber, C. Pedersen, B.A. Phan, S.A. Larsen, K. Ogimoto, et al.
マウスにおける寒冷誘導性摂食亢進はAgRPニューロンの活性化を必要とする
Elife, 9 (2020), Article e58764
Google Scholar
15
M. Fälth、K. Sköld、M. Norrman、M. Svensson、D. Fenyö、P.E. Andren
SwePep、内因性ペプチドと質量分析のためにデザインされたデータベース
Mol. Cell. Proteomics, 5 (2006), pp.
PDFを見る記事を見るScopusで見るGoogle Scholarで見る
16
K. Lippert、L. Kedenko、L. Antonielli、I. Kedenko、C. Gemeier、M. Leitner、他。
高齢者における糖代謝障害およびメタボリックシンドロームと関連する腸内細菌叢異常症
ベネフィット Microbes, 8 (2017), pp.
Scopusで見るGoogle Scholar
17
Y. ファン、O. ペダーセン
ヒトの代謝の健康と疾患における腸内細菌叢
Nat. Rev. Microbiol., 19 (2021), pp.
CrossRefScopusで見るGoogle Scholarで見る
18
C. クレメンセン、T.D.ミュラー、S.C.ウッズ、H.-R. Berthoud、R.J.Seeley、M.H.Tschöp
代謝制御における腸脳クロストーク
Cell, 168 (2017), 758-774ページ
PDFで記事を見るScopusで記事を見るGoogle Scholar
19
C. C.シュヴァリエ、O.ストヤノヴィッチ、D.J.コリン、N.スアレス=ザモラノ、V.タラロ、C.ヴェイラット=ドゥレベックス、他。
腸内細菌叢は寒冷時のエネルギー恒常性を制御する
Cell, 163 (2015), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
20
M. Ziętak、P. Kovatcheva-Datchary、L.H. Markiewicz、M. Ståhlman、L.P. Kozak、F. Bäckhed
寒冷曝露による食事誘発性肥満の減少に、変化した微生物叢が寄与している
Cell Metab., 23 (2016), 1216-1223頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
21
R.J. Perry, L. Peng, N.A. Barry, G.W. Cline, D. Zhang, R.L. Cardone, et al.
酢酸はメタボリックシンドロームを促進するマイクロバイオーム-脳-β細胞軸を媒介する
ネイチャー, 534 (2016), 213-217頁
CrossRefScopusで見るGoogle Scholarで見る
22
S. ハママー、コバサ
腸内細菌叢は無菌マウスの中枢神経ペプチド欠損を回復させる
Int. J. Mol. Sci., 23 (2022), p. 11756
CrossRefScopusで見るGoogle Scholarで見る
23
M. スヴェンソン、K. スケルド、P. スヴェニングソン、P.E. アンドレン
ペプチドミクスに基づく新規神経ペプチドの発見
J. プロテオーム研究, 2 (2003), 213-219頁
ScopusGoogle Scholarで見る
24
F.Y.チェ、J.リム、H.パン、R.ビスワス、L.D.フリッカー
マイクロ波を照射したマウスの脳と下垂体の定量的神経ペプチドミクス
Mol. Cell. プロテオミクス, 4 (2005), pp.
PDFを見る記事を見るScopusGoogle Scholarで見る
25
B. MacLean, D.M. Tomazela, N. Shulman, M. Chambers, G.L. Finney, B. Frewen, et al.
Skyline:標的プロテオミクス実験の作成と解析のためのオープンソースドキュメントエディター
バイオインフォマティクス, 26 (2010), pp.
CrossRefScopusで見るGoogle Scholarで見る
26
P. マウスにおけるペプチドームの動的な動態。
ペプチドームの動態から、プロバイオティクスによる腸脳軸の調節が明らかになった。
Sci. Signal., 13 (2020), Article eabb0443
ScopusGoogle Scholarで見る
27
T. マゴッチ、S.L. サルツバーグ
Flash:ゲノムアセンブリを改善するための短いリードの高速長さ調整
バイオインフォマティクス, 27 (2011), pp.
CrossRefScopusで表示Google Scholarで表示
28
J.G. Caporaso, J. Kuczynski, J. Stombaugh, K. Bittinger, F.D. Bushman, E.K. Costello, et al.
QIIMEによる高スループットコミュニティシーケンスデータの解析
Nat. Methods, 7 (2010), 335-336ページ
CrossRefScopusで表示Google Scholarで表示
29
C. (注1)本データベースは、(注2)本データベースの一部である。
SILVAリボソームRNA遺伝子データベースプロジェクト:改良されたデータ処理とウェブベースのツール
核酸研究, 41 (2013), D590-D596頁
スコープで見るGoogle Scholar
30
C. Lozupone, R. Knight
UniFrac:微生物群集を比較するための新しい系統発生学的手法
Appl. Environ. 微生物学, 71 (2005), pp.
スコープで見るGoogle Scholar
31
J.P.バーバック
神経ペプチドの概念からオンラインデータベースまで www.neuropeptides.nl
Eur. J. Pharmacol., 626 (2010), pp.
PDFを見る記事を見るScopusで見るGoogle Scholarで見る
32
B.R. Southey、A. Amare、T.A. Zimmerman、S.L. Rodriguez-Zas、J.V. Sweedler
NeuroPred:神経ペプチド前駆体の切断部位を予測し,得られたペプチドの質量を提供するツール
核酸研究, 34 (2006), W267-W272頁
CrossRefScopusで見るGoogle Scholarで見る
33
Y. キム、S. バーク、V. フック、N. バンデイラ
神経ペプチドデータベースとスペクトルライブラリ
バイオインフォマティクス, 27 (2011), pp.
CrossRefScopusで表示Google Scholarで表示
34
J. (注1)本データベースは、(注2)本データベースの一部である。
PEAKS DB: 高感度で正確なペプチド同定のためのde novoシーケンス支援データベース検索
Mol. Cell. プロテオミクス, 11 (2012), Article M111.010587
PDFを見る記事を見るCrossRefGoogle Scholar
35
G.P.キース・フランクリン
定位座標系におけるマウス脳
(第3版), Academic Press, New York, NY (2008)
Google Scholar
36
J.H.ウォードマン、I.ベレズニューク、S.ディ、J.G.タスカー、L.D.フリッカー
ProSAAS由来ペプチドは神経ペプチドYと共局在し、摂食調節における神経ペプチドとして機能する。
PLoS One, 6 (2011), Article e28152
CrossRefScopusで見るGoogle Scholarで見る
37
Y. バーク、ハオ・リー
ヒツジ下垂体からの新規生理活性ペプチドの単離と特性
J. Biol. Chem., 239 (1964), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
38
S.H. Lockie, K.M. Heppner, N. Chaudhary, J.R. Chabenne, D.A. Morgan, C. Veyrat-Durebex, et al.
中枢神経系グルカゴン様ペプチド-1受容体シグナルによる褐色脂肪組織熱産生の直接制御
糖尿病, 61 (2012), 2753-2762頁
CrossRefScopusで見るGoogle Scholarで見る
39
D.S. Ludwig, N.A. Tritos, J.W. Mastaitis, R. Kulkarni, E. Kokkotou, J. Elmquist, et al.
トランスジェニックマウスにおけるメラニン濃縮ホルモンの過剰発現は、肥満とインスリン抵抗性を引き起こす。
J. Clin. Invest., 107 (2001), 379-386ページ
スコープで見るGoogle Scholar
40
J.B.マーシャル、L.P.カプカラ、L.D.マニング、A.J.マッカロー
ラット単離膵小葉における膵外分泌機能に対するコルチコトロピン様中間葉ペプチドの影響
J. Clin. Invest., 74 (1984), 1886-1889ページ
CrossRefScopusで見るGoogle Scholarで見る
41
B. Kreymann, G. Williams, M.A. Ghatei, S.R. Bloom
グルカゴン様ペプチド-1 7-36:ヒトにおける生理的インクレチン
Lancet, 2 (1987), 1300-1304頁
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
42
B. マイスター、M.L.ホーカンソン
[オレキシン--食欲を刺激する新しい視床下部ペプチド]。
Lakartidningen, 95 (1998), pp.
スコープで見るGoogle Scholar
43
M.W.シュワルツ
オレキシンと食欲:エネルギー恒常性の全体像が少し大きくなる
Nat. Med., 4 (1998), pp.
スコープで見るGoogle Scholar
44
S.P.カルラ、M.G.ドゥベ、A.サフ、C.P.フェルプス、P.S.カルラ
食欲亢進に伴う室傍核での神経ペプチドY分泌の増加
Proc. Natl. Acad. Sci. U. S. A., 88 (1991), pp.
CrossRefScopusで見るGoogle Scholarで見る
45
V.M. Navarro, F. Ruiz-Pino, M.A. Sánchez-Garrido, D. García-Galiano, S.J. Hobbs, M. Manfredi-Lozano, et al.
女性の思春期制御におけるニューロキニンBの役割と代謝状態によるその調節
J. 神経科学, 32 (2012), 2388-2397頁
スコープで見るGoogle Scholar
46
J.Y. Yang, Y.S. Lee, Y. Kim, S.H. Lee, S. Ryu, S. Fukuda, et al.
腸内常在菌バクテロイデス・アシディファシエンスはマウスの肥満を予防し、インスリン感受性を改善する。
粘膜免疫学, 10 (2017), 104-116頁
PDFを見る記事を見るCrossRefGoogle Scholar
47
M. 渡辺, S.M. Houten, C. Mataki, M.A. Christoffolete, B.W. Kim, H. Sato, et al.
胆汁酸は細胞内甲状腺ホルモン活性化を促進することによりエネルギー消費を誘導する
ネイチャー, 439 (2006), pp.
CrossRefScopusで見るGoogle Scholarで見る
48
I. マルティネス、J. ペルディカロ・ディアハン、W. ブラウン・アンドリュー、S. ハモンズ、J. カーデン・トレバー、P. カー・ティモシー、他。
ハムスターの腸内細菌叢組成は、食事誘発性の宿主コレステロール代謝の変化に影響を受けている可能性が高い。
Appl. 微生物学, 79 (2013), pp.
スコープで見るGoogle Scholar
49
M.D.スペンサー、T.J.ハンプ、R.W.リード、L.M.フィッシャー、S.H.ザイゼル、A.A.フォドー
ヒト消化管マイクロバイオームの構成とコリン欠乏による脂肪肝発症との関連性
消化器病学, 140 (2011), 976-986頁
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
50
J.J. Jeong, H.J. Park, M.G. Cha, E. Park, S.M. Won, R. Ganesan, et al.
プロバイオティクスとしての乳酸菌:肝疾患を中心に
微生物, 10 (2022), p. 288
Google Scholar
51
J.N.ペネファーザー、A.レッチ、M.L.カンデナス、E.パタク、F.M.ピント、C.A.マッジ
タキキニンおよびタキキニン受容体:成長するファミリー
ライフサイエンス, 74 (2004), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
52
V.M.ナバロ
キスペプチドとニューロキニンBの相互作用
Adv. Exp. Med. Biol., 784 (2013), pp.
CrossRefScopusで見るGoogle Scholarで見る
53
I.E. Sucquart, R. Nagarkar, M.C. Edwards, V. Rodriguez Paris, A. Aflatounian, M.J. Bertoldo, et al.
ニューロキニン3受容体拮抗作用は、高アンドロゲンPCOSマウスモデルにおける主要な代謝機能を改善する。
内分泌学, 162 (2021), 記事 bqab020
Google Scholar
54
S.E.カノスキー、H.J.グリル
海馬の食物摂取制御への寄与:ニーモニック、神経解剖学的、内分泌学的メカニズム
Biol. Psychiatry, 81 (2017), 748-756頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
55
S.E. Kanoski、M.R. Hayes、H.S. Greenwald、S.M. Fortin、C.A. Gianessi、J.R. Gilbert、他。
海馬のレプチンシグナル伝達は食物摂取を減少させ、食物に関連した記憶処理を調節する
神経精神薬理学, 36 (2011), pp.1859-1870
CrossRefScopusで見るGoogle Scholarで見る
56
P. スウィーニー、ヤン
摂食を抑制する興奮性腹側海馬-外側中隔回路
Nat. Commun., 6 (2015), p. 10188
スコープで見るGoogle Scholar
57
E. カルボ・オチョア、C. アリアス
インスリンシグナル機能障害によって引き起こされる海馬の細胞および代謝の変化と、加齢およびアルツハイマー病における認知機能障害との関連:動物モデルを用いた研究
Diabetes Metab. Res. Rev., 31 (2015), pp.
CrossRefScopusで見るGoogle Scholarで見る
58
M. ソト、W.カイ、小西真人、C.R.カーン
海馬と扁桃体におけるインスリンシグナルは代謝と神経行動を制御する
Proc. Natl. Acad. Sci. U. S. A., 116 (2019), pp.
CrossRefスコープで見るGoogle Scholar
59
N. バンデイラ、E.W.ドイチュ、O.コールバッハー、L.マルテンス、J.A.ビスカイノ
高感度ヒトプロテオミクスデータのデータ管理:現在の慣行、推奨事項、将来への展望
Mol. Cell. プロテオミクス, 20 (2021), p. 100071
PDFを見る記事を見るGoogle Scholar
引用者 (0)
‡
これらの著者は本研究に等しく貢献している。
© 2023 the authors. 米国生化学分子生物学会を代表してエルゼビア社より発行。
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
Copyright © 2023 Elsevier B.V. or its licensors or contributors. ScienceDirect® は Elsevier B.V. の登録商標です。
