
腸管バリア機能障害は関節炎の病態に不可欠な役割を果たし、疾患を改善するための標的となりうる
腸管バリア機能障害は関節炎の病態に不可欠な役割を果たし、疾患を改善するための標的となりうる
ダイアナ・E・マテイ
マドヴィ・メノン
ダグマー・G・アルベル
Nigel Klein
Paul A. Blair 15, 16
クラウディア・マウリ 15
すべての著者を表示する
脚注を表示するオープンアクセス公開日:2021年5月13日DOI:https://doi.org/10.1016/j.medj.2021.04.013
PlumX メトリクス
ハイライト
血清の腸管透過性マーカーLPB、LPS、I-FABPはRAで増加する
関節炎を発症したマウスでは、腸管透過性が上昇し、腸の炎症が起こっている
腸管バリアの破綻には、細菌と白血球の両方が必要である
関節炎における腸管バリア機能不全の予防は関節の炎症を改善する
背景と意義
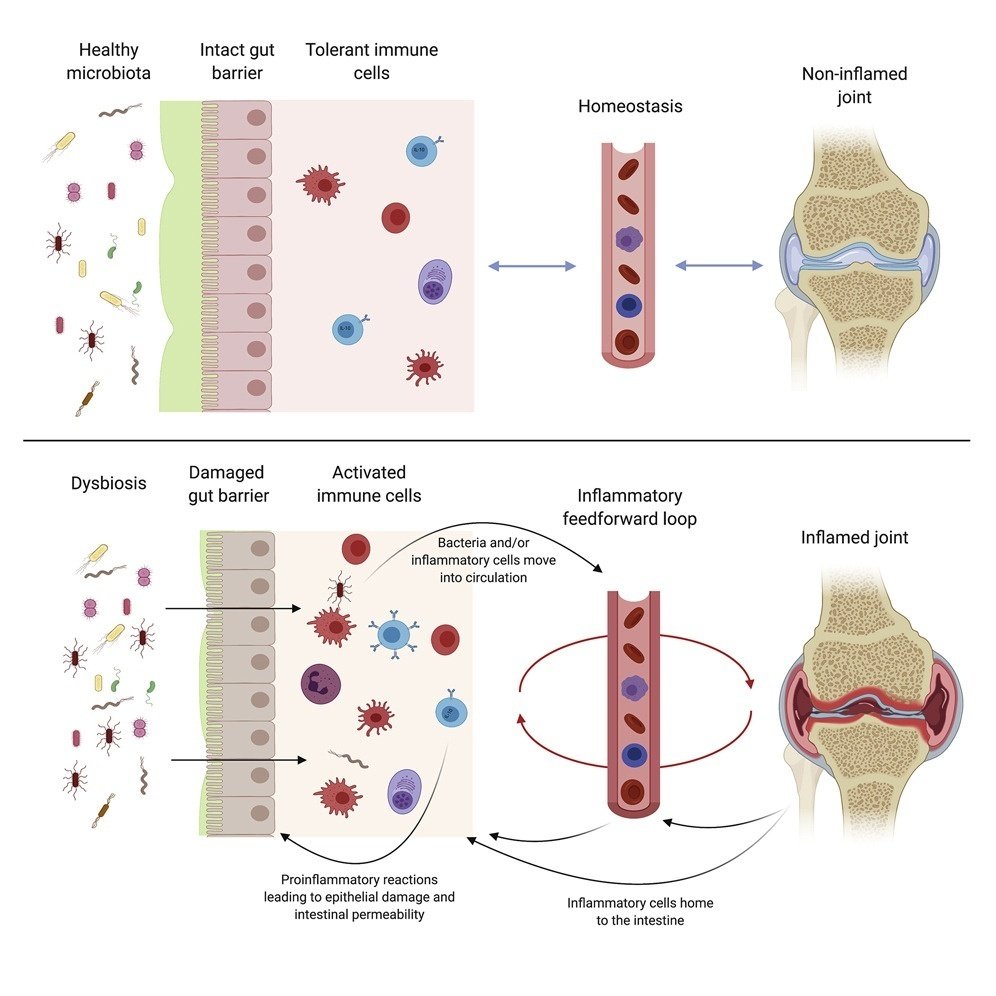
関節リウマチは、慢性的な関節の炎症によって特徴づけられる自己免疫疾患である。蓄積された証拠から、腸内に存在する細菌の組成の変化が関節の炎症に関与している可能性が示唆されています。現在のところ、細菌やその産物がどのようにして免疫系の細胞に指示を与え、有害なものとなって関節炎を誘発するのかは不明である。ユニバーシティ・カレッジ・ロンドンの研究者らは、関節炎では、腸の粘膜に深い損傷があり、バリアとして適切に機能しないこと、また、炎症を引き起こす白血球が腸内に蓄積していることを明らかにしました。関節炎では、細菌が腸内膜の禁止境界線を越えること、特定の薬剤で腸管透過性欠損を修復することで関節炎が抑制されることを示した。
概要
背景
関節リウマチ(RA)の発症には、腸内細菌叢の異常が重要な役割を果たしていることを示唆する証拠がある。腸内細菌の変化と関節炎症の発症との関連は不明である。ここでは、腸内環境の変化があるかどうか、そしてそれが関節炎の発症にどのように寄与しているかを考察する。
研究方法
RA患者の末梢血と血清における腸管透過性、損傷、炎症のマーカーの変化を解析した。自然発症のK/BxNマウス、野生型、遺伝子組み換えのインターロイキン(IL)-10R-/-あるいはクローディン-8-/-マウスから分離した血清、腸、リンパ系器官を免疫蛍光/組織学、ELISA、フローサイトメトリーにより解析した。
所見
RA患者は、血清中の腸管透過性・損傷マーカーおよび細胞性腸管ホーミングマーカーのレベルが上昇し、両パラメーターは疾患の重症度と正の相関があった。関節炎マウスでは、疾患初期から腸管透過性の上昇、細菌の移動、炎症性腸管障害、インターフェロンγ(IFNγ)+の増加およびIL-10+腸管浸潤白血球頻度の減少、腸管上皮IL-10R発現の減少が認められた。腸管バリアーを破壊するためには、関節炎を引き起こす細菌と白血球の両方が必要であることがメカニズム的に示されている。我々は、腸管オルガノイドをIFNγに暴露すると上皮細胞によるIL-10Rの発現が低下すること、上皮IL-10R欠損マウスでは腸管透過性が上昇し関節炎が増悪することを明らかにした。また、腸管透過性が構成的に亢進しているClaudin-8-/-マウスも関節炎を悪化させる。腸管透過性亢進を抑制する分子であるAT-1001をマウスに投与すると関節炎が改善される。
結論
腸管バリアーの破綻が関節炎発症に関与していることを示唆し、腸管バリアーの恒常性を回復させることが関節炎の新しい治療法として提案された。
資金提供
Versus Arthritis (21140 and 21257) および UKRI/MRC (MR/T000910/1) より資金提供を受けている。
図解要約
図 サムネイル fx1
大きな画像を見るダウンロード 高解像度画像
CATスケール
前臨床研究
キーワード
関節炎
腸管透過性
腸管粘膜
炎症
治療
はじめに
関節リウマチ(RA)は、激しい滑膜炎と関節軟骨および骨の破壊をもたらす持続的な炎症によって特徴づけられる全身性の慢性自己免疫疾患である。1 RAに寄与する遺伝的および環境要因の理解は進んでいるものの、疾患の病因はまだ十分に理解されていない。RAにおける疾患の要因の一つとして、腸内細菌叢の異常増殖に大きな関心が寄せられている2, 3, 4。例えば、Prevotella copriの異常増殖はRAの病態と関連している4, また、P. copriの無菌マウスへの移植は、SKG脊椎関節炎モデルにおいて関節腫脹を誘発するのに十分であることが示唆されている6。RAにおけるディスバイオーシスは、シトルリン化ペプチドの供給源となること9、抗原擬態10、抗原提示細胞およびT細胞の活性化11、そして腸管上皮の完全性の変化12など、多くのメカニズムによって疾患発症に寄与しているという仮説が立てられてきた。
腸管上皮のバリアの主な機能は、細菌およびその他の病原体が内腔から腸管組織および全身循環系に移行するのを防ぐと同時に、栄養分の通過を可能にすることである13。腸管バリアは、上皮細胞間の接着結合とタイトジャンクションの両方の絶妙なバランスによって維持されており、後者は主にゾヌラ・オクルデンス(ZO)タンパク質、クローディンおよびオクルディンによって形成されている13, 14。これらの結合は、腸内細菌の組成の変化12,15や粘膜組織の炎症性変化16,17によって損なわれ、その結果、管腔内内容物が粘膜に異常に移行する可能性がある。同様に、インターフェロンγ(IFNγ)や腫瘍壊死因子α(TNF-α)の増加などの粘膜サイトカイン産生異常は、タイトジャンクションタンパク質の発現を再編成または減少させ、腸管バリアの完全性を損ねることがある19,20。腸管バリアの恒常性は、強直性脊椎炎(AS)、22, 23, 24型糖尿病、25、多発性硬化症など、多くの全身性疾患の発症に関与している26,27。
我々は、腸管バリア機能の低下が関節炎の病理学的特徴であるかどうか、また、これらの変化が疾患に寄与しているかどうかを調べることを目的とした。我々は、関節炎には腸管バリアー機能の低下と白血球の腸管ホーミングの変化が伴うこと、そしてこれらのいずれかを修正することで関節炎の重症度を軽減できることを報告する。我々は、RA患者が健常者と比較して、腸管の損傷と透過性のマーカーであるリポポリサッカライド(LPS)、LPS結合タンパク質(LBP)、腸管脂肪酸結合タンパク質(I-FABP)の血清レベルが上昇し、腸管帰巣マーカーであるケモカイン受容体9(CCR9)とリンパ球パイエル板接着分子1(LPAM-1)を発現する白血球の全身の上昇があることを示している。また、LBP値は非活動期に比べ活動期に有意に増加し、疾患の重症度と相関すること、RAにおける腸の完全性の喪失はエタネルセプト(TNF-α阻害剤)治療により部分的に改善されることを示した。関節炎が腸粘膜のホメオスタシスに与える影響と、これらの変化が疾患において病的であるかどうかをさらに理解するために、我々はRAの自然発症および誘発実験モデルを活用した。我々は、関節炎の発症が、腸管透過性と炎症の発症と本質的に関連していることを示す。関節炎が発症すると、腸管上皮細胞のIL-10に対する応答性が失われ、腸管透過性が亢進し、関節炎が増悪することを示す。しかし、関節炎における透過性の亢進には、関節炎細胞や腸内細菌の存在も必要であることを示す。これらの知見は、構成的に腸管透過性が亢進すると関節炎が悪化すること、タイトジャンクションの完全性の回復や白血球の腸への再循環の防止が関節炎を改善することを示す知見と合わせて、腸-関節軸が関節炎の発症に複雑に関与していることを示すものである。
研究成果
RA患者は血清中の腸管バリアー損傷マーカーのレベルが上昇していた
RAが腸管膜の完全性の喪失を伴うかどうかを調べるため、RA患者と健常対照者の3つの腸管透過性バイオマーカーの血清レベルを比較した。グラム陰性菌の膜成分であるLPS、LPSの移行に反応して腸管上皮と肝臓で産生される急性期タンパク質であるLBP、28,29、腸管上皮の完全性の特異的バイオマーカーであるI-FABPである30。血清学的に関節炎の証拠があり、関節痛はあるが滑膜炎はない患者(プレRA)では、健常対照者と比較してLPSレベルが有意に上昇し、LBPレベルが上昇する傾向を示し、I-FABPレベルが中等度に上昇したが、初期の未分化臨床関節炎(初期RA)を示す患者では、健常対照者(HC)と比較してLBPレベルが有意に上昇し、LPSとI-FABPレベルが中等度に上昇した。疾患が確立したRA患者の血清中では、3つのマーカーすべてが健康な対照群と比較して有意に上昇していた(図1A-1C;表S1)。非ステロイド性抗炎症薬(NSAIDs)などの関節炎に対する一般的な治療法は、腸管透過性を高めることが報告されている31。LPS、LBP、I-FABPのレベルは、解析からNSAID治療患者を除外しても、有意に高いままだった(図S1A-S1C)。同様に、LPS、LBP、I-FABPのレベルは、未治療のRA患者では健常対照者と比較して有意に高かった(図1D-1F)。さらに、患者を治療法によって層別化しても、腸管透過性マーカーのレベルには差が見られなかったことから、本疾患で観察される腸管透過性マーカーの増加におけるNSAIDsの役割の可能性は否定された(図1G〜1I)。
図1G-1
図1関節リウマチにおける腸管透過性の亢進
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
腸管透過性が疾患の重症度に応じて変化する可能性があるかどうかを評価するために、患者を不活性型(28関節疾患活動性スコア[DAS28]<2.6)、中間型(2.6<DAS28<5.1)、活性型(DAS28>5.1)に層別化して各グループ内の血清LPS、LBP、I-FABPレベルを解析しました。すべての活動性グループにおいて、3つのマーカーは健常対照者と比較して有意に高い値を示した。LBPは、中等症または非活動期の患者において、活動期の患者に比べ、有意に低値であった。また、中等症および非活動期の患者群では、活動期に比べ血清LPS濃度が低下する傾向が見られた(図1J〜1L)。全RA患者の解析から、血清LBP濃度はDAS28およびCRPと直接相関し、血清LBP濃度が最も高い患者では、DAS28スコアとCRPレベルの合計が最も高くなった(図1Mおよび図S1D)。
RA患者の横断的コホートの層別化により、腸管透過性マーカーのレベルは、異なる治療によって影響を受けないことが示された。しかし、疾患活動性の低い患者では、LBPのレベルが低く、LPSのレベルが低下する傾向が見られた。これは、治療の成功によってRAにおける炎症を抑制することで、腸管透過性を低下させることができる可能性があることを示唆している。このように、いくつかのTNF-α阻害剤はRAと炎症性腸疾患の両方に対して有効な治療法となりうることを考えると、治療法の層別化に効果が見られなかったことは驚くべきことであった。TNF-αの中和が腸管透過性の血清マーカーレベルに影響を与えるかどうかを調べるために、TNF-α阻害剤(エタネルセプト)治療を受けたRA患者の縦断コホートの血清中のLPS、LBP、I-FABPの濃度を治療開始前と6ヶ月後(6ヶ月は治療への反応を判断するには十分な期間:図S1E-S1G)で検査した。DAS28が1.2以上減少したと定義されるエタネルセプト治療が奏効した患者では、血清LPSおよびLBPのレベルが有意に減少した。しかし、I-FABPの値はエタネルセプトの影響を受けませんでした。エタネルセプトが効かない患者では、腸管透過性マーカーのいずれにも減少がみられませんでした。
CCR9とLPAM-1は、腸に再循環するリンパ球によって主に発現されていることが以前に示されている。CCR9またはCCR9とLPAM-1発現の主要な誘導因子であるビタミンAを欠損したマウスでは、腸管固有層に動員されるリンパ球の数が減少する32, 33。RA患者は、腸管向性マーカーLPAM-1とCCR9を共発現するPBMCの割合が増加しており(図1NおよびS1H)、RAの消化管ホーミングが増加していることを示唆していた。LPAM-1+CCR9+PBMCの割合は、疾患の重症度(DAS28)とも正の相関があり、腸における免疫事象とRAの病態がさらに関連することが示唆された(図1O)。
関節炎マウスでは腸管透過性の亢進と炎症が見られる
関節炎発症中に腸の完全性がどのように影響を受けるかを詳細に調べるため、RAのいくつかの側面を模倣したK/BxN自然発症関節炎モデルを利用した(図S2A)34。プレゼンテーションを明確にするため、異なる病期を前疾患(2週)、初期疾患(4週)、確立疾患(6週)と定義している。対照マウス(CTRL)は、6週齢のナイーブなC57BL/6マウスである。CTRLおよび病前マウスと比較して、病初期のマウスおよび関節炎が確立したマウスで血清LBP濃度の上昇が観察された(図2A)。血清LBP濃度は、関節腫脹の重症度と正の相関があった(図2B)。さらに、経口投与したフルオレセインイソチオシアネート(FITC)-デキストランの取り込みを測定することにより、腸管バリアの完全性を評価したところ、関節炎の早期から透過性が上昇し、病気の高さでピークに達することが確認された(Figure 2C)。組織学的には、関節炎マウスの小腸(SI)および大腸上皮細胞で、タイトジャンクションの構築と完全性の重要なメディエーターであるZO-1の発現低下35,36を観察した(図2D、2E、S2B、およびS2C)。血清による透過性の測定値と一致し、ZO-1の発現も疾患の初期段階から減少していた。さらに、関節炎の初期および確立したK/BxNマウスのSI(図2Fおよび2G)および結腸(図S2DおよびS2E)において、疾患前およびCTRLマウスと比較して、上皮浸食および陰窩伸長などの著しい形態的変化が検出された37。注目すべきは、関節炎マウスのSIと大腸に炎症性細胞浸潤が存在することで、免疫細胞を介した腸の変化が示唆された(Figure 2F、2G、S2D、S2E)ことである。関節炎マウスの腸管上皮で観察された形態学的変化とZO-1発現の消失とは対照的に、肺の粘膜上皮には有意な変化が検出されず、粘膜上皮の完全性の喪失は主に腸に限定されることが示唆された(図S2F-S2H)。
図サムネイルgr2
図2関節炎を発症したマウスでは、腸管透過性と腸管炎症が見られる
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
上皮の内腔側の粘膜層の完全性は、腸の健康と恒常性の客観的な測定値であり15、ムチン2(MUC2)は腸粘膜層の最も豊富なタンパク質成分である38。我々は、関節炎のK/BxNマウスのSIにおいて、疾患前およびCTRLマウスと比較してMUC2の著しい減少を報告した(図2Hおよび図2I)。また、関節炎マウスのSIの絨毛上ではCTRLと比較してゴブレット細胞数が有意に減少しており、MUC2発現の減少を裏付けている(図2J)。関節炎マウスの大腸では、関節炎における杯細胞数の増加にもかかわらず、疾患前およびCTRLマウスと比較してMUC2タンパク質レベルの差は検出されなかった(図S2I〜S2K)。
関節炎の微生物叢と細胞の組み合わせが腸管透過性の乱れを促進する
関節炎マウスで観察された炎症性浸潤の蓄積と、ヒトおよびマウスモデルにおける関節炎の発症における微生物叢の役割を考慮し、我々は次に、腸管バリアの完全性の喪失に対する末梢性関節炎リンパ球および腸内細菌の寄与について検討した2,39。健常者と比較して関節炎患者PBMCのLPAM-1+CCR9+発現が高いという患者データと一致して(図1N)、脾臓、パイエル板(PPs)、腸間膜リンパ節(MLs)でLPAM-1+CCR9+CD45+細胞の頻度が著しく増加することが確認された。関節炎K/BxNマウスでは、CTRLマウス(ナイーブ非肥満糖尿病[NOD]マウス)と比較して、脾臓、パイエル板(PP)、腸間膜リンパ節(mLN)、足排泄腋窩リンパ節(ALN)においてLPAM-1+CCR9+CD45+細胞の頻度が著しく増加しており、腸への細胞循環が増加していることが関節炎の特徴と考えられる(Figure 3A).
図サムネイルgr3
図3関節炎の脾臓細胞や腸内細菌の異常は腸管透過性の亢進を引き起こす可能性がある
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
関節炎マウスの細胞が単独で、あるいは関節炎腸内細菌叢との組み合わせで、腸管バリアの完全性の喪失に寄与しているかどうかを直接調べるために、関節炎脾細胞および/または糞便をリンパ球欠損NOD scid gamma(NSG)マウスに移植し、FITCデキストラン摂取による腸管透過性の影響を評価しました。関節炎脾臓細胞は、IFNγ、IL-6、TNF-αなどの炎症性サイトカインの発現の上昇を示した(図3B)。関節炎のK/BxNドナーマウスの糞便は、疾患前マウスおよびKRNコントロールと比較して、Prevotella属の細菌の増加を含む、関節炎に関連すると以前発表された細菌の濃縮を示した(図3C、S2L、およびS2M)。NSGレシピエントは、関節炎K/BxNマウスまたはコントロールKRNマウス(K/BxNマウスの母系)の糞便を経口投与され、1週間静置された後、細胞または糞便の移植の前に、内在性細菌による潜在的交絡作用を除去するために、腸内細菌の減少をもたらすことが知られている広域の抗生物質を投与した40。関節炎または非関節炎コントロールの脾臓細胞(K/BxNマウスの父系であるNODマウスの脾臓細胞)を無処理、抗生物質処理、糞便移植を行ったNSGマウスに静脈内移植し、2日後に腸管透過性を測定した。抗生物質を投与したNSGマウスに、コントロールまたは関節炎K/BxNマウスの糞便のみを再構成しても、未投与のNSGマウスと比較して透過性は有意に増加しなかった(図3Dおよび図3E)。コントロールの脾臓細胞の移植は、糞便の経口摂取の有無にかかわらず、透過性を増加させなかった(図3E)。関節炎を有するK/BxNマウスの脾臓細胞を移植すると、未処置のNSGマウスでは透過性が中程度に上昇した。しかし、K/BxN脾臓細胞をK/BxN糞便と共移植した場合にのみ、未処置のNSGマウスと比較して透過性の有意な増加が認められた(図3D)。これらの結果は、腸管透過性の破壊を誘導するためには、関節炎誘発性細胞と関節炎誘発性腸内細菌叢の両方が必要であることを示している。
腸管透過性亢進の結果の1つは、細菌自身の循環中への移行であると考えられる。関節炎が確立したマウスは、疾患の初期段階のマウスと比較して、mLN、ALN、および脾臓に細菌の16 s DNAの蓄積を示した(図3F)。これらの結果から、関節炎の発症には腸管バリアーの完全性の喪失が伴うことがさらに確認され、またこの欠陥が細菌の組織的拡散につながり、関節炎の発症に寄与している可能性があることが示された。
腸管上皮IL-10シグナルの消失は腸管バリアー機能障害と関節炎の重症化に寄与する
関節炎の急性期のマウスは、ナイーブなマウスと比較して、血清LBPとFITC-デキストランのレベルが上昇し、上皮のZO-1発現が減少した(図S3B-S3H)。AIAを有するマウスは、関節炎K/BxNマウスと同様の炎症性形態学的変化を腸粘膜に示し、疾患中のLPAM-1とCCR9の発現の全身的増加を示した(図S3I〜S3N)。興味深いことに、腸の炎症および腸のバリア完全性、ならびに腸のホーミングマーカーの発現の両方は、AIAの寛解期の間に部分的に回復し、炎症および/または末梢免疫系の活性化が、腸の健全性および透過性の変化と密接に関連していることを示唆した(図S3BおよびS3E〜S3N)。K/BxNモデルと同様に、粘膜上皮の形態学的変化及びZO-1発現の喪失は、肺の上皮では観察されなかった(図S3O〜S3Q)。AIAを有するマウスは、腸内細菌叢のディスバイオシスも示し、Prevotellaの存在量が有意に増加し、Lactobacillusが減少する傾向にあった(図S3R〜S3T)。これらの細菌量の変化は発病1日目から明らかであったが、関節炎のピーク時にはより顕著であった(図S3R-S3T)。
関節炎マウスの腸粘膜に炎症性浸潤の増加が観察され、再循環する関節炎促進性細胞が腸管バリアの完全性の喪失に関与していることから、次に、関節炎における腸の形態的変化が、腸のCD45+白血球によって産生される炎症性サイトカインと抗炎症性サイトカインのバランスの変化を伴うかどうかを評価した。関節炎のK/BxNマウスは、疾患の初期段階のマウスと比較して、十二指腸、空腸、回腸、および結腸において、IFNγ+とIL-10+CD45+白血球の比率が著しく高かった(図4AおよびS4A〜S4C)。AIAを有するマウスは、K/BxNマウスと同様のIL-10発現の喪失と、腸上皮のCD45+細胞によるIFNγ発現の増加を示した(図4Bおよび4C)。粘膜上皮の完全性に対する変化と同様に、肺組織の白血球は、腸の白血球と同程度の炎症性変化を示さなかった(図S4DおよびS4E)。K/BxNマウスの肺では、ナイーブコントロールと比較してIFNγ+細胞の頻度がわずかに増加する傾向が見られたが、AIAを有するマウスは、そのコントロールとの差異を示さなかった。
図 サムネイル gr4
図4IL-10シグナルの消失は腸管透過性と関節炎の重症度に影響を及ぼす
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
いくつかの報告では、IL-10-IL-10Rシグナルは腸の恒常性を維持し、炎症性障害から上皮を保護するのに重要であることが示唆されている43, 44, 45 Ex vivoでは、AIAの関節炎K/BxNおよびC57BL/6マウスの両方は、それぞれのCTRLと比較して十二指腸および結腸の腸上皮細胞(IEC)によるIL-10R発現が著しく減少している(図4D-4H、S5A、およびS5B)。さらに、十二指腸IECによるex vivo IL-10R発現は、関節炎の重症度(AIA3日目の膝の腫れで測定)と有意な逆相関を示し、関節炎の重症度とIECによるIL-10R発現喪失の関連性が強化された(図4I)。
次に、IECによるIL-10R発現の消失が、関節炎に関連したディスバイオージスの結果であるかどうか、および/または、上皮内リンパ球(IEL)および前庭単核細胞(LPMC)によって発現されるIFNγの上昇の結果であるかどうかを検討した。IEC IL-10R発現の消失における腸内細菌叢の役割を評価するため、関節炎マウスとナイーブコントロールに抗生物質のカクテルを投与し、細菌を除去した。関節炎マウスで観察されたIL-10R発現の阻害は、抗生物質処理によって修正され、IL-10R発現のレベルは、十二指腸と結腸の両方でナイーブマウスで見られたレベルにまで回復した(図4J)。IEC IL-10R発現の阻害におけるIFNγの役割を評価するために、ナイーブC57BL/6マウスの小腸から分離したクリプトから増殖させたオルガノイドを、IFNγ、IL-10、またはその組み合わせで培養した。培養終了時に、上皮細胞のIL-10R発現をフローサイトメトリーで測定した(図4KおよびS5C〜S5E)。オルガノイドIECによるIL-10Rの発現、およびIECの生存率は、外因性IFNγを用いた培養後にともに低下した。オルガノイドIECの生存率は、IL-10の添加により部分的に回復した。これらの結果は、関節炎に関連する細菌とIFNγのような炎症性サイトカインの両方が、関節炎におけるIECのIL-10R発現の喪失に寄与していることを示唆するものであった。
関節炎における腸管バリアーの維持にIEC IL-10Rの発現が果たす役割を理解するために、非造血器官側のIL-10Rを欠き、免疫系の細胞での発現を保持するキメラマウスを作製した(野生型[WT]→放射線照射IL-10R-/- [WT→iIL-10R-/-] マウス:図4L)。コントロールWTマウスと比較してナイーブWT→iIL-10R-/-マウスにおいて、SIおよび結腸の両方の腸上皮細胞上のFITC-デキストラン転位の著しい増加およびZO-1発現の喪失が観察され、コントロールと比較してナイーブグローバルIL-10R-/-マウスのSIにおけるZO-1の喪失と同様に、非血液細胞上のIL-10R発現が腸透過性の維持に直接寄与することが示された(図4M〜4OおよびS5F〜S5I)。AIA誘導時、WT→iIL-10R-/-マウスは、関節炎のWT→iWTマウスと比較して、SIの粘液層の著しい損失を含む腸の炎症の悪化を示した(図4P-4S、S5J、およびS5K)。また、WT→iIL-10R-/-マウスは、関節炎を発症したWT→iWTマウスと比較して、関節炎が有意に悪化した(図4T)。したがって、我々の結果は、腸上皮細胞上のIL-10Rの発現の障害が、腸バリアの完全性の崩壊および関節炎症の増加に寄与することを示唆する。
腸管透過性の恒常的な亢進は、マウスをより重篤な関節炎にさせる
WT→iIL-10R-/-マウスで観察される関節腫脹の変化が、IL-10R発現の広範な喪失や免疫調節異常ではなく、腸管透過性の増加に直接関連しているかどうかを調べるために、最近作製されたが未特性のクローディン-8-/-マウス(Cl8-/-)を利用した。クローディン-8 は、細胞外透過性を低下させるタイトジャンクションタンパク質であり、クローディン-8 の発現欠如は、以前にクローン病や腸管バリア機能障害と関連していた46,47。WT マウスと比較して、ナイーブ Cl8-/- マウスでは構成的に腸の透過性が上昇している(図 5A)。AIA誘発後、Cl8-/-マウスはWT対照と比較して関節炎を著しく悪化させ(図5B)、脾臓のIFNγ+およびIL-17+CD45+細胞の頻度が増加した(図5C)。関節炎症の重症度の上昇は、関節炎を起こしたWTマウスと比較して、腸管上皮細胞によるZO-1の発現の低下を伴っていた(図5Dおよび5E)。これらのデータは、腸管透過性の亢進がマウスに関節腫脹をより重症化させる素因となることを示唆している。
図5gr5
図5Claudin8-/-マウスは腸管透過性が亢進し、より重症の関節炎を発症する。
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
腸管透過性と細胞再循環を調節することで関節炎が改善される
上記の結果から、腸管バリアーの喪失を防ぐことで関節炎を抑制できるかどうかを検討する必要があった。AT-1001 は、現在、セリアック病の治療効果を検証中であり、リウマチの治療に再利用できる可能性があるため、特に注目されています49。AT-1001を関節炎マウスに経口投与すると(図S6)、未処置マウスと比較してFITC-デキストランの取り込みが著しく減少し(図6A)、関節の腫れが劇的に減少した(図6B)ことからわかるように、腸管透過性の崩壊が防止された。これは、IFNγ+およびIL-17+CD45+脾臓細胞の頻度の減少(図6C)およびクリプト伸長および上皮浸食などの腸組織損傷のレベルの低下(図6D、6E、S6BおよびS6C)によって示されるように、全身および腸炎症の著しい減少を伴うものであった。MUC2の発現も、未処置の関節炎マウスと比較してAT-1001処置マウスの腸で増加し、粘膜炎症の減少を確認した(図6Fおよび図6G)。また、AT-1001投与により、関節炎時に観察される腸管上皮細胞上のZO-1発現の低下が部分的に抑制された(図6H〜6J)。
図サムネイルgr6
図6腸管バリアーの完全性の喪失を防ぐと、関節炎の重症度が低下する
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
AT-1001処理の別の結果は、未処理マウスと比較して、AIAを有するマウスの脾臓におけるLPAM-1+CCR9+CD45+細胞の割合が減少することである(図6K)。これらの結果と、RA患者のPBMC(図1N)および関節炎K/BxNおよびAIAマウスの全身でLPAM-1+CCR9+細胞の割合が増加している(図3AおよびS3N)ことから、これらの細胞の腸と末梢間の再循環を阻害することで関節炎の重症度が低下するかどうかを評価しようと考えた。特異的なCCR9拮抗薬であるベルチルノン50を用いてCCR9を介した再循環をブロックすると、AIAマウスの疾患のピーク時の関節腫脹が未処置の対照群と比較して有意に減少しました(図6L)。
考察
本研究では、RA発症における腸の関与について、腸管上皮バリアーの消失と不顕性腸炎の発症という2つの重要な側面について検討した。これまでの研究で、関節炎では腸管透過性が亢進している可能性が示唆されている。しかし、これらの研究では、薬物の影響を排除することはできず、また、疾患の重症度との関連も示されていない。Bjarnasonら51名とMielantsら23,31名は、51Cr-EDTA吸収アッセイを用いて、RA、AS、変形性関節症における腸管「リーキー」性を調査した。彼らは、3つの疾患すべてにおいて、51Cr-EDTAの吸収の増加、すなわち腸管透過性の増加を認めたが、RAにおける吸収の増加は、疾患というよりもNSAID治療の結果であると結論づけた。Tajikらによる最近の研究では52、新規発症および発症したRA患者の両方で腸管上皮の完全性の喪失が検出されることが示されたが、腸管透過性の進展または消失における治療の役割については調査していない。我々は、腸管障害と透過性のマーカーである血清LPS、LBP、I-FABPレベルが、健常対照者と比較して活動性RA患者で上昇していること、これらの測定値は治療とは無関係であることを示し、透過性の増強は治療というよりも疾患の特徴であることを示唆している。また、病気の重症度とLBPのレベルとの間に正の相関があることも報告している。
興味深いことに、TNF阻害剤エタネルセプトの投与を受けたRA患者の縦断的コホートにおける腸管透過性マーカーの分析では、治療が奏効した患者では腸管の完全性が部分的に回復していることが示された。腸管透過性マーカーのレベルが低下したのは、全身性炎症が減少した結果であると考えられ、腸管への炎症性細胞の動員を減らすと同時に、腸管炎症性サイトカインの産生を減少させると考えられる(詳細は、腸管透過性を高めるIFNγの役割との関連で後述する)。しかしながら、エタネルセプトが腸の完全性を完全に回復できないことを示す結果は、関節炎におけるこの喪失に、さらなるメカニズムが寄与していることを示唆している。例えば、腸内細菌の異常は腸管透過性の亢進に直接関与している可能性があり18、エタネルセプトはRA患者において腸内細菌の異常を部分的にしか改善できないことが以前報告されている53。RA患者における腸管透過性の増加は、ゾヌリンやミオシンIXB(MYO9B)の多型など、遺伝的素因によるものである可能性もあり、炎症性腸疾患(IBD)における腸管の完全性の喪失と関連している54、55。現在、多くのTNF阻害剤がRAおよびIBDの治療薬として認可されており56,57、腸の炎症と透過性、そしてRAの症状を改善する能力を比較することが正当化されるでしょう。
RAにおける不顕性腸炎を示す初期の直接的証拠は、検査した26人のRA患者のうち12人の腸に111インジウム放射性標識白血球の異常な局所的集積が見られたことであった58。RA患者の回腸と大腸の生検の電子顕微鏡検査では、刷子縁の破壊や微絨毛密度の低下などの超微細構造の変化が検査した患者のサブセットで検出されることが示唆されたが、これらの変化は光学顕微鏡や内視鏡検査ではあまり見られず、脊椎関節症患者の生検ほど明らかではなかった59。自然発症と誘発の2つの異なる関節炎実験モデルを利用し、FITC-デキストランの移動とタイトジャンクション蛋白質ZO-1の損失によって測定した腸管透過性の増加、ならびに疾患の初期段階からの関節炎における腸管上皮、筋壁、炎症浸潤への広範囲な炎症性変化が示された。これらの形態学的変化は、IFNγを発現する炎症性白血球の浸潤と抗炎症性IL-10発現細胞の消失と一致しており、腸が関節炎時の白血球浸潤部位であることを示唆するこれまでのヒト予備研究の結果を支持している58。興味深いことに、60%までのRA患者が肺に病的変化を生じうるにもかかわらず、少なくともこれらの前臨床モデルでは肺粘膜に有意な変化は検出されなかった。
RA患者を対象とした以前の研究では、Collinsella aerofaciensやPorphyromonas gingivalisなどのタイトジャンクション破壊細菌が疾患と関連していることが報告されており、18,60腸管透過性を促進する細菌の役割が示唆されている。我々のデータもまた、腸管バリアの変化を促す上で関節炎菌が極めて重要な役割を担っていることを裏付けている。しかし、NSG免疫不全マウスに腸管透過性を誘導するためには、高レベルのIFNγ、TNF-α、IL-6を発現する関節炎原性糞便と脾臓細胞、および低レベルのIL-10の両方が必要であることを示したため、複雑さも加わっている。この結果は、炎症性サイトカインであるIFNγとTNF-αが、上皮細胞のZO-1内在化、オクルディンのダウンレギュレーション、細胞死を引き起こすことによって、上皮バリア機能障害を誘導することを示す、大腸上皮細胞株を用いた以前のin vitro知見を支持するものである16, 17,19,20 腸管透過性の増加が自己免疫の原因となり得る多くのメカニズムが提案されてきた。1型糖尿病では、膵臓リンパ節への微生物の移動により、ヌクレオチド結合オリゴマー化ドメイン含有タンパク質2(NOD2)シグナルが増加し、Th1およびTh17反応が増強されることが示唆されている61。これらの結果は、mLN、関節排出リンパ節および脾臓への細菌の移動が増加しているという我々の結果と一致する。関節炎がTh1およびTh17細胞によって引き起こされることを考えると1、末梢リンパ組織に存在する細菌が、関節炎における炎症性T-ヘルパー細胞の分化を促進する可能性がある。細菌の移動だけでなく、腸管透過性の向上により、免疫学的に活性な細菌の代謝産物やその他の細菌産物が全身に拡散する可能性があります。例えば、多関節型若年性特発性関節炎(JIA)の子供たちは、細菌産物への全身的な曝露が増加している証拠を示している。29 腸管透過性の増加の結果として、我々はLPSの移動を検出したが、LPSはBALB/cマウスのコラーゲン抗体誘発関節炎において炎症性関節炎を生成するための補助剤として使用されているので、それ自体が末梢の炎症を促進しているのかもしれない62。
恒常性においては、局所的に発現した IFNγが腸管透過性に及ぼす影響は、正常なバリア機能を促進する IL-10 の能力によって抑制されるはずです。16 In vitroでは、IL-10シグナルは IFNγによる上皮細胞のタイトジャンクション破壊と細胞生存率の損失を抑制します 21,43,63 。しかし、IFNγは上皮細胞によるIL-10Rの発現をアップレギュレートすることが報告されており、IL-10による保護に対してより敏感になっています。45 これらのin vitroの知見とは対照的に、両方の関節炎モデルにおいて、in vivoでの腸管上皮のIL-10R発現が失われ、白血球によるIFNγ発現が増加したことが観察されました。同様に、腸管オルガノイドのin vitro細胞培養を用い、IECをIFNγに暴露すると、細胞生存率とIL-10Rの発現が低下することを示す。IFNγとIL-10を一緒に添加すると、細胞生存率は部分的にしか回復しない。したがって、これらの結果は、IFNγが上皮細胞によるIL-10Rの発現を阻害することを初めて提唱するものである。我々の結果と以前に示された結果の相違は、in vivoでは関節炎におけるサイトカイン環境のより広い変化の影響、in vitroでは細胞株とオルガノイドとして培養した初代細胞の炎症刺激に対する反応の違いによるものであると思われる。上皮細胞のIL-10-IL10R腸管シグナルの消失が関節炎の発症に関連することは、非造血細胞上のIL-10Rを欠損したキメラマウスが腸管透過性と炎症の増大を起こし、WTコントロールよりも有意に重症な関節炎を発症するという我々のデータによって確認された。また、両方の関節炎モデルにおいて、関節炎に関連するPrevotella属菌の増加が観察されたことから、関節炎で見られる腸管上皮のIL-10R発現の消失は、dysbiosisによるものである可能性も考えられる。この仮説は、関節炎誘発時に抗生物質で治療したマウスで腸管上皮細胞上のIL-10R発現が回復したことを示す我々の結果からも支持される。
また、腸管透過性の遺伝的素因が関節炎モデルマウスの病因であることを初めて示した。クローディン-8-/-マウスはWTコントロールに比べてより重度の関節炎を発症する。さらに、腸管透過性の発現を防ぐことは、関節炎モデルマウスの関節腫脹を軽減する有効な方法であることを示し、コラーゲン誘発関節炎モデルにおけるTajikら52の結果を確認した。腸管では、ゾヌリンが上皮細胞に発現し、プロテアーゼ活性化受容体2および上皮成長因子受容体と共結合してシグナルを伝達します。その結果、プロテインキナーゼ-C-α依存的にタイトジャンクションの集合が破壊される。現在までのところ、上皮細胞によるゾヌリン発現を誘発する刺激としては、グルテンと細菌片のみが報告されており、後者は C-X-C motif chemokine receptor 3 (CXCR3) を介している64。したがって、AT-1001治療が、ディスバイオシスによる関節炎病理を予防する作用を持つ可能性があると考えられる。同様のメカニズムが、ASにおける腸管透過性の発現にも示唆されており、慢性疾患患者は、回腸への細菌侵入とゾヌリン発現の組織内アップレギュレーションを示す。
結論として、腸の形態変化と腸管透過性の増加は、関節炎の発症と同時 に起こり、寛解期には減少することが明らかになった。腸の変化は、腸内細菌の異常と末梢における耐性の喪失によって引き起こされ、これらの変化がフィードバックされて全身性の炎症と関節腫脹を増強することが示唆された。最後に、腸管透過性の調節または腸管向性細胞再循環の防止は、関節炎症の重症度に直接影響することから、RA治療のための2つの新しい腸管依存的な治療法を提案するものである。
研究の限界
本研究にはいくつかの限界がある。まず、腸管透過性の程度を調節することは、上述のように関節腫脹の程度に影響するが、これら2つの現象が関連する正確なメカニズムは、まだ十分に解明されていない。特に、関節炎では全身性の細菌の移動が増加することが観察されますが、これらの細菌の正体や、それらが疾患の病態を直接誘導することができるかどうかは分かっていません。さらに、我々は、関節炎における腸の病理学の個々の要素を調査することを可能にするトランスジェニックマウスを利用するために、C57BL/6バックグラウンドのAIAモデルに移行したが、このモデルは、ヒト疾患のいくつかの側面を再現しているに過ぎない。この背景を持つすべての関節炎モデルと同様に、AIAは誘導モデルであり、疾患は自己寛解性である。慢性関節炎における腸への変化の影響と、腸に直接作用する治療が確立された疾患において有効であるかどうかを決定するために、さらなる研究が必要であろう。
STAR★Methods
主要リソース表
試薬またはリソースソース IDENTIFIER
抗体
CD19 BV785, Clone 6D5 Biolegend Cat# 115543; RRID: AB_11218994
CD3 BV605、クローン17A2 Biolegend Cat# 100237; RRID: AB_2562039
CD4 BV711、クローンRM4-5 Biolegend Cat# 100550; RRID: AB_2562099
CD8a BUV805、クローン53-6.7 BD Biosciences Cat#; 564920 RRID: AB_2716856
MHC-II APC-Cy7、クローン M5/114.15.2 Biolegend Cat# 107628 RRID: AB_2069377
Ly6G Alexa Fluor 700、クローン1A8 Biolegend Cat# 127622 RRID:AB_10643269
EpCAM FITC、クローン G8.8 Biolegend Cat# 118208 RRID: AB_1134107
CCR9 PE-Cy7、クローン CW-1.2 Biolegend Cat# 128712 RRID:AB_10933082
CD11b BV605、クローン M1/70 Biolegend Cat# 101257; RRID: AB_2565431
CD11c FITC、クローン N418 Biolegend Cat# 117306; RRID: AB_313775
CD45 BUV737、クローン104 BD Biosciences Cat# 564880 RRID: AB_2738998
LPAM-1 PE, Clone DATK32 BD Biosciences Cat# 553811 RRID: AB_395066
IL-10R PE, クローン 1B1.3a BD Biosciences Cat# 112706 RRID: AB_313519
Ly6C PE-Cy7、クローン HK1.4 サーモフィッシャーサイエンティフィック Cat# 25-5932-82 RRID: AB_2573503
F4/80 APC、クローン BM8 ThermoFisher Scientific Cat# 17-4801-82: RID: AB_2784648
IFNγ APC、クローン XMG1.2 BD Biosciences Cat# 17-7311-82: RID: AB_469504
IL-10 PE、クローン JES5-16E3 Biolegend Cat# 505008; RRID: AB_315362
IL-17 eFluor 450, クローン eBio17B7 ThermoFisher Scientific Cat# 48-7177-82 RRID: AB_11149503
CCR9 Alexa Fluor 647, クローン BLICCR9 Biolegend Cat# 346301 RRID: AB_2275427
Rabbit anti-mouse ZO-1 Abcam Cat# ab216880; RRID: AB_10678863
ウサギ ポリクローナル抗 MUC2 Abcam Cat# ab76774 RRID: AB_1523987
Goat anti-rabbit IgG Alexa Fluore 555 ThermoFisher Scientific Cat# A32732 RRID: AB_2633281
Donkey anti-rabbit IgG Alexa Fluor 488 ThermoFisher Scientific Cat# A32790 RRID: AB_2762833
化学物質、ペプチド、リコンビナントタンパク質
メチル化ウシ血清アルブミン(mBSA) Sigma Aldrich Cat# A1009
免疫グレード ウシ II 型コラーゲン Chondrex Cat# 20021
インコンプリートフロイントアジュバント(IFA) Sigma Aldrich Cat# F5506
Phorbol-12-myristate-13 acetate (PMA) Sigma Aldrich Cat# P8139
イオノマイシン Sigma Aldrich Cat# I0634
DAPI Sigma Aldrich Cat# D9542
Brefeldin A Biolegend Cat# 420601
2-メルカプトエタノール ThermoFisher Scientific Cat# 31350010
RNase-Free DNase セット QIAGEN Cat# 79254
ネオマイシン Sigma Aldrich Cat# N1876
メトロニダゾール Sigma Aldrich Cat# M3761
バンコマイシン Sigma Aldrich Cat# V2002
アンピシリン Sigma Aldrich Cat# A9393
FITC-デキストラン Sigma Aldrich Cat# 46944-500MG-F
コラゲナーゼ VIII Sigma Aldrich Cat# C2139
コラゲナーゼ V Sigma Aldrich Cat# C9263
コラゲナーゼ D Roche Diagnostics Cat# 11088866001
Dispase GIBCO Cat# 17105-041
DNase I Roche Diagnostics Cat# 10104159001
リベラーゼ TL Roche Diagnostics Cat# 5401020001
GlutaMAX ThermoFisher Scientific Cat# 35050061
N-2 ThermoFisher Scientific Cat# 17502048
B27 ThermoFisher Scientific Cat# 17504044
N-acetylcysteine Sigma Aldrich Cat# A9165
Murine epithelial growth factor Peprotech Cat# 315-09
ヒト・リコンビナント R-spondin Biolegend Cat# 783604
マウスリコンビナント Noggin Peprotech Cat# 250-38
リコンビナントマウス IFNγ Biolegend Cat# 575306
遺伝子組換えマウス IL-10 Biolegend Cat# 575806
Vercirnon (抗CCR9) Chemocentryx/MedChemExpress Cat# HY-15724
重要な市販アッセイ
Picopure™ RNA 分離キット ThermoFisher Scientific Cat# KIT0204
iScript™ cDNA 合成キット Biorad Cat# 1708891
iQ™ SYBR® green スーパーミックス Biorad Cat# 1708882
Nextera DNA ライブラリー調製キット イルミナ Cat# FC-121-1030
MinElute PCR 精製キット QIAGEN Cat# 28004
QIAamp DNA Mini Kit QIAGEN Cat# 51304
BioPulverizer Lysing Matrix E MP Biomedical Europe Cat# 116914050
Taq PCR Core kit QIAGEN Cat# 201225
ZymoBIOMICS 微生物群集 DNA 標準試料 Zymo Research Cat# D6305
Agencourt AMPure XP Beckman Coulter Cat# A63881
Qubit dsDNA HS アッセイキット-500 アッセイ ThermoFisher Scientific Cat# Q32854
NEBNext Library Quant Kit for Illumina New England BioLabs Cat# E7630L
高感度 D1000 スクリーンテープ Agilent Cat# 5067-5584
Agilent High Sensitivity DNA Reagents Agilent Cat# 5067-4627
MiSeq 試薬キット v2 (500 サイクル) Illumina Cat# MS-102-2003
PhiX Control v3 Illumina Cat# FC-110-3001
ヒト LPS 結合タンパク質 ELISA キット R&D Systems 社 Cat# DY870-05
ヒト腸管脂肪酸結合タンパク質(I-FABP)ELISA キット Sigma Aldrich Cat# RAB0537
ヒト LPS ELISA キット Cusabio Cat# CSB-E09945h
Murine LPS-binding protein ELISA kit Hycult Biotech Cat# HK205-01
PAS 染色キット Abcam Ab150680
寄託データ
16S DATA 本紙 NCBI SRA アクセッション番号 PRJNA720523
実験モデル 生物/系統
マウス C57BL/6J Envigo N/A
マウス NOD.Cg-PrkdcscidIl2rgtm1Wjl/Szj (NSG) UCL, Clare Hall N/A
マウス、Tg(TcraR28,TcrbR28)KRNDim Prof. Diane Mathis N/A
マウス、NOD I-Ag7 Mauro Peretti教授 N/A
マウス Il10ra-/- Werner Muller教授 N/A
マウス B6;129S5-Cldn8tm1Lex/Mmucd アンドリュー・スミス教授 N/A
オリゴヌクレオチド
qPCRプライマー
Hprt
Fwd 5′- TTTGCTGACCTGCTGGATTAC -3′ ThermoFisher Scientific, この論文 N/A
Rev 5′-CTTTTATGTCCCCCGTTGACT-3′。
V3/V4 16秒
Fwd 5′-TCCTACGGGAGGCAGCAGT-3′ ThermoFisher Scientific, This paper N/A
Rev 5′-GGACTACCAGGGTATCTAATCCTGTT-3′。
Il10ra
N/A QIAGEN Cat# 249900
ソフトウェアとアルゴリズム
GraphPad Prism 8 グラフパッドソフトウェア https://www.graphpad.com
Flowjo v10.5.0 Flowjo, LLC https://www.flowjo.com
NDP.view2 ビューイングソフトウェア 浜松 https://www.hamamatsu.com/eu/en/product/type/U12388-01/index.html
Illumina Casava 1.7 Illumina https://www.illumina.com
Mothur V1.35.13 Schloss et al.66 https://mothur.org/
フィロセック https://joey711.github.io/phyloseq/
その他
RPMI-1640 培地 Sigma Aldrich Cat# R8758
Advanced DMEM/F12 GIBCO Cat# 12634028
赤血球溶解バッファー Sigma Aldrich Cat# R7757
仔牛胎児血清(FCS) Biosera Cat# FB1001/500
正常ヤギ血清 Vector Cat# S1000
エチレンジアミン四酢酸 ThermoFisher Scientific 社の Cat# AM9260G
LIVE/DEAD™ Fixable Blue Invivogen Cat# L34961
Vectashield Mounting Medium with DAPI Vector labs Cat# H-1200-10
ホルマリン溶液、中性緩衝液、10% Sigma Aldrich Cat# HT501320
ペニシリン/ストレプトマイシン Sigma Aldrich Cat# P0781
eBioscience™ 細胞内固定化・透過化バッファーセット ThermoFisher Scientific Cat# P078188-8824-00
Brilliant stain buffer BD Biosciences Cat# 563794
M. tuberculosis H37 Ra, desiccated BD Cat# 231141
Percoll Plus GEヘルスケア Cat# 17544501
O.C.T コンパウンド Tissue-Tek Cat# 23-730-571
Matrigel コーニング Cat# 356231
新しいタブで表を開く
リソースの有無
リード連絡先
リソースや試薬に関する詳細な情報やリクエストは、リードコンタクトであるPaul Blair ( p.blair@ucl.ac.uk ) までお願いします。
材料の利用可能性
この研究では、新しい試薬は生成されなかった。
データおよびコードの利用可能性
本研究で作成した16Sデータセットは、NCBI Sequence Read Archiveで入手可能である。PRJNA720523 に掲載されている。
実験モデルおよび被験者の詳細
ヒト試料
血清は、関節リウマチ(RA)患者および健康な成人対照者から、倫理委員会の承認に基づく十分なインフォームド・コンセントを得て得た。University College London Hospitals Health Service Trust (14/LO/0506 and 14/SC/1200); CPP, Ile de France VII (13-048), Academic Medical Centre, Amsterdam (METC 2013_304), および Azienda Ospedaliero Universitaria Careggi (2012/0035P82) の各倫理委員会の承認を得て、インフォームドコンセントを得た。患者および健常対照者の臨床情報は、表S1に示す。
マウス
C57BL/6J マウスは、Envigo Laboratoriesから購入した。NOD scid gamma(NSG、NOD.Cg-PrkdcscidIl2rgtm1Wjl/Szj)マウスは、UCL、Clare Hallから購入した。K/BxN自然発症関節炎マウスは、TCRトランスジェニックKRNマウス(Tg(TcraR28,TcrbR28)KRNDim、Diane Mathis, Harvard Medical School, USAにより提供)と(I-Ag7)NODマウス(Mauro Peretti, Queen Mary University of London, UKにより提供)を自家交配させることにより飼育された。Il10ra-/-マウスは、W. Muller(University of Manchester、UK)により提供された。クローディン8-/-マウス(B6;129S5-Cldn8tm1Lex/Mmucd)は、A. SmithおよびB. Nedjat-Shokouhiによって提供された(系統に関する遺伝子情報については、補足の方法図1)。マウスは雌雄同体で、すべてのK/BxN実験に使用したが、AIA実験には病気の発生が予測できるため、雌のみを使用した。マウスは実験群にランダムに割り当てられ、可能な限りケージ間で混合された。マウスは、20-24℃、45-64%の湿度、12-明暗サイクルで、特定の日和見主義者および病原体フリー(SOPF)条件下で個別換気ケージに収容した(健康診断(フルFELASAプロファイル)は毎年実施された)。実験用マウスにはHarlan Teklad pellets 2018(タンパク質18%)を、繁殖用マウスにはHarlan Teklad pellets 2010(タンパク質19%)を与え、餌と水はアドリビテーションで利用可能とした。マウスは2-12週齢の間に使用し、ユニバーシティ・カレッジ・ロンドンの動物施設で維持した。可能な限り、倫理的かつ還元的な動物使用を考慮し、サンプルサイズを確定するために初期の予備実験を行った。すべての実験は、University College LondonのAnimal Welfare and Ethical Review Bodyによって承認され、英国内務省によって認可された。
K/BxNについては、ノギス(POCO 2T; Kroeplin Längenmesstechnik)を用いて関節(前足、後足関節)のサイズを測定し、その疾患スコアを以下のように算出した。
腫脹
関節の大きさ(Tx)-関節の大きさ(T0)。
関節サイズatT0
×100
∗T0=3週齢、離乳日。
方法詳細
抗原誘発関節炎(AIA)の誘発
AIAは、以前に記載された方法で誘導した41,42。簡単に言えば、マウスを、100μLの完全フロイントアジュバント(CFA)およびリン酸緩衝生理食塩水(PBS、Sigma-Aldrich)中の200μgのメチル化ウシ血清アルブミン(mBSA、Sigma-Aldrich)で尾部の基部に皮下免疫化した。3 mg/ml CFAは、結核菌(231141、BD)を不完全フロイントアジュバント(F5506、Sigma-Aldrich)中で混合することにより調製された。7日後、マウスは右膝に10μLのPBSに溶解した200μgのmBSAを関節内注射され、左膝にはコントロールとしてPBSのみを注射された。関節サイズはノギスを用いて測定した。膝の腫脹は、抗原を注射した膝とPBSを注射した膝との間のサイズの増加率として計算された。
疾患スコアは以下のように算出した。
腫脹率
mBSAknee-PBSknee
PBSknee
×100
関節炎中に微生物叢の枯渇のために抗生物質で処理した場合、C57BL/6マウスは、皮下注射の7日前から、ネオマイシン(1g/L、N1876、Sigma-Aldrich)、メトロニダゾール(1g/L、M3761、Sigma-Aldrich)およびバンコマイシン(0.5g/L、V2002、Sigma-Aldrich)を組み合わせて飲料水中で投与された。マウスは実験期間中、抗生物質を投与されたままであった。
In vivo腸管透過性測定
RA患者および健常対照者(HC)の血清中のヒトLPS結合タンパク質(LBP)レベルを、製造者の説明書に従ってELISA法により測定した(DY870-05、RnD Systems)(PBS/1%BSAで1000分の1に希釈した)。腸内脂肪酸結合タンパク質(I-FABP)のレベルも、製造者の指示に従って、前述のRA患者およびHCの血清(1:1)においてELISA法により測定した(RAB0537、シグマ社)。LPSレベルも、これらのサンプルで、製造者の指示に従って、原液のまま、ELISAによって測定した(CSB-E09945h、Cusabio)。
マウス血清(1000分の1に希釈)中のマウスLPS結合タンパク質レベルを、製造業者の説明書に従ってELISAにより測定した(HK205-01、Hycult Biotech)。
FITC-デキストランのトランスロケーション測定のために、14時間ケージから餌を取り除き、その後マウスに水で希釈した600mg/kg体重の4kD FITC-デキストラン(46944-500MG-F、Sigma)をガバージさせた。投与30分後に採血し、励起波長485nm、発光波長535nmの蛍光光度計(TECAN Genios Spectra Fluor plus)を用いてFITC-デキストランの血清中濃度を測定した。FITC-dextranはPBSで連続的に希釈し、標準曲線を作成した。
細胞の調製
脾臓、パイエル板(PP)、腸間膜(mLN)および腋窩(ALN)リンパ節を、L-グルタミンおよびNaHCO3(Sigma-Aldrich)を含む完全RPMI-1640(cRPMI)培地に、1:10牛胎児血清(FBS)(Biosera)および1:100Penicillin(10. 000単位/ml)/ストレプトマイシン(10mg/ml)(シグマ-アルドリッチ)。単細胞懸濁液は、70μmセルストレーナー(BD Biosciences)を通して組織を解離させることにより得た。赤血球は、Red Blood Cell (RBC) Lysis buffer (Sigma-Aldrich) を用いて溶解させた。
上皮内リンパ球(IEL)および固有層単核細胞(LPMC)の分離のために、小腸および大腸を取り出し、脂肪および糞便を除去した。小腸は、PPを除去し、十二指腸、空腸、回腸に分けた。腸を縦にスライスして5〜10mmに切り、5mMエチレンジアミン四酢酸(EDTA, Thermo Fisher Scientific)を含むHanks Balanced Salt Solution(HBSS, Thermo Fisher Scientific)を用いて180rpm、37℃で15分間インキュベーションを行った。インキュベーション後、サンプルをボルテックスし、100μmセルストレーナー(BD Biosciences)を通して溶液からIELsを回収し、上記と同様に組織を再インキュベートした。両セットのIELs分離後、残った組織を新鮮なHBSSで洗浄してEDTAを除去し、さらにそれぞれの消化酵素(小腸:コラゲナーゼVIII - 1 mg/mL(C2139, Sigma-Aldrich); 結腸:コラゲナーゼV - 0. 425 mg/mL (C9263, Sigma-Aldrich), collagenase D - 0.625 mg/mL (11088866001, Roche Diagnostics), dispase - 1 mg/mL (17105-041, GIBCO), DNase I - 0.03 mg/mL (10104159001, Roche Diagnostics)) を使用した。小腸は 25 分、大腸は 40 分、180 rpm、37℃、10 分毎に厳密に振盪しながらインキュベートした。回収した IEL を 40:75% 等張 Percoll Plus (17544501, GE Healthcare) 勾配でスピンし(20 分、21℃、900 g)、その界面をさらに使用した。LPMCsについては、消化後の細胞をcRPMIで洗浄し、40%等張Percollに再懸濁し、450gで8分間遠心してサンプルの残渣を除去した。
肺免疫細胞の単離のために、解剖の前に肺血管床をPBSで灌流した。肺を小片に切り、0.13 mg/ml Liberase TL (Roche) および 20 U/ml DNase I (Roche) を含む無血清 RPMI-1640 で、37℃で45分間、一定に振盪しながら消化した。消化された組織は、さらに70μmのセルストレーナーを通して単細胞に解離された。フローサイトメトリーによる肺免疫細胞の同定のためのゲーティング戦略は、補足の方法図2に示されている。
すべての単細胞懸濁液を回収した後、cRPMIで洗浄し、計数した。
フローサイトメトリー
単細胞懸濁液は、以下の表面抗マウスマーカーの組み合わせで染色した。CD19 BV785、CD3 BV605、CD4 BV711、MHC-II APC-Cy7、Ly6G Alexa Fluor 700、CD11b BV605、CD11c FITC、EPCAM FITC、CCR9 PE-Cy7 (Biolegend), CD45 BUV737、CD8 BUV805、LPAM-1 PE、IL-10R PE、シグレックF PE(BD Bioscience)、Ly6C PE-Cy7(eBioscience)、F4/80 APC(Invitrogen); および LIVE/DEAD Fixable Blue Dead Cell Stain (Invitrogen, Thermo Fisher Scientific) を用いて RT で 30 分間死細胞を排除し,2%パラフォルムアルデヒド(PFA)溶液(Sigma)で固定した.細胞内サイトカイン産生のために,まず細胞を,phorbol 12-myristate 13-acetate (PMA, 50 ng/ml, Sigma-Aldrich), Ionomycin (250 ng/ml, Sigma-Aldrich) および Brefeldin A (5 μg/ml, Sigma-Aldrich) とともに cRPMI 中で 0.5X106 cells/well で 4.5 h 培養した.その後、細胞を上記のように表面マーカーで染色し、製造者の指示に従ってeBioscience細胞内染色キットを用いて固定および透過化し、IFNγ APC(BD Bioscience)、IL-10 PE(Biolegend)、IL-17 eFluor 450(eBioscience)の組み合わせでインキュベートした。
健常対照者またはRA患者から単離したPBMCを、LIVE/ DEAD Fixable Blue Dead Cell Stain(Invitrogen)、RTで20分間、フローサイトメトリー用の抗ヒト抗体、4℃で30分間で以下のようにex vivo染色をした。CCR9 Alexa Fluor 647 (Biolegend) および LPAM-1 PE (Novus Biologicals).
フローサイトメトリーはLSR II (BD Biosciences)で行った。データはFlowJo(Treestar)を用いて解析した。
凍結組織切片の組織学的評価
腸管切片(小腸の十二指腸,空腸,回腸および近位,内側,遠位結腸)を採取してO.C.Tコンパウンド(Tissue-Tek)に包埋し,肺は50%OCT/PBSで膨張させてOCTに包埋し,乾燥氷冷したisopentane(Sigma)でスナップフローイングを行った.腸組織を6μmの切片に切断し(HM525 NX cryostat,Thermo Scientific),肺を10μmの切片に切断してSuperfrost Plusスライド(VWR)に接着し,Tissue-Tek DSR自動染色機でヘマトキシリン・エオジン(H&E)染色を行った.切片は10%中性緩衝ホルマリン溶液(Sigma)で固定し、PBSで再水和、ヘマトキシリン染色、洗浄、エオシンYで対比染色し、75%から100%の高濃度のエタノールで順次洗浄、脱水した。切片はNDP NanoZoomer(浜松)を用いてスキャンし、NDP viewソフトウェアで解析した。
腸の炎症の程度は、小腸と大腸の各部位について盲検法で、若干の変更を加えた上で、半定量的にスコア化した37,67。簡単に言えば、各組織について5つの基準を0から3まで評定した。白血球浸潤(0-なし;1-最小;2-軽度、粘膜層におけるリンパ球および好中球の多巣性浸潤;3-中程度、粘膜および粘膜下層におけるリンパ球および好中球のびまん性浸潤)、陰窩伸長、筋壁肥厚(ともに0-正常(ナイーブまたは2週間齢のK/BxNの100%以下)。1-軽度(101%-150%);2-中等度(151%-200%);3-重度(200%以上))、上皮侵食の程度、杯細胞またはクリプト全体の消失(0-、なし;1-軽度、多巣;2-中等度、多巣;3-重度、びまん)、ナイーブマウスの腸切片と比較して、上皮の侵食がどの程度あるか?各基準のスコアを合計して、各組織の総合的な炎症スコアとした。
過ヨウ素酸シッフ(PAS)染色
腸切片を採取し、上記のようにOCTでスナップ凍結し、-80℃で保存した。凍結切片(6μm)を10%中性緩衝ホルマリン溶液(Sigma)で10分間固定し(RT)、製造者の指示に従ってPAS染色キットを用いてムチンおよび杯細胞数を染色した(ab150680、abcam)。簡単に説明すると、切片を過ヨウ素酸溶液で染色し、RO水で洗浄し、シッフ溶液で染色し、水道水ですすぎ、ヘマトキシリン、ブルーイング試薬、ライトグリーン試薬で染色し、各ステップの間に水洗を行い、最後に75%から100%まで順次濃度の高いエタノールで脱水してDPX (BDH VWR) を用いてマウントした。切片はNDP NanoZoomer (Hamamatsu)を用いてスキャンし、NDP viewソフトウェアで解析した。
免疫蛍光法
腸管切片と肺を採取し、上記と同様にOCTでスナップ凍結した。凍結切片(6μm)を10%中性緩衝ホルマリン溶液(Sigma)で室温(RT)で10分間固定し、PBSで再水和し、0.3%Triton X-100(Sigma)入り10%正常ヤギ(Vector Labs)またはロバ(Abcam)血清で室温(RT)20分間ブロッキングをした。組織を一次抗体(EpCAM-FITC、Biolegend;ウサギ抗マウスZO-1、Abcam;ウサギポリクローナル抗MUC2、Abcam)とともに4℃にて一晩インキュベートした。二次抗体(ヤギ抗ウサギIgG-Alexa Fluor 555, Thermo Fisher, ロバ抗ウサギIgG-Alexa Fluor 488, Thermo Fisher)はX2 PBS洗浄後に翌日添加し、RTで1時間インキュベートした。最後にスライドをDAPI入りProlong Antifade Mountant(Thermo Fisher)またはDAPI入りVectashield(Vector Labs)でマウントし,AxioVisionまたはZen lite(ブルー版)ソフトウェアを用いてZeiss蛍光顕微鏡でイメージングし,Fiji(ImageJ)を用いて平均蛍光強度を分析した。
バクテリアのトランスロケーション測定
脾臓、腸間膜、関節排泄(腋窩)リンパ節を、初期疾患および関節炎のK/BxNマウスから無菌的に単離した。細菌16 s rDNAを、製造業者の説明書に従ってQIAmp DNA mini kit (51304, QIAGEN)を用いて消化された組織から抽出した。簡単に言うと、サンプルを溶解バッファーとProteinase Kで一晩消化し、Tissue Lyser(QIAGEN)を用いてホモジナイズした。得られた16秒間の細菌rDNAを含む上清を精製し、-20℃で凍結した。サンプルは、QuantiTect SYBR Green PCRキット(QIAGEN)を用いて、qPCR(Fプライマー:5′-TCCTACGGAGGCAGCAGT、Rプライマー:5′-GGACTACCAGGTATCTAATCCTGTT)によりV3/V4 16 s rDNA領域について製造者の説明に従って定量化された。
関節炎細胞移植および細菌再構成
ナイーブNOD scid gamma(NSG)マウスを抗生物質で処理した:アンピシリン(1 g/L, A9393, Sigma-Aldrich), ネオマイシン(1 g/L, N1876, Sigma-Aldrich), メトロニダゾール(1 g/L, M3761, Sigma-Aldrich), およびバンコマイシン (0.5 g/L, V2002, Sigma-Aldrich); あるいは3週間オートクレーブにかけた水中で飼育した。脾臓細胞は、関節炎K/BxNマウスまたはNODコントロールから分離し、プールし、コントロール、抗生物質処理マウスまたは以下に記載するようにK/BxNまたはKRNマウスの腸内細菌叢で再構成したNSGマウスにi.v. (6000万細胞/マウス)移した。
細菌再構成のために、NSGマウスは抗生物質で2週間処理し、細菌再構成の前に24時間オートクレーブ水に交換した。関節炎K/BxNマウスまたはコントロール(ナイーブKRN)マウスの糞を新鮮なまま採取し、ホモジナイズしてPBSで希釈し、7日前および細胞移植当日にNSGマウスに投与した(0.06 mg feces/マウス)。
腸管上皮細胞の分離
腸管上皮細胞の分離は、十二指腸、空腸、回腸に分離した小腸からPPと脂肪を除去した。SIと結腸の腸管組織をHBSSで洗浄し、縦方向に2-5 mmに切断し、5% FCSと2.5 mM EDTAを添加したHBSSで180 rpm、37℃で40分間インキュベーションを行った。IECを100μmのセルストレーナーに通し、cRPMIでx2回洗浄した。腸管切片から破片と残った脂肪を25%-40%等張パーコールグラジエントスピン(10分、600g、21℃)を用いて除去し、界面に上皮細胞を含ませた。その後、IECをcRPMIで洗浄し、計数し、さらにFACS染色またはqPCRのためのmRNA抽出に使用した。
RT-PCRによる遺伝子発現
IECからRNAをメーカーの説明書に従って抽出し(Arcturus Picopure RNA isolation kit, Applied Biosystems)、iScript(Biorad)を用いて最大500 ngのmRNA/サンプルからcDNA合成を行った。il10ra (QuantiTect, QIAGEN) およびハウスキーピング遺伝子 hprt (F primer: 5′-TTTGCTGACCTGCTGGATTAC-3′, R primer: 5′-CTTTTATGTCCCCCGTTGACT-3′) についてのqPCR反応は、iQ SYBR® Greenを用いて実施された。サンプルはOpticon RT-qPCR machine(MJ Research社製)で二重にアッセイし、ΔC(t)法を用いて相対発現量を算出した。
小腸オルガノイドの培養
オルガノイドの樹立と維持は、公表されているプロトコールと同様に行った68,69。簡単に言えば、小腸の近位部を縦に切断し、Mg2+とCa2+を含まない氷冷PBS(GIBCO)で洗浄し、絨毛を削り取り、その後さらにPBSで洗浄した。腸を2-4 mmに切断し、50 mLファルコンチューブに移し、上清が透明になるまでピペッティングしてPBSで2-3回洗浄した。清浄な腸切片を、PBS中2mM EDTAの入った新しいチューブに移し、ローラーシェイカー上で4℃、30分間インキュベートし、クリプトの単離を行う。分離したクリプトを十分に洗浄し、約300-500クリプト/30μL Matrigel/wellでMatrigel(Corning)中にプレーティングするためにカウントする。Matrigel液滴の固化後(37℃で10分間)、培養液を各ウェルに添加した。1×ペニシリン/ストレプトマイシン(Sigma)、2mM GlutaMAX、10mM HEPES、1×N-2 supplement、1×B-27 supplement(all Thermo Fisher)、1mM N-acetylcysteine(Sigma) を含む Advanced DMEM/F12 (GIBCO)、上皮成長因子(50 ng/ml、Peprotech)、1 μg/mlのヒト組み換え R-spondin( Biolegend)、0. μg/mlのマウス組換えNoggin(Peprotech)。
組換えIFNγおよびIL-10(Biolegend)を1ng/mlで一晩オルガノイドに加え、オルガノイド上皮細胞のIL-10R発現に対する影響を調べ、上記と同様にフローサイトメトリーで染色し、分析した。
骨髄キメラの作製
キメラマウスおよび適切な対照を生成した。簡単に言うと、レシピエントWTまたはIL-10R-/-マウスは、セシウム源を介して9Gyのγ線照射を受け、5時間平衡させた後、107個のドナー骨髄細胞をi.v.投与された。IL-10Rの欠損を上皮(非造血)細胞のみに限定するため、照射したIL1-0R-/-マウスはWT骨髄(造血細胞)を投与し、すべてのキメラマウスはAIA誘導に使用する前に少なくとも6週間放置して再構成させた。
AT-1001を用いた腸管透過性の調節
合成ゾヌリン拮抗薬であるAT-1001は、A. Fasano (Massachusetts General Hospital)から好意的に提供された。マウスは、AIA誘導のためのmBSA/CFA皮下注射から8日間、150μLの水で希釈した50μgのAT-1001、または陰性対照として150μLの水を、毎日2回経口摂取した(図S6Aに記載)。
腸への免疫細胞再循環の調節
ケモカイン受容体CCR9に対する市販の薬剤であるVercirnon(Chemocentryx)を、10%Kolliphor® EL(Sigma)中の懸濁液として製剤化した。マウスあたり250μL中200μg(10mg/kg)を、図S6AのAT-1001処理と同じタイムスケールでAIA誘導中毎日2回腹腔内注射した。
16S rDNA配列決定
細菌配列決定を、以前に記載されたように実施した70。簡単には、20〜50mgの糞便材料を、製造業者のプロトコルに従ってQIAmp DNA mini kit(QIAGEN)を用いて抽出し、さらに、ライジングマトリクスE(MP Biomedicals)を用いて50Hzで1分間ビーズビートすることによって細胞破壊ステップを行った(Tissuelyser LT、QIAGEN)。16S rRNA遺伝子のV3-V4領域にまたがるバーコードプライマーは、イルミナアダプター、8ヌクレオチドのバーコード配列、10ヌクレオチドのパッド配列、2ヌクレオチドのリンカー、遺伝子特異的プライマー:341F-CCTACGGNGGCWGCAGまたは805R-GACTACHVGGTATCTAATCCを含むように以前に記載した66ように設計された。(Sigma-Aldrich, Dorset, UK)を用いた。抽出したDNAサンプルは、Taq Core PCRキット(QIAGEN)を用いて、製造者の指示に従って異なるバーコードの組み合わせで増幅した。その後、サンプルをプールして、各サンプルからほぼ同濃度の16S rRNAアンプリコンを含むライブラリを作成し、品質チェック、配列決定、および解析を既述70,66の方法で行った。
定量および統計解析
すべてのデータは、平均値±SEMで表した。臨床的および組織学的なスコアリングは盲検下で行った。AIAモデルにおけるin vivo試験については、WT関節膝腫脹の平均最大値が2mm、SDが0.39mm、試験群関節膝腫脹の予想値が±0.6mmというデータから検出力の計算を行った。3匹以上のグループサイズは、少なくとも80%の統計的検出力に達するのに十分であった(http://www.statisticalsolutions.net/pss_calc.php)。統計的有意性を評価するために、一元配置分散分析(3群以上の比較)、二元配置分散分析、対または非対Studentのt検定(2群間の比較)を実施した。特に断りのない限り、ANOVAを用いた多重比較にはボンフェロンニ補正を適用した。すべてのデータは、D'Agostino-Pearsonオムニバス正規性検定によって決定されたように、正規分布を有していた。すべての図において、p値は以下のように表される。∗p<0.05;**p<0.01;**p<0.001,***p<0.0001.免疫蛍光法および組織学スキャンを除くすべてのデータは、GraphPad Prism 7 (La Jolla, CA, USA)を用いて解析した。
謝辞
KRNマウスを提供してくださったDiane Mathis教授とChristophe Benoist教授(ハーバード大学医学部)、NODマウスを提供してくださったMauro Peretti教授(ロンドン大学クイーンメアリー校)、IL10ra-/-マウスを提供してくださったWerner Muller教授(マンチェスター大学)、動物飼育であらゆる支援をいただいたUniversity College London Biological Services unitのスタッフ、エタネルセプト処理患者血清サンプルを提供してくださったABIRISK Consortiumの皆様に感謝します。グラフの要旨はBioRender.comで作成されました。この研究はVersus Arthritis program grant ( 21140 ) と UKRI/MRC ( MR/T000910/1 ) から C.M. と P.A.B. に資金提供された。D.E.M. は Versus Arthritis PhD studentship ( 21257 ) から C.M に、 E.C.R. は Versus Arthritis UK Foundation fellowship ( 21141 )から資金提供された。A.M.S.とB.N.-S.はMedical Research Council ( MR/L000261/1 and MR/K023624/1 , respectively ) から資金援助を受けた.
著者による貢献
D.E.M.は実験の計画、実施、データ解析、原稿執筆を行った。M.M.は、実験を行い、データを分析し、原稿を批判的に検討した。D.G.A.とN.K.は16S rDNA配列の決定と解析を行った。A.M.S.とB.N.-S.はクラウディン8-/-マウスを提供し、原稿を批判的に検討した。A.F.はAT-1001を提供し、原稿を批判的に検討した。L.M.とJ.J.M.は、RA患者の募集とサンプル処理を行った。A.D.は実験を行った。S.B.、A.G.、S.H.-B.-A.はエタネルセプトのサンプルを提供し、S.B.は彼らの臨床情報を提供した。E.C.R.は実験を行い、原稿を批判的に検討した。P.A.B.は実験を行い、試験と実験の設計、データの分析、原稿の執筆を行った。C.M.は、研究および実験の設計、データの分析、原稿の執筆を行った。
利害関係者の宣言
A.F.は、腸管透過性を利用してグルテンフリー食を補完する治療法を開発するアルバ・セラピューティクス社の共同設立者であり、株主である。
補足情報
pdfをダウンロード (37.59 MB)
pdfファイルに関するヘルプ
資料S1. 表S1、図S1-S6
参考文献
マッキネス I.B.
Schett G.
関節リウマチの発症機序。
N. Engl. J. Med. 2011; 365: 2205-2219
記事で見る
スコープス (3319)
パブコメ
クロスリファレンス
グーグル奨学生
オルタ-バースG.
ロメロ=フィゲロア M.D.S.
モンティエル・ヤルキーン A.J.
ピサノ=ザラテ M.L.
ガルシア-メナ J.
Ramírez-Durán N.
腸内細菌の異常と関節リウマチ:腸内細菌叢と関節リウマチの病態の関連性。
J. Immunol. Res. 2017; 2017: 4835189
記事で見る
スコープス (137)
PubMed
クロスリファレンス
グーグル奨学生
Jeong Y.
キム・J.W.
You H.J.
Park S.J.
Lee J.
Ju J.H.
パク M.S.
Jin H.
Cho M.L.
Kwon B.
他。
早期関節リウマチ患者における腸内細菌組成および機能の変化。
J. Clin. Med. 2019; 8: 693
記事で見る
スコープス(43)
クロスリファレンス
グーグル・スカラー
シャー・J.U.
シェスナックA.
ロングマンR.S.
セガタ・N.
ウベダ C.
ビエルスキ C.
ロストロン T.
セルンドーロ V.
パマー E.G.
エイブラムソンS.B.
他
腸内プレボテラ・コプリの増殖は、関節炎に対する感受性の増強と相関している。
eLife. 2013; 2: e01202
記事で見る
PubMed
クロスリファレンス
グーグル奨学生
ドラゴL.
関節リウマチにおけるPrevotella copriと微生物叢:完全に説得力のある証拠?
J. 臨床。Med. 2019; 8: 1837
記事で見る
スコープス(15)
クロスリファレンス
グーグルスカラー
前田洋平.
倉川哲也
梅本英樹
本岡大介
伊藤洋一
後藤和彦
廣田和彦
松下正樹
古田由紀子
楢崎正樹
他.
腸管における自己反応性T細胞の活性化を介したディスバイオーシスによる関節炎発症への寄与。
Arthritis Rheumatol. 2016; 68: 2646-2661
記事で見る
スコープス(319)
PubMed
クロスリファレンス
グーグル奨学生
前田康宏
武田和彦
関節リウマチにおける腸内細菌叢の役割.
J. Clin. Med. 2017; 6: 60
記事で見る
スコープス(113)
クロスリファレンス
グーグルスカラー
ピアンタ A.
アルヴィカーS.
ストールK.
Drouin E.E.
ワン Q.
コステロC.E.
Steere A.C.
関節リウマチ患者における腸内細菌Prevotella copriの免疫関連性のエビデンス。
Arthritis Rheumatol. 2017; 69: 964-975
記事で見る
スコープス (187)
PubMed
クロスリファレンス
グーグル奨学生
ベニケT.B.
エリンゼンT.
グレラップ H.
ボンデラップ O.K.
カールセン T.G.
マイヤー・M.K.
ボグステッド M.
クリスチャンセン G.
ビルケルンド S.
アンデルセン V.
Stensballe A.
関節リウマチ腸管粘膜のプロテオーム解析。
J. プロテオーム・リサーチ 2017; 16: 346-354
記事で見る
スコープス(35)
PubMed
クロスリファレンス
グーグル奨学生
Zhang X.
Zhang D.
Jia H.
Feng Q.
Wang D.
Liang D.
Wu X.
Li J.
Tang L.
Li Y.
et al.
関節リウマチでは口腔内および腸内細菌叢に異常があり、治療により一部正常化する。
Nat. Med. 2015; 21: 895-905
記事で見る
スコープス (862)
PubMed
クロスリファレンス
グーグル奨学生
ブロックK.E.
鄭
デント A.L.
キー B.L.
Huang H.
腸内細菌叢は濾胞性ヘルパーT細胞ではなく、Th17細胞を通してK/BxN自己免疫関節炎を制御する。
J. Immunol. 2016; 196: 1550-1557
記事で見る
スコープス(55)
PubMed
クロスリファレンス
グーグル奨学生
ゲレイロ C.S.
カラード
ソウサ J.
フォンセカJ.E.
食事、微生物叢、および腸管透過性、関節リウマチの未知の三要素。
フロント。Med.(ローザンヌ)。2018; 5: 349
記事で見る
スコープス (57)
PubMed
クロスリファレンス
グーグル奨学生
グロシュヴィッツ K.R.
ホーガン S.P.
腸管バリア機能:分子制御と疾患発症機構
J. アレルギーの臨床。Immunol. 2009; 124: 3-20, quiz 21-22
記事で見る
スクープ (986)
パブコメ
概要
全文
全文PDF
Google Scholar
カパルド C.T.
パウエルD.N.
カルマンD.
層状の防御:粘液とタイトジャンクションはどのように腸管バリアを封鎖するのか。
J. Mol. Med. (Berl.). 2017; 95: 927-934
記事で見る
スコープス (137)
PubMed
クロスリファレンス
グーグル奨学生
コーフィールド A.P.
ヒトの健康と病気における腸内細菌叢と粘液バリアの相互作用。
マイクロオーガニズムズ。2018; 6: 78
記事で見る
スコープス(73)
クロスリファレンス
グーグルスカラー
アンドリュース C.
マクリーンM.H.
Durum S.K.
サイトカインによる腸管上皮機能のチューニング。
フロント。Immunol. 2018; 9: 1270
記事で見る
スコープス (116)
PubMed
クロスリファレンス
グーグル奨学生
ブリューワー M.
リューゲリングA.
Kucharzik T.
パルコスC.A.
マダラ J.L.
ホプキンス A.M.
ヌスラット A.
炎症性サイトカインは、アポトーシス非依存的なメカニズムで上皮バリア機能を破壊する。
J. Immunol. 2003; 171: 6164-6172
記事で見る
スコープス (689)
PubMed
クロスリファレンス
グーグル奨学生
チェン J.
ライト K.
デイビスJ.M.
ジェラルドP.
マリエッタE.V.
マーレー J.
ネルソンH.
マテソンE.L.
タネヤV.
まれな系統の腸内微生物の拡大が関節リウマチを特徴づける。
Genome Med. 2016; 8: 43
記事で見る
スコープス (370)
PubMed
クロスリファレンス
グーグル奨学生
ブリューワー M.
ウテックM.
イワノフA.I.
ホプキンス A.M.
パルコスC.A.
ヌスラット A.
インターフェロンγはマクロピノサイトーシス様過程を経て、上皮タイトジャンクションタンパク質の内在化を誘導する。
2005; 19: 923-933
記事で見る
スコープス (289)
PubMed
クロスリファレンス
グーグル奨学生
ワン・フー
シュワルツ・B.T.
グラハム W.V.
Wang Y.
Su L.
クレイバーグ D.R.
エイブラハム C.
ターナー J.R.
IFN-γによるTNFR2発現は、TNF依存性の腸管上皮バリア機能障害に必要である。
Gastroenterology. 2006; 131: 1153-1163
記事で見る
スコープス (245)
PubMed
概要
全文
全文PDF
Google Scholar
シュヴァル D.S.
ウアヘドJ.
ビスワスA.
ゲッテルJ.A.
ホーウィッツ B.H.
クラインC.
ミューゼA.M.
Snapper S.B.
インターロイキン10受容体シグナル:マウスおよびヒトにおける腸管粘膜恒常性のマスターレギュレータ。
Adv. Immunol. 2014; 122: 177-210
記事で見る
スコープス (190)
PubMed
クロスリファレンス
グーグル奨学生
チッチャF.
グッジーノG.
リッツォA.
アレッサンドロR.
ルケッティ M.M.
ミリング S.
サイエヴァ L.
サイパース H.
スタンポーン T.
ディ・ベネデットP.
他。
強直性脊椎炎患者における腸管上皮と血管のバリアーに異常とゾヌリンのアップレギュレーションが見られる。
Ann. Rheum. Dis. 2017; 76: 1123-1132
記事で見る
スコープス (149)
PubMed
クロスリファレンス
グーグル奨学生
Mielants H.
デボスM.
Goemaere S.
Schelstraete K.
Cuvelier C.
ゲータールス K.
マールテンス M.
アッカーマン C.
Veys E.M.
炎症性リウマチ性疾患における腸管粘膜透過性。II。疾患の役割。
J. Rheumatol. 1991; 18: 394-400
記事で見る
PubMed
Google Scholar
スミスM.D.
ギブソンR.A.
ブルックスP.M.
強直性脊椎炎と関節リウマチにおける腸管透過性の異常。
J. Rheumatol。1985; 12: 299-305
記事で見る
PubMed
グーグルスカラー
ボッシ E.
モルテーニL.
ラダエリM.G.
フォリーニL.
フェルモ I.
バジガルッピ E.
ピエモンティ L.
パストーレM.R.
パローニ R.
腸管透過性の亢進は、1型糖尿病の臨床的発症に先行する。
Diabetologia。2006; 49: 2824-2827
記事で見る
スコープス(276)
PubMed
クロスリファレンス
グーグル奨学生
ブスカリヌ M.C.
チェラソーリB.
アニバリV.
ポリカーノC.
リオネットL.
カピ M.
メッケリ R.
ロマーノ S.
フォルナシエロ A.
マッテイ G.
他
再発寛解型多発性硬化症患者における腸管透過性の変化。パイロットスタディ。
Mult. Scler. 2017; 23: 442-446
記事で見る
スコープス (83)
PubMed
クロスリファレンス
グーグル奨学生
カマラ・レマロイC.R.
シルバC.
グリーンフィールド J.
リュウ・W.Q.
メッツ L.M.
Yong V.W.
多発性硬化症における腸管バリア機能のバイオマーカーは、疾患活動性と関連している。
Mult. Scler. 2020; 26: 1340-1350
記事で見る
スコープス (29)
PubMed
クロスリファレンス
グーグル奨学生
ディローンA.K.
クメンM.
トローセイドM.
Åkra S.
リャスクー E.
ムーム B.
ヴェステルフス M.
カールソン T.H.
セリェフロット I.
Hov J.R.
原発性硬化性胆管炎における疾患重症度と関連する腸管バリア機能の循環マーカー。
リバ-イント. 2019; 39: 371-381
記事で見る
スコープス(27)
PubMed
クロスレフ
グーグル奨学生
フォティスL.
シャイフN.
バスチスK.W.
サムソンC.M.
レフ・ツィオンR.
フレンチ A.R.
Tarr P.I.
若年性特発性関節炎における腸管主導型全身性炎症の血清学的証拠。
J. Rheumatol. 2017; 44: 1624-1631
記事で見る
スコープス(18)
PubMed
クロスレフ
グーグル奨学生
ペルサース M.M.
ヘルメンスW.T.
グラッツ J.F.
組織傷害の血漿マーカーとしての脂肪酸結合蛋白質。
Clin. Chim. Acta. 2005; 352: 15-35
記事で見る
スコープス (381)
PubMed
クロスリファレンス
グーグル奨学生
Mielants H.
ゴーメアS.
デボスM.
シェルストラートK.
ゲータールスK.
マールテンス M.
アッカーマン C.
Veys E.M.
炎症性リウマチ性疾患における腸管粘膜透過性。抗炎症薬の役割。
J. Rheumatol. 1991; 18: 389-393
記事で見る
PubMed
Google Scholar
岩田真一
平木山明
江島由紀夫
影近 弘之
加藤千春
Song S.Y.
レチノイン酸はT細胞に腸管ホーミングの特異性を刷り込んでいる。
Immunity. 2004; 21: 527-538
記事で見る
スコープス (1194)
PubMed
概要
全文
全文PDF
Google Scholar
ウァルベル M.A.
マリセンM.
ガイ-グランD.
メッフルE.
ヌッセンツヴァイク M.C.
リケルム M.
キャリア A.
Malissen B.
CC-ケモカイン受容体CCR9を欠損したマウスは、初期のT細胞およびB細胞の発生に軽度の障害を示し、T細胞受容体gammadelta(+)腸上皮内リンパ球の減少を示す。
Blood. 2001; 98: 2626-2632
記事で見る
スコープス (260)
PubMed
クロスリファレンス
グーグル奨学生
クスコフ V.
コルガーノフA.S.
ドゥシャテルV.
デゴットC.
ブノワC.
マチス D.
全身性自己免疫によって引き起こされる臓器特異的疾患。
細胞。1996; 87: 811-822
記事で見る
スコープス (709)
PubMed
概要
全文
全文PDF
Google Scholar
スティーブンソン B.R.
シリシアーノJ.D.
ムースカー M.S.
グッデナウ D.A.
ZO-1:様々な上皮のタイトジャンクション(zonula occludens)に関連する高分子量ポリペプチドの同定。
J. セルバイオロジー 1986; 103: 755-766
記事で見る
スコープス (1272)
PubMed
クロスリファレンス
グーグル奨学生
ウェルズJ.M.
ブルマーR.J.
デリアンM.
マクドナルドT.T.
トルストF.
カニ・P.D.
テオドルー V.
デッカー J.
メヘスト A.
de Vos W.M.
他
腸管バリアのホメオスタシスと潜在的バイオマーカー。
Am. J. Physiol. Gastrointest. 肝臓 Physiol. 2017; 312: G171-G193
記事で見る
スコープス (271)
PubMed
クロスリファレンス
グーグル奨学生
エルベンU.
ロッデンケンパーC.
ドアーフェルK.
Spieckermann S.
ハラーD.
ハイメサットM.M.
ツァイツ M.
ジークムント B.
Kühl A.A.
モデルマウスにおける腸管炎症の組織形態学的評価の手引き。
Int. J. Clin. Exp. Pathol. 2014; 7: 4557-4576
記事で見る
PubMed
グーグル奨学生
ホルメン・ラーソン J.M.
トムソンK.A.
ロドリゲス-ピニェイロA.M.
カールソンH.
ハンソンG.C.
マウス胃,小腸および結腸における粘液の研究.III. 胃腸のMuc5acおよびMuc2ムチンのO-グリカンのパターンから、部位特異的な分布が明らかになった。
Am. J. Physiol. Gastrointest. 肝臓生理学. 2013; 305: G357-G363
記事で見る
スコープス (112)
PubMed
クロスリファレンス
グーグル奨学生
ウー・エイチ・ジェイ
イワノフI.I.
ダースJ.
服部 恭平
嶋 毅
梅崎由香里
リトマン D.R.
ブノワC.
Mathis D.
腸内残留型分節性糸状菌はTヘルパー17細胞を介して自己免疫性関節炎を引き起こす。
Immunity. 2010; 32: 815-827
記事で見る
スコープス (1147)
PubMed
概要
全文
全文PDF
Google Scholar
ラコフ・ナホウム S.
パグリノJ.
エスラミ-ヴァルザネF.
エドバーグ S.
Medzhitov R.
toll-like receptorによる常在細菌叢の認識は、腸のホメオスタシスに必要である。
Cell. 2004; 118: 229-241
記事で見る
スコープス (3241)
PubMed
概要
全文
全文PDF
Google Scholar
オレイニカ K.
ロッサーE.C.
マテイD.E.
ニスタラK.
ボスマ A.
ドロズドフ I.
Mauri C.
iNKT細胞の調節を介した制御性B細胞によるCD1d依存的な免疫抑制。
Nat. Commun. 2018; 9: 684
記事で見る
スコープス(54)
PubMed
クロスリファレンス
グーグル奨学生
ロッサー E.C.
オレイニカK.
トノンS.
ドイル・R.
ボスマ A.
カーターN.A.
ハリスK.A.
ジョーンズ S.A.
クラインN.
マウリC.
制御性B細胞は、腸内細菌叢によるインターロイキン-1βおよびインターロイキン-6の産生によって誘導される。
Nat. Med. 2014; 20: 1334-1339
記事で見る
スコープス (281)
PubMed
クロスリファレンス
グーグル奨学生
デニング T.L.
キャンベルN.A.
ソン F.
ガロファロ R.P.
クリンペルG.R.
レイエスV.E.
Ernst P.B.
マウス小腸・大腸の上皮細胞におけるIL-10受容体の発現。
Int. Immunol. 2000; 12: 133-139
記事で見る
スコープス (80)
PubMed
クロスリファレンス
グーグル奨学生
ジャリーA.
ボサードC.
ブーハンナC.
マソン D.
エスパゼ E.
ドニ M.G.
Laboisse C.L.
粘膜IL-10とTGF-βは、ヒト結腸移植片におけるLPS駆動型、IFN-γ媒介型の上皮障害の予防に重要な役割を果たす。
J. Clin. Invest. 2008; 118: 1132-1142
記事で見る
パブコメ
グーグルスカラー
コミンスキー D.J.
キャンベルE.L.
エーレントラウトS.F.
ウィルソンK.E.
ケリーC.J.
グローバーL.E.
コリンズ C.B.
ベイレス A.J.
サエディB.
Dobrinskikh E.
他
IFN-γによる極性腸管上皮のアピカルIL-10受容体の誘導。
J. Immunol. 2014; 192: 1267-1276
記事で見る
スコープス (66)
PubMed
クロスリファレンス
グーグル奨学生
アンゲロウ S.
ユウ A.S.
システインスキャン変異導入によるクローディン細胞外ドメインの構造・機能研究
J. Biol. Chem. 2009; 284: 29205-29217
記事で見る
スコープス (75)
パブコメ
概要
全文
全文PDF
Google Scholar
ツァイシグ S.
ビュルゲルN.
ギュンツェルD.
リヒター J.
マンカーツ J.
ワーンシャッフェ U.
クローゼン A.J.
ツァイツ M.
フロムM.
Schulzke J.D.
クローディン2、5および8の発現と分布の変化により、活動性クローン病におけるタイトジャンクションの不連続性とバリア機能不全が引き起こされる。
Gut. 2007; 56: 61-72
記事で見る
スコープス (828)
PubMed
クロスリファレンス
グーグル奨学生
Fasano A.
ゾヌリン、タイトジャンクションの制御、および自己免疫疾患。
Ann. N Y Acad. Sci. 2012; 1258: 25-33
記事で見る
スコープス (187)
パブコメ
クロスリファレンス
グーグル奨学生
レフラーD.A.
ケリーC.P.
グリーンP.H.
フェドラックR.N.
ディマリノA.
ペロー W.
ラスムッセン H.
ワン C.
バーシック P.
バチアー N.M.
Murray J.A.
グルテンフリー食にもかかわらずセリアック病の症状が持続する場合の酢酸ララゾチド:無作為化比較試験。
Gastroenterology. 2015; 148 (9.e6): 1311
記事で見る
スコープス(158)
PubMed
概要
全文
全文PDF
Google Scholar
ベッカーP.
エブスワース K.
ウォルターズ M.J.
ベラホビッチR.D.
エルトル L.S.
シャルバット・T.T.
プンナ・S.
パワーズJ.P.
キャンベル J.J.
サリバンT.J.
他
潰瘍性大腸炎治療におけるCCR9アンタゴニスト。
Mediators Inflamm. 2015; 2015: 628340
記事で見る
スコープス (16)
PubMed
クロスリファレンス
グーグル奨学生
ビャルナソンI.
ウィリアムズP.
ソ A.
ザネリG.D.
レヴィ A.J.
グンペル J.M.
ピータース T.J.
Ansell B.
関節リウマチにおける腸管透過性と炎症:非ステロイド性抗炎症薬の効果。
Lancet。1984; 2: 1171-1174
記事で見る
スコープス(269)
PubMed
概要
Google Scholar
タジクN.
フレッシュM.
シュルツ O.
シャルター F.
ルーカス S.
アジゾフ V.
デュエルホルツ K.
シュテフェン F.
オマタ Y.
リングスA.
他。
ゾヌリンと腸管上皮のバリア機能を標的とした関節炎発症の予防。
Nat. Commun. 2020; 11: 1995
記事で見る
スコープス (112)
PubMed
クロスリファレンス
グーグル奨学生
ピッキアンティ-ディアマンティA.
パネビアンコC.
サレミS.
ソルジ M.L.
ディ・ローザR.
トロペーア A.
スグルレッティ M.
サレルノ G.
テラチアーノF.
ダーメリオR.
他。
関節リウマチ患者における腸内細菌叢の解析:疾患関連のディスバイオーシスとエタネルセプトによる修飾。
Int. J. Mol. Sci. 2018; 19: 2938
記事で見る
スコープス(91)
PubMed
クロスリファレンス
グーグル奨学生
ヒーガン P.S.
チャンドックS.K.
バローンC.
イーガン M.
ベーラーM.
ムースカー M.S.
炎症性腸疾患感受性遺伝子であるミオシンIXbを欠損したマウスは、腸管バリアー機能が損なわれ、回腸に表層性潰瘍を形成している。
サイトスケルトン(ホーボーケン)。2016; 73: 163-179
記事で見る
スコープス (14)
PubMed
クロスリファレンス
グーグル奨学生
パップ・M.
フォルディI.
ネメスE.
ウドヴァルディ M.
ハルスファルヴィ J.
アルトルジェイ I.
メイト I.
ディンヤ T.
ヴァルヴォルギ C.
バルタZ.
他。
ハプトグロビン多型:セリアック病発症とその臨床症状に関する新規遺伝的リスクファクター。
Clin. Chem. 2008; 54: 697-704
記事で見る
スコープス (24)
PubMed
クロスリファレンス
グーグル奨学生
アデグボラ S.O.
サハナンK.
ワルサビタルネJ.
ハート A.
トーザー P.
クローン病における抗 TNF 療法。
Int. J. Mol. Sci. 2018; 19: 2244
記事で見る
スコープス(106)
クロスリファレンス
グーグルスカラー
マー X.
Xu S.
関節リウマチのTNF阻害剤治療。
Biomed. Rep. 2013; 1: 177-184
記事で見る
PubMed
クロスリファレンス
グーグル奨学生
セガール A.W.
アイゼンバーグD.A.
ハジロウソウV.
トルフリーS.
クラーク J.
Snaith M.L.
関節リウマチの病因に腸が関与していることの予備的証拠?
Br. J. Rheumatol. 1986; 25: 162-166
記事で見る
スコープス (49)
PubMed
クロスリファレンス
グーグル奨学生
ポルツィオV.
ビアジG.
コラードA.
デ・サンティ M.
ヴィンディーニ C.
ビティ S.
バイエリP.F.
マルコロンゴR.
脊椎関節症と関節リウマチにおける腸の組織学的および超微細構造的な炎症性変化。
Scand. J. Rheumatol. 1997; 26: 92-98
記事で見る
スコープス (39)
PubMed
クロスリファレンス
グーグル奨学生
フラック M.B.
コラスR.A.
ムニョス-アティエンザE.
カーティスM.A.
ダリ・J.
ピッツァリス C.
炎症性関節炎は腸内環境の改善機構を破壊し、Porphyromonas gingivalis によるバリア破壊を促進する。
JCI Insight. 2019; 4: e125191
記事で見る
スコープス (34)
PubMed
クロスレフ
グーグル奨学生
コスタ F.R.
フランソゾーM.C.
デ・オリベイラG.G.
イグナシオA.
カストルディA.
ザンボーニ D.S.
ラモス S.G.
カマラN.O.
デ・ゾエテM.R.
パームN.W.
他
腸内細菌叢の膵臓リンパ節への移行は、NOD2の活性化を誘発し、T1D発症に寄与する。
J. Exp. Med. 2016; 213: 1223-1239
記事で見る
スコープス (107)
パブコメ
クロスリファレンス
グーグル奨学生
イレラ N.
ダスコラA.
パリオG.
ビトA.
マッツォン E.
マンニーノ F.
スクアドリト V.
アルコラッチ V.
ミヌトーリ L.
カンポ G.M.
他
β-カリオフィレンは、CB2受容体とPPAR-γ受容体の間のクロストークを介して、マウスのコラーゲン抗体誘導関節炎(CAIA)を緩和する。
バイオモレキュールズ. 2019; 9: 326
記事で見る
スコープス(33)
クロスリファレンス
Google Scholar
アレクセーフ E.E.
ラニスJ.M.
カオ D.J.
キャンベル E.L.
ケリーC.J.
バティスタ・K.D.
ジェリッチ・M.E.
ジェンキンス B.R.
ウォーク S.T.
コミンスキー D.J.
コルガン S.P.
微生物叢由来のインドール代謝産物はインターロイキン-10受容体の制御を介してヒトおよびマウスの腸のホメオスタシスを促進する。
Am. J. Pathol. 2018; 188: 1183-1194
記事で見る
スコープス(178)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
Fasano A.
ゾヌリンとその腸管バリア機能制御:炎症、自己免疫、および癌への生物学的ドア。
Physiol. Rev. 2011; 91: 151-175
記事で見る
スコープス (531)
PubMed
クロスリファレンス
Google Scholar
ナインメッツ・バイオファーマ
ララゾチド酢酸塩のCeD症状の緩和に対する有効性及び安全性を評価する試験。
2021
https://ClinicalTrials.gov/show/NCT03569007
記事で見る
Google Scholar
シュロスP.D.
ウェストコット S.L.
リャービン T.
ホール J.R.
ハルトマン M.
ホリスターE.B.
レスニウスキーR.A.
オークリーB.B.
パークス D.H.
ロビンソンC.J.
他
微生物群集を記述し比較するための、オープンソース、プラットフォーム非依存、コミュニティ支援型ソフトウェア。
Appl. Environ. Microbiol. 2009; 75: 7537-7541
記事で見る
スコープス (14116)
パブコメ
クロスリファレンス
グーグル奨学生
クラウスグルーバーT.
シエリングC.
アーデルマンK.
ハリソンO.J.
チョムカ A.
ピアソン C.
アハーン P.P.
シェール M.
オウッカ M.
パウリー F.
T-betは、腸におけるIL-23駆動型病原性CD4(+)T細胞応答の重要なモジュレーターである。
Nat. Commun. 2016; 7: 11627
記事で見る
スコープス (58)
PubMed
クロスリファレンス
グーグル奨学生
ジョウェット G.M.
ノーマンM.D.A.
ユウ T.T.L.
ロセル・アレバロ・P.
フーグランドD.
ラスト・S.T.
リードE.
ハムルード E.
ウォルターズ N.J.
ニアジ U.
他。
ILC1 は腸管上皮とマトリックスのリモデリングを促進する。
Nat. Mater. 2021; 20: 250-259
記事で見る
スコープス (33)
PubMed
クロスリファレンス
グーグル奨学生
ジーテックT.
ラートE.
第3章 腸管オルガノイド:実験室で育てたミニ腸管。
において。Davies J.A. Lawrence M.L. Organoids and Mini-organs. アカデミック, 2018: 43-71
記事で見る
Google Scholar
ロッサー E.C.
パイパーC.J.M.
マテイD.E.
ブレアP.A.
レンデイロ A.F.
オーフォード・M.
アルバー D.G.
クラウスグルーバーT.
カタラン D.
クラインN.
他。
微生物叢由来の代謝産物は、制御性B細胞におけるアリールハイドロカーボン受容体の活性化を増幅することにより、関節炎を抑制する。
Cell Metab. 2020; 31: 837-851.e10
記事で見る
スコープス (147)
PubMed
概要
全文
全文PDF
Google Scholar
記事情報
出版年譜
掲載されました。2021年5月13日
受理されました。2021年4月15日
改訂版受理 2021年2月22日
受理:2020年2月4日 2020年2月4日
身分証明書
DOI: https://doi.org/10.1016/j.medj.2021.04.013
