
空間プロテオミクスで解明する乳癌免疫反応の未来
記事執筆者:医師(医学研究者)
レビュアー:稲森 瑠星(医療AIコミュニティ運営者)
3つの要点
トリプルネガティブ乳癌に対する免疫チェックポイント阻害薬の効果を検討するランダム化比較試験で収集された癌組織について、43種類のタンパク質の空間発現情報を同時にマッピングした。
免疫チェックポイント阻害薬感受性乳癌と耐性乳癌では細胞の種類や空間配置に違いが見られた。
治療前の乳癌の細胞組成と空間的組織の両方が免疫療法の効果を予測。
Spatial predictors of immunotherapy response in triple-negative breast cancer
written by Wang XQ, Danenberg E, Huang CS, Egle D, Callari M, Bermejo B, Dugo M, Zamagni C, Thill M, Anton A, Zambelli S, Russo S, Ciruelos EM, Greil R, Győrffy B, Semiglazov V, Colleoni M, Kelly CM, Mariani G, Del Mastro L, Biasi O, Seitz RS, Valagussa P, Viale G, Gianni L, Bianchini G, Ali HR.
Journal:Nature
Published Online:Sep 6 2023
この記事に含まれる画像は、論文や紹介スライド、またはそれらを参考に作成されたものです。
本研究を理解する上での背景知識
病理医は診断の際、基本的にヘマトキシリン・エオジン(HE)染色の標本を重視する。
病理医はHE標本に加えて免疫染色標本も補助的に使用する。免疫染色では、抗原抗体反応を用いて、特定の一つのタンパク質の局在を空間的にマッピングすることができる。
次世代シークエンサーの登場により、組織のゲノム異常を包括的に調べられるようになった。現在、日本の臨床現場ではがん遺伝子パネル検査が取り入れられている。この検査では、がん組織から核酸を抽出し、がん関連遺伝子の異常の有無を調べることができる。しかしながら、この方法には細胞の不均一性や空間情報の解析が難しいという限界点もある。
近年、シングルセル解析や空間解析という手法が開発され、細胞の位置情報を保ったまま、一細胞レベルで細胞の種類やRNA・蛋白発現が解析できるようになった。一部の国では、この手法は臨床現場でも応用されつつある。
がん遺伝子パネル検査やシングルセル解析や空間解析は治療選択に影響を与えうる重要な手法だが、非常に高価なため、全例で行うことは現実的ではない。そのため、HE染色標本とこれらのマルチオミクスデータを統合することで、HE染色標本からオミクスデータを予測するという方向性が期待される。
背景
免疫チェックポイント阻害薬は固形癌の治療に大きなインパクトをもたらしたが、一部の患者にしか効果を示さない。高額な費用や副作用の問題もあり、免疫チェックポイント阻害薬に感受性を示す集団を同定できるバイオマーカーの同定が急務である。
免疫チェックポイント阻害薬の効果を支えているのは、がん微小環境における細胞間の相互作用である。そのため、細胞の空間情報解析が非常に重要になる。
近年、イメージングマスサイトメトリーを用いた空間プロテオミクス解析が確立してきている。同手法では40種類程度のタンパク質の局在を一細胞レベルでマッピングすることができる。
方法
NeoTRIPランダム化比較試験に登録されたトリプルネガティブ乳癌患者から採取されたFFPE組織の腫瘍サンプルにおける43のタンパク質の発現をマッピングした。
NeoTRIPは早期トリプルネガティブ乳癌を対象とした臨床試験で、ネオアジュバント化学療法(カルボプラチンとナブパクリタキセル)と化学療法+抗PD-L1免疫療法(カルボプラチン、ナブパクリタキセル、アテゾリズマブ)を1:1のランダム化で比較した。
がん組織については、治療前(n=243)、2回目の治療サイクルの初日(n=207)、薬物治療後の外科的切除時(n=210)の3つの時点で採取された。これらの組織について、イメージングマスサイトメトリーを用いた空間プロテオミクス解析を行った。

結果
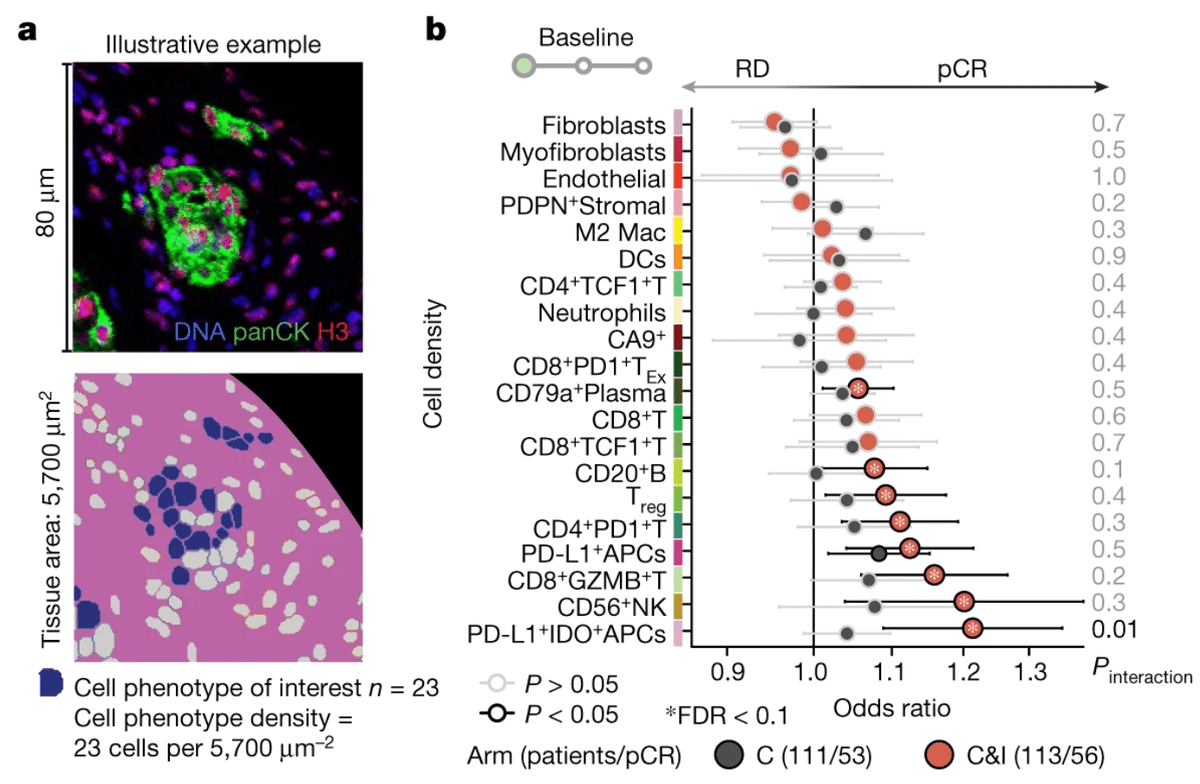
組織構造と奏効との関連を評価するため、無作為化群別にpCRを予測するロジスティック回帰モデルを当てはめ、各特徴と奏効との関連が治療によって有意に異なるかどうかを検定するために統計的相互作用の項をモデルに含めた(下図a, b)。
異なる上皮細胞およびTME細胞の表現型の密度が、反応を予測する能力において異なるかどうかを調べたところ、PDL1+IDO+APCの密度のみが免疫チェックポイント阻害薬の反応を予測した(下図b)。
異なる細胞間相互作用が免疫チェックポイント阻害薬に対する反応と関連しているかどうかを調べた。
細胞同士が直接接触している場合は相互作用しているとみなした(下図e)。
8つの上皮-TME相互作用と反応との関連は治療間で有意に異なり、「上皮とCD20+B細胞」および「上皮とCD8+GZMB+T細胞」の細胞相互作用が最も大きな差効果を示した(下図f)。

表現型ごとのKi67+細胞の割合を計算し(下図a)、pCRとの関連を検証した(下図b, c)。
免疫療法群では12の上皮細胞表現型(下図b)と16のTME細胞表現型(下図c)が奏効を予測した。
MHCI&IIhi細胞におけるKi67+細胞の割合は、上皮細胞の中で最も強い免疫療法奏効予測因子であった。
CD8+TCF1+T細胞におけるKi67+細胞の割合は、全体として強い免疫療法奏効予測因子であった。

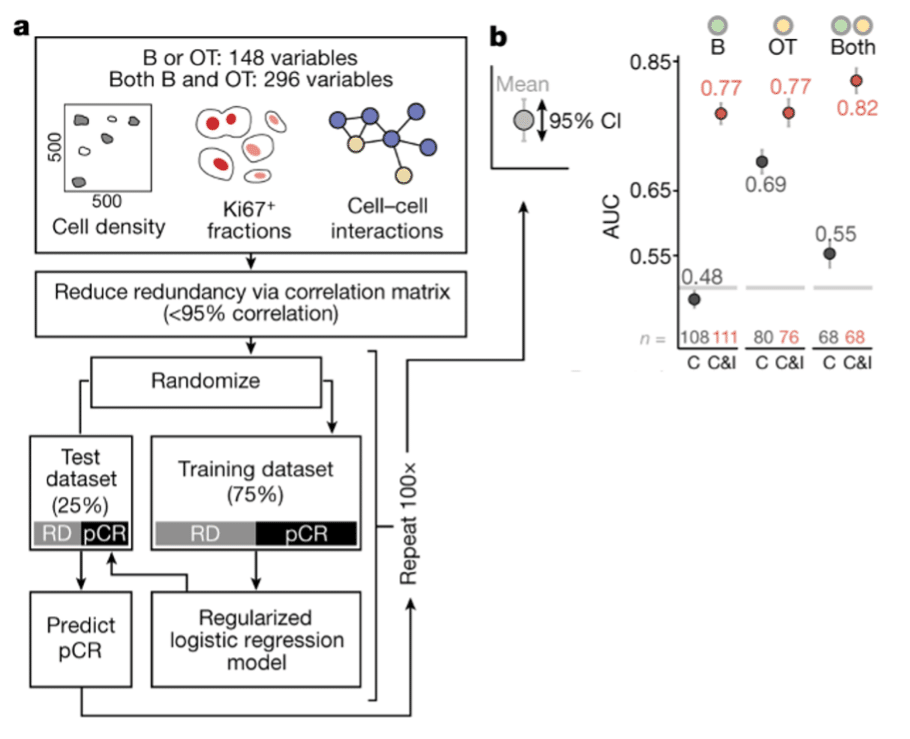
免疫療法の反応性を予測する様々な組織特徴に関して、これらの複合的な予測能が治療や時点によって異なるかどうかを検討した(下図a)。
各治療群について、3パターン(治療前、治療中、両方)のデータを用いた多変量ロジスティック回帰モデルを当てはめたところ、予測性能は免疫療法を受けた患者で常に優れており、免疫療法がTMEの活性化状態と腫瘍構造に大きく依存していることが示唆された(下図b)。
治療前と治療中の特徴を組み合わせることで、予測性能は有意に改善したことから、治療前だけでなく治療中の早期生検が予測精度を向上させる可能性があることが示唆された。
結論
トリプルネガティブ乳癌における空間プロテオミクス解析によって、免疫チェックポイント阻害薬の反応予測因子が同定された。細胞の表現型、活性化状態、空間的構成がICBの効果を総合的に決定する。
治療前および治療中の空間情報を統合することで、より正確な免疫チェックポイント阻害薬の効果予測が期待される。
記事執筆者 医師(医学研究者)の感想
空間プロテオミクス情報は、がん治療選択にとって重要な情報を提供しうる。ヨーロッパなど一部の地域ではすでに臨床現場に取り入れられており、今後のデータ蓄積が期待される。しかしながら、がんパネル検査と同様、解析自体に膨大な費用がかかるという問題点もある。そのため、今後はHE画像からオミクスデータを予測するという方向性が期待される。つまり、臨床データだけでなく、ゲノム情報や空間プロテオミクス情報が付与されたHE画像に大きな価値が存在すると考える。
空間プロテオミクス解析により、一細胞レベルで蛋白発現情報が確認できるようになった。このことにより、HE画像による細胞の同定がより容易になると考えられる(これまではHE画像のみを頼りにしていたので、病理医によって意見が異なることも多かった。しかし空間プロテオミクス情報の登場で、1細胞レベルでより正確なアノテーション情報を付与できるようになるかもしれない)。このことは、HE画像とAIを用いた病理診断の予測能向上につながるかもしれない。
レビュアー 稲森 瑠星(医療AIコミュニティ運営者)の感想
この研究は、トリプルネガティブ乳癌に対する免疫チェックポイント阻害薬の反応予測において、細胞の表現型、活性化状態、および空間配置が重要な役割を果たすことを明らかにした。特に、免疫療法の効果を予測するために治療前および治療中の空間情報の統合が有効であることが示されている。
この研究は、より正確な治療効果の予測を可能にする新たな方法論を提示しており、将来的に臨床診断や治療選択に大きく貢献する可能性がある。空間プロテオミクス解析の臨床応用により、個別化医療の実現に向けた一歩を踏み出したと言えるのではないだろうか。
Callistoについて
東大発スタートアップCallistoは、医療AI/創薬AIの研究開発にすぐ使える医用画像データプラットフォームを手掛けています。医療施設が提供した放射線画像や病理画像(と臨床情報・分子診断結果)に取捨選択~アノテーション~標準化を施し、匿名加工情報の形で医療AI企業・医療機器メーカー・製薬企業などに販売します。また、これらのデータセットも活かしつつ、創薬AI/医療AIの受託開発やコンサル、マーケティングも行っています。データ提供施設には、データセット利用による売上の一部を還元することで、持続可能なエコシステムを実現します。
https://callisto-ai.com/
この記事が気に入ったらサポートをしてみませんか?
