
松廼屋|論点解説 薬剤師国家試験対策ノート問 107-106【化学】論点:プロテアソーム阻害 / 形式電荷変化 / 混成軌道変化 / ルイス酸 / sp3混成
第107回薬剤師国家試験|薬学理論問題 /
問106
一般問題(薬学理論問題)【物理・化学・生物】
化学|問 107-106
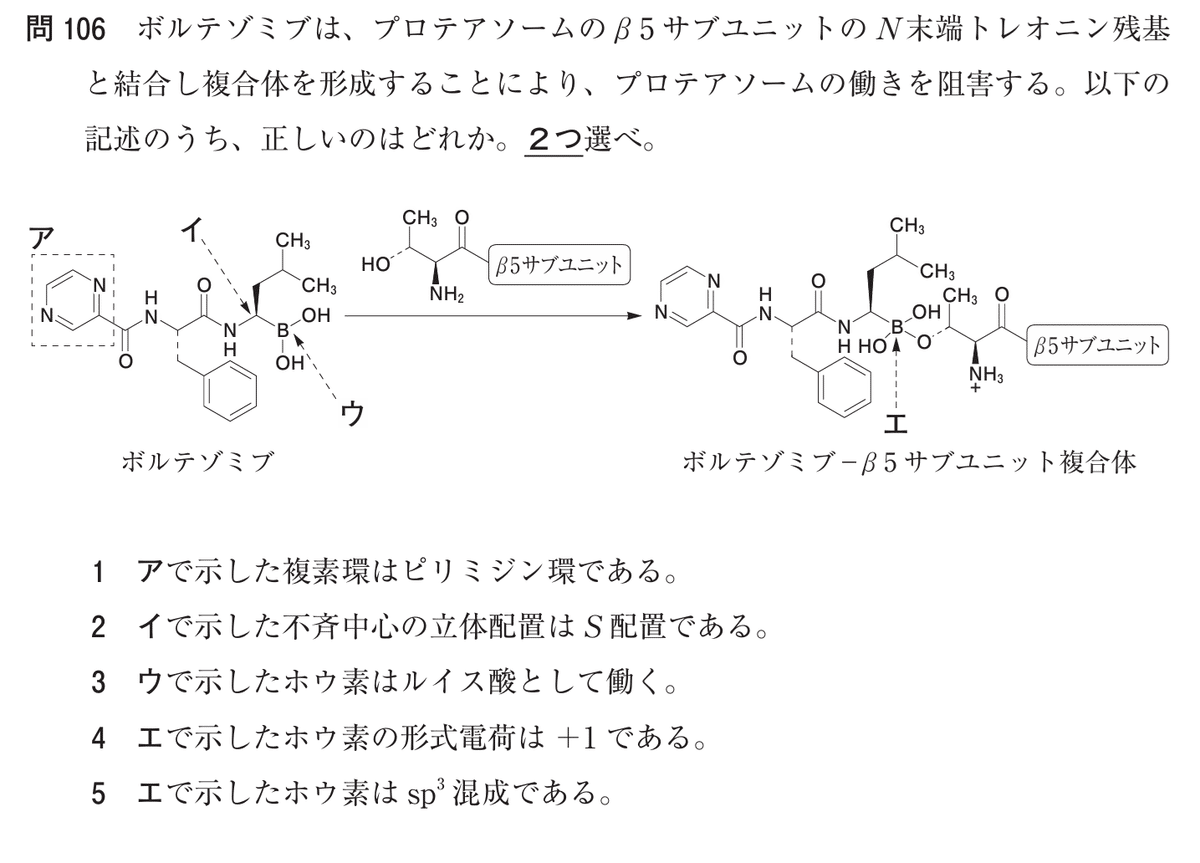
Q. ボルテゾミブは、プロテアソームのb5サブユニットのN末端トレオニン残基と結合し複合体を形成することにより、プロテアソームの働きを阻害する。以下の記述のうち、正しいのはどれか。2つ選べ。

■選択肢
1. [ア]で示した複素環はピリミジン環である。
2. [イ]で示した不斉中心の立体配置はS配置である。
3. [ウ]で示したホウ素はルイス酸として働く。
4. [エ]で示したホウ素の形式電荷は+1である。
5. [エ]で示したホウ素はsp3混成である。
松廼屋|論点解説 薬剤師国家試験対策ノート問 107-106【化学】論点:プロテアソーム阻害 / 形式電荷変化 / 混成軌道変化 / ルイス酸 / sp3混成|matsunoya
こんにちは!薬学生の皆さん。
Mats & BLNtです。
matsunoya_note から、薬剤師国家試験の論点解説をお届けします。
苦手意識がある人も、この機会に、薬学理論問題【化学】を一緒に完全攻略しよう!
今回は、第107回薬剤師国家試験|薬学理論問題 / 問106【化学】 、論点:プロテアソーム阻害 / 形式電荷変化 / 混成軌道変化 / ルイス酸 / sp3混成を徹底解説します。
薬剤師国家試験対策ノート NOTE ver.
matsunoya_note|note https://note.com/matsunoya_note
Here; https://note.com/matsunoya_note/n/n544368550884
松廼屋|論点解説 薬剤師国家試験対策ノート問 107-106【化学】論点:プロテアソーム阻害 / 形式電荷変化 / 混成軌道変化 / ルイス酸 / sp3混成|matsunoya
薬剤師国家試験対策には、松廼屋の eラーニング
「薬剤師国家試験対策ノート」
マガジン|薬剤師国家試験対策ノート on note
👉マガジンをお気に入りに登録しよう!
このコンテンツの制作者|
滝沢 幸穂 Yukiho Takizawa, PhD
https://www.facebook.com/Yukiho.Takizawa
お友達や知り合いに、matsunota_note で学習したeラーニングを勧めてみたい方は、いいね!、口コミ、おススメなど、よろしくお願いします!
設問へのアプローチ|
第107回薬剤師国家試験の問106【化学】(問107-106)では、β酸化による脂肪酸の代謝反応からプロテアソーム阻害 / 形式電荷変化 / 混成軌道変化 / ルイス酸 / sp3混成などが問われました。
有機化学におけるボラン酸(R-B(OH)2)の反応メカニズムの理解を問われています。
コアカリキュラムの出題範囲の優先順位で言ったら、
炭素(C)だろぅ…!🤣
とだれもが思いますが、今回は、ホウ素(B)でした。
炭素ではなくホウ素に関する混成軌道やルイス酸としての反応を知っている必要があります。
File:Sp2-Orbital.svg - Wikimedia Commons File:Sp3-Orbital.svg - Wikimedia Commons

5. ホウ素(B) ファイル:Electron shell 005 Boron.svg - Wikipedia
6. 炭素(C) ファイル:Electron shell 006 Carbon.svg - Wikipedia
7. 窒素(N) ファイル:Electron shell 007 Nitrogen.svg - Wikipedia
8. 酸素(O) ファイル:Electron shell 008 Oxygen.svg - Wikipedia
まあ、ボラン酸(R-B(OH)2)の化学反応メカニズムは、知っていてよい知識なのかもしれないので、この機会に徹底攻略しましょう。(^^)/
なお、今後、こういったマイナーな論点での問題設計👽は厳にコントロールしていくべきです。
レビュワーが、草案の時点で責任者に差し戻して指導と修正を指示すべき事案です。
「プロテアソームのb5サブユニットのN末端トレオニン残基と結合し複合体を形成する」として化学構造式を示していますが、草案の時点でエビデンスとしての科学文献を添付すべきです。
ちなみに、右側の化学構造式では、ホウ素にマイナス記号(-)がついているのが、この化学構造の場合は一般的です。

単なる書き忘れ👽(テヘッ)かもしれませんが。。
ホウ素に酸素が3つ結合している化学構造の例


ボルテゾミブ (Bortezomib) の化合物プロファイル
PubChem Bortezomib | C19H25BN4O4 | CID 387447 - PubChem

ボルテゾミブ - Wikipedia File:Bortezomib Structural Formula V.1.svg - Wikimedia Commons
IUPAC名:
[(1R)-3-methyl-1-[[(2S)-3-phenyl-2-(pyrazine-2-carbonylamino)propanoyl]amino]butyl]boronic acid化学式: C₁₉H₂₅BN₄O₄
PubChem CID: 387447
PMDA インタビューフォーム 製造販売元/ヤンセンファーマ株式会社
ボルテゾミブ F1_ベルケイド注射用3mg
添付文書
PDF(2023年09月01日) / HTML
ボルテゾミブは、ジペプチドボロン酸誘導体であり有機化学におけるボラン酸(R-B(OH)2)です。
可逆的に26Sプロテアソームを阻害することが特徴です。
構造と分類
N-末端を保護されたジペプチドであり、ピラジン酸-フェニルアラニン-カルボン酸をホウ酸に置換したロイシンの順で結合しています。
R-C(=O)OH → R-B(OH)2

File:Fenyloalanina.svg - Wikimedia Commons
File:L-leucine-skeletal.png - Wikimedia Commons
ボルテゾミブは、L-フェニルアラニン誘導体であり、アミノ酸アミド、ピラジン、ボロン酸を含む構造を持つ化合物です。
主な化学的特徴:
ボロン酸基(dihydroxyboranyl基)を有し、タンパク質分解酵素のプロテアソームに対する特異的な結合性を示します。
L-フェニルアラニン残基とピラジン-2-カルボニル基を有するジペプチド構造。

ボルテゾミブ - Wikipedia File:Bortezomib Structural Formula V.1.svg - Wikimedia Commons
薬理作用と作用機序
作用機序:
ボルテゾミブは26Sプロテアソームの活性部位に可逆的に結合し、その酵素活性を阻害します。この阻害により、ユビキチン-プロテアソーム経路で分解されるべきタンパク質が蓄積し、細胞周期の停止やアポトーシス(プログラム細胞死)を引き起こします。特に腫瘍細胞ではプロテアソーム機能が活発であるため、選択的な抗がん作用を示します。役割:
抗悪性腫瘍剤:
多発性骨髄腫やマントル細胞リンパ腫で有効性が確認されています。プロテアソーム阻害剤: タンパク質分解の阻害に基づく作用。
臨床応用
承認された用途:
多発性骨髄腫
マントル細胞リンパ腫
2003年にFDAにより最初のプロテアソーム阻害剤として承認されています。
重要な物理化学的特性
可逆的な阻害作用:
ボルテゾミブのボロン酸基は、プロテアソームのスレオニン残基に結合し、可逆的な阻害を実現します。スレオニンは側鎖にヒドロキシエチル基を持つ。

File:L-leucine-skeletal.png - Wikimedia Commons
まず基本的な知識について復習しておきましょう。
■■Grok 2 + FLUX (beta)
ボロン酸(Boronic Acid)の反応について
ボロン酸(Boronic Acid)の反応は、有機化学において重要です。
主に以下のような反応が知られています:
Suzuki-Miyauraカップリングのメカニズム:

Suzuki-Miyauraカップリング:
ステップ1:
ボロン酸とハロゲン化アリール(またはビニル)がパラジウム触媒の存在下で反応します。一般に、塩基と溶媒が使用され、水を加えることがあります。ステップ2:
ボロン酸が酸化されて四配位ボロン酸となり、これがパラジウムのオキシダティブアディションを経て、最終的にC-C結合を形成します。ステップ3:
触媒サイクルが進行し、パラジウムが還元されて再び触媒として利用可能になります。
Petrini反応:
ステップ1:
ボロン酸がアルデヒドやケトンと反応し、四配位ボロン酸錯体を形成します。ステップ2:
この錯体が次にアミンと反応し、アミノアルコールを生成します。
ボロン酸のエステル化:
ステップ1:
ボロン酸がアルコールと反応して、ボロン酸エステルを形成します。この反応は可逆的であり、水の存在下では逆反応も起こり得ます。R-B(OH)2 + R'-OH ⇔ R-B(OH)2-O-R'

文献リスト:
Miyaura, N.; Suzuki, A. "Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds" in Chem. Rev. 1995, 95, 2457–2483.
Hall, D. G. "Boronic Acids: Preparation and Applications in Organic Synthesis, Medicine and Materials" Wiley-VCH, 2005.
Brown, H. C.; Singaram, B. "Organoboranes in Organic Synthesis" in Acc. Chem. Res. 1988, 21, 287-293.
■■GPT4o
混成軌道とは
1. 混成軌道について
混成軌道は、原子の電子配置に基づく軌道が化学結合に適応するために再配置される過程で生じます。
具体的には、異なるエネルギーの原子軌道(s軌道とp軌道など)が混合して、新しい等価なエネルギーを持つ軌道を形成します。これにより、分子内で特定の結合角や形状が生まれます。
2. 主な混成軌道のタイプ
混成軌道の種類は、中心原子の周囲の結合電子対や孤立電子対の数に基づきます。
sp混成軌道
結合: 2本のσ結合(線形構造)
軌道構成: 1つのs軌道と1つのp軌道が混成
例: 二酸化炭素 (CO₂)、アセチレン (C₂H₂)
sp²混成軌道
結合: 3本のσ結合(平面三角形構造)
軌道構成: 1つのs軌道と2つのp軌道が混成
例: エチレン (C₂H₄)、ホウ素トリフルオリド (BF₃)
sp³混成軌道
結合: 4本のσ結合(正四面体構造)
軌道構成: 1つのs軌道と3つのp軌道が混成
例: メタン (CH₄)、アンモニア (NH₃, ただし孤立電子対1つ)

File:Sp2-Orbital.svg - Wikimedia Commons File:Sp3-Orbital.svg - Wikimedia Commons
3. ボルテゾミブのホウ素における混成軌道の変化
ボルテゾミブのホウ素原子は、プロテアソームと結合する前後で混成状態が変化します。
結合前の状態 (sp²混成)
ホウ素はボロン酸基にあり、炭素鎖と2つの水酸基にσ結合。
1つの空のp軌道を持つため、sp²混成。
結合後の状態 (sp³混成)
トレオニン残基の水酸基がホウ素に電子を供与し、共有結合が形成される。
この結果、ホウ素のσ結合数が4に増加し、混成軌道はsp³となる。
反応過程を以下の式で表せます:
R-B(OH)₂ + R'OH → R-B(OH)₂(OR') + H₂O

4. sp³混成の特徴と結合角
sp³混成軌道は正四面体形状をとり、結合角は理論的に109.5°となります。
この特性により、ボルテゾミブのホウ素はプロテアソームとの結合部位で安定した立体構造を保持します。

File:Sp2-Orbital.svg - Wikimedia Commons File:Sp3-Orbital.svg - Wikimedia Commons
引用文献
Pauling, L. (1931). The Nature of the Chemical Bond. Journal of the American Chemical Society, 53(4), 1367–1400.
混成軌道の概念の基礎を築いた古典的研究。
Huheey, J. E., Keiter, E. A., & Keiter, R. L. (2006). Inorganic Chemistry: Principles of Structure and Reactivity. Pearson.
混成軌道とその応用についての標準的な教科書。
PubChem. Bortezomib Compound Summary. Retrieved from https://pubchem.ncbi.nlm.nih.gov
ボルテゾミブの構造と化学的性質に関する基本情報。
ルイス酸およびルイス塩基
1. ルイス酸とルイス塩基の定義
ルイス酸:
電子対を受容する化学種(電子対受容体)。空の軌道を持つか、電子密度が不足している分子またはイオンが該当します。
例: BF₃, AlCl₃, H⁺ルイス塩基:
電子対を供与する化学種(電子対供与体)。孤立電子対を持つ分子またはイオンが該当します。
例: NH₃, H₂O, OH⁻
2. ルイス酸とルイス塩基の反応
ルイス酸とルイス塩基は反応することで「付加体」を形成します。
この反応は、電子対の供与と受容を通じて共有結合(または配位結合)を形成する過程です。
一般的な反応式:
A (ルイス酸) + :B (ルイス塩基) → A-B (付加体)
例1: BF₃とNH₃の反応
BF₃ + :NH₃ → F₃B-NH₃
BF₃は電子不足のホウ素を持つためルイス酸。
:NH₃は孤立電子対を持つためルイス塩基。
3. ルイス酸の特徴と性質
電子不足:
中心原子がオクテット則を満たしていない場合(例: BF₃, AlCl₃)。空の軌道:
中心原子に空の軌道が存在し、電子対を受け取れる(例: H⁺)。金属錯体:
遷移金属イオンは通常、ルイス酸として振る舞い、配位子から電子対を受容します。
4. ルイス塩基の特徴と性質
孤立電子対の存在:
非共有電子対を持つ分子やイオンが該当します(例: H₂O, OH⁻, CN⁻)。高い電子密度:
電子密度が高い原子や官能基(例: アミン、チオール)はルイス塩基性が強い。求核性:
ルイス塩基は求核試薬として化学反応で作用することが多い。
5. 応用例
酸-塩基触媒反応:
ルイス酸触媒(例: AlCl₃)は有機反応で電子密度を低下させ、反応性を向上させます。
例: Friedel-Craftsアルキル化でのAlCl₃の使用。
配位化学:
ルイス酸(中心金属)とルイス塩基(配位子)間の相互作用が錯体形成の基礎。
医薬品化学:
ボルテゾミブのように、ホウ素基(ルイス酸)が標的分子の電子対を受容して共有結合を形成。

6. ルイス酸とルイス塩基の強さ
ルイス酸の強さは、中心原子の電気陰性度、酸化状態、および配位環境に依存します。
例: BF₃ < BCl₃ < BI₃(ハロゲンの電気陰性度の低下によりルイス酸性が強まる)。ルイス塩基の強さは、孤立電子対の利用可能性、原子の電気陰性度、および共鳴安定化に依存します。
例: NH₃ > H₂O > HF(電気陰性度の増加により塩基性が弱まる)。
引用文献
Lewis, G. N. (1923). Valence and the Structure of Atoms and Molecules. Chemical Catalog Company.
ルイス酸とルイス塩基の概念の起源。
Huheey, J. E., Keiter, E. A., & Keiter, R. L. (2006). Inorganic Chemistry: Principles of Structure and Reactivity. Pearson.
ルイス酸・塩基の理論と応用。
Housecroft, C. E., & Sharpe, A. G. (2012). Inorganic Chemistry. Pearson.
配位化学におけるルイス酸とルイス塩基の応用。
PubChem. Boronic Acids and their Reactivity. Retrieved from https://pubchem.ncbi.nlm.nih.gov
ボロン酸基のルイス酸性について。
形式電荷(Formal Charge)とは

ホウ素(B) ファイル:Electron shell 005 Boron.svg - Wikipedia
炭素(C) ファイル:Electron shell 006 Carbon.svg - Wikipedia
窒素(N) ファイル:Electron shell 007 Nitrogen.svg - Wikipedia
酸素(O) ファイル:Electron shell 008 Oxygen.svg - Wikipedia
1. 形式電荷
形式電荷は、分子やイオンの各原子が持つ仮想的な電荷を表す概念です。
分子内での電子の実際の分布ではなく、共有結合における電子を等分割した場合の電荷を計算します。
形式電荷は、化学構造の妥当性を評価し、反応性や構造安定性を予測するのに役立ちます。
2. 形式電荷の計算式
形式電荷 (FF) は以下の式で計算されます:
F = V − (N + (1/2)・B)
ここで:
V: 原子の価電子の数(周期表での主族番号)。
N: 原子に孤立して存在する電子の数(非共有電子対の総数)。
B: 原子が共有する結合電子対の数。
3. 具体例
水分子 (H₂O)

酸素原子について計算:
V = 6(酸素の主族番号)。
N = 4(酸素の非共有電子対:2対)。
B = 4(2本の共有結合に4つの電子が関与)。
→ 酸素の形式電荷は 0 です。
F = 6 − (4 + (1/2)・4) = 0
硝酸イオン (NO3−)

各酸素原子について計算(1つの共有結合を持つ酸素):
V = 6。
N = 6(非共有電子対:3対)。
B = 2(1本の共有結合)。
→ この酸素の形式電荷は -1 です。
F = 6 − (6 + (1/2)・2) = −1
4. 形式電荷の意義
分子構造の妥当性の検証:
分子内の形式電荷ができるだけ0に近いほど安定な構造であることを示します。形式電荷が大きい場合は、共鳴構造や他の分子モデルを考慮すべきです。共鳴構造の優劣の判断:
共鳴構造では、形式電荷が最も小さく、負電荷が電気陰性度の高い原子に配置されているものが支配的構造とされます。反応性の予測:
正または負の形式電荷を持つ原子は、反応部位(求電子性、求核性)となる可能性が高い。
5. ボルテゾミブの形式電荷の応用例
ボルテゾミブでは、ホウ素原子に形式電荷が関連します。プロテアソームのN末端トレオニン残基と結合すると、ホウ素は電子密度を受け取り形式電荷が変化します。

結合前のホウ素:
V = 3、N = 0、B = 6(3本の共有結合)
F = 3 − (0 + (1/2)・6) = 0
結合後のホウ素:
V = 3、N = 0、B = 8(4本の共有結合)
F = 3 − (0 + (1/2)・8) = -1

引用文献
Gillespie, R. J., & Popelier, P. L. A. (2001). Chemical Bonding and Molecular Geometry. Oxford University Press.
形式電荷と分子構造に関する詳しい解説。
Atkins, P., & de Paula, J. (2014). Physical Chemistry. Oxford University Press.
形式電荷の計算と応用についての基礎。
McMurry, J. (2016). Organic Chemistry. Cengage Learning.
有機分子内の形式電荷と反応性に関する解説。
PubChem. Bortezomib Compound Summary. Retrieved from https://pubchem.ncbi.nlm.nih.gov
ボルテゾミブの構造と特性に関連する情報。
論点およびポイント
■■GPT4o
化学|問 107-106
論点|プロテアソーム阻害 / 形式電荷変化 / 混成軌道変化 / ルイス酸 / sp3混成
ポイント|
ボルテゾミブの作用機構:
プロテアソームのb₅サブユニットN末端トレオニン残基の水酸基とホウ素が結合し、プロテアソームの機能を阻害する。形式電荷の変化:
反応前: ホウ素はsp²混成で形式電荷は0。
反応後: トレオニン残基の水酸基との共有結合形成によりsp³混成に変化し、形式電荷は-1。
ホウ素の役割:
反応を通じてルイス酸として機能し、トレオニンから電子対を受容。混成軌道の変化:
反応前は三角平面形のsp²混成。結合後は四面体形のsp³混成に移行する。プロテアソーム阻害の重要性:
26Sプロテアソーム活性の阻害は、ユビキチン経路を介したタンパク質分解を防ぎ、細胞周期停止とアポトーシスを誘導することで抗がん作用を発揮。安定化要因:
トレオニン残基との結合で新たな共有結合が形成され、電子密度の再分配が得られる。
薬剤師国家試験 出題基準
出典: 薬剤師国家試験のページ |厚生労働省 (mhlw.go.jp)
出題基準 000573951.pdf (mhlw.go.jp)
論点を整理します。
■■GPT4o
総合的な論点
ボルテゾミブは、プロテアソーム阻害剤として作用し、N末端トレオニン残基の活性部位と結合することでその機能を抑制します。:
ボルテゾミブの化学構造:
ボロン酸基の特性、複素環の化学的性質、不斉炭素の立体化学など。プロテアソームの機能:
b₅サブユニットの役割とトレオニン残基の重要性。ボルテゾミブ-プロテアソーム複合体の形成機構:
ホウ素原子の役割と電子的性質、結合後の構造変化。複素環化合物の命名や電子特性、結合混成状態に基づく判断。
化学反応の概要
ボルテゾミブは、プロテアソームのb₅サブユニットにおけるトレオニン残基と共有結合を形成します。この反応では、ホウ素原子がトレオニンの水酸基と結合し、安定なボロン酸エステルを形成します。
この結合がプロテアソーム活性を阻害し、細胞周期の停止やアポトーシスを誘導します。
関連する化学的特性
ホウ素原子の性質:
ボロン酸基はルイス酸として働きやすく、電子受容能を示します。
トレオニン残基の水酸基がルイス塩基として反応します。立体化学:
不斉炭素の立体配置は、反応性と選択性に影響を与えます。混成軌道:
ボルテゾミブのホウ素は、結合状態によってsp³からsp²混成軌道に変化します。
各選択肢の論点および解法へのアプローチ方法
選択肢1: [ア]で示した複素環はピリミジン環である。
論点
「ア」で示された環がピラジン環であるか、ピリミジン環であるかを判断する問題です。
ピリミジン環: 窒素原子が1,3位に配置された六員環。
ピラジン環: 窒素原子が1,4位に配置された六員環。

アプローチ方法
ボルテゾミブの化学構造を確認し、「ア」で囲まれた複素環に着目する。
環中の窒素原子の配置(1,4位であるか1,3位であるか)を識別する。
化学式に基づいて正しい名称を判断する。
結論: ボルテゾミブの該当環は窒素原子が1,4位に存在するため、ピラジン環が正解です。
選択肢2: [イ]で示した不斉中心の立体配置はS配置である。
論点
不斉中心(炭素原子)の立体配置がSであるかRであるかを判断する問題です。
立体配置はCahn-Ingold-Prelog (CIP) 順位則に基づいて決定されます。

アプローチ方法
「イ」で示された不斉炭素に結合する4つの置換基(窒素、炭素、ホウ素、水素)を識別する。
順位を決定し、最小順位の置換基(水素)を背面に配置する。
1位から3位の置換基を追う方向が時計回りならR配置、反時計回りならS配置である。
結論: 窒素、炭素、ホウ素の順位を追うと時計回りであるため、R配置が正解です。
選択肢3: [ウ]で示したホウ素はルイス酸として働く。
論点
ホウ素原子がルイス酸としての性質を示すかを判断する問題です。
ルイス酸は電子対を受容する化学種であり、ボロン酸基のホウ素は通常、空のp軌道を持つためルイス酸として働きます。

アプローチ方法
ボロン酸基(B(OH)₂)の電子状態を分析する。
トレオニン残基の水酸基(ルイス塩基)とホウ素の相互作用を確認する。
ボロン酸エステル形成過程でホウ素が電子対を受容することを証明する。
結論: ホウ素はトレオニンの酸素から電子対を受容するため、ルイス酸として働く。
選択肢4: [エ]で示したホウ素の形式電荷は+1である。
論点
形式電荷が正確に計算されているかを確認する問題です。
形式電荷は以下の公式で計算されます:
形式電荷 = 価電子数 − (孤立電子数 + (1/2) × 共有電子数)
ボルテゾミブの結合後のホウ素原子は次のような結合状態にあります:
ホウ素には炭素鎖と2つの水酸基、トレオニンの酸素(O-H)が共有結合しています。
孤立電子対は存在しません。
計算の詳細:
価電子数: ホウ素の価電子数は3。
孤立電子数: 0。
共有電子数: 4つのσ結合があるため8電子。
形式電荷=3−(0+1/2×8)=3−4=−1
アプローチ方法
「エ」で示されたホウ素の結合状況(炭素鎖、2つの水酸基、トレオニンの酸素)を確認する。
上記の公式を用いて形式電荷を計算する。
結論: ホウ素は結合後に形式電荷-1を持つため、+1ではありません。
選択肢5: [エ]で示したホウ素はsp3混成である。
論点
ホウ素の結合状態がsp³混成軌道であるかどうかを判断する問題です。
sp³混成: ホウ素が4つのσ結合を形成。
sp²混成: ホウ素が3つのσ結合を形成し、1つの空のp軌道を持つ。

ホウ素(B) ファイル:Electron shell 005 Boron.svg - Wikipedia
炭素(C) ファイル:Electron shell 006 Carbon.svg - Wikipedia
窒素(N) ファイル:Electron shell 007 Nitrogen.svg - Wikipedia
酸素(O) ファイル:Electron shell 008 Oxygen.svg - Wikipedia
アプローチ方法

結合前後でホウ素の混成状態を確認する。
結合前: sp²混成(空のp軌道を持つ)。
結合後: トレオニンの酸素が結合し、4つのσ結合を形成するためsp³混成。

結論: 「エ」で示されたホウ素は結合後、sp³混成を示します。
引用文献のリスト
Adams, J. (2004). The Proteasome: A Suitable Antineoplastic Target. Nature Reviews Cancer, 4(5), 349–360.
ボルテゾミブのプロテアソーム阻害機序についての包括的なレビュー。
Kisselev, A. F., & Goldberg, A. L. (2001). Proteasome Inhibitors: From Research Tools to Drug Candidates. Chemistry & Biology, 8(8), 739–758.
プロテアソームの機能と阻害剤の作用機序に関する科学的議論を含む。
Hu, J., Zhang, X., & Shen, W. (2006). Reactivity and Applications of Boronic Acids in Organic Chemistry. Chemical Reviews, 106(6), 2596–2619.
ボロン酸基の化学的性質と反応性について解説。
Cahn, R. S., Ingold, C., & Prelog, V. (1956). The Specification of Molecular Chirality. Angewandte Chemie International Edition in English, 5(4), 385–415.
CIP順位則の基礎に関する原論文。
PubChem. Bortezomib Compound Summary. Retrieved from https://pubchem.ncbi.nlm.nih.gov
ボルテゾミブの化学構造や物理化学的性質に関する基本情報。
深掘り
選択肢3, 4, 5の詳細解説
選択肢3: [ウ]で示したホウ素はルイス酸として働く。
論点詳細
ホウ素原子がルイス酸としての性質を発揮するのは、空のp軌道を持ち、電子対を受け取れる性質があるためです。
ボルテゾミブのボロン酸基(B(OH)₂)において、ホウ素原子はプロトン化もしくは電子受容体として振る舞います。
ボロン酸基はホウ素に2つの水酸基が結合しており、空のp軌道が存在します。これがルイス酸としての特性を生む主因です。
トレオニンの水酸基(-OH)がルイス塩基として働き、ホウ素のp軌道に電子を供与することで共有結合(ボロン酸エステル)が形成されます。
ルイス酸とは、電子対を受容する化学種のことであり、ホウ素原子はこの基準を満たします。
反応式では以下のように記述できます:
R-B(OH)₂+R'OH (トレオニン水酸基) → R-B(OH)₂(OR')+H2O
この反応でホウ素が電子を受け取る役割を果たしており、ルイス酸として働くことがわかります。
選択肢4: [エ]で示したホウ素の形式電荷は+1である。
論点詳細
形式電荷は以下の公式で計算されます:
形式電荷=価電子数 − (孤立電子数 + (1/2) × 共有電子数)
ボルテゾミブの結合後のホウ素原子は次のような結合状態にあります:
ホウ素には炭素鎖と2つの水酸基、トレオニンの酸素(O-H)が共有結合しています。
孤立電子対は存在しません。
計算の詳細:
価電子数: ホウ素の価電子数は3。
孤立電子数: 0。
共有電子数: 4つのσ結合があるため8電子。
形式電荷=3−(0+12×8)=3−4=−1
結論
ホウ素の形式電荷は-1であり、+1ではありません。
選択肢5: [エ]で示したホウ素はsp3混成である。
論点詳細
ホウ素の混成軌道は、結合前後で変化します:
結合前(自由状態のボロン酸):
ホウ素は2つの水酸基(σ結合)と炭素鎖(σ結合)に結合し、1つの空のp軌道を持つ。このため、sp²混成です。結合後(プロテアソーム複合体):
トレオニンの水酸基と共有結合を形成することで、ホウ素は4つのσ結合を持ちます。この場合、ホウ素の混成軌道はsp³に変化します。
sp³混成は、中央原子が4つのσ結合を持ち、正四面体形状を形成する場合に適用されます。ボルテゾミブがプロテアソームと結合すると、ホウ素原子は以下の形状をとります:
炭素鎖(1つ)
2つの水酸基
トレオニンの水酸基(1つ)
これにより、ホウ素原子はsp³混成状態となり、四面体配位を持つことが確認されます。
引用文献
Adams, J. (2004). The Proteasome: A Suitable Antineoplastic Target. Nature Reviews Cancer, 4(5), 349–360.
ボルテゾミブの作用機序とホウ素原子の役割に関する記述。
Hu, J., Zhang, X., & Shen, W. (2006). Reactivity and Applications of Boronic Acids in Organic Chemistry. Chemical Reviews, 106(6), 2596–2619.
ボロン酸基の性質および反応性に関する基礎知識。
Cahn, R. S., Ingold, C., & Prelog, V. (1956). The Specification of Molecular Chirality. Angewandte Chemie International Edition in English, 5(4), 385–415.
立体化学のCIP順位則。
PubChem. Bortezomib Compound Summary. Retrieved from https://pubchem.ncbi.nlm.nih.gov
ボルテゾミブの化学構造に関する基本情報。
以上で、論点整理を終わります。
理解できたでしょうか?
大丈夫です。
完全攻略を目指せ!
はじめましょう。
薬剤師国家試験の薬学理論問題【化学】からプロテアソーム阻害 / 形式電荷変化 / 混成軌道変化 / ルイス酸 / sp3混成を論点とした問題です。
なお、以下の解説は、著者(Yukiho Takizawa, PhD)がプロンプトを作成して、その対話に応答する形でGPT4o & Copilot 、Gemini 1.5 Pro、またはGrok 2 (beta) が出力した文章であって、著者がすべての出力を校閲しています。
生成AIの製造元がはっきりと宣言しているように、生成AIは、その自然言語能力および取得している情報の現在の限界やプラットフォーム上のインターフェースのレイト制限などに起因して、間違った文章を作成してしまう場合があります。
疑問点に関しては、必要に応じて、ご自身でご確認をするようにしてください。
Here we go.
第107回薬剤師国家試験|薬学理論問題 /
問106
一般問題(薬学理論問題)【物理・化学・生物】
化学|問 107-106
Q. ボルテゾミブは、プロテアソームのb5サブユニットのN末端トレオニン残基と結合し複合体を形成することにより、プロテアソームの働きを阻害する。以下の記述のうち、正しいのはどれか。2つ選べ。

■選択肢
1. [ア]で示した複素環はピリミジン環である。
2. [イ]で示した不斉中心の立体配置はS配置である。
3. [ウ]で示したホウ素はルイス酸として働く。
4. [エ]で示したホウ素の形式電荷は+1である。
5. [エ]で示したホウ素はsp3混成である。
■■GPT4o
化学|問 107-106
■論点|プロテアソーム阻害 / 形式電荷変化 / 混成軌道変化 / ルイス酸 / sp3混成
この問題の論点は、ボルテゾミブの構造特性と化学反応におけるホウ素の役割を特定することです。
■解説1|

[ウ]で示したホウ素はルイス酸として働く。(選択肢3)[正しい]
ホウ素は周期表第13族の元素であり、電子不足(価電子数が6)であるため、電子対を受け取る性質を持つ。
反応において、トレオニン残基の水酸基からの電子対を受容することで共有結合を形成するため、ルイス酸として機能する。
[エ]で示したホウ素はsp³混成である。(選択肢5)[正しい]
結合前のホウ素は2つの水酸基と炭素鎖に結合しており、sp²混成(平面三角形構造)である。トレオニン残基の水酸基との結合により、ホウ素が4つの電子対を持つ四面体構造に変化し、sp³混成に移行する。

■解説2|
[ウ]で示したホウ素のルイス酸性の重要性:
ボルテゾミブは、ホウ素のルイス酸性を利用してプロテアソームのb₅サブユニットのN末端トレオニン残基と特異的に結合します。この特性はプロテアソーム阻害剤としての活性に直接関係しており、癌細胞内のタンパク質分解を防ぐ重要な役割を果たします。[エ]で示したホウ素のsp³混成への変化:
混成軌道の変化は、反応の進行に伴う電子密度の分配と共有結合形成の結果です。反応後のsp³混成により四面体構造が形成され、結合の安定性が向上します。
■結論|
正しい選択肢は以下の通りです:
3. [ウ]で示したホウ素はルイス酸として働く
5. [エ]で示したホウ素はsp³混成である
■補足|
[ア]で示した複素環はピリミジン環である。(選択肢1)[誤り]
図中で示される環はベンゼンの1,4位の炭素が窒素で置換されたものでピラジン環です。
ピリミジン環はベンゼンの1,3位の炭素が窒素で置換されたものです。
これらは6員環における窒素の位置が異なる異性体です。

[イ]で示した不斉中心の立体配置はS配置である。(選択肢2)[誤り]
示された不斉中心では、優先順位に従い時計回りに窒素(N)、炭素(C)、ホウ素(B)が結合しており、R配置になります。
[エ]で示したホウ素の形式電荷は+1である。(選択肢4)[誤り]

形式電荷の計算に基づくと、ホウ素の形式電荷は-1であり、+1ではありません(価電子数、共有電子、孤立電子の合計から計算可能)。
価電子数: ホウ素の価電子数は3。孤立電子数: 0。
共有電子数: 4つのσ結合があるため8電子。
形式電荷 = 価電子数 − (孤立電子数 + (1/2) × 共有電子数)
形式電荷 = 3 − (0 + 12 × 8) = 3 − 4 = −1
必須問題の解説は、こちらからどうぞ。
薬剤師国家試験対策ノート|論点解説 必須問題 第106回-第109回 一覧 powered by Gemini 1.5 Pro, Google AI Studio & GPT4, Copilot|matsunoya (note.com)
薬学理論問題の解説は、こちらからどうぞ。
薬剤師国家試験対策ノート|論点解説 薬学理論問題 第106回-第109回 一覧 powered by Gemini 1.5 Pro, GPT4o, Copilot, and Grok 2|matsunoya
お疲れ様でした。
🍰☕🍊
では、問題を解いてみましょう!
すっきり、はっきりわかったら、合格です。
第107回薬剤師国家試験|薬学理論問題 /
問106
一般問題(薬学理論問題)【物理・化学・生物】
化学|問 107-106
Q. ボルテゾミブは、プロテアソームのb5サブユニットのN末端トレオニン残基と結合し複合体を形成することにより、プロテアソームの働きを阻害する。以下の記述のうち、正しいのはどれか。2つ選べ。

■選択肢
1. [ア]で示した複素環はピリミジン環である。
2. [イ]で示した不斉中心の立体配置はS配置である。
3. [ウ]で示したホウ素はルイス酸として働く。
4. [エ]で示したホウ素の形式電荷は+1である。
5. [エ]で示したホウ素はsp3混成である。
楽しく!驚くほど効率的に。
https://note.com/matsunoya_note
お疲れ様でした。
🍰☕🍊
またのご利用をお待ちしております。
ご意見ご感想などお寄せくださると励みになりうれしいです。
note からのサポート、感謝します。
今日はこの辺で、
それではまた
お会いしましょう。
Your best friend
Mats & BLNt
このコンテンツ
松廼屋|論点解説 薬剤師国家試験対策ノート問 107-106【化学】論点:プロテアソーム阻害 / 形式電荷変化 / 混成軌道変化 / ルイス酸 / sp3混成|matsunoya
Here; https://note.com/matsunoya_note/n/n544368550884
よろしければこちらもどうぞ
薬学理論問題の論点解説 一覧です。
走る!「基本骨格」Twitter Ver.|薬剤師国家試験対策ノート @YouTube
このコンテンツの制作者|
滝沢幸穂(Yukiho.Takizawa)phD
■Facebook プロフィール
https://www.facebook.com/Yukiho.Takizawa
■X (Former Twitter) プロフィール 🔒
https://twitter.com/YukihoTakizawa
CONTACT|
mail: info_01.matsunoya@vesta.ocn.ne.jp (Matsunoya Client Support)
tel: 029-872-9676
日々の更新情報など、Twitter @Mats_blnt_pharm 🔒から発信しています!
🔒🐤💕 https://twitter.com/Mats_blnt_pharm
https://note.com/matsunoya_note
note.com 右上の🔍で
( matsunoya_note 🔍 )
松廼屋 Mats.theBASE
https://matsunoya.thebase.in/
サポート感謝します👍
最後までお読みいただきましてありがとうございました。
Here; https://note.com/matsunoya_note/n/n544368550884
松廼屋|論点解説 薬剤師国家試験対策ノート問 107-106【化学】論点:プロテアソーム阻害 / 形式電荷変化 / 混成軌道変化 / ルイス酸 / sp3混成|matsunoya
ここから先は
¥ 1,000
Amazonギフトカード5,000円分が当たる
医療、健康分野のリカレント教育における「最強コンテンツ」を note で誰でもいつでも学習できる、 https://note.com/matsunoya_note はそんな場にしたい。あなたのサポートがあれば、それは可能です。サポート感謝します!松廼屋 matsunoya
