
松廼屋|論点解説 薬剤師国家試験対策ノート問109-182【薬剤】論点:バイオ医薬品 / 微粒子製剤 / 分散性 / ゼータ電位・平均粒子径
第109回薬剤師国家試験|薬学理論問題 /
問182
一般問題(薬学理論問題)【薬剤】
問109-182
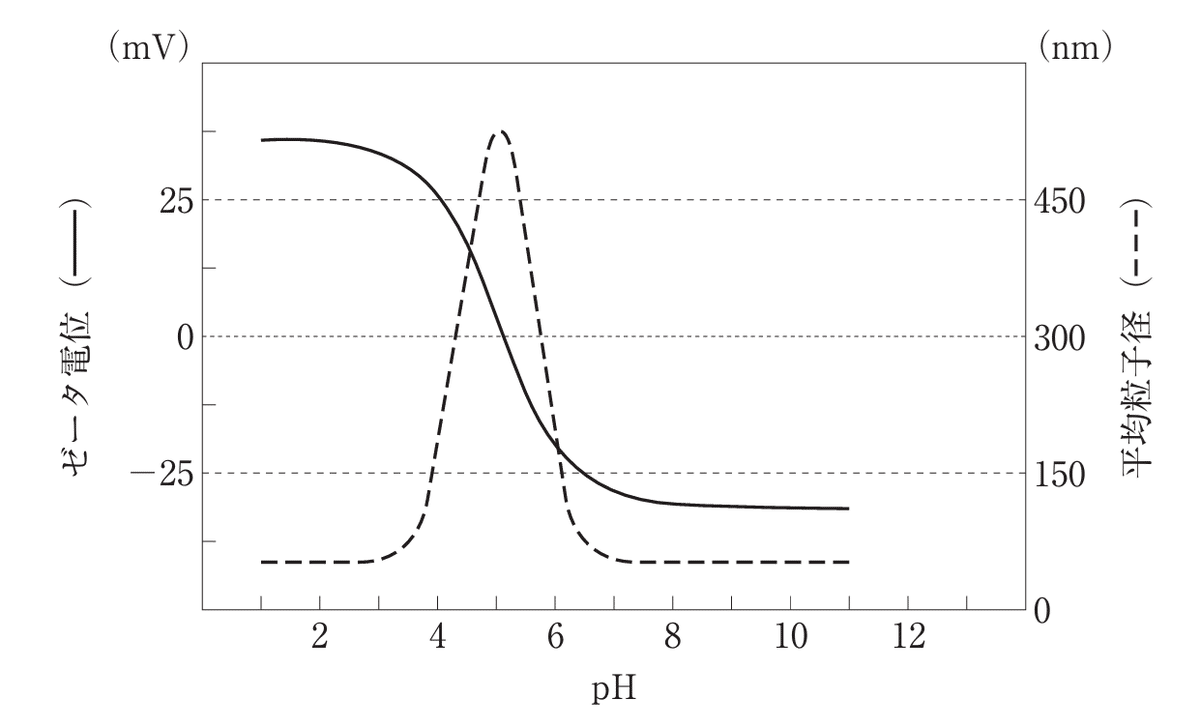
Q. バイオ医薬品の微粒子製剤の水への分散性を、ゼータ電位と平均粒子径から評価した。下図の異なるpHにおける結果に関する記述のうち、正しいのはどれか。2つ選べ。ただし、一次粒子の粒子径はpHにより変化せず、温度は一定とする。また、粒度分布は一峰性で十分小さく、粒子の凝集は可逆的とする。
■選択肢
1. pH2で分散粒子は正に帯電している。
2. pH5付近で最も凝集性が高い。
3. pH6付近で粒子表面は電気的に中性である。
4. pH8以上で粒子は凝析している。
5. 塩を加えることでpHによらず分散性を改善できる。
こんにちは!薬学生の皆さん。
Mats & BLNtです。
matsunoya_note から、薬剤師国家試験の論点解説をお届けします。
苦手意識がある人も、この機会に、薬学理論問題【薬剤】を一緒に完全攻略しよう!
今回は、第109回薬剤師国家試験|薬学理論問題 / 問182、論点:バイオ医薬品 / 微粒子製剤 / 分散性 / ゼータ電位・平均粒子径を徹底解説します。
薬剤師国家試験対策ノート NOTE ver.
matsunoya_note|note https://note.com/matsunoya_note
Here; https://note.com/matsunoya_note/n/n00b9090a6635
松廼屋|論点解説 薬剤師国家試験対策ノート問109-182【薬剤】論点:バイオ医薬品 / 微粒子製剤 / 分散性 / ゼータ電位・平均粒子径
薬剤師国家試験対策には、松廼屋の eラーニング
「薬剤師国家試験対策ノート」
マガジン|薬剤師国家試験対策ノート on note
👉マガジンをお気に入りに登録しよう!
このコンテンツの制作者|
滝沢 幸穂 Yukiho Takizawa, PhD
https://www.facebook.com/Yukiho.Takizawa
お友達や知り合いに、matsunota_note で学習したeラーニングを勧めてみたい方は、いいね!、口コミ、おススメなど、よろしくお願いします!
設問へのアプローチ|

第109回薬剤師国家試験の問182(問109-182)では、バイオ医薬品 / 微粒子製剤 / 分散性 / ゼータ電位・平均粒子径に関する知識を問われました。
今回の出題範囲:
製剤化のサイエンス|製剤の性質|分散系材料
界面の性質(界面張力、分配平衡、吸着等)や代表的な界面活性剤の種類と性質について説明できる。
代表的な分散系(分子集合体、コロイド、乳剤、懸濁剤等)を列挙し、その性質について説明できる。
分散した粒子の安定性と分離現象(沈降等)について説明できる。👈ココ
分散安定性を高める代表的な製剤的手法を列挙し、説明できる。
薬剤師国家試験 出題基準
出典: 薬剤師国家試験のページ |厚生労働省 (mhlw.go.jp)
出題基準 000573951.pdf (mhlw.go.jp)
論点を整理します。
■■Grok 2 (beta)
総合的な論点
1. ゼータ電位の変化と分散性への影響
ゼータ電位(ζ電位): 粒子表面の電荷を示すもので、粒子間の引力(ファンデルワールス力)と斥力(静電反発力)のバランスに影響を与えます。これはDLVO理論に基づいて説明されます。ゼータ電位が高い場合(絶対値が大きい)、粒子間の斥力が強くなり、分散性が向上します。

DLVO理論: V_T = V_A + V_R
ここで、 V_T は総ポテンシャルエネルギー、 V_A はファンデルワールス引力、 V_R は静電斥力です。ゼータ電位が高い場合、 V_R が大きくなり、粒子は安定した分散状態を維持します。
DLVO理論は、DeryaguinとLandau、VerweyとOverbeekによって提唱されたコロイドの安定性を説明するための理論です。
DLVO理論は、粒子溶液におけるコロイド粒子の相互作用エネルギーを、主に次の二つの力のバランスとして説明します:
ファンデルワールス力(引力)
粒子間での分子間の電子雲の相互作用から生じ、長距離ではロンドン分散力(分子間引力)が優勢となります。
この力は距離の6乗に反比例して減衰します。
静電斥力
粒子が電荷を帯びている場合に生じます。粒子が同じ符号の電荷を持っているとき、これらの電荷は互いに反発します。この斥力は、粒子が近づきすぎると急速に増加します。
安定性と凝集:
安定性: ゼータ電位が大きい絶対値を持つ場合、エネルギー障壁が高く、粒子は分散安定です。
凝集: イオン強度の増加やpHの変化(ゼータ電位が0に近づく)によって、エネルギー障壁が低下し、粒子は容易に凝集します。
制御: コロイドの分散性を制御するためには、電解質の添加、表面の電荷を変えるための化学処理、pHの調整などを行います。
pHの影響: pHの変化は粒子表面の解離基(-COOH, -NH2 など)の荷電状態に影響を与えます。このため、pHが変わるとゼータ電位も変化します。
pH2でのゼータ電位: pHが低いと、多くの生物学的分子はプロトン化されやすく、正の電荷を帯びる可能性が高いです。
等電点(pI): pH5付近でゼータ電位が0mVに近づくのは、多くの蛋白質やバイオ医薬品の等電点付近である可能性があります。この点では粒子表面の電荷が中性に近づき、凝集が起こりやすくなります。
2. 平均粒子径の変化
粒径の変化: ゼータ電位が低下すると、粒子間の斥力が弱まり、凝集が進みます。これにより平均粒子径が大きくなります。
pH3からpH5: この範囲で粒子径が急激に増加しているのは、ゼータ電位が低下し、粒子が凝集しやすくなったためです。
pH6以降: ゼータ電位が再び負の値に戻ると、斥力が再び働き始め、凝集が解消され、粒子径が小さくなります。

このような粒子間の相互作用とpHの変化によるゼータ電位の変動が、微粒子の分散性にどのように影響を与えるかが問題の核心です。
各選択肢の論点および解法へのアプローチ方法
選択肢1: pH2で分散粒子は正に帯電している。
論点: pHが低い(酸性)領域では、多くの生物分子のカルボキシル基やアミノ基はプロトン化されやすく、正の電荷を持つ可能性が高いです。
解法へのアプローチ:
ゼータ電位データの確認: 図からpH2付近のゼータ電位が25mV以上であることを確認する。
化学的な知識: 酸性環境では、-COO-や-NH2などの基がH⁺と結合し、正の電荷を帯びることを理解する。
文献や理論の参照: 蛋白質やバイオ医薬品の等電点の概念を参考に、酸性条件下での電荷状態を検討する。

選択肢2: pH5付近で最も凝集性が高い。
論点: ゼータ電位が0に近づくと、粒子間の斥力が最小になり、凝集が最大化します。
解法へのアプローチ:
ゼータ電位データの確認: pH5付近でゼータ電位が0mVに近づいていることを確認する。
粒子径の変化: pH5付近で平均粒子径が最大になることを確認し、これが凝集の結果であると解釈する。
DLVO理論の適用: ゼータ電位が低ければ、静電斥力が弱まり、凝集が容易になることを理論的に説明。

選択肢3: pH6付近で粒子表面は電気的に中性である。
論点: ゼータ電位が-25mV程度まで下がる。これは中性ではなく負の電位です。
解法へのアプローチ:
ゼータ電位の理解: 中性とはゼータ電位が0mVに近いことを意味します。pH6付近の値は明らかに負です。
データの再確認: ゼータ電位の数値を正確に読み取り、中性の定義と比較。

選択肢4: pH8以上で粒子は凝析している。
論点: pH8以上ではゼータ電位は負の値を維持し、粒子は安定しています。
解法へのアプローチ:
ゼータ電位と粒子径のデータ確認: pH8以上でゼータ電位が安定し、粒子径も一定であることを確認。
凝析の定義: 凝析は通常、粒子が凝集して大きな塊を形成することを指します。pH8以上では粒子径は最小で一定です。

選択肢5: 塩を加えることでpHによらず分散性を改善できる。
論点: 塩を加えるとイオン強度が増加し、ゼータ電位が低下する可能性があるが、一概に分散性が改善するとは限りません。
解法へのアプローチ:
塩の影響の理論: ホフマイスター効果やイオン強度の増加によるDLVO理論の変化を検討。
実際のデータの必要性: この現象は実験データがないと確定できないため、理論的な可能性として議論する。
選択肢の論点および解法へのアプローチ
深掘り
選択肢1: pH2で分散粒子は正に帯電している。
水素イオンとプロトン化: pHが低い(酸性)環境では、水溶液中には多くのH⁺(水素イオン)が存在します。これらのイオンは分子の解離基に結合しやすく、その結果、分子表面に正の電荷を帯びることになります。特に、カルボキシル基(-COOH)やアミノ基(-NH2)のような解離基は、酸性条件下でプロトン化して正の電荷を帯びます。
ゼータ電位とpHの関係: ゼータ電位は粒子表面の電荷の指標であり、pHの変化によって大きく影響を受けます。pHが低下すると、通常はプロトン化が進み、ゼータ電位が正の値を取る傾向があります。
解法へのアプローチ:

ゼータ電位データの確認:
問題に示されたデータでは、pH2でのゼータ電位が25mV以上とされています。この値は明らかに正です。化学的な知識の応用:
カルボキシル基のプロトン化:
-COO- + H+ → -COOH
アミノ基のプロトン化:
-NH2 + H+ → -NH3+
これらの反応により、分子表面に正の電荷が増えることを説明します。文献や理論の参照:
**等電点(pI)**の概念を利用して、蛋白質やバイオ医薬品の分子がどのpHで正に帯電するかを理解します。等電点は分子が中性になるpHであり、それより低いpHでは正に帯電します。
DLVO理論を用いて、電荷の存在がどのように粒子間相互作用に影響を与えるかを説明。特に、正の電荷がどう斥力に寄与して分散性を保つかを論じます。実験的裏付け:
実験では、pHの変化に伴うゼータ電位の測定が一般的に行われます。pH2での正のゼータ電位は、これらの測定結果と一致するかを確認します。結論:
pH2では、生物学的分子の表面に存在するプロトナブルな基がプロトン化することで、粒子は確実に正に帯電するという結論に至ります。これにより、選択肢1は正しいと判断されます。
このように、各ステップを通じて科学的な根拠に基づいて論述することで、選択肢1が正しい理由を明確に理解し、説明することができます。
選択肢2: pH5付近で最も凝集性が高い。
ゼータ電位のゼロクロス: pH5付近でゼータ電位が0mVに近づくということは、粒子表面の電荷が中性に近づいていることを示しています。これは粒子間の静電斥力が最小になり、凝集が起こりやすくなる条件です。
DLVO理論の適用: DLVO理論に基づくと、ゼータ電位が0に近いとき、粒子間の総ポテンシャルエネルギV_T は以下のように表現されます:
V_T = V_A(ファンデルワールス引力だけが主要な力)
このとき、斥力 V_R がほとんど働かないため、粒子が凝集しやすくなります。
解法へのアプローチ:

ゼータ電位データの精査:
図から、pH5付近でゼータ電位が0mVに接近することを確認。凝集性のエビデンス:
実験結果から、平均粒子径がpH5で最大になることを確認。これは凝集が最も進行した結果です。DLVO理論の理解と適用:
静電斥力がゼロに近づくと、粒子間の引き合う力(ファンデルワールス力)が主導権を握り、凝集が促進されることを示す。粒度分布の考慮:
問題では粒度分布が一峰性で、粒子が凝集するがその凝集が可逆的であると仮定されています。pH5付近で最大の凝集が起こることをこの前提のもとで説明。表面電荷の役割:
ゼータ電位が低下すると、粒子表面の電荷が減少し、それに伴い粒子間の斥力が低下し、凝集が起こりやすくなる。実験データの解釈:
pH5付近でゼータ電位が0mVに近づくと同時に、粒子径が最大になる。これは粒子が最も集まりやすい状態であることを示しています。結論:
pH5付近でのゼータ電位の特性と粒子径の変化から、このpHで凝集性が最大であることが最も科学的に根拠のある解釈であると判断。
このように、科学的な理論と実験データを組み合わせることで、選択肢2が正しい理由を詳細に説明することができます。
選択肢3: pH6付近で粒子表面は電気的に中性である。
ゼータ電位と中性の定義: 粒子表面が電気的に中性であるということは、ゼータ電位が0mVに近いことを意味します。しかし、pH6付近のゼータ電位は-25mVであり、これは明らかに中性ではなく、負の電荷を示しています。
等電点(pI)の概念: 等電点は分子が電気的に中性になるpHです。問題のデータから、pH5付近がゼータ電位が0に近いことから、これが等電点に近い可能性が高いです。pH6では既にゼータ電位が負にシフトしています。
解法へのアプローチ:

ゼータ電位データの精査:
図から、pH6でのゼータ電位が-25mVであることを確認。この値は中性(0mV)とは一致しません。等電点の理解:
等電点は分子の構造と含まれる機能基に依存し、pH5付近でゼータ電位が0mVとなることから、このpH付近が等電点に近いと推測されます。pHの影響:
pHが6に近づくと、分子表面の解離基は再度解離し始め、負の電荷を帯びるようになるため、ゼータ電位が負の値に変わります。実験データとの比較:
pH5付近でのゼータ電位の変化(0mV付近)を考慮すると、pH6では粒子が中性であるというのは誤りです。電気化学的な知識:
酸性条件(pH低い)でプロトン化しやすい基はpHが上がるにつれて解離し、負に帯電する傾向があることを理解します。結論:
pH6付近では、ゼータ電位が-25mVとなっており、これは粒子表面が電気的に負に帯電していることを示しています。したがって、選択肢3は正しくありません。
このように、ゼータ電位の変化とpHの関係を詳細に分析することで、選択肢3が誤りであることを明確に示すことができます。
選択肢4: pH8以上で粒子は凝析している。
凝析の定義: 凝析は通常、粒子が凝集して大きな塊を形成し、沈殿することが含まれます。ただし、ここでの問題では、粒子径がpH8以上で最小値を示して一定であり、凝集や凝析のエビデンスが見られません。
ゼータ電位の役割: pH8以上でゼータ電位は負の値を維持しており、これは粒子間の斥力が存在し続けていることを示唆します。これにより粒子は安定した分散状態を保つことが可能です。
解法へのアプローチ:

ゼータ電位データの確認:
pH8以上のゼータ電位が-25mV未満で安定していることを確認。これは粒子間で斥力が働き続けていることを示します。平均粒子径の変化:
問題のデータによると、pH8からpH11まで粒子径は約70nmと最小値で一定。これは凝集や凝析が進んでいないことを示しています。分散安定性の科学:
高い(絶対値)ゼータ電位は粒子間の斥力を増加させ、分散安定性を高める。この場合、負のゼータ電位があるため、粒子は互いに反発し、凝析を防ぎます。DLVO理論の適用:
DLVO理論の観点から見ると、pH8以上では斥力 V_R が引き続き存在し、粒子間の総ポテンシャルエネルギV_T は凝集を防ぐ方向に動いています。実験的観察:
分散液の外観や沈降速度などの実験的エビデンスが示されていない限り、凝析しているという判断は難しいです。問題の情報からは凝集が進んでいないことが示唆されています。結論:
pH8以上でのゼータ電位が負の値を維持し、平均粒子径が一定であることから、粒子は凝析しているというよりも、むしろ安定した分散状態を維持していると言えます。したがって、選択肢4は正しくありません。
このように、ゼータ電位と平均粒子径のデータを基に、分散安定性について詳細に検討することで、選択肢4が誤りであることを証明することができます。
選択肢5: 塩を加えることでpHによらず分散性を改善できる。
イオン強度の影響: 塩を加えると溶液のイオン強度が増加します。イオン強度が増えると、ゼータ電位が低下する傾向があり、これは電荷のシールド化(Debyeスクリーン効果)によるものです。ゼータ電位が低下すると、粒子間の静電斥力が弱まり、凝集が進みやすくなる可能性がありますが、それが必ずしも分散性の改善に結びつくわけではありません。
分散性の改善方法: 塩の添加による分散性の改善は特定の条件下で有効です。例えば、塩がイオンを提供することでイオン雲を作り出し、粒子間斥力を調整することができますが、pHごとにその効果は異なります。
解法へのアプローチ:
イオン強度とゼータ電位の関係:
Debyeスクリーン長(κ⁻¹)が短くなることで、粒子間の静電斥力が弱まります: k = √((2e^2 N_A I) / (ε k_B T))
ここで、 I はイオン強度です。イオン強度が増加すると、ゼータ電位は低下します。塩の役割:
塩は塩基性イオンまたは酸性イオンを供給し、pHによっては粒子表面の電荷を中和することで凝集を促進したり、逆に斥力を増加させて分散性を向上させることがあります。実験的裏付けの必要性:
塩の添加がどのように分散性に影響を与えるかは、実験データがなければ断定的に言えません。実験では、塩濃度、塩の種類、pHの条件下での分散性の変化を観察する必要があります。理論的な考察:
ハーディ・シュルツェ則によれば、塩のイオンは粒子表面の電荷を中和するだけでなく、塩の種類によっては逆に分散を助けることがあります。しかし、これは特定のシステムに依存します。結論:
「pHによらず」分散性が改善できるという一般論は、科学的には正しくありません。塩の添加が分散性にどのように影響を与えるかは、塩の種類、濃度、およびシステム内のその他の条件(pH、温度、粒子の性質など)に大きく依存します。
このように、選択肢5は理論的には一部の条件下で真であるかもしれませんが、一般に適用できるかどうかはケースバイケースで、実験的エビデンスが必要となります。
Ref.
以下の文献は、問題で扱われたゼータ電位、粒子分散性、pHの影響、および塩の影響に関する基本的な知識と理論を提供しています。具体的な実験データや新しい研究については、具体的な文献を探す必要がありますが、ここでは一般的な参考文献をリストします。
Deryaguin, B. V., & Landau, L. (1941). Theory of the stability of strongly charged lyophobic sols and the adhesion of strongly charged particles in solutions of electrolytes. Acta Physicochimica URSS, 14(6), 633-662.
DLVO理論の基礎を提供する。Verwey, E. J. W., & Overbeek, J. Th. G. (1948). Theory of the Stability of Lyophobic Colloids. Elsevier, Amsterdam.
静電斥力とファンデルワールス引力の相互作用を詳述。Hunter, R. J. (2001). Foundations of Colloid Science (2nd ed.). Oxford University Press.
ゼータ電位と分散安定性についての包括的な情報。Masliyah, J. H., & Bhattacharjee, S. (2006). Electrokinetic and Colloid Transport Phenomena. Wiley-Interscience.
ゼータ電位とその測定法、および粒子間相互作用についての詳細な説明。Israelachvili, J. N. (2011). Intermolecular and Surface Forces (3rd ed.). Academic Press.
表面力と粒子間力の詳細な理論的背景。Lyklema, J. (1995). Fundamentals of Interface and Colloid Science (Vol. 1). Academic Press.
界面科学とコロイド科学の基礎をカバー。Shaw, D. J. (1992). Introduction to Colloid and Surface Chemistry (4th ed.). Butterworth-Heinemann.
入門レベルでゼータ電位や分散安定性について説明。Tadros, Tharwat F. (2003). Applied Surfactants: Principles and Applications. Wiley-VCH.
表面活性剤の役割と分散系での使用について。
以上で、論点整理を終わります。
理解できたでしょうか?
大丈夫です。
完全攻略を目指せ!
はじめましょう。
薬剤師国家試験の薬学理論問題【薬剤】からバイオ医薬品 / 微粒子製剤 / 分散性 / ゼータ電位・平均粒子径を論点とした問題です。
なお、以下の解説は、著者(Yukiho Takizawa, PhD)がプロンプトを作成して、その対話に応答する形でGPT4o & Copilot 、Gemini 1.5 Pro、またはGrok 2 (beta) が出力した文章であって、著者がすべての出力を校閲しています。
生成AIの製造元がはっきりと宣言しているように、生成AIは、その自然言語能力および取得している情報の現在の限界やプラットフォーム上のインターフェースのレイト制限などに起因して、間違った文章を作成してしまう場合があります。
疑問点に関しては、必要に応じて、ご自身でご確認をするようにしてください。
松廼屋|論点解説 薬剤師国家試験対策ノート問109-182【薬剤】論点:バイオ医薬品 / 微粒子製剤 / 分散性 / ゼータ電位・平均粒子径|matsunoya
Here we go.
第109回薬剤師国家試験|薬学理論問題 /
問182
一般問題(薬学理論問題)【薬剤】
問109-182
Q. バイオ医薬品の微粒子製剤の水への分散性を、ゼータ電位と平均粒子径から評価した。下図の異なるpHにおける結果に関する記述のうち、正しいのはどれか。2つ選べ。ただし、一次粒子の粒子径はpHにより変化せず、温度は一定とする。また、粒度分布は一峰性で十分小さく、粒子の凝集は可逆的とする。

■選択肢
1. pH2で分散粒子は正に帯電している。
2. pH5付近で最も凝集性が高い。
3. pH6付近で粒子表面は電気的に中性である。
4. pH8以上で粒子は凝析している。
5. 塩を加えることでpHによらず分散性を改善できる。
■■Grok 2 (beta)
薬剤|問 109-182
■論点|バイオ医薬品 / 微粒子製剤 / 分散性 / ゼータ電位・平均粒子径
この問題の論点は、バイオ医薬品の微粒子製剤の分散性を、pHとゼータ電位の変化から評価し、粒子間の相互作用と凝集の関係を理解することです。

■解説1|
pH2で分散粒子は正に帯電している。 (選択肢1) [正しい]
プロトン化の過程: pH2という酸性条件下では、粒子表面上のカルボキシル基やアミノ基などの解離基がプロトン化されます。これにより、分子表面に正の電荷が発生します。
これを示すデータとして、問題のグラフではpH2でゼータ電位が25mV以上と高くなっています。
これは、粒子が正に帯電していることを直接示しており、選択肢1が正しいことを裏付けます。
pH5付近で最も凝集性が高い。 (選択肢2) [正しい]
ゼータ電位のゼロクロス: pH5付近でゼータ電位が0mVに近づくことは、粒子表面が中性に近づいていることを意味します。
DLVO理論によれば、ゼータ電位が0mVに近づくと、粒子間の静電斥力が最小になり、ファンデルワールス引力が優勢になるため、粒子が凝集しやすくなります。
問題のグラフでは、pH5で平均粒子径が最大(475nm)になることが示されており、これは凝集が最大に達していることを示しています。
■解説2|
選択肢1: pH2で粒子が正に帯電していることは、酸性条件での分子のプロトン化に基づく基本的な化学反応です。蛋白質やバイオ医薬品の等電点よりも低いpHでは、分子表面の電荷が正に偏ります。
選択肢2: 凝集性のピークは通常、ゼータ電位が中性に近づく点で見られます。これは、粒子同士の斥力が最小化されるためです。pH5での粒子径の変化がこの現象を明確に示しています。
■結論|
選択肢1と選択肢2が正しいです。
pH2では粒子が正に帯電し、pH5付近で凝集性が最大になることが、問題のデータと科学的理論の両方で支持されます。
■補足|
pH6付近で粒子表面は電気的に中性である。 (選択肢3) [誤り]
pH6でのゼータ電位が-12.5未満とされており、これは中性(0mV)ではなく、負に帯電していることを示しています。等電点はpH5付近である可能性が高いため、pH6では粒子は既に負の電荷を持つようになります。
pH8以上で粒子は凝析している。 (選択肢4) [誤り]
問題のデータでは、pH8以上でもゼータ電位が-25mV未満で安定しており、粒子径は約70nmで最小値を示し一定です。
これは粒子が凝析せず、安定した分散状態を維持していることを示しています。
塩を加えることでpHによらず分散性を改善できる。 (選択肢5) [誤り]
塩の添加が分散性に及ぼす影響は、塩の種類、濃度、pHなどに大きく依存します。
一般に、塩を加えることでイオン強度が増加し、ゼータ電位が低下しますが、これが分散性の改善に必ずしもつながるわけではありません。
実際には、システムごとに異なる効果が見られるため、この一般論は適切ではありません。
■Lecture
■■Copilot
論点解説1 コロイドの粒子径について
コロイドは、非常に小さな粒子が液体や気体中に分散している状態を指します。これらの粒子のサイズは、通常1ナノメートル(nm)から1マイクロメートル(μm)の範囲にあります。コロイド粒子のサイズは、その性質や挙動に大きな影響を与えます。
粒子径の測定方法: コロイド粒子のサイズを測定する方法には、動的光散乱(DLS)、透過型電子顕微鏡(TEM)、および走査型電子顕微鏡(SEM)などがあります。これらの方法を用いて、粒子の平均径やサイズ分布を評価します。
粒子径の影響: 粒子のサイズは、コロイドの安定性、光学特性、触媒活性などに影響を与えます。例えば、非常に小さな粒子は表面積が大きくなるため、化学反応の速度が速くなることがあります。
粒子径の制御: コロイドの製造過程では、粒子のサイズを制御することが重要です。これにより、特定の用途に適したコロイドを作成することができます。例えば、医薬品のドラッグデリバリーシステムでは、粒子のサイズが薬物の放出速度や体内での分布に影響を与えます。
論点解説2 バイオ医薬品について
バイオ医薬品は、生物由来の物質を用いて製造される医薬品のことです。これには、タンパク質、ペプチド、核酸、細胞、ウイルスなどが含まれます。バイオ医薬品は、従来の化学合成による医薬品とは異なり、非常に複雑な構造を持つことが多いです。
製造方法: バイオ医薬品は、遺伝子組み換え技術や細胞培養技術を用いて製造されます。例えば、インスリンやモノクローナル抗体などが代表的なバイオ医薬品です。
用途: バイオ医薬品は、がん、自己免疫疾患、感染症、遺伝性疾患など、さまざまな病気の治療に使用されます。特に、従来の治療法では効果が得られない場合に有効です。
特徴: バイオ医薬品は、高い特異性と効果を持つことが多いですが、製造コストが高く、保存や取り扱いが難しいことがあります。また、免疫反応を引き起こすリスクもあります。
必須問題の解説はこちらからどうぞ。
薬剤師国家試験対策ノート|論点解説 必須問題 第106回-第109回 一覧 powered by Gemini 1.5 Pro, Google AI Studio & GPT4, Copilot|matsunoya (note.com)
薬学理論問題【薬剤】(1) の解説はこちらからどうぞ。
薬剤師国家試験対策ノート|論点解説 薬学理論問題 薬剤(1) 第106回-第109回 31問 powered by GPT4o, Chat GPT|matsunoya (note.com)
お疲れ様でした。
🍰☕🍊
では、問題を解いてみましょう!
すっきり、はっきりわかったら、合格です。
第109回薬剤師国家試験|薬学理論問題 /
問182
一般問題(薬学理論問題)【薬剤】
問109-182
Q. バイオ医薬品の微粒子製剤の水への分散性を、ゼータ電位と平均粒子径から評価した。下図の異なるpHにおける結果に関する記述のうち、正しいのはどれか。2つ選べ。ただし、一次粒子の粒子径はpHにより変化せず、温度は一定とする。また、粒度分布は一峰性で十分小さく、粒子の凝集は可逆的とする。

■選択肢
1. pH2で分散粒子は正に帯電している。
2. pH5付近で最も凝集性が高い。
3. pH6付近で粒子表面は電気的に中性である。
4. pH8以上で粒子は凝析している。
5. 塩を加えることでpHによらず分散性を改善できる。
楽しく!驚くほど効率的に。
https://note.com/matsunoya_note
お疲れ様でした。
🍰☕🍊
またのご利用をお待ちしております。
ご意見ご感想などお寄せくださると励みになりうれしいです。
note からのサポート、感謝します。
今日はこの辺で、
それではまた
お会いしましょう。
Your best friend
Mats & BLNt
このコンテンツ
松廼屋|論点解説 薬剤師国家試験対策ノート問109-182【薬剤】論点:バイオ医薬品 / 微粒子製剤 / 分散性 / ゼータ電位・平均粒子径|matsunoya
Here; https://note.com/matsunoya_note/n/n00b9090a6635
よろしければこちらもどうぞ
このコンテンツの制作者|
滝沢幸穂(Yukiho.Takizawa)phD
■Facebook プロフィール
https://www.facebook.com/Yukiho.Takizawa
■X (Former Twitter) プロフィール 🔒
https://twitter.com/YukihoTakizawa
CONTACT|
mail: info_01.matsunoya@vesta.ocn.ne.jp (Matsunoya Client Support)
tel: 029-872-9676
日々の更新情報など、Twitter @Mats_blnt_pharm から発信しています!
🔒 🐤💕 https://twitter.com/Mats_blnt_pharm
https://note.com/matsunoya_note
note.com 右上の🔍で
( matsunoya_note 🔍 )
松廼屋 Mats.theBASE
https://matsunoya.thebase.in/
サポート感謝します👍
最後までお読みいただきましてありがとうございました。
Here; https://note.com/matsunoya_note/n/n00b9090a6635
松廼屋|論点解説 薬剤師国家試験対策ノート問109-182【薬剤】論点:バイオ医薬品 / 微粒子製剤 / 分散性 / ゼータ電位・平均粒子径|matsunoya
ここから先は
¥ 700
医療、健康分野のリカレント教育における「最強コンテンツ」を note で誰でもいつでも学習できる、 https://note.com/matsunoya_note はそんな場にしたい。あなたのサポートがあれば、それは可能です。サポート感謝します!松廼屋 matsunoya
