
人気講師ノート8 赤外分光法で水素結合の強さもわかっちゃう。
人気講師ノート7の続きです。
1.そもそも赤外分光法って何!?
赤外線を照射すると,分子は赤外線のエネルギーを吸収して,分子を構成する原子間の振動あるいは回転に変化が起きます。赤外分光法は,4000~650 cm-1の様々なエネルギーを持った光(赤外線)を照射します。ある分子を透過(あるいは反射)させた赤外線は,照射する前の赤外線よりも,分子の運動に使われる分,エネルギーが弱くなります。
この差を検出することで,分子に吸収されたエネルギー = 分子の運動(振動や回転)をわかります。分子の運動に使われるエネルギーは,その分子構造(官能基と官能基の環境)によって異なります。
2.振動の種類
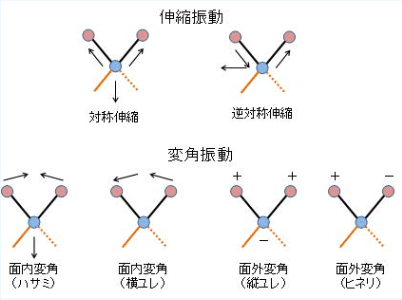
分子の運動には,伸縮振動と変角振動があります。それぞれの振動がどのような動きをしているかは,WikiのURLの中央部分で「動画」としてみることができます。
伸縮振動には,対称伸縮振動(Symmetric sterching)と逆対称伸縮振動(Antisymmetric stereching)があります。同時に伸びるか・伸びないかです。
変角振動は,4種類あって,ハサミ・横揺れ・縦揺れ・ひねりです。絵ではわかりづらいですが,上記URLの動画と英語名で誰でもわかるようになります。※ハサミ(Scissoring)・横揺れ(Rocking)・縦揺れ(Wagging;羽ばたきかな)・ひねり(Twisting)。下記の絵の引用元。
2-1. 赤外分光相関表
お分かりのとおり,それぞれの官能基で吸収ピークが出てくる波数が異なります。この吸収ピークが検出される各官能基の一覧表を「赤外分光相関表」といいます。これを頼りに,ピークの同定を行っていくわけです。
この一覧表を見て思います・・・・
えっ?めちゃあるじゃん?これを覚えないといけないの?
なんか法則性はないの?などなど
以下に続きます!
3.振動モデル (二原子間の振動をバネで近似)
二原子間の振動エネルギーは各間距離の二次関数として近似されるんですけど,とりあえず式を表しちゃいます。
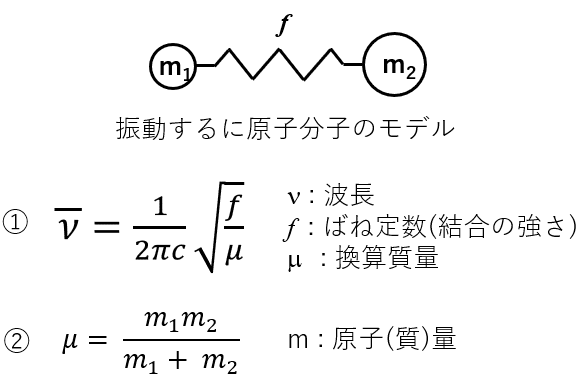
①の「波長」を求める式が最も大事になってきますし,今後の分析法における重要なポイントもこの式で説明します。
①の右辺にある「2πc」は定数ですので,計算の際には必要ですが理論的には「数値が変動しない値」なので考える際には必要ありません。何が言いたいかわからないでしょうから,具体例を出して説明していきます。
3-1.結合の強さ(f)による効果
炭素と炭素間の結合には,単結合(C-C),二重結合(C=C),三重結合(C≡C)の三種類があります。炭素間の結合の数によって,二重や三重という名前がついています。
感覚的に、どの結合が一番強そうか???
それは,単結合より三重結合のほうが強いですよね。
つまり,①式の f (結合の強さ)は,三重結合>二重結合>単結合の順番ンあります。f と ν は比例の関係にありますので,波数(ν)の大きさの順番も,三重結合>二重結合>単結合の順番になります。
実際に検出される波数領域は,
三重結合:2300~2100 cm-1
二重結合:1800~1500 cm-1
単結合 :1500~900 cm-1
となります。これは,他の多重結合であるC-N,C=N や C-O, C=Oについても同様な傾向があります。
また,結合の強さは電気陰性度とも関係しています。相互作用などを無視すれば,O-H, N-H, C-Hについても,検出される波数領域が予想できます。
電気陰性度は,O > N > C の順番で弱くなりますので,水素との結合の強さfは,O-H > N-H > C-H の順番になります。つまり,原理的に波数(ν)の大きさの順番も,O-H > N-H > C-Hの順番になると考えられます。実際には,O-Hは相互作用の影響から低波数側に若干シフトすると考えられるので,検出される波数領域は,
O-H:3600~3000 cm-1
N-H:3700~3000 cm-1
C-H:3300~2700 cm-1
となります。つまり、官能基の結合力の強さから,「どの順番にピークが出てくるかを②の式を知ることで,予想することができます」
3-2. 換算質量(μ;原子量)による効果 (質量効果)
3-1のf(結合の強さ)とは対照的に,
換算質量の大きさは,波数に【反】比例します。
つまり,分母である換算質量が大きくなると,波数は小さくなります。
この数式を読むのが苦手な人が多いので,補足しますと,

つまり,分母である換算質量が大きくなると,波数は小さくなります。
この換算質量の効果については,H(水素)が関与すると,著しく影響が出てきます。
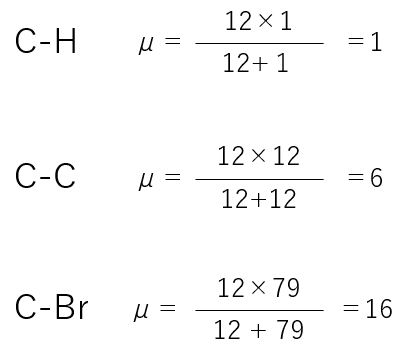
水素が含まれる2原子分子の換算質量は,とても小さい値になります。つまり,水素が含まれると「分母である換算質量が小さい値」になるので,波数は大きな値になります。
C-H:3300-2700 cm-1
C-C:1500-900 cm-1
C-Br:500-600 cm-1
となります。つまり,周期表から元素の大体の質量がわかるので,どのあたりにピークが出るか予想できます。
これら,式①と②および「結合の強さ(f)」と「換算質量(二原子分子の質量)μ」から,官能基の検出されるピーク位置を予想することができます。
また,計算でも求めることができます。巻末に計算問題を置いておきますね(後日)。
3-3. 水素結合の影響
前述のとおり,研究者は測定物がどのような構造であるかを知ったうえで,赤外吸収スペクトルを測定して,その構造に起因する官能基の伸縮振動や変角振動を帰属します。上記の式②から、ある程度予想できますが,相互作用することで順序が入れ替わることがあります。
伸縮振動と波数の位置をまとめた論文があります。この論文によって,水素結合の強さが,赤外吸収スペクトル
Stretching Frequencies as a Function of Distances in Hydrogen Bonds
J. Am. Chem. Soc.1955, 77, 24, 6480-6486
K. Nakamoto, M. Margoshes, R. E. Rundle
リンク先は,ちょうど説明したい1ページ目の図が見えています。簡略化した図を以下に示します。
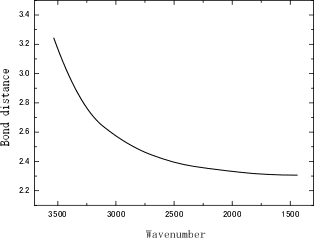
水素結合の一般的な構造式の模式図は以下のように考えられます。
D-H・・・A
(O-H・・・O)
(O-H・・・Cl)
(N-H・・・O)
Dは水素を供与するドナー(Donor),Aは水素を授与するアクセプター(Acceptor)の略称です。
上記グラフの縦軸は,H・・・Aの距離です。横軸はD-Hの波数を表しています。
水素結合が強くなるということは,H・・・Aの距離が短く(小さく)なるということなので,結果として「低波数側にシフトします」。
相互作用が強い=低波数側にシフトする
これは、結合の強さでも同様に考えられる。H・・・Aの距離が短くなるということは,D-Hの距離がAに引っ張られることで長くなっているとも考えられる。結果として,相互作用が強くなることで,
D-H距離が長くなる=D-Hの結合力 f が弱くなる
f が弱くなるということは式②から,波数が小さな値になることを意味している。
本ノートは続きます。
おひねりいただければ,両手を挙げて喜び配属学生に飯をおごりたいと思います。本ノートの課題は後日に追記します。
YouTubeによる授業動画も始めました。抑揚によって,重要な部分がより明確になるかもです。
ここから先は
¥ 100
Amazonギフトカード5,000円分が当たる
学生から大好評だった授業ノートを公開します。役立てていただければ幸いです。また,家でできる実験も書いていきますね。
