
モル濃度の計算
※期間限定無料。本記事は電子書籍出版後に有料記事になります。予めご承知おきください。2021/10月現在
溶液
濃度の話の前に、基本の基本をおさらいしておきましょう。それは、溶質、溶媒、溶液です。
溶質…溶けているもの(例)食塩
溶媒…溶かしているもの(例)水
溶液…溶質と溶媒、液全体(例)食塩水
食塩が溶けているものなので溶質、水が溶かしているものなので溶媒、食塩水が溶質と溶媒をあわせた溶液になります。

溶質の例は、食塩NaCl、硫酸H2SO4、塩化水素HCl、水酸化ナトリウムNaOHなどです。問題文によって少し数値が異なることはありますが、これらの分子量、式量は、NaCl=58.5、H2SO4=98、HCl=36.5、NaOH=40です。
溶液中に含まれる溶質の割合を濃度といいます。質量パーセント濃度、モル濃度などがあります。ポイントは濃さです。濃度は「濃さ」を表しています。
濃さを求めているところは、質量パーセント濃度、モル濃度も同じです。ちがいは、溶質や溶液の単位です。
質量パーセント濃度
質量パーセント濃度は、溶液中の溶質の質量を百分率〔%〕にしたものです。

質量パーセント濃度は、溶質、溶液ともに質量[g]です。絶対に忘れないようにしましょう。

モル濃度
モル濃度は、溶液1 L中の溶質の物質量molを表したものです。
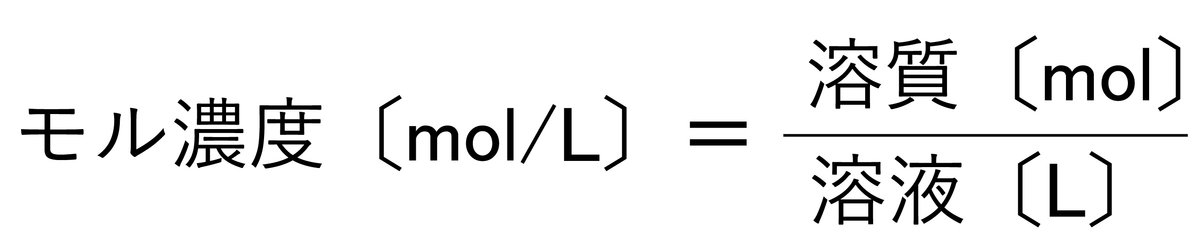
この式は、溶液1Lに溶質が何molあるかを表しています。モル濃度も質量パーセント濃度と同じように溶液、溶質が話題で、濃さを表しています。

くり返しになりますが、モル濃度は、溶液1L中の溶質の物質量molで表すので、濃度を換算する問題では、溶液1Lあたりで考えるとよいです。
モル濃度mol/Lを求める。

溶質の物質量molを溶液の体積Lでわるとモル濃度mol/Lになります。
問題 溶液4.0LにNaCl 2.0molが溶けている。モル濃度mol/Lを求めよ。
解答 2.0〔mol〕÷4.0〔L〕=0.50〔mol/L〕
問題 溶液0.50LにNaOH 1.5molが溶けている。モル濃度〔mol/L〕を求めよ。
解答 1.5〔mol〕÷0.50〔L〕=3.0〔mol/L〕
問題 溶液2.0LにNaCl 117gが溶けている。モル濃度mol/Lを求めよ。
解答 117〔g〕÷ 58.5〔g/mol〕=2.00〔mol〕
2.00〔mol〕÷ 2.0〔L〕=1.0〔mol/L〕
解説 58.5はNaClの式量。原子量Na=23 Cl=35.5
NaCl⇒Na+Cl=23+35.5=58.5
問題 溶液2.0LにNaOH 120gが溶けている。モル濃度mol/Lを求めよ。
解答 120〔g〕÷ 40〔g/mol〕=3.0〔mol〕
3.0〔mol〕÷ 2.0〔L〕=1.5〔mol/L〕
解説 40はNaOHの式量。原子量Na=23 O=16 H=1.0
NaOH⇒Na+O+H=23+16+1.0=40
溶質の物質量molを求める。
溶液の体積Lにモル濃度mol/Lをかけると、溶質の物質量molになります。
問題 1.5mol/LのHCl水溶液400mLに,HClは何molあるか。
解答 1.5〔mol/L〕×0.400〔L〕=0.60〔mol〕
問題 0.75mol/LのH2SO4水溶液300mLに,H2SO4は何molあるか。
解答 0.75〔mol/L〕×0.300〔L〕=0.225〔mol〕
濃度計算の型
濃度計算に出てくるモノは、溶質の質量g、溶質の物質量mol、溶液の質量g、溶液の体積Lの4つです。この4つに、密度g/cm3、分子量、質量パーセント濃度%、モル濃度mol/Lを絡めて計算をします。まず、これらを計算で扱うことに慣れましょう。「問題文で与えられているのは、溶質の物質量と溶液の体積だな。求めるのはモル濃度だから、、、」というように、モノと単位を意識します。
濃度計算の求め方は、大きくわけて4つしかありません。換える、モル濃度、質量パーセント濃度、希釈混合 です。
換える の求め方から見てみましょう。溶質の質量g、溶質の物質量mol、溶液の質量g、溶液の体積Lは、かけ算やわり算をすることで、モノと単位を換えることができます。
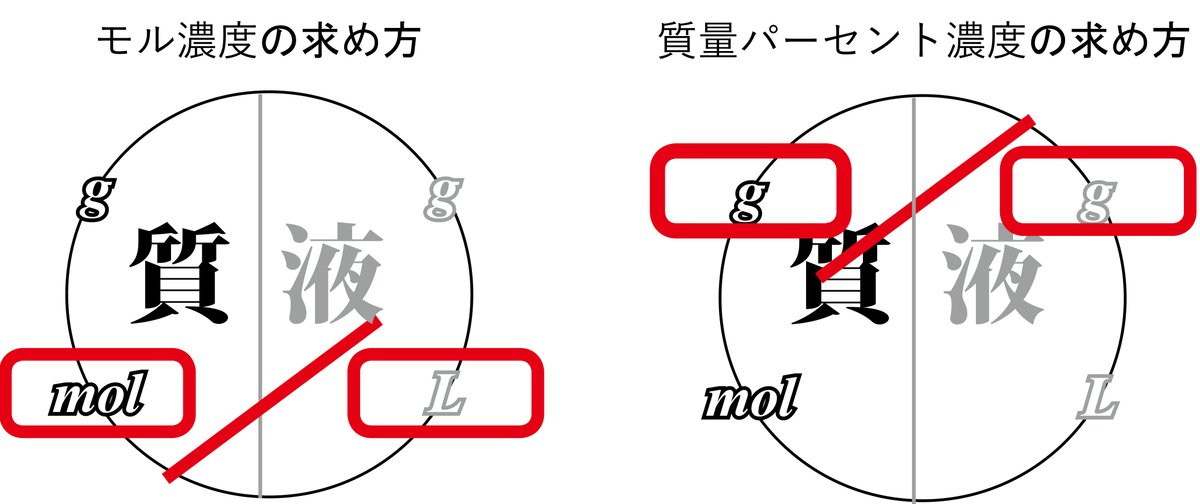
これらのかけ算やわり算をまとめた計算方法が、下図の濃度計算の型になります。質パー濃度は、質量パーセント濃度の略です。

図中の矢印は、それぞれ次のことを表しています。
溶液の質量gに質量パーセント濃度をかけると溶質の質量gになります。

溶液の体積Lにモル濃度mol/Lをかけると溶質の物質量molになります。

溶質の質量gを分子量(もしくは式量)でわれば溶質の物質量molになります。

溶液の体積mL(=cm3)に密度g/cm3をかけると溶液の質量gになります。

これらのかけ算やわり算が、基本の基本です。換える の求め方をしっかりとマスターしてください。
次は、モル濃度と質量パーセント濃度の求め方です。溶質を溶液でわることは同じですが、単位がちがいます。
最後に、希釈混合の求め方は3つのパターンがあります。溶質の質量gで立式、溶質の物質量molで立式、溶液の質量gで立式の3つです。

希釈混合とは、水でうすめる、もしくは溶液どうしを混ぜることです。このとき、何が変わって何が変わらないか、がポイントです。
たとえば、水でうすめたときです。溶媒である水の質量は変わりますが、溶質の質量gは変わりません。変わらないモノで立式します。左辺をうすめる前の溶質の質量g、右辺をうすめた後の溶質の質量gとして、=で結べば式が完成します。これが、上図の溶質の質量gで立式ということになります。
溶質の質量gではなく、溶質の物質量molが話題になっているときは、溶質の物質量molで立式します。
溶液どうしを混ぜたときは、変わるものは何でしょうか。溶質と溶媒の質量gはそれぞれ変わりますが、溶液の質量の和gは変わりません。
これらをまとめると、次のようになります。
①溶質の質量gで立式
うすめても溶質の質量gは変わらない。(もしくは)混ぜても溶質の質量の和gは変わらない。
②溶質の物質量molで立式
うすめても溶質の物質量molは変わらない。(もしくは)混ぜても溶質の物質量の和molは変わらない。
③溶液の質量gで立式
うすめても溶液の質量の和gは変わらない。(もしくは)混ぜても溶液の質量の和gは変わらない。
換える の求め方
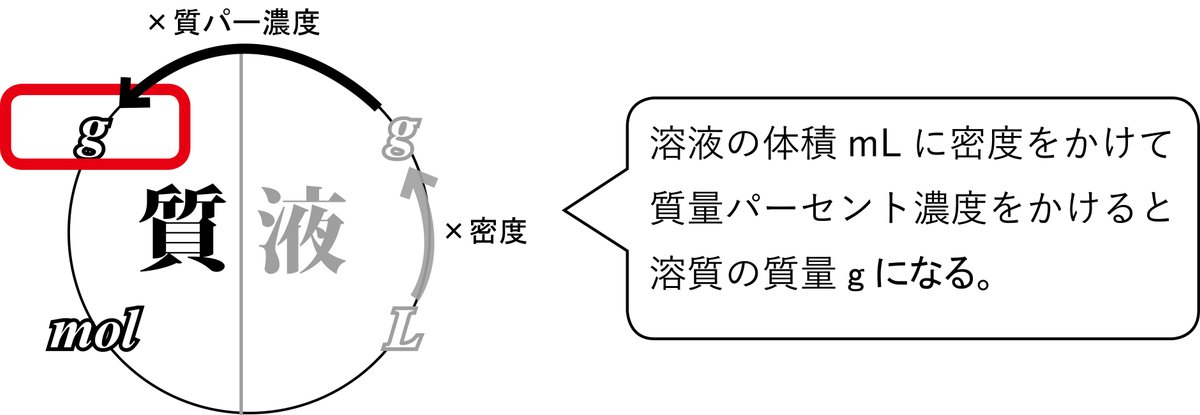
溶液の体積Lにモル濃度mol/Lをかけて、分子量(式量)をかけると溶質の質量gになります。
問題 2.0mol/LのH2SO4水溶液 500mL 中のH2SO4は何mol か(①)。また,H2SO4は何gか(②)。
解答 ① 0.500〔L〕× 2.0〔g/mol〕=1.0〔mol〕
② 1.0〔mol〕× 98〔g/mol〕=98〔g〕
解説 98はH2SO4の式量。原子量H=1.0 S=32 O=16
H2SO4⇒H×2+S+O×4=1.0×2+32+16×4=40
問題 0.50mol/LのNaNO3水溶液400mL中のNaNO3は何molか(①)。また,NaNO3は何gか(②)。
解答 ①0.400〔L〕×0.50〔g/mol〕=0.20〔mol〕
②0.20〔mol〕×85〔g/mol〕=17〔g〕
解説 85はNaNO3の式量。原子量 Na=23N=14O=16
NaNO3⇒Na+N+O×3=23+14+16×3=85

問題 密度が1.08g/cm3の希塩酸は、16%の塩化水素を含む。この希塩酸1L中には、何gの塩化水素が溶けているか。
解答

解説 溶質が何gあるかを求めよ、という意味です。溶液の体積cm3から溶質の質量gを求めましょう。溶液の体積mLに密度g/cm3(=g/mL)をかけて質量パーセント濃度をかけると溶質の質量gになります。
質量パーセント濃度 の求め方

溶質の質量gを溶液の質量gでわって100をかけると質量パーセント濃度になります。
問題 11.7gの塩化ナトリウムを水に溶かして500cm3とした水溶液がある。ただし、この塩化ナトリウム水溶液の密度を1.02g/cm3とする。この塩化ナトリウム水溶液の質量パーセント濃度を求めよ。
解答

解説 質量パーセント濃度を求める話です。質量パーセント濃度%は、溶質の質量gと溶液の質量gがわかれば、求まります。問題文から溶質gと溶液gが見当たらなければ、単位を換えていきましょう。溶質gと溶液gを用意します。溶液cm3に密度g/cm3をかけると溶液gになるので、これで計算ができます。
希釈混合 の求め方

問題 18mol/Lの濃硫酸(密度1.8g/cm3)を水で希釈し、2.4mol/L(密度1.14g/cm3)の希硫酸を300mLつくりたい。必要な濃硫酸の量は何mLか。また、加えた水(密度1.0g/cm3)の量は何mLか。
解答 必要な濃硫酸をx〔mL〕、加えた水をy〔mL〕とする。
x/1000×18=300/1000×2.4 ・・・①式
x×1.8 +y×1.0=300×1.14 ・・・②式
①式より、x=40〔mL〕
x=40を②式に代入して解くと、y=270〔mL〕
解説

問題文には、密度g/cm3、モル濃度mol/L、体積mLがあります。密度を用いれば、溶液の体積から溶液の質量を求められるので、混ぜても溶液の質量の和gは変わらない、で式が立てられます。
また、モル濃度と体積から物質量molを求められるので、うすめても溶質の物質量molは変わらない、で式が立てられます。
問題 98%濃硫酸の密度1.8g/cm3として、この濃硫酸のモル濃度を求めよ。H2SO4=98
解答

解説 モル濃度を求める話なので、溶質の物質量molを溶液の体積LでわればOKです。溶液cm3→溶液g→溶質g→溶質mol→溶液mol/Lの流れです。
溶液の体積Lが問題文にないのにモル濃度mol/Lを求める問題があります。このとき、『溶液を1Lとする』という一文を書きましょう。「えっ、勝手に1Lにしていいの?」と心配されるかもしれませんが、OKです。なぜなら、今求めているのは濃度だからです。くり返しますが、濃度は“濃さ”です。もし、溶液を1Lでなく、500mL、100mLにしても、“濃さ”は変わりません。モル濃度は、溶液1L中に溶質が何molあるかを表すものです。溶液1Lあたりで考えることで、計算の手間は省けます。問題文に溶液が○○mLと具体的な数値がなければ、『溶液を1Lとする』としてスタートさせましょう。
