丁度いい距離感
時事ネタではないですが、ちょうどこれを書くタイミングで
「ソーシャルディスタンス(social Distance)」
なるものが話題なので、前置きとして考えたいと思います。
そもそも日本ではどうも、「ソーシャルディスタンス」というように「名詞形」の言い方が広まっていますが、これはもともと「社会科学」の用語で、
①コミュニケーションを取るのにちょうどいい距離
②異なる階級や民族の間で生ずる距離感
の事を指していたそうです。
この度の、感染拡大防止策として言われているのは、正しくは
「ソーシャルディスタンシング(Social Distancing)」
という動名詞形で、「距離を空ける、または保つ事」という意味になります。
●適切な距離感が信頼を生む
言葉の問題はいいんですが、私はこれ、新型コロナの前から気になっていました。
時々いるんですよね、「異常に近い人」。
話をするときとか、物を渡すときとか、
「何もそんなに寄ってこなくても」
と思うくらい近づいてくる人いません?
友達同士でじゃれ合ったり、恋人同士ならまだしも、
(これも「公共の場」では然るべき距離感と言うのがあると思いますが)
特に身内でもなく親しい間柄でもない人が、必要以上に近づいているのを見ると、
「何か秘密にしたい事でもあるのかな」
などと、すごく疑念というか違和感を感じるんです。
ちなみに、コミュニケーションをメインの仕事としている人は、この意味での「ソーシャルディスタンス」にすごく気を使っているそうです。
初めてお目にかかるときは、その場の人の密度にもよりますが、
まず3~5mくらいまで近付いて
会釈などして存在を気付いてもらうように振る舞うのだそうです。
そして、相手が意識したら
1.5~2mくらいまで近付いて挨拶や名刺交換
などを行うそうです。この距離がソーシャルディスタンスです。
これ以上近くなると、
相手の「パーソナルスペース」に入る
事になるそうなのですが、これはある程度親しい間柄でないと、
パーソナルスペースに入ることで逆に信用を失う
事もあるそうです。
●ちょうどいい距離でエネルギが最小になる
そこまで計算をしなくても、話をしたり作業をしたり、何か人と関わるときに「丁度いい距離」ってありますよね。
遠すぎると、大声を出したり、物を渡したりするのに行ったり来たりするのにエネルギを使います。
近すぎると、息が臭わないかとか、身体が当たらないかとか気になったりして、やはりエネルギを使います。
ちょうどいい距離感で、消耗するエネルギが最小になるのです。
ということで、今回は「分子間力」の話です。(案外うまく着地しました。)
前回は、分子間力について解説が無いまま「分子間のポテンシャルエネルギ」が出てきてしまいました。
「ジュール・トムソン膨張」で温度変化が見られるのは、気体の密度が高く、分子間力が働くときであるという事でした。
●分子間力は静電気力
分子間に働く力が初めて明らかにされたのは、1877年、J. D. ファン=デル=ワールスの論文「気体と液体との連続転移性について」によります。化学者達に理論的な分子の存在が認められた、約17年後の事でした。
余談ですが、
van=der=Waals
はオランダ人です。オランダでは姓の前に、
英語の "of the" にあたる意味の称号
をつける人が多いのです。化学電池で有名な「J. H. ファント=ホフ」も
"van't" が "van het" の略
で、
"der" が「男性・単数」
"het" は「中性・単数」の名詞につける一格の定冠詞
です。
この論文で紹介されているのは、現在「ファン=デル=ワールス力」と呼ばれている分子間力です。
その後、L. C. ポーリングが1922年から、様々な「塩」や「錯体」の結晶構造を研究し始めました。中でも水素化合物の極性が特に強い事が分かり、「水素結合」が後に明らかになります。
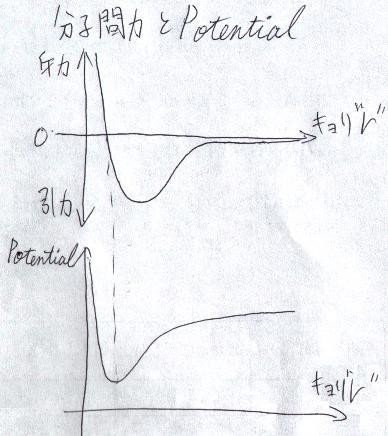
さて、分子間力の主な原因は「クーロン力(静電気力)」です。ファン=デル=ワールス力の中身を詳しく話すと複雑なのですが、これも
有極性分子の「誘起分極」
と、
瞬間的分極による「分散力(ロンドン力)」
があると言われています。
何れにしろクーロン力なので、距離に依存する力が働きます。という事は、
分子間力による「ポテンシャル・エネルギ」
が考えられるということになるわけです(下図)。
●人間らしい分子
このような形になるのは、
有極性分子も遠くから見ると、全体では電気的に中性
であり、
ある程度距離が離れると急に弱く
なるからです。また、
近距離では電子殻同士の「斥力」が効いてくる
ということです(下図)。
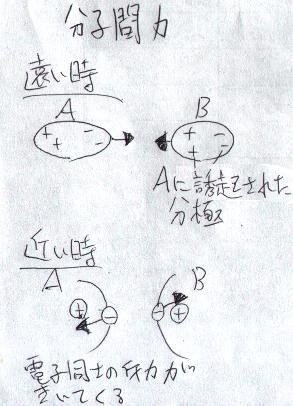
これを考えると、
「結晶でない固体の塊」が安定している状態
(後注:ファン=デル=ワールス結晶と言うのもあるそうです)
と言うのは、
分子間力によるポテンシャルの最小になるところ
(つまり、分子間力が"0"になるところ)
の状態であると言えます。また、
液体が「流動性」を持つのに「表面」を持つ
のは、
分子同士が「結晶」を作るほど近い距離にはないが、
分子間力が働くくらいの距離にある状態である
ことから説明できます。
ちなみに、この時形成する表面を「自由表面」と言い、自由表面はそれを形成する為のエネルギーが最小になるような形を取ります。
このように、分子同士も
近付きすぎるとマイナス(電子)の面が目立って、
お互い遠ざけ合う(斥力)ようになり、
適切な距離よりちょっと遠いと、近づきたく(引力)なり、
あまり遠いとお互い関係(引力や斥力)が無くなる
という事が分かり、実に人間らしい振る舞いをするものだと思います。
