SLip・FLiRT・KP.2 の中和回避、感染力および膜融合における特徴(2024年3月)
Characteristics of JN.1-derived SARS-CoV-2 subvariants SLip, FLiRT, and KP.2 in neutralization escape, infectivity and membrane fusion
元→https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00849-0

SUMMARY
ワクチン接種を受けた個人、重症急性呼吸器症候群コロナウイルス 2 (SARS-CoV-2) に感染した患者、またはクラス III モノクローナル抗体 S309 における抗体による中和について、JN.1 由来のサブバリアント SLip、FLiRT、および KP.2 を調査します。
JN.1 と比較して、SLip、KP.2、特に FLiRT は、二価ワクチン接種および BA.2.86/JN.1 波回復期ヒト血清に対する耐性が高まっています。XBB.1.5 一価ワクチン接種ハムスター血清は、FLiRT および KP.2 を強力に中和しますが、SLip に対する効率は低下しています。すべてのサブバリアントは S309 に対して耐性があり、JN.1 と比較して感染性、細胞間融合、およびスパイク処理が低下しています。
モデル化により、SLip の L455S と F456L は ACE2 のスパイク結合を減少させ、FLiRT と KP.2 の R346T はスパイク結合を強化することが明らかになりました。これら 3 つの変異は、D339H とともにスパイクの重要なエピトープを変化させ、これらのサブバリアントの中和に対する感受性の低下を説明するものと考えられます。
私たちの調査結果は、JN.1 サブバリアントの中和耐性の増加を強調しており、現在の XBB.1.5 単価ワクチンでも十分な保護を提供できるものの、将来のワクチン製剤では JN.1 スパイクを免疫原として考慮する必要があることを示唆しています。
INTRODUCTION
パンデミックが続く中、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)の進行中の進化と、スパイクタンパク質の生物学、特に中和抗体(nAbs)に対する感受性への影響を追跡することは非常に重要です。パンデミックは、2023年夏の終わりに、当時優勢だった変異体XBB.1.5と比較して30を超えるスパイクタンパク質の変異を特徴とする変異体であるBA.2.86の出現により転換点を迎えました。
幸いなことに、BA.2.86 は無数の変異にもかかわらず、免疫回避の増加は示さず、XBB 系統の変異体と比較して回復期血清およびワクチン接種血清中の抗体によってよりよく中和されました。しかし、BA.2.86 から進化したその後の変異体に対する懸念が高まっています。これには、2023 年後半に出現し、BA.2.86 と比較して単一スパイク変異 L455S を特徴とする JN.1 が含まれます。この単一の変異により、JN.1 は 2023 年後半から 2024 年 5 月にかけて世界中で優勢になりました。
L455S は、JN.1 のヒト ACE2 に対する親和性を低下させる一方で、nAbs に対する免疫回避およびウイルス伝染を強化します。JN.1 の出現以来、L455、F456、R346 など、スパイクの主要部位に変異を持つ一連の変異体が特定されています (図 1A)。当初は、XBB.1.5 のバックボーンに L455F および F456L 変異を持つ、いわゆる FLip 変異体が出現したため、「FLip」という名前が付けられました。これらの部位は引き続きホットスポットであり、F456L 変異を伴う JN.1 スパイクタンパク質を持つ「SLip」と呼ばれる株が出現しました。「S」は、JN.1 の特徴である L455S 変異を指します。

最近では、SLip のバックボーンにさらに R346T 変異を持つ FLiRT 変異体の出現が見られました。別の FLiRT 変異体である KP.2 は、S1 に R346T と F456L の両方を含み、S2 に V1140L 変異を含みます。現在、JN.1 は世界中で優位性を失いつつあり、KP.2 やその他の JN.1 由来の変異体に急速に取って代わられています (図 1B)。
JN.1 は、効率は低下するものの、XBB.1.5 一価ワクチン接種血清によって中和できることが示されています。しかし、JN.1 系統の亜変異体で得られた追加のスパイク変異が、特に秋と冬の季節が近づいている中で、この COVID-19 ワクチン製剤の有効性に影響を与えるかどうかは、現時点では不明です。
この研究では、SLip、FLiRT、KP.2 が、親 JN.1 と並行して、(1) 一価祖先スパイク (野生型 [WT]) mRNA ワクチンを少なくとも 2 回接種し、二価 WT + BA.4/5 ブースターを 1 回接種した個人、(2) 一価組換えムンプスワクチン XBB.1.5 を 2 回接種したハムスター、および (3) オハイオ州コロンバス (米国) での BA.2.86/JN.1 感染波中に感染した個人からの血清によって中和される能力を調査しました。これらの分析は、祖先の D614G と並行して行われ、抗原地図作成分析によって補完されています。
また、293T-ACE2 および CaLu-3 細胞におけるこれらの変異体の侵入と融合性、およびスパイクの処理と細胞膜上での発現を特徴付けました。
重要なことに、私たちの調査は、これらの JN.1 系統の変異体に対する免疫原としての XBB.1.5 と JN.1 の比較に焦点を当てており、スパイクタンパク質の生物学的特性に劇的な変化が生じたかどうか、および中和回避とウイルス感染性への影響を判断しています。
RESULTS
JN.1由来変異体が293T-ACE2およびCaLu-3細胞へのウイルス侵入および感染性に与える影響
まず、関心のある SARS-CoV-2 スパイクを持つ擬似型レンチウイルスが、ヒト ACE2 を過剰発現する 293T 細胞 (293T-ACE2) およびヒト肺上皮細胞株 CaLu-3 に侵入できる効率を調査しました。
我々が以前に報告したように、BA.2 および XBB.1.5 を含む初期オミクロン株は、293T-ACE2 細胞において祖先 D614G 変異体と比較して高い感染性を示しました。ただし、BA.2.86 および JN.1 では感染性がわずかに低下しました (図 1C)。ここで、FLiRT はこの細胞株で JN.1 と同様の感染性を示しましたが、KP.2 (p > 0.05)、特に SLip (p < 0.05) は JN.1 と比較してわずかに低下しました (図 1C)。
以前に示したように、Omicron 変異体は D614G と比較して CaLu-3 細胞での感染性が著しく低下していますが、BA.2.86 では顕著に増加しています。しかし、ここでは JN.1、SLip、FLiRT、および KP.2 が BA.2.86 と比較して CaLu-3 細胞で低い感染性を示し (すべて p < 0.0001)、SLip はグループの中で最も低い感染性を示し、JN.1 と比較して約 2.2 倍減少しました (p < 0.001) (図 1D)。

全体的に、最近出現した FLiRT および KP.2 サブ変異体、特に SLip は、以前の変異体 BA.2 および XBB.1.5、およびその親 BA.2.86 と比較して CaLu-3 細胞で低い感染性を示しています。
親株のJN.1と比較して、新しい変異体によるSLip、FLiRT、KP.2のCOVID-19二価ワクチン接種ヒト血清に対する耐性が増加
選択された変異体による中和からの回避の程度をテストするために、まず、オハイオ州立大学ウェクスナー医療センターの医療従事者(HCW)のコホートから採取した血清を使用しました。このコホートは、一価mRNAワクチン(WT)を少なくとも2回接種し、さらにWTとBA.4/5スパイクの両方を含む二価ワクチンを少なくとも1回接種しました(n = 10)(図2Aおよび2B)。中和は、血清の連続希釈液と感染した 293T-ACE2 細胞を混合した擬似型レンチウイルスを使用して測定し、各変異スパイクの 50% での中和力価 (NT50) を決定しました。

以前のすべてのオミクロン株で示されているように、JN.1 は祖先の D614G と比較して力価が著しく低く、53.3 倍減少しました (p < 0.0001)。SLip、FLiRT、および KP.2 も力価が大幅に低下し、NT50 はそれぞれ D614G より 56.3 倍 (p < 0.0001)、86.4 倍 (p < 0.0001)、および 76.7 倍 (p < 0.0001) 低くなりました。注目すべきことに、SLip は JN.1 と同等の力価を示したのに対し、FLiRT と KP.2 は力価の減少がより顕著で、それぞれ JN.1 より 1.62 倍 (p > 0.05) と 1.43 倍 (p > 0.05) 低かった (図 2A と 2B)。
全体的に、FLiRT と KP.2 は、親株 JN.1 および関連株 SLip と比較して、二価ワクチン接種血清中の nAbs からの逃避が増加しています。
XBB.1.5一価ワクチン接種ハムスター血清中の抗体はFLiRTとKP.2を強力に中和するが、SLipに対する効率は低下
次に、XBB.1.5 単価組換えおたふく風邪ワクチンを 2 回接種したゴールデン シリアン ハムスターの血清を使用して中和を測定しました (n = 10) (図 2C および 2D)。

以前に示したように、ハムスターの血清は、BA.2.86 を含む最新オミクロン株の一部に対して、先祖の D614G と比較して強力な nAb 力価を示しました。JN.1 の中和力価も増加し、計算された NT50 値は 6,613 で、D614G の 22.5 倍でした (p < 0.0001)。SLip、FLiRT、KP.2 の NT50 値は、それぞれ D614G と比較して 9.9 倍 (p < 0.0001)、15.8 倍 (p < 0.0001)、15.6 倍 (p < 0.0001) 増加し、JN.1 と比較してそれぞれ 2.3 倍、1.4 倍、1.4 倍減少しました (それぞれ p > 0.05) (図 2C および 2D)。
これらの新しい JN.1 由来の変異体に対する XBB.1.5 一価ワクチン接種ハムスター血清の全体的な高い力価は、二価ワクチン接種グループが示す一般に低い抗体力価とは対照的でしたが (図 2A~2D)、各変異体の下降傾向は SLip を除いて同様でした。
SLip、KP.2、特にFLiRTは、親JN.1と比較して、BA.2.86/JN.1波回復期血清による中和に対する感受性が低下
自然感染中に誘導される抗体による変異体中和を調べるために、オハイオ州コロンバス(米国)で2023年11月から2024年2月までのBA.2.86/JN.1感染波中にCOVID陽性となった個人の血清を使用しました(n = 7)(図2Eおよび2F)。4人はコロンバスの救急隊員とその家庭内接触者(n = 4、P1~P4)で、3人はOSUメディカルセンターに入院した集中治療室(ICU)のCOVID-19患者(n = 3、P5~P7)でした。すべての患者は異なる用量のmRNAワクチンを接種しており、サンプルは最後のワクチン接種から34~892日後に採取されました(表S1)。

SLip、FLiRT、KP.2 に対する力価はさらに減少し、それぞれ D614G と比較して 13.6 分の 1 (p < 0.001)、15.2 分の 1 (p < 0.001)、12 分の 1 (p < 0.01) に減少しました。二価コホートと同様に、FLiRT 変異体は JN.1 と比較して力価が最も低下しました (1.70 分の 1 の減少) が、その差は統計的に有意ではありませんでした (p > 0.05) (図 2E および 2F)。
サンプル P5、P6、P7 は、オハイオ州立大学ウェクスナー医療センターの ICU に入院した患者から採取されました (図 2F、表 S1)。注目すべきことに、これらの患者のうち 2 人、P6 と P7 は、JN.1 系統の変異体に対して高い力価を示しました。P6 は 77 歳の男性で、モデルナ社の単価ワクチンを 1 回、ファイザー社の二価ワクチンを 1 回接種し、最後のワクチン接種から 434 日後にサンプルを採取しました。P7 は 46 歳の女性で、モデルナ社の一価ワクチンを 3 回、モデルナ社の二価ワクチンを 1 回接種し、最後のワクチン接種から 334 日後にサンプルを採取しました。
P5 は 49 歳の男性 ICU 患者で、モデルナ社の一価ワクチンを 2 回しか接種していません;サンプルは最後のワクチン接種から 892 日後に採取され、JN.1、SLip、FLiRT、KP.2 に対する nAb 力価は 3 人の ICU 患者の中で最も低いものでした。
全体的に、BA.2.86/JN.1 回復期患者の血清は、最新の JN.1 系統の亜種 SLip、FLiRT、KP.2 を効果的に中和しましたが、FLiRT に対する効率はやや低下しました。
クラスIII mAb S309はSLipまたはFLiRTを中和しない
パンデミック制御対策のもう1つの重要な戦略は、治療用モノクローナル抗体(mAb)の使用であり、これはCOVID-19パンデミック、特に2020年から2021年の間に実証されました。ただし、結合がSARS-CoV-2スパイク上の単一のエピトープに限定されているため、単一の変異によってその有効性が簡単に損なわれ、開発されたmAbのほとんどがオミクロンに対して完全に無効になります。特に、私たちと他の研究者は以前、クラスIII mAb S309の結合が、BA.2.75.2、CA.3、CH.1.1、BA.2.86、およびJN.1を除くオミクロンのサブバリアントに対してほぼ維持されることを示しました。SLipとFLiRTの両方がS309による中和を完全に回避したことから、この傾向は続いているようです(図3Aおよび3B)。

S309 耐性にとって重要な保存された D339H 変異を保持する KP.2 については、この実験は実行しませんでした (説明を参照)。
抗原地図作成分析により、XBB.1.5一価ワクチン接種群とBA.2.86/JN.1感染群におけるSLip、FLiRT、KP.2の抗原距離の減少が示される
これらの変異間の関係をさらに解明するために、抗原地図分析を実施しました (図 4)。簡単に言うと、この分析は、抗原単位 (AU) として表示される各変異体 (丸) と各血清サンプル (四角) の力価の間の相対的な差に基づいて中和力価を変換します。

予想されるように、JN.1 サブバリアントは二価コホートの祖先 D614G とは抗原的に異なり、SLip、KP.2、およびそれらの親 JN.1 と比較して FLiRT が最も特徴的です (図 4A)。
XBB.1.5 一価ワクチン接種ハムスター グループでは、D614G と JN.1 変異体の間の距離は、二価コホートの約 6 AU から約 4 ~ 5 AU まで著しく減少しています。変異体同士もより密集しており、SLip は FLiRT および KP.2 からわずかに離れています (図 4B)。
BA.2.86/JN.1 波コホートでも同様の現象が見られ、二価および XBB.1.5 一価コホートと比較して、全体的な抗原距離が短くなっています (約 3~4 AU)。また、JN.1 由来のサブ変異体は大部分が密集しており、親 JN.1 は SLip、FLiRT、および KP.2 から比較的離れています (図 4C)。
SLip、FLiRT、KP.2スパイクは、JN.1と比較して、融合性、表面発現、および処理がわずかに低下
これまでの研究では、多くの オミクロン株のスパイク生物学に、膜融合性や処理など、顕著な変化がみられました。
ここでは、新しい JN.1 由来のサブバリアントのスパイクが細胞膜間の融合を引き起こす能力 (図 5A~5D)、細胞膜上での発現 (図 5E および 5F)、およびウイルス産生細胞におけるフリンによる S1/S2 サブユニットへの処理 (図 5G) を特徴付けました。

他の オミクロン株と同様にJN.1 は D614G と比較して細胞間融合活性が著しく低下しました。この下降傾向は、293T-ACE2 細胞と CaLu-3 細胞の両方で FLiRT と KP.2 で維持され、SLip ではさらに維持されました (D614G と比較して p < 0.0001)。この下降傾向は、293T-ACE2 細胞と CaLu-3 細胞の両方で FLiRT と KP.2 で維持され、SLip ではさらに維持されました (D614G と比較して p < 0.0001)。
擬似型ベクターを生成するために使用された 293T 細胞の表面上のスパイクの発現が測定されました。JN.1由来の亜変異体は、祖先のD614Gと比較して発現が2~3倍減少していることが分かりました(p < 0.0001)。また、FLiRTは親のJN.1よりも大幅に低いことがわかりました(p < 0.0001)(図5Eおよび5F)。
トランスフェクトされた293T細胞の溶解液でスパイクのS2サブユニットを調べ、S2/S比を定量化してフーリン切断効率の程度を決定したところ、SLip、FLiRT、およびKP.2スパイクの処理効率はJN.1と比較してわずかに低下していることがわかりました(図5G)。

全体として、細胞間融合およびスパイク処理の減少は、293T-ACE2およびCaLu-3細胞における感染性の減衰と一致しています(図1Cおよび1D)。
SLip、FLiRT、KP.2スパイクの変異の構造モデリング
スパイク変異がこれらの新しい変異体に与える影響をより深く理解するために、受容体のエンゲージメント、スパイク構造の安定性、および抗体の相互作用の変化を調べるために相同性モデリングを実行しました。
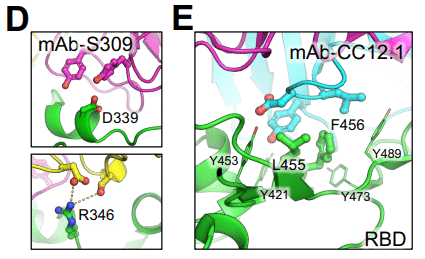
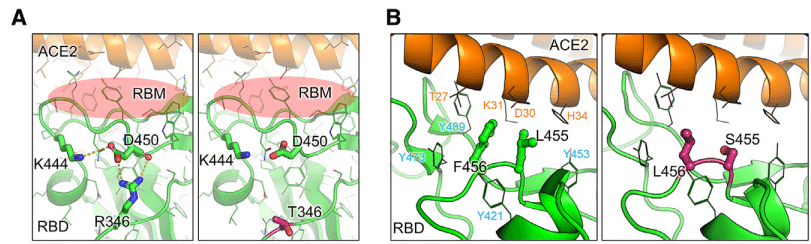
受容体結合モチーフ (RBM) の残基 R346 は、親 BA.2.86 系統 (N450D) に存在する残基 D450 と水素結合と塩橋の両方を形成できます。この相互作用により、残基 D450 とそのループが RBM から引き離され、受容体との結合プロセスが妨げられる可能性があります。R346T 変異はこの相互作用を無効にし、残基 D450 と RBM の張力を解放して、ACE2 結合親和性を高める可能性があります (図 6A)。

逆に、RBM 内の中心に位置する残基 L455 と F456 は、Y421、Y453、Y473、および Y489 によって形成される疎水性ケージに包まれています。この疎水性コアは、ACE2 結合にとって重要です。
JN.1 株および SLip 株に見られる F456L や L455S などの変異は、RBM の局所的疎水性を低下させ、ACE2 残基 T27、K31、D30、および H34 との相互作用を減少させ、ACE2 に対するウイルス親和性を低下させる可能性があります (図 6B)。

さらに、構造分析により、残基 V1104 がスパイクステム領域上の P1090、F1095、および I1115 とともに疎水性コアに位置していることが示されています。V1104L 変異は空洞を埋めて局所的な疎水性相互作用を改善し、融合前のスパイク構造を安定化させる可能性があります。これにより、融合後の構造へのスパイクタンパク質の遷移効率が低下します (図 6C)。

残基 D339 および R346 は、S309 を含むクラス III 抗体のエピトープ領域内にあります (図 6D)。これらの位置の変異は、BA.2.86 系統とその後の系統 FLiRT および KP.2 に存在しており、抗体中和からのウイルス回避を強化する可能性があります。
最後に、RBM 上の残基 F456 と L455 は、CC12.1 などのクラス I RBD nAbs によって頻繁に標的にされ (図 6E)、サイズと化学的特性の変化を伴う L455S および F456L 変異は、S309 および CC12.1 からのウイルスの回避を効果的に可能にしました。
DISCUSSION
SARS-CoV-2 スパイクタンパク質の進化は、COVID-19 パンデミックの制御に大きな課題をもたらし続けています。
BA.2.86 は、以前の変異体と比較してワクチン接種を受けた血清および回復期血清における nAbs の回避が増加したとは証明されていませんが、その後の変異体、つまり JN.1 は回避が増加しています。
最近のオミクロン株は、特に L455、F456、R346 などの重要な部位でスパイクに収束変異を蓄積しています。最近の SARS-CoV-2 オミクロン変異体は、特に L455、F456、R346 などの重要な部位でスパイクに収束変異を蓄積しています。
興味深いことに、ACE2 結合に悪影響を与えるにもかかわらず、JN.1 と BA.2.86 を区別する単一の L455S 変異は、免疫回避を著しく高め、この変異体が世界中で優勢になりました。
ここでは、F456L (SLip) と R346T (FLiRT) が、テストしたすべてのコホートにおいて、親 JN.1 と比較して、JN.1 由来の変異体が nAbs からさらに逃れるのに寄与していることを示しています (図 2A~2F)。

FLiRT は、二価免疫を受けた医療従事者と BA.2.86/JN.1 波の患者で nAbs 力価の最大の減少を示しましたが、これはおそらく、両コホートの免疫原つまり WT・BA.4/5・BA.2.86/JN.1 に R346T 変異が欠けていることによるものと考えられます (図 2A、2B、2E、および 2F)。
この考えは、XBB.1.5 単価ハムスター血清サンプルによって FLiRT と KP.2 の両方が SLip よりもよく中和され、XBB.1.5 スパイク免疫原が重要な R346T 変異を抱えているという発見によってさらに裏付けられています。この変異は FLiRT と KP.2 の両方に存在し、SLip には存在しません (図 2C および 2D)。
私たちと他のグループは以前、R346T が mAb 結合と免疫回避の重要な部位であることを実証しました。R346T 変異のもう 1 つの利点は、L455S および F456L 変異によって引き起こされる ACE2 に対する親和性の喪失を補うことです (図 6B)。
L455S および F456L 変異はいずれも RBD の疎水性接触を減少させ、ACE2 の結合を低下させます。R346T は RBM の立体構造サポートを強化することでこの減少を補います (図 6A)。
これらの効果の結果は、SLip と比較して FLiRT および KP.2 のウイルス感染性が増加していることに見られます (図 1C および 1D)。

特に、KP.2 変異体は V1104L の効果の恩恵を受けており、疎水性内部空洞充填によってスパイク立体構造をさらに安定化させます (図 6C);これにより、融合前スパイクと融合後スパイクの移行が効率が悪くなり、感染性が阻害される可能性があります。

FLiRT と SLip はどちらも、親の変異体 BA.2.86 および JN.1 と同様に、クラス III mAb S309 による中和に耐性があることが分かりました。したがって、KP.2 を含むこれらの変異体はすべて、クラス III 抗体エピトープの中央に位置する D339H 変異を有しており、S309 結合を無効にする立体障害を生み出しています (図 6D)。SLip 変異体は、XBB.1.5 単価ハムスターコホートで最も低い nAb 力価を示しましたが、これはおそらく、L455S を含む親 JN.1 の上に F456L 変異が存在するためでしょう。
F456L 変異は、FLip を含むいくつかの以前の循環変異体で発生しており、強力な免疫回避に寄与しています。この変異は、循環変異体の間で頻度が増加していることは注目に値します。
F456L はクラス I mAbs が標的とする主要なエピトープを変化させることで免疫回避を媒介しますが (図 6E)、他の変異 (L455S など) もクラス I エピトープの破壊に寄与します。注目すべきことに、F456L は XBB.1.5 スパイク免疫原には存在せず、これが XBB.1.5 単価ハムスターコホートで SLip の nAb 力価が最も低かった理由を説明できます。
ただし、XBB.1.5 単価ハムスター血清の力価は依然として検出限界をはるかに上回っており、SLip を除いて JN.1 からわずかに低下しただけであったことから、免疫原としての XBB.1.5 スパイクは依然として JN.1 系統の変異体に対して潜在的に効果的な保護を提供できることが示唆されます。さらに、XBB.1.5 単価ハムスター血清では、JN.1 系統のスパイク間の距離が短く、これもまた、免疫原としての XBB.1.5 スパイクが WT + BA.4/5 二価ワクチンよりも幅広い抗体反応を刺激できることを示唆しています (図 4A および 4B)。BA.2.86/JN.1 波コホートは、XBB.1.5 コホートと同様の抗原マッピングを示し、D614G と JN.1 サブバリアント間の距離はさらに短く、JN.1 バリアント自体も密集していました (図 4C)。
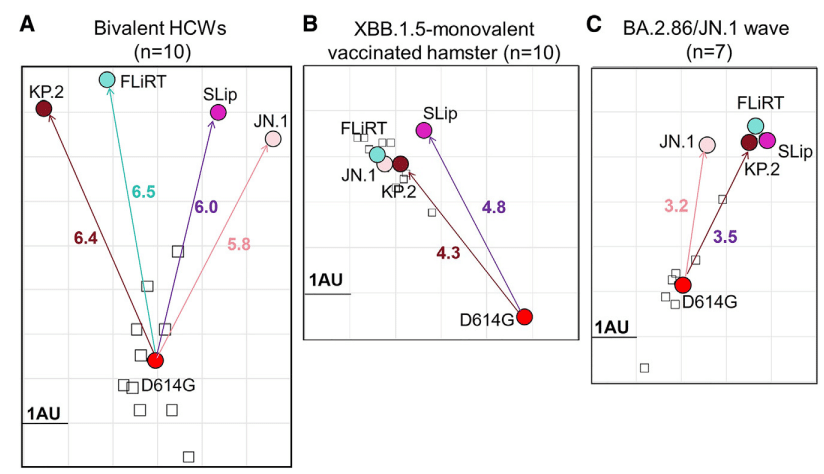
この反応パターンは、他のグループによって提示されたデータと似ており、JN.1 感染と事前の免疫化を組み合わせると、BA.5、XBB、または XBB.1.5 のブレイクスルー感染と比較して、JN.1 バリアントに対する優れた nAb 力価が刺激されることが示されています。他のグループの結果と同様に、私たちのコホートの抗原距離が短いことから、JN.1 スパイクは JN.1 系統の変異体に対する nAbs を刺激するより効果的な免疫原として機能でき、またおそらくそうすべきであることが示唆されます。全体的に、JN.1 変異体 (SLip を除く) に対する免疫原としての XBB.1.5 と BA.2.86/JN.1 スパイクの違いはごくわずかであるように見えます (図 2C ~ 2F、4B、および 4C)。
3 セットの血清で、KP.2 スパイクの nAb エスケープが FLiRT および SLip と比較してさらに強化されたという循環における KP.2 の優位性の増加ができる証拠は見つかりませんでした (図 2E および 2F)。しかし、KP.2 は、パパイン様プロテアーゼ (PLP) ドメインの外側の非構造タンパク質 3 (nsp3) における T2283I 変異を含む、SARS-CoV-2 ゲノムの他の領域に追加の変異を獲得しました。 これはウイルスの複製を促進し、宿主の免疫応答を調節すると考えられます。本物の KP.2 および関連する JN.1 系統の変異体を使用したさらなる調査は、パンデミックにおいて KP.2 に JN.1 および他のサブバリアントよりも選択的優位性を与える可能性のあるメカニズムを区別するのに役立つでしょう。
この研究で得られたもう 1 つの興味深い、そしていくぶん意外な発見は、新たに出現した JN.1 サブバリアントのほとんど、特に SLip が、CaLu-3 細胞における感染性と細胞間融合活性が親 JN.1 と比較して低下しているという点です (図 1 および 5)。フローサイトメトリーおよびウェスタンブロッティング分析により、ウイルス産生細胞の細胞膜上のバリアントスパイクタンパク質の発現レベルが低下していること、および細胞内でのフリンによるスパイク処理の効率が低下していることが明らかになりました。これらの発見を合わせると、感染性と融合表現型の増加が観察された理由を部分的に説明できます。
注目すべきことに、スパイク生物学のこれらの側面は、CaLu-3 細胞におけるスパイク処理、融合性、および/または感染性の増加を示す親 BA.2.86 や、以前に優勢だった XBB.1.5 や EG.5.1 などのオミクロン株の一部とは著しく異なります。スパイク生物学におけるこれらの違いのメカニズムと意味についてはさらに調査が必要ですが、私たちの研究結果では、F456L、R346T、V1140L などの変異の一部は、抗体回避には有益であるものの、スパイク生物学の他の側面に悪影響を与える可能性があることが示唆されており、免疫回避とウイルスの適応度の間の重要なトレードオフが浮き彫りになっています。
私たちの研究は、本物の SARS-CoV-2 ではなく、擬似型レンチウイルスを使用して実施されたことを強調したいと思います。2 つのシステムには、ウイルスタンパク質成分や、レンチウイルスの場合はウイルス糖タンパク質が細胞膜上に、本物の SARS-CoV-2 の場合はトランスゴルジ体に組み込まれるなどの違いがあります。
これらの違いにもかかわらず、私たちのグループと他のグループは、擬似型レンチウイルスシステムが本物の SARS-CoV-2 の感染性と中和性を正確に再現できることを以前に実証しています。
COVID-19の世界的パンデミックは終息したと宣言されましたが、SARS-CoV-2は進化を続け、ワクチン接種や感染によって引き起こされた宿主免疫から逃れています。私たちのデータは、最近のJN.1系統の変異体は免疫逃避と生物学的特性が変化しており、進化し続けることを示唆しています。私たちの研究結果は、SARS-CoV-2の新たな変異体の継続的な追跡と特性評価の重要性を強調しています。パンデミックのこの段階では、ほとんどの人が少なくとも1回、場合によっては数回ウイルスに曝露しており、したがって複雑な免疫原性背景を持っているため、このような研究は特に重要です。
将来のワクチン開発では、JN.1 および/または密接に関連したスパイクを潜在的な免疫原として考慮する必要がありますが、XBB.1.5 一価ワクチンは依然としてある程度の防御を提供できる可能性があります。
Limitations of Study
私たちの実験では、本物の感染性 SARS-CoV-2 株ではなく、目的のスパイクタンパク質を持つシュードタイプのレンチウイルスを利用します。ただし、レンチウイルス モデルは、生きた SARS-CoV-2 の中和を正確に反映していることが証明されており、COVID-19 ワクチンの有効性を評価するのに役立つことが示されています。さらに、この作業の適時性により、より高度なバイオセーフティ レベル 3 (BSL3) の徹底的な実験を実施することはできません。
私たちのコホート、特に BA.2.86/JN.1 回復期患者のサンプル サイズは、機関審査委員会 (IRB) の規則と制限により制限されています。ただし、他の同様の研究は同様のサイズのコホートで行われており、私たちも過去に同様のコホート サイズで信頼性の高い結果を発表しています。また、IRB の制限により、私たちのヒトコホートには、性自認、祖先、人種、民族、社会経済的地位などの人口統計情報が欠落しており、これらはすべて、この研究で提示されたデータに影響を及ぼす可能性があることを認識しています。サンプルサイズが比較的小さいため、性別や年齢が nAb 応答に与える影響について意味のある発言をすることはできず、これらの分析は含まれていませんでした。とはいえ、これらのコホートのデータは、SARS-CoV-2 の生物学に関する重要な洞察を提供し、将来の COVID-19 ワクチン製剤にタイムリーなガイダンスを提供します。
相同性モデリングは本物のクライオ電子顕微鏡構造ほど正確ではなく、主要な変異が ACE2 相互作用と抗体関与に与える影響については、さらなる構造研究による確認が必要であることを認識しています。
以下省略。
