BA.2.86/JN.1 および EG.5.1/HK.3 の系統特異的な病原性・免疫回避・ウイルス学的特徴(2024年10月)
Lineage-specific pathogenicity, immune evasion, and virological features of SARS-CoV-2 BA.2.86/JN.1 and EG.5.1/HK.3
SARS-CoV-2 BA.2.86/JN.1 および EG.5.1/HK.3 の系統特異的な病原性、免疫回避、およびウイルス学的特徴
Abstract
スパイクに L455S 変異を追加した SARS-CoV-2 JN.1 は、親の変異体 BA.2.86 と比較すると、以前のすべての変異体よりも優勢となり、優勢な循環変異体となりました。最近の研究では、SARS-CoV-2 JN.1 の免疫抵抗性が調査されましたが、世界的優位性には追加の要因が寄与していると推測されていますが、今日まで解明されていません。
ここでは、分化した一次ヒト鼻上皮細胞 (hNEC) において、SARS-CoV-2 JN.1 は BA.2.86 よりも感染性が高いことがわかりました。メカニズム的には、BA.2.86 よりも SARS-CoV-2 JN.1 が感染性を獲得したことは、L455S によってもたらされる侵入効率の向上と hNEC でのスパイク切断の改善に関連していることを実証しています。構造的には、S455 は、ACE2H34 の BA.2.86 スパイクと比較して、JN.1 スパイクタンパク質の ACE2 への結合モードを変更し、隣接する残基との水素結合の数を増やすことで JN.1 スパイクタンパク質の内部構造を修正しました。これらの発見は、単一の変異 (L455S) が hNEC へのウイルスの侵入を促進し、免疫回避性を高め、SARS-CoV-2 JN.1 の強力な伝染性に寄与していることを示しています。
さらに、SARS-CoV-2 BA.2.86/JN.1 と EG.5.1/HK.3 の間の in vitro および in vivo のウイルス学的特性を評価し、2 つの Omicron サブ系統の主要な系統固有の特徴を特定して、Omicron の抗原性、伝染性、病原性に関する理解に貢献します。
Introduction
SARS-CoV-2 オミクロンは 2021 年後半に出現し、強力な免疫回避、弱毒化された病原性、および著しく増加した伝染性が特徴です。ウイルスは進化を続け、人類の間でとなっています。2023年半ば、SARS-CoV-2の主な変異株は、XBB.1.5、XBB.1.16、EG.5.1などの組み換えXBB系統の子孫でした。その後、2023年7月にBA.2の子孫であるBA.2.86が検出され、BA.2.86スパイクにはBA.2のものと比較して30以上の変化が含まれているため、国際的な注目を集めました。
最近の研究では、BA.2.86 は免疫回避性が強く、気管支腺癌 Calu3 細胞への感染に効果的であるが、BA.2 と比較すると病原性は弱まっていることが実証されています。その後まもなく、BA.2.86の子孫系統であるJN.1が2023年8月25日に初めて検出されました。
JN.1 は BA.2.86 と比較してスパイクタンパク質に 1 つの変化 (L455S) しか追加されていないにもかかわらず、急速に普及し、BA.2.86 やその他の XBB 子孫に取って代わり、世界中で優勢な変異体となっています。急速に拡散が進んでいるため、WHO は JN.1 を親系統の BA.2.86 とは別の関心対象変異体 (VOI) として分類しています。最近の研究では、JN.1 の免疫回避能力が特徴付けられています。
しかし、JN.1 のその他の特徴、たとえば固有の病原性、プロテアーゼの使用、細胞侵入、スパイク切断、ヒトの鼻腔上皮細胞への感染性などは、十分に調査されていません。本研究では、JN.1 の in vivo および in vitro ウイルス学的特徴を包括的に調査し、その結果を BA.2、BA.2.86、XBB.1、EG.5.1、および HK.3 の結果と比較しました。
本研究では、JN.1 スパイクの L455S 変異によってもたらされる免疫回避性の向上に加えて、細胞侵入の利点が得られることを明らかにしました。さらに、本研究の結果は、BA.2 の子孫変異体 BA.2.86/JN.1 と XBB の子孫変異体 EG.5.1/HK.3 の間に明確な系統固有の特徴があることを示しました。
Results
Evolution of SARS-CoV-2 JN.1
※省略
Immune evasion of SARS-CoV-2 JN.1
BA.2.86/JN.1 および EG.5.1/HK.3 とその祖先変異体 BA.2 および XBB.1 の免疫回避特性を評価するために、これらの変異体に対してモノクローナル抗体 (mAbs) パネルに対する擬似ウイルス中和アッセイを実施しました。オミクロン亜変異体は mAbs の顕著な回避を示すことが知られています。
最近の研究と一致して、臨床的に承認された mAb LY-CoV140424 は、親変異体 BA.2 を除くすべてのテストされたオミクロン変異体の擬似ウイルスに対して不活性であることがわかりました (図 2a)。さらに、SD1 ドメインを標的とする mAb S3H3 は、BA.2、XBB.1、EG5.1、および HK.3 擬似ウイルスに対して有効性を示しましたが、BA.2.86 および JN.1 擬似ウイルスに対する中和活性は限られていました (図 2a)。

注目すべきことに、mAb S309 は評価したすべての変異体に対して有効性を維持しましたが、BA.2.86 および JN.1 と比較して XBB 子孫変異体に対してより有効であり、これは XBB.1、EG.5.1、HK.3、BA.2.86、および JN.1 擬似ウイルスに対する IC50 値がそれぞれ 0.104 μg/ml、0.073 μg/ml、0.126 μg/ml、2.440 μg/ml、および 1.993 μg/ml であったことからも明らかです (図 2a)。
興味深いことに、SA55 は BA.2.86 および JN.1 擬似ウイルスを含むすべてのテスト済み Omicron 変異体に対して有効性を維持しました (図 2a)。
次に、XBB または JN.1 のブレイクスルー感染を経験する前に不活化ワクチンを接種した人の血漿を用いて、これらのオミクロン変異体の体液性免疫回避を評価しました。我々は2つのコホートを募集した。1つはワクチン接種後にBA.5のブレイクスルー感染を起こし、その後JN.1に再感染したグループ(n = 16)で、もう1つはBA.5のブレイクスルー感染後にXBBに再感染したグループ(n = 16)である(補足表1)。
最近の研究と一致して、XBB 再感染からの血清は中和パターンの変化を示し、BA.2 擬似ウイルスに対する幾何平均力価 (GMT) は 1454 と最も高かった (図 2b および補足図 2a)。これらの血清は、XBB の子孫 (XBB.1、EG.5.1、HK.3) 擬似ウイルス、および BA.2.86 および JN.1 擬似ウイルスに対する力価が著しく低下していました (図 2b)。

JN.1 擬似ウイルスは、BA.2.86 擬似ウイルスと比較して免疫回避が著しく向上しており、BA.5 感染後に XBB に再感染した人の GMT が 1.6 倍低下していることからもそれがわかります (図 2b)。
同様に、HK.3 擬似ウイルスは、EG.5.1 擬似ウイルスと比較して免疫回避が著しく向上しており、このコホート内で GMT が 1.4 倍低下していることからもそれがわかります (図 2b)。
このコホートの血清中和データは、抗原マップを作成するためにさらに利用されました。出現した亜変異体 JN.1 と BA.2.86 はクラスターを形成しましたが、HK.3 と EG.5.1 は別のグループを構成しました (図 2c)。これらの亜変異体は祖先株から著しく分岐しており、抗原の類似性だけでなく、先行株と比較して抗体耐性も高いことが示されています。

第 2 コホートでは、JN.1 によるブレイクスルー感染を経験した個人は、BA.2、BA.2.86、および JN.1 擬似ウイルスに対する中和力価が高く、GMT が 2500 を超えていることが分かりました。しかし、XBB.1、EG.5.1、および HK.3 擬似ウイルスに対する中和力価は、著しく強力に誘発されなかったことから、XBB の子孫変異体は JN.1 から抗原的に離れていることが示唆されます (図 2d および補足図 2b)。

この観察と一致して、抗原マッピングにより、BA.2、JN.1、および BA.2.86 のクラスター化が明らかになりましたが、HK.3 と EG.5.1 は別のクラスターを形成しました。特に、XBB.1 は両方のクラスターから離れており、XBB サブバリアント内での大きな進化的分岐を示しています (図 2e)。
Antigenicity of SARS-CoV-2 JN.1
これらのオミクロン亜種の抗原性をさらに評価するために、ハムスターに SARS-CoV-2 BA.2、BA.2.86、JN.1、XBB.1、EG.5.1、HK.3 を感染させ、感染後 16 日目に感染ハムスターから血清を採取しました。
結果は、JN.1 および BA.2.86 擬似ウイルスの両方が、SARS-CoV-2 BA.2、XBB.1、EG.5.1、HK.3 に感染したハムスターから採取した血清に対して顕著な耐性を示したことを示しました (図 2f)。興味深いことに、SARS-CoV-2 JN.1 および BA.2.86 感染は主に自己向き抗体反応を引き起こしましたが、それらの祖先株 BA.2 および XBB サブ系統はより広範囲の保護を誘発しました (図 2f および補足図 3)。
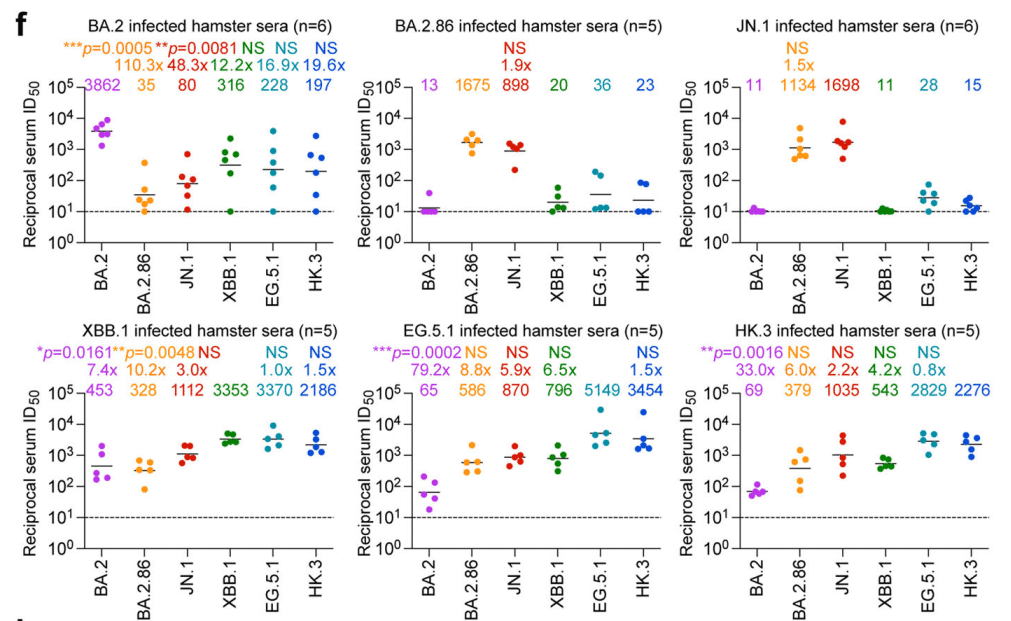
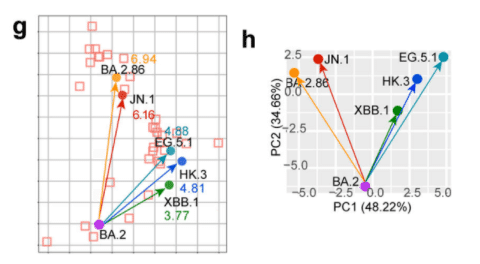
ハムスター血清データに基づく抗原距離マップ (図 2g) および主成分分析 (PCA) マップ (図 2h) は、再び、しかしより明確に、JN.1 と BA.2.86 をグループ化し、XBB.1、HK.3、および EG.5.1 は別のグループを形成し、SARS-CoV-2 サブバリアント間の交差反応性がそれらの進化的関係と一致していることを示しています。
さらに、示されたスパイクトリマーで免疫されたマウスから得られた血清を使用して、これらの SARS-CoV-2 変異体の体液性免疫回避を評価しました。マウス血清を使用した中和アッセイでは、JN.1 および BA.2.86 擬似ウイルスは、XBB.1、HK.3、および EG.5.1 擬似ウイルスと比較して、BA.2 および XBB.1 スパイク免疫血清に対してより顕著に耐性があることが示されました (図 2i)。感染したハムスターで得られた結果と一致して、JN.1 および BA.2.86 スパイク免疫は主に自己向き抗体反応を引き起こしました (図 2i および補足図 4)。

これらの結果を合わせると、JN.1 および BA.2.86 は抗原的に XBB 亜系統とは異なることがわかります。
Virological features of SARS-CoV-2 BA.2.86/JN.1 and EG.5.1/HK.3 in vitro
SARS-CoV-2 BA.2.86/JN.1 のウイルス学的特徴を EG.5.1/HK.3 と比較して調査するため、まずスプリット GFP ベースの細胞間融合アッセイを実施し、293T 細胞におけるスパイクタンパク質の融合性を評価しました。結果から、BA.2.86 および JN.1 スパイクは、XBB の子孫変異体 XBB.1、EG.5.1、および HK.3 のスパイクよりも細胞間融合を効率よく媒介していないことがわかりました (図 3a)。

興味深いことに、BA.2.86 および JN.1 スパイク媒介融合を比較すると、JN.1 スパイクの L455S 変異により融合性が 3.4 倍大幅に増加することが分かりました (P = 0.0325)。同様に、EG.5.1 と HK.3 スパイクを介した融合を比較すると、HK.3 スパイクの L455F 変異により融合性が 2.2 倍有意に増加しました (P < 0.0001) (図 3a)。フローサイトメトリーで 293T 細胞上のスパイクタンパク質の表面発現を評価したところ、L455S と L455F を介した融合の増加は、発現したスパイクタンパク質の表面発現の増加によるものではないことがわかりました (補足図 5)。
さらに、293T 細胞と Calu3 細胞間の細胞間融合を調査したところ、L455S と L455F はそれぞれ 1.5 倍と 1.2 倍融合を促進しましたが、その差は統計的有意性には達しませんでした (補足図 6)。
並行して、B.1、BA.2、BA.2.86、JN.1、XBB.1、EG.5.1、および HK.3 のスパイクタンパク質を運ぶ VSV ベースの擬似ウイルスを使用して擬似ウイルスの侵入を評価しました。
結果は、L455S 変異が VeroE6-TMPRSS2、VeroE6、Caco2、および 293T 細胞での擬似ウイルスの侵入を大幅に促進したことを示しました (図 3b)。これは、これらの細胞タイプでの BA.2.86 擬似ウイルスの侵入よりも JN.1 擬似ウイルスの侵入が増加したことで証明されました。同様に、HK.3 スパイクの L455F 変異は、VeroE6 および Calu3 細胞での EG.5.1 よりも HK.3 の擬似ウイルスの侵入を大幅に促進しました (図 3b)。

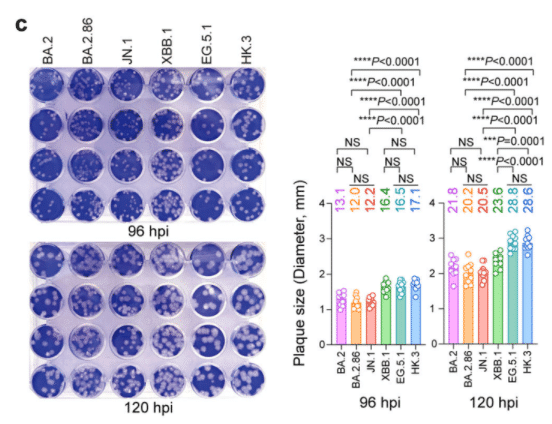
次に、SARS-CoV-2 BA.2、BA.2.86、JN.1、XBB.1、EG.5.1、HK.3 を VeroE6 細胞に感染させ、感染後 96 時間および 120 時間でプラーク形成を定量化しました。
BA.2 の子孫変異体は、感染後 96 時間および 120 時間でプラーク形成が XBB の子孫変異体よりも小さいことがわかりました。感染後 96 時間および 120 時間の両方で、BA.2.86 および JN.1 のプラークサイズは、EG.5.1 および HK.3 よりも大幅に小さかったです (図 3c)。
さらに、B.1、BA.2、BA.2.86、JN.1、XBB.1、EG.5.1、およびHK.3のスパイクタンパク質を運ぶ擬似ウイルスのプロテアーゼ使用を評価しました。評価した細胞は、擬似ウイルスの導入前に、汎セリンプロテアーゼ阻害剤であるカモスタットまたは汎カテプシン阻害剤であるE64Dで2時間処理しました。
SARS-CoV-2 の侵入が主に細胞膜で起こる VeroE6-TMPRSS2 細胞と Calu3 細胞では、BA.2.86 および JN.1 擬似ウイルスの侵入は、EG.5.1 および HK.3 擬似ウイルスよりもカモスタット処理に対して著しく感受性が高いことがわかりました (図 3d および補足図 7)。

同時に、SARS-CoV-2 が主にエンドソーム侵入経路から侵入する 293T 細胞では、EG.5.1 および HK.3 擬似ウイルスの侵入は、BA.2.86 および JN.1 擬似ウイルスよりも E64D 処理に対してより敏感でした (図 3d および補足図 7)。
これらの結果と一致して、両方の侵入経路をサポートする Caco2 細胞では、Camostat 処理は BA.2.86 および JN.1 擬似ウイルスの侵入に対してより効果的でしたが、E64D 処理は EG.5.1 および HK.3 擬似ウイルスの侵入に対してより効果的でした (図 3d および補足図 7)。
全体的に、これらの結果は、ウイルス侵入経路の系統特異的な優先性を示しており、BA.2 子孫変異体 BA.2.86 および JN.1 は、XBB 子孫変異体 EG.5.1 および HK.3 よりも TMPRSS2 媒介細胞表面侵入経路に依存していることを示しています。さらに、L455S および L455F 変異はどちらも、親変異体と比較して、JN.1 および HK.3 の細胞間融合と擬似ウイルス侵入を促進します。
Virological features of SARS-CoV-2 BA.2.86/JN.1 and EG.5.1/HK.3 in human nasal epithelial cells
我々と他の研究者らの結果から、JN.1スパイクのL455S変異とHK.3スパイクのL455F変異は、親変異体BA.2.86およびEG.5.1と比較して免疫回避の強化に寄与していることが明らかになった。しかし、SARS-CoV-2 JN.1 のヒトへの高い伝染性が、初代ヒト鼻上皮細胞 (hNEC) における適応度の向上にも関連しているかどうかはまだ不明です。
この目的のため、まず、比較グループとして BA.2、BA.2.86、XBB.1、EG.5.1、および HK.3 を含め、Calu3 および hNEC における SARS-CoV-2 JN.1 の複製を評価しました。
Calu3 細胞における疑似ウイルスの侵入とプロテアーゼ依存性に関する私たちの研究結果と一致して (図 3b および図 3d)、SARS-CoV-2 BA.2.86 および JN.1 の Calu3 細胞への侵入と複製は、初期の時点 (感染後 2 および 24 hpi) では EG.5.1 および HK.3 よりも効率的でした。
ただし、SARS-CoV-2 EG.5.1 および HK.3 は Calu3 細胞で効率的に複製されました。72 hpi までに、SARS-CoV-2 EG.5.1 および HK.3 のウイルス複製中間体、サブゲノムエンベロープ (sgE) 遺伝子コピーは BA.2.86 および JN.1 を上回りました (図 4a)。

興味深いことに、感染後の同じ時点で、SARS-CoV-2 JN.1 は、BA.2 (4.7 倍、P < 0.0001)、BA.2.86 (2.7 倍、P < 0.0001)、XBB.1 (8.6 倍、P < 0.0001)、EG.5.1 (6.0 倍、P < 0.0001)、HK.3 (3.0 倍、P < 0.0001) など、評価された他の Omicron 変異体よりも hNEC で大幅に効率的に複製されました (図 4b)。

72 hpi での差異がウイルス侵入レベルの相違に関連しているかどうかを理解するために、JN.1 の hNEC への疑似ウイルス侵入を評価し、その結果を BA.2.86、EG.5.1、および HK.3 の結果と比較しました。
複製結果と一致して、BA.2.86 疑似ウイルスは EG.5.1 疑似ウイルスおよび HK.3 疑似ウイルスよりも高い効率で hNEC に侵入し、一方、JN.1 疑似ウイルスは BA.2.86 疑似ウイルス (1.6 倍、P = 0.0082)、EG.5.1 疑似ウイルス (3.9 倍、P < 0.0001)、および HK.3 疑似ウイルス (3.2 倍、P < 0.0001) よりも確実に hNEC に侵入することがわかりました (図 4c)。

hNEC への疑似ウイルス侵入における L455S の役割を正確に特定するために、XBB.1、EG.5.1、および HK.3 スパイクタンパク質の背景に L455S を導入しました。
データによると、L455S の存在により、hNEC への XBB.1、EG.5.1、および HK.3 疑似ウイルスの侵入がそれぞれ 7.7 倍、1.3 倍、1.9 倍増加しました (補足図 8)。

さらに、JN.1 による hNEC 侵入の増加についてさらに詳しく知るために、hNEC での JN.1 のプロテアーゼ使用とスパイク切断を評価しました。
hNEC における SARS-CoV-2 BA.2.86 と JN.1 の感染はどちらも TMPRSS2 に依存し、カテプシンには依存していないことがわかりました。これは他の Omicron 変異体と一致していますが、BA.2.86 と JN.1 の TMPRSS2 使用効率には限定的な差があります (図 4d)。

次に、感染後 48 hpi で hNEC 細胞溶解物を採取し、SARS-CoV-2 JN.1 のスパイク切断を調べました。
興味深いことに、SARS-CoV-2 JN.1 スパイクの S1/S2 での切断は BA.2.86 の切断よりも効率的である一方、BA.2.86 のスパイク切断は EG.5.1 および HK.3 の切断よりも効率的であることがわかりました (図 4e、f)。これは hNEC への疑似ウイルスの侵入結果と一致しています。

さらに、24 hpi で採取した SARS-CoV-2 BA.2.86、JN.1、EG.5.1、および HK.3 に感染した hNEC の免疫染色を行い、ヌクレオカプシド (N) シグナルを定量化しました。
我々の結果では、SARS-CoV-2 JN.1 に感染した hNEC では、BA.2.86、EG.5.1、または HK.3 に感染した細胞と比較して、N シグナルが有意に高いことが検出された (図 4g、h)。

これらの結果を合わせると、hNEC では BA.2.86 と JN.1 が XBB の子孫変異体 EG.5.1 および HK.3 よりも適応度が高いことが示され、L455S 変異によって hNEC で JN.1 の感染性がさらに高くなったことが、ヒトにおける他の変異体に対する優位性に寄与している可能性があることがわかる。
Cryo-EM structures of SARS-CoV-2 BA.2.86/JN.1 spike in complex with ACE2
JN.1 スパイクが BA.2.86 スパイクと比較して ACE2 と異なる方法で結合するかどうかを評価するために、BA.2.86 S (6 P) および JN.1 S (6 P) 三量体の安定化融合前エクトドメインと複合体を形成した ACE2 の構造をクライオ電子顕微鏡 (cryo-EM) で個別に決定しました (図 5)。精製したスパイク三量体を ACE2 と 1:1.2 のモル比で混合し、10 分後にクライオ EM 研究用にガラス化しました。

クライオ電子顕微鏡分析により、BA.2.86 スパイク ACE2 (S-ACE2) と JN.1 S-ACE2 複合体はどちらも、3 つの ACE2 に結合した 3 つのアップ RBD (図 5a、c) という 1 つのコンフォメーション状態しか持たないことが明らかになりました。これは、それぞれ 2.70 Å と 3.06 Å の解像度で決定されました (補足図 9、10)。
スパイク-ACE2 インターフェースの密度を向上させるために、BA.2.86 と JN.1 の NTD_RBD_ACE2 領域をそれぞれ 3.29 Å と 3.07 Å に局所的に精密化し (図 5b、d および補足図 9、10)、RBD-ACE2 領域の明確なモデル構築を可能にしました。BA.2.86 S-ACE2 と JN.1 S-ACE2 のインターフェースは、L455S 変異が局所的な変化を引き起こした点を除いて、ほぼ同一です。
BA.2.86 スパイク ACE2 構造では、ACE2H34 の側鎖には 2 つの代替配向があります (図 5e)。
好ましい配向 A では、ACE2H34 はスパイク L455 とファンデルワールス相互作用を確立し、スパイク Y453 と水素結合を形成します (図 5e)。配向 B では、ACE2H34 の側鎖は反対方向にスイングし、S494 と水素結合を形成します (図 5e)。

重要なのは、JN.1 スパイク ACE2 構造では、L455S 変異が ACE2H34 とスパイク L455 の相互作用を切断するため、ACE2H34 の側鎖は配向 B にのみ存在することです (図 5f)。
どちらの方向でも、spikeQ493 は ACE2H34 とファンデルワールス相互作用を形成します (図 5e、f)。要約すると、ACE2H34 は BA.2.86 スパイクに結合し、その側鎖は 2 つの代替配向をとるが、JN.1 スパイク-ACE2 構造では、ACE2H34 の側鎖が S494 と水素結合を形成すると、配向 B で相互作用が発生する。
BA.2.86、JN.1、WT、XBB.1、およびEG.5.1変異体のRBD-ACE2インターフェース領域をさらに構造解析したところ、ほとんどの変異体はACE2H34に1つのコンフォメーションしか持たず、BA.2.86に類似した結合モードを持たないことが明らかになりました。 これが、BA.2.86. SとACE2の間の強い結合力を説明している可能性があります(図5g)。特に、JN.1 RBDL455Sの特定の変異部位に隣接する領域では、他の変異体と比較して大きな違いがありました。
この領域では、RBDS455は隣接する残基F456、Q493、P491、およびY453と5対の水素結合を形成できますが、他の変異体のRBDL455はP491およびY453と2対の水素結合しか形成できません(補足図11)。

構造解析に基づくと、L455S 変異の結果として水素結合ネットワークが変化すると推測されます。これが、スパイクタンパク質で BA.2.86 と比較すると JN.1 には 1 つの L455S 変異しか追加されていないにもかかわらず、JN.1 の無効性が強化されている理由を説明できるかもしれません。
Intrinsic pathogenicity of SARS-CoV-2 BA.2.86/JN.1 and EG.5.1/HK.3 in vivo
※省略
Discussion
2023年半ば、SARS-CoV-2の循環型変異株は、XBB.1、XBB.1.5、XBB.1.6、EG.5.1などのXBBの子孫が優勢でした。2023年7月に出現したBA.2の子孫であるBA.2.86は、細胞膜経路の侵入効率が向上したにもかかわらず、XBBの亜系統に勝つことはできませんでした。興味深いことに、BA.2.86 の子孫変異体である JN.1 は、BA.2.86 と比較してスパイクに L455S 変異を追加で含み、他のすべての循環変異体を急速に置き換えて、世界中で優勢な変異体になりました。最近の研究 (現在の研究を含む) では、JN.1 の免疫回避が強化されていることが実証されており、これが JN.1 の急速な増加に寄与していると考えられています。しかし、ヒトにおける JN.1 の高い伝染性が他の要因とも関連しているかどうかは、まだ解明されていません。
今回の研究では、JN.1 は hNEC において BA.2.86 よりも高い感染性を持つことがわかりました。メカニズム的には、BA.2.86 よりも JN.1 が獲得した感染性は、L455S によってもたらされる侵入効率の向上と hNEC におけるスパイク切断の改善に関連していることが実証されました。これらの結果は、JN.1 の強力な伝染性が、獲得した免疫逃避に加えて、hNEC における感染性の増加と関連していることを示しています。
構造的には、ACE2H34 は BA.2.86 スパイクに結合し、その側鎖は 2 つの代替配向をとる一方、JN.1 スパイク-ACE2 構造では、ACE2H34 の側鎖が S494 と水素結合を形成するときに、L455S 変異が ACE2H34 とスパイク L455 間の相互作用を切断するため、相互作用は 1 つの配向で発生することが実証されました。さらに、他の変異体と比較した場合、JN.1 RBDL455S の特定の変異部位に隣接する領域に有意な違いがあることが分かりました。具体的には、RBDS455 は隣接する残基 F456、Q493、P491、および Y453 と 5 対の水素結合を形成できるのに対し、他の変異体の RBDL455 は P491 および Y453 と 2 対の水素結合しか形成できないことがわかりました。
JN.1 RBDL455S 領域における水素結合数の増加と内部構造の修正により、JN.1 が BA.2.86 よりも感染力が高まった理由が説明できるかもしれません。
ただし、この変化がウイルスと宿主の相互作用をどのように変え、JN.1 の感染力を高めたのかという正確なメカニズムは、今後の研究で評価される必要があります。
BA.2.86 と JN.1 は BA.2 系統に由来し、EG.5.1 と HK.3 は XBB 系統の子孫であるため、一連の in vitro および in vivo 実験で、これら 2 つの独立して進化した Omicron 亜系統のウイルス学的特性を比較しました。
EG.5.1 と HK.3 は mAb S3H3 と S309 に対して依然として感受性がある一方、BA.2.86 と JN.1 は S3H3 の中和効果を逃れ、S309 に対して部分的にしか感受性がないことがわかりました。これは最近の研究結果と一致しています。BA.5 のブレイクスルー感染に続いて XBB の再感染が起こったコホートでは、XBB の再感染によって BA.2 の子孫バリアント (BA.2.86 および JN.1) と XBB の子孫バリアント (XBB.1、EG.5.1、HK.3) の両方に対して限定的な中和が誘発されることが分かりました。評価したサブバリアントの中で、最も低い GMT は HK.3 に対して検出されましたが、これは L455F と F456L の二重 FLip 変異によるものと考えられます。
JN.1 は依然として主要な循環変異体であるため、JN.1 のブレイクスルー感染時の血清中和を評価しました。JN.1 のブレイクスルー感染は BA.2、BA.2.86、JN.1 に対して高い GMT を誘導しましたが、XBB.1、EG.5.1、HK.3 に対しては中和力価が大幅に低下することがわかりました。
同様に、JN.1 に感染したハムスターや JN.1 スパイクでワクチン接種したマウスは、主に BA.2.86/JN.1 系統に対する自己向き抗体反応を誘発し、他の XBB サブ系統との双方向交差反応性が大幅に低下しました。
これらを合わせると、抗原的に離れた Omicron サブ系統間の限定的な交差防御は、将来の COVID-19 ワクチンの開発において考慮する必要があります。
hNEC では、BA.2 子孫変異体 (BA.2.86 および JN.1) が XBB 子孫変異体 (EG.5.1 および HK.3) よりも感染に明らかに有利であることが結果から示されました。これは、ウイルスの複製率の高さ、疑似ウイルスの侵入の堅牢性、スパイクの切断の改善、感染細胞数の増加によって証明されました。XBB.1、EG.5.1、および HK.3 スパイクの背景に L455S 変異をさらに導入することで、L455S 変異が hNEC における 3 つの変異体すべての疑似ウイルス侵入を強化できることを実証しました。さらに、JN.1.7、KP.2、KP.3、JN.1.18、LB.1 など、最新の監視対象変異体 (VUM) はすべて L455S を保有しており、L455S が適応度の向上に及ぼす影響をさらに示唆しています。
最近の多くの研究では、さまざまな細胞タイプに対する JN.1 の感染性が調査されています。疑似ウイルスの調製、ウイルス培養、細胞培養のプロトコルの違いが、得られる結果に影響を及ぼす可能性があることに注意することが重要です。したがって、説得力のある結論に達するには、研究室間の知見を比較対照する必要があります。
興味深いことに、感染した動物の肺では、BA.2 の子孫変異体 (BA.2.86 および JN.1) による感染は、XBB の子孫変異体 (EG.5.1 および HK.3) と比較して、ウイルスの複製が少なく、組織学的変化が軽減されました。これは、ハムスターにおける BA.2.86 と EG.5.1 の複製と病原性を比較した以前の知見と一致しており、これらの変異体が持つ非スパイク変異に関連している可能性があります。
まとめると、我々の研究は、JN.1スパイクのL455S変異がhNECにおけるJN.1の感染を促進し、それがヒト間でのJN.1の高い伝染性に寄与している可能性があることを示しています。さらに、我々の研究結果は、BA.2子孫変異体BA.2.86/JN.1とXBB子孫変異体EG.5.1/HK.3の間の系統特異的なウイルス学的特徴を示しており、これらの特徴は、それらの伝染性と病原性を理解する上で役立ちます(補足図12)。

以下省略。
