辺縁から表舞台へ: 自然免疫の 50 年間の進歩(2024年3月)
From periphery to center stage: 50 years of advancements in innate immunity
辺縁から表舞台へ: 自然免疫の 50 年間の進歩
元→From periphery to center stage: 50 years of advancements in innate immunity: Cell
Summary
過去 50 年間、免疫学の分野では、コペルニクス的革命のようなことが起こりました。
長い間、免疫学者は主に、リンパ球の非常に特異的な活動に関与する、いわゆる適応免疫に関心を持っていました。
しかし、免疫のもう一方の部門、いわゆる「自然免疫」は無視されてきました。
Cell の 50 周年を記念して、私たちは自然免疫のプロセスと構成要素を概説し、この分野の現代状態につながる独創的な貢献を追跡しました。
自然免疫は適応免疫に加わり、体の防御や恒常性、病理学を研究するすべての人にとって関心の中心となっています。
私たちは現在、自然免疫受容体とその下流シグナルを標的とした治療が、感染症や炎症性疾患、がんに対して大きな期待を寄せる時代に入りつつあります。
Introduction
「innate (先天的)」という用語は、生まれながらに持っているものとして定義されますが、免疫の文脈では、 これは、生物の生命の初めから存在し、感染の過程で遺伝子再構成を受けない免疫系の部分を指すために使用されてきました。
歴史的に、これは「適応免疫」という用語とは対照的です。適応免疫には、リンパ球として知られる身体への脅威に「適応」して対処するために遺伝子再構成を受ける特殊な免疫細胞によって行われるプロセスが含まれます。
適応免疫では、免疫系は、B 細胞および T 細胞と呼ばれるリンパ球のクローンを増殖させ、感染後にさらに多くのリンパ球が存在するようにすることで、侵入した病原体に反応します。
これは、制御された安全な方法で抗原特異的 T 細胞と B 細胞の増殖を促進するワクチンの仕組みでもあり、後で感染が発生した場合に免疫系が迅速に対応できるようにします。
「免疫」という用語自体は、この適応能力を指しています。ラテン語の「immunis」に由来し、さらなる感染から「免除」を意味しています。
現在、病原体に対する体の防御にはリンパ球に加えて多くの細胞や因子が関与していることがわかっており、これらは一般に「innate immunity(自然免疫)」という用語に分類されています。
しかし、いわゆる先天的プロセスは、主にエピジェネティックな、異なるタイプの記憶を骨髄細胞に生成する可能性があります。
これは、骨髄細胞の記憶と真のリンパ球の記憶を区別するために「訓練された免疫」と呼ばれています(ボックス 1 を参照)。
このため、一般に白血球として知られるすべての白血球が免疫応答において役割を担っていることを認識する必要がありました。リンパ球は適応免疫を行い、骨髄細胞は自然免疫を行います。
用語が過度に単純化されているように見えるのは、1974 年当時、自然免疫の構成要素が粗雑で専門化されていないように見えたという事実を反映しています。
抗体、次いで T 細胞受容体で明らかになりつつある特異性とは異なり、自然免疫因子の保護効果ははるかに広範囲であり、1 つの病原体や抗原に特異的ではありませんでした。
これらは、皮膚や粘膜部位の上皮のバリア機能(多くの種類の微生物が組織に侵入するのを防ぎます)、侵入微生物を捕捉する粘液、細菌を分解する体液中のリゾチーム、胃の酸性などの物質などに関与します。
1970年代に注目された自然免疫の最も洗練された構成要素は補体で、これは細菌または細菌の溶解を引き起こす抗原/抗体複合体に反応して活性化される一連のタンパク質です。
補体のルーツは自然免疫分野のまさに初期に遡りますが、近年再び関心が高まっています。
補体系には、古典経路、代替経路、およびレクチン経路という 3 つの異なる経路があります。
補体系の成分は肝臓によって生成され、血液由来の病原体の検出、炎症の活性化、および除去に関与します。 (Trouw、Daha、West et al. でレビュー済み)。
自然免疫と宿主防御における補体の役割 - ScienceDirect
Th1応答の調節における細胞内補体の予期せぬ役割 - ScienceDirect
最近、いわゆる「コンプロソーム」の説明により、補体系の基本的な機能に再びスポットライトが当てられています。
コンプロソームは、代謝、細胞生存、遺伝子制御など、免疫系の細胞内の基本的にすべての生理学的プロセスに関与する補体系の細胞内成分を表します。
たとえば、単球およびマクロファージにおける C3 および C5 の細胞固有の発現は、インターロイキン (IL)-1β の産生に関与しています。
ちょうど昨年、Cell 誌に 2 つの研究が発表され、このシステムに関する新たな洞察が得られました。
Desaiらによる最初の研究は、補体のC5a成分が真菌感染時の食細胞の生存とエフェクター機能の駆動においてどのように重要な役割を果たすかを示しています。
Wuらによる2番目の研究では、補体が腸の健康の重要な調節因子であることが示唆されています。
彼らは、腸の細胞が局所的に補体成分C3を生成し、共生微生物を保存して健康な腸を確保しながら、侵入微生物に対する保護を提供することを示しています。
補体系は1世紀以上前に発見され、 そして私たちはその規制上の特性についてまだ学んでいる段階です。
この研究は、私たちが知っていることの全体像を評価、再評価し、文脈に落とし込むこと、そして自然免疫系の複雑さについてまだ学ばなければならないことを認識することの重要性を強調しています。
自然免疫の初期の頃、炎症に興味を持った生物学者は、補体系を超えた他の複雑な構成要素やプロセスを明らかにし始めました。
宿主防御における好中球の役割は、殺菌性過酸化水素の生成につながるニコチンアミド アデニン ジヌクレオチド リン酸 (NADPH) オキシダーゼによって引き起こされる呼吸バーストの説明を含めて、定義されてきました。
1980 年代以降、炎症誘発性サイトカイン IL-1 や腫瘍壊死因子 (TNF) など、サイトカインと呼ばれる多数の細胞間メッセンジャー分子が報告されました。 これらは、核因子 (NF)-κB などの転写因子を介して、標的細胞における炎症性遺伝子の発現を大幅に増加させることが示されました。
サイトカインは、白血球の接着や遊走などのプロセスだけでなく、発熱や血管拡張などの生理学的プロセスを誘導および制御することが示されています。
サイトカインの名前は通常、説明的なもので、名前の IL のインターは「間」を、ロイキンは白血球を指し、その後に各メッセンジャーを表す番号が続きます。
免疫細胞を感染部位に誘引する走化性サイトカインであるケモカインは、同様に標準化され番号が付けられた方法で名前が付けられます。
重要なのは、サイトカインがマクロファージや樹状細胞などの自然免疫細胞から適応細胞への重要なつながりであることが判明したことです。 骨髄細胞からのメッセージは、T 細胞の特定のサブセットの分化と抗病原体エフェクター機能の両方を駆動します。
真の「自然免疫革命」は、チャールズ・ジェインウェイが彼が「パターン認識受容体」(PRR)と呼んだものの存在を仮説した1989年頃に始まりました。 「病原体関連分子パターン」(PAMP)を認識する受容体タンパク質として定義されてます。 これは本質的に、宿主生物のタンパク質が、通常は存在しない、したがって感染を示す分子のクラスを検出できるシステムです。
PRR および PAMP という用語は現在、免疫学の用語集にしっかりと組み込まれており、多種多様な宿主受容体および病原体関連因子を指します (表 1 を参照)。
1989年に書いた論文の中で、ジェインウェイは「漸近線に近づく」という表現を使い、その中で免疫学者が適応免疫だけに関心を持っていたら、免疫系に関する知識は漸近線または限界に達するだろうと述べた。

これは、免疫学者にとってはある種の叫びとして機能し、免疫学者の多くは自然免疫に移行し、PRR とその効果を模索していました。
ジェインウェイ氏はまた、免疫学者たちは、ワクチンの効果を引き出すために必要な「ちょっとした秘密」であるアジュバントがどのように作用するのか全く分かっていないと述べた。
抗体を産生するために抗原タンパク質を動物に注射するだけでは強い免疫反応を引き起こさないことは何十年も前から知られていました。
強力な反応を得るには、完全フロイントアジュバント(パラフィン油中で加熱死滅させた抗酸菌)やミョウバン(水酸化アルミニウム)などを抗原と組み合わせる必要がありましたが、その理由は誰も知りませんでした。
PRR と PAMP の同定により、アジュバント中の微生物成分がどのように免疫応答を刺激するのかが明らかになり始めました。
しかし、ミョウバンなどの非微生物性アジュバントがどのようにして同様の効果をもたらしたのでしょうか?
その答えには、先駆的な自然免疫学者であるポリー・マッツィンガーが提唱したアイデアが含まれています。 彼は、免疫システムが実際に反応するものは危険因子であると主張しました。
これは、免疫システムはもっぱら「自己」と「非自己」を区別するために存在するという伝統的な見解からの革新的であり、やや物議を醸したものでした。
PRR は、炎症生物学者が数十年にわたって研究してきた微生物産物 (つまり PAMP) または損傷した組織の産物の形で「危険」を感知する危険センサーであることが判明しました。
これらは、危険/損傷関連分子パターン (DAMP) と呼ばれるようになり、今日では、PAMP、DAMP、および自然免疫受容体のリガンドとして機能する他の同様のクラスの分子が免疫の中心的な概念を表しています。
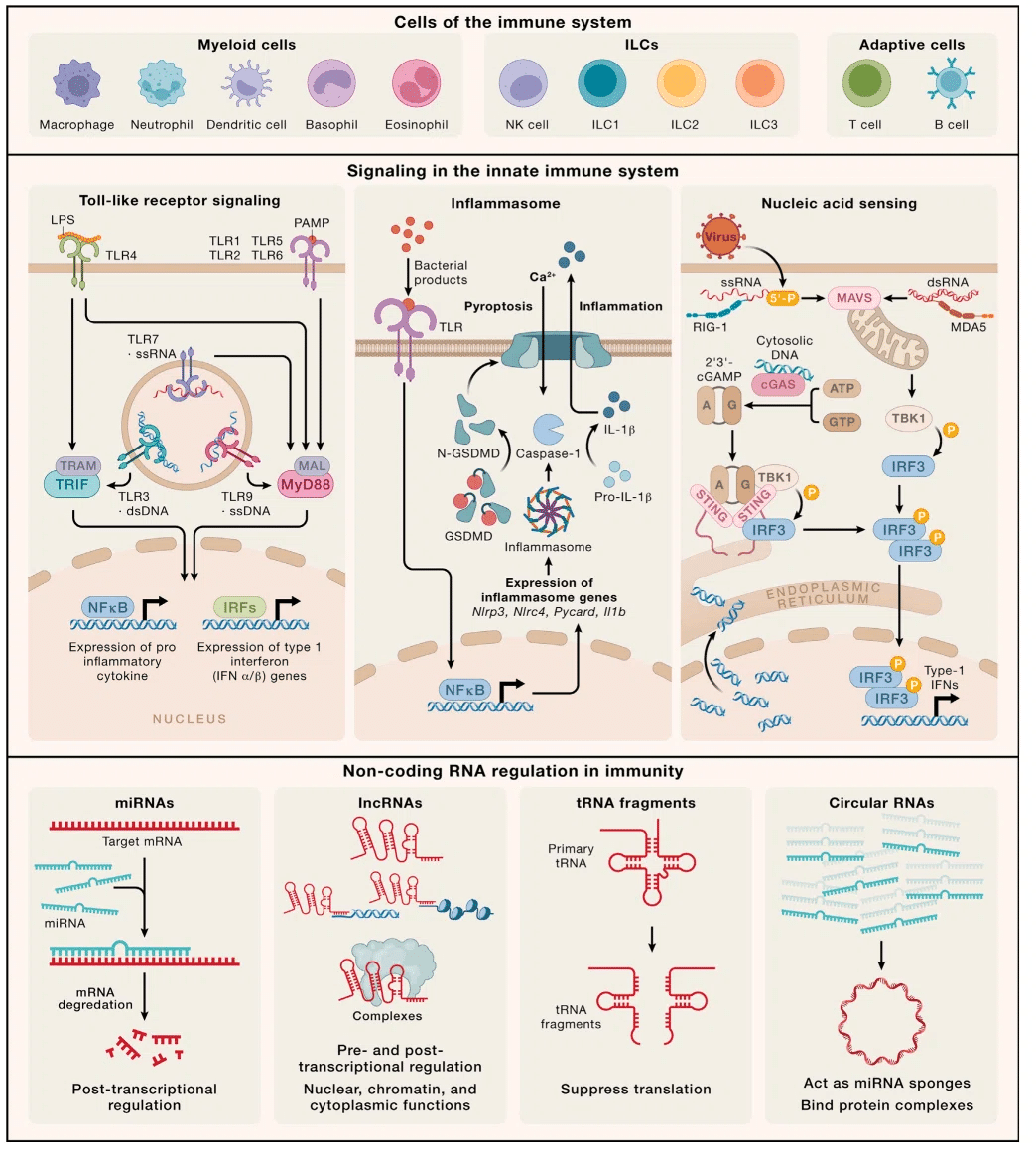
したがって、1990 年代までに、Toll 様受容体 (TLR) をはじめとする複数の PRR の説明により、免疫学における大きな進歩の舞台が整いました。その結果、NOD 様受容体 (NLR)、C 型レクチン受容体 (CLR)、RIG-I 様受容体 (RLR)、AIM2 様受容体 (ALR) 、環状 GMP-AMP (cGAMP) シンターゼ (cGAS) などの発見につながりました (図 1 および 2)。

一部のものは、骨髄細胞によるリンパ球への抗原提示という非常に重要なプロセスを促進するなど、細菌、ウイルス、真菌、寄生虫に対する複数の抗菌プロセスを推進することが示されています。 したがって、免疫応答の「非特異的」分枝と「特異的」分枝との間につながりがもたらされます。
これらのシグナル伝達カスケードの一過性の活性化は感染に対する防御にとって重要ですが、これらの経路の持続的な活性化は有害となる可能性があり、自己免疫および自己炎症状態に関連します。
免疫学の分子的および細胞的役割の理解における進歩は、特に一連の自己免疫疾患および自己炎症性疾患におけるサイトカインの標的化において、実質的な臨床的進歩をもたらした。 関節リウマチ、炎症性腸疾患、乾癬、アトピー性皮膚炎などの一般的な病気で何百万人もの患者が恩恵を受けています。
このレビューでは、一般読者を念頭に置いて、過去 50 年間に明らかになった自然免疫の主な特徴について説明します。
先駆的な研究の多くは Cell 誌に掲載されました。
また、これらのプロセスを標的とすることがさらなる治療の進歩につながるかどうかについても推測しています。
多くの点で、この分野はまだ初期段階にあり、これらの経路内の制御、特にエピジェネティックな制御の複雑さについて学ぶべきことがたくさんあります。
自然免疫に重要な追加の成分がまだ発見される可能性があります。そして、ワクチン開発や、感染症や自己免疫疾患に対するより効果的な治療法を開発するために、自然免疫の力を調整することはまだできていません。
Families of PRRs
PRR はゲノム内にコードされており、体細胞組み換えを受けるリンパ球受容体とは区別されます。
これらの生殖系列にコードされた受容体は、細菌や真菌の細胞壁の成分など、微生物に重要かつ固有の保存された成分を認識します。 自己と病原体のカテゴリー、および細胞損傷の区別が可能になります。
PRR ファミリのカタログの概要を表 1 に示します。

これらの受容体が活性化されると、複雑なシグナル伝達経路が開始され、炎症誘発性サイトカインや抗ウイルス遺伝子が生成されます。
これらのシグナルはまた、樹状細胞の成熟を引き起こし、共刺激分子を誘導し、抗原提示を増加させます。
これにより、自然免疫系が直接活性化し、下流の適応免疫応答を形成することが可能になります。
PRR はさまざまな細胞内の位置で発現し、そのため刺激が細胞表面、細胞内コンパートメント内、サイトゾル内、または核のいずれから来たのかに関する情報を伝達します。
また、体液中に分泌されて細胞間の機能を果たすこともあります。
マクロファージや樹状細胞などの自然免疫系の細胞は、PRR の活性化の結果として劇的な変化を受けます。 上皮細胞や内皮細胞などの非骨髄細胞は、宿主防御に関連する形で PAMP および DAMP に応答することがますます理解されています。
PRR を発現する細胞は成熟し、サイトカインを産生します; それらは食作用に関与し、多数の細胞死経路を引き起こし、オプソニン作用、補体活性化、適応免疫活性化などの免疫応答の他の分野に影響を与えます。
自然免疫応答の進化的多様性の説明については、Box 2 を参照してください。
ここでは、細胞表面からサイトゾルに至る認識の息吹をカバーし、過去 50 年間に自然免疫に大きな洞察をもたらした PRR の 3 つの大きなカテゴリーに焦点を当てます。
TLRs
TLR は 1 型膜貫通型糖タンパク質です。そして、リガンド結合に必要な細胞外ロイシンリッチリピート(LRR)モチーフと、下流のシグナル伝達に必要な細胞内の細胞質Toll-IL-1受容体(IL-1R)耐性(TIR)相同ドメインによって構造的に特徴づけられます。
現在までに、ヒトゲノムでは 10 個(TLR1 ~ 10)、マウスでは 13 個(TLR1 ~ 13)の TLR が同定されていますが、TLR10 は配列内に終止コドンが存在するためマウスでは機能しません。
表 1 に示すように、各 TLR は固有の PAMP によってトリガーされます。
TLR1、2、4、および 5 は細胞表面に局在しており、 一方、TLR3、7、8、および 9 はすべて核酸の感知に役割を果たしており、細胞内コンパートメントに存在します。
ヒトとマウスにおけるこの受容体ファミリーの発見について説明し始めるためには、 まず、IL-1R タイプ 1 (IL-1R1) に関する初期の研究と、ショウジョウバエにおけるトールというタンパク質の最初の発見について説明する必要があります。
1980年代の多くの研究室は、T細胞活性化の重要な制御因子、急性期反応に加えて発熱の誘発因子としての多面発現性炎症促進性サイトカインIL-1の機能を特徴づけた。 これには、肝臓におけるC反応性タンパク質などのタンパク質の誘導が含まれます。
IL-1 の受容体である IL-1R1 をコードする遺伝子は 1988 年に初めてクローン化されましたが、不思議なことに、予測された配列にはその作用機序を示す認識可能なモチーフが含まれていませんでした。
それは、キイロショウジョウバエのトールというタンパク質が、IL-1R と相同な細胞質ドメイン (現在は TIR ドメインと呼ばれる) を持っていることが示された 1991 年までのことでした。
トールは、ハエの背腹極性に関与していることが最初に特定されました。
興味深いことに、時間の経過とともに現れるパターンは、少なくともショウジョウバエでは、タンパク質には「二重の働き」があり、免疫系内のプロセスに加えて発生プロセスでも重要な役割を果たす可能性があるということです。
ショウジョウバエのToll受容体はリガンドSpätzleに結合し、Tubeと呼ばれるアダプタータンパク質を介してシグナル伝達を行い、その結果キナーゼPelleが活性化され、続いてNF-κB転写因子ファミリーのメンバーであるDorsalが活性化されますが、これはタンパク質Cactusによって阻害されます。
一方、1994 年に Barbara Baker らは、タバコ植物の N タンパク質がタバコモザイクウイルスに対する耐性を与えることを報告しました。
Toll; IL-1R1; 耐病性タンパク質であるNタンパク質の間の相同性を考慮して、「TIR」ドメインという用語を作ったのはバーバラ・ベイカーでした。
これらのシグナル伝達成分はすべて、哺乳動物系内に相同体があることが判明しました。
トールの機能喪失変異体がハエで生成されたとき、研究者らは、これらのハエが真菌感染症には非常に感受性が高いにもかかわらず、グラム陰性細菌感染症には耐性があることを発見して驚きました。
真菌感染によるトール経路の活性化により、NF-κB ファミリーのメンバーであるショウジョウバエ免疫因子 (DIF) の下流で抗菌ペプチドであるドロソマイシンの産生が誘導されることが判明しました。 一方、ジプテリシンはグラム陰性感染に反応してハエで産生される抗菌ペプチドであり、免疫不全(IMD)経路を通じてシグナルを伝達します。
バイオインフォマティクス分析により、TIRドメインを持つ哺乳類タンパク質がさらに多く存在することが明らかになりました。 これにより、TLR ファミリーが説明されます。TLR ファミリーはすべて TIR ドメインを持ちますが、免疫グロブリン ドメインを持つ IL-1R1 とは異なり、LRR を持ちます。
TLR4 は、Toll の哺乳類相同体として初めて同定されました。
Medzhitov らは、TLR4 の活性型が共刺激分子 B7 (分化クラスター 80 [CD80]) の発現を誘導できることを初めて示しました。 これは、自然免疫受容体による T 細胞活性化との関連性を提供したため、重要な発見でした。
この研究に続いて、遺伝子マウスモデルにより、グラム陰性菌産物および敗血症リポ多糖(LPS)のドライバーに関与する重要な受容体としてTLR4が同定されました。
1960年代に、ジャクソン研究所のC3H/HeJマウスコロニーで自然突然変異が発生し、マウスがLPS毒性に対して耐性を持ちました。
TLR4 遺伝子 (以前は Lpsd 遺伝子と呼ばれていた) のエクソン 3 へのミスセンス変異を追跡したのは、ボイトラー研究室の研究でした。
ジュール・ホフマンとブルース・ボイトラーは、ハエの先天センサーとしてのトールとマウスのLPS受容体としてのTLR4をそれぞれ発見した研究で、2011年にノーベル医学賞を受賞しました。
1999年、アキラ研究室はTLR4欠損またはノックアウト(KO)マウスを開発し、LPSに応答しないことを示し、実際にTLR4がLPSのシグナル伝達受容体であることを再度確認した。
しかし、LPS の致死性における 1 つの重要な側面は、LPS がカスパーゼ 11 を誘導し、カスパーゼ 1 を介してピロトーシスと呼ばれる一種の細胞死を促進する可能性があるという発見でした。
その後、LPS がカスパーゼ 11 に結合してこのプロセスを活性化することが示され、これが実際に LPS 致死性の鍵でした。
重要なことに、低用量のポリI:Cは、マウスのLPS致死に対するTLR4の要件を回避できました。
したがって、マウスにおける致死性に関する TLR4 の主な効果は、LPS の効果を媒介するカスパーゼ 11 を誘導することです。
TLR signaling
TLR ファミリーのメンバーは同様の交差する経路を通じてシグナルを伝達しますが、TLR4 は最もよく研究されているファミリーメンバーであるため、ここではそれに焦点を当てます。
TLR4 は、細胞外 N 末端の LRR 配列と、細胞膜の内側にあり下流のシグナル伝達カスケードのプラットフォームを形成する TIR シグナル伝達ドメインで構成されています。
LPS の認識において単独で機能するのではなく、LPS 結合タンパク質 (LBP) を含む多くの共受容体と連携して機能します。 これはミセル内の LPS に結合し、別の共受容体 CD14 の相互作用を可能にします (Pålsson-McDermott および O'Neill で総説)。
リポ多糖受容体Toll様受容体‐4によるシグナル伝達 - Pålsson‐McDermott - 2004 - 免疫学 - Wiley Online Library
CD14 は LPS に対する感受性を 1,000 倍以上増加させ、細胞表面で MD2 および TLR4 と複合体を形成します。
LPS内の6つの脂質鎖のうち5つはMD2の疎水性ポケット内に埋まっており、これが二量体複合体を架橋して「m」構造を形成していることが、2009年にParkらによって結晶学によって解明されました。
LPSが結合するとこれらの構造変化が起こり、細胞内で下流のシグナル伝達カスケードが開始されます。
TLR4 は複数のアダプタータンパク質と相互作用する能力があるため、すべての TLR の中で最も複雑な下流シグナル伝達を持っています。
1997 年に、骨髄分化一次応答タンパク質 88 (MyD88) が IL-1R1 の下流にシグナルを送り、NF-κB を活性化することが示されました。
これは TIR ドメインを持ち、TLR の TIR ドメインとの同型相互作用を通じてシグナルを伝達します。
TLR4 シグナル伝達の場合、MyD88 はアダプタータンパク質 MyD88 アダプター様 (MAL、TIR ドメイン含有タンパク質、TIRAP としても知られる) とともに機能して、NF-κB を駆動します。
MyD88 にはデス ドメインも含まれており、IL-1R 活性化キナーゼ 4 (IRAK4) との相互作用を媒介し、IRAK4 は自己リン酸化を通じて IRAK1 および 2 を活性化します。
TNF 受容体関連因子 6 (TRAF6) は、複合体に動員されるユビキチンリガーゼであり、K63 ユビキチン鎖の形成を開始します。 トランスフォーミング成長因子 (TGF)B 活性化キナーゼ 1 (TAK1) および TAK 結合タンパク質 (TAB2 および 3) を動員するための足場を形成します。
次に、B 細胞阻害剤のカッパ光線ポリペプチド遺伝子エンハンサーの核因子であるアルファ (IκBα) キナーゼ複合体がリン酸化によって活性化され、K48 結合ユビキチン化と分解を受けて NF-κB を放出して核に移行し、炎症誘発性遺伝子を活性化します。
ほとんどのTLRは同様のMyD88依存性シグナル伝達経路を使用しますが、 TLR4 は、アダプタータンパク質である TIR ドメイン含有アダプター誘導インターフェロン (IFN)-β (TRIF) および TRIF 関連アダプター分子 (TRAM) とも並行して関与するという点で独特です。
下流シグナルには、核因子カッパ-B キナーゼサブユニットイプシロン-IKKε/TANK 結合キナーゼ (TBK1) の阻害剤を動員する TRAF3 が含まれ、その後 IFN 制御因子 3 (IRF3) をリン酸化して活性化します。
これは次に核に移動し、そこで I 型 IFN を含む抗ウイルスタンパク質の産生を誘導します。
アダプタータンパク質結合の下流で形成されるこれらの高次複合体は、「ミドソーム」および「トリフォソーム」複合体と呼ばれることもあり、超分子組織化中心(SMOC)として機能し、これらのシグナル伝達事象を促進します。
MyD88 シグナル伝達は原形質膜で発生しますが、トリフォソームの活性化には受容体複合体のエンドサイトーシスとその後の細胞のエンドソーム区画からの活性化が必要です。
TLR4の活性化は、マクロファージの重大な代謝変化を引き起こし、解糖を促進し、好気性解糖への移行とミトコンドリア代謝の変化を意味する「ワールブルグ効果」と呼ばれるものを促進することが示されています。
これはLPSに対するマクロファージの反応にとって重要です。解糖を阻害すると、重要な炎症誘発性サイトカイン IL-1β の産生が減少するためです。
このプロセスには解糖酵素ピルビン酸キナーゼアイソザイム M2 (PKM2) の二量体化が必要です。 これは核に移行し、解糖系の酵素をコードする遺伝子だけでなくIL-1β自体も含むHIF-1α依存性遺伝子の発現を促進します。
LPS活性化マクロファージでは、クレブス回路中間体のコハク酸塩の蓄積により、深遠な代謝再配線が発生します。
これは、クレブス回路酵素コハク酸デヒドロゲナーゼ (SDH) によって酸化されることが示されています。 ミトコンドリア内の複合体 I を介した逆電子輸送を引き起こし、活性酸素種 (ROS) の生成を促進し、さらに低酸素誘導因子 1 アルファ (HIF-1α) の活性化を促進します。
LPS は、クレブス回路酵素フマル酸ヒドラターゼの抑制を介してフマル酸生成を増加させることも示されています。
これは、ミトコンドリア膜電位の増加を介してミトコンドリアを乱し、ミトコンドリア二本鎖 RNA (dsRNA) の放出につながります。 これは、RNA センサーであるレチノイン酸誘導性遺伝子 I (RIG-I) および黒色腫分化関連タンパク質 5 (MDA-5) によって検出され、IFN-β の発現を促進します。
最後に、LPS は、遺伝子 Irg-1 によってコードされる酵素アコニテート デカルボキシラーゼ-1 の発現を増加させることも示されています。
これにより、アコニン酸がイタコン酸に変換され、これには幅広い抗炎症作用があり、炎症性マクロファージを制限するように作用します。
これらの研究は、2013年から本格的に始まった免疫代謝分野に貢献しました。
自然免疫における免疫代謝の複雑さについては、さらなる研究が必要です。
多数の代謝産物は動的に変化しており、免疫細胞のエフェクター機能の調節における代謝産物の役割を解明する取り組みはまだ始まったばかりです。
これらの発見はすべて、約 20 年間にわたって起こりました。これは分子免疫学の勝利です。
現場にいる私たちの多くは、TLR の新たな複雑性についてまだ頭を悩ませていました。 一方、他の PRR が参入し、視野がさらに広がりました。
Discovery of the inflammasome
インフラマソームの発見
過去 20 年ほどにわたって活発な活動が見られている自然免疫内の 2 番目の領域は、インフラマソームに関するものです。
「インフラマソーム」は、サイトゾルで形成され、サイトカイン IL-1β および IL-18 の活性化に重要な役割を果たす、いくつかの PRR の 1 つが関与する多タンパク質複合体を表す用語です。 同様に、パイロトーシスと呼ばれる炎症性タイプの細胞死を媒介するガスダーミンファミリータンパク質の処理も行います。
インフラマソームを構成する NLR センサーは、PAMP および DAMP に応答します。
ここでは、この分野の概要を簡単に説明します。より詳細な説明については、次のレビューを参照してください。
インフラマソームの360°ビュー:活性化、細胞死、および疾患のメカニズム:細胞 (cell.com)
インフラマソーム:集合、調節、シグナル伝達のメカニズム |Nature Reviews 免疫学
既知の PRR 関連インフラマソームとその活性化のそれぞれを表 1 に概説します。

主要な PRR ファミリーの 1 つは、ヌクレオチド結合ドメイン (NBD)、LRR 含有 (NLR) タンパク質ファミリーです。
これらには 2 つの種類があります:NLRP と呼ばれる N 末端にピリン ドメイン (PYD) を含むもの、または NLRC と呼ばれる N 末端に CARD ドメイン (CYD) を含むものです。
インフラマソームの活性化により、プロカスパーゼ-1 がタンパク質分解的に切断されて、触媒的に活性化された形態になります。
カスパーゼ-1 は、IL-1β および IL-18 のプロ型を活性型に処理し、ガスダーミン D によって細胞内に形成された孔を通して放出されます。
ガスダーミン D 細孔の形成は、パイロトーシスと呼ばれる特殊な形態の細胞死も引き起こします。 これは炎症と適応免疫細胞の下流の活性化に関連しています(図2)。
さらにガスダーミンファミリーのメンバーが多数存在し、そのすべてが特定の細胞および組織の発現パターンを示し、ヒトの健康と病気において新たな役割を果たしています。
すべてのガスダーミンは孔を形成しますが、その活性化を引き起こす正確なメカニズムはまだ研究中です。
NLRP3 inflammasome
NLRP3 はインフラマソームの中で最もよく研究されており、イオン流 (K 流出および Ca+2+ 流) を含む幅広い活性化プロセスを備えています; 代謝変化(ミトコンドリアとリソソームの機能不全、脂肪酸合成、高浸透圧ストレス); さらには核酸 (dsDNA、ウイルス RNA、酸化 DNA) も含まれます。
非常に多くのさまざまな分子が単一のセンサーをどのように活性化できるのかは不明であり、引き続き熱心な研究の焦点となっています。
NLRP3 インフラマソームの活性化は 2 つの段階で起こります。
ステップ 1 には、通常 NF-κB の活性化による経路の構成要素の上方制御が含まれ、シグナル 2 には下流センサーの直接活性化が含まれます。
プライミングの要件は、細胞の種類と特定のインフラマソームによって異なります。
NLRP3 は細菌やウイルスの感染やさまざまな有害な刺激に応答する際に宿主にとって有利ですが、 この経路の過剰な活性化は、遺伝性でNLRP3の活性化変異が関与するクリオピリン関連周期性発熱症候群(CAPS)を含む、多くの炎症性疾患と関連していることは注目に値します。
Nucleic acid sensing, uncovered
核酸センシングの解明
自然免疫におけるもう一つのおそらく予想外の発展は、自然免疫を引き起こす DNA センサーの発見でした。
したがって、DNA は、生命の情報分子であるだけでなく、特に核の外側の間違った場所に現れた場合には、免疫や炎症の主要な推進力となる役割を果たしました。
あるいは、自然免疫の分野の中心人物であるヴィシュヴァ・ディクシットの言葉を借りれば、それが「サイトゾルの神聖さを侵害した」場合です。
実際、DNA が判明する前の 1928 年に、遺伝物質科学者のフレデリック・グリフィスは免疫系を活性化する「変換原理」を示したことで有名であり、後にそれが DNA であることが判明しました。
私たちが自分自身の DNA に反応しない理由は、DNA が核またはミトコンドリアの保護壁に包まれており、PRR から隠されているためです。
このプロセスはエラーを起こしやすく、自己 DNA のサイトゾルへの漏出は全身性エリテマトーデス (SLE) などの自己免疫疾患に関連していることが今はわかっています。
2000 年代半ばから、細胞質内の DNA の直接感知に関与する主要な役割を特定し、特徴づけようという大きな動きがありました。
エンドソームに局在するTLR9は、細菌に共通するCpG DNAの受容体であることが示されています。
Absent in melanoma 2 (AIM2) は、DNA に直接結合し、IL-1 および IL-18 の放出につながるインフラマソームの形成を誘導できる DNA センサーとして同定されました。
しかし、DNA がどのように感知されて 1 型 IFN の産生につながるのかについてはあまり知られていませんでした。
IFI16、DEAD-box ヘリカーゼ(モチーフ D-E-A-D [asp-glu-ala-asp] にちなんで呼ばれる)、HNRNPA2B1 など、多くの潜在的な DNA 受容体が何らかの役割を果たすことが示されています。
初期の研究から、STING がこの経路で重要な役割を果たしていることが明らかであり、当初はアダプターであるだけでなく、潜在的に直接センサーであると考えられていました。
しかし、この分野は、環状ジヌクレオチドと、この経路の調節におけるインターフェロン遺伝子のアダプター刺激因子 (STING) の重要な役割の発見により急速に進歩しました。
cGAS は、アダプター STING を活性化するセカンド メッセンジャー cGAMP の産生を通じて I 型 IFN を活性化するサイトゾル DNA センサーです。
cGAS は、生理学的条件下で自己阻害状態でサイトゾルに存在します。
cGAS が DNA に結合すると、構造変化が起こり、細胞内の ATP と GTP の貯蔵から cGAMP が生成されます。
cGAMP はセカンド メッセンジャーとして機能し、STING に結合して活性化します。
STING は細菌のセカンド メッセンジャーに結合して応答することが知られていましたが、cGAMP はこの経路を活性化する宿主由来のセカンド メッセンジャーの最初の例でした。
STING はキナーゼ TBK1 を活性化し、転写因子 IRF3 をリン酸化し、その核への移行とその後の 1 型 IFN の活性化を引き起こします。
STING は NF-κB を活性化し、炎症誘発性サイトカインの産生を引き起こすこともあります。
サイトゾル内の RNA を認識する主な受容体は、RIG-I および MDA-5 です (図 2、表 1)。

これらの細胞質に局在する受容体は、それぞれ一本鎖 RNA (ssRNA) と dsRNA の認識に重要です。
興味深いことに、私たち自身の RNA には、アデノシンからイノシンへの変更 (A から I への編集) などの修飾が含まれており、これが私たち自身の RNA をこれらの受容体の活性化から守るのに役立ちます。
これらの受容体は、インフルエンザ、肝炎、西ナイルウイルスなどのウイルス RNA 感染に対する防御において重要な役割を果たします。
RIG-I は 5'ppp- などの RNA の主要な構造を認識できますが、MDA-5 は長い dsRNA を好みます。
受容体が活性化されると、I 型 IFN が強力に誘導されます (図 2)。
How activation of the innate immune pathways controls adaptive immunity
自然免疫経路の活性化がどのように適応免疫を制御するか
多くの免疫学者にとって、自然免疫の最も重要な特徴は、自然免疫がどのように適応免疫を促進するかであり、その関連性の発見は、おそらく過去 50 年間の免疫学における最も重要な発見です。
2011 年下半期のノーベル医学賞は、ほぼちょうど 50 年前に樹状細胞を発見したラルフ・スタインマン博士に授与されました。
樹状細胞 (DC) は、全身の組織部位から抗原を捕捉し、免疫系の特殊なリンパ節内の T 細胞に提示するのに役立つため、プロフェッショナルな抗原提示細胞と呼ばれることがよくあります。
樹状細胞は末梢に存在し、高レベルの自然免疫 PRR を発現します。
樹状細胞は活性化されると、炎症誘発性サイトカイン、遊走性ケモカイン受容体の発現増加、および T 細胞と相互作用して下流の適応免疫応答を活性化する表面タンパク質の上方制御を伴う成熟を起こします。
DCの成熟におけるTLRシグナル伝達経路の重要な役割は、MyD88欠損マウスからのDCが成熟に失敗した場合に実証されました。
ほとんどのTLRで使用される重要なアダプタータンパク質がなければ、TLR4の下流の代替TRIFアダプターを介した刺激のみがDCの抗原提示活性を活性化することができます。
さらに、MyD88 欠損マウスの初期の研究では、特に炎症性 T 細胞応答を駆動するための TLR シグナル伝達経路の重要性が強調されています。 炎症性の低い T 細胞サブタイプと B 細胞は、TLR シグナル伝達の大部分が存在しない状態でもほとんどの機能を保持していたためです。
樹状細胞は単一細胞タイプではなく、過去数年にわたって、各臓器内に組織内に存在するものを含む多くの DC サブタイプが特徴付けられてきました。
DC は、ウイルス病原体や腫瘍を除去するために細胞傷害性 T 細胞 (CTL) と結合します。
細胞内病原体と原虫はCTLとT細胞のTh1(タイプ1サブタイプ)によって対処され、Th17(タイプ3サブセット)細胞は細胞外病原体の制御において重要な役割を果たします。
DC と適応免疫についてさらに詳しく説明するには、次のレビューを参照してください。
自然免疫系による獲得免疫の制御 |自然免疫学 (nature.com)
ヒト樹状細胞サブセット:最新情報 - Collin - 2018 - 免疫学 - Wiley Online Library
Discovery of the ILCs
ILCの発見
自然リンパ系細胞ファミリーのメンバーは 1970 年代半ばに初めて記載されましたが、現在使用されている命名法は 2013 年に提案されたばかりです。
自然リンパ球 (ILC) は、自然免疫応答の制御において重要な役割を果たします。
ILC は T 細胞の生来の対応物として機能し、これらの細胞の機能的サブタイプは T 細胞の機能的サブタイプを反映しているように見えますが、抗原特異的 T 細胞受容体はありません。
ILC ファミリーの創設メンバーであるナチュラルキラー (NK) 細胞は、CD8 CTL と同様に機能します。 一方、ILC1 は Th1 に似ており、ILC2 は Th2 に似ており、ILC3 は 3 型応答性 T 細胞サブタイプ (TH17、TH22) に似ています。
NK細胞は1975年に初めて命名され、ウイルス感染に対する初期反応において重要であることが示されました。
ILC は一般に粘膜組織内で機能し、通常は少数存在し、炎症の活性化、組織リモデリング、代謝制御、および適応免疫応答への影響に関与しています。
ILC 文献の詳細なレビューについては、次のレビューをお勧めします。
自然リンパ球 — 統一された命名法の提案 |Nature Reviews 免疫学
自然リンパ球:10年:細胞 (cell.com)
Controls on innate immunity
自然免疫の制御
過去 50 年間におけるもう 1 つの非常に有益な分野は、自然免疫経路における複数の制御の解明です。
PRR の下流にある複雑なシグナル伝達カスケードの一過性の活性化は、恒常性の維持にとって重要です。
したがって、これらの免疫カスケードのタイミングの制御に関与する主要なプレーヤーを理解することが重要でした。
免疫応答のあらゆる側面と同様、自然免疫細胞で観察される絶妙なタイミングに寄与する制御層が存在します。
タンパク質の代謝回転の速度は、単純な制御層の 1 つです。
例えば、転写因子 p65 は IκB によって細胞質に保持され、PRR の活性化後にのみ核に移動します。
刺激後、IκB はリン酸化を受け、その後 28S プロテアソーム内で分解されます。
ただし、IκB 自体が NF-κB によって誘導されるため、IκB の代謝回転は急速であり、そのため、IκB が翻訳されると、細胞質内に p65 を保持する役割が再開され、応答の一過性の原因となります。
自然免疫応答のさまざまな段階で役割を果たす多くのプロセスが特定されています。
いくつかの主要なプレーヤーの概要をまとめた表を作成しました (表 2)。ここでは 2 つの主要なコントローラーに焦点を当てます:(1) A20 とユビキチン化、および (2) 非コード RNA、どちらも過去 20 年間に膨大な量の発見が見られました。
A20 and control of ubiquitination
A20とユビキチン化の制御
A20 (TNFAIP3 としても知られる) は、普遍的に発現されるユビキチン修飾タンパク質であり、それ自体が NF-κB シグナル伝達の下流で誘導されます。
A20 は、ユビキチン鎖を追加または除去するように機能するという点で独特です。
A20 は、細胞死の阻害に加えて、NF-κB シグナル伝達を負に制御するように機能します。
A20欠損マウスの作製後、A20が恒常性の維持に重要な要素であることが明らかになりました。
マウスは予想されるメンデル比で生まれますが、多臓器炎症により出生後すぐに死亡します。また、シグナル伝達調節異常の主な原因はTLR経路に由来すると思われます。
A20 は、遺伝子内で同定された一塩基多型 (SNP) により、SLE などの多くの炎症性疾患と強く関連しています。
SNP はリンパ腫と関連しているため、A20 は腫瘍抑制因子としても関与しています。
自然免疫シグナル伝達経路の多くのアームは、ユビキチン化のプロセスを通じて制御されます。
特定のユビキチン マークによって、タンパク質が除去されるか活性化されるかが決まります。
リジン 48 (K48) 結合ユビキチン鎖は、プロテアソームによる分解のためにタンパク質をマークし、リジン 63 (K63) 結合ユビキチン鎖は下流シグナル伝達の活性化足場として機能します。
A20 は、K63 関連タンパク質の脱ユビキチン化を通じて TLR および NOD シグナル伝達経路の負の制御を媒介し、NLRP3 インフラマソームを制御することも示されています。
自然免疫の調節におけるノンコーディングRNAの新たな役割
自然免疫シグナル伝達に関する初期の研究の多くはタンパク質カスケードと細胞表現型に焦点を当てていましたが、次世代シークエンシングの開発により、明らかな調節機能を備えた RNA 転写物のパンドラの箱が開かれました。
ヒトゲノムの大部分は活発に転写されていますが、重要な疑問は、タンパク質をコードしていない RNA 転写物のどれだけが機能的に関連しているのかということでした。
自然免疫におけるノンコーディング RNA に関する理解が最も進んでいる分野は、マイクロ RNA 研究の分野です。
マイクロRNA (miR) は1990年代初頭に初めて同定され、自然免疫系におけるその特定の役割は2000年代後半に明らかになり、NF-κBの制御因子としてmiR155およびmiR146aが説明されました。
miRNA は小さな RNA (長さ 23 ヌクレオチド) で、ほとんどが RNA ポリメラーゼ II から転写され、一部は RNA ポリメラーゼ III 転写物です。
それらは独立した遺伝子としてコードされることも、タンパク質をコードする遺伝子のイントロンから出現することもできます。
一次転写物は転写され、核内で処理されてから細胞質に輸送され、そこでダイサーによる切断を受けて二本鎖を形成します。
次に、RNA の一方の鎖が RNA 誘導サイレンシング複合体 (RISC) にロードされ、RISC が複合体を 3' 非翻訳領域 (UTR) または標的 mRNA に導き、標的タンパク質の抑制を引き起こします。
miR155 と miR146 は、自然免疫系内で最もよく特徴付けられている 2 つの miRNA であり、これらが相互に平衡を保つことができることを示唆する証拠があります。
miR155 と miR146 はどちらも、TLR リガンドによる炎症活性化後、または感染後に高度に誘導されます。
miR155 は炎症誘発性であり、負の制御因子 SHIP1 および SOCS-1 を標的としますが、miR146 は TRAF6 および IRAK1 を標的とする抗炎症性です。
miR146a 欠損マウスは慢性炎症と自己免疫の症状を示し、これらのマウスは高レベルの miR155 を発現します。 これらの miRNA が恒常性のある炎症反応に対する平衡状態として機能するという証拠が追加されました。
マウスにおける miR155 の欠損は、免疫系に広範な影響を及ぼします。
これらは、内毒素ショックモデルにおいて反応の低下を示し、その適応免疫反応は、感染または自己免疫中の T 細胞および B 細胞反応への影響によって偏っています。
自然免疫系における miRNA の詳細については、次の包括的なレビューをお勧めします。
マイクロRNAによる炎症反応の制御 |年次レビュー (annualreviews.org)
マイクロRNA:Toll様受容体シグナル伝達の微調整剤 |Nature Reviews 免疫学
マイクロ RNA は制御的役割が最初に理解されましたが、ゲノムから生成される RNA の最大のグループは長鎖非コード RNA (lncRNA) です。
分析パイプラインに応じて、20,000 ~ 100,000 個の lncRNA が存在すると予測されており、これらの遺伝子座の少数は小さな機能ペプチドをコードしていることが示されています。
2013年、lincRNA-Cox2と名付けられたlncRNAが自然免疫系の遺伝子に影響を及ぼし、lincRNA-Cox2が除去されるとIL-6などの遺伝子の下方制御が起こる一方、IFN遺伝子は上方制御されることが示されました。
XIST は、1991 年に初めて同定された、最もよく研究されている lncRNA です。
XIST は X 染色体上にコードされており、女性の X 染色体不活化に必要です。
興味深いことに、TLR7 は X 染色体上にコードされており、X の不活化を回避することができます。
これは T 細胞において特に重要であることが示されており、この重要な非コーディング RNA と自己免疫、特に SLE に関連する制御とが関連付けられています。 これは、X染色体の余分なコピーを持つクラインフェルター症候群の患者だけでなく、女性にも不均衡な影響を及ぼします。
この状態での過剰な TLR7 は、観察されたシグナル伝達欠陥の一部を説明できる可能性があります。
最近の研究では、雄マウスで XIST を過剰発現させるだけで自己抗体が形成され、これらのマウスの T 細胞と B 細胞が野生型の雌の T 細胞と B 細胞に似ていることが示されました。
過去 10 年間で、この分野は大幅に拡大し、lncRNA と免疫に関する多くの出版物が出版されました。
この分野の詳細なレビューについては、以下をお勧めします。
RNAを免疫に結びつける:免疫学の動向 (cell.com)
長鎖ノンコーディングRNA:生体機能への分子モダリティ |年次レビュー (annualreviews.org)
lncRNAの機能の方法と理由:自然免疫の視点 - ScienceDirect
Therapeutic possibilities
治療の可能性
自然免疫プロセスとその制御の解明に続いて、これらの注目すべき発見を治療上の利益に利用する取り組みが行われました。
新しくてエキサイティングな展望が生まれつつあります。
PRR の同定は、ワクチンのアジュバントにすぐに応用されました。PRR の発見により、ジェインウェイの「ちょっとした秘密」が分子的にどのように機能するかが説明される可能性が非常に高かったからです。
多くの努力にもかかわらず、ワクチン用のアジュバントの合理的な設計の進歩は遅く、現在も進行中です。
ワクチンアジュバントにおける自然免疫の重要性は、YF-17D と呼ばれる弱毒化生ウイルスからなる黄熱病ワクチンに関する Bali Pulendran らの研究で見事に実証されました。
これはこれまでに開発されたワクチンの中で最も効果的であり、1回の接種で数十年間の予防効果が得られます。
その効果を引き出すには、TLR2、TLR3、TLR7、TLR9、RIG-I、およびMDA-5を含む幅広い生来のセンサーが必要であり、これらはおそらくウイルス内の多様なPAMPを感知していると考えられます。
これとは別に、TLR4 が LPS の受容体であり、モノホスホリル リピド A (MPL) がアジュバントとして登場することが判明する前に、LPS の解毒バージョンがテストされました。
QS-21と呼ばれる植物抽出物(チリの石鹸樹皮の植物サポニンから作られたリポソーム)およびコレステロールと組み合わせて、帯状疱疹のワクチンやマラリアワクチンに使用されます。
AS04 は、MPL とのアルミニウム塩を含むアジュバントであり、ヒトパピローマウイルスおよび B 型肝炎ウイルスのワクチンに使用されます。
TLR9 アゴニスト CpG DNA の修飾型は、B 型肝炎のワクチンに使用されています。
現在、インフルエンザを対象としたイミキモド(性器いぼの治療に使用され、その後TLR7リガンドであることが判明した小分子)、 インフルエンザを対象としたフラジェリン (TLR5 リガンド)、インフルエンザと狂犬病を対象とした dsRNA ポリマー (TLR3 リガンド) を用いた臨床試験が進行中です。
さらに、特に抗腫瘍ワクチンだけでなく、インフルエンザ、HIV、および結核においても、STING アゴニストに大きな関心が寄せられています。
COVID-19のmRNAワクチンは、自然免疫活性化リガンドがアジュバント効果にどのように関係するかについて新たな疑問を引き起こしました。
このワクチンには、イオン化脂質とコレステロールを含む脂質ナノ粒子(LNP)内に、SARS-CoV-2のスパイクタンパク質をコードする修飾mRNAが含まれています。
LNP 自体は、タンパク質抗原とともに使用するとアジュバント特性を持つことが示されています。 一方、ワクチンは免疫原性のためにMDA-5を必要とするが、興味深いことに他の全てのPRRは必要ないことが示されました。
MDA-5がワクチン自体のRNAを感知しているのか、それともおそらくミトコンドリア由来の内在性RNAを感知しているのかは不明です。
ワクチン接種アジュバントは PRR 活性化を利用して免疫系を刺激します。その裏返し的行為になるが治療として、自己炎症性疾患や自己免疫疾患における PRR をブロックする取り組みも行われています。
虚血再潅流傷害や関節リウマチなどの症状でTLR2を標的とする抗体は前臨床の可能性を示していたが、ヒト臨床試験での有効性が欠如していることが主な理由で進歩していません。
敗血症におけるTLR4を標的とする試みも行われ、アンタゴニストのエリトランは臨床試験でわずかな効果しか示さなかったが、これは臨床的に介入のタイミングが原因か、あるいはおそらく慎重な患者層別化の必要性が原因である可能性があります。
NLRP3 は、広範囲の自己炎症および自己免疫状態、特にアルツハイマー病やパーキンソン病などの中枢神経系疾患における潜在的な役割を考えると、非常に興味深い標的であることが証明されています。
当初、IL-1β 産生のシグナル 2 をブロックすることが示されていたCRID3/MCC950 と呼ばれる小分子阻害剤は、 それから、NLRP3 インフラマソーム活性化中の ATP 依存性オリゴマー化に必須のヌクレオシド トリホスファターゼ (NTPase) ドメイン (NACHT ドメイン) に結合することにより、NLRP3 を特異的に標的とすることが示されました。
この阻害剤および他の NLRP3 阻害剤をベースにした複数の化合物が臨床開発のさまざまな段階にあり、CAPS、変形性関節症、痛風、骨髄異形成症候群、喘息、パーキンソン病、冠動脈疾患を対象とした治験が行われています。
NLRP3、さらには他のインフラマソームを阻害することは、複数の炎症性疾患にわたって治療に応用できる可能性があります。
NLRP3 の阻害は、抗生物質や感染症に似ている可能性さえあります。ある薬剤は、多くの疾患、この場合、骨髄細胞によって引き起こされる炎症が病原性である疾患に利益をもたらします。
また、関節リウマチ、脳卒中、SLE、神経障害などの症状における cGAS-STING 経路の標的化にも大きな関心が寄せられています。
サイトカインの出現により、複数のサイトカインを標的とした治療薬や、特にチロシンキナーゼのヤヌスキナーゼ(JAK)ファミリーにおけるサイトカイン駆動シグナルの阻害剤の開発がもたらされ、患者に多大な利益をもたらしました。
特定のサイトカインやシグナルを標的とすることは、感染症やがんのリスクを高めるという点では特に問題はありません。
PRR、あるいはPRRが活性化するシグナルの標的化が、特にサイトカインの標的化が特に効果的ではないか、まだ証明されていない疾患において、優れているとは言わないまでも、同様の臨床上の利益をもたらすことが期待されています。
Concluding remarks
50年前、自然免疫に対する私たちの理解は原始的でした。 当時の自然免疫はそのように見られていたからです。
研究助手から大学院生、研究成果を発表する博士研究員に至るまで、何百もの研究室にわたる、何千人もの研究者が参加する協調的な取り組みにより、原始的な仮定よりもはるかに洗練された相互接続されたプロセスの全世界が明らかになりました。
今後も興味深い発見が続き、自然免疫のさらに多くの構成要素が明らかになる可能性があります。
これらの将来の発見は、生物学的プロセスのこれらの本質的かつ最も基本的なものについての理解をさらに深めるものであり、その標的化は免疫介在性疾患および炎症性疾患および癌に対する大きな治療の可能性を秘めているに違いない。
以下省略。
///////////////////////////////////////////////////////////////////////////
Box 1. Innate immune memory
ボックス 1. 自然免疫の記憶
自然免疫記憶とは、自然免疫系が一定期間、ある種の限られた記憶を保持しているように見える現象です。
通常、生物の生涯にわたって持続することができる適応免疫記憶とは異なり、自然免疫記憶は数か月から 1 年程度持続します。
異なる刺激、たとえばβ-グルカンやLPSは、骨髄細胞に異なるトレーニングプログラムを誘導します。これは、獲得免疫細胞で観察される遺伝子組換えではなく、エピジェネティックな変化を通じて誘導されます。
訓練された免疫の概念は、カルメット ゲラン桿菌 (BCG) のようなワクチンがどのように機能するかを説明するいくつかの方法に役立ちます。 結核に対して設計されたこの製品は、ウイルスを含むさまざまな感染性微生物に対して、宿主をより広範囲にカバーできます。
BCG ワクチンは、適応免疫系を欠く重度複合免疫不全(SCID)マウスにおいて致死性カンジダ症に対する保護を提供することが示されています。 これは、免疫系の自然免疫アームの中で起こるこのタイプの記憶の重要性を強調しています。
多くの研究では、単球とマクロファージがマウスの研究でトレーニングを促進する上で重要な役割を果たしており、トレーニングは骨髄の前駆細胞で起こり、末梢に循環する細胞に加えて中枢トレーニングも行われることが示されています。
細胞の 3D 構造、エンハンサーの H3K4me1 マーク、プロモーターの H3K4me3 マークを含むエピジェネティックな再プログラミング、および lncRNA の発現誘導はすべて、トレーニングのプロセスに寄与すると考えられています。
代謝の変化も関係しており、β-グルカンを使用したトレーニング中に好気性解糖系が増加します。
異なるリガンドは異なる代謝産物を誘導し、グルカンはフマル酸塩を誘導し、LPS はコハク酸塩を誘導します。
それぞれがトレーニング中に誘発される全体的な信号に影響を与える可能性があります。
食事から環境や病理学的曝露まで、多くのことがトレーニングに影響を与える可能性があります。
これらの経路を治療効果に利用することについて臨床的に影響力のある洞察を得るために、トレーニングを支配する正確な分子機構を解明するには、多くの作業が残されています。
///////////////////////////////////////////////////////////////////////////
Box 2. Evolutionary diversity of innate immunity
Box 2. 自然免疫の進化的多様性
動物種間の自然免疫プロセスを比較すると、いくつかの興味深い類似点と相違点が明らかになり、自然免疫の進化的多様性についての洞察が得られ続けています。
ウニは、222 個の TLR と 203 個の NLR を含む、生来の受容体の膨大なレパートリーを持っています。
そのシグナル伝達レパートリーも同様に広大で、58 個の TIR アダプター様タンパク質、36 個の TRAF タンパク質、および 541 個のデスドメイン含有タンパク質があります。
これはおそらく、ウニには適応免疫が欠如しており、ウニに感染する可能性のある感染性微生物に対処するための適切な多様性を確保するための生来のレパートリーが拡張されているためであると考えられます。
同じことは植物にも言えます。たとえば、シロイヌナズナは数百の TLR と NLR を持っています。
cGAMP/STING 経路は細菌内でも保存されており、バクテリオファージに対する防御を提供していることが判明しました。
コウモリは、LRR ドメインが変化した異なる NLRP3 を持っており、NLRP3 インフラマソームの活性が低下します。
これが、人間には病原性を示すウイルスに対してコウモリが耐性がある理由の 1 つである可能性があります。
最後に、馬は、馬に感染するロドバクター・スフェロイデス由来の LPS の一種を認識できる TLR4 を持っています。
このタイプの LPS は、ヒト TLR4 に対するアンタゴニストです。
これにより、馬は特定の細菌に対して適切な免疫応答を開始できるようになります。
///////////////////////////////////////////////////////////////////////////
