
【がん検査・治療のいま】がん細胞だけをねらい打ち ホウ素中性子捕捉療法(BNCT)
江戸川病院の挑戦
ホウ素中性子捕捉療法(BNCT)は放射線治療の進化系。正常細胞のダメージが少ないなど患者にとっても医療機関にとっても、さまざまなメリットがある。今号では東京・城東地域の中心的医療機関、江戸川病院にお邪魔し、放射線治療のエキスパートである同病院放射線科部長の黒﨑弘正医師らにBNCTの仕組み・プロセス、現在進めているBNCTの「特定臨床研究」などについて伺った。
課題は正常細胞のダメージを最小限に抑えること
放射線治療は放射線を病変部に照射し、がん細胞にダメージを与え、がんの増殖能力を抑制する治療法。ただし、たとえば放射線の代表格であるX線の場合、がん細胞だけでなく、病巣に至るまでの正常な組織と病巣の周囲、病巣を突き抜けた後の正常な組織にもダメージを与えてしまい、臓器の障害などを引き起こす可能性があった。
正常細胞のダメージを最小限に抑える―これが放射線治療の大きな課題 だった。
この課題に対する答えの1つ目が「トモセラピー」など、がんの大きさ・形を捉えてピンポイントで放射線を照射する方法(高精度放射線治療)、2つ目が陽子線、重粒子線などの「粒子線治療」、3つ目が今回のテーマである「ホウ素中性子捕捉療法(Boron Neutron Capture Therapy: BNCT)」だ。
取材のために訪れたのは東京・江戸川区東小岩にある江戸川病院。放射線治療後の再発乳がんを対象としたBNCTの「特定臨床研究」に取り組んでいる。
「老舗」ながら、院内には「進取の気性」が横溢
江戸川病院は泌尿器科、整形外科、がん治療を3本柱に、急性期医療を担う東京・城東地域の中心的医療機関。地域と患者に支持され、長い歴史を刻んできた。2022年度の1日平均入院患者数は318.3人、1日平均外来患者数は隣接するメディカルプラザ江戸川(江戸川病院外来棟)を含めて915.1人に達する、地域に愛された医療機関だ。
1932年(昭和7年)開業の「老舗」ながら、院内には「進取の気性」が横溢。患者のためになると判断したら、積極的に新しい機器・治療法を採用してきた。
手術支援ロボット「ダビンチ」や前立腺がんに対する局所温熱療法の「フォーカルセラピー」(治療が必要な部分だけを熱して局所的に治療)も、いち早く導入。2007年には放射線治療装置「トモセラピー」を稼働させた。
トモセラピーは現在、3台が稼働。前立腺がんに対する照射回数が世界一を記録したこともあるほど多数の症例を治療してきた。トモセラピーを含むIMRT専用装置の実施実患者の数では日本でも10指に入る。
放射線治療のエキスパートが着任し、潮目が変わった
実は BNCTに取り組むのも早かった。加藤隆弘・元院長の時代、2011年に病院設置型BNCTを導入した。もともとは陽子線治療の導入を検討していたが、BNCTが、がん細胞だけにダメージを与えられることから、BNCTに取り組むことになった。
ところが、装置が、なかなか安定しない。肝心のビームが安定的に発射できないのだ。推進役の加藤院長が逝去したこともあって、院内ではBNCTからの撤退も検討されるようになった。
ただ、同じメーカーのBNCT装置が国立がん研究センターで稼働を始めており、「安定的な照射さえできれば」と希望を託して事業の継続が決まった。
潮目が変わったのは2021年9月、放射線科部長の黒﨑弘正医師が着任してからだ。黒﨑医師は群馬大学医学部の卒業。都立駒込病院、虎の門病院、船橋市立医療センターなどを経て、東京厚生年金病院(現JCHO東京新宿メディカル医療センター)の放射線治療科部長を務めた放射線治療のエキスパート。
黒﨑医師が放射線科の責任者としてBNCTプロジェクトの「かじとり役」に就いたことで、プロジェクトが一気に進んだ。折よく装置もビームを安定的に照射できるようになった。

対象となる疾患を脳腫瘍から乳がんに変更
「中性子は加速されて陽子線とリチウムターゲットとの核反応によって生成されます。当院にBNCT装置が導入された当初は陽子線加速部やリチウムターゲットシステムに問題があり、安定して中性子の照射ができませんでした。ちょうど私が着任したころ、この問題が解決され、安定して中性子の照射ができるようになりました」
と黒﨑医師は話す。大所帯の放射線治療科のリーダーシップをとるかたわら、外来に立ち、さらにBNCTの特定臨床研究をスタートさせるための準備・書類作成に追われる、超多忙な日々がやってきた。
その時点で、BNCTの対象となる疾患を脳腫瘍から乳がんに変更するという、大きな決断も行った。
「競合」となる国立がん研究センターのBNCTの対象疾患は血管肉腫とメラノーマ。筑波大学が「脳腫瘍を対象としたBNCTの研究を始める」という情報も聞こえてきた。
「他施設と同じ研究はすべきではないと判断しました。乳がんは身近な疾患で、患者数も多いうえ、今後も、ますます増えていくと予想されます。当院で放射線治療を受ける患者さんの4分の1が乳がんの患者さんです。治療可能な中性子量を考慮すると体表面から6~7センチ程度の疾患が適応となるため、乳がんが適応範囲だと考えました」(黒﨑医師)
再発乳がん患者を対象に特定臨床研究がスタート
2022年8月、本格的にBNCT装置を稼働させるため、「BNCT準備室」を立ち上げた。黒﨑医師ひとりでは手が回らないため、京都大学でBNCTを研究していた岡﨑啓太さんを採用した。
岡﨑さんは京都大学大学院工学研究科の原子核工学専攻博士課程を修了後、医学物理を学ぶため米国のミネソタ大学に留学、修士号を取得した実力派。江戸川病院でもBNCTプロジェクトの片翼として力を発揮する。
着任時にはBNCTの関連機器が揃っていなかった。
「例えば線量計算をするための計算機や血中のホウ素濃度を測定するための備品が整っていませんでした。それら必要な備品のリストアップを行い、放射線治療室や各検査科、薬剤部などの全面的な協力を得て、2023年4月には治療可能な環境が整いました」
と岡﨑さんは話す。
こうして江戸川病院における特定臨床研究がスタートする。放射線治療後の再発乳がん患者を対象に、2023年7月、1例目、続いて2~4例目の照射が行われた。

中性子線が起こす核反応ががん細胞だけを内側から破壊
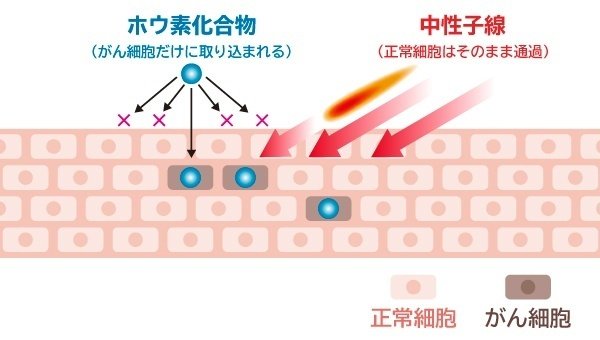
「BNCT はホウ素中性子捕捉療法の名前の通りホウ素-10Bと熱中性子との核反応で生じる α粒子及びリチウム原子核を用いて、がん細胞のみを破壊する治療法です。正常細胞のダメージを最小限に抑えられることから、『がん細胞選択的治療』とも呼ばれています」(黒﨑医師)
江戸川病院のBNCT装置は全長7mのRFQライナックで加速された陽子線とターゲットシステム内のリチウムとの核反応によって中性子を生成させ、照射する。治療のプロセスは別図の通り。
最初に10Bの入った薬剤を約2時間かけて点滴で投与する。10Bは主に、がん細胞に吸収され、定着する。
がん細胞が増殖する際、アミノ酸の輸送を担うアミノ酸トランスポーター LAT-1が発現・亢進し、がん細胞に必須アミノ酸を取り込む。は、この必須アミノ酸に似た化学式を持っており、投与すると、がん細胞に取り込まれる。
その後、10Bが取り込まれた、がん細胞に中性子線を照射すると、がん細胞でのみ核反応が生じ、がん細胞は死滅する。生成された α粒子とリチウム原子核が飛ぶ距離は、がん細胞の直径以下であり、治療は、がん細胞の中だけで完結する

BNCTは日本が一歩も二歩もリード
BNCTは患者にとっても医療機関にとってもメリットは大きい。
患者にとっては
正常細胞に与えるダメージが小さい
標準治療である放射線治療後に再発した患者にも適応が可能である
治療中、痛みを感じないので、無麻酔で実施できる(ただし、やや窮屈な姿勢を保つ必要あり)
照射回数1回であり、通院が不要
外科手術や化学療法の適応とならない疾患も治療を受けられる
といったメリットがある。
装置そのものも陽子線や重粒子線装置に比べると、はるかに小さく、加速器の大きさは7m程度。電力に関しても陽子線治療であれば陽子線のエネルギーが200~300MeVほど必要なのに対し、BNCTは2.5MeV程度であり、電気代も抑えられる。
しかも BNCTは日本が大きくリードしている分野。中性子そのものは1932年、チャドウィックによって発見された。1936年、ロッヒャーによって「中性子捕捉療法」が提唱され、1950~60年代の米国で、悪性脳腫瘍を対象にしたBNCT臨床試験が実施された。
ところが、中性子線にガンマ線などが混入し、ホウ素化合物も適切なものが使用されなかったことから、正常細胞のダメージが大きく、臨床試験は大失敗に終わった。米国は、この時点で、BNCTの研究から、いったん撤退する。

病院併設可能な小型の加速器が開発された
手詰まりな状況を変えたのが、がん細胞に取り込まれるホウ素化合物が開発されたことである。それに加え、原子炉ベースの中性子源から病院併設可能な小型の加速器が開発され、BNCTが一気に現実のものとなったのだ。
BNCTに関しては日本が一歩も二歩もリード。世界のトップを走っている。
江戸川病院の特定臨床研究は2023年11月末時点で4例の照射が行われた。1例目で病巣が縮小したほか、2例目は腫瘍マーカーの数値が治療前13に対して2カ月後には4と基準値以下になった。
「BNCTは日本発の技術でつくられた、画期的ながん治療装置です。研究・開発をさらに進めて、世界に、この治療法を発信していきたいと考えています」
と黒﨑医師の目は未来を見据えていた。

黒﨑 弘正(くろさき・ひろまさ)
群馬大学医学部卒業。同大学院医学部医学研究科修了。都立駒込病院、虎の門病院、船橋市立医療センターなどを経て、東京厚生年金病院(現JCHO東京新宿メディカル医療センター)放射線治療科部長を務めた。日本ハイパーサーミア学会理事。2024年に江戸川区で行われる同学会第41回大会の大会長。大会テーマは黒﨑医師発案の「温熱仲間を増やす」。
