化学の観点から解説する現代めっき技術シリーズ 第一回「めっき技術概観と電解めっき」
1.はじめに
皆さんはじめまして、Hazaculaと申します。本記事は、一般にはほとんど知られていない「めっき」という技術について、化学の観点から解説するシリーズです。
めっきというと、本性が現れるというような意味の「めっきが剥げる」という慣用句が有名であり、なんとなく見た目を取り繕うといった悪いイメージが付き纏います。しかし、めっきという技術は今や、現代文明を維持するのに必要不可欠な技術となっています。
本記事は、めっき薬品メーカー勤務約10年(1回転職経験)の筆者が、めっき液の原理について大雑把に解説する内容となっています。
2.めっきの定義とは?
めっきめっきと言っていますが、めっきとは一体何なんでしょう? まずここの定義をはっきりさせる必要があります。とりあえずここでは、
“金属イオンを溶かした溶液から、なんらかの電気化学的反応により基板上に金属薄膜を成膜する技術”
と定義しておきます。溶融亜鉛めっきなんてものもありますが、専門外なので今回は触れないことにしましょう。
化学反応を利用して金属イオンが溶けた溶液から金属薄膜を得る技術、と理解していただければOKです。
3.そもそもなんでめっきするのか?
例えば次のような例を考えましょう。
あなたはとある金属加工メーカーの技術者です。ある時上司から
「なるべく軽い金属球を作ってくれ。軽ければ軽いほどいい。ただ、外で風雨にさらされるから、錆びにくいものにしてくれ。電気も流すから、電導性のいいやつな。あ、内部空洞にするのはダメだかんな」
あなたは頭を抱えることになるでしょう。なるべく軽い金属球というと、現実的にはアルミニウム球がいいだろう。しかし、アルミニウムは錆びやすい金属である。錆びを防止するためなら、表面に塗料を塗れば解決できるだろうが、そうすると今度は電導性が得られない。錆びにくく電導性のいい金属といえば銀や金があるが、いずれも高価な上にとてつもなく密度が高い(重い)。さてどうするか? 軽くて錆びずに電気をよく通す。そんな金属があるのか!?
実は、上の例はめっきを使えばたちどころに解決してしまいます。まずアルミニウムの金属球を用意します。しかし、アルミニウムだけでは錆びやすいので、表面にニッケルをめっきしましょう。さらに電導性をよくするに、最表面に金をめっきしましょう。表面に薄くめっきするだけなので、ニッケルも金も少量で構わないし、重さもほとんど変わりません。しかも錆びにくくて電導性も良くできる。素晴らしい! 最高ではありませんか!
これがめっきをする理由なのです。単一の金属では必要な物性が得られなくとも、表面に何層か他の金属をめっきすることで、必要な物性が得られるようになるのです。これこそがめっきをする理由であり、めっきが現代にいたるまで大きな影響力を保持し続けてきた理由なのです。
このようなめっきの特徴が威力を発揮する分野としては、例えば電子回路があります。電子回路は、当然ながら電気をよく流さなければなりません。最もよく電気を流す金属は銀ですが、銀は高価なため(それでも貴金属の中では安いが)、通常は価格と電導性の観点から銅が使われます。しかし、10円玉を想像していただければわかる通り、銅は錆びやすい金属です。使っているうちに回路が錆びてしまいましたではお話になりません。そこで、最表面に錆びないよう金をめっきするのです(実際には、銅の拡散を防ぐため、さらにニッケルを挟む)。最表面を金とすることで、ワイヤボンディングやはんだなどでの接合も容易になりますし、耐食性もよくなります。もしあなたがスーパーファミコン世代なら、ファミコンカセットの読み込みが悪いときに、カセットをふーふーと吹いたことがあるのではないでしょうか? あのカセットのコネクタ接触部分にも金が使われています。ファミコンカセットでなくとも、LANケーブルやUSB端子など、金めっきが使われている箇所は多か所に上ります。このように、めっきは現代文明に必要不可欠なのです。

4.めっきの利点と欠点
さて、金属表面に他の金属を付けるのは、別にめっきでなくても可能です。例えば真空蒸着、例えばスパッタリング、例えば溶射など。上げていけばキリがありません。ではめっきの利点とは何なのでしょうか? 筆者が思うに、それは設備投資とエネルギー効率だといえます。
めっきを行うのに最低限必要な設備とは何か? めっきの種類にもよりますが、ここでは電源などが不要な無電解めっきを考えたいと思います。無電解めっきを行うのに本当に最低限必要な設備とは、大きな水槽と、ヒーター。これだけです。
え!?
と思われたあなた。本当にこれだけなのです。えぇ、そりゃちゃんと高品質なめっきを得るには、脱脂だの水洗層だのと諸々が必要なのですが、品質も何も考えずにただめっきをしたいだけなら、水槽とヒーターがあれば十分です。電解めっきの場合は、陽極と整流器が必要ですが、それも精々数万円すれば入手できるでしょう。合計して、数十万円あれば十分です。
比較対象として、真空蒸着を考えましょう。真空蒸着を行うには、ドでかい真空蒸着装置が必要です。一台数百万、いや数千万はするだろうか。めっきと比べると雲泥の差です。しかも、普通に大気中で行えるめっきとはことなり、成膜中は真空装置の内部。手を入れたり内部の様子を見ることも難しい。しかも、基板を入れて真空ポンプで真空状態にし、成膜する金属を高温に加熱して蒸着するというのは、時間もかかるし手間もかかる。めっきなら、液に浸漬して数分から数十分待てばそれで終わりです。めっきの方が、はるかに効率的で設備投資額も低くてすむことがお分かりいただけたでしょうか? もちろん高品質なめっきのためにはより多くの設備が必要ですが、それでも巨大で精密な真空蒸着装置よりかははるかに安く済むのです。必要なエネルギー量も少なくてすみます。
ここまではメリットの話しかしていないので、デメリットの話もしておきましょう。めっきのデメリットとはずばり、
化学反応を用いているという一点に尽きます!
化学反応が上手くいっていればいいのですが、一たび変なものが混入したりして化学反応が上手く進まなくなってしまったら一大事です。ろ過したり活性炭処理したりで済めばいい方で、最悪の場合めっき液を全交換するしかないこともあります。一方、真空蒸着はこのようなデメリットとは無縁です。蒸着装置が故障でもしない限り、ちゃんと成膜できる。溶射やスパッタも同様です。めっきで高品質な成膜を行うには、めっき液に関する化学反応を理解し、めっき装置だけでなくめっき液の面倒をきちんと見なくてはならないのです。
このようにメリットとデメリットの両方が存在しているものの、それでもメリットの部分が非常に大きいため、めっきは現在も使われ続けているのです。
5.めっきの反応と種類
さて、ここまでめっきがどういうものかについて説明してきましたが、そろそろめっきの反応について解説していきましょう。めっき液中で起きている反応は多岐にわたりますが、こと成膜に関しては、次の半反応式だけを知っていれば十分です。
Mn+ + ne- → M
ここで、Mn+はn価の金属イオン、e-は電子、Mは成膜された単体の金属です。つまり、n価の金属イオンがn個の電子を受け取って、単体の金属ができるという反応です。めっきにはいろいろと種類があるものの、いずれのめっきに於いても必ずこの反応が起きています。違うのは、ne-の部分、つまり金属イオンMn+を還元するのに必要な電子の出どころだけです。この電子の出どころは、電解めっきでは外部電源、無電解還元めっきでは還元剤が電子の出どころとなります。
さて、今ちらっと出た電解めっきだの無電解めっきだのについて触れておきましょう。めっきにはいろいろな種類があると言いましたが、ものすごーく大雑把に分類するなら、たったの2種類しかありません。電解めっきと無電解めっきです。電解めっきとは、めっき液に外部電源を接続して、電流を流すことで金属を成膜する方法であり、無電解めっきは外部電源を使わずに、化学反応だけで成膜する方法です。それぞれにメリットとデメリットがあるのですが、今回はまず電解めっきについて解説しましょう。電解めっきは、全てのめっきの基本。まずは基本から押さえていくことにしましょう。なお、無電解めっきに関しては次章でお話しすることとしましょう。
6.電解めっきって?
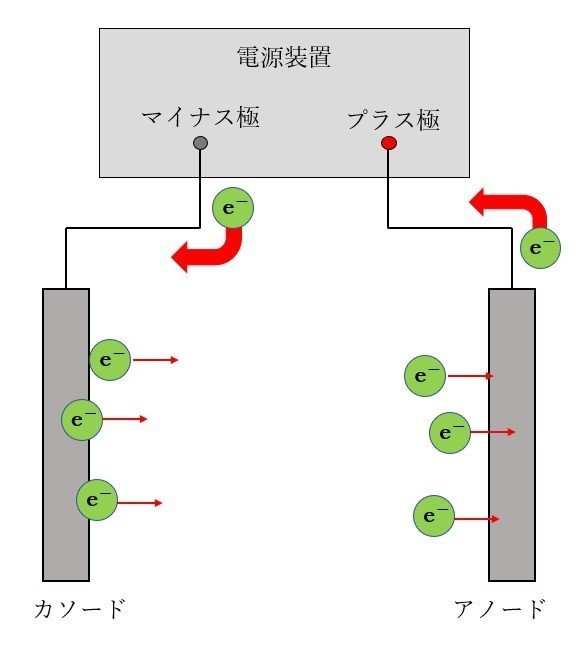
電解めっきでは、めっき液に電流を流して成膜する。中学校や高校の理科の実験で、電気分解の実験をやった人もいるのではないでしょうか? あれとほぼ同じです。つまり、プラスとマイナスの電極をそれぞれめっき液に差し込み、電源を繋いで電流を流すのです。実際には、マイナスの電極はめっきする製品となり、ここで金属が成膜する。プラスの電極は色々とあるので、これに関しては後述します。ちなみにめっきにおいては、マイナス極のことをカソード、プラス極のことをアノードと呼びます。本記事でも、以降この呼び方で進めていくこととしましょう。めっき屋は、こだわりが強いのです。
さて、カソードは電源のマイナス極に繋がっています。マイナス極からは、電子が次々と送り出されてきます。一方アノードでは電子が次々と吸い込まれていく。これらの電子はめっき液中でどのように反応するのでしょう? それぞれ見てみましょう。
7.カソード反応
カソードから次々と送り出されてくる電子は、受け取るものがいなければそのまま電極表面に溜まり、電源電圧に比例した電荷が溜まったらそこで終わりとなります。これはいわゆるコンデンサーと等しい状態です。しかし、今はめっき液が電極付近で反応するという条件を考えています。反応が進む場合、どうなるでしょうか?
電子を受け取るというのは、つまり還元反応です(酸化還元の定義については高校化学の教科書を見てほしい。電子を失うのが酸化、得るのが還元である)。金属イオンが溶けている水溶液の場合、電子を受け取りうる物質は2つあります。金属イオンと、水素イオンです。それぞれの反応は次のようになります。
Mn+ + ne- → M …………(1)
2H+ + 2e- → H2 …………(2)
(1) の反応がいわゆるめっきです。基板に電源装置のマイナス極を繋いで電流を流
せば、(1)の反応が起きて金属が成膜できるのです。では(2)の反応は、何でしょうか? 実は、(2)の反応は副反応と呼ばれるものなのです。この副反応は、水溶液を用いるめっきにおいては多かれ少なかれ必ず起きるものです。つまり、流した電流が100%めっきに使われるわけではないのです! これは後々問題となりますので、覚えておきましょう。
8.アノード反応
アノードでは電子が次々と吸い込まれていきます。つまり、電子が奪われる酸化反応が進みます。アノード反応は正直複雑であり、めっき液によっても反応の種類が異なり、それを網羅して説明するのは大変です。そこで、ここでは電解めっきの中でも比較的有名なニッケルめっきを例に挙げて説明しましょう。電解ニッケルめっきでは、アノードにニッケル板を使用し、ニッケル板表面では以下のような酸化反応が進行します。
Ni → Ni2+ + 2e- …………(3)
(3)の反応は、ニッケルの溶解反応となります。ちなみに、中学校時代の水の電気分解の実験を覚えている人は、アノードで酸素が発生すると思うかもしれません。しかし、酸素というのは意外と発生しにくいものなのです。溶液中に他に酸化されやすい物質がある場合、基本的にその物質が優先的に酸化され、酸素発生は進行しません。つまり、アノードにおける(3)の反応は100%進行するのです。ここが、カソード反応と異なる点です。
ちなみに、金めっきではアノードに不溶性の陽極(Ptめっきされたチタンなど)を用います。この場合、浴中成分によっては酸素が発生することもあります。
9.めっき液に必要な成分とは
さてここまで来たら、次はめっきに必要な成分について見ていってみましょう。これまでの解説からは、水に金属イオンを溶かして電気を流せばめっきができると思われる方が大部分なのではないでしょうか? それはある意味で正しいのです。しかし、高品質なめっき皮膜を得るには金属イオンだけでは不十分なのです。では実際に、どのような成分が必要なのでしょうか? めっき液に使われうる成分について下に列挙してみたので見ていただきましょう。
金属イオン(※)
錯化剤(※)
pH緩衝剤(※)
電導塩
還元剤(無電解還元めっき液のみ)
キレート剤
界面活性剤
結晶調整剤
光沢剤
析出抑制剤
析出促進剤
陽極溶解剤
下地保護剤
安定剤
電位調整剤
なんかよく分からんけど入れとくとなんか調子いいからとりあえず入れてるアレ
ちなみに※印はほぼ確実に入っている成分です。凄まじい数ですが、事実これらはめっき液に含まれている成分なのです。もちろん、めっき液の種類や、めっきの目的によって入れる成分入れない成分は出てきますし、1つの薬品で複数の役割をこなしているといった場合もありますが、現実問題としてこれぐらいの種類の成分は必要なのです。めっき薬品メーカーをやってきた筆者が知る限り、大体のめっき液には最低限5種類程度の成分は入っています。多いものでは10種類ぐらいは入っているでしょうか。このあたりは各薬品メーカーのトップシークレットであり、私自身も口外すると裁判沙汰になる成分をいくつも知っているので、拷問にでもかけられない限り公にはできません。しかし、一般に公開されているごく普通の組成については、その気になれば一般人でも調べられる程度であるため、以下ではそれについて解説することにしましょう。とはいえ、全てを解説するとすさまじい時間がかかるので、ここでは※をつけたうち、これまで出てきていない錯化剤とpH緩衝剤について解説しましょう。
10.錯化剤とは
錯化剤とは!
配位子のことである!
たった2行で終わってしまったが、さすがにこれだけではよく分からないだろうから、詳しく説明しましょう。
めっきには金属イオンが必要だと説明しましたが、金属イオンはただそのまま溶液中に溶けているわけではありません。基本的には、錯化剤(配位子)と呼ばれる分子によって周囲を取り囲まれた状態で溶けています。高校化学で錯イオンというのを習った事と思います。あれのことです。専門的には、配位子のローンペアーが金属の軌道に電子を供与して結合するのですが、まぁ細かいことは置いておきましょう。ざっと次の図のような感じで金属を取り囲んで錯体(錯イオン)を形成しています。

ちなみに、錯体化学でいう配位子のことをめっき業界では“錯化剤”と呼びます。めっき業界は、なぜか用語に変なこだわりがあるので、とりあえず以下でもその慣習に倣って錯化剤と呼ぶことにします。
なぜわざわざ錯体の状態にするのか? それは、裸の金属イオンでは、めっき液という厳しい環境で生きていけないからなのです。
めっき液中の環境は、想像以上に厳しいものです。アノードおよびカソード表面でのpHジャンプ、他の添加剤との副反応、無電解めっきであれば還元剤との反応等、とにかく凄まじく厳しい環境です。特に問題となるのが、アルカリ側にずれる場合です。ニッケルや銅といった比較的安い金属(以下卑金属と呼ぶ)は、アルカリ性にすると水酸化物となって沈殿してしまうのです。金属イオンは常にこのような危険性と隣り合わせ状態なのです。
つまり、裸状態の金属イオンでめっき液に挑むというのは、丸腰で飢えたライオンの檻に突撃するようなもんなのです。そこで、宇宙世紀のMSパイロットがノーマルスーツを着るがごとく、金属イオンは配位子の庇護を受けながらめっき液に挑むのです。配位子による“錯化”状態にあれば、多少のpH変動ではびくともしなくなります。また、金属と錯体の種類によっては溶解性も向上します。
配位子にはいろいろと種類があるものの、多くはハロゲンや塩基性化合物、配位性官能基を持った有機化合物です。配位子と金属イオンの組み合わせについては、色々と相性があるので、以下ではその相性を予測する重要な規則をご紹介しましょう。
11.配位子と金属との相性
配位子と金属イオンとの相性を予測する重要な規則として、HSAB則という規則があります。イオンを硬さ、軟らかさというパラメータで分け、陽イオンと陰イオンの相性の良さを判定するのがHSAB則です(イオンじゃなくてもいいのですが、ここでは分かり易くするためイオンとして考えます)。“硬さ”というと、なんともよく分からない表現ですが、硬いイオンというのは一般にイオン結合性が強いものであり、軟らかいイオンは共有結合性が強いものです。と、こんな感じで説明されてもまだ分らないでしょうから、以下の例を考えてみましょう。
鉄の原料と言えば鉄鉱石ですが、鉄鉱石の主成分をご存じでしょうか? 答えは酸化鉄(III)(化学式はFe2O3)です。では、銀の原料をご存じでしょうか? 日本で算出する銀鉱石の多くは輝銀鉱(Ag2S)です。酸化鉄(Fe2O3)と輝銀鉱(Ag2S)。これらはいずれも、金属イオン(Fe3+,Ag+)と、カウンターアニオン(O2-,S2-)との化合物です。自然界からこれらの形で算出するということは、これらの化合物は安定であるということに他ならないのですが、ではなぜFe3+の相棒はO2-なのか? Fe2S3であってもいいのではないか? そう思われないでしょうか?
実は、相棒が逆になった化合物も普通に存在します。しかし、それらはいずれも不安定なのです。Fe2S3は、空気中で簡単に酸化されて酸化鉄(Fe2O3)と硫黄(S)に分解します。酸化銀(Ag2O)は、加熱すると単体の銀(Ag)と酸素(O2)に分解します。しかし、鉱石として出てくる形態は極めて安定です(でないと、地中の高温や高圧にさらされた段階で分解してしまう)。この違いは何なのか?
実はこの違いこそが、イオンの硬さの違いなのです。Fe3+とO2-は硬く、Ag+とS2-は軟らかい。つまり、硬いもの同士、軟らかいもの同士は相性が良く、硬いものと軟らかいものは相性が悪いのです。

このHSAB則というのは、実験的に判明した傾向を説明するために作られた規則であるため、かなりふわっとした概念なので、化学者以外には分かりづらいかもしれません。もしあなたが百合厨やカプ厨やBL厨なら、あのキャラとあのキャラのカプはありだけど、こっちのキャラとのカプはさすがに無いな~と思えるような例が幾つかあるのではないでしょうか? それと似たような感じだと考えていただければ差し支えありません。あるいはこういう考え方もあります。旅行先のホテルで、朝食にフレンチトーストと緑茶が出てきたらどう思いますか? 納豆と鯵と味海苔とパンを出されたら? 山奥の老舗の温泉旅館で朝食にカレーとナンが出てきたらどう思いますか?
硬いイオンと軟らかいイオンの相性の悪さというのは、上記のような感じなのです。フレンチトーストにはコーヒー、納豆と鯵と味海苔にはご飯の組み合わせが最良であるように、イオンにも相性のいい組み合わせと悪い組み合わせがあるのです。
HSAB則に則ったイオンと錯化剤の組み合わせ例を以下の表にまとめました。

金属イオンと錯化剤の相性の良さは重要ですが、しかし相性が良すぎても良くありません。相性が良すぎるということは、それだけ安定ということで、場合によっては電気を流しても金属が析出しなくなってしまいます。なので、ある程度の安定性はあるものの、安定になりすぎない錯化剤をチョイスしなければならないのです。一般的に使われる錯化剤はある程度決まっているものの、全く新しいめっき液を作りたい、あるいは新種の合金めっきを作りたいとなったら、錯化剤の選定から始めなければならないことも多々あるのです。
12.pH緩衝剤
pH緩衝剤の話で第一回を締めくくることにしましょう。pH緩衝剤とは、細かい原理は置いておきますが、ある一定のpH範囲内においてpH変動を抑制するものと考えていただければ大丈夫です。
pH緩衝剤もめっき液に於いては重要です。一部の強酸や強アルカリの液を除いて、何がしかのpH緩衝剤を含んでいることがほとんどです。なぜpH緩衝剤が必要なのか。pH緩衝剤が無ければ、酸やアルカリのちょっとした混入でpHが大きく狂ってしまうし、電解に伴うpH変動にも対応できないからです。電解に伴うpH変動とはなんでしょうか? もう一度、アノード反応とカソード反応を見てみよう。ここでもニッケルめっき液で考えます。
カソード反応
Ni2+ + 2e- → Ni …………(1)
2H+ + 2e- → H2 …………(2)
アノード反応
Ni → Ni2+ + 2e- …………(3)
両者を見比べてみると、アノードの溶解反応が100%進むのに対し、カソードの析出反応は100%進みません。このカソードの反応が問題です。(2)式を見てください。分かり易くなるように、(2)式の両辺に2OH-を加えてみましょう。
2H2O + 2e- → H2 + 2OH- …………(4)
(4)式を見てもらえれば分かる通り、電解反応が進むとOH-が増えていくことになります。つまり、浴がアルカリ側(pHが高い方)に動いていくのです。pH緩衝剤がなければ、あっという間にアルカリ側に傾いて水酸化ニッケルが沈殿してしまうでしょう。これはあくまで一例であり、浴種によっては酸性側に傾いていくこともあります。アルカリ性の浴の場合、空気中の二酸化炭素を吸収することでpHが酸性側に傾いていくこともありえます。こういった電解に伴う副反応によるpH変動を防ぐためにも、pH緩衝剤は重要なのです。もっとも、pH緩衝剤を添加したとしてもpHの変動を完全に抑制するのは困難であり、めっき工場では日々pH変動を監視してpH調整を行っているのが実情です。
このように、めっき液は常にpH変動要因と隣り合わせなのです。その影響を最小限にするために、pH緩衝剤が入っているのです。
ここまで、金属イオン、錯化剤、pH緩衝剤の役割について解説しました。しかし、めっき液中の成分はほかにも多数ありますし、めっき液には無電解めっきもあります。次回は、無電解めっきとその浴中成分の役割について取り上げる予定です。
