
BioNTechのRNAコロナワクチンはSV40プロモーター/エンハンサー配列を含む大量の残留DNAで汚染されている: Science, Public Health Policy and the Lawに掲載された論文から
コロナワクチンのDNA汚染問題は2023年2月、アメリカのKevin McKernan先生によって彼自身のブログ上で初めて報告されました。McKernan先生は、BioNTech / Pfizer社およびモデルナ社のワクチンがスパイク遺伝子とベクター由来の残留DNAで汚染されている事を発見したのです。McKernan先生はその後もコロナワクチンのDNA汚染の検証と関連情報の発信を精力的に続けており、海外では既に複数の研究者がMcKernan先生の発見の追試に成功しています。

https://x.com/hudikaha/status/1864330736259747845
表1はmRNAワクチンのDNA汚染についての国内外の検証実験の状況を藤川賢治先生がまとめられたものです。DNA汚染問題は既に海外では大きなスキャンダルとなっています。
今回紹介する論文の著者であるKämmerer博士らによるコロナワクチンのヒト細胞株への導入実験については以前にも紹介した事があります。この度、Kämmerer博士らのDNA汚染問題の検証実験の結果が査読を通って発表されましたので、紹介させていただきます。論文内では、ドイツで接種されたBioNTech社のワクチンもDNA汚染されているのか、そして汚染DNAはヒト細胞に導入されるのかを検証しています。
BioNTech RNA-Based COVID-19 Injections Contain Large Amounts Of Residual DNA Including An SV40 Promoter/Enhancer Sequence
Kämmerer et al. (2024) Science, Public Health Policy and the Law
https://publichealthpolicyjournal.com/biontech-rna-based-covid-19-injections-contain-large-amounts-of-residual-dna-including-an-sv40-promoter-enhancer-sequence/?utm_source=substack&utm_medium=email
BioNTechのRNAベースのCOVID-19ワクチンには、SV40プロモーター/エンハンサー配列を含む大量の残留DNAが含まれる
要約
背景:BNT162b2のRNAベースのCOVID-19ワクチンは、免疫反応のためのスパイクタンパクを効率的に生産するために、ヒト細胞にトランスフェクションするように指定されている。
方法: 私達は、HEK293細胞培養、免疫組織化学、ELISA、PCR、および質量分析法を適用し、4つのドイツ製ロットBNT162b2を分析した。
結果: 私達は、HEK293細胞へのヌクレオシド修飾mRNA (modRNA) 生物製剤の導入が成功した事を実証し、細胞培養の数日間、強固なレベルのスパイクタンパクが産生される事を示した。細胞培養液への分泌は、主にエクソソームマーカーが豊富な細胞外小胞を介して行われた。さらに、これらのバイアルのRNAおよびDNA含有量を分析し、臨床用量あたり32.7 ngから43.4 ngの濃度で、全てのロットでRNase A消化後に大量のDNAが確認された。これは、国際的な規制当局が設定した臨床用量あたり10 ngという最大許容濃度をはるかに超えている。 選択したPCRプライマーペアを用いた遺伝子解析により、残留DNAはスパイク遺伝子をコードするDNAマトリックスの断片だけでなく、SV40プロモーター/エンハンサーや抗生物質耐性遺伝子を含むプラスミド由来の全ての遺伝子の断片を表している事が証明された。
結論:我々の結果は、BNT162b2ワクチンの安全性について重大な懸念を提起するものであり、これらの懸念が払拭されない限り、全てのRNA生物学的製剤の即時中止を求めるものである。
コロナワクチン由来のスパイクタンパクは細胞外小胞を介して細胞外に分泌される

実験に使用されたのはBioNTech (Comirnaty コミナティ) ワクチンの4種類のロットです。このうちFD7958、FE6975、EX8679は一価ワクチンであり、HD9869のみが二価ワクチンでした。
BioNTech社はドイツのマインツに本社を置くバイオテクノロジー企業であり、Pfizer (ファイザー) 社とともにコロナワクチンの開発に携わってきました。BioNTechとファイザーはコロナワクチン3億回分をEUに、3000万回分をイギリスに、1億回分をアメリカと中国にそれぞれ提供する契約を締結していました。またBioNTechは、HIVそして結核への感染を予防するための前臨床ワクチンおよび免疫療法を開発するプログラムについて、ビル&メリンダ・ゲイツ財団との間にも契約を結んでいます。
実験が行われた時点 (2023年) では、4つのロットのうち3つのロットの一価ワクチンに関しては、メーカーが当初設定していた有効期限は既に切れていましたが、バイアルは未開封であり、なおかつ常に-80℃の状態で保存されていたものでした。またその有効期限自体もドイツのワクチン規制当局のパウル・エールリヒ研究所 (PEI) によって数回にわたり公式に延長されていました (2021年9月10日:6ヶ月から9ヶ月へと延長、2022年3月/4月:9ヶ月から12ヶ月へと延長、2022年12月2日:12ヶ月から18ヶ月へと延長)。そのため筆者らは、バイアルの品質が実験結果へ与える影響は無いと判断しています。
遺伝子導入実験には分裂中のヒト細胞のモデルとしてヒト腎臓細胞 (HEK293) が使われました。実験の際にはトランスフェクション試薬は一切添加されていないにも関わらず、4つのロットの全てにおいてHEK293細胞への遺伝子導入は成功し、スパイクタンパクの強い発現が免疫組織化学的により実証されました (図1A)。これは脂質ナノ粒子を介して細胞へのトランスフェクションが起こった事を意味します。スパイク陽性細胞で評価した遺伝子導入効率は、ロットFD7958では90.5%、ロットFE6975では74.6%、ロットEX8679では76.4%、ロットHD9869では80.7%、未処理細胞では0%でした。トランスフェクション後の細胞では大型の空胞が見られたように細胞障害の徴候を示しました (図1B)。
ELISA法による解析では4つのロット全てにおいて早くも1日後にはスパイクタンパクが明確に発現し、5日後まで生産量が増加し、7日後には1日後よりもスパイク濃度がさらに高くなりました (図1C)。
さらにELISA法を用いてトランスフェクトされた細胞の培養上清中のスパイクタンパクを分析すると、3種類の一価ロットでは、培地中のスパイクタンパクの量が時間とともに明確に増加していました (測定値は0日目からそれぞれの時点までの累積量) (図1D)。これはスパイクタンパクが細胞表面に存在している事のみならず、細胞からも分泌された事を意味します。
二価ロットであるHD9869では、トランスフェクトされた細胞の培地中のスパイクタンパク濃度はELISAの検出限界を下回りました (図1D)。おそらくこれは、ロットHD9869が二価ワクチン (武漢株とオミクロン変異株) であり、使用されたELISAが武漢株のみを検出し、オミクロン株由来のスパイクタンパクは検出されなかったためでしょう。

筆者らはロットGH9715をHEK293細胞株にトランスフェクションし、スパイクタンパクがどのようなメカニズムで培養上清中に分泌されるのかを質量分析法によって解析しました。細胞外小胞の分画に細胞外小胞が濃縮されている事が細胞外小胞マーカー (CD81、TSG101、alix) によって確認できます (表1)。スパイクタンパクが細胞溶解物のみならず、細胞外小胞からも検出されたのです。このように、スパイクタンパクはエクソソームなどの形態で細胞外に分泌されていると考えられます。
mRNAコロナワクチンにはEMAの規制値を4〜5倍超過するDNAが混入している
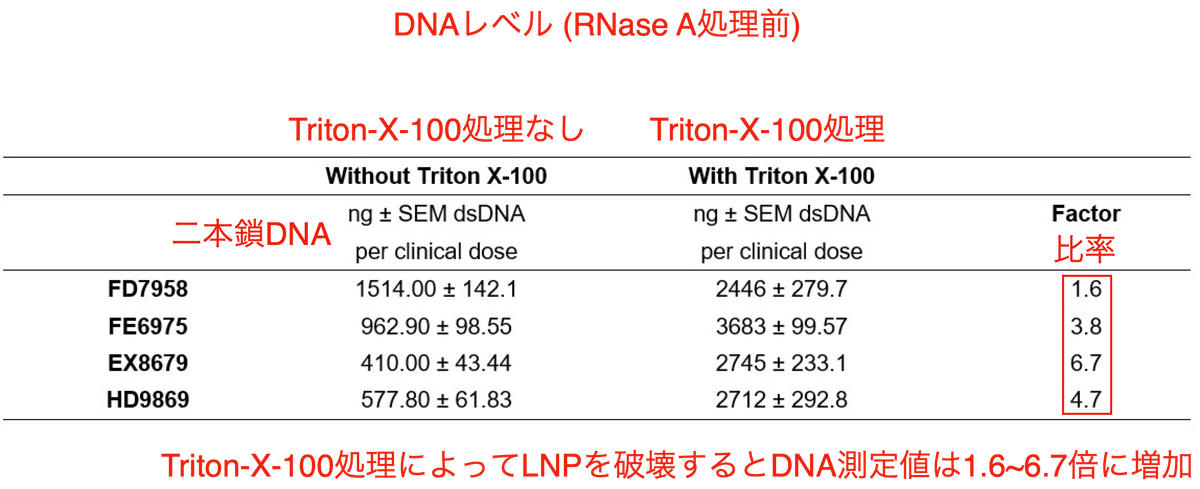
予備試験として1%のTriton-X-100処理によりLNPを開口すると、DNA含有量が1.6倍から6.7倍に増加しました (表2)。この比率の差は、製造工程におけるDNA残渣のLNP充填におけるばらつきの大きさを反映しているものと考えられます。Triton-X-100処理によりDNA測定値が増加するのはLNPからDNAが放出されたためであり、これは汚染DNAがLNPに封入されていた事を意味します。
以降の実験は全て、Triton-X-100処理を施したサンプルを用いて実施されています。

Qubit RNA High Sensitivity Assayによる解析では、バイアル中には臨床用量あたり30 µgのRNAが含まれており、これはメーカーの申告通りのRNA量でした (図2A)。そして、10倍希釈したバイアルの内容物を 1% Triton-X-100処理後にRNase未処理のまま蛍光光度計によって分析したところ、1回の臨床投与あたり1326~4225 ng という高濃度の二本鎖 (ds) DNAが検出されました (図2B)。
AccuBlue法では3つのロットで最も低いDNA濃度を示し、そのうちロットFE6975では Qubit法と同じ濃度を示しました (図2B)。4つのロットのうち3つのロット (FE6976、EX8679、HD9869) については、Pico Greenアッセイが最も高いDNA濃度を示し、ロットFD7958については、QubitアッセイがPico Greenアッセイよりもわずかに高いDNA濃度を示しました。これらは二本鎖DNA検出用のキットです。
RNAによる干渉を排除するためにRNase-A処理を行うと、残留DNAの量は臨床用量あたり32.71 ngから43.38 ngでした (図2C)。これは 1 mgのRNAあたり1.23 µg~1.62 µgのDNAに相当し、欧州医薬品庁 (EMA) が設定した上限値を4~5倍も上回っています (図2D)。
ちなみにAccuBlueによる測定においては、RNaseA未処理サンプルでは最も低いDNAレベルが示され、RNaseA処理後では最も高いDNA含有量が示されました。AccuBlueは使用した3つの試験システムの中ではRNAとの相互作用は最も低いために、DNA濃度測定の際のRNAとの交差反応が最も少なかったのです。
SV40エンハンサーを含めて、汚染DNAは細胞内に取り込まれる
上記のように汚染DNAはLNPに封入されていると見られますので、ワクチンRNAのみならず汚染DNAそのものもトランスフェクションされたかどうかを検査するため、トランスフェクション細胞からDNAが精製されました (トランスフェクションの6時間後)。ここで注意すべき点としては、DNA精製に用いられたキットは環状プラスミドDNA精製用キット (Gene Jet Plasmid Mini Kit) であるため、小断片DNA量は過小評価される可能性があるという事です。

図3AはBioNTechがmodRNA製造のテンプレートとして使用したDNAプラスミドです。PCRで増幅される領域 (SV40プロモーター/エンハンサー、ネオマイシン耐性カセット、ORIレプリコン、スパイクタンパク) には1から7までの番号が振られています。これらの遺伝子をPCRで増幅したところ、4つのロット全てのバイアルからスパイク、オリ、ネオマイシン耐性カセット、SV40エンハンサーのPCR産物が検出されました (図3B)。またそれだけではなく、トランスフェクション後の細胞のDNAからも同様に正しいサイズのPCR産物が検出されたのです (図3B)。ポジティブコントロールはSV40含有プラスミドの混入がすでに証明されているロットGH9715です。
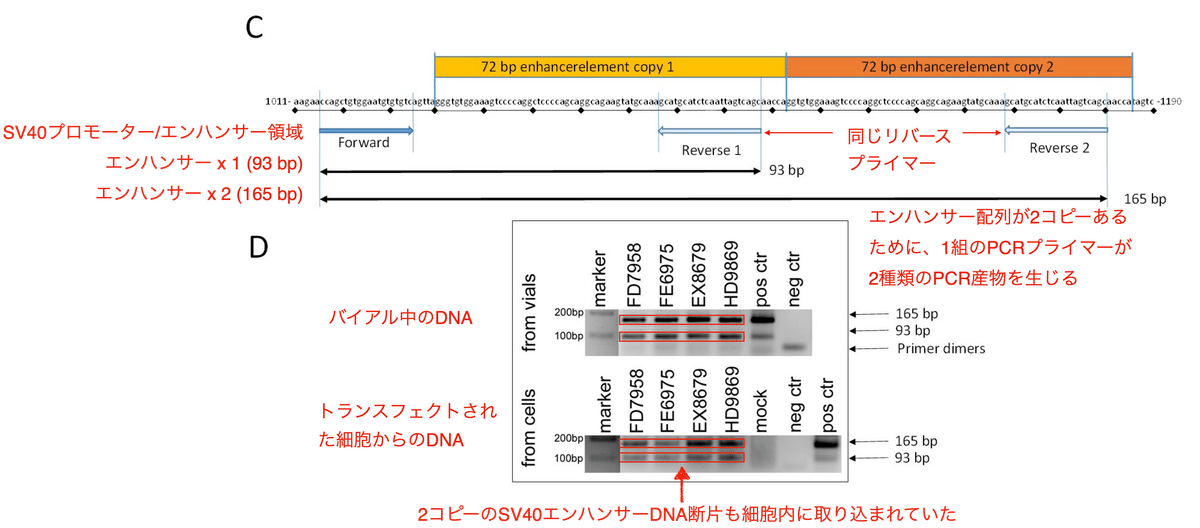
BioNTechの鋳型プラスミドには2コピーのSV40プロモーター/エンハンサー領域が存在します (図3C)。同一のリバースプライマーが結合する配列が2箇所にあるために、1組のPCRプライマーが165 bpと93 bpの2つの増幅産物を生じます。これら2つのPCR産物はどのバイアルからも、また、トランスフェクトされた細胞のDNAからも検出されました (図3D)。
一本鎖DNAも加えると汚染DNA量はおそらくEMA基準の数倍をはるかに越える
今回の研究で検出された汚染DNA量は1回の臨床用量あたり32.7~43.4 ngでしたが、これはWHOが注射用生物学的製剤での許容範囲であると宣言している10 ngという上限値をはるかに超えるものでした。
さて、ここで留意すべき点があります。今回DNAの測定に使われたのは二本鎖DNA用のキットであり、一本鎖DNAは対象外だという事です。ここから先は私自身の考察になります。

図4は私自身で描いたものです。RNase処理によって分解されるものは純粋なRNAのみならず、RNA/DNAハイブリッド中のRNAも含まれます。RNase処理後にDNAの測定値は激減しますが、これはRNA/DNAハイブリッドの消失も影響しているでしょう。しかし、本来測定すべき汚染DNAには二本鎖DNAに加えて一本鎖DNAやRNA/DNAハイブリッド中の一本鎖DNAも含まれるのです。
相同性組換えは二本鎖DNA末端からの一本鎖DNAの露出 (リセクション) を起点として開始されるように、一本鎖DNAはDNA組換え能が高いのです。この一本鎖DNAの性質はゲノム編集におけるゲノムの組換えにも応用されています。このように汚染DNAに含まれる一本鎖DNAもゲノムへに統合されるリスクが高いものです。
なぜ汚染DNAが危険なのか
DNAの汚染量はEMAの基準を既に越えていますが、一本鎖DNAまで含めるとこの量はさらに超過するでしょう。また、実際には汚染DNAの質量よりも「数」がより問題となります。これらの断片のそれぞれがゲノムを攻撃する「散弾」となり得るからです。
Kämmerer博士らがこの研究で改めて示したように、mRNAコロナワクチンへのDNA汚染の問題とは、DNAがLNP内に封入されているために細胞に容易に取り込まれるからに他なりません。生物学的製剤中の残留DNAの公式な限界値は脂質ナノ粒子のようなトランスフェクション試薬にパッケージ化された核酸に対しては定義されていません。実際そのような注射剤において残留DNAの安全レベルを定義する事を許可する科学的根拠は存在しないのです。
またこの論文において、McKernan先生らによって報告されていたコロナワクチン中に含まれるSV40プロモーター/エンハンサーのDNA配列の存在が再確認されました。72bpのSV40プロモーター/エンハンサー配列が深刻な問題になる理由は、細胞核へのDNAの輸送を促進しゲノム統合のリスクを高めるためです。しかもこの配列は、BioNTech/Pfizer社がワクチンの承認手続きのために提出したプラスミドマップでは公開されていませんでした。ではなぜメーカーは、本来不要であり危険な配列をわざわざワクチン鋳型プラスミドに組み込み、その事実を隠匿していたのでしょうか。
細胞内に取り込まれ、核に輸送される大量のDNA断片はランダムにゲノムに取り込まれる懸念があります。そして、ランダムなゲノムの組換えや変異こそが癌の原因なのです。ワクチン中の汚染DNAがmRNAワクチン接種後のターボ癌の作用機序の一つと考えられます。
