
【まいけるアカデミア】アゾの話
まいけるです。最近、経費でボルハルトショアー現代有機化学を購入しました。大学有機化学の教科書として、つとに有名な一冊です。上下巻構成なので厳密には二冊かもしれませんが…
最近はすっかり忘れてましたが、やっぱりこういう本で勉強するのは楽しいものですね。というわけで何かを書きたくなってしまいまして、題材は何でもよかったんですが、芳香族ジアゾニウム塩のお話でもしようかなと思います。具体的にはベンゼンを出発物質として、塩化ベンゼンジアゾニウムの合成に至るまでの道のりを俯瞰し、その道中で脱線しながら四方山話を展開するとともに、塩化ベンゼンジアゾニウムの具体的な反応例を見ていきます。

ふだんギターのこととかくだらないことしか喋ってないからフォロワーの誰にも刺さらないと思うのですが、理系の高校生にはそれなりに役立つ内容かもしれません。
ベンゼンの合成
まずはベンゼンから。ベンゼンは、戦前は主にコークス製造における副産物として得られていました。しかし時代の流れとともに石油からのベンゼン合成へとシフトしてき、特にナフサ(注1)の接触改質が主要な製法として知られています。重質ナフサ(注1参照)を水素ガスと混合し、塩化白金/塩化ロジウム触媒存在下にて500-525°C, 8-50 atmで作用させると、脂肪族炭化水素が芳香族炭化水素へと変換されます。この時の粗生成物をさらに蒸留、溶媒抽出などによって分離精製すると、高純度のベンゼンが得られます。
ベンゼン→ニトロベンゼンの合成
次にニトロベンゼンの合成ですが、これには混酸(濃硫酸:濃硝酸=3:1の混合物)を使用します。芳香族化合物およびセルロースのニトロ化(注1)の際に用いられる酸です。
混酸の中では、強い求電子剤であるニトロニウムイオンNO2+が発生します。一方で芳香環は電子密度が高いために求核的です。よって両者が反応し、ニトロベンゼンが生成します。


ニトロベンゼン→アニリンの合成
アニリンはニトロベンゼンの還元によって得られ、200-300°C程度の高温で金属触媒を用いるのが一般的です。代表的な方法の一つとしてBéchamp還元が挙げられ、鉄触媒を用いる反応です。その機構は少々複雑ですがちゃんと書いておきます。
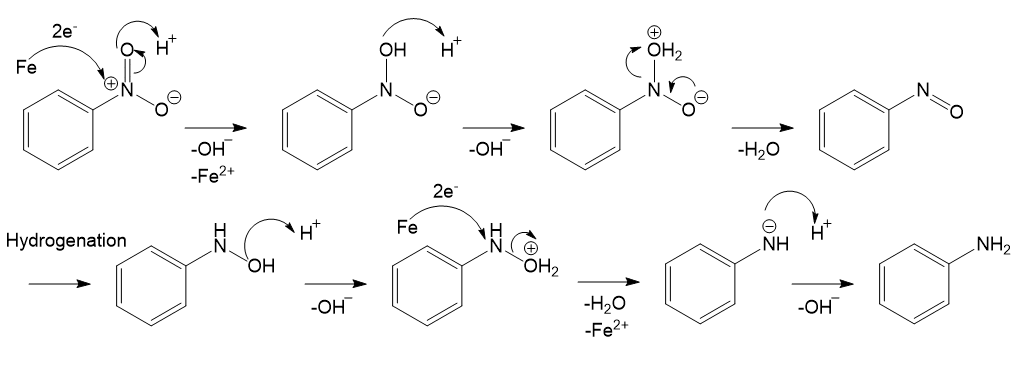
分かりづらいですが2分子のFe2+と4分子のOH-が生成しているので、最終的には2分子のFe(OH)2が生成するという形になります。また、この図中では酸の種類を明言していませんが、例えば塩酸などが使用可能です。
アニリンがらみで言うと、アニリンブラックというものがありました。アニリンを硫酸酸性のニクロム酸カリウム(注3)で処理すると、黒色沈殿が生成します。これをアニリンブラックと言い、現代でも黒色顔料として使用されています。

アニリン→塩化ベンゼンジアゾニウムの合成
ここが一番ごちゃごちゃしてます。基本的な登場人物はアニリン、亜硝酸ナトリウム、そして塩酸です。Na塩ではないただの亜硝酸を用いる選択肢もありますが、安定性に欠けるため、亜硝酸塩が使われることが多いです。
まず大事なのは、亜硝酸ナトリウムからのニトロソニウムイオンの生成です。名前は似ていますが、冒頭で登場したニトロニウムイオンとは別物なので注意が必要です。

次に、アニリンがニトロソニウムイオンを攻撃し、以下のような反応機構で進行します。最終生成物にはCl-が書かれていませんが、実際の反応系には塩酸の電離で生じたCl-がふよふよしているはずなので、そいつらがイオン結合してくれればOKです(こんな雑な説明でいいのか?)。

一点注意するのは、塩化ベンゼンジアゾニウムは安定性に欠けており、高温だとすぐに分解してしまいます。よって、この反応は5°C以下の低温で実施しないといけません。
塩化ベンゼンジアゾニウムの反応
目的物である塩化ベンゼンジアゾニウムが得られたところで、この物質がどように反応するか見てみます。
まず、先ほどの”5°C以下”という点ですが、5°Cを超える高温になるとフェノールに分解されてしまいます(C6H5N2Cl + H2O → C6H5OH + HCl + N2↑)。フェノールといえばクメン法ですが、さすがに面倒くさくなってきているので、もう書きません。
実際にはフェノール合成のためというより、アゾ染料合成のための出発物質として使われることが多いのではと思います(やっとタイトル回収できた…)。たとえば塩化ベンゼンジアゾニウムはN,N-ジメチルアニリンと反応して4-ジメチルアミノアゾベンゼンを与えます。このような反応様式はジアゾカップリングと呼ばれ、その他さまざまな基質と反応させることで種々の染料が得られます。
これは鮮やかな橙色を与える色素であり、バターイエローとの別名もありますが、酸性条件下ではプロトンが付加して赤色に変化します。つまりpHに応じて色が変わるので、pH指示薬として用いられます。


唐突に魔女が登場しましたが、なんの脈絡もなく出てきたわけではなく、あの知育菓子「ねるねるねるね」においても同様の現象が起きています。あちらの場合はアゾ染料ではなくアントシアニンが主成分です。
ブルブルブルブルアイアイ ブルーベリーアイ
— わかさ生活 広報部 (@WAKASASEIKATSU) April 8, 2023
(アイ!)
わかさ生活の ブルーベリーアイ
(アイ!)
アイ
アイ
アイアイアイ
北欧生まれのブルーベリーで
アントシアニンパワー!
(ブルブルブルブルブルブルブルブル・・・)
ブルブルブルブルアイアイ ブルーベリーアイ
(アイ!)
ブルブルブル文字数
↑一定以上の世代しかわからないやつ
ブルーベリーだけではなく、ムラサキキャベツとかにも含まれてます。子供の時、理科の授業や自由研究で、ムラサキキャベツでpHを測る実験をした人は多いのではないでしょうか。実はムラサキキャベツとねるねるねるねは、全く同じ原理が背景にあります。もう作図が面倒なので外部ソースに頼りますが、1番,2番…と混ぜていくとpHが徐々に変化し、アントシアニンが構造を変えることで別々の色に発色するのです。子供向け知育菓子にしては必要な知識レベルが高すぎないか?というのは禁句なのでしょう。

だいぶふざけてしまいましたが、もう一つ重要な反応としてザンドマイヤー反応があり、これは芳香族ジアゾニウムイオンをハロゲン化アリールなどの種々の置換生成物に変換する反応です。反応機構としては、1電子還元から始まるラジカル的な機構(Single Electron Transfer, SET)が提案されていますが、その実態は詳細に理解されているわけではありません。ジアゾニウム部分からN2が脱離し、生じたフェニルラジカルに置換基が導入されるというのが大まかな反応様式です。
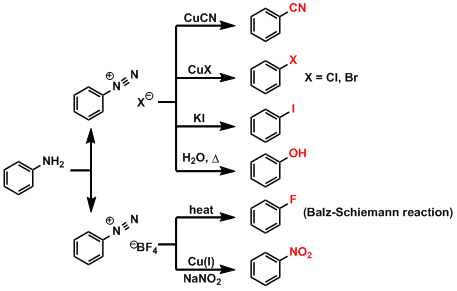
ここに示されているように、芳香族ジアゾニウム塩を起点とするザンドマイヤー反応では、実に多様な置換生成物が得られます。具体的にはシアノ化、ハロゲン化などが含まれます。これらの生成物を得るためには必ずザンドマイヤー反応を経由しなくてはいけない、なんてことはありませんが、(現にニトロベンゼンについては先ほど紹介しましたし、フェノールはクメン法などがありますし)合成戦略の幅を広げるという意味においては活躍する機会があるかもしれません。
ずいぶんいろいろと書きましたが、これでも本当に大学有機化学全体のごくごくわずかな部分しか触れていません。サハラ砂漠で啄木が一握の砂した程度です。一握の砂するとは? そのうちまた似たような話を書くかもしれません、書かないかもしれません。
時間があるよって人は注釈も読んであげてください。
注釈
(注1)我々が普段使っている石油製品はむろん原油から作られているわけですが、原油は広範囲な分子量(すなわち広範囲な沸点)を持つ炭化水素の混合物です。そのままでは雑多な成分がごちゃごちゃしていて扱いにくいので、常圧蒸留にて大まかに分離・精製します。沸点範囲がおよそ30-180°Cのものをナフサといい、そのうち低沸点な方(30-80°C程度)を軽質ナフサ、高沸点な方(80-180°C)を重質ナフサと言います。
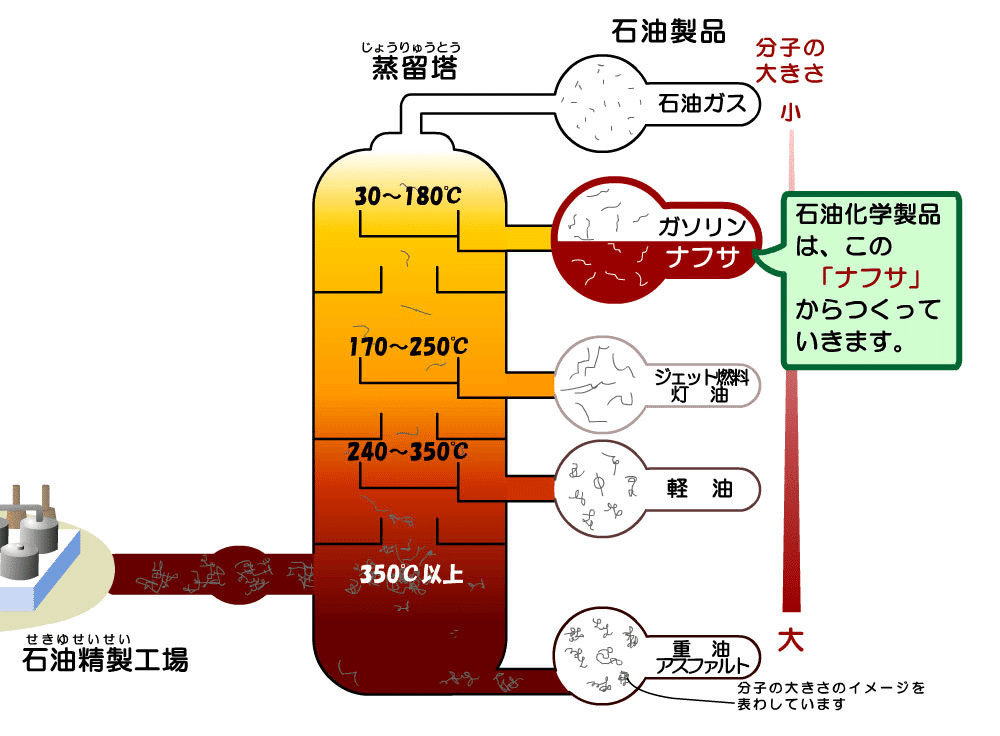
重質ナフサはガソリンの原料としても重要な意味を持っていますが、ところでナフサより下の方を見ると"軽油"がいます。レギュラーガソリンと間違えて軽油を給油してしまったというのは、昔から聞く典型的なミスですが、「引火」と「発火」の違い、そして一般的なエンジンとディーゼルエンジンの作動原理を知れば、なぜこのミスがNGなのか科学的に考察できます。
一般的なエンジンは、空気とガソリンの混合物をエンジン内部に吸気したあと、点火プラグの火花によって混合物を爆発させます。このときの膨張圧力がピストンを押し動かし、車の動力として作用します。火花を外部から供給することで爆発を生み出すので、この場合は「引火」が動力源になります。
対してディーゼルエンジンでは点火プラグは存在せず、「発火」を動力源とします。ディーゼルエンジンは燃料と空気の混合物ではなく、空気のみを吸気し、これを強く圧縮して高温の環境を作り出し、そこに軽油を噴射します。すると軽油は自然発火によって爆発し、これがピストンを押し動かします。
ではここで、ガソリンと軽油の引火点と発火点を比較してみましょう。ガソリンの方が引火点が低く、軽油との差は最大で90°C以上になります。つまり軽油は、ガソリンよりもずっと引火しにくいので、通常のエンジンでは燃料として使うには適しません。しかし発火点では関係が逆転し、軽油の方がガソリンよりも発火しやすいとわかります。つまりディーゼルエンジンにガソリンを入れると、先ほどとほぼ同じ現象が起きます。ガソリンは軽油よりも発火しにくいので、十分に燃えてくれないのです。よって通常エンジンに軽油を使用するのも、ディーゼルエンジンにガソリンを使用するのも、両者等しくNGな行為なのです。
実際には燃料効率の良し悪しだけで済む問題ではなく、不完全燃焼によって点火プラグが汚染されていき、最終的には点火不可能→自走不可能という事態にも発展しうるので十分に注意が必要です。

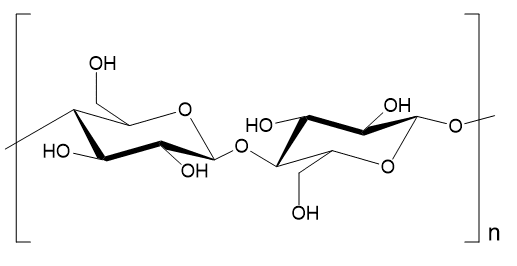
(注2)ギターのニトロセルロースラッカーの作り方も、基本的に同じらしい(https://www.ichimonzi.com/Reborn/2022/03/%E7%A5%9E%E8%A9%B1%EF%BC%81%EF%BC%9F%E3%83%8B%E3%83%88%E3%83%AD%E3%82%BB%E3%83%AB%E3%83%AD%E3%83%BC%E3%82%B9%E3%83%A9%E3%83%83%E3%82%AB%E3%83%BC%E3%81%A7%E5%A1%97%E8%A3%85%E3%81%99%E3%82%8B%E6%9C%AC.html)です。セルロースは、D-グルコースどうしがβ(1→4)グリコシド結合*してできる多糖で、グルコース1分子中にヒドロキシ基(-OH)が3つあります。それぞれが硝酸エステルになりうるので、エステル化の度合いに応じてモノ/ジ/トリニトロセルロースと呼ばれます。ラッカー用としてはジニトロがよく用いられます。トリニトロの場合は収率85%程度で得られますが、15%のロスはセルロースがシュウ酸に酸化されてしまうのが原因です。
シュウ酸は過剰摂取すると結石の原因になりますから、気をつけましょう。
*糖構造の平面より下(アキシャル方向)に置換基が結合する場合がα、平面より上(エカトリアル方向)に置換基が結合する場合がβです。ナンバリングについては、アノマー炭素(下図で2分子を架橋しているエーテル酸素が結合している炭素)を1として、環内のエーテル酸素から遠ざかる方向に2,3,4…とします。アノマー炭素とエーテル酸素間の結合は、加水分解による切断と再結合を繰り返すため、鎖状構造と環状構造との間に平衡が成立し、さらに再結合の際に立体異性が変化するので化学的に重要です。
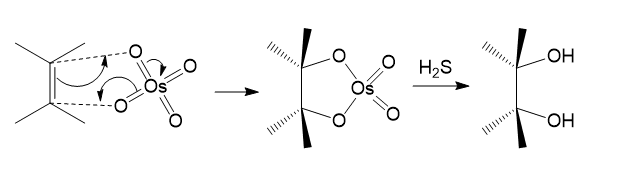
(注3)ニクロム酸カリウムは強力な酸化剤の一つとして知られますが、もう一つ代表的な酸化剤として過マンガン酸カリウムKMnO4が挙げられます。有機化学的な文脈でのKMnO4の使用法としては、例えばアルケンの1,2-ジオール化や、芳香族メチルの酸化などがあります。しかしジオール化においては、生成するジオールがさらに酸化されるなどの問題があり、実用性に難があります。代わりに、四酸化オスミウムOsO4を用いても同様の結果が得られます。この時、アルケン-オスミウム間では、sp2平面のどちらか一方において協奏的付加反応が進みます。言い換えるとこれはsyn付加です。最後にH2Sが登場していますが、これは還元的加水分解のために使用します。NaHSO3などでも代用可能です。
私が所属していた学科は高分子や糖類や石油化学を専門とされていた先生方がいらっしゃったので、こうした講義をよく聞いていました。ノスタルジーです。
最後まで読んだ貴方、きっと化学の学才があります。化学ってなにかと煙たがられている印象がある学問分野ですが、ぜひ皆さんもその楽しさに触れてみてください。
ではでは~。
