
Staphylococcus argenteusについて
2024.11.20のmicrobiology conferenceは僕が担当し, Staphylococcus argenteusを取り上げました。
********************************************************
症例は80歳男性, 慢性腎不全に対して透析カテーテル経由で維持透析をされており, 完全房室ブロック, 洞不全症候群によりペースメーカー (pacemaker, PM) が留置されています。来院当日朝までは普段通りだったようですが, 午前中に急に悪寒と倦怠感を訴えたため救急搬送となりました。診察, 画像検査では熱源ははっきりしませんでしたが, カテーテル関連血流感染症 (catheter-related bloodstream infection, CRBSI) や感染性心内膜炎を念頭にセフトリアキソン, バンコマイシンが開始され入院となりました。
10時間後, 末梢血管から採取された血液培養2セットから, ブドウ状のグラム陽性球菌が発育しました。MALDI-TOF MS (ver. 12) により, Staphylococcus aureus complex (Staphylococcus argenteus) と同定され, 翌日には血液寒天培地上にβ溶血する白色のコロニーが確認できました (Figure 1)。感受性良好だったため, 第3病日よりセファゾリン単剤へ変更となっています。また, カテーテル感染を念頭に透析カテーテルの交換も行われました。
Figure 1.
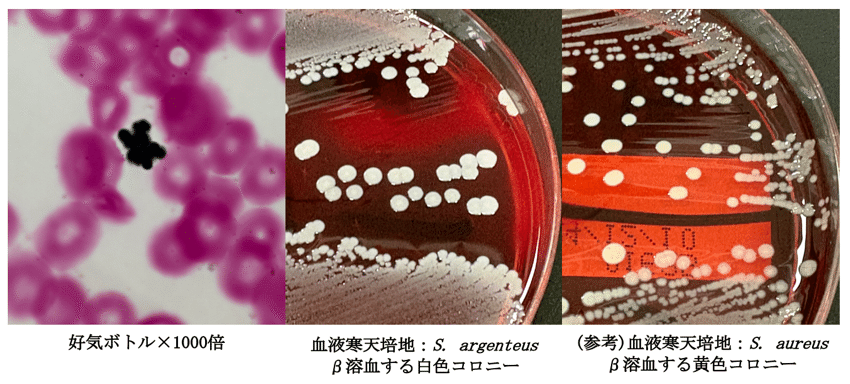
少し話は逸れますが, 血液培養からグラム陽性球菌が発育した場合, ブドウ状か連鎖状か, 粒のサイズ・染色性はどうか, 背景赤血球の溶血性はどうかを確認します。ブドウ状グラム陽性球菌が見えた場合はほとんどがStaphylococcus spp.であり, 次はそれがS. aureusなのか, コアグラーゼ陰性ブドウ球菌なのかを見極める必要があります。
その際に, 下記スコアリングが有用であることが日本から報告されており, 3点をカットオフとすると感度93.9%, 特異度91.9%とされています (Table 1)(Figure 2) [1]。
Table 1. the STAPH score

話は戻って, S. argenteusは2015年に新種登録されたS. aureusの類縁菌で, S. aureus complexに含まれる細菌です [2]。2006年にオーストラリア, ダーウィン在住の先住民族女性の血液培養から白色コロニーを形成するS. aureus clonal complex 75 (CC75) が分離され, それがゲノム解析により別菌種であることが示唆され, S. argenteusと呼ばれるようなったことが始まりです [2-3]。CC75は, νSAαやνSaβ といったgenome islandを持っており, 従来のS. aureusよりもかなり前に分岐していた可能性が指摘されています [4-5]。つまり, S. argenteusは近年登録された細菌ですが, 従来のS. aureusの祖先である可能性が示唆されています。
極めて似た二つの細菌ですが, WGSによると S. argenteus とS. aureusは同一の16S rRNA遺伝子を持ちますが, average nucleotide identityが87%, とdigital DNA–DNA hybridizationが34%と, 異なる菌種であることがわかります [6]。では表現型で区別することは可能なのでしょうか?S. argenteusはコアグラーゼ陽性, クランピング因子陽性で, その他の生化学的性状を持ってしても残念ながらS. aureusと区別することはできません。しかし, S. aureusと異なり, スタフィロキサンチンをcodeするcrtM遺伝子を欠くため, 血液寒天培地上でβ溶血する白色コロニーを形成します [7]。この特徴から, かつてローマ帝国で製造されていた銀貨の名称であり, ラテン語で”silver”を意味する”argenteus”よりS. argenteusと名付けられています (“aureus”は”gold”を意味しましたね)。
S. argenteus はMALDI-TOF MSで同定可能ですが, まだまだ市民権を得ているわけではない細菌かと思います。臨床医がS. argenteusをCoNSのような病原性の低いブドウ球菌と誤認することを避けるため, CLSIやEUCASTでは, “S. argenteusがMALDI-TOF MSまたはシークエンシングによって同定された場合, S. aureus complex (S. argenteus) と報告すること”を推奨しています [8-9]。また, 薬剤感受性検査, S/I/R判定もS. aureusに準ずることが推奨されています。
では, S. aureusによる感染症のうち, どれくらいの割合でS. argenteusが分離されているのでしょうか?香港で行われた研究では, S. aureus complexによる侵襲性感染症のうち, 4.0%がS. argenteusによるものであることが報告されており [10], オーストラリアの小児膿痂疹患者では8.4% [7], 台湾の菌血症患者では12% [11] に昇ります。タイでは5年間で分離割合が4.1%→18.6%と上昇していることが報告されています [12-13]。一方, 日本では2013-2020年に分離されたS. aureusのうちS. argenteusは1.0%だったことが広島大学の後方視的単施設研究で報告されています [14]。これらの研究はすべて, ST-2250がpredominant genotypeでした。
ST-2250以外のcladeとして, ST-1223も多く分離されています [6]。これら2つは病原性が異なり, ST-1223はsei, seg, selm, selu2, set23といったenterotoxinを保有する一方, ST-2250は皮膚軟部組織感染症に関連するpvl遺伝子を保有するprophageを獲得しています [3]。ST-2250で同定されている新たな病原性に関するgenome islandとそれに関連する複数のphageが, ST-1223と比較してST-2250が広まった理由であるとされています [3]。
また, S. aureusとS. argenteusの臨床像の比較試験も行われています。in vitroでは, S. argenteus はS. aureusと比較し, スタフィロキサンチンを欠くことで酸化ストレスおよび好中球殺傷の影響を受けやすく [4], マウスの敗血症および皮膚感染モデルでは毒性が低いことが報告されています [7]。先述のタイで行われたS. aureus complexによる市中発症敗血症 (菌血症40%弱) を調査した前向き研究では, S. argenteusはS. aureusと比較して有意に呼吸不全が少なく (5.2% vs 20.2%, aOR 0.21, 95%CI 0.06–0.74), ショックも少ない傾向にありましたが有意差はつかず (6.9% vs 12.3%, aOR 0.46, 95%CI 0.15–1.44), 28-day mortalityは有意差がありませんでした (6.9% vs 8.7%, aOR 0.80, 95%CI 0.24–2.65) [13]。これは, S. argenteusの感受性が良いこと (メチシリン耐性株はゼロ), pvl遺伝子保有株がS. aureusより少ないこと (16% vs 51%), その他のvirulence gene (sea, seb, sec, sed, see) 保有株も少ないこと (1株のみseb保有, 他はゼロ) に起因している可能性が指摘されています。また, 免疫抑制剤や化学療法を受けた患者は除外されていること, 皮膚軟部組織感染症患者が多いことなども結果に影響しているのかもしれません。一方, 台湾で行われた後方視的研究では, S. argenteus菌血症患者はメチシリン感受性S. aureus菌血症患者と比較し, 3ヶ月以内の入院歴を有し, 呼吸器系感染や複数菌感染が多く, 多変量Cox回帰分析において独立した死亡リスクの上昇と関連していることが報告されており (aHR 1.85, 95%CI 1.033–3.294) [11], 先述の研究とは異なる結果でした。尚, 本研究ではメチシリン耐性株は除外されるprotocolになっていますが, すべてのS. argenteus株でmecA遺伝子陰性が確認されています。いずれの研究もS. argenteusはS. aureusと比べ感受性良好でしたが, 稀ながらメチシリン耐性株の報告もあるため [15], 今後の動向を注視する必要があるでしょう。
上記をまとめると, S. argenteusはS. aureusと比較し, 抗菌薬感受性は良好でpvlやseaなどの毒素遺伝子保有率が低いものの, その臨床転機の良し悪しは結論がついていないということが言えるかと思います。
今回は詳しく触れませんが, S. aureus complexにはS. argenteus以外にS. schweitzeri [2], S. roterodami [16], S. singaporiensis [17] が含まれます。このうち, S. schweitzeriのヒト感染例は執筆時点 (2024.11.18) で報告されていません。
さて, 今回透析カテーテル由来と思われるS. argenteus菌血症であり, S. aureusに準じた治療を行っていくこととなります。したがって, IDSAのガイドラインに則りカテーテル抜去・血液培養再検が行われました [18]。しかし, 本症例はPM留置後であり, 加えてどのような配慮や管理が必要でしょうか?
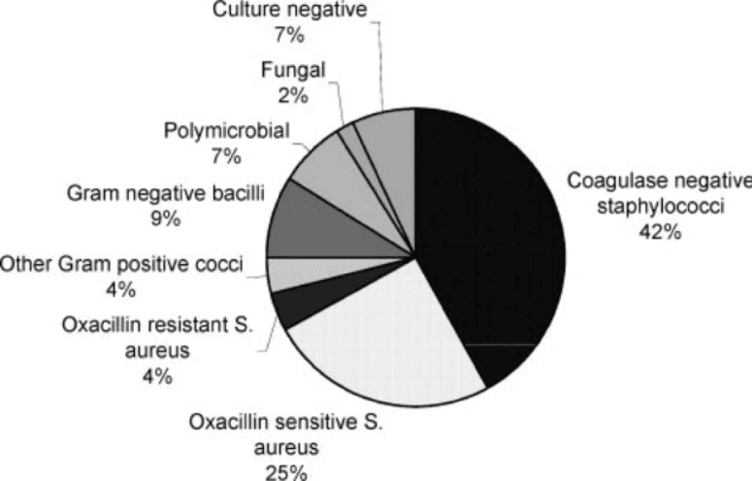
PMや植込み型除細動器 (implantable cardioverter defibrillator, ICD), および心臓再同期療法 (cardiac resynchronization therapy, CRT) などを総じて, 心血管植込み型電子デバイス (cardiovascular implantable electronic device, CIED) と呼びます。CIED infectionの管理について, American Heart Association (AHA) から2023年にstatementが発表されています [19]。原因微生物に関して, Staphylococcus spp.が71%を占めます(Figure 3)。
Figure 3. Microbiology of cardiovascular implantable electronic device infections
また, CIED infectionは大きく分けて, ポケット感染とリード/弁感染の二つがあります。最近, IEの診断基準であるDuke criteriaが改定されたThe 2023 Duke-ISCVID criteriaが発表され [20], minor criteriaに含まれる素因の項目にCIEDが追加されました。しかし, これはCIED infectionに特化したものではないため, AHAはstatementの中で, 第一線の臨床医を念頭に置いたCIED infectionの臨床的定義を作成しています (Table 2)。
Table 2. American Heart Association Clinical Definitions of Cardiovascular Implantable Electronic Device Infection
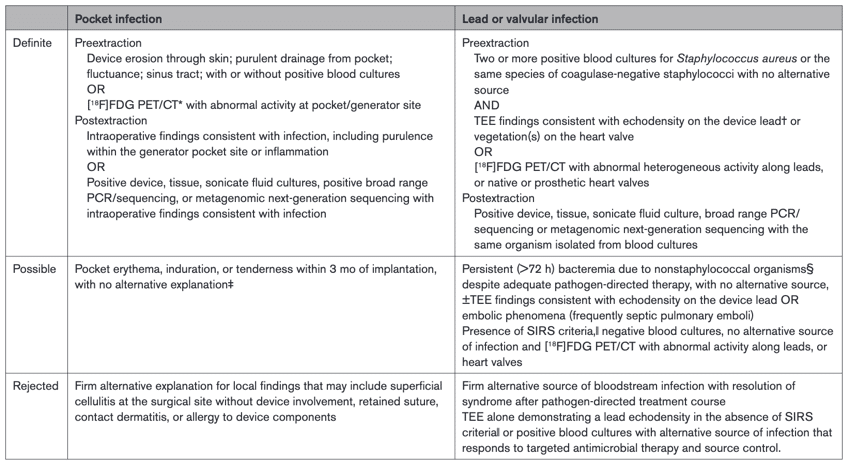
ここでも, Lead or valvular infectionのDefinite criteriaの中で, 血液培養からStaphylococcus spp.が複数セットで発育していることが抜去前の項目に含まれており, CIED埋め込み後患者のStaphylococcus spp.菌血症ではCIED infectionを考慮すべきであると言えます。
本症例ではポケット所見は正常であり, リードや弁に疣贅が付着していないか評価する必要がありそうです。そこで, 下記のアルゴリズムが提唱されています (Figure 4B)。そのため, 本症例では, 経胸壁心エコーに加えて経食道心エコーを行っていただくことを主治医へお勧めし, 循環器内科コンサルトの運びとなりました。
だいぶ長くなったので, 今回は診断までで終了します。治療については, また機会があればお話しします。
Figure 4. Diagnosis and management algorithms for suspected CIED pocket infection (A) and suspected CIED lead/valvular infection without pocket infection (B).

【References】
1. Hayashi T, et al. Rapid differentiation of Staphylococcus aureus in blood cultures using the STAPH score: a prospective observational study. Microbiol Spectr. 2024;12:e0122324.
2. Tong SYC, et al. Novel staphylococcal species that form part of a Staphylococcus aureus-related complex: the non-pigmented Staphylococcus argenteus sp. nov. and the non-human primate-associated Staphylococcus schweitzeri sp. nov. Int J Syst Evol Microbiol. 2015;65:15-22.
3. Goswami C, et al. Genomic Analysis of Global Staphylococcus argenteus Strains Reveals Distinct Lineages With Differing Virulence and Antibiotic Resistance Gene Content. Front Microbiol. 2021;12:795173.
4. Holt DC, et al. A very early-branching Staphylococcus aureus lineage lacking the carotenoid pigment staphyloxanthin. Genome Biol Evol. 2011;3:881-95.
5. Ng JW, et al. Phylogenetically distinct Staphylococcus aureus lineage prevalent among indigenous communities in northern Australia. J Clin Microbiol. 2009;47:2295-300.
6. Wu S, et al. Evolutionary Divergence of the Novel Staphylococcal Species Staphylococcus argenteus. Front Microbiol. 2021;12:769642.
7. Tong SY, et al. Virulence of endemic nonpigmented northern Australian Staphylococcus aureus clone (clonal complex 75, S. argenteus) is not augmented by staphyloxanthin. J Infect Dis. 2013;208:520-7.
8. CLSI. Performance Standards for Antimicrobial Susceptibility Testing. 34th ed. CLSI supplement M100. Clinical and Laboratory Standards Institute; 2024.
9. Becker K, et al. Implications of identifying the recently defined members of the Staphylococcus aureus complex S. argenteus and S. schweitzeri: a position paper of members of the ESCMID Study Group for Staphylococci and Staphylococcal Diseases (ESGS). Clin Microbiol Infect. 2019;25:1064-70.
10. Chen JHK, et al. Prevalence and Characteristics of Invasive Staphylococcus argenteus among Patients with Bacteremia in Hong Kong. Microorganisms. 2023;11:2435.
11. Chen SY, et al. High mortality impact of Staphylococcus argenteus on patients with community-onset staphylococcal bacteraemia. Int J Antimicrob Agents. 2018;52:747-53.
12. Thaipadungpanit J, et al. Clinical and molecular epidemiology of Staphylococcus argenteus infections in Thailand. J Clin Microbiol. 2015;53(3):1005-1008.
13. Chantratita N, et al. Comparison of community-onset Staphylococcus argenteus and Staphylococcus aureus sepsis in Thailand: a prospective multicentre observational study. Clin Microbiol Infect. 2016;22(5):458.e11-458.e4.58E19.
14. Kitagawa H, et al. Low incidence of Staphylococcus argenteus bacteremia in Hiroshima, Japan. J Infect Chemother. 2020;26(1):140-143.
15. Witteveen S, et al. Genetic Characteristics of Methicillin-Resistant Staphylococcus argenteus Isolates Collected in the Dutch National MRSA Surveillance from 2008 to 2021. Microbiol Spectr. 2022;10(5):e0103522.
16. Schutte AHJ, et al. Characterization of Staphylococcus roterodami sp. nov., a new species within the Staphylococcus aureus complex isolated from a human foot infection. Int J Syst Evol Microbiol. 2021;71:10.1099/ijsem.0.004996 .
17. Chew KL, et al. Staphylococcus singaporensis sp. nov., a new member of the Staphylococcus aureus complex, isolated from human clinical specimens. Int J Syst Evol Microbiol. 2021;71:10.1099/ijsem.0.005067 .
18. Mermel LA, et al. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2009;49:1-45.
19. Baddour LM, et al. Update on Cardiovascular Implantable Electronic Device Infections and Their Prevention, Diagnosis, and Management: A Scientific Statement From the American Heart Association: Endorsed by the International Society for Cardiovascular Infectious Diseases. Circulation. 2024;149:e201-16.
20. Fowler VG, et al. The 2023 Duke-International Society for Cardiovascular Infectious Diseases Criteria for Infective Endocarditis: Updating the Modified Duke Criteria. Clin Infect Dis. 2023;77:518-26.
