Listeria monocytogenes
2025/1/22のmicrobiology conferenceを担当しました。GPRが血培から生えた際の鑑別方法などを確認しつつ, 微生物学的特徴・臨床像・治療について触れました。治療のところは私見を踏まえています。
************
潰瘍性大腸炎に対して, 3週間前からプレドニゾロン1mg/kg/日で寛解導入療法が開始となった45歳女性。受診2日前より倦怠感あり, 悪寒戦慄を認めたため救急外来を受診されました。軽度の頭痛は認めるものの, 下痢などは認めずフォーカス不明の発熱として血液培養を採取し帰宅となりましたが, 翌日グラム陽性桿菌が好気・嫌気ボトルから発育しました。質量分析にてListeria monocytogenesと判明し, 翌日には血液寒天培地上に薄くβ溶血する白色コロニーが観察できました (Figure 1)。
Figure 1. 血液培養グラム染色・コロニー

グラム陽性桿菌が血液培養から分離された場合, まずは形態的に分類すると良いと思います。その情報に加え, 陽性ボトルの種類や溶血性を踏まえさらに細分化してくと, 下記のようになります (過去レクチャーより引用)。
Table 1. グラム陽性桿菌の分類
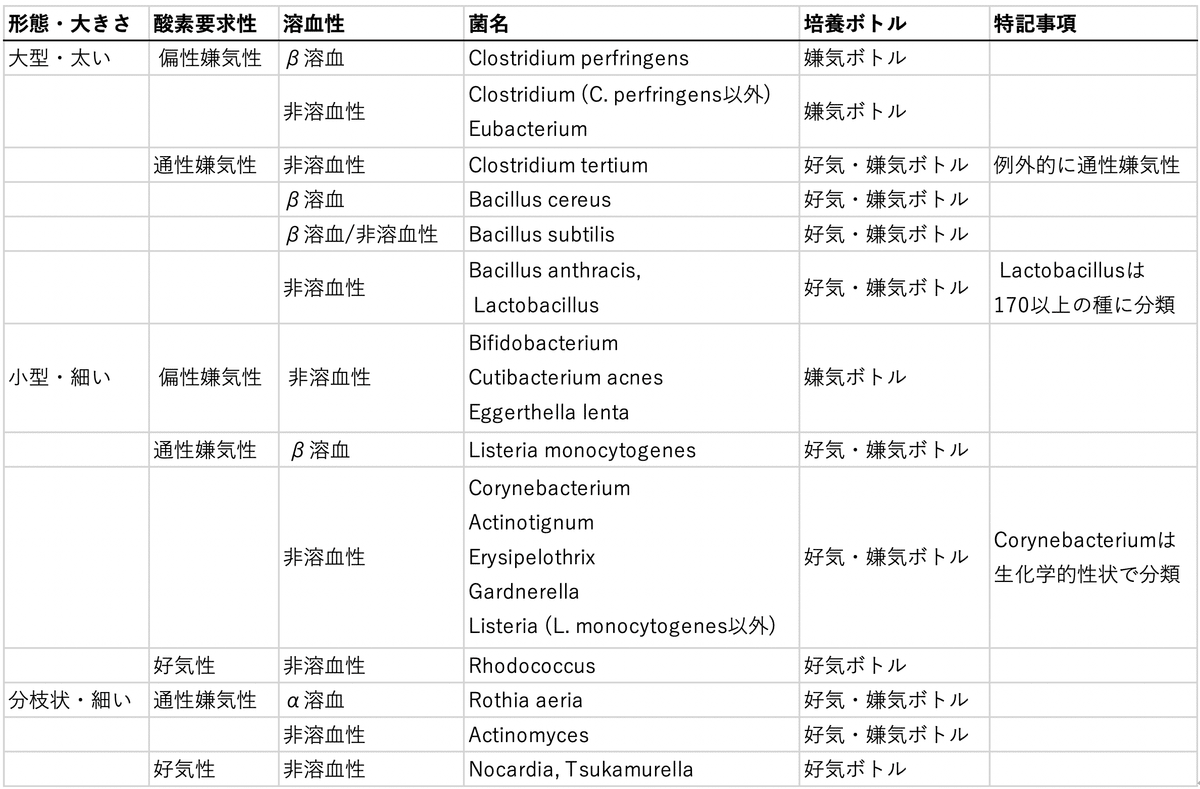
さて, 本日はL. monocytogenesについてお話しします。
Listeria spp.は, 大きく”sensu stricto”と”sensu lato”に分類され, 現在合計28種 (それぞれ10種, 18種) から構成されていますが [1], ヒトに病原性を有するものは”sensu stricto”に属するL. monocytogenesのみです [2]。L. monocytogenesは, 芽胞非形成性グラム陽性小桿菌であり, 低温増殖可能な, 30℃での運動性を有する, 通性嫌気性細胞内寄生菌です。血液寒天培地上に弱いβ溶血を示し, 至適発育温度は30-37℃ですが, 4℃でも発育可能であり, 冷蔵後の検体では他の細菌よりも発育速度が早いことが特徴です (cold enrichment) [3]。生化学的特徴として, カタラーゼ陽性, VPテスト陽性, インドールテスト陰性, 馬尿酸加水分解陽性に加えて, CAMPテスト陽性であることが挙げられます (Figure 2)。
Figure 2. CAMP test (左からS. agalactiae, L. monocytogenes)

L. monocytogenesは, 1926年にケンブリッジ大学で初めて感染実験動物であるウサギやモルモットから発見され, Bacterium monocytogenesと命名されました (”monocytogenes”は, これらの動物の末梢血単球増加 (monocytosis) を引き起こすことに由来) [5]。1929年に初めてヒト感染例が報告され, 母体から胎児への垂直感染例も報告されていましたが, 詳細な感染経路が判明したのは1983年のことです。
土壌, 地下水, 動物およびヒトの糞便から分離され, 変動する環境に容易に適応し, 低温, 酸性, 高塩分濃度を含む過酷な条件でも生存可能です [2][7]。さらに, 胃pH<3では殺菌されますが, 3.5-4では生存率が上昇します [8]。そのため, L. monocytogenesは過酷な消化管環境に打ち勝ち, 消化管を経由し感染を起こします (Figure 3)。現在, L. monocytogenes感染症 (listeriosis, リステリア症) は99%が食品媒介性と言われています。加工肉や乳製品, 包装済みサンドイッチ, 冷燻魚, 調理済み野菜, サラダ, 果物など様々な食品が原因となり [7], 世界中でアウトブレイクを引き起こしています [9]。L. monocytogenesは元々O抗原とH抗原による分類が行われていましたが, ヒト分離株は1/2a, 1/2b, 4bがほとんどで [10], アウトブレイクのサーベイランスには不向きでした。そのため, MLSTやさらに詳細なコアゲノムMLSTが行われていますが [11-12], 今回は割愛します。
病原因子として, inlAによってcodeされるInternalin A (InlA) やhlyによってcodeされるlisteriolysin O (LLO) などが知られ, これらの働きで宿主細胞へ侵入し, 貪食細胞から脱出し, 宿主免疫応答を回避します [6]。
Figure 3. L. monocytogenesの感染経路 [7]

リステリア症には, 自然治癒する発熱性胃腸炎から菌血症や髄膜脳炎などの侵襲性疾患まで,幅広い疾患が含まれます。皮膚軟部組織感染も生じることがありますが, これは血流感染の結果, もしくは汚染物による直接感染が原因です。免疫正常者でも大量のL. monocytogenesに曝露することで胃腸炎をきたしますが, 侵襲性疾患の発症は宿主因子に依存し, 妊婦, 新生児, 高齢者, 細胞性免疫不全者で発生率が高いことが知られています [5][13]。
Table 2. 疾患ごとのリステリア症のリスク・死亡率 [13]

侵襲性リステリア症は大きく, brain infection (neurolisteriosis), 菌血症, 新生児リステリア症を含む妊娠関連感染に分けられ, これらはそれぞれ症例の31%, 52%, 14%を占めると言われています [7]。また, 侵襲性リステリア症は比較的稀ではありますが, 死亡率 15.9–22%と推定されており [1], 早期診断・介入が重要かと思います。
特に菌血症は最もcommonな侵襲性リステリア症の病型ですが, 発熱や下痢, 悪寒, 筋痛など非特異的症状から敗血症性ショックまで幅広い臨床像があり, 軽度の症状であれば認識が難しい可能性があります。侵襲性リステリア症に関する前向きコホート研究では, 症状出現から受診まで平均2日間でしたが, 25%以上の患者が受診まで6日以上要していました [14]。血液培養陽性率は61-79%と報告されており, 菌血症患者の21%が集中治療 (その半数が人工呼吸器使用) を必要とし, 18%で多臓器不全が生じると言われています [7]。
また, 注意すべきはneurolisteriosisであり, 髄膜炎や脳幹脳炎, 脳膿瘍などが含まれます。近年TNFα阻害薬を使用している炎症性腸疾患がneurolisteriosisのリスク因子として同定されています [15]。Neurolisteriosis患者では, 肺炎球菌や髄膜炎菌などの他の病原体による細菌性髄膜炎の患者と比較し, 一般的に症状の発現が遅く, neurolisteriosis患者における症状発現時期の中央値は入院の2日前と報告されています [16]。発熱は85-90%に認めますが, 発熱, 項部硬直, 精神状態の変化からなる細菌性髄膜炎の古典的三徴は36-68%と症状が揃わないことも稀ではありません [7]。そのため, 特に菌血症が判明している症例では髄液穿刺の閾値は低くもつ必要があると考えます。リステリア髄膜炎では髄液白血球数上昇の程度が他細菌による髄膜炎に比べて低く (中央値 620/ml) [16-17], 25%でリンパ球優位になると言われています。グラム染色で菌体が認められるのはわずか28-36%で, 血液培養は46-73%で陽性になります [17-18]。最近流行りのFilmArrayはどうかというと, 髄膜炎・脳炎パネルのL. monocytogenesの感度・特異度は80.4%, 99.1%であり [19], 検査前確率が高い状況では除外に用いるのは難しそうです。
侵襲性リステリア症に対する治療は, 比較試験は行われていませんがアンピシリンが第一選択薬です。アンピシリンは, 亜阻害濃度でLLOの産生を低下させ, 高濃度 (MICの16倍以上) では完全な殺菌効果を示すことが報告されています [20-21]。L. monocytogenesは複数のペニシリン結合蛋白 (penicillin binding protein, PBP) を有しており, 特にPBP3がペプチドグリカン合成に関わっている重要なPBPと言われています [22]。アンピシリンはこのPBP3に結合することで効果を発揮しますが, セファロスポリンはPBP3に結合できないため自然耐性を示します [23]。
また, in vitroでゲンタマイシンはペニシリンと併用することでシナジー効果を発揮することが報告されており [24], 侵襲性リステリア症に対してJohn Hopkins Abx GuideやUpToDateではアンピシリン+ゲンタマイシンが推奨されています。IDSA [25] やESCMID [26] の髄膜炎ガイドラインでもアンピシリンにゲンタマイシンの使用を考慮すると記載されていますが, ガイドライン公開以降に発表された臨床試験の結果はPros [14]/Cons [27]であり, Sanford Guideでは最近の改訂でアンピシリン単剤を推奨するようになりました。有効性を示したものとして, 中枢神経感染症, 血流感染, および妊娠に関連したlisteriosisの患者を対象とした前向きコホート研究を紹介します [14]。この研究では, アミノグリコシド使用が, 中枢神経感染症または菌血症症例で死亡率低下に関与し (OR 0.60, 95%CI 0.38-0.94), 4日間以上のアモキシシリン・アミノグリコシド併用療法は, アモキシシリン単剤治療と比較し生存について独立した保護効果を示しました (OR 0.35, 95% CI 0.22-0.56)。しかし, 中枢神経感染症のみの患者群に絞ると, アミノグリコシドの有効性は低下しており, 血液脳関門を通過できないアミノグリコシドが中枢神経病変ではなく菌血症に対して有効だったと考えれば説明しやすいかと思います。一方で, 非妊婦のL. monocytogenes菌血症, 中枢神経感染症を対象とした後方視的研究では, アンピシリンとゲンタマイシンの併用療法は, アンピシリン単剤治療と比較し30日死亡率を改善しなかったと報告されています [27]。ただし, 有意差はなかったもののアンピシリン単剤治療は死亡リスクが上昇する傾向にあり (OR 1.947, 95% CI 0.691-5.487), 組入れ患者数が少なかったことが結果に影響した可能性があります。まとめると, アンピシリンとゲンタマイシン併用療法はリステリア症に対してpositiveに働きそうではありますが, 腎機能低下症例や使用禁忌例 (妊婦) ではアンピシリン単剤でも許容されるということになりそうです。
ゲンタマイシンの使用量についてですが, John Hopkins Abx GuideやUpToDateでは5mg/kg/日を推奨しています。これは, 例えば同様にシナジー効果を狙って使用する腸球菌の感染性心内膜炎に対する投与量 (3mg/kg/日) より, 少し多めの推奨になっています。L. monocytogenesに対して用いるゲンタマイシンが現在の投与量に落ち着いた経緯は明らかではなく, 先述の基礎研究においてシナジー効果のためにゲンタマイシンに求められた濃度は 1 μg/mlと低く設定されています [24]。そのため, 個人的には3 mg/kg/日でも目標濃度を達成できる可能性はあると考えており, そうしています。
L. monocytogenesによる脳髄膜炎に対する補助治療としてのデキサメタゾンの立ち位置についても少し触れます。これもまた様々な研究結果が得られており, 死亡率が上昇するというフランスの前向きコホート研究 [14] と, 死亡率が低下するというオランダの前向きコホート研究とがあります [28]。この不一致について, オランダのコホートの方がデキサメタゾンを使用された患者の割合が多く割り当てが正確であること, フランスのコホートではデキサメタゾン投与患者の重症度が高い可能性があることなどが指摘されています [28]。
治療期間に関して, 質の高い研究はありませんが, UpToDateを参照すると中枢神経感染症を伴わない原発性菌血症 (周産期含む) では2週間, 中枢神経感染症では3週間が推奨されています。さらに, 免疫不全者では原発性菌血症であっても3週間を推奨する場合もあるようです。
*****
本症例は, 血液培養陽性を受けて入院加療の方針となりました。当初訴えていた頭痛は再診時に消失していましたが, 髄膜炎の評価のため髄液穿刺を行いました。結果的に細胞数・蛋白・糖は全て正常で, 細菌性髄膜炎の合併はなさそうで, 原発性菌血症と診断しました。免疫抑制剤を内服していることから, アンピシリン12g/日とゲンタマイシン3mg/kg/日を併用し治療開始をお勧めしました。尚, 原因食品について詳細に確認しましたが, 特に疑わしいものはなく原因は不明でした。今回便培養は提出していませんが, 患者さんが元々L. monocytogenesを保菌しており, 免疫抑制に伴い一過性菌血症をきたしたのだろうか, と想像しています。
*****
【参考文献】
1. Orsi RH, Liao J, Carlin CR, Wiedmann M. Taxonomy, ecology, and relevance to food safety of the genus Listeria with a particular consideration of new Listeria species described between 2010 and 2022. mBio. 2024;15(2):e0093823. PMID: 38126771
2. Orsi RH, Wiedmann M. Characteristics and distribution of Listeria spp., including Listeria species newly described since 2009. Appl Microbiol Biotechnol. 2016;100(12):5273-5287. PMID: 27129530
3. Erdogan HM, Cripps PJ, Morgan KL. Optimization of a culture technique for the isolation of Listeria monocytogenes from faecal samples. J Vet Med B Infect Dis Vet Public Health. 2002;49(10):502-506. PMID: 12485361
4. ASM, protocols. CAMP Test (Oct. 1, 2006) available at https://asm.org/protocols/camp-test-protocols (accessed January 21, 2025)
5. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases, 206, 2543-2549.e2
6. Mostowy S, Cossart P. Virulence factors that modulate the cell biology of Listeria infection and the host response. Adv Immunol. 2012;113:19-32. PMID: 22244577
7. Koopmans MM, Brouwer MC, Vázquez-Boland JA, van de Beek D. Human Listeriosis. Clin Microbiol Rev. 2023;36(1):e0006019. PMID: 36475874
8. Jiang L, Olesen I, Andersen T, Fang W, Jespersen L. Survival of Listeria monocytogenes in simulated gastrointestinal system and transcriptional profiling of stress- and adhesion-related genes. Foodborne Pathog Dis. 2010;7(3):267-274. PMID: 19899961
9. CDC, Listeria Outbreaks (August 9, 2024) available at; https://www.cdc.gov/listeria/outbreaks/index.html (accessed January 21, 2025)
10. Cartwright EJ, Jackson KA, Johnson SD, Graves LM, Silk BJ, Mahon BE. Listeriosis outbreaks and associated food vehicles, United States, 1998-2008. Emerg Infect Dis. 2013;19(1):1-184. PMID: 23260661
11. Tsai YH, Moura A, Gu ZQ, et al. Genomic Surveillance of Listeria monocytogenes in Taiwan, 2014 to 2019. Microbiol Spectr. 2022;10(6):e0182522. PMID: 36222695
12. Ruppitsch W, Pietzka A, Prior K, et al. Defining and Evaluating a Core Genome Multilocus Sequence Typing Scheme for Whole-Genome Sequence-Based Typing of Listeria monocytogenes. J Clin Microbiol. 2015;53(9):2869-2876. PMID: 26135865
13. Goulet V, Hebert M, Hedberg C, et al. Incidence of listeriosis and related mortality among groups at risk of acquiring listeriosis. Clin Infect Dis. 2012;54(5):652-660. PMID: 22157172
14. Charlier C, Perrodeau É, Leclercq A, et al. Clinical features and prognostic factors of listeriosis: the MONALISA national prospective cohort study. Lancet Infect Dis. 2017;17(5):510-519. PMID: 28139432
15. Sheybani F, Brouwer MC, Löwenberg M, van de Beek D. Community-acquired bacterial meningitis in patients with inflammatory bowel diseases. J Infect. 2022;85(5):573-607. PMID: 35933041
16. Koopmans MM, Brouwer MC, Bijlsma MW, et al. Listeria monocytogenes sequence type 6 and increased rate of unfavorable outcome in meningitis: epidemiologic cohort study. Clin Infect Dis. 2013;57(2):247-253. PMID: 23592828
17. Brouwer MC, van de Beek D, Heckenberg SG, Spanjaard L, de Gans J. Community-acquired Listeria monocytogenes meningitis in adults. Clin Infect Dis. 2006;43(10):1233-1238. PMID: 17051485
18. Mylonakis E, Hohmann EL, Calderwood SB. Central nervous system infection with Listeria monocytogenes. 33 years' experience at a general hospital and review of 776 episodes from the literature. Medicine (Baltimore). 1998;77(5):313-336. PMID: 9772921
19. Trujillo-Gómez J, Tsokani S, Arango-Ferreira C, et al. Biofire FilmArray Meningitis/Encephalitis panel for the aetiological diagnosis of central nervous system infections: A systematic review and diagnostic test accuracy meta-analysis. EClinicalMedicine. 2022;44:101275. PMID: 35198914
20. Nichterlein T, Domann E, Kretschmar M, et al. Subinhibitory concentrations of beta-lactams and other cell-wall antibiotics inhibit listeriolysin production by Listeria monocytogenes. Int J Antimicrob Agents. 1996;7(1):75-81. PMID: 18611740
21. Korsak D, Markiewicz Z, Gutkind GO, Ayala JA. Identification of the full set of Listeria monocytogenes penicillin-binding proteins and characterization of PBPD2 (Lmo2812). BMC Microbiol. 2010;10:239. PMID: 20843347
22. Krawczyk-Balska A, Popowska M, Markiewicz Z. Re-evaluation of the significance of penicillin binding protein 3 in the susceptibility of Listeria monocytogenes to β-lactam antibiotics. BMC Microbiol. 2012;12:57. PMID: 22513233
23. Vicente MF, Pérez-Dáz JC, Baquero F, Angel de Pedro M, Berenguer J. Penicillin-binding protein 3 of Listeria monocytogenes as the primary lethal target for beta-lactams. Antimicrob Agents Chemother. 1990;34(4):539-542. PMID: 2111657
24. Moellering RC Jr, Medoff G, Leech I, et al. Antibiotic synergism against Listeria monocytogenes. Antimicrob Agents Chemother. 1972;1(1):30-34. PMID: 4207757
25. Tunkel AR, Hartman BJ, Kaplan SL, et al. Practice guidelines for the management of bacterial meningitis. Clin Infect Dis. 2004;39(9):1267-1284. PMID: 15494903
26. van de Beek D, Cabellos C, Dzupova O, et al. ESCMID guideline: diagnosis and treatment of acute bacterial meningitis. Clin Microbiol Infect. 2016;22 Suppl 3:S37-S62. PMID: 27062097
27. Dickstein Y, Oster Y, Shimon O, et al. Antibiotic treatment for invasive nonpregnancy-associated listeriosis and mortality: a retrospective cohort study. Eur J Clin Microbiol Infect Dis. 2019;38(12):2243-2251. PMID: 31399915
28. Brouwer MC, van de Beek D. Adjunctive dexamethasone treatment in adults with listeria monocytogenes meningitis: a prospective nationwide cohort study. EClinicalMedicine. 2023;58:101922. PMID: 37007737
