170)細胞の老化とがん化を抑制するラパマイシン
体がみるみる若返るミトコンドリア活性化術170
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【毒ガスからスタートした抗がん剤の開発】
最初の抗がん剤のナイトロジェンマスタードは、第一次世界大戦に化学兵器として使われたマスタードガスのイオウ原子を窒素に置き換えた化合物です。DNAやDNA結合タンパク質の特定の部位に結合して、DNAの複製を阻害して細胞分裂を止めます。
白血病や悪性リンパ腫の治療薬として効果を認められましたが、その作用機序から明らかなように細胞分裂を行っている正常細胞も死滅させるため、強い副作用が起こります。その後毒性を弱めたナイトロゲンマスタード誘導体が開発され、シクロフォスファミドやメルファランといった抗がん剤が現在も使用されています。

ナイトロジェンマスタードが最初にがん患者に使用されたのは1946年です。1950年代以降のがん治療法の研究領域では、「がんはいかなるコストを払っても抹殺すべき」という考えが主流で、「がん細胞を死滅させる細胞毒を見つけて抗がん剤にする」と言うような研究が重視されました。したがって、細胞毒性の強い抗がん剤が多く開発され、現在も使用されています。
しかし、細胞分裂を阻害して増殖しているがん細胞を死滅させようとする抗がん剤の最大のデメリットは、正常細胞にもダメージを与えて強い副作用を引き起こすことです。骨髄細胞(白血球や赤血球や血小板)や免疫組織や消化管粘膜や毛根細胞など絶えず細胞分裂を行っている正常細胞もダメージを受けるため、白血球減少や免疫力低下や消化管機能障害や脱毛など様々な副作用を発症します。
【副作用の強いがん治療は老化を促進し、寿命を短縮する】
一般的に、正常細胞に毒性の強い抗がん剤は、正常な細胞のDNAやタンパク質や細胞膜にダメージを与えるので、基本的には細胞や組織の老化を促進し、寿命を短くする可能性があります。二次的に別のがん(2次がん)を発症させるリスクや、免疫機能が傷害されると感染症を引き起こすリスクも高くなります。
抗がん剤の副作用による諸臓器の機能低下や組織の老化促進も問題になっています。例えば、乳がんの補助化学療法を受けた患者さんは老化が10年~15年程度進む可能性を示唆する報告があります。以下のような論文があります。
Effect of Cytotoxic Chemotherapy on Markers of Molecular Age in Patients With Breast Cancer (乳がん患者における寿命のマーカーに対する細胞傷害性抗がん剤の作用)
J Natl Cancer Inst. 2014 Apr;106(4):dju057.
この論文では、乳がん患者の2つの集団(コホート)で検討しています。一つは33人の乳がん患者を経時的に追跡する前向き研究で、もう一つは治療後平均3.4年が経過している乳がんサバイバーのコホートで、このコホートにおいて補助化学療法を受けた人と受けていない人で比較しています。
末梢血のT細胞のP16INK4aやARF遺伝子の発現量は加齢とともに増加することが知られており、細胞老化のマーカーとして知られています。この遺伝子発現量(mRNA量)を老化のマーカーとして検討すると、乳がんで術前あるいは術後の補助化学療法は、加齢を10~15年分促進する(つまり、寿命を10~15年間ほど短縮する)というデータが得られたということです。
老化関連の遺伝子と2種類の老化関連のサイトカイン(VEGFAとMCP1)が抗がん剤治療によって増えているので「抗がん剤治療は老化を促進する」、増えた量から換算すると、「10年から15年に相当する年月の老化が促進していた」というのがこの論文の結論です。
しかも、老化のマーカーは、前向き研究のコホートでは抗がん剤治療直後から上昇し、抗がん剤治療終了12ヶ月後も上昇しており、治療後平均3.4年が経過したコホートでも上昇が認められるので、抗がん剤治療による老化促進の影響は数年あるいは永久に持続する可能性が示唆されると言っています。
抗がん剤はDNA損傷、テロメア短縮、エピジェネティックな変化、ミトコンドリア機能障害を引き起こし、老化細胞の誘導と蓄積につながります。老化細胞は、幹細胞と組織の再生能力を制限し、炎症を増加させることにより、加齢に伴う衰退を加速します。(図)

【人間は老化細胞とがん細胞の蓄積で死亡する】
私たちの体は多数の細胞で成り立っています。このような正常な細胞の集まりの中で、加齢とともに異常な細胞が出現してきます。一つは老化細胞で、もう一つはがん細胞です。
老化した細胞が増えれば、組織の機能は低下し、免疫力などの生体防御力が低下すると感染症に罹りやすくなり、がん細胞の増殖を止めることができなくなります。さらに心臓や呼吸器などの全身臓器の機能が低下するとその個体は老衰で死亡します。
がん細胞は増殖と細胞死の制御ができなくなった細胞で、正常な細胞や組織を侵略するように数を増やしていきます。正常組織を破壊するので、がん細胞が多く増えると宿主は死亡します。つまり、個体の死は老化細胞とがん細胞の蓄積が原因となります。(図)

【老化細胞の蓄積は組織機能を障害する】
老化細胞は増殖を停止した細胞です。老化細胞が組織に蓄積すると、周りの正常細胞に様々な悪影響を及ぼすことが知られています。老化細胞はサイトカイン、成長因子、ケモカイン、プロテアーゼなどの多くの成分を分泌しています。これらの因子は老化関連分泌表現型(senescence-associated secretory phenotype :SASP)と呼ばれ、老化細胞の周囲の組織に炎症や機能障害を引き起こす可能性があります。つまり、老化細胞が蓄積すると老化関連分泌表現型(SASP)の産生によって、その組織の機能が障害され、細胞の老化やがん化を促進します。(図)

【老化細胞はがん細胞の発生・増殖を促進する】
細胞老化はがん細胞の発生・増殖を防ぐためのメカニズム(がん抑制機構)という考えがあります。細胞老化に伴う細胞周期の停止はがん抑制遺伝子が関与しています。ダメージを受けた細胞のがん化を防ぐメカニズムの一つが細胞老化という考えです。(図)

細胞老化というメカニズムが存在するのは「細胞のがん化を防ぐため」という考えは説得力があるように思われます。しかし逆に、老化細胞ががん細胞の発生・増殖・浸潤・転移を促進する可能性が指摘されています。老化細胞が老化関連分泌表現型 (SASP) として知られる炎症誘発性の細胞間シグナル伝達に関与する多数の因子の合成および放出を増加するからです。
これらの因子の中には、腫瘍形成を促進できる様々な炎症性分子と細胞外小胞があります。老化した繊維芽細胞からの SASP は、がん細胞の発生や増殖や腫瘍形成を促進することが示されています(図)

【老化細胞除去作用を持つ成分の探索が行われている】
老化細胞を選択的に排除する薬物をSenolytic drugと言います。「seno=老化」と「lytic = 溶解」を組み合わせた用語です。
Senolytics(老化細胞除去薬)という用語は、2015年にカークランド(JamesnL. Kirkland)とチコニア(Tamara Tchkonia)によって導入されました。この二人はメイヨークリニック(Mayo Clinic Robert and Arlene Kogod Center on Aging)の研究者です。
老化細胞は増殖を止めていますが、細胞死も抑制されていて、老化関連分泌表現型 (SASP)を産生し続けるので、周囲の正常細胞に悪影響を及ぼします。そこで、老化細胞のアポトーシス(細胞死)を誘導して老化細胞を除去しようという考えです。
老化細胞を死滅するのではなく、老化関連分泌表現型 (SASP) の作用を抑制する薬をSenomorphic drug(老化細胞阻害薬)と言います。mTOR阻害薬のラパマイシン、AMPK賦活剤のメトホルミン、JAK阻害剤のルキソリチニブなどが有用視されています。(図)

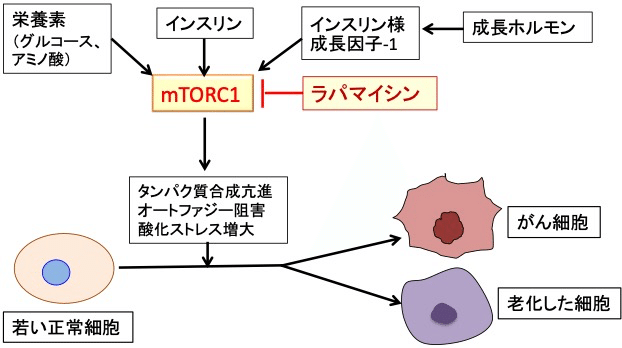
老化細胞とがん細胞の発生要因としては、遺伝子異常の蓄積、酸化ストレス、オートファジーの阻害、mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)の活性亢進、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系の亢進などがあり、その多くは細胞の老化とがん化で共通しています。
つまり、老化細胞とがん細胞の排除は共通の方法で達成でき、老化細胞を減らす方法はがん細胞も減らせると言うことです。
【mTORC1は細胞のがん化と老化を促進する】
細胞の老化とがん化で最も重要なのがmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)の活性亢進です。
ラパマイシン(Rapamycin)は1970年代にイースター島の土壌から発見された放線菌の一種が産生する有機化合物で、シロリムス(Sirolimus)という別名で呼ばれることもあります。
イースター島は、チリ領の太平洋上に位置する火山島で、現地語名はラパ・ヌイ(Rapa Nui)と呼ばれています。「ラパ・ヌイ」とはポリネシア系の先住民の言葉で「広い大地」を意味します。モアイ像の建つ島として有名です。ラパマイシンはラパ・ヌイにちなんで名付けられました。

ラパマイシンは免疫抑制作用があり、米国では臓器移植の際の拒絶反応を防ぐために使用されています。さらに、平滑筋細胞増殖抑制作用や抗がん作用や寿命延長効果が知られています。
ラパマイシンの生体内のターゲット分子が、哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin)、略してmTOR(エムトール)というタンパク質です。
mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼ(タンパク質のセリンやスレオニンをリン酸化する酵素)で、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。
最初に酵母におけるラパマイシンの標的タンパク質が見出されてTOR(target of rapamycin)と命名され、後に哺乳類のホモログ(相同体)が見出されてmTOR(哺乳類ラパマイシン標的タンパク質)と命名されました。
mTORにはmTOR複合体1(mTORC1)とmTOR複合体2(mTORC2)の2種類があります。mTORに幾つかの他のタンパク質が結合して複合体を形成しており、結合しているタンパク質の違いで2種類の複合体ができ、異なる機能を担っています。mTORC1は成長因子や、糖やアミノ酸などを含む栄養素のセンサーとして機能し、mTORC2は細胞骨格やシグナル伝達の制御を担っています。
インスリンやインスリン様成長因子(IGF-1)によって活性化されるのはmTORC1の方で、ラパマイシンで阻害されるのもmTORC1です。
【mTORC1活性を阻害すると細胞や組織が若返り、がんの発生が抑えられる】
mTORC1が活性化するとオートファジーは抑制されます。インスリンはmTORC1を活性化するので、糖質の多い食事はインスリンとmTORC1と介してオートファジーを抑制することになります。
オートファジーが抑制されると悪性腫瘍が発生しやすくなります。これは、細胞内に異常タンパク質や不良ミトコンドリアが蓄積することが引き金になると考えられています。また、オートファジーの抑制は、古くなった細胞内のタンパク質や小器官の分解を阻害するので、細胞の老化を促進します。
つまり、インスリンやインスリン様成長因子-1によってmTORC1が活性化されることは体の成長促進や筋肉増強には効果があるのですが、オートファジーの抑制や酸化ストレスの亢進によって細胞の老化とがん化を促進することになります。
ラパマイシンはmTORC1の活性を阻害することによって細胞の老化をがん化を阻害し、寿命を延ばします。(図)