
ブルガダ症候群・メモ(2021年版)
江花有亮
東京医科歯科大学病院遺伝子診療科
2021年5月16日初稿
0.はじめに
ブルガダ症候群は特徴的な心電図パターンを認め、心臓に構造的な異常を認められないにもかかわらず突然死のリスクが高い遺伝性不整脈の一つです。心筋細胞の脱分極や再分極の調整に関与するイオンチャネルやそのチャネルの機能を支えるタンパク質が存在し、そのタンパク質をコードしているいくつかの遺伝子の変異に、環境的要因や後天的要因が加わって発症すると考えられています。ブルガダ症候群の患者の症状は無症状から突然死まで幅広く見られます。一般的に、青年期から壮年期の男性に多く見られ健康診断の心電図異常を指摘されます。まれに突然死が初発の症状であることもあるますため、生活管理や正確な診断が非常に重要です。
本書では2018年に改訂された日本循環器学会「遺伝性不整脈の診療に関するガイドライン」や2013年に米国・欧州・アジア不整脈学会(HRS/EHRA/APHRS)から出版されたHRS/EHRA/APHRS Expert Consensus Statement on the Diagnosis and Management of Patients with Inherited Primary Arrhythmia Syndromeを解説し、またこれらガイドライン出版後に示されたエビデンスをもとにまとめております。
本書が想定している読者はブルガダ症候群に関わる人たちです。
1.ブルガダ症候群
1992年にブルガダらは、構造的・器質的な心疾患を認めないにもかかわらず心室細動発作を起こした8症例から、心電図で不完全右脚ブロックと右胸部誘導でのST上昇という特徴を見出し、ブルガダ症候群として報告した。この特徴的な心電図波形は2つの型が存在するが、季節変動などで変化し時に正常化する。青壮年男性に多いこと、失神・突然死の家族歴を有すること、安静時の心室細動が見られることなどの共通点から、早期再分極症候群と合わせてJ波症候群と称することもある。
健康診断で見つかったブルガダ症候群に特徴的な心電図波形、ブルガダ型心電図をどのようにリスク評価し、管理・治療するのかについては未だに標準化されていない。
その病態は個々の心筋組織の不均一な活動であると考えられている。
2.ブルガダ型心電図
12誘導心電図は左側が四肢誘導、右側が胸部誘導である。ブルガダ型心電図は胸部誘導の上から2,3段の波形で診断できる(図)。脚ブロックとは心房から心室への電気刺激伝導が通常よりも遅れていることを表す。右室へ連なる右脚と左室へ連なる左脚がある。右脚ブロックとは右室へ連なる刺激伝導系の流れがわずかに遅れている状態を指す。非常に遅れている場合に完全右脚ブロックとなり、わずかに遅れている場合は不完全右脚ブロックとなる。
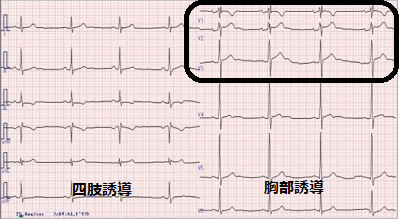

ところで、心電図波形上の特徴的な所見から「P波」「Q波」「R波」「S波」「T波」「U波」と命名されており、胸部誘導におけるQRS波形は第1から第2誘導では下向き、第3誘導から上向きを示すことが多いが、右脚ブロックでは第1、第2誘導も上向きの波形を示す。不完全右脚ブロックでは完全右脚ブロックに比べQRS幅が正常に近く狭い。
また右胸部誘導とは心電図の電極の位置を指し、上記と同じく胸部誘導の第1、第2誘導を指す。心電図上のS波からT波にかけて通常、S波は基線の高さまで戻ってからT波に至るが、ST上昇ではS点が基線まで戻らず、QRSからT波までなだらかに連なっている状態を指す。ST上昇は通常、心筋組織の障害を指すが、ブルガダ型心電図の所見の意味については今なお議論がある。
ブルガダ型心電図にはコブド型とサドルバック型があり、前者のほうが不整脈の発生リスクが高い。

3.心イベント、および致死性不整脈の割合
ブルガダ延長症候群では心イベントがどれくらい起こりやすいのかが重要である。心イベントとは失神と致死性不整脈、突然死が挙げられる。起こりやすい致死性不整脈として、心室細動という不整脈が挙げられる。心電図上の特徴としてギザギザの鋸の歯のような形状の波形がみられる。ここまでランダムで、非常に速い心拍では全身に血流を送るポンプの機能を果たすことができない。脳への血流が減るか途絶えてしまうので失神という症状で現れ、その不整脈が長く続けば脳のみならず全身への血流が保つことができなくなるため死に至る。
ブルガダ症候群に限らず、遺伝性不整脈は長期にわたり無症状のこともあるが、心室頻拍(VT)、心室細動(VF)などの致死性不整脈を発症するとまず動悸、めまい、失神などの症状が出現した後、その状態が長く続くと心停止・心臓突然死の原因となりうる。
人口動態統計での不整脈死の割合と心臓突然死の頻度
心臓突然死は心臓に起因する予期せぬ内因死である。2019年(令和元年)の人口動態統計によると、心疾患による死亡数は約20.7万人で、全死因の約15.0%である。そのうち不整脈及び伝導障害による死は約3万人で2.3%を占めていた。また乳児死亡数892人のうち乳幼児突然死症候群は4.8%であった。
突然死の年間発生率は久山町研究では40歳以上の住民10万人あたり89人、京都市民の調査では10万人当たり102人、新潟県の15歳以上の調査では10万人当たり145人であった。日本人においては10万人当たり100人程度と推測され、年間13万人が突然死していると考えられる。
久山町研究で、1962~2009年に剖検を施行した1,934人のうち発症から24時間以内の突然死は204人、そのうち心臓突然死は100人であった。そのうち23%は原因不明の心疾患であり、このような原因不明の心疾患の一部は遺伝性不整脈であった可能性がある。通常の病理解剖のうち、器質的心疾患を認めなかった突然死症例に対し、遺伝子検査を実施したところ、17.6~26.1%に遺伝性不整脈の遺伝子変異が認められた。
日本の状況をまとめると、わが国では年間約13万人の突然死の発生があり、そのうち約7万人が心臓突然死であり、遺伝性不整脈はそのうちの約10%、7,000人程度と考えられる。
一般的な診断の流れ
失神や心停止などの重篤な症状を認めた場合、病歴や家族歴、検診所見などとともに、一般的に心臓超音波検査、心臓MRI、冠動脈造影検査などの画像検査が行われる。同時に12誘導心電図、24時間ホルター心電図検査などを合わせて行う。あるいは二次性不整脈の原因となるような、薬物、電解質異常、代謝性疾患、外傷などを調べる。これらの検査で心臓その他に明らかな器質的異常(=構造的な異常)を認めない場合、遺伝性不整脈が疑われる。
遺伝性不整脈が疑われる場合、入院あるいは外来においてカテコラミンやNaチャネル遮断薬などの負荷試験や心臓電気生理検査によるリスク判定を目的として適応が検討される。
4.ブルガダ症候群の疫学
ブルガダ症候群の有病率は東アジアで比較的高く、コブド型の割合は日本の成人で0.1から0.3%と報告されている。一方、欧米人は0.02から0.15%である。サドルバック型はさらに高く、40歳以上の集団において、全体で0.7%、男性に限れば2.14%とされる。
有病率
日本人のデータはガイドラインでは3,300人から14,000人規模の、5つの研究結果の表になっている。コブド型は0.05から0.26%、サドルバック型を含むそれ以外の頻度は0.09から1.2%とばらつきが大きい。まとめると心電図でみられる頻度は14.2人/10万人・年である。30から40代で初めて出現するケースが多く、平均年齢は45歳である。また突然死発生の平均年齢は57歳である。小児では少なく、0.005%程度と報告されている。
性差
ブルガダ症候群は男性に多く発症することが知られており、男性が全体の7、8割を占めている。日本の研究結果では女性は5%を占めるのみである。男性に多い理由として、右室心外膜で一過性外向きK電流の密度が高いため、第1相の凹みが深いため、イオン電流の影響を受けやすいと考えられている。またテストステロンはカリウム電流のような細胞外向き電流を増価させ、細胞内向きのL型カルシウム電流を減少させることが知られている。ある研究では血中のテストステロン濃度が高いことが示されている。
家族歴
突然死の家族歴を有する症例について、日本では12~14%と考えられている。
予後
予後は診断された際に不整脈や失神の経験があるかどうかが重要なカギである。日本人ブルガダ症候群の心イベント発生率は心室細動の経験のある人は年間8~10%、失神の経験がある人は年間0.5~2%、無症候例では年間0~0.5%程度である。これは欧米の結果とほぼ一致している。FINGER研究で、VF既往群7.7%/年、失神既往例1.9%/年、無症状0.5%/年であった。
日本人のコブド型の発端者245人の心イベント発生率は34~63か月追跡調査をして、心室細動を起こしたことがある人の再発率は年間10.2%、失神したことのある人で年間0.6%、無症状だった人は年間0.5%であった。 コブド型でない85人の場合、心室細動を起こしたことのある人は年間10.6%、失神を起こしたことのある人は1.2%、無症状では0%であった。
別の研究でもコブド型の460人中、心イベント発生率は心室細動を経験したことのある84人中27人(32%)、失神を経験したことのある109人中8人(7%)、無症状の267人中3人(1%)であった。
5.ブルガダ型心電図の原因となる状況
ブルガダ症候群の危険因子は青壮年期のアジア人男性であり、薬剤や発熱、運動直後、高血糖状態が原因で二次的にコブド型となり、致死性不整脈が発生することがある。またしばしば日内変動や季節変動を示すことも知られている。
基本プロフィール
ブルガダ症候群はアジア人、青壮年代、男性に多い。
発熱
発熱はブルガダ型心電図の発現リスクだけでなく、致死性不整脈発生リスクも上げる。発熱時のみコブド型波形を示す無症候例でも突然死は年間0.9%に見られる。
薬剤
薬剤としては抗不整脈薬のうちIa群やIc群のナトリウムチャネル遮断薬は負荷試験に用いられる。薬剤投与後にST変化が増強する。ピルジカイニドやフレカイニド、プロカインアミドなどが用いられている。薬剤誘発性ブルガダ症候群は下に記す。
運動
運動中は交感神経が刺激されることで、コブド型からサドルバック型に変化し、リスクは軽減されるが、運動後には副交感神経が緊張するためST変化が顕著になり、リスクが上昇するケースがある。
血糖値
経口糖負荷試験で血糖値やインスリン値が上昇することで、ST変化が増強し、リスクが上がることがある。食後、とくに夕食後にはコブド型へ認めることがある。短時間に多くの食物を摂取することで副交感神経が緊張し、致死性不整脈リスクが上がる可能性がある。
ブルガダ型心電図を取りうる状況
1) 心電図パターン
非定型右脚ブロックや左脚ブロックなど
2) 心疾患
左室肥大、急性冠動脈イベント(特に右室)、急性心膜炎、心筋炎、解離性大動脈瘤、肺塞栓症などの急性疾患や不整脈原性右室心筋症、異型狭心症。
右室流出路を灌流する円錐枝や右室枝の閉塞で同じような変化がみられる。
3) その他
自律神経失調、高カリウム血症などの電解質異常、低体温、漏斗胸
6.ブルガダ型心電図を取りうる薬剤
ナトリウムチャネル遮断薬以外に、ブルガダ症候群・ブルガダ型心電図変化を誘発する薬剤が複数報告されている。三環系抗うつ剤、フルオキセチン、リチウム、トリフルオペラジン、抗ヒスタミン剤、コカインなどが挙げられている。フランスの研究では、心電図に異常を認めない1,000人の健常者にナトリウムチャネル遮断薬による薬剤チャレンジ試験を実施した結果、0.5%に薬剤誘発性ブルガダ型心電図変化が認められた。薬剤誘発性QT延長症候群と同様に、薬剤誘発性ブルガダ型心電図変化にも潜在性イオンチャネルの機能障害が考えられる。
https://www.brugadadrugs.org/
(1) 三環系抗うつ薬
三環系抗うつ薬の心臓突然死のリスクとして、アミトリプチンの最大容量での相対リスクは2.5倍である。キニジンのような抗不整脈作用もあり、再分極に影響を及ぼすため、QT延長とトルサード・ド・ポアンツの結果の可能性もあるが、一般的な心血管系への影響は心室内伝導遅延である。また右胸部誘導では一過性のコブド型がみられることがある。実際、心疾患の既往のない65人の若年患者にアミトリプチリンかクロミプラミンを意図的に過剰摂取した際に、15%にコブド型ブルガダ型心電図変化が認められている。この変化は第0相のナトリウムの最大電流の低下とIto活性化の低下に起因するものである。
(2) リチウム
リチウムはうつ病や双極性情動障害の治療に使用される。これまでQT延長を伴わない非特異的なT波異常と関連している。その他、洞不全症候群、心防鼠度、房室ブロック、右脚ブロック、心室頻拍、心室細動などとの関連が示されている。ある報告ではリチウム療法を受けた2例においてコブド型変化を認めており、リチウムからの離脱により心電図の回復を認めている。細胞実験では治療範囲のリチウムによって強力なナトリウムチャネル遮断を示すことが報告されている。
(3) 抗ヒスタミン薬
第一世代の抗ヒスタミン薬で治療された患者でコブド型心電図変化を認めた。眩暈の治療のためにジメンヒドリナート(ドラマミン®)の静注によって一過性のST上昇を認め、フレカイニドの投与で無症候性ブルガダ症候群と診断された。
またジフェンヒドラミン(レスタミン®)でもコブド型変化を認めた。これは薬物の過剰摂取の結果であると考えられる。
(4) コカイン
コカインには間接的な交感神経刺激作用に加えて、フレカイニドに似た強力なナトリウムチャネル遮断効果を持っている。この作用がコカインによって誘発される心臓突然死の主要なメカニズムと考えられている。
正常心電図の人がレクレーションとしてのコカインを使用した際に一過性コブド型変化をきたした例が報告されているが、薬物誘発試験にも心臓電気生理検査でも誘発はされなかった。
通常はコカインの過剰摂取後にブルガダ型心電図の誘発を認める。コカインの全身性痙攣の発作で心停止や重篤な代謝性アシドーシスを合併した例では右脚ブロックやQRS幅の拡大、コブド型変化を認め、炭酸水素ナトリウムの急速投与により心臓伝導障害やブルガダパターンが正常化した。
動物モデルでコカインの大量投与によりPR, QRS, QTc、AH, HV感覚が大幅に延長することが示されている。
(5) ブピバカイン
抗不整脈薬のうちIB型(リドカインやメキシレチン)によってブルガダ型心電図が誘発されることはないが、より長時間作用型の局所麻酔薬であるブピバカイン(マーカイン®)はSCN5A保因者において心室性不整脈の誘発が報告されている。リドカインとは異なり、ブピバカインはブルキンエ線維と心室筋の脱分極の第0相を強力に抑制し、長時間ナトリウムチャネルに結合したままになる。
(6) カルシウムチャネル遮断薬
カルシウムチャネル遮断薬のうち、ベラパミルによるブルガダ誘発が1例報告されている。ジルチアゼムと硝酸イソソルビドの同時投与もブルガダ症候群と心室頻拍を誘発する。
メカニズムとして、カルシウムチャネル遮断薬によるIca(カルシウム電流)が遮断し、既存のINA(ナトリウム電流の欠損によって新外膜活動電位ドームの相乗的喪失を齎し、症候群の原因となる。
(7) プロポフォール
プロポフォールは麻酔薬である。重篤な副作用は基本的にはないが、高容量のプロポフォール注入による突然死の報告は見られていた。その病態生理学的メカニズムは不明である。
長期プロポフォール投与を受けた頭部外傷患者67人中7人はプロポフォール注入症候群であり、6人がブルガダ型心電図を認めている。
6.ブルガダ症候群の診断基準

7.心筋細胞の動き(活動電位)
心筋細胞の活動電位(action potential)は、電気的刺激に応じて細胞膜に生じる一過性の膜電位の変化である。活動電位はスパイクやインパルス、あるいは「発火」と呼ばれる。活動電位は、主としてナトリウムイオン(Na+)やカリウムイオン(K+)が、細胞内外の濃度差に従ってイオンチャネルを通じて受動的拡散を起こすことによって起こる。活動電位はさまざまな種類の細胞から生み出されるが、最も広範には神経系において神経細胞同士や、神経細胞から筋肉や腺などの他の体組織に情報を伝達するために使われる。活動電位はすべての細胞で同じというわけではない。心筋は神経に次いで活動電位を発する組織である。
心筋細胞の内と外の間では、電位差が常に存在している。これは細胞内外での金属イオン分布と、これらイオンに対する細胞膜の透過性と選択性に由来する。電荷を持つイオンの分布が細胞内外で異なるため、活性化していない静止状態の細胞では通常、細胞外と比べ細胞内の電位がマイナスとなっている。活動電位とは、この電位差がなんらかの刺激によって一時的に逆転する現象である。
活動電位における負から正への電位の変化に要する時間は短く、数ミリ秒である。どんな細胞の活動電位にも順に脱分極相、再分極相があり、多くの場合過分極相の段階もある。脱分極のプロセスにおいて心筋細胞の興奮、つまり細胞の電位が一時的にプラスからマイナスになる膜電位の一連の反応を通して0mVに近づくことで膜電位が脱分極し閾膜電位(threshold)に達すると活動電位が生じる。心臓のペースメーカー細胞のような細胞では、中間電圧のプラトー相は下降相に先行し活動電位持続時間を数百ミリ秒延長する。活動電位の発生には電位依存性Na+チャネルの存在が不可欠である。心臓の調律を担っている洞房結節の細胞はNa+チャネルの代わりに電位依存性Ca2+チャネルを通してCa2+電流による活動電位を発生させる。
心筋細胞の活動電位による膜電位の変化は以下のプロセスを辿る(図)。
第0相 Phase0:脱分極相(depolarization)
第1相 Phase1:スパイク(spike)
第2相 Phase2:プラトー相(plateau)
第3相 Phase3:再分極相(repolarization)
第4相 Phase4:静止電位(resting potential)
心筋細胞の活動電位は神経の活動電位と原則的には同一ですが、0電位付近での再分極の速度が極端に遅いのが特徴的である。活動電位波形の上でこの部分を プラトー相 plateau phase と呼ぶ。心筋活動電位はこのプラトー相を有することが特徴であり、このために活動電位の持続時間が非常に長い。心筋活動電位の各相は、第0相から第4相までの番号で呼ばれる。図に各相の名称を対比して示した。
プラトー相形成のイオン機構は、種々の実験から現在ではほぼ図のように考えられている。Na+流入に対する細胞膜の透過性が急速かつ一過性に上昇することによって細胞内の陽イオン濃度が上がることで活動電位の立ち上り(第0相)が形成される。スパイク形成(第1相)に続いて主としてCa2+に対する透過性がゆっくりと上昇するとともにK+に対する細胞外への透過性が生じ始めることによってプラトー相が形成される。次いでCa2+透過性が減少しはじめK+の細胞外への透過性が上昇することで再分極が起こる。これら金属イオンに対する膜の透過性のもとは、細胞膜に存在するそれぞれのNa+、Ca2+、K+イオンチャネルが担っている。
最初の急速かつ一過性のNa+透過性上昇をもたらす細胞膜のイオン通路を 速いNa+チャネル、これに対してプラトー相形成に関与するものを 遅いCa2+チャネル と呼ぶ。この「遅いCa2+チャネル」はプラトー相形成に関与するとともに、心筋収縮にも極めて重要な役割を果たすと考えられている。このCa2+チャネルは膜電位に依存して活性化されるので、「 電位依存性Ca2+チャネル 」とも呼ばれ、一方、これとは異なるタイプのCa2+チャネルも見出されており、それらと区別するために、 L-型カルシウムチャネルと呼ぶ。
活動電位の発生が細胞内外の陽イオンの濃度勾配を基にしていることは神経の場合と同様であり、Na+とK+濃度勾配の維持にはNa+ポンプが関与している点も神経と同じである。Ca2+の濃度勾配(細胞外が高く、細胞内はきわめて低い)維持にはCa2+ポンプやNa+/Ca2+交換機構が関与すると考えられている。
8.心筋細胞レベルで起こっていること
ブルガダ症候群に伴う致死性不整脈の発生は心筋細胞にあるイオンチャネル機能に関係する遺伝子異常があり、ここに様々な要因が複雑に絡み合って起こっている。心臓の形態・構造自体には異常は認められなくても、分子生物学的にナトリウムチャネル、カルシウムチャネル、カリウムチャネルなどのタンパク質の構造変化や非機能性タンパク質の発現障害および細胞膜を通過するイオン交換の低下によって活動電位発生の遅延や伝導障害に伴って起こっている。
心臓が活動するために電気刺激による活動電位が心筋細胞を伝わることで収縮・弛緩している。伝導速度には、細胞の脱分極につながるナトリウムチャネルの活性化と、それに続く心筋細胞間のギャップ結合伝導の両方が含まれる。活動電位の発生や伝播の中で生じる様々な電気的な混乱によって、伝導障害および不整脈発生につながる可能性がある。
ブルガダ症候群の1/4はSCN5A遺伝子の機能喪失型変異に起因しており、フェーズ0の間に内向き電流が減少している。結果として生じるフェーズ0中のより遅いアップストロークと、その結果としての活動電位の遅延は、ブルガダ症候群の心室性不整脈の発生を介する上で重要な役割を果たす。
Martiniらは、1989年に右心室の線維性変化を捉え、この変化がECGにおけるRBBBおよびST部分の上昇が生じる可能性について報告している。Scn5a遺伝子改変マウス(Scn5a +/-、Scn5a 1798insD / +、およびSCN5aG1408R)を用いた動物モデルにおいては標的となった遺伝子改変により間質の線維化の刺激伝導の低下と関連していることが判明した。Scn5a +/-マウスはまた、進行性心臓伝導障害(レネグレ病)を示唆する進行性の伝導障害を示し、右心室生検では、線維症、アポトーシス、および心筋炎などの構造変化が存在することが見出された。罹患した心筋を介した不連続な伝導を反映している。
ナトリウムチャネルとギャップ結合の両方が介在板に共存することが示され、デスモソーム、ギャップ結合、およびナトリウムチャネル複合体を含むタンパク質相互作用ネットワークのホストであるという概念が確立している[95]。[96]。剖検所見から、ブルガダ症候群患者の心臓の右室流出路におけるコラーゲン沈着による心筋線維化の増加とギャップ結合発現の減少が確認され、これらのネットワークの成分が互いに独立していないという考えを支持している。
再分極理論は、心筋壁を横切る活動電位差持続時間(APD)の短縮がブルガダ型心電図の主な原因であるとしている。機能喪失SCN5A変異によってNa +チャネルの速い不活性化と遅い不活性化にそれぞれ反対の影響を及ぼしている。[101]。速い不活性化の中断は持続的なNa +電流につながり、遅い心拍数での再分極の延長に繋がる。ただし、遅延した不活性化の中間的な状態の割合が増大することでNa +チャネルの回復が遅れ、Na電流が減少する。
KCN〇やSCN〇とはK-ChaNnelやSodium-ChaNnelから取られた略語である。KチャネルはPCNでは?と思うかもしれないが、会話では「ケーチャネル」という言葉を使うためだろう。Naチャネルは「ナトリウムチャネル」や「ソディウムチャネル」と呼称している。
(1) NaV1.5 (SCN5A, SCN1B, SCN2B, SCN3B)
NaV1.5は心臓活動電位のうち第0相を形成する。1998年に同定されたSCN5Aはαサブユニットであり, SCN1B, SCN2B, SCN3Bなどのβサブユニットと結合してNaV1.5を形成している。
αサブユニットは電位依存性膜貫通性のタンパク質である。4つの反復する膜貫通ドメインを持ち、それぞれのドメインにS1からS6のセクションを持つ、巨大なたんぱく質である。主に心筋活動電位第0相の脱分極過程を担う。Kチャネルとは異なり、1つのタンパク質で1つのαサブユニットとなる。4つの機能修飾βサブユニットと結合し、チャネルの開孔(=ゲーティング)の調節に関わっている。
Nav1.5は活性化したのち、不活性化が極めて速い。SCN5Aの場合は、機能獲得型も機能喪失型も心筋細胞の不安定性をもたらす。機能喪失による伝導遅延や心筋活動遅延、早期不活性化、チャネル開孔異常などによる影響がある。機能獲得型変異もNaイオンの持続的流入に伴って起こる細胞内濃度の上昇によって、細胞内Caイオンの過負荷につながり、心筋収縮・弛緩、酸素消費の過程に負の影響を及ぼす可能性がある。
(2) NaV1.8 (SCN10A)
もう一つのブルガダ症候群に関連するナトリウムチャネルはNaV1.8をコードするSCN10Aである。SCN5Aと同じくナトリウムチャネルのαサブユニットだが、このNaV1.8は後根神経節の感覚神経に発現している。ブルガダ症候群の原因遺伝子として挙げられているが、心筋細胞での発言は極めて小さく単独での関与ではない。共発現の実験ではSCN5Aの機能を増強することが示されている。
(3) CaV1.2 (CACNA1C、CACNB2、CACNA2D1)
構造
L型カルシウムチャネルをコードしている。CACNA1Cはα1サブユニット、CACNB2はβ2サブユニット、CACNA2D1はα2/δサブユニットである。カルシウムチャネルはα1、α2/δ、βサブユニットが1:1:1の割合で複合体を構成している。α2/δは細胞外に、βは細胞内に存在している。CACNA1Cは先天性QT延長症候群、ティモシー症候群の原因遺伝子でもある。統合失調症や双極性障害のリスク遺伝子としても報告されている。
CaV1.2は4つのヘテロ四量体であり、S1-S4は電圧センサー、S5,S6は選択性フィルターを構成している。S1-S3のヘリックス部分には負に帯電したアミノ酸が含まれ、S4には正に帯電したアミノ酸が含まれている。S3-S4リンカー部分がチャネルのゲーティングを決めている。
機能
カルシウム(Ca)チャネルの開孔はα1サブユニットで起こっている。心筋細胞の膜電位の変化に反応して活性化する。ナトリウムチャネルの開孔によって脱分極(細胞内の電位がマイナスから0に戻ること)が始まるとCaチャネルの電位感受性ドメイン(S1-S4ヘリックス)が構造変化し開孔する。すると流入したCaは速やかにカルモジュリンと結合し、CaチャネルのEFハンド付近のループと相互作用して構造変化を起こし、早いチャネルの不活性化が起こり(Ca依存性不活性化)、Ca電流が低下し始める。続いて脱分極状態そのものも遅い不活性化の一因となる。ティモシー症候群の原因変異(Gly406Arg)の解析により不活性化速度が遅延することで、結果として機能獲得型の機能障害であることが示された。一連の解析からCaV1.2のI-IIループとβサブユニットの複合体が蓋(lid)として細胞質側(細胞の内側)から塞ぐことで「電位依存性」不活性化が起こると考えられる。
L型Caチャネルはアドレナリン受容体のようなGタンパク共役受容体からPKAを介してリン酸化刺激を受け、Ca電流を増強させる。
9.ブルガダ症候群の生活指導と治療
(1) 生活指導
日常生活上の注意点としては、不整脈発作のリスク因子を取り除くことと不整脈発作時の対処方法である。
Naチャネル遮断薬や抗うつ病の薬などは心電図異常を増強させ、不整脈発作を惹起する可能性があるため、使用を避ける。
過度の飲酒を避ける。
発熱時には速やかに解熱を図る。
経過観察例において、新たに湿疹が出現した場合には直ちに受診する。
家族や周りの人たちにAEDの使い方や心肺蘇生の方法を習得してもらう。
(2) 薬物治療
ブルガダ症候群の心室細動発生の機序は右室心外膜側心筋での一過性外向きK電流(Ito)の増加によるST上昇と第2相リエントリーの発生である。Itoを抑制する薬理作用を持つキニジンは頻回の心室細動発作の既往のある患者に推奨される(Class IIa)。日本人向けガイドラインでは300-600㎎の投与となる。またシロスタゾールはホスホジエステラーゼIII阻害によって細胞内cAMPを増価させ結果としてCa電流を増加させる作用がある。心拍数増加によってItoを減少させ、発作を予防する。200㎎の投与量である。Ca拮抗薬であるベプリジルはItoを含む複数のKチャネルを抑制する。Naチャネルの活性化増強によりNa電流が増加することで予防作用が示されている。
(3) 植込み型除細動器
コブド型心電図に加えて、心室細動や心停止の既往を有する患者は植込み型除細動器(implantable 、cardioverter defibrillator; ICD)のクラスI適応である。心室細動や心停止がなくても、コブド型心電図に加えて①不整脈原性失神か夜間苦悶様呼吸を有する症例、②原因不明の失神に加え心臓電気生理検査で心室細動が容易に誘発されるケースはクラスIIaである。またコブド型心電図をきたす無症候性でも、臨床所見や家族歴心電図所見、遺伝子変異の有無があり、心臓電気生理検査で容易に心室細動が誘発されるケースはIIbのICD適応となる。
(4) カテーテル・アブレーション
心室遅延電位や分裂電位を呈する右室流出路心外膜側に対するアブレーションによって、ブルガダ型心電図波形が正常化した例が報告された。
10.ブルガダ症候群の原因遺伝子
ブルガダ症候群の原因遺伝子としてSCN5Aが同定されて以降、合わせて23の関連遺伝子が報告されている。これまでメンデル型単一遺伝子疾患の「イオンチャネル病」と考えられてきたが、近年では複数の遺伝子変異が関与する複雑な形質であると理解されている。小児ではほとんど見られず、成人例が大多数を占めることから、後天的な要素が含まれると考えられる。
1) BrS1, SCN5A
1998年にブルガダ症候群の原因遺伝子として同定されたSCN5AはナトリウムチャネルNaV1.5のαサブユニットである。活動電位の第0相をなす。
SCN5Aの変異は日本人のブルガダ症候群の15-20%を占めている。SCN5A(NM_000335.5)はナトリウムチャネルのサブユニット5(sodium voltage-gated channel alpha subunit 5)である。この遺伝子の変異が機能獲得型であるとき、先天性QT延長症候群の原因ともなる。
SCN5A変異を持つ患者と持たない患者を比較すると、心電図のPQ間隔が長く、薬剤負荷によるPQ間隔・QRS間隔の延長の幅が大きい。心臓ペーシング・カテーテルによる心内電位の観察ではヒス束から心室電位までの幅が長いことが知られている。
ブルガダ症候群のうちSCN5A陽性者60人と陰性者355人の比較研究では、陽性者の方が心イベントの発生率が高く、初発年齢も低かった。SCN5A遺伝子の中でもナトリウムチャネルの中心孔のあたりに存在する遺伝子変異は予後が悪い可能性も指摘されているが、統計学的には有意差はなかった。
SCN5Aはブルガダ症候群の他、先天性QT延長症候群3型(LQT3)、進行性心臓伝導障害、洞不全症候群、先天性房室ブロック、乳児突然死症候群、拡張型心筋症でも報告されている。
https://www.ncbi.nlm.nih.gov/gene/6331
(2) NaV1.8 (SCN10A)
もう一つのブルガダ症候群に関連するナトリウムチャネルはNaV1.8をコードするSCN10Aである。SCN5Aと同じくナトリウムチャネルのαサブユニットだが、このNaV1.8は後根神経節の感覚神経に発現している。ブルガダ症候群の原因遺伝子として挙げられているが、心筋細胞での発言は極めて小さく単独での関与ではない。共発現の実験ではSCN5Aの機能を増強することが示されている。
(3) CACNA1C
電位依存性カルシウムチャネルサブユニットα1C(CACNA1C; calcium voltage-gated channel subunit alpha1 C)である。日本人での頻度は非常にまれで0.5%である。ブルガダ症候群だけでなく、先天性QT延長症候群、あるいはティモシー症候群の原因遺伝子でもある。CaV1.2のαサブユニットの変異によりCa電流の低下がみられる。
βアドレナリン作動性アゴニストによってこの電位依存性カルシウムチャネルを刺激するメカニズムが確立されている。
Ca拮抗薬の有効性が報告されている。
※ティモシー症候群(TS; OMIM 601005)は、致命的な不整脈、指や足の指の水かき、先天性心疾患、免疫不全、断続的な低血糖、認知異常、自閉症などの多臓器機能障害を特徴としている。
11.結果の解釈について
遺伝子検査において原因遺伝子の中に変異が同定されてもその変異が疾患発症の原因となりうるかどうか結果の解釈をする必要がある。疾患の有無にかかわらず稀少変異は存在しうる。病的変異が確認されている家系内においても頻繁に認められる浸透度の変動や散発的な遺伝子型陰性の症例の存在によって、多くの稀少変異が一般集団内で予想外に高い頻度で認められていることから、臨床的に関連する遺伝的変異の中に病原性のスペクトルが存在すると考えられている。単独で疾患の原因となるには不十分な低および中程度の浸透性変異が存在することから、遺伝性不整脈の病因は遺伝的要因のみならず、臨床的・環境的要因も重要であることが共通見解となっている。
変異は病的、良性、病的意義の不明な変異(VUS)に分類される。因果関係に十分な証拠がある場合、あるいは変異が疾患を引き起こしていないことを裏付ける根拠が明確な場合は、それぞれ病的変異・良性変異と診断できる。ところが因果関係が不十分である場合、あるいは矛盾している場合はVUSとして分類される。2015年、米国臨床遺伝・ゲノム学会(ACMG)は変異解釈に関する共同声明を発表しされた指針が広く採用されている。ClinVarやHGMDなどの変異情報の公開リポジトリからのデータは解釈に役立つ。健常人の遺伝情報についてはgnomAD v3.1や東北メガバンクの日本人多層オミックス参照パネル(jMorp)において確認できる。日々情報が更新されており、以前の分類の根拠となったデータに新しいデータを加えて再評価することが重要である。遺伝子が特定の表現型と強い関連を示すかという点は更に重要である。ClinGenのサイトにおいて遺伝子型と表現型をリンクの臨床および実験的証拠を評価する必要されている。
12.遺伝カウンセリング
遺伝子検査の特殊性として、ある個人での検査結果は生涯変更がないこと、1つの変異は次世代へ50%の確率で受け継がれることである。ここから健常人でも将来重篤な疾患を発症する可能性を知りえることになり、また血縁者が病的変異保因者であることから発症リスクを知り得ることとなる。そのため遺伝診療においては各段階で遺伝カウンセリングが不可欠である。がんゲノム診療体制には遺伝カウンセラーが必ず含まれ、遺伝子検査が患者のみならず健康な家族へも及ぼし得る影響についての情報提供や病的変異陽性者やその家族への心理的サポートに欠かせない存在となっている。
遺伝診療は明確に診断されている発端者について原因遺伝子の変異同定を実施したのち、カスケード検査として同じ変異について無症候性のリスクのある親族に提供するという2段階のプロセスが一般的な流れである。遺伝子検査を受ける人を厳密に選択し、変異について正確な解釈をすること、この二点が患者とその家族にとって最良の結果が達成されるために重要である。被検者の選択基準として、特徴的な表現型を示していること、若年発症、重篤さ、濃厚な家族歴などは遺伝的な影響を強く示唆する。臨床診断が不明確なまま検査を進めても同定された遺伝的変異の解釈が非常に困難となる。遺伝性不整脈の場合、誤分類によって重大な影響を及ぼす可能性があるため検査の事前確率が低い場合は避けることが望ましい。家族歴の取得は遺伝診療の第一歩と言える。遺伝性不整脈は一般的に常染色体優性(AD)の遺伝形質を取る。心臓突然死や失神は明確な症状である反面、様々な要因でも起こりうるため、死後の情報を含めて詳細な問診が必須である。その中で専門的なスキルを持つ遺伝カウンセラーは遺伝リスクについて良好なコミュニケーション関係を構築し、遺伝子検査やサーベイランスの頻度の提案を通して、より良い心理社会的適応に導く役割を果たしている。
