
レムデシビルによる心筋障害 & 経口新型コロナ治療薬処方シェア
こんにちは。新型コロナウイルス感染症 (COVID-19) の治療方法は変化し続けています。
はじめに、レムデシビルによってまれに起こる心筋障害について、最後に日本における経口投新型コロナ治療薬商法シェア (6月13日up date)について、書いてあります。
本来のこのnote記事は目次の「はじめに」から始まります。その前に簡単に総論的な説明を加えてみました (under growing 7月28日2023)
ヒト感染症を起こすウイルスに対する治療薬概観
ヌクレオシド類似体は一般にウイルス複製、特にウイルス DNA または RNA ポリメラーゼを標的とし ( Eltahla AA, Luciani F, White PA, Lloyd AR, Bull RA. 2015. Inhibitors of the hepatitis C virus polymerase; mode of action and resistance. Viruses 7:5206–5224)、複数のウイルス感染症の治療に臨床的に成功しています (De Clercq E, Li G. 2016. Approved antiviral drugs over the past 50 years. Clin Microbiol Rev 29:695–747.)。
しかし、コロナウイルスに対する抗ウイルスヌクレオシドの同定と開発は、独特の CoV プルーフリーディング 3'-5' エキソリボヌクレアーゼ (ExoN) の存在によって妨げられてきました。(Agostini ML, Andres EL, Sims AC, et al. Coronavirus susceptibility to the antiviral remdesivir (GS-5734) is mediated by the viral polymerase and the proofreading exoribonuclease. mBio. 2018; 9.pii: e00221-18.)



承認された抗ウイルス薬は、RNA ウイルス (HCV、RSV、およびインフルエンザ ウイルス)、DNA ウイルス (HCMV、HBV、HPV、HSV、および VZV)、およびレトロウイルス (HIV) ごとにグループ化されています。 現在使用されている抗ウイルス薬の名前はオレンジ色の長方形で囲まれています。 中止または中止された抗ウイルス薬の名前は灰色の長方形で囲まれています。 複数のウイルスを阻害する薬剤は、ウイルス グループ間の重複領域に示されています。 HCV 薬剤については、承認された併用薬 (シメプレビルとソホスブビル、ソホスブビルとダクラタスビル、ダクラタスビルとアスナプレビル、およびリバビリンと PegIFNα-2b) を示すためにプラス記号が使用されます。Clin Microbiol Rev 29:695–747.
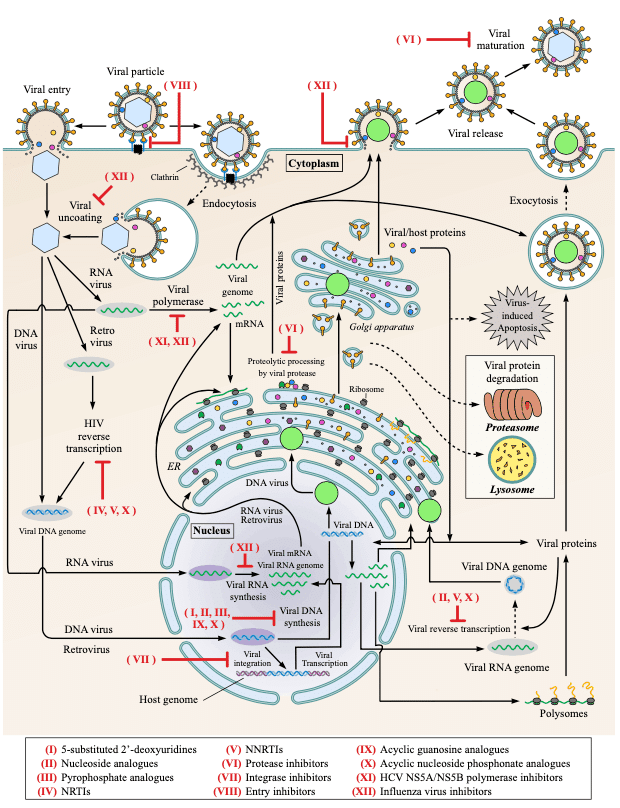
ローマ数字で並べた 12 の薬物グループが下部に示されており、ウイルスのライフサイクルの主要な段階を妨げる薬物作用が赤い矢印で強調表示されています。 黒い実線の矢印はウイルス複製を伴う直接的な生物学的経路を示し、黒い点線の矢印は宿主細胞内の中間経路を伴う生物学的経路を示します。 エンドサイトーシス、エキソサイトーシス、ウイルス侵入、逆転写、ウイルス組み込み、ウイルス転写、ウイルス翻訳、ウイルス出芽/放出、ウイルス成熟、および細胞コンパートメントに関連するその他の経路(ゴルジ装置、ミトコンドリア、小胞体)など、ウイルスの主要な段階が示されています。 ER]、リボソーム、プロテアソーム、ポリソーム、およびエンドソーム)(詳細については、参考文献 177、300、および 466 を参照)。 特に、DNA ウイルス (HCMV、HBV、HPV、HSV、および VZV)、RNA ウイルス (HCV、RSV、およびインフルエンザ ウイルス)、およびレトロウイルス (HIV) の複製経路は、宿主細胞に侵入した後に分岐します。 RNA ウイルスは細胞質内で複製しますが、DNA ウイルスとレトロウイルスはさらに核に侵入して DNA 合成を行います。 薬物グループ XIII は、このグループの薬物が主に免疫調節剤または抗有糸分裂剤として作用し、ウイルスタンパク質を直接標的としないため、表示されないことに注意してください。 タンパク質と細胞成分の形状とサイズは一定の縮尺ではありません。Clin Microbiol Rev 29:695–747.
インフルエンザウイルスのRNAポリメラーゼとRNAポリメラーゼインヒビター (RibavirinとFavipiravir)
概観のみ


レムデシビル GS-5734 とは?
レムデシビルは、SARS-CoV、MERS-CoV、SARS-CoV-2を含む細胞培養およびマウスモデルにおいて、広範囲のヒトおよび人獣共通コロナウイルスに対して効果的な抗ウイルス活性を示すヌクレオチドアナログプロドラッグです。

マウスモデルにおいて SARS-CoV 疾患に対する予防効果と治療効果の両方を実証した研究→Sheahan TP, et al. 2017. Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses. Sci Transl Med 9:1–11.
レムデシビルはSARS-CoVや MERS-CoVと同様の50%有効濃度値(EC50)でマウス肝炎ウイルス(MHV)を阻害する。 レムデシビルドの存在下でWT MHVを継代すると、EC50で測定したところ、GS-5734に対して最大5.6倍の耐性を付与する、すべてのCoVにわたって保存されている残基におけるnsp12ポリメラーゼの2つの変異が選択された。 耐性ウイルスは、レムデシビルの非存在下では直接共感染継代において WT と競合できまなかった。
レムデシビルは、エキソリボヌクレアーゼ校正活性が損なわれていない場合でも、nsp12 ポリメラーゼを妨害する可能性があります。
Agostini ML, Andres EL, Sims AC, et al. Coronavirus susceptibility to the antiviral remdesivir (GS-5734) is mediated by the viral polymerase and the proofreading exoribonuclease. mBio. 2018; 9.pii: e00221-18.
日本語ブログ
野生型β-コロナウイルスマウス肝炎ウイルス (WT MHV) を GS-5734 親ヌクレオシド GS-441524 で継代すると、nsp12 RNA 依存性 RNA ポリメラーゼ (F476L および V553L) の予測フィンガー ドメインにおける 2 つの非同義変異に関連する表現型耐性が生じた。しかし、この耐性ウイルスは、レムデシビル非存在下でのin vitro同時感染継代で野生型ウイルスと競合できなかった。
米国最初のCOVID-19症例に投与し有効だった
35才男性、高トリグリセリド血症以外は健康。武漢渡航歴あり。胸部XーPで非定型肺炎像の出現から1日後にレムデシビル投与し、10日続いた発熱げ消失し軽快した。N Engl J Med. 2020; 382:929-936. 日本語ブログ

Engl J Med. 2020; 382:929-936.

早期投与で入院&死亡に87%の有効性

対象:過去7日以内に症状が発現し、少なくとも1つの疾患進行の危険因子(年齢60歳以上、肥満、または併存する特定の疾患)を有する、入院していない新型コロナウイルス感染症患者
方法:レムデシビルの静脈内投与(1日目に200mg、2日目と3日目に100mg)またはプラセボの投与を受ける群に無作為に割り当てられた。有効性の主要評価項目は、28 日目までの新型コロナウイルス感染症関連の入院または何らかの原因による死亡の複合値でした。安全性の主要評価項目は、有害事象でした。二次評価項目は、28日目までの新型コロナウイルス感染症関連の受診または何らかの原因による死亡の合計であった。無作為化を受け、レムデシビルまたはプラセボを少なくとも1回投与された合計562人の患者が分析に含まれた:レムデシビル群の患者279人、プラセボ群の患者283人。平均年齢は50歳、患者の47.9%が女性、41.8%がヒスパニック系またはラテン系でした。最も一般的な併存疾患は糖尿病 (61.6%)、肥満 (55.2%)、高血圧 (47.7%) でした。
結果:何らかの原因によるCOVID-19関連の入院または死亡は、レムデシビル群2 人(0.7%)、プラセボ群 15 人(5.3%)で発生した(ハザード比、0.13; 95% 信頼区間 [CI]、0.03 ~ 0.59; P=0.008)。レムデシビル群では患者246人中4人(1.6%)、プラセボ群では患者252人中21人(8.3%)が28日目までにCOVID-19 関連の医療機関を受診した(ハザード比0.19、95%CI、 0.07~0.56)。

安全性:28日目までに、レムデシビル群では患者279人中118人(42.3%)、プラセボ群では患者283人中131人(46.3%)で有害事象が発生した(表3)。両群の患者の少なくとも 5% で発生した最も一般的な非重篤な有害事象は、吐き気、頭痛、咳でした。研究者らが試験レジメンに関連すると判断した有害事象は、レムデシビル群では患者279人中34人(12.2%)、プラセボ群では患者283人中25人(8.8%)に発生した。レムデシビル群ではプラセボ群よりも重篤な有害事象を起こした患者が少なかった(患者279人中5人[1.8%]対283人中19人[6.7%])

結論:COVID-19 進行のリスクが高い入院していない患者において、レムデシビルの3日間投与は許容できる安全性プロフィールを示し、プラセボよりも入院または死亡のリスクが87%低かった。NCT04501952
N Engl J Med. 2022 Jan 27;386(4):305-315. 日本語ブログ
レムデシビル耐性の獲得
後天性B細胞欠損症患者は3ヶ月以上新型コロナウイルスの持続感染を経て肺炎が増悪したためレムデシビル投与されたがレムデシビル耐性変異を獲得した
ステージIVの非ホジキンリンパ腫(NHL)を患う70歳の女性は、リンパ球減少症と低ガンマグロビン血症を合併し、2019年3月にリツキシマブとベンダムスチンの一連の投与を完了した。 NHLは、2020年5月にSARS-CoV-2感染症を発症した際には寛解していた。
40 日目の胸部 CT では、以前の検査と比較して不透明度が増加した。

患者は当院に入院し、持続感染を伴う免疫不全宿主における臨床的およびウイルス学的再発の懸念から、標準的な5日間の投与計画を延長した10日間のRDV投与(148~157日目)を受けた。
患者は治療に対して臨床反応を示し、発熱の回復(149日目、図1a)、CRPの正常化(156日目、図1c)、および胸部CT上の混濁の改善(162日目、図1d)、RT-PCR Ct 値の増加、ウイルス培養中のプラーク形成単位 (PFU) の数の減少、アンプリコンで測定される SARS-CoV-2 サブゲノム RNA (sgRNA) の割合の低下がみられた。

しかし、160日目には18に達したRT-PCR Ct値の減少と、156日目の気道標本中のPFUおよびsgRNAの増加によって証明されたように、RDV療法中および後にウイルス排出の再燃が発生した(図2a)

163 日目に、カシリビマブ-イムデマブ (6,7) の 8 g 点滴を受けた。 急速かつ持続的なウイルス学的反応は、それぞれ 164 日、166 日、217 日までに、検体中の検出不能な培養ウイルス、低 sgRNA、陰性 NP RNA で観察された。
配列決定されたゲノムはネクストストレインクレード20 C内の単一系統(パンゴB1)に属している(補足図1)。nsp12 の変異 E802D が同定され、患者検体でのその検出は RDV 療法と一時的に関連していた (図 2b)。 E802Dは、病気の初期段階(36日目)に採取された検体でも、RDV療法の最初の5日間(148~152日目)に採取された検体でも、1%を超える対立遺伝子頻度では同定されなかった。 この変異は、RDV 療法の開始 7 日後 (155 日目) に初めて検出され、160 日目までに、鼻咽頭検体と唾液検体の対立遺伝子頻度のそれぞれ 23% と 96% を占めた。 Orf1a/1ab 読み取り値の PAML 分析 9 では このフレームでは、この位置は、RDV 投与後のポジティブ選択の確率が最も高いと特定された (BEB Prob(w > 1)、0.984; 平均オメガ、9.90)。
nsp12 の E802 残基は、SARS-CoV-2 RNA ポリメラーゼの活性部位を構成する残基の一部を含むパーム サブドメインに存在する (1、2、10)。 E802残基は、D804およびK807との静電ネットワークに参加し、新生RNAへの結合に関与するループを安定化する(図2c、補足図2a)。 E802D は、in vitro RDV 耐性選択実験で同定され、薬剤の IC50 が約 2.5 倍増加する (2)。

図2bc

Structure depicting E802 in relationship to nsp12 (PDB:7BV2) b) Viral titers (PFU) assessed under 5 μM RDV treatment. Biological replicates are depicted (n=3) with the mean represented by the horizontal line. Significance was assessed by an ANOVA, *p < 0.05 (p=0.03).

これらの発見は、nsp12 の残基 E802Dでの置換によって媒介される RDV 耐性が、免疫無防備状態の宿主の環境において治療の失敗につながる可能性があることを示唆する。
Nat. Commun. 2022;13:1547. doi: 10.1038/s41467-022-29104-y.
日本語ブログ

はじめに
下図は、日本感染症学会によるCOVID-19に対する薬物治療の考え方の最新号 第15版に掲載の治療薬の考え方です。

COVID-19に対する薬物治療の考え方 第15版
パキロビッド(ニルマトレビル/リトナビル)を新型コロナウイルス感染症の患者のうち重症化リスク因子のある軽症~中等症の患者に、ゾコーバ(エンシトレビルフマル酸) を重症化リスク因子のない軽症~中等症の患者を対象に投与することができます。
上図にあるモルヌピラビル (ラブゲリオ ) はEUでは使わなれなくなりました。
レムデシビルは入院中、あるいは施設入所中のCOVID-19患者に対して投与される最も一般的な薬となっています。
日本においてレムデシビルは、2020年5月7日に特例承認され、2021年夏に保険適用されました。当時を説明したブログ記事
レムデシビルの代表的な臨床研究を2つ
○ATCC-1 スタディ 論文のブログ Part 1 Part 2 Part 3 Part4
○入院していない高リスクCOVID-19患者にレムデシビルの3日間投与した二重盲検ランダム化プラセボ対照試験 NCT04501952 結果は、COVID-19関連入院または死亡がレムデシビル群の患者 2 人(0.7%)、プラセボ群の患者 15 人(5.3%)でリスクを87%減少 論文ブログ 概要と方法 結果 考察
投与方法(用法・用量)
成人と体重40 kg以上の小児にはレムデシビルとして、投与初日に200 mgを、投与2日目以降は100 mgを1日1回点滴静注する。
体重3.5 kg以上40 kg未満の小児にはレ ムデシビルとして、投与初日に5 mg/kgを、投与2日目以降は2.5 mg/kgを1日1回点滴静注する。
なお、総投与期間は10日までとする。 添付文書抜粋
レムデシビル(GS-5734) 2020年10月22日承認 FDA
抗ウイルス薬ベクルリー(レムデシビル)は、入院を必要とする新型コロナウイルス感染症(COVID-19)の治療のために、12歳以上で体重40キログラム以上の成人および小児患者に使用される。ベクルリは、病院または入院治療と同等の急性期治療を提供できる医療施設でのみ投与されるべきです。ベクルリーはFDAの承認を受けた最初の新型コロナウイルス感染症治療薬である。FDAへリンク
レムデシビル(商品名:ベクルリー点滴静注用100 mg) とは?
レムデシビルは抗ウイルス薬で、RNA 依存性 RNA ポリメラーゼを阻害してウイルスの増殖を防ぎます。
適応は、軽症者で重症化リスクの高い患者と、中等症以上とされていますが、ガイドラインにおいて副作用をできるだけ少なくするために、投与中の肝機能を注意深くモニタリングすること、および腎機能障害のある患者にはレムデシビルを使用しないことが推奨されています。
レムデシビル (GS-5734; Veklury)について詳しく
作用機序
レムデシビルは親油性と細胞透過性を高めるフェノールおよび1-アラニン エチルブチル エステルを含むマクギガン プロドラッグ部分を含む修飾アデノシン アナログです。静脈内投与後、レムデシビルは急速にモノヌクレオシド型 (GS-441524) に変換され、複数の宿主酵素によって細胞内で薬理学的に活性な三リン酸型 (RTP)に代謝され、その結果、RNA の強力かつ選択的な阻害剤として作用します (図2)

レムデシビルが心筋障害を起こすメカニズム
東北大の魏范研教授と九州大の西田基宏教授の研究チームによる成果で、5月16日に国際科学誌コミュニケーションズ・バイオロジーに論文掲載されました。Commun Biol 6, 511 (2023)
お急ぎのかたは、太字パネルをお読みください
レムデシビル投与により心血管イベントが報告されています。具体的には、低血圧、徐脈、QT延長、T波異常などです
今回、研究者たちは、レムデシビルが修飾アデノシンアナログなので内因性リガンドであるアデノシンと同じように、Gタンパク質共役受容体 (GPCR)を活性化するのではないか?と仮説を立てました。
スクリーニングには、Gタンパク質共役受容体 GPCR の活性化を一度に多数を検出するシステムを使いました。[このシステムについての大学によるプレスリリースはこちら、Nature Methodsの論文はこちら]

そして、レムデシビルが GPCR の中で、ウロテンシンII受容体 (UTS2R = GPR14) を選択的に活性化することを突き止めました。ウロテンシンII受容体は特に心血管系の細胞膜に多数発現し血管収縮などの作用があります。中枢神経系にも発現していますが機能は不明です。
レムデシビルは静脈内に投与されると速いスピードで代謝され、図2 (上部にあります) にある RNとRTPに変化します。良い情報として、RNとRTPは両方ともウロテンシンII受容体に作用しませんでした。
アビガンとラブゲリオもウロテンシンII受容体に作用しませんでした。

レムデシビルはウロテンシンII受容体 (UTS2R)と3つのアミノ酸 (T304、N297、M134)で相互作用していました。また、レムデシビルがウロテンシンII受容体に結合して活性化シグナルが入るためには、3か所とも相互作用する必要がありました。活性化シグナルの下流の細胞外シグナル調節キナーゼ(ERK)1/2のリン酸化が確認されました。
ウロテンシンII受容体 (UTS2R) とレムデシビルのドッキング モデル (下図)
ウロテンシンII受容体 の AlphaFold 構造は緑色のリボンです。レムデシビルと受容体の選択された側鎖は棒で示され、それぞれ灰色と緑色に色付けされています。黒い破線は水素結合を示します。

緑色のリボンヒト UTS2R の AlphaFold 構造は
AlphaFold Monomer v2.0にある人間のウロテンシンII受容体構造からpLDDTスコアの低い蓋状N末端領域(1〜42)をトリミングしたものに、Reduce 58 プログラムを使用して水素原子を追加したもののオルソステリックポケットに、レムデシビルをAutoDockFRを使ってドッキングしました。
上図にある3つのアミノ酸 (T304、N297、M134) を変異させるとレムデシビルによる活性化が完全に消失しました。N297がレムデシビルのマクギガン部分と相互作用し、M134 および T304 はヌクレオシド部分と相互作用します。一方、これら 3 つの残基とは対照的に、D130 はレムデシビルと UTS2R の結合に対して阻害効果がありました。
以上の事実は、レムデシビルが単純なアデノシンの代わりではなく、ウロテンシンII受容体 ( UTS2R) のユニークなリガンドであることを示しています。

つぎに、ヒト人工多能性幹細胞由来心筋細胞(hiPSC-CM) を使用した電場電位(FP)に対するレムデシビルの効果を調べました。FP持続時間(FPD)は、心電図(ECG)上のQT間隔と密接に相関します(図 3b)

レムデシビルがウロテンシンII受容体 (UTS2R)に結合すると、心電図のQT延長と相関性の高いFP持続時間の延長が起きました。
QT間隔の延長は、重篤で潜在的に致死的な不整脈の発生と関連しており、薬物誘発性心血管毒性の主な原因です。
次に、穴あきパッチクランプによるhiPS-CMの自発的活動電位測定からQT延長を評価する実験を行いました。この時、UTS2Rアンタゴニストのウランチドを追加投与したところQT延長は有意に抑制されました(図 3e)。

次に、新生児ラット心筋細胞 (NRCM) にレムデシビルを作用させると心筋収縮力が低下しました。レムデシビルと、UTS2Rアンタゴニストのウランチドを同時に作用さえるとレムデシビルの心筋収縮力抑制効果がもとの状態近くまで回復しました。(下図)

これまでの結果から、レムデシビルがウロテンシンII受容体 (UTS2R)に結合すると心筋収縮力が抑制されました。UTS2R活性化シグナルはヘテロ三量体Gタンパク質であるGα ファミリーにつながっているはずです。このファミリーのGα i/oは、イオンチャネルの調節を介して心筋の収縮性と心拍数に関与していることがわかっています。
Gα i/oの阻害剤である百日咳毒素 (PTX)は、レムデシビルの心筋収縮力抑制作用を抑制したが、Gα q/11阻害剤である YM-254890は影響しなかった

Gα i/o阻害は、レムデシビルによって誘導されるERK1/2およびAKTのリン酸化を減少させた(図 4c,d)。


以上から、レムデシビルは心筋細胞のウロテンシンII受容体に結合して不整脈を誘導し、Gα i/o依存性のAKT/ERKシグナル伝達経路を介して心筋細胞の収縮性を低下させることが示唆されました

なお、他の研究者の主張を否定する実験で、ヒトにおけるレムデシビル投与後の最大血漿濃度に等しい10μMのレムデシビルは、ミトコンドリア呼吸複合体タンパク質の定常状態レベルに影響を与えませんでした
レムデシビルの副作用が強く出る可能性のある変異の抽出
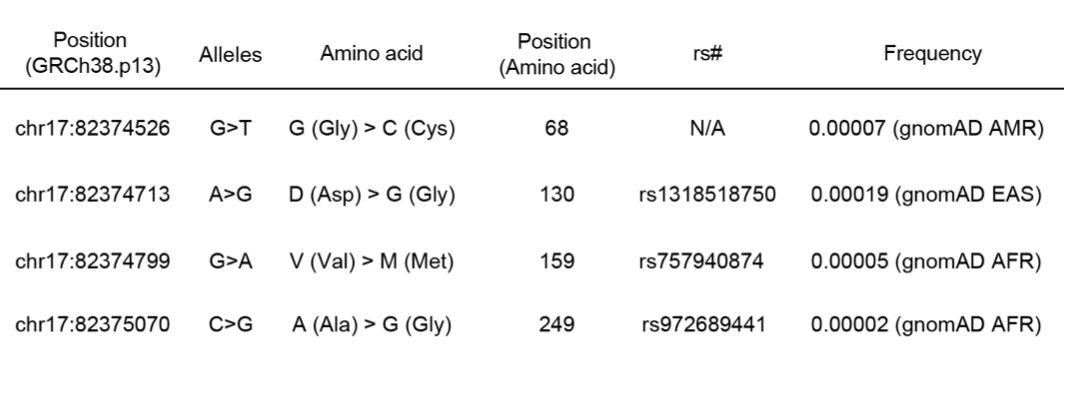
東北大学東北メディ カル・メガバンク機構が構築した 14,000 人の日本人のデータベース(日本人全 ゲノムリファレンスパネル 14KJPN)を調べたところ、ウロテンシン受容体に は 2,000 を超えるバリアントが存在し、その中で 1 アミノ酸置換を伴うミスセ ンス変異が 110 種類存在していました。110 種類の、バリアントを1つずつ導入した受容体を作成しました。それらとレムデシビルに対する活性を調べました。その結果、レムデシビルに対 する活性が増加する 4つのミスセンスSNV(G68 1.49 C、D130 3.32 G、V159 34.54 M、およびA249 ICL3 G)が見つかりました(図 7)。この4つの変異を持っている人の頻度は低いです[5万人に1人〜5000人に1人] (下表)、レムデシビルの心臓副作用が強く出る可能性があるかもしれません。ただしこの研究から、はっきりと断言することはできません。



COVID-19に対する薬物治療の考え方 第15版
この論文のブログ記事
原著へのリンク
WHOが実施した「Solidarity」試験(30カ国、11,200人以上のデータを含む)の中間データ
WHOガイドライン開発グループの専門家は、「レムデシビルは、死亡率や、人工呼吸の必要性、臨床的改善までの時間など、患者にとって重要なアウトカムに意味のある影響を及ぼさない」と声明で述べた。News
おまけ 経口新型コロナ治療薬 2023年処方シェア
重症化リスク因子を有する患者への処方が可能なのがラゲブリオ、パキロビッドです。
ゾコーバは12歳以上かつ重症化リスク因子を有していない患者への処方も可能なことから若年層への処方が進んでいます。



