移植患者のCMV感染症予防(ローテーター用資料)
はじめに
移植後患者さんを担当してもらうことが当科ではチョコチョコあります.
上の先生から,「サイト注意しといて」などと言い放たれ困る人もいるんじゃないかと思います(ただしそれは指導医が悪いです)
「血液内科なんて血液培養とβDグルカンとってりゃいいんじゃないの?」
「最初から治療薬いれておけばいいんでない」
「アンチゲネミアの見方がわからない,いつ治療すんの」
「血液内科なんてただでさえ横文字多くてわからんのに移植なんて・・・」
そんな声が聞こえてくるようで申し訳ないです.
血液内科に興味がある人もない人も一応当科の方針が共有できるように作ってこちらもみました.なんでそうなるか,や踏み込んだ内容は興味がある人は一緒に追加で勉強しますので,いつでも声かけてください.アンチョコと教科書の中間ぐらい,ちょっとアンチョコ寄りの内容にしていこうと思います.
なお「血液内科志望で移植に関する本も買いました!」という人や「感染症に興味があってCMVに関して勉強ちょっとしました」という人,ましてや「血液内科医,感染症科医です」という人は門前払いです.あくまで「血液内科に興味はないし,教科書とか買うほどの熱意はないけど,担当した以上はちゃんと研修医として診療するよ?」という人向けです.あくまで教科書に1ページぐらいで載っていることをまとめてます!!実際ここに買いてあることはほぼ神田先生の本に載ってます.↓コレコレ

再活性化?感染症?感染?
まず定義からいきましょう.カンファレンスでいつも混同するところです.
CMV感染(いわゆる再活性化):アンチゲネミア,PCR,あるいは組織培養からCMVを検出する状態
CMV感染症:CMV感染によって臓器障害をきたしている状況
になります.CMVによって臓器障害をきたしてしまうと,非常に予後が悪いです.なのでCMVが検出された時点(再活性化)で治療を始めてしまおう!というのがPre-emptive therapy(先制攻撃治療)となります.さらに言えばリスクのある人には予防を行い,発症しないようにしよう!というのが基本コンセプトになります.
予防(レテルモビル(プレバイミス®︎))
こいつが出て大きく変わりました.
ウイルス複製のカプシドに遺伝子を梱包する過程を阻害する薬剤です.
第三相のRCTでCMV感染(治療を要する)を60.6%⇨37.5%まで減少させました.しかも副作用である腎機能障害や骨髄抑制は有意差を認めないという驚異的な結果でした.新規薬剤を評価する上でとても大事なのが(みなさんも学会発表の際は注意してください)「有効性」と「安全性」です!この二つの点で十分に満たしておりました.
ただ副次的エンドポイントの死亡率は48週後では消失しておりました.ただその後のpost-hoc解析では全死亡抑制効果がMDアンダーソンにより示されました.それはCMV感染症の予防や発症遅延によるものと考えられ,他にも難治性CMV感染症の減少なども示されております.
実はプレバイミス,万能と思いきや中止後にCMVの再活性化が増える,ことがわかっています.ただ,だから意味ないよ,というわけでなくCMVの再活性化の発症遅延が死亡率を下げることがわかっています.
そんなプレバイミス,一つ問題があります.「誰につかえばいいか」これがまだ示されておりません.薬剤の評価で「有効性」「安全性」が大事といいましたが,もう一つ大事なのが「コスト,投与継続が現実的に可能か」があります.プレバイミス1錠の値段が14645円になります.1日2錠使ったら29000円ですよ!!100日使ったら290万円です.適正に使用していきたいですね.
繰り返しになりますが,まだプレバイミスを誰に使用したらいいか,わかっておりませんし,指針もありません.これはあくまで当科の方針ですが
患者(レシピエント),ドナーのいずれかがCMV既感染の場合,day7からプレバイミスを開始
併用の免疫抑制剤がシクロスポリン(サンディミュン®︎)の場合は240mg1T,タクロリムス(プログラフ®️)の場合は240mg2Tを使用する.
ボリコナゾール併用の場合にはボリコナゾールの治療効果を減弱させる恐れがある
ドナーもレシピエントもCMV未感染の場合はレテルモビルも使用せず,またCMV陰性輸血製剤を使用する
上記となっております.これは施設ごとに差があるので,あくまで当院での指標になります(他の病院に行った時にA病院ではこうしていたのに!とかいわないでね).またまだ使用はできませんがMaribavirやBrincidofovirなどの薬剤も予防薬としてありますが,今回は割愛します.
リスク因子
古典的にドナーとレシピエントのCMV抗体の組み合わせが,移植後のCMV感染症のリスクに関連すると言われています.
ドナーをD,レシピエントをRとして
D-/R+>D+/R+>>(越えられない壁)>>D+/R->>D-/R-
雑感としてこんな感じで考えてください.
以下は後輩にドヤ顔するところです.無視していいです.
CMV感染症の発症はレシピエントの抗体があるかどうかで大きく変わり,また治療においてはドナーのCMV抗体陽性かどうかが大きく影響します.
というのも移植後のCMVに関する免疫はドナー由来のCMV特異的メモリーT細胞が大きな役割を果たすので,とくに生着まで時間がかかるMAC(骨髄破壊的前処置)ではドナーのCMV抗体の有無で非再発死亡に差が出るとも言われております.
先制攻撃治療 Pre-emptive therapy
みなさんをまず混乱させるやつです.
「CMVアンチゲネミアが●●だから(バラ)ガンシ始めといて〜」ってやつです(ただこんな適当な指示を出されたら教えてください.そいつ踏んづけます).これについてまとめていきたいと思います.最初に述べたとおり,まだ臓器障害はきたしていないけど,ウイルスが検出されているから,臓器障害(CMV感染症)をきたす前に治療しちまおうぜ!ってやつですね.
ガンシクロビル(GCV)はCMV感染(症)の治療薬ですが,一部でおこなっている移植患者へのLVFXや抗真菌薬のような予防投与としては使用されません.それはGCVの毒性によります.「有効性」と「安全性」でしたね.実は予防投与としてGCVを投与したところ,骨髄抑制と感染症により非再発死亡が有意に増えた,とわかっているからです.だから必要なときだけ使用する,というのが(V)GCVになります.作用機序としてはウイルスのDNAポリメラーゼを阻害し,複製をさせない!というものになります.先生によってはその作用機序,副作用から「GCVはほぼ抗がん剤と同じと思って使え!」という先生もいるほどですね.
じゃあ実際にどう治療するかみていきましょう.
GCVもしくはVGCVには「維持用量(Level 1)」と「初期用量(Level 2)」が存在します.「なんで初期なのでLevel 2なんだよ」と思うかもしれませんが,実は維持用量から開始することが日本人では推奨されているからです.添付文書やアメリカのガイドラインでは初期用量から開始することが書かれていますが,これをしてしまうと骨髄抑制,感染症,そしてなにより二次性生着不全を増やすことが知られているからです.
というわけで実際のフローチャートはこちらになります.

モニタリングは通常上記の通りday100で終了になりますが,day100以降も一部で継続します.GVHD発症例,ステロイド使用例,ATG/アレムツズマブの使用例,(CBT例)ではモニタリングを継続します.そして上記でも述べた通り,レテルモビル(プレバイミス®︎)使用例は中止後にCMVの再活性化が見られるため3ヶ月はモニタリングを継続します.

ハイリスク:臍帯血移植,HLAハプロ移植,HLA不適合移植,移植前にATGや抗CD52抗体使用,ステロイド使用(0.5mg/kg以上)
ローリスク:それ以外
ただここはかなり施設間で差があると思われます.

ただ一般的にGCVには骨髄抑制,FCNには電解質異常と腎機能障害が問題になります.投与する際は必ず上級医と日々投与量を確認しましょう.
もう一つ,CMVモニタリングのC7-HRPとC10/11(いわゆるアンチゲネミア)は単純比較ができないということと,白血球がないと検査できないことに注意しましょう.
正直研修医でここまでできれば十二分にデキレジです.
指導医と相談しながら検査治療をしていきましょう.
ここから先はアドバンスな内容になります.というのもあまり決まりきった内容がなく,治療方針に悩むことが指導医でも多いからです.だから読まなくていいです.
CMV感染症
まず診断はかなり難しいです.というのもアンチゲネミアが陽性+臓器障害,だけで診断できるものでもないからです.各診療科と相談しながら診断をしていく,ということになります.特にGVHDやTMAが代表的な鑑別であり,組織学的な証明ができないことも多いからです.
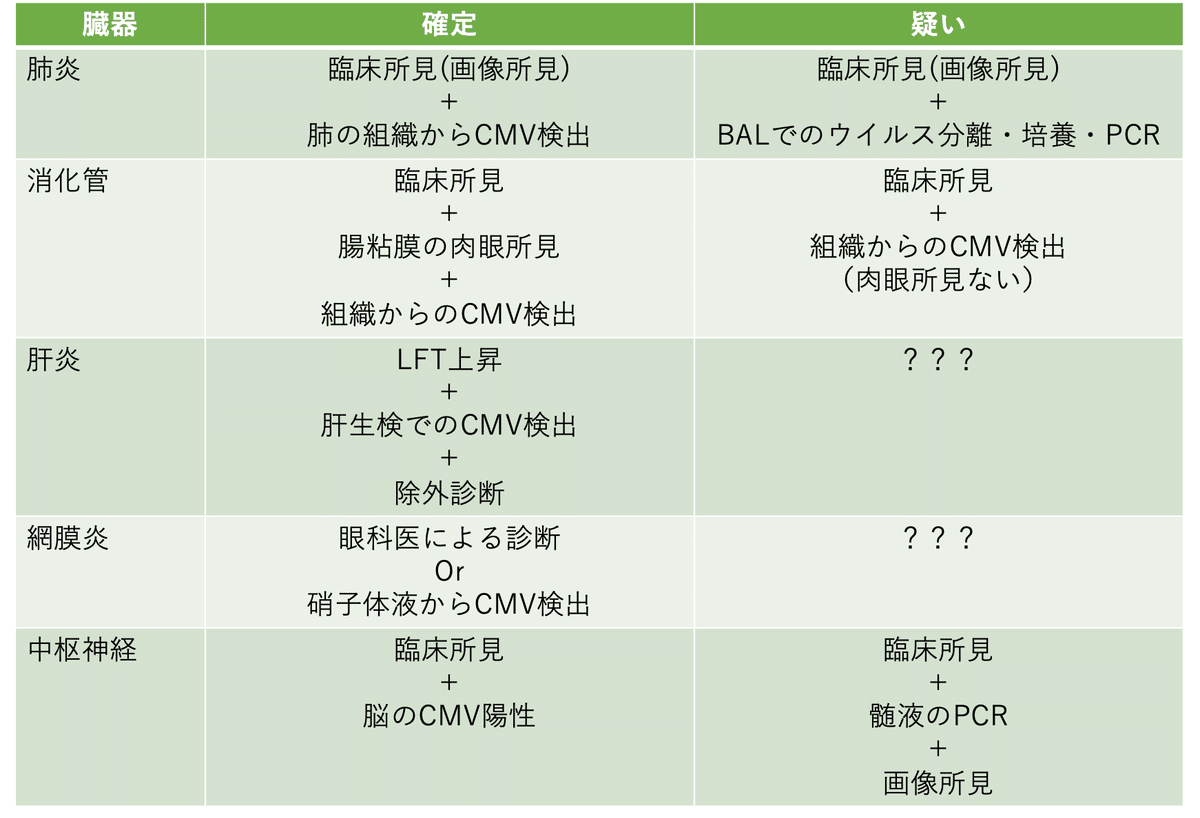
一覧にしてみました.移植後でただでさえ侵襲的な検査さえ躊躇ったりするのに,こんな検査ができるのか・・・ってかんじですよね.これが診断が難しい理由の一つでもあります.またこれは代表例であって正直CMV感染症はGVHDと同じくどこでも起きます.
CMV肺炎
昔はこれが最大頻度のCMV感染症でしたが,先制攻撃治療によりへりました.しかし生存率は最悪で30%程度です.典型例では徐々に両側のGGOが出現,呼吸器症状がはじまり1週間程度で人工呼吸器が必要になったりします.CMV感染症のなかで唯一,抗ウイルス薬+IVIGのエビデンス(の可能性)があるものです.(ほかのCMV感染症ではIVIGはエビデンスありません)
CMV腸炎
現在,もっとも多いのがCMV腸炎です.TMA,GVHDとの鑑別がいつも困難な上に,CMVアンチゲネミアの感度は悪く,PCR検査ですら感度50%と言われております.肉眼所見+組織でのCMVの証明が必要になります.
CMV肝炎
確定には肝生検が必要です.やはりGVHDとの鑑別が問題になります.かつては肝臓単独のGVHDはほぼない,といわれていましたが,末梢血幹細胞移植が中心になりつつある現代においては,liver solitaryなGVHDも経験されるようになりました.
CMV網膜炎
HSCTでは実はあまり少ないと言われております.さらにCMVアンチゲネミアの感度も悪いので足元を掬われることがあります.むしろ移植後晩期に多いとされており,典型的には「GVHDでステロイドを含む治療をしていたらアンチゲネミア陽性で,実は網膜症も合併していた」という経過が多いです.なので当科では免疫抑制を加えてる移植後患者において「治療必要なCMV感染もしくは感染症が起きた場合」「眼症状が出現したとき」は積極的に眼科医師に診察を依頼しております.
CMV中枢感染症
だいぶ稀な感染症となります.MRIと髄液検査で診断をします.多くはHHV-6脳炎と鑑別が必要になります.
ほかにもCMV感染症はGVHDと同じく白血病の再発率を下げる可能性も言われておりますが,そもそもCMV感染症そのものがかなりfatalなものであることが多いので,起こさない,起きる前に叩く,が治療になります.
CMV感染症の治療
先制攻撃治療とは異なり,Level2から治療を開始し(2〜4weeks)その後Level1での治療をさらに維持的に行います(several weeks).ただここはかなり匙加減が大きいところと,実際にLevel 2を投与したくても患者さんが耐えられないかもしれないことが多く,複数の診療科で相談することもままあります.また治療が2週間施行して改善が見られない場合はCMVの耐性変異検査を行いますが,施設限界で提出できない場合はFCNに切り替えたり,併用したりします.感染症科や場合によっては専門家への相談が必要になります.
お付き合いいただきありがとうございました.

こちらは横浜関内のらーめん二郎で修行をした方の二郎インスパイア店です.なんと汁なしが食べられます.よければ一緒に食べにいきましょう.
血液内科はややこしいし,(物理的な)戦闘力が高そうでなんとなく関わりにくいというイメージを持ってることとおもいます.でも,僕のような中途入局者を暖かく受け入れてくれるほどの度量もありますし,なんだかんだ人に教えたり人から学んだりすることが好きな人が多いです.うちの医局,とてもいいところです.もし興味があればお声掛けください.
