
ゲノム編集の応用と未来への課題
これまで、コツコツと宮岡佑一郎先生の「トコトンやさしいゲノム編集の本」を自分なりにまとめてきました。この分野の進歩はとても早くて、それに伴い、倫理的・社会的な問題も次々に出てきていることも感じています。
今回は、同じ本の最後の方のまとめをしていきたいと思います。
年寄りの初学者ではありますが、これを機会に、いろんな他の分野の書籍も読んでみたり、世界の知見にも触れていければ、と思う今日この頃です。
1:研究目的の遺伝子改変生物を作る(植物から動物まで)
ゲノム編集技術は、これまでマウスなどに限られてきた遺伝子改変を、あらゆる生物種で可能にしています。食糧問題や地球環境問題などを鑑みても、植物の遺伝子改変が可能になったことは大きな進歩でしょう。(個人的には色々なリスクを考えてしまいますが)
2014年には、中国で世界初のゲノム編集した2匹のマカクザルが誕生しています。体外受精したサルの受精卵に、Cas9のmRNAとガイドRNAを注入してゲノムを編集し、代理母のサルに移植して誕生させました。これらのサルは、それぞれ脂質代謝に関わる遺伝子と免疫に関わる遺伝子を、NHEJによって破壊した個体でした。モデル生物として、ヒトと進化的に近縁なサルは有益なのです。
2:畜産のあり方を変える?ゲノム編集畜産動物
現在の畜産動物の品種の多くは、人間が1万年にもわたり、望む性質を持つ品種を追求し、選択してきた歴史の賜物です。
例えば、乳牛と肉牛は、より美味しく、より多くの牛乳と牛肉を生産する牛をそれぞれ選び、交配することで確立してきました。
基本的に、牛には角が生えますが、現代の畜産では牛同士が傷つけあわないよう、また飼育作業員が怪我をしないように、角を切り落とす除角という作業が広く行われています。ただ、この除角は牛に多大な苦痛を与え、実施する人間にも大きな負担になります。
しかし、特に肉牛の中には、もともと角が生えない品種があります。
その原因遺伝子を探索した結果、POLLED(角がないという意味)と名付けられた遺伝子のDNA配列の違いが、角の有無を決めることが判明しました。
そこで、アメリカの大学と企業からなるグループが、本来であれば角が生える乳牛ゲノム中のPOLLED遺伝子の配列を、角の生えない肉牛のPOLLED遺伝子の配列に、ゲノム編集による相同組み換えで改変し、その結果、見事に角の生えない乳牛が誕生しました。
3:栄養も収穫量も増える?ゲノム編集作物
イマザモックスと呼ばれる除草剤は、アミノ酸の合成に不可欠なアセト乳酸合成酵素(ALS)というたんぱく質の機能を阻害することで、除草効果を発揮します。
ところが、このALS遺伝子の287番目のCがTに置き換わる変異によって、変異ALSはこのイマザモックスに対して耐性になります。
そこで、神戸大学と筑波大学を中心とするグループが、デアミナーゼ融合dCas9を用いて、イネのALS遺伝子にこの変異を導入することに成功しました。この変異を持つイネを、イマザモックスを除草剤として使いながら栽培すれば、効率的に収穫が出来るはずです。
他にも、中国のグループが、トマトのゲノムの中から、リコピンの代謝に関わる遺伝子をCRISPR/Cas9によって改変し、通常の5倍以上のリコピンを含むトマトの作製に成功しています。
畜産動物も、植物由来の飼料で育成されますので、農業が食糧の供給を支える基盤であると言えます。
4:遺伝子組み換え作物・畜産動物(遺伝子を外部から導入する)
例えば、トマトでの遺伝子組み換えの場合、病気になりやすいトマトのゲノムDNAに、病気になりにくくする遺伝子を、トランスジェニック技術で導入します。
病気に耐性をもたらす細菌の遺伝子をトマトに導入することが出来ます。
この場合は、異種間遺伝子組み換え作物になります。
生み出される細菌の遺伝子を持つトマトは、自然に生じることはありません。
細菌ではなく、同じトマトで病気になりにくい品種から、病気に耐性を与える遺伝子を、病気になりやすいトマトに導入することも可能です。この場合は同種間遺伝子組み換えですが、それでもその遺伝子はトマトゲノムDNA中に自然に存在する形ではなく、人工的な形で導入されます。
結果として、遺伝子組み換え作物や畜産動物は、自然界には存在しないゲノムDNA配列を持つことになります。
5:ゲノム編集作物・畜産動物
CRISPR/Cas9などを用いて、美味しくて病気になりやすいトマトのゲノムDNA配列中の、病気に関わる遺伝子配列を、病気になりにくい遺伝子配列に編集します。
編集後の作物からは、CRISPR/Cas9などのゲノム編集ツールは取り除かれ、編集された病気に耐性の遺伝子配列だけが残ります。
出来上がった作物そのものだけを見れば、伝統的な品種改良で作製される作物と全く同じであることは着目すべき点です。
ゲノム編集は、通常の品種改良作業を超高速化しているだけと考えることも出来ます。
今後、社会や消費者がゲノム編集作物をどう受け止めていくか、その議論のための情報開示・表示などをどのように行なっていくか、隠蔽されることはないのか、など高いハードルは残っています。
6:蚊を駆逐して伝染病を根絶するという考え方(遺伝子ドライブ)
自分自身を増やす能力を持つDNA配列を遺伝子ドライブと呼び、Cas9とガイドRNAの遺伝子配列で作ることが出来ます。
この遺伝子ドライブは、標的生物のゲノムDNAに挿入されますが、挿入されたガイドRNAは自身が挿入されたゲノムDNA配列を標的としています。
仮に遺伝子ドライブが蚊の一対の染色体の片方に存在するとします。
本来、この蚊の子が遺伝子ドライブを持つ確率は50%のはずです。
しかし、遺伝子ドライブから発現するCas9が、ガイドRNAに誘導され、もう一方の染色体を切断します。
すると、2本の染色体間でHR(相同組み換え)が起こり、切断された染色体に遺伝子ドライブのDNA配列がコピーされます。
結果、この蚊の子は全て遺伝子ドライブを持つようになります。
以降も同じことが繰り返され、遺伝子ドライブを持つ蚊の割合が、世代を重ねるごとに増えていくことになります。
この遺伝子ドライブに、Cas9とガイドRNAに加えて、ある物質に感受性になり、蚊が死ぬ遺伝子を組み込むとします。この遺伝子ドライブを持つ蚊を作製し、野に放ちます。通常の遺伝子であれば、蚊の集団中で広がることはありませんが、上述の特性から、遺伝子ドライブを持つ蚊の割合は、時間とともに高まります。
したがって、一定時間後に感受性をもたらす物質を散布すれば、遺伝子ドライブを持つ蚊を駆除出来るのです。
遺伝子ドライブの技術は、マラリアなどの伝染病を媒介する蚊や鼠などの駆除に有用な可能性があります。

7:世界初のHIV感染完治から治療への道(CCR5遺伝子の変異でHIV耐性に)
ヒト免疫不全ウイルス(HIV)は、免疫に必要不可欠なT細胞などに感染し、細胞死を起こすと言われています。
そのため、通常では感染しない病原体にも簡単に感染してしまう状態、つまりエイズ(後天性免疫不全症候群)を起こします。
Timothy Ray Brown というアメリカ人男性は、世界で初めてHIV感染を完治したと考えられています。
Brown氏はHIV感染とは別に、発症した白血病治療のために、骨髄移植を受けました。骨髄移植では、移植前に全身への放射線照射で、全ての血球細胞を死滅させます。そこに移植した骨髄から正常な血球細胞が産生され、患者の身体で機能するのです。実は、Brown氏に移植された骨髄細胞には、CCR5という遺伝子に変異があることがわかっていました。
CCR5たんぱく質は、細胞表面で、ある特定の分子のセンサーとして機能します。
しかし、Brown氏に移植された細胞の変異CCRは、細胞の中から表面に正常にたどり着くことが出来ません。
HIVは、細胞表面に存在するたんぱく質に結合し、それを足がかりにしてT細胞の中に侵入し感染します。
CCR5は、その足がかりとなるたんぱく質の一つなのです。
T細胞は、本来HIVなどのウイルスを駆逐するわけですが、HIVはT細胞に感染し、その機能を阻害します。
しかし、Brown氏に移植された骨髄細胞由来のT細胞は、CCR5が細胞表面に存在しないため、HIVは感染出来ません。
幸いなことに、CCR5に変異があっても、T細胞の免疫機能は正常であるために、変異CCR5を持つT細胞が、HIV感染を免れ、逆にHIVを駆逐してくれたわけです。

8:ゲノム編集T細胞によるHIV治療(CCR5を破壊した細胞を移植する)
Brown氏の例から、T細胞を中心に免疫を担う細胞のCCR5遺伝子を破壊すれば、HIV感染を治療出来るという期待が膨らみました。
ZFNを開発し、TALENやCRISPR/Cas9の登場以前から、ゲノム編集の医療応用の研究開発を進めるアメリカのSangamo Therapeutics社は、このCCR5破壊によるHIV治療の治験を進めています。
HIVに感染した患者から、単離したT細胞あるいはT細胞の元となる未分化な血液細胞にZFNを用いてNHEJを誘導し、CCR5遺伝子を破壊します。
Brown氏に移植されたCCR5の変異は、遺伝子の途中に32塩基の欠失があり、異常な部位に翻訳終結コドンが生じるために、正常なCCR5たんぱく質が発現しません。
この変異は、ヨーロッパでは比較的多くの人で認められ、両親由来のCCR5のうち、片方だけがこの変異を持つ人は全体の10%、両方のCCR5が共に変異を持つ人は全体の1%程度存在し、両方とも変異を持つ場合は、HIV感染を免れることが出来ると考えられています。
ZFNによるNHEJを介した変異誘導は、この32塩基欠失変異に出来るだけ近い形で起きるように設計されています。
CCR5を破壊したT細胞あるいは未分化な血液細胞を患者に戻し、これらの細胞の免疫によるHIV排除を期待するのです。
Brown氏は、変異CCRを持つ他人の骨髄細胞を移植したため、免疫拒絶反応に悩まされましたが、ゲノム編集を用いた治療では、患者自身の細胞を用いるために、免疫拒絶反応は起こらないと期待されています。
このZFNによるCCR5破壊のHIV治験は、かなり有望な結果を示しています。
同様のゲノム編集をCRISPR/Cas9で行おうという動きもあります。
9:がん免疫療法(PD-1のこと)
がん細胞には、その遺伝子異常の結果として、がん細胞だけに特有のたんぱく質を発現している場合があります。
私たちの免疫システムは、このがん細胞特有のたんぱく質を目印として、攻撃する仕組みをもともと持っており、T細胞がその中心的な役割を担います。
このT細胞のがん免疫には、免疫反応を強めるアクセルと、弱めるブレーキとなる仕組みが備わっています。
このうち、ブレーキとして機能する分子の一つがPD-1です。
PD-1は、本来、自分自身の細胞を間違って攻撃しないように、T細胞表面に発現するたんぱく質です。
しかし、がん細胞はPD-1のブレーキ機能を巧みに利用して、T細胞ががん細胞を攻撃しないように操っているのです。
したがって、PD-1によるがん免疫のブレーキを弱め、がん細胞への免疫排除を解除してあげれば、がんが治療出来る可能性が出てきます。
本庶博士の開発したオプジーボという薬は、このPD-1に結合する抗体であり、PD-1のがん免疫におけるブレーキ機能を阻害します。その結果、T細胞によるがん免疫の攻撃力を高め、メラノーマなどのがんの治療に高い効果を発揮すると言われています。

さらに、ゲノム編集によってPD-1遺伝子を破壊したT細胞を移植する、がん免疫療法が各国で進められています。アメリカの研究では、がん細胞特有のたんぱく質に結合して、T細胞の免疫能力を高めるがん免疫のアクセルとなる分子も、PD-1を破壊したT細胞に発現させています。
ただ、あまり免疫力を高めすぎると、自分の正常な細胞とがん細胞の区別がつかなくなり、自身を攻撃する自己免疫疾患に陥ってしまいます。
そのため、ブレーキとアクセルの適度なバランスが重要になります。
このPD-1破壊によるがん治療も、CRISPR/Cas9によるNHEJを介して、PD-1を破壊した後、患者に戻すという治験になります。
10:生体内ゲノム編集による疾患の治療(筋ジストロフィーや代謝異常症)
筋ジストロフィーは、筋細胞の構造を支えるジストロフィンというたんぱく質の変異によって、全身の筋肉の機能が低下する病気です。
ジストロフィンは、ヒトの遺伝子の中でも最も巨大なものの一つで、多くの繰り返し構造を持ちます。そのため、ジストロフィンは、その一部を切り落としても、比較的正常に機能出来ます。ちょうど、長いバネのある一部分を切り落としたとしても、残った部分は少し短いバネになる、というイメージです。
そこで筋ジストロフィーの患者の筋肉に、ジストロフィン遺伝子の変異を持つ部分を標的とするガイドRNAとCas9を導入し、異常な部分だけを切り落とす試みが進んでいます。既に、筋ジストロフィーモデルマウスヤ犬では、Cas9を用いた筋力の回復が認められており、筋ジストロフィーの新たな治療法としての期待が高まっています。

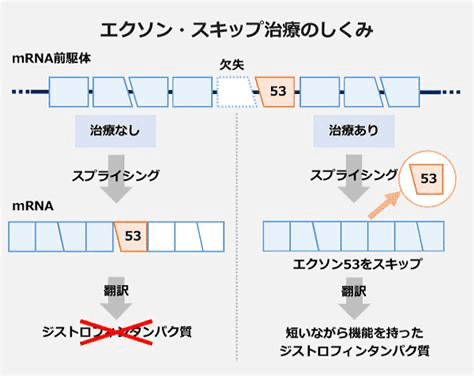
また、細胞の中で代謝反応を担う酵素の変異により、有害な代謝産物が蓄積する代謝異常症の治療にも、生体内ゲノム編集の応用が期待されています。
例えば、糖脂質を分解するαーガラクトシダーゼの遺伝子異常によって起こるファブリー病では、肝臓の細胞のゲノムにαーガラクトシダーゼの遺伝子を挿入し、失われた酵素活性を補う試みが進んでいます。
そのためには、他の遺伝子機能を損なわずに、安全に導入した遺伝子が発現するためのゲノム編集条件を確立する必要があり、研究が進んでいます。既に、マウスなどのモデル動物では、ゲノム編集を用いた遺伝子導入による酵素活性の補充効果が認められており、ヒトの治験に向けた研究が進んでいます。
他にも、血友病やムコ多糖症などで、酵素活性を補う同様のアプローチによる治療法開発が進められています。
11:iPS細胞とゲノム編集
ヒトiPS細胞は、あらゆる細胞腫に分化出来るため、ゲノム編集との組み合わせで様々な疾患研究が展開されています。
まず、健康なヒト由来のiPS細胞に、疾患の原因となる変異をゲノム編集で導入し、疾患の細胞モデルを作製出来ます。心疾患、神経疾患、肝疾患などを中心に、研究が進んでいます。
また、患者由来iPS細胞の変異を正常な配列に修正することなどで、ゲノムを編集したiPS細胞の移植治療も期待出来ます。
現在日本では、健康なヒト由来iPS細胞から分化させた細胞を移植する治験が各研究機関で進められています。また、生体内の直接ゲノム編集治療に向けた研究にもiPS細胞が貢献しています。


12:ヒト受精卵のゲノム編集
私たちの身体は、約37兆個もの細胞から出来ています。
細胞には様々な種類がありますが、大きく体細胞と生殖細胞の二つに分類されます。
生殖細胞はその名の通り、生殖に関わる細胞で、卵や精子とそのもとになる細胞が該当します。これらの細胞は、受精して次世代の個体を形成することで、その遺伝情報を伝えていきます。
ゲノム編集によって生殖細胞に導入した遺伝子配列の改変は、世代を超えて人類の中に永遠に残る可能性があります。倫理的な問題が大きく、応用には非常に慎重な姿勢が求められます。
一方、もし受精卵の段階で遺伝的な異常を修正出来れば、その受精卵に由来する人間の細胞は、全て修正されたDNA配列を持つことになります。
したがって、受精卵のゲノム編集は、望む編集だけを誘導出来れば、究極のゲノム編集治療とも言えます。
現在、体外受精では、着床前スクリーニングや着床前診断が行われています。
体外受精した受精卵から少し発生の進んだ胚の細胞を使い、遺伝的な異常や特徴の有無を確認します。複数の胚から望むものを子宮に移し、妊娠・出産することが出来ます。しかし、受精卵のゲノム編集を正確に行えれば、胚の遺伝的異常を修正出来ます。
現在、基礎研究レベルでは、ヒト受精卵のゲノム編集は既に実施されており、治療法としての可能性が精力的に検討されているところです。
13:ゲノム編集された双子の誕生?(中国で何が起きたのか)
2018年11月末、賀建奎という中国の研究者が、突如、ゲノム編集した双子の女児を誕生させたと発表しました。賀博士は、その3日後に、国際学会で双子について講演しました。彼の主張によると、この双子の父親はHIVに感染しており、感染防止のためにCCR5を破壊。HIV陰性の母親の卵子と、洗浄してHIVを除去した父親の精子を体外受精させ、直後にCas9とガイドRNAを受精卵に注入し、NHEJによりCCR5遺伝子を破壊したとのこと。そのうち2個の受精卵から少し発生の進んだ胚を、両親の同意を得て、母親の子宮に戻し、出産に至りました。
両親由来の2個のCCR5遺伝子について、片方の女児は正常のままの配列と15塩基欠失変異を、もう片方の女児は4塩基欠失変異と1塩基挿入変異を、それぞれ持つそうです。
生み出されたこれら3種類の変異CCR5遺伝子配列は、いずれもヨーロッパで認められる、HIV感染に耐性なヒトの持つ32塩基欠失と異なります。
また双子の女児の後者の場合、4塩基欠失と1塩基挿入変異は、翻訳の読み枠をずらすため、理論上CCR5は破壊されると予想されます。
一方、双子の女児の前者の場合、15塩基欠失は、コドンの枠が変わらず(15は3の倍数。コドンは3つの塩基からなり1つのアミノ酸に翻訳。)、5個のアミノ酸を欠くCCR5たんぱく質が翻訳されることになります。この部分がなければCCR5の機能は失われると賀博士は主張していましたが、それを裏付ける科学的証拠はありません。また、2個のCCR5遺伝子のうち、片方は元の配列のままなので、CCR5の機能は完全には失われていないのです。

ゲノム編集によって生み出されたCCR5変異は、どれもヨーロッパの一部の人に見られる変異とは異なる。
この双子のゲノム編集の危険度は極めて高いと言えます。
CCR5を失うと、インフルエンザでの致死率が上昇することが報告されています。
また、CCR5を失ったマウスは学習・記憶能力が高まるという報告もあります。
作製された変異も自然に存在する32塩基欠失とは異なるため、今後どのような影響が出てくるか不明です。
さらにCCR5変異はアジア系人種にはほぼ認められません。人種間の遺伝的相違の影響も不明です。CCR5の機能の理解が不十分なまま、生殖細胞を含む全身の細胞で遺伝子を破壊したのです。
その一方、有益性はほぼゼロです。母親がHIV陰性のため、父親の精子洗浄と体外受精で、子供にHIVは感染しません。出生後の子供へのHIV感染予防法は、薬剤を含め他にも存在します。
今回のことは、一連の治験が秘密裏に行われたこともあり、倫理面での問題も深刻です。ゲノム編集技術で救われる人たちがいる一方で、この技術が今後も悪用されないかどうか、疑念は拭えません。
ゲノム編集技術は、CRISPR/Cas9の応用以降、爆発的な発展を遂げてきました。
それは医療、農業、畜産などの多くの分野に波及しています。
農業や畜産などでは、ゲノム編集の実用化は実現の一歩手前まで来ています。
ゲノム編集畜産動物や農作物が今後実際に流通する前には、研究者が社会に丁寧に説明し、容認されていく努力を怠ってはいけません。しかし、そのような技術が、私たちの日常生活を変える目前まで達しているという事実は、驚くべきことです。
日夜研究を重ねてきた、生命科学研究者の努力と英知の結晶とも言えるでしょう。
