異なる免疫シグネチャがSARS-CoV-2ワクチンの組み合わせを識別する
元→https://www.medrxiv.org/content/10.1101/2022.09.05.22279572v1

Distinct immune signatures discriminate SARS-CoV-2 vaccine combinations
異なる免疫シグネチャがSARS-CoV-2ワクチンの組み合わせを識別する
Abstract
Several vaccines have been found effective against COVID-19, usually administered in homologous regimens, with the same vaccine used for the prime and boost doses.
いくつかのワクチンが COVID-19 に対して有効であることが判明しており、通常は同種のレジメンで投与され、プライムおよびブースト用量に同じワクチンが使用されます。
However, recent studies have demonstrated improved protection via heterologous mix-and-match COVID-19 vaccine combinations, and a direct comparison among these regimens is needed to identify the best employment strategies.
ただし、最近の研究では、COVID-19 ワクチンの異種混合混合による防御の改善が実証されており、最適な雇用戦略を特定するには、これらのレジメンを直接比較する必要があります。
Here, we show a single-cohort comparison of changes to the humoral and cellular immune compartments following five different COVID-19 vaccines spanning three technologies (adenoviral, mRNA and inactivated vaccines).
ここでは、3 つの技術(アデノウイルス、mRNA、および不活化ワクチン)にわたる 5 つの異なる COVID-19 ワクチン後の体液性および細胞性免疫コンパートメントへの変化の単一コホート比較を示します。
These vaccines were administered in a combinatorial fashion, resulting in sixteen different homologous and heterologous regimens.
これらのワクチンは組み合わせて投与され、16 の異なる同種および異種レジメンが得られました。
SARS-CoV-2-targeting antibody titres were highest when the boost dose consisted of mRNA-1273, independent of the vaccine used for priming.
SARS-CoV-2 を標的とする抗体力価は、プライミングに使用したワクチンとは無関係に、ブースト用量が mRNA-1273 で構成されている場合に最高でした。
Priming with BBIBP-CorV induced less class-switching among spike-binding memory B cells and the highest antigen-specific T cell responses in heterologous combinations.
BBIBP-CorVでプライミングすると、スパイク結合メモリーB細胞間のクラススイッチングが少なくなり、異種の組み合わせで最高の抗原特異的T細胞応答が誘導されました。
These were generally more immunogenic in terms of specific antibodies and cellular responses compared to homologous regimens.
これらは一般に、同種のレジメンと比較して、特異的抗体および細胞応答の点でより免疫原性が高かった.
Finally, single-cell analysis of 754 samples revealed specific B and T cell signatures of the vaccination regimens, indicating distinctive differences in the immune responses.
最後に、754 個のサンプルの単一細胞分析により、ワクチン接種レジメンの特定の B 細胞および T 細胞の特徴が明らかになりました。 免疫応答の際立った違いを示しています。
These data provide new insights on the immunological effects of COVID-19 vaccine combinations and a framework for the design of improved vaccination strategies for other pathogens and cancer.
これらのデータは、COVID-19 ワクチンの組み合わせの免疫学的効果に関する新しい洞察と、他の病原体やがんに対する改善されたワクチン接種戦略を設計するためのフレームワークを提供します。
Main text
The management of the COVD-19 pandemic has relied heavily on the development and global deployment of vaccines that protect against SARS-CoV-2.
COVID-19 パンデミックの管理は、SARS-CoV-2 から保護するワクチンの開発と世界的な展開に大きく依存しています。
Numerous homologous prime-boost vaccination regimens were shown to stimulate robust cellular and humoral immune responses and have been approved for clinical use.
多数の同種のプライムブーストワクチン接種レジメンが、強力な細胞性および体液性免疫応答を刺激することが示され、臨床使用が承認されています。
The many different vaccines and vaccine technologies employed during this pandemic provide a unique opportunity to study their effects and dissect the immune mechanisms of protection associated with each regimen.
このパンデミックの間に採用された多くの異なるワクチンとワクチン技術は、それらの効果を研究し、各レジメンに関連する防御の免疫メカニズムを分析するユニークな機会を提供します。
Recent reports have shown that certain heterologous prime-boost regimens provide enhanced protection against SARS-CoV-2 (https://www.who.int/publications/i/item/WHO-2019-nCoV-vaccines-SAGE-recommendation-heterologous-schedules), in line with preclinical data comparing heterologous vs. homologous vaccination regimens against numerous other pathogens.
最近の報告では、特定の異種のプライムブーストレジメンが SARS-CoV-2 に対する保護を強化することが示されています。これは、他の多数の病原体に対する異種ワクチン接種レジメンと同種ワクチン接種レジメンを比較した前臨床データと一致しています。
Nevertheless, because the corresponding differences in antibody and cellular immune responses are not fully understood, there is still no consensus on the most appropriate regimens for existing COVID-19 vaccines.
それにもかかわらず、抗体と細胞免疫応答の対応する違いは完全には理解されていないため、既存の COVID-19 ワクチンの最も適切なレジメンについてはまだコンセンサスが得られていません。
Furthermore, little is known about the immunogenicity and reactogenicity of heterologous combinations of most COVID-19 vaccines available on the market.
さらに、市場で入手可能なほとんどの COVID-19 ワクチンの異種組み合わせの免疫原性と反応原性についてはほとんど知られていません。
The primary COVID-19 vaccination regimens approved for clinical use include viral-vector based approaches such as AZD1222 (two-dose homologous prime-boost, henceforth termed AZD), developed by the University of Oxford in collaboration with AstraZeneca; Sputnik V (prime-boost heterologous human adenoviral vectors, serotypes 26 (henceforth Sput 26) and 5 (Sput 5)) by the Gamaleya Research Institute; and Ad5-nCoV-S (a single-dose viral vector vaccine, henceforth Ad5) by CanSino Biologics.
臨床使用が承認された主要な COVID-19 ワクチン接種レジメンには、ウイルスベクターベースのアプローチが含まれます。①オックスフォード大学がアストラゼネカと共同で開発したAZD1222(2回投与相同プライムブースト、以降AZDと呼ぶ)、②Gamaleya Research Institute によるSputnik V(プライムブースト異種ヒトアデノウイルスベクター、血清型 26 (以下、Sput 26) および 5 (Sput 5))、③CanSino BiologicsによるAd5-nCoV-S(単回投与ウイルスベクターワクチン、以降Ad5)。
Also included are inactivated vaccines such as BBIBP-CorV (henceforth BBIBP), developed by Sinopharm, and mRNA-based vaccines such as mRNA-1273 by Moderna, as well as protein subunit vaccines such as NVX-CoV2373, a recombinant spike protein nanoparticle vaccine by Novavax.
また、Sinopharm が開発した BBIBP-CorV(以降 BBIBP)などの不活化ワクチンやモデルナのmRNA-1273などのmRNAベースのワクチン、Novavaxによる組換えスパイクタンパク質ナノ粒子ワクチンであるNVX-CoV2373などのタンパク質サブユニットワクチンも含まれます。
These vaccines are being widely administered on a global scale (https://covid19.trackvaccines.org/agency/who/).
これらのワクチンは世界規模で広く投与されています。
In 2021, the Argentine Ministry of Public Health began a multicentre study to systematically compare the immune responses to homologous and heterologous COVID-19 vaccination regimens in Argentina.
2021 年、アルゼンチン公衆衛生省は、アルゼンチンにおける同種および異種の COVID-19 ワクチン接種レジメンに対する免疫応答を体系的に比較する多施設研究を開始しました。
In the present study, we specifically analysed samples from one cohort from ECEHeVac (NCT04988048) located at a clinical centre in the city of Córdoba (REPIS-Cba #4371 ).
本研究では、コルドバ市の臨床センター (REPIS-Cba #4371 ) にある ECEHeVac (NCT04988048) からの 1 つのコホートからのサンプルを具体的に分析しました。
The individuals recruited for the trial were first vaccinated with one dose of AZD, BBIBP, Sput 26, or mRNA-1273, followed by a randomized second dose of AZD, BBIBP, Sput 26, Sput 5, mRNA-1273 or Ad5, resulting in a total of 16 different homologous or heterologous prime-boost regimens.
試験に採用された個人は、最初にAZD、 BBIBP、Sput 26、またはmRNA-1273の1回のワクチン接種を受けました。その後、AZD、BBIBP、スプット 26、スプット 5、mRNA-1273、または Ad5 の無作為化された 2 回目の投与が行われ、合計 16 の異なる同種または異種のプライムブーストレジメンが得られます。
We conducted a head-to-head comparison of immune responses to COVID-19 vaccine regimens and interrogated antibody and cellular responses, which are known to act in tandem to provide protection against SARS-CoV-2, for all 16 prime-boost regimens and correlated them with their immunogenicity.
COVID-19 ワクチン レジメンに対する免疫応答と、調べた抗体および細胞応答を直接比較しました。これらは、16 のすべてのプライムブーストレジメンについて、SARS-CoV-2 に対する保護を提供するために連携して作用することが知られており、それらを免疫原性と相関させました。
Study design and vaccine combinations
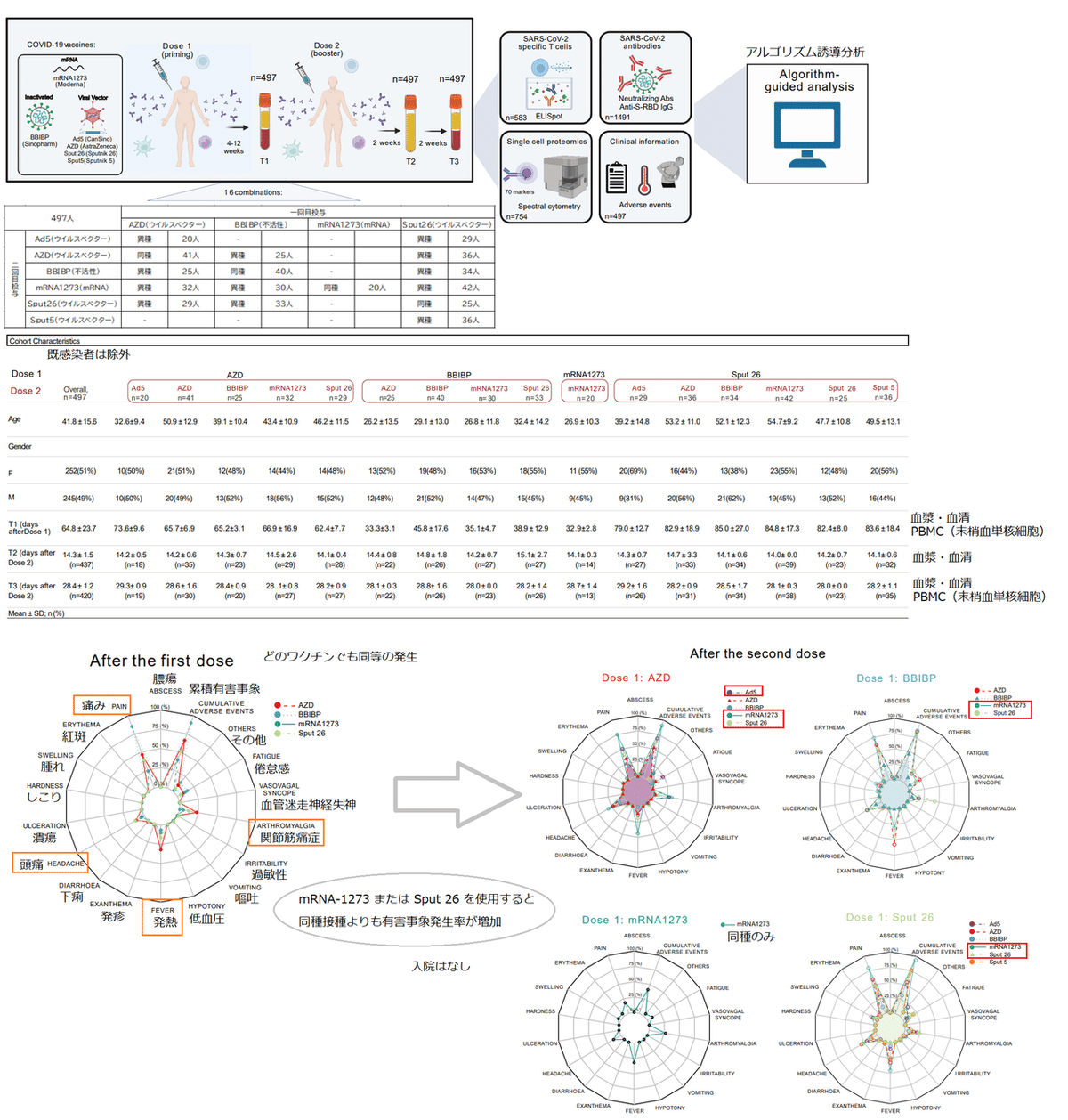
To compare the immunological changes resulting from different COVID-19 vaccination regimens, we enrolled subjects to be vaccinated with the regimens listed in Fig. 1a.
さまざまな COVID-19 ワクチン接種レジメンに起因する免疫学的変化を比較するために、図 1a にリストされているレジメンでワクチン接種を受ける被験者を登録しました。
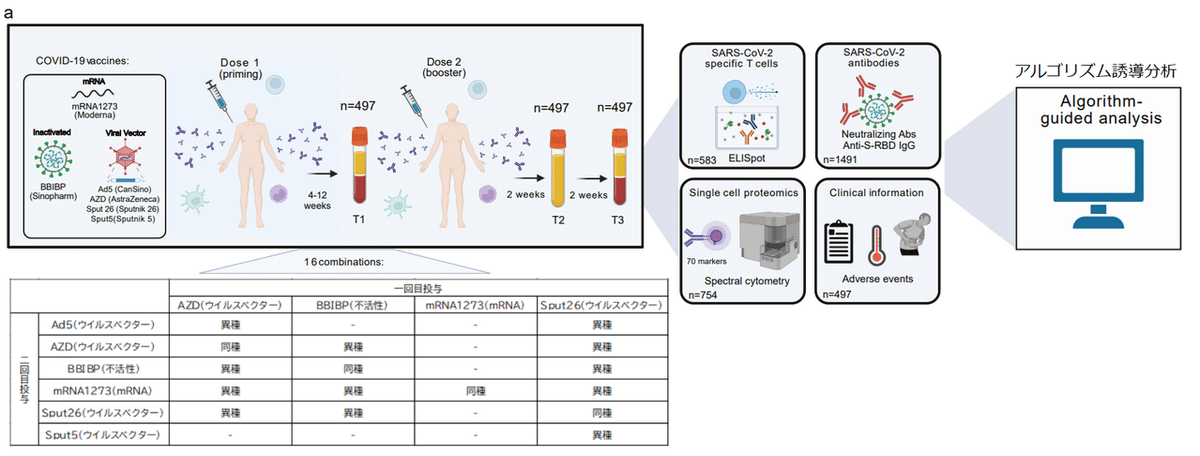
Individuals were given a priming dose (Dose 1) followed by a homologous or heterologous booster dose (Dose 2) 4-12 weeks later, resulting in a total of 16 combinatorial vaccination regimens.
4~12 週間後にプライミング用量(用量 1)に続いて、同種または異種のブースター用量(用量 2)が個人に投与され、合計 16 の組み合わせワクチン接種レジメンが行われました。
The interval between Dose 1 and Dose 2 depended on the first vaccine administered.
1回目の投与と2回目の投与の間隔は、最初に投与されたワクチンによって異なります。
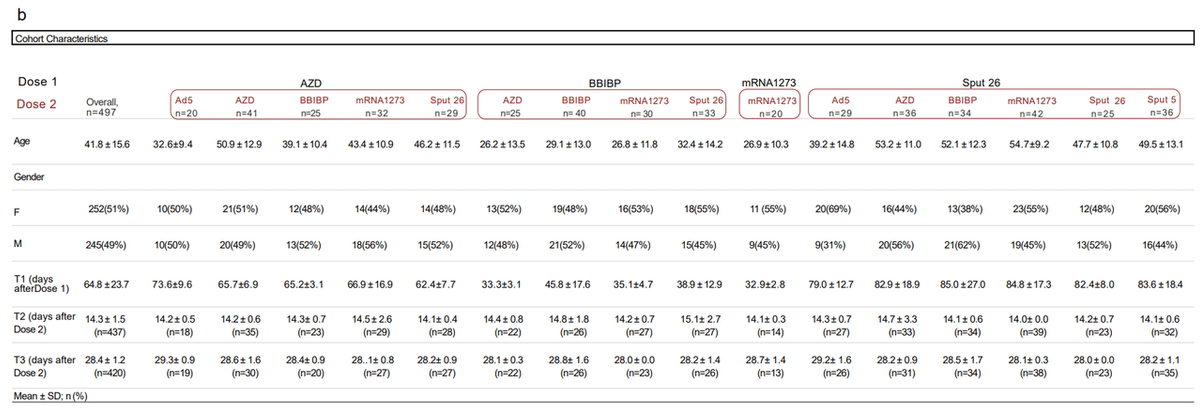
Blood samples were collected from each volunteer at 4-12 weeks after Dose 1 (T1), 14 ± 2 days after Dose 2 (T2), and 28 ± 1 days after Dose 2 (T3) (Fig. 1a-b).
血液サンプルは、投与 1 の 4~12 週間後(T1)、投与 2 の 14 ± 2 日後(T2)、および投与 2 の 28 ± 1 日後(T3)に各ボランティアから採取されました(図 1a-b)。
The T1-T2 and T2-T3 intervals were approximately two weeks for all groups (Fig. 1b).
T1-T2 および T2-T3 間隔は、すべてのグループで約 2 週間でした(図 1b)。
Serum and plasma were collected at all timepoints, and peripheral blood mononuclear cells (PBMCs) were isolated at T1 and T3.
血清と血漿はすべての時点で収集され、末梢血単核細胞(PBMC)は T1 と T3 で分離されました。
In total, 1,491 samples from 497 individuals were included in the analysis.
合計で、497 人の個人からの 1,491 のサンプルが分析に含まれました。
Characteristics of the whole cohort and the vaccine groups are summarized in Fig. 1b.
コホート全体とワクチン群の特徴を図 1b にまとめます。
Individuals with a prior history of COVID-19 or a positive SARS-CoV-2 nucleocapsid protein IgG ELISA result at T1 were excluded.
COVID-19 の既往歴があるか、T1 で SARS-CoV-2 ヌクレオキャプシドタンパク質 IgG ELISA の結果が陽性である個人は除外されました。
The vaccine groups were comparable in number of participants and gender distribution.
ワクチン群は、参加者数と性別分布において同等でした。
All study participants were monitored for up to 6 months after Dose 2 to assess reactogenicity.
すべての研究参加者は、反応原性を評価するために、用量 2 後最大 6 か月間監視されました。
Pain at the site of injection was the most frequent local adverse event after Dose 1 (Extended Data Fig. 1a) and Dose 2 (Extended Data Fig. 1b).
注射部位の痛みは、用量 1 (拡張データ図 1a) および用量 2 (拡張データ図 1b) の後、最も頻繁に見られた局所的な有害事象でした。

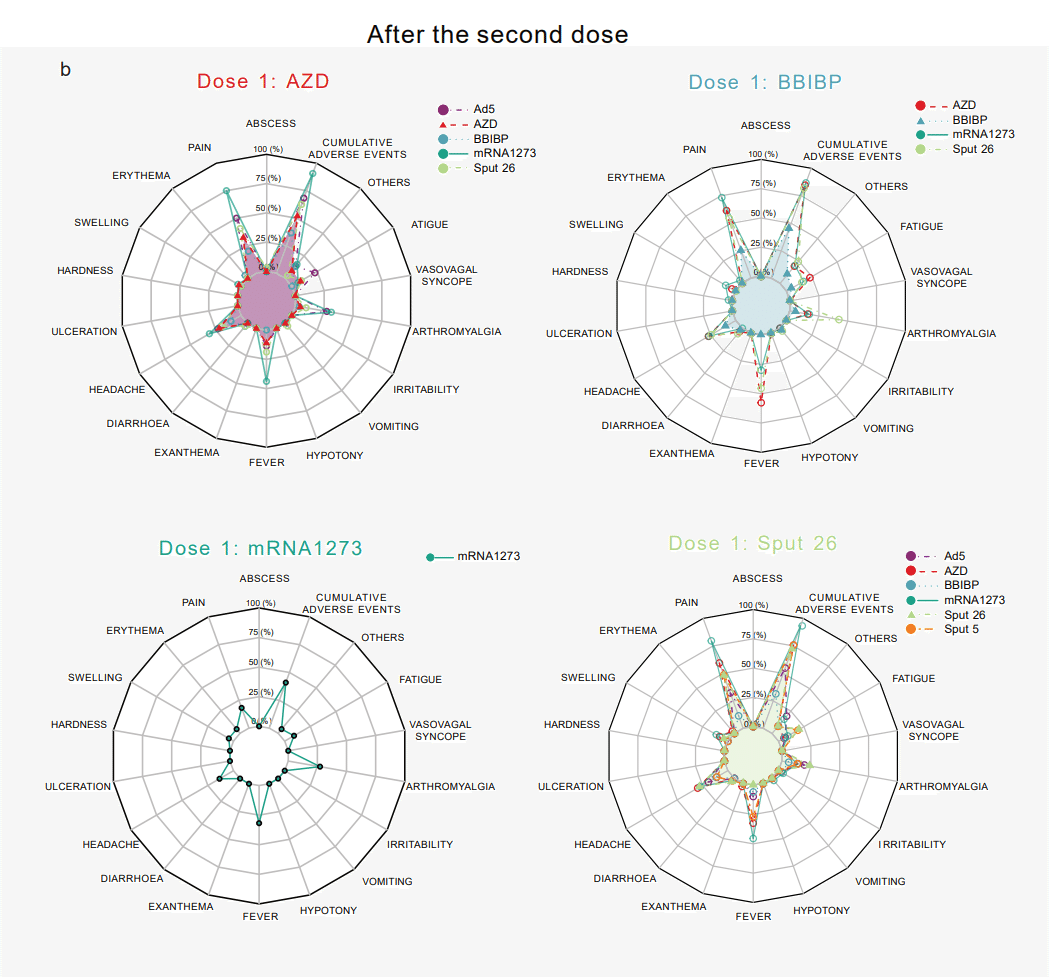
The most common systemic adverse manifestations were fever, arthromyalgia, and headache.
最も一般的な全身性の有害症状は、発熱、関節痛、頭痛でした。
In general, the spectrum of reported adverse events was comparable across all groups.
一般に、報告された有害事象のスペクトルは、すべてのグループで同等でした。
Of note, the use of mRNA-1273 or Sput 26 as Dose 2 in heterologous regimens, and the combination of AZD/Ad5 (Dose 1/Dose 2), increased the frequency of reported cumulative adverse events compared to homologous regimens.
注目すべきは、用量 2 としてmRNA-1273 または Sput 26 を異種レジメンで使用すること、および AZD/Ad5 の組み合わせ (用量 1/用量 2)は、同種のレジメンと比較して、報告された累積的な有害事象の頻度が増加しました。
All reactogenicity symptoms were short-lived, and there were no hospitalizations due to adverse events.
すべての反応原性の症状は短命であり、有害事象による入院はありませんでした。
Thus, all vaccine regimens were considered collectively well-tolerated.
したがって、すべてのワクチンレジメンは、全体として忍容性が高いと見なされました。
mRNA-1273 boost enhances humoral response
We evaluated the antibody response to the 16 prime-boost regimens by measuring participants’ serum levels of IgG specific for the receptor-binding domain (RBD) of the SARS-CoV-2 spike protein (anti-S-RBD IgG) and their SARS-CoV-2-neutralizing antibody (NAb) titres at timepoints T1, T2, and T3 for all vaccination groups (Fig. 2a-b).
すべてのワクチン接種群のT1、T2、およびT3の時点での、SARS-CoV-2スパイクタンパク質(抗S-RBD IgG)の受容体結合ドメイン(RBD)に特異的なIgGとSARS-CoV-2中和抗体(NAb)力価の参加者の血清レベルを測定することにより、16のプライムブーストレジメンに対する抗体反応を評価しました(図2a-b)。
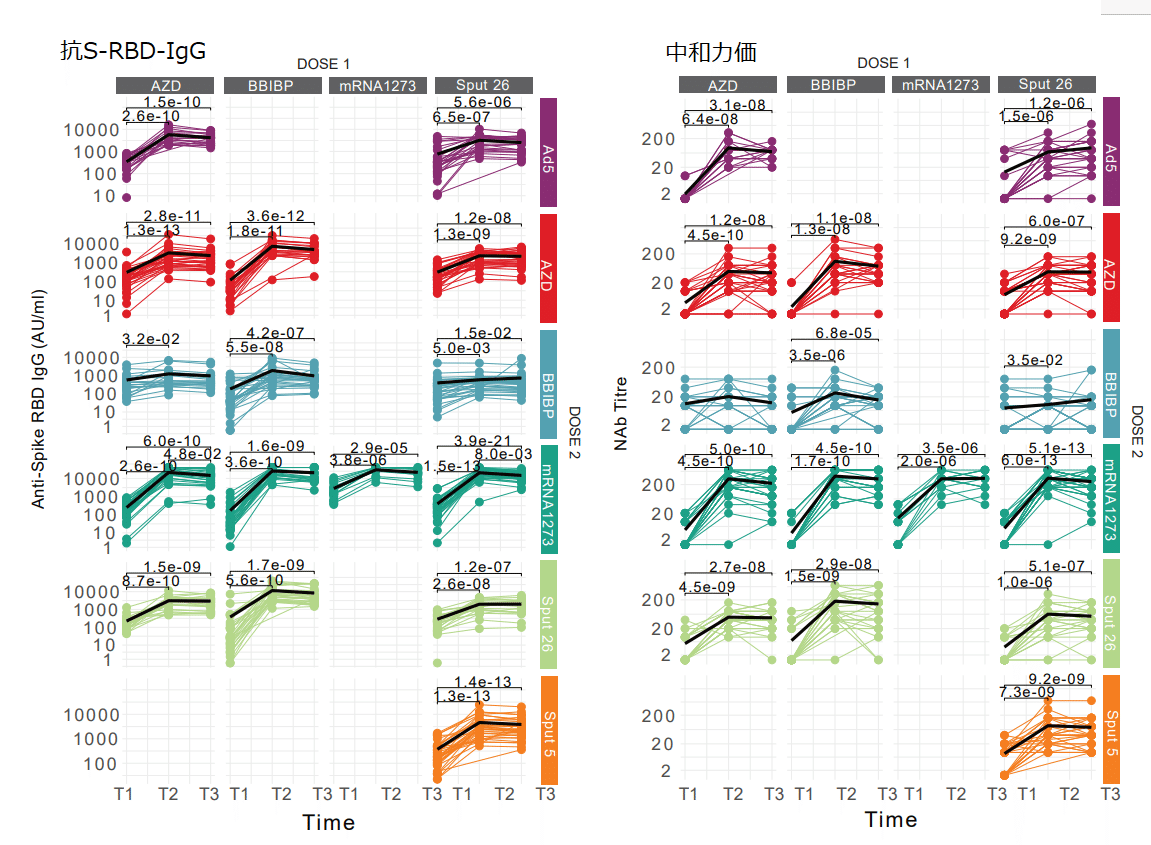
All study participants had detectable anti-S-RBD IgG levels (> 50 AU/ml) after Dose 2, and anti-S-RBD IgG levels increased in most vaccine groups at T2 and T3 compared to T1 (Fig. 2a).
すべての研究参加者は、用量 2 後に検出可能な抗 S-RBD IgG レベル (> 50 AU/ml) を有し、抗 S-RBD IgG レベルは、T1 と比較して T2 および T3 でほとんどのワクチン群で増加しました (図 2a)。
Anti-S-RBD IgG levels increased significantly from T1 to T3 in all groups except for AZD/BBIBP.
抗 S-RBD IgG レベルは、AZD/BBIBP を除くすべてのグループで T1 から T3 にかけて大幅に増加しました。
Peak antibody concentrations were reached at T2, with a marginal and non-significant decrease at T3, for almost all groups (Fig. 2a).
ほぼすべてのグループで、抗体濃度のピークは T2 に達し、T3 ではわずかに減少し、有意ではありませんでした(図 2a)。
The NAb titres showed similar patterns, although detectable titres (≥ 1:10) were not present in all individuals (Fig. 2b).
NAb 力価は同様のパターンを示しましたが、検出可能な力価 (≥ 1:10) はすべての個人に存在するわけではありませんでした (図 2b)。
Both of these humoral responses were most strongly enhanced by mRNA-1273 except after priming with AZD, where boosting with Ad5 led to the greatest fold increase in NAb titres (Extended Data Fig. 2a-b).
これらの体液性応答は両方とも、AZD でプライミングした後を除いて、mRNA-1273 によって最も強く増強されました。AZDでは、Ad5 によるブーストがNAb 力価の最大倍増につながりました(拡張データ図 2a-b)。
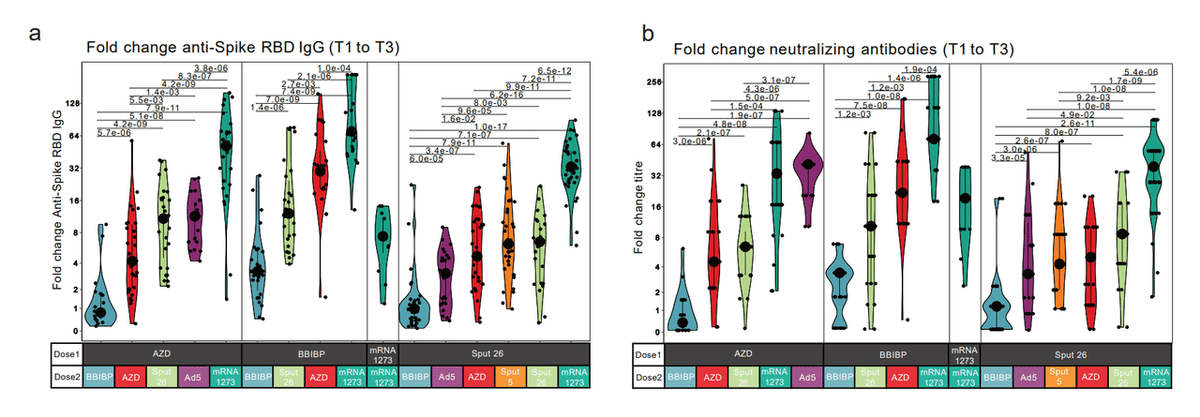
At T3, anti-S-RBD IgG levels and NAb titres were highest in individuals that received homologous mRNA-1273/mRNA-1273 vaccination and in all the heterologous groups that included mRNA-1273 as Dose 2 (Fig. 2c-d).
T3 では、抗 S-RBD IgG レベルと NAb 力価は、同種の mRNA-1273/mRNA-1273 ワクチン接種を受けた個人と、mRNA-1273 を用量 2 として含むすべての異種グループで最高でした(図 2c-d)。
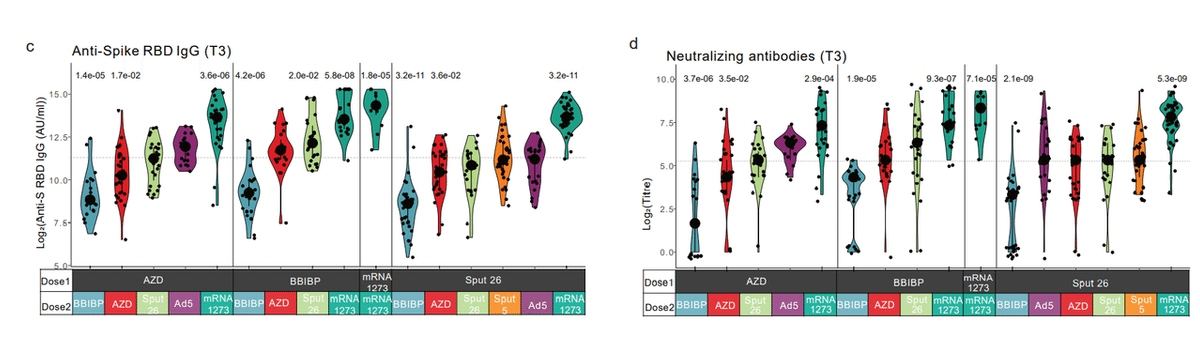
Anti-S-RBD IgG levels were also positively correlated with NAb titres at T3 (Extended Data Fig. 2c).
抗 S-RBD IgG レベルも、T3 での NAb 力価と正の相関がありました(拡張データ図 2c)。
Thus, heterologous vaccine combinations generally elicited enhanced antibody responses compared to homologous combinations, except when BBIBP was administered as Dose 2 (Fig. 2c-d).
したがって、異種ワクチンの組み合わせは、BBIBP が用量 2 として投与された場合を除いて、一般に、同種の組み合わせと比較して強化された抗体応答を誘発しました(図 2c-d)。
In conclusion, using mRNA-1273 as Dose 2 induced the strongest antibody responses, regardless of the vaccine used as Dose 1.
結論として、mRNA-1273 を用量 2 として使用すると、用量 1 として使用したワクチンに関係なく、最も強い抗体応答が誘導されました。
Strong B cell response after mRNA-1273
B cells contribute to immunological memory against many viral infections and are important in protecting against COVID-19.
B 細胞は、多くのウイルス感染に対する免疫記憶に寄与し、COVID-19 からの保護に重要です。
The ability of COVID-19 vaccines to induce memory B cell expansion is therefore critical for their efficacy.
したがって、COVID-19 ワクチンがメモリー B 細胞の拡大を誘導する能力は、その有効性にとって重要です。
Hence, we generated a multi-parametric flow cytometry panel to interrogate post-vaccination B cell dynamics, using fluorescently labelled wild-type SARS-CoV-2 spike multimer probes to identify memory B cells (mBCs) specific for the SARS-CoV-2 spike protein.
したがって、ワクチン接種後の B 細胞の動態を調査するために、マルチパラメトリック フロー サイトメトリー パネルを作成しました。蛍光標識された野生型 SARS-CoV-2 スパイク マルチマー プローブを使用して、SARS-CoV-2 スパイクタンパク質に特異的な記憶 B 細胞(mBC)を識別します。
Data were projected using Uniform Manifold Approximation and Projection (UMAP) in conjunction with FlowSOM clustering to evaluate the canonical B cell populations and identify spike-binding mBCs (Fig. 3a, Extended Data Fig. 3a).
データは、正規の B 細胞集団を評価し、スパイク結合 mBC を特定するために、FlowSOM クラスタリングと組み合わせて Uniform Manifold Approximation and Projection(UMAP)を使用して投影されました(図 3a、拡張データ図 3a)。
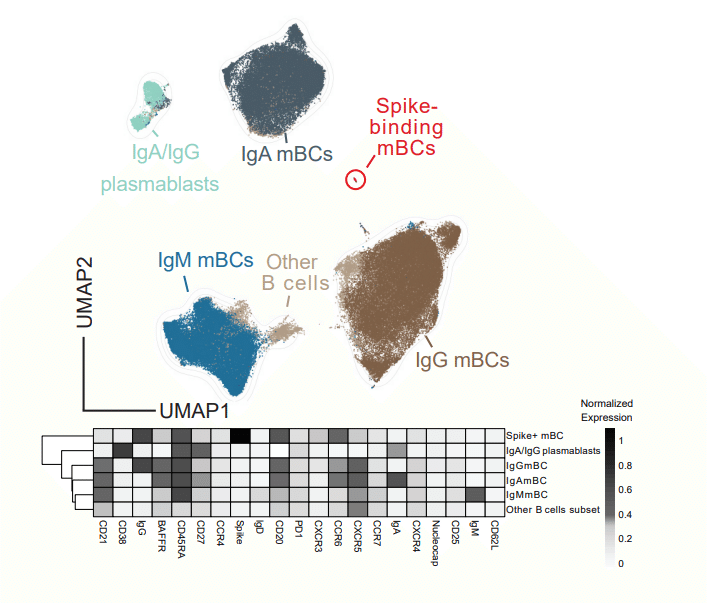
The proportions of all these B cell populations except the spike-binding mBCs were similar among the 16 vaccinated groups at T3 (Fig. 3b).
スパイク結合 mBC を除くこれらすべての B 細胞集団の割合は、T3 で 16 のワクチン接種グループ間で同様でした(図 3b)。
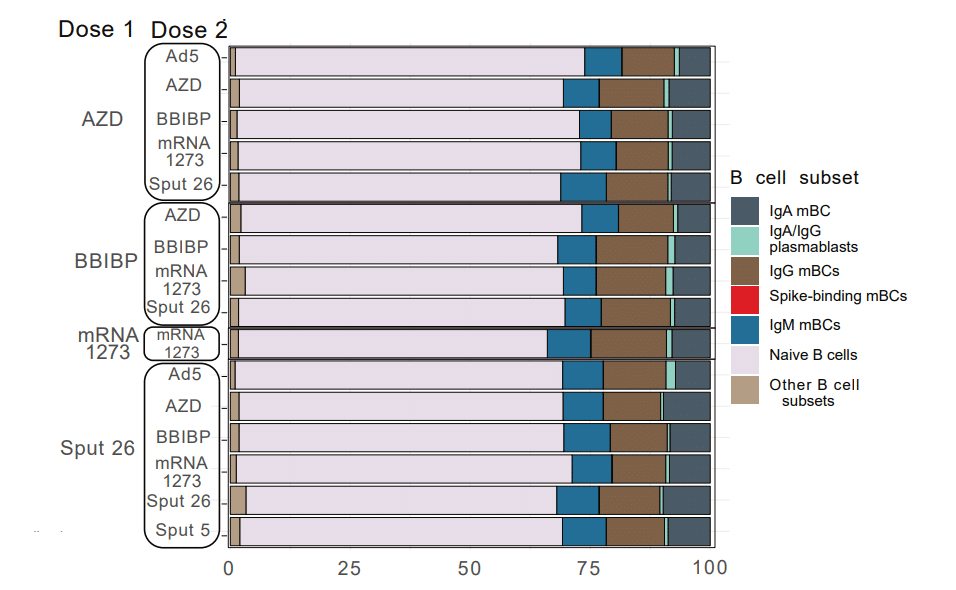
One month after Dose 2 (T3), we observed a significant increase in the frequency of this population in all vaccine groups, except for those with BBIBP as Dose 2 (Fig. 3c).
投与 2 (T3) の 1 か月後、投与 2 として BBIBP を使用したものを除くすべてのワクチン群で、スパイク結合 mBC の頻度が大幅に増加したことが観察されました (図 3c)。
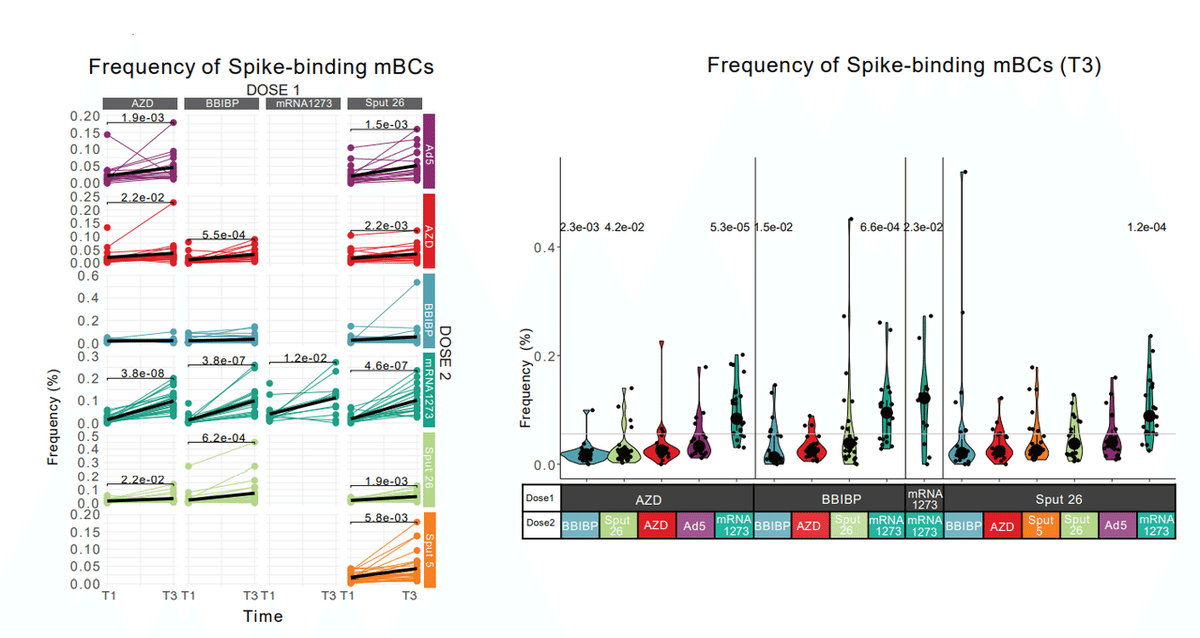
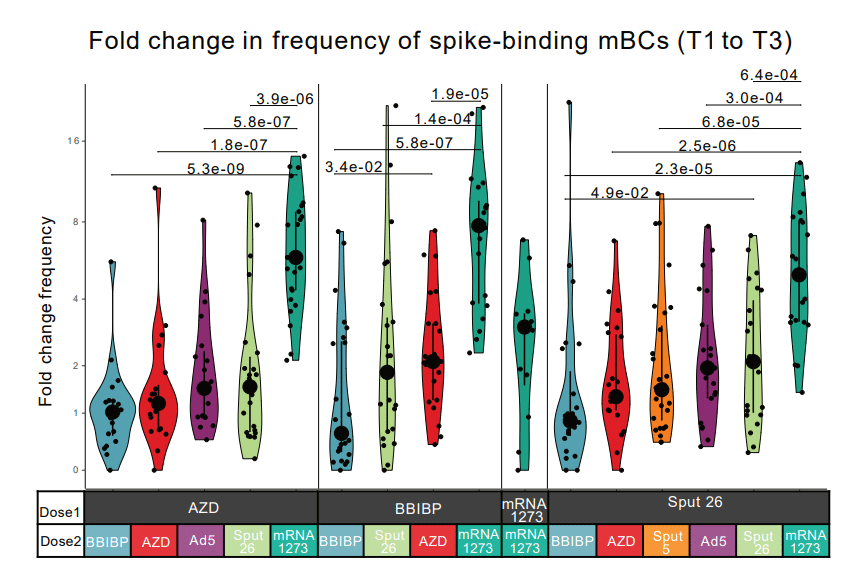
In line with our findings from the anti-S-RBD IgG and NAb analyses, the most pronounced increase in spike-binding mBCs was observed in individuals who received mRNA-1273 as Dose 2 (Fig. 3d, Extended Data Fig. 3b, and Extended Data Table 1).
抗 S-RBD IgG および NAb 分析から得られた調査結果と一致して、用量 2 として mRNA-1273 を投与された個人で、スパイク結合 mBC の最も顕著な増加が観察されました(図3d、拡張データ図3b、および拡張データ表1)。
Of note, we found that the frequency of these cells correlated with the levels of anti-S-RBD IgG and NAbs for some (but not all) vaccine groups, suggesting that this frequency could serve as an indicator for the systemic antibody response in certain cases, at least at early time points after vaccination (Fig. 3e).
注目すべきは、これらの細胞の頻度が、一部の(すべてではない)ワクチン群の抗 S-RBD IgG および NAbs のレベルと相関することを発見したことです。この頻度は、特定のケースでは、少なくともワクチン接種後の初期の時点で、全身の抗体反応の指標として役立つ可能性があることを示唆しています(図 3e)。
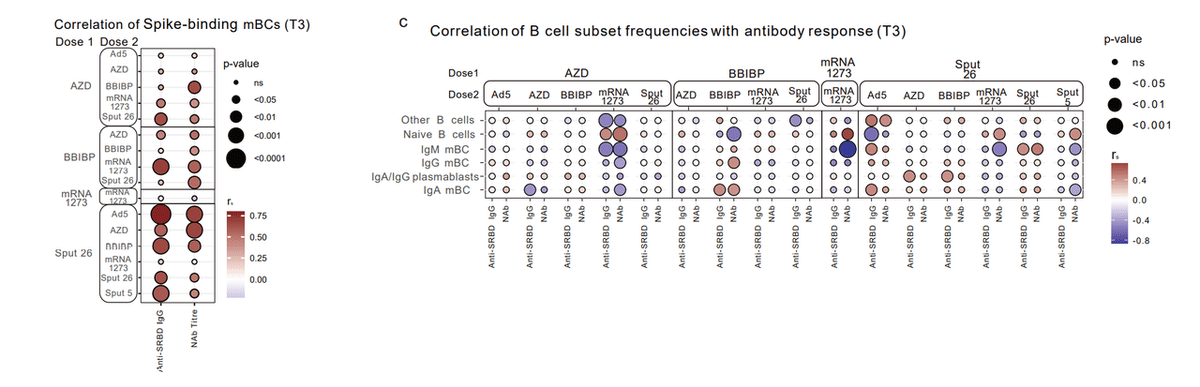
We did not observe a correlation between the antibody levels and the frequencies of other B cell subsets in most of the vaccine groups (Extended Data Fig. 3c).
ほとんどのワクチン群で、抗体レベルと他の B 細胞サブセットの頻度との間に相関関係は観察されませんでした(拡張データ図 3c)。
To better understand the effect of various vaccine regimens on the phenotype of spike-binding mBCs, we evaluated these cells’ expression of differentiation markers and trafficking molecules at T3 (Fig. 3f).
スパイク結合mBCの表現型に対するさまざまなワクチンレジメンの影響をよりよく理解するために、これらの細胞のT3での分化マーカーと輸送分子の発現を評価しました(図3f)。
Spike-binding mBCs from BBIBP-primed groups showed the lowest relative expression of IgG and the highest of IgM, indicating limited class switching (i.e. from IgM to a IgG/IgA isotype).
BBIBP でプライミングされたグループのスパイク結合 mBC は、IgG の最低の相対発現と IgM の最高の相対発現を示しました。
The highest intensity of IgA was found in spike-binding mBCs from individuals vaccinated with mRNA-1273/mRNA-1273 (Fig. 3f, Extended Data Table 2).
最高強度の IgA は、mRNA-1273/mRNA-1273 をワクチン接種した個人のスパイク結合 mBC に見られました(図 3f、拡張データ表 2)。
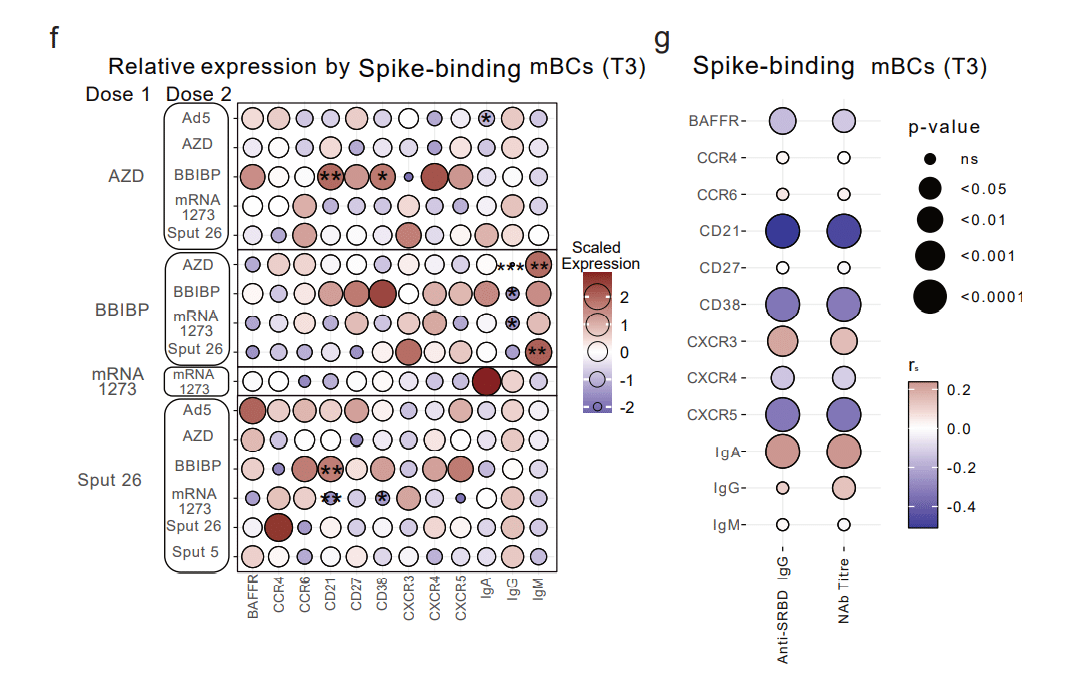
Next, we examined whether these phenotypes were indicative of the strength of the antibody response (Fig. 3g, Extended Data Fig. 3d).
次に、これらの表現型が抗体反応の強さを示しているかどうかを調べました(図 3g、拡張データ図 3d)。
We found strong negative correlations between antibody response (anti-S-RBD IgG levels and NAb titres) and the expression of CD21, CD38, and CXCR5 on spike-specific mBCs, while IgA and CXCR3 were positively correlated with antibody response.
抗体応答(抗 S-RBD IgG レベルと NAb 力価)とスパイク特異的 mBC での CD21、CD38、CXCR5 の発現との間には強い負の相関が見られましたが、IgA と CXCR3 は抗体応答と正の相関がありました。
Thus, not only the frequency but also the phenotype of antigen-specific mBCs can reflect the strength of the antibody response after COVID-19 vaccination (Fig. 3g).
したがって、抗原特異的mBCの頻度だけでなく表現型も、COVID-19ワクチン接種後の抗体反応の強さを反映する可能性があります(図3g)。
Overall, our results highlight three key points.
全体として、私たちの結果は 3 つの重要なポイントを強調しています。
First, spike-binding mBC frequencies increased after Dose 2 in almost all groups, with the strongest expansion seen in mRNA-1273-boosted individuals.
まず、スパイク結合 mBC 頻度は、ほとんどすべてのグループで用量 2 後に増加し、mRNA-1273 でブーストされた個人で最も強い増加が見られました。
Second, boosting with BBIBP did not significantly increase spike-binding mBC frequencies and resulted in mBCs compatible with a switched resting (CD21+CD27+CD38+/lo) or pre-switched (IgM+CD21+ CD27+CD38+/lo) phenotype.
第二に、BBIBP によるブーストは、スパイク結合 mBC 頻度を有意に増加させず、スイッチ休止(CD21+CD27+CD38+/lo)またはスイッチ前(IgM+CD21+CD27+CD38+/lo)表現型と互換性のある mBC をもたらしました。
Boosting with mRNA-1273, meanwhile, induced phenotypes indicating switched activated (IgG/IgA+CD21-CD27+CD38-) or atypical (IgG/IgA+CD21-CD27-CD38lo) mBCs.
一方、mRNA-1273 によるブーストは、切り替えられた活性化 (IgG/IgA+CD21-CD27+CD38-) または非定型 (IgG/IgA+CD21-CD27-CD38lo) mBC を示す表現型を誘導しました。
Third, spike-binding mBCs from BBIBP-primed individuals showed expression profiles suggesting limited isotype switching (indicated by higher IgM expression) alongside phenotypic markers (CD21, CD38, CXCR5, CXCR3) that correlate with the level of antibody production after vaccination.
3番目に、BBIBPでプライミングされた個人からのスパイク結合mBCは、ワクチン接種後の抗体産生のレベルと相関する表現型マーカー(CD21、CD38、CXCR5、CXCR3)とともに、限られたアイソタイプスイッチング(より高いIgM発現によって示される)を示唆する発現プロファイルを示しました。
Thus, the B cell immune landscape in vaccinated individuals clearly mirrors the antibody profile seen in the serum shortly after vaccination.
したがって、ワクチン接種を受けた個人の B 細胞免疫の状況は、ワクチン接種直後の血清に見られる抗体プロファイルを明確に反映しています。
BBIBP priming induces highest T cell responses
Increased frequencies of interferon-gamma (IFNγ)-secreting T cells against SARS-CoV-2 spike, nucleoprotein, and matrix proteins are known to predict protection after vaccination from COVID-19.
SARS-CoV-2スパイク、核タンパク質、およびマトリックスタンパク質に対するインターフェロン-ガンマ(IFNγ)分泌T細胞の頻度の増加は、COVID-19からのワクチン接種後の保護を予測することが知られています。
To assess the cellular immune response upon antigen re-encounter, we stimulated PBMCs from timepoints T1 and T3 with SARS-CoV-2 spike and nucleocapsid peptide pools and measured IFNγ production with an ELISpot assay (Fig. 4a-b).
抗原再遭遇時の細胞性免疫応答を評価するために、SARS-CoV-2スパイクとヌクレオキャプシドペプチドプールでT1とT3の時点からPBMCを刺激し、ELISpotアッセイでIFNγ産生を測定しました(図4a-b)。
Spike-induced IFNγ production was significantly increased (1.6-fold) at T3 in the AZD/mRNA-1273 group, while BBIBP-primed individuals showed significant increases with all booster vaccines (Fig. 4a and c, Extended Data Fig. 4a).
AZD/mRNA-1273 グループでは、T3 でスパイク誘発性の IFNγ 産生が有意に増加しました(1.6 倍)が、BBIBP でプライミングされた個体は、すべてのブースター ワクチンで有意な増加を示しました(図 4a および c、拡張データ図 4a)。
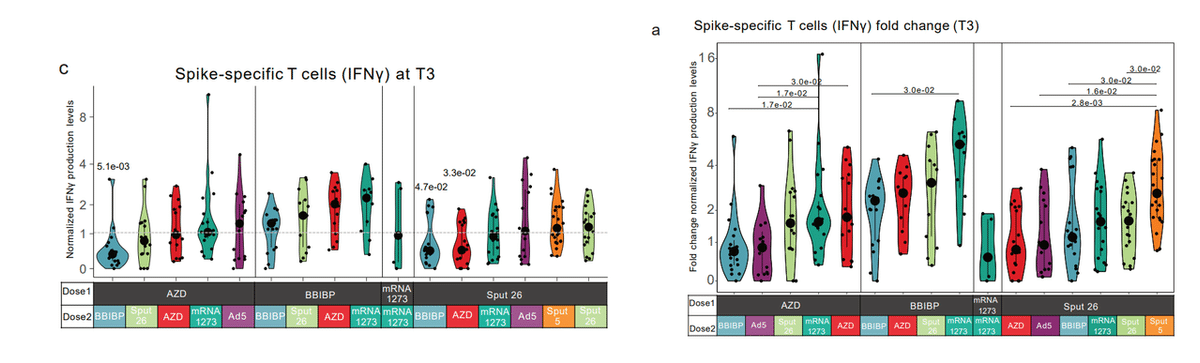
For Sput 26-primed individuals, only Sput 5 (2.7-fold) as Dose 2 resulted in a significant increase of spike-specific responses at T3.
Sput 26 でプライミングされた個人の場合、Dose 2 として Sput 5 (2.7 倍) のみが T3 でのスパイク特異的応答の有意な増加をもたらしました。
The strongest response in AZD-primed individuals was observed in the AZD/Ad5 group, while BBIBP-primed individuals reached high levels with all vaccine combinations (Fig. 4c, Extended Data Fig. 4a, and Extended Data Table 1).
AZD でプライミングされた個人の最も強い反応は、AZD/Ad5 グループで観察されました。一方、BBIBP でプライミングされた個人は、すべてのワクチンの組み合わせで高レベルに達しました (図 4c、拡張データ図 4a、および拡張データ表 1)。
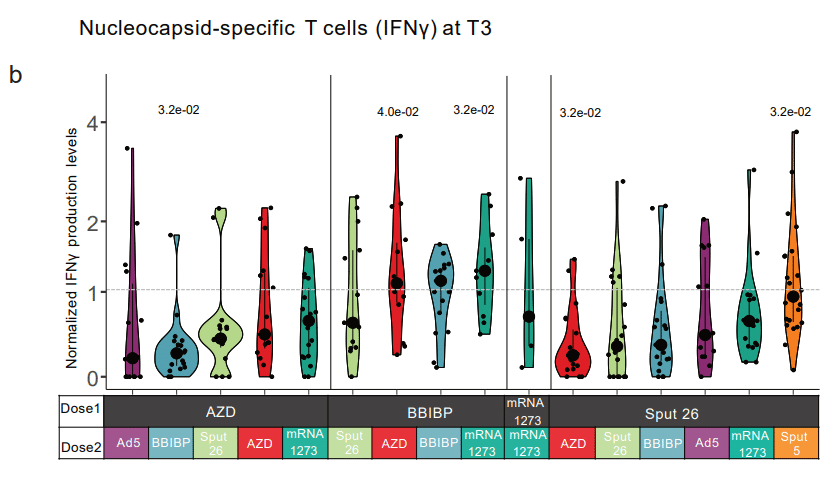
Meanwhile, the nucleocapsid-induced IFNγ production at T3 in BBIBP-primed participants was highest after boosting with mRNA-1273, BBIBP, or AZD, whereas a Sput 26 boost resulted in a lower response (Extended Data Fig. 4b).
一方、BBIBP でプライミングされた参加者の T3 でのヌクレオキャプシドによる IFNγ 産生は、mRNA-1273、BBIBP、または AZD でブーストした後に最も高かった。一方、Sput 26 ブーストでは応答が低下しました (拡張データ図 4b)。
Overall, BBIBP-primed individuals showed the highest spike-induced IFNγ production, independent of Dose 2.
全体として、BBIBP でプライミングされた個人は、用量 2 とは無関係に、スパイクによる IFNγ 産生が最も高かった。
BBIBP is the only vaccine in the study that targets the whole SARS-CoV-2 virus rather than solely the spike protein.
BBIBPは、スパイクタンパク質のみではなく、SARS-CoV-2ウイルス全体を標的とする研究で唯一のワクチンです。
Therefore, as expected, this was the only vaccine that induced strong cellular immunity against nucleocapsid peptides.
したがって、予想通り、これはヌクレオキャプシド ペプチドに対する強力な細胞性免疫を誘導した唯一のワクチンでした。
Interestingly, we did not detect responses above the threshold level when BBIBP was given as Dose 2 in heterologous regimens (Fig. 4c).
興味深いことに、BBIBP が異種レジメンで用量 2 として投与された場合、閾値レベルを超える反応は検出されませんでした(図 4c)。
In sum, these results reveal that T cell-mediated responses against SARS-CoV-2 spike and nucleocapsid peptides are stronger when BBIBP is administered as Dose 1, regardless of the vaccine used as Dose 2.
まとめると、これらの結果は、SARS-CoV-2 スパイクおよびヌクレオキャプシド ペプチドに対する T 細胞を介した応答は、用量 2 として使用されたワクチンに関係なく、用量 1 として BBIBP が投与された場合により強いことを明らかにしています。
T cell clusters track antigen-specific responses
Given the differences in the T cell responses, we interrogated overall T cell dynamics to determine whether the frequencies of specific T cell subsets are indicative of strong spike-specific cellular responses upon antigen re-encounter.
T 細胞応答の違いを考慮して、全体的な T 細胞ダイナミクスを調査し、特定の T 細胞サブセットの頻度が抗原再遭遇時の強いスパイク特異的細胞応答を示しているかどうかを判断しました。
We began by generating a lymphocyte-focused panel for single-cell analysis and defined 15 canonical T cell subpopulations using naïve/memory-associated markers (Fig. 4d, Extended Data Fig. 5a-b).
まず、単一細胞分析用のリンパ球に焦点を当てたパネルを作成し、ナイーブ/メモリー関連マーカーを使用して 15 の正規 T 細胞亜集団を定義しました (図 4d、拡張データ図 5a-b)。
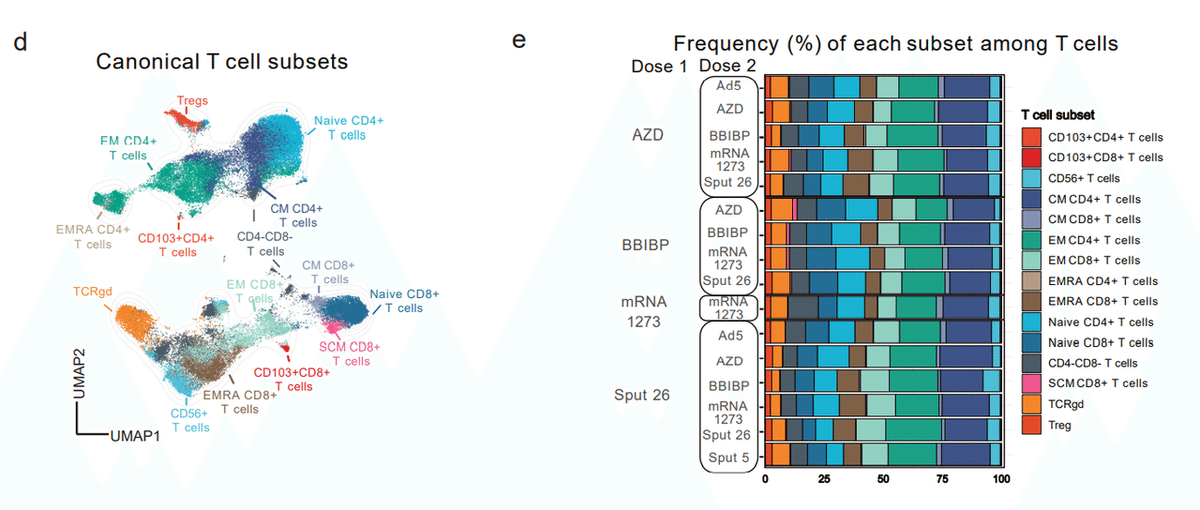
No significant differences were observed in the relative frequencies of these subsets among the vaccinated groups at T3 (Fig. 4e), and none of the subsets showed a strong correlation (|rs| > 0.25 and p < 0.05) with Spike-induced IFNγ production (Extended Data Fig. 5c).
T3 でワクチン接種を受けたグループ間で、これらのサブセットの相対頻度に有意差は観察されませんでした(図 4e)。 また、いずれのサブセットも、Spike による IFNγ 産生との強い相関 (|rs| > 0.25 および p < 0.05) を示しませんでした (拡張データ図 5c)。
To investigate the canonical T cell subsets more deeply, we reclustered the samples using 27 functional and lineage-specific spectral flow parameters (Extended Data Fig. 5a) and performed FlowSOM clustering on the T cell compartment (Extended Data Table 1).
標準的な T 細胞サブセットをより深く調査するために、27 の機能的および系統固有のスペクトル フロー パラメータを使用してサンプルを再クラスタリングし(拡張データ図 5a)、T 細胞コンパートメントで FlowSOM クラスタリングを実行しました(拡張データ表 1)。
The frequencies of four of the resulting T cell clusters correlated with the levels of spike-induced IFNγ production detected in the ELISpot assay (|rs| > 0.25 and p < 0.05) (Extended Data Table 3, Fig. 4f-h, Extended Data Fig. 5d).
得られた 4 つの T 細胞クラスターの頻度は、ELISpot アッセイで検出されたスパイク誘導 IFNγ 産生のレベルと相関していました (|rs| > 0.25 and p < 0.05) (拡張データ表 3、図 4f-h、拡張データ 図 5d)。
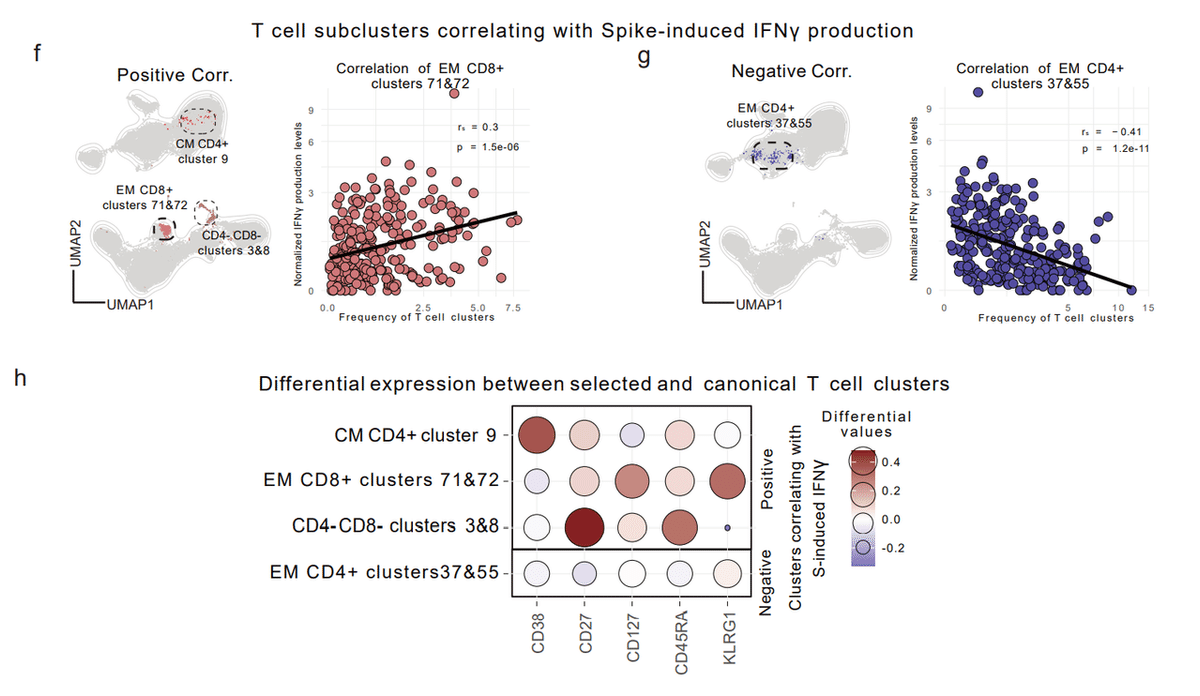
The phenotypes and the differentially expressed markers of the correlating clusters are depicted in Extended Data Fig. 5e and Fig. 4h, respectively.
相関クラスターの表現型と示差的に発現するマーカーは、それぞれ拡張データ図 5e と図 4h に示されています。
CM CD4+ cluster 9, EM CD8+ clusters 71&72, and CD4-/CD8- clusters 3&8 respectively expressed high levels of CD38, KLRG1, and CD27 compared to the canonical T cell populations (Fig. 4h).
CM CD4+ クラスター 9、EM CD8+ クラスター 71&72、および CD4-/CD8- クラスター 3&8 は、標準的な T 細胞集団と比較して、それぞれ高レベルの CD38、KLRG1、および CD27 を発現しました (図 4h)。
Next, we compared the frequency of these T cell clusters across the 16 vaccine regimens, finding that BBIBP-primed combinations showed higher frequencies of CD4-/CD8- clusters 3&8 compared to the other groups (Extended Data Fig. 5f and Extended Data Table 4).
次に、これらの T 細胞クラスターの頻度を 16 のワクチン レジメン間で比較しました。BBIBP でプライミングされた組み合わせは、他のグループと比較して CD4-/CD8- クラスター 3&8 の頻度が高いことがわかりました(拡張データ図 5f および拡張データ表 4)。
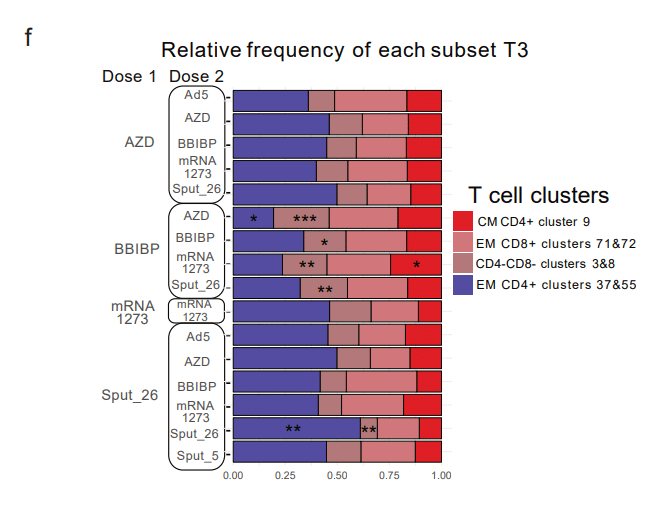
In sum, we identified post-vaccination T cell clusters that are markers for an antigen-specific T cell response upon antigen re-encounter and are differentially expressed in BBIBP-primed individuals.
要するに、抗原再遭遇時の抗原特異的 T 細胞応答のマーカーであり、BBIBP でプライミングされた個体で示差的に発現するワクチン接種後の T 細胞クラスターを特定しました。
Vaccine regimen immune signatures
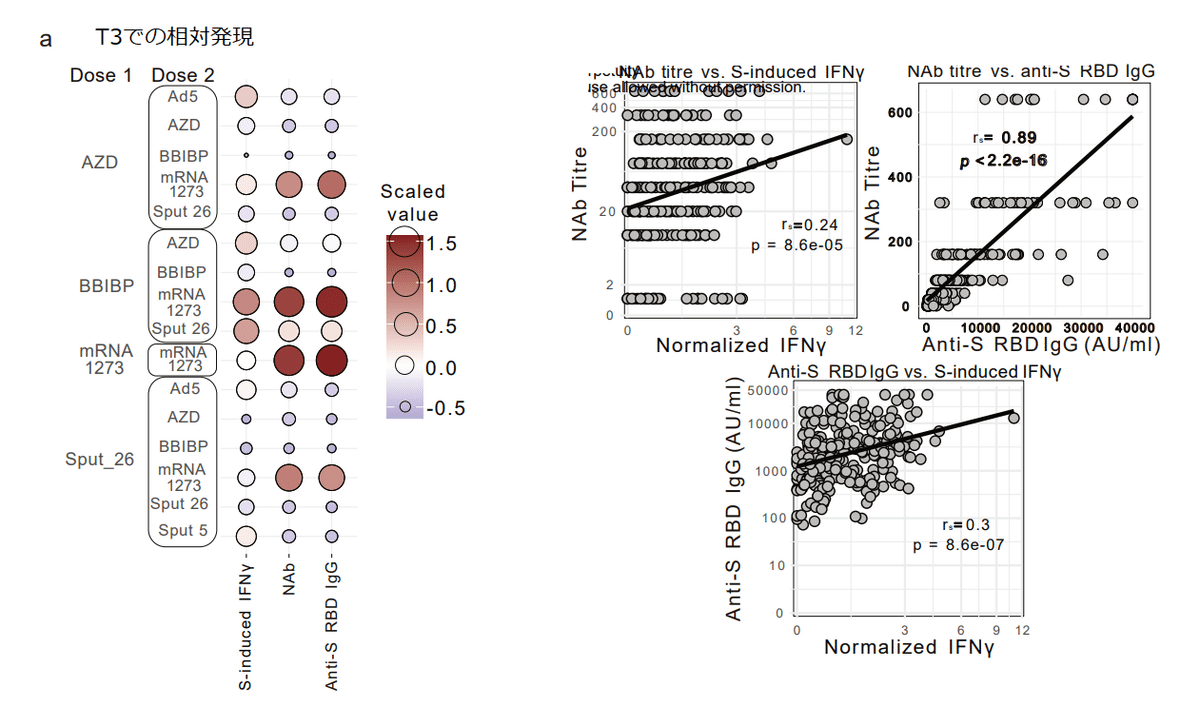
Side-by-side analysis of our humoral and cellular immunogenicity data (Fig. 2c-d, Fig. 4c, and Extended Data Table 1) revealed that BBIBP/mRNA-1273 induced especially high responses in both immune compartments (Fig. 5a).
体液性および細胞性免疫原性データ(図 2c-d、図 4c、拡張データ表 1)を並べて分析したところ、BBIBP/mRNA-1273 が両方の免疫コンパートメントで特に高い応答を誘発したことが明らかになりました(図 5a)。
We then analyzed whether these primary humoral and T cell parameters correlated with each other.
次に、これらの一次体液性パラメーターと T 細胞パラメーターが互いに相関しているかどうかを分析しました。
We found a significant correlation between anti-S-RBD IgG levels and spike-induced IFNγ production at T3, while NAb titres were less strongly correlated with the cellular response (Fig. 5b).
T3での抗S-RBD IgGレベルとスパイク誘導IFNγ産生との間に有意な相関関係が見つかりました。 一方、NAb力価は細胞応答とあまり強く相関していませんでした(図5b)。
Thus, higher antibody levels (especially anti-S-RBD IgG) are accompanied by higher T cell responses after COVID-19 vaccination, although this correlation was not shared by all vaccine groups (Extended Data Fig. 6a).
したがって、COVID-19 ワクチン接種後の T 細胞応答の増加は、抗体レベル(特に抗 S-RBD IgG)の増加に伴いますが、この相関関係はすべてのワクチン群で共有されているわけではありません(拡張データ図 6a)。
In our cohort, we observed interindividual differences in the strength of the immune response after vaccination (Fig. 2c-d and Fig. 4c).
私たちのコホートでは、ワクチン接種後の免疫応答の強さの個人差が観察されました(図 2c-d および図 4c)。
Furthermore, the specific immune factors that determine the protective efficacy of COVID-19 vaccines are not entirely understood.
さらに、COVID-19 ワクチンの防御効果を決定する特定の免疫因子は完全には理解されていません。
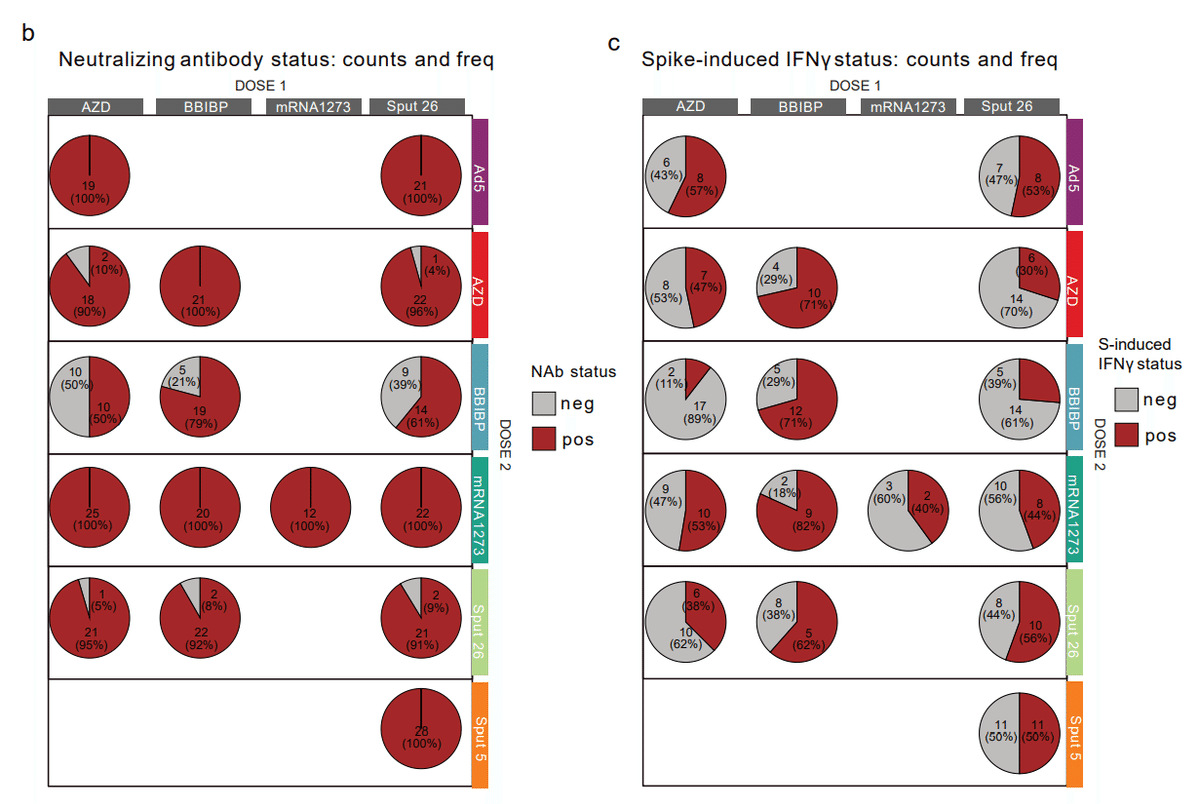
In order to assess the immune compositions associated with relatively stronger or weaker immunogenicity, we divided the cohort into positive and negative responders for NAbs and spike-induced IFNγ production (anti-S-RBD IgG status was not included, since all participants were positive responders after Dose 2).
比較的強い免疫原性または弱い免疫原性に関連する免疫組成を評価するために、コホートを NAb およびスパイク誘導 IFNγ 産生に対する陽性応答者と陰性応答者に分けました。 (すべての参加者が用量 2 後に陽性反応者だったため、抗 S-RBD IgG ステータスは含まれませんでした)。
Positive responders were defined as neutralizing titre (NAb) ≥ 10 for NAbs and > 1.03 for spike-induced IFNγ production.
陽性応答者は、中和力価(NAb)が NAbs で 10 以上、スパイク誘発 IFNγ 産生で 1.03 以上と定義されました。
The proportions of positive responders among the vaccine groups are shown in Extended Data Fig. 6b-c.
ワクチン群間の陽性応答者の割合は、拡張データの図 6b-c に示されています。
Consistent with Fig. 3g, positive responders for NAb titres had higher anti-S-RBD IgG levels and lower expression of CD21, CD38, and CXCR5 on spike-binding mBCs (Fig. 5c).
図 3g と一致して、NAb 力価に対する陽性応答者は、抗 S-RBD IgG レベルが高く、スパイク結合 mBC でのCD21、CD38、および CXCR5 の発現が低かった(図 5c)。
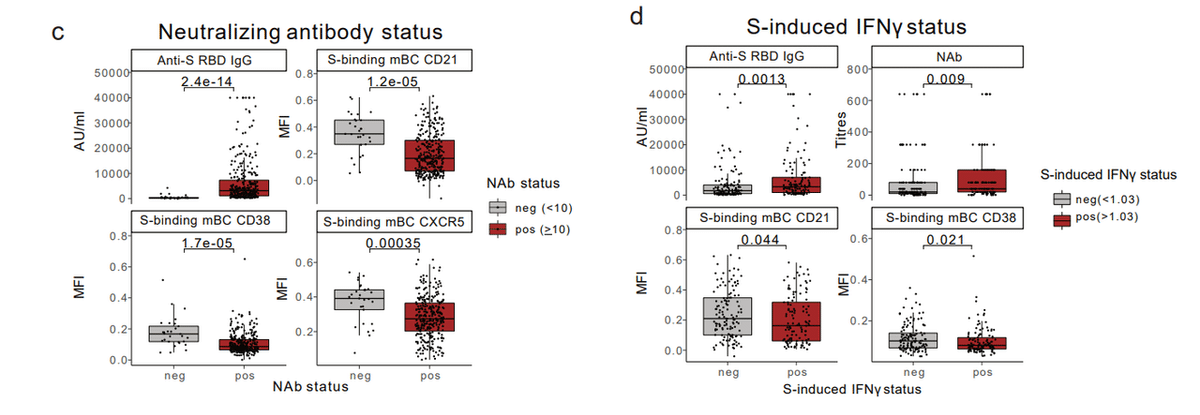
Positive responders for spike-induced IFNγ production had significantly higher anti-S-RBD IgG levels and NAb titres and lower expression of CD21 and CD38 by spike-binding mBCs (Fig. 5d).
スパイク誘導 IFNγ 産生に対する陽性応答者は、抗 S-RBD IgG レベルと NAb 力価が有意に高く、スパイク結合 mBC による CD21 と CD38 の発現が低かった(図 5d)。
In addition, the frequencies of the four T cell clusters that correlated with the IFNγ response (Fig. 4f-h) were all significantly different between positive and negative responders for spike-induced IFNγ production (Extended Data Fig. 6e) but were similar between positive and negative responders for NAb titres (Extended Data Fig. 6d).
さらに、IFNγ応答と相関する4つのT細胞クラスターの頻度(図4f~h)はすべて、スパイク誘導IFNγ産生に対する陽性反応者と陰性反応者の間で有意に異なっていました(拡張データ図6e)。しかし、NAb力価の陽性反応者と陰性反応者の間で類似していました(拡張データ図6d)。
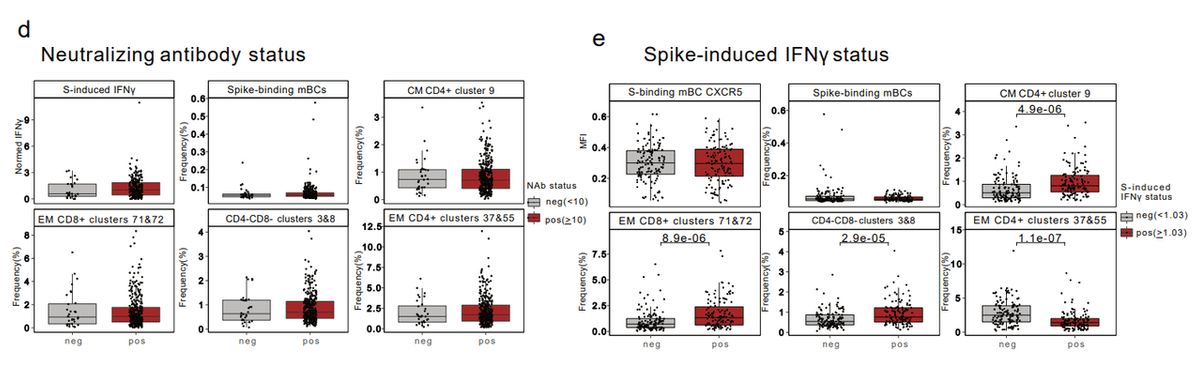
Thus, higher post-vaccination anti-S-RBD IgG levels and lower expression of CD21 and CD38 by spike-binding mBCs were associated with strong humoral neutralizing activity and antigen-specific T cell responses.
したがって、ワクチン接種後の抗 S-RBD IgG レベルの上昇と、スパイク結合 mBC による CD21 および CD38 の発現の低下は、強力な体液性中和活性と抗原特異的 T 細胞応答と関連していました。
We then combined the mBC response markers from Fig. 5c-d and the T cell clusters shown in Extended Data Fig. 6d-e in order to better characterize the specific cellular immune profiles associated with the 16 vaccine regimens.
次に、16 のワクチンレジメンに関連する特定の細胞性免疫プロファイルをよりよく特徴付けるために、図 5c-d の mBC 応答マーカーと拡張データ図 6d-e に示されている T 細胞クラスターを組み合わせました。
K-means clustering resulted in the segregation of five main vaccine regimen signatures (i.e., boost BBIBP, boost mRNA, prime BBIBP, viral vector 1, and viral vector 2) clearly separated through the comparison of 10 parameters (Fig. 5e).
K-means クラスタリングにより、10 個のパラメーターの比較を通じて明確に分離された 5 つの主なワクチン レジメン シグネチャ(ブースト BBIBP、ブースト mRNA、プライム BBIBP、ウイルス ベクター 1、およびウイルス ベクター 2)が分離されました(図 5e)。
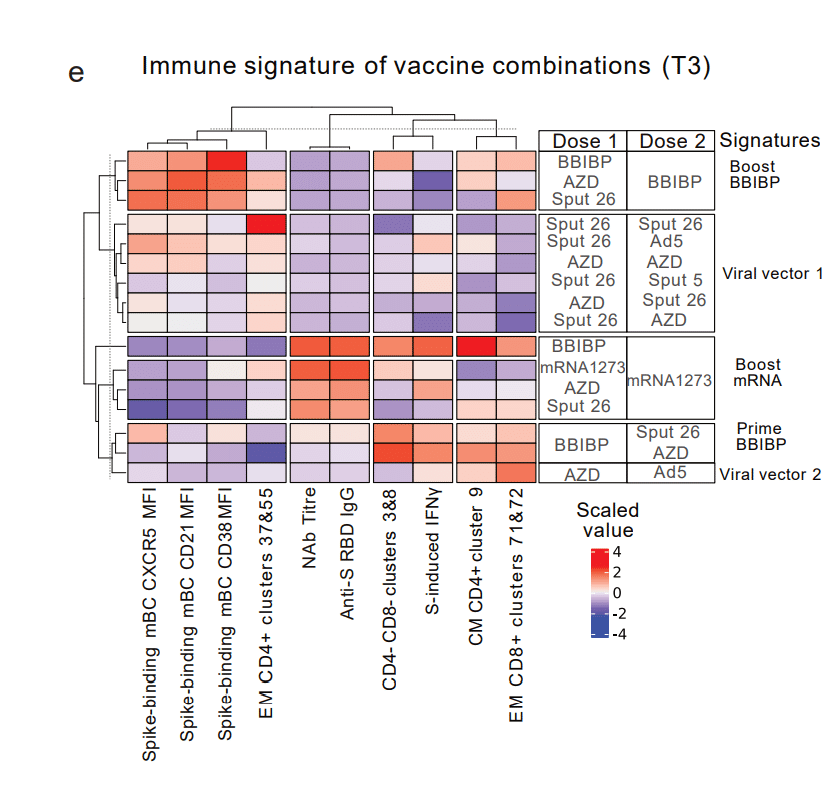
BBIBP/mRNA-1273, which was the most immunogenic combination with regards to both the antibody and T cell responses, presented its own distinct immune signature characterized by spike-binding mBCs with an activated phenotype (low expression of CD21, CD38, and CXCR5), low frequency of T cells in effector memory (EM) CD4+clusters 37&55, and high frequencies of T cells in CD4-/CD8- clusters 3&8, central memory (CM) CD4+ cluster 9, and EM CD8+ clusters 71&72.
抗体と T 細胞応答の両方に関して最も免疫原性の高い組み合わせであるBBIBP/mRNA-1273は、活性化された表現型 (CD21、CD38、および CXCR5 の低発現)を伴うスパイク結合 mBC 、エフェクター メモリー (EM) CD4+ クラスター 37 & 55 の T 細胞の低頻度、および CD4-/CD8- クラスター 3 & 8、セントラル メモリー (CM) CD4+ クラスター 9、および EM CD8+ クラスター 71 & 72 の T 細胞の高頻度を特徴とする独自の明確な免疫シグネチャを示しました。
These analyses also revealed that while BBIBP was the least immunogenic booster vaccine, it elicited the highest expression of CXCR5, CD21, and CD38 on spike-binding mBCs (all shown to be higher in negative NAb titre responders in Fig. 5c).
これらの分析により、BBIBP は免疫原性が最も低いブースター ワクチンである一方で、スパイク結合 mBC で CXCR5、CD21、および CD38 の最高の発現を誘発したことも明らかになりました(図 5c では、NAb 力価が負の応答者でより高いことが示されています)。
These same markers were all expressed with a lower intensity in individuals boosted with mRNA-1273.
これらの同じマーカーはすべて、mRNA-1273 で追加免疫した個人ではより低い強度で発現しました。
Finally, we compared antibody production and cellular immune responses to SARS-CoV-2 among these five groups.
最後に、これら 5 つのグループ間で SARS-CoV-2 に対する抗体産生と細胞性免疫応答を比較しました。
The groups “boost mRNA” and “priming BBIBP” respectively induced the highest humoral and antigen-specific T cell responses (Fig. 5f and Extended Data Table 1).
グループ「ブースト mRNA」および「プライミング BBIBP」は、それぞれ最高の体液性および抗原特異的 T 細胞応答を誘導しました(図 5f および拡張データ表 1)。
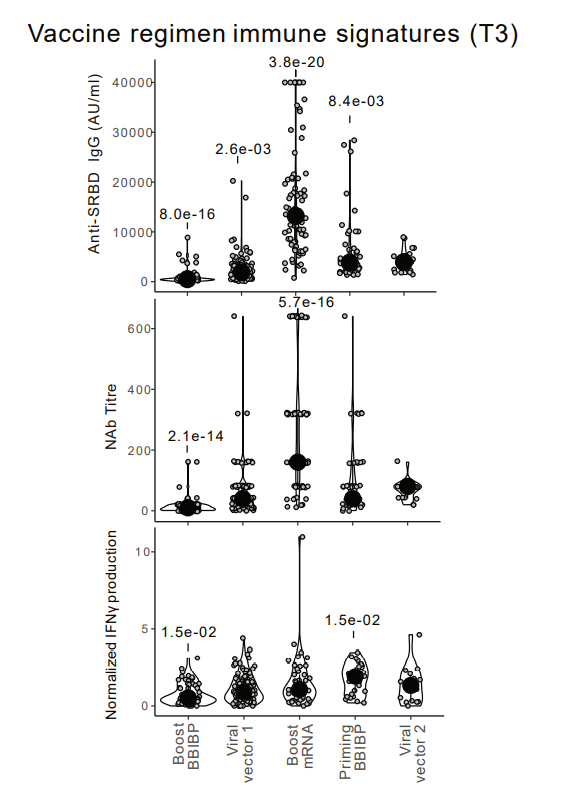
Our analysis thus allows the extraction of vaccine regimen-driven immune signatures, which are linked to immunogenicity.
したがって、私たちの分析により、免疫原性に関連するワクチンレジメン主導の免疫シグネチャの抽出が可能になります。
These results provide insights into the underlying immunological mechanisms of vaccine-induced immune responses.
これらの結果は、ワクチン誘発性免疫応答の根底にある免疫学的メカニズムへの洞察を提供します。
Discussion
The plethora of different COVID-19 vaccines available offer an unprecedented opportunity to study human immune responses to immunization.
利用可能なさまざまな COVID-19 ワクチンは、予防接種に対するヒトの免疫応答を研究する前例のない機会を提供します。
Here, we present the most comprehensive head-to-head immunophenotyping comparison of vaccine protocols to date, covering adenoviral-vector, inactivated virus, and mRNA platforms.
ここでは、アデノウイルスベクター、不活化ウイルス、および mRNA プラットフォームをカバーする、これまでのワクチン プロトコルの最も包括的な 1 対 1 の免疫表現型比較を紹介します。
We show that several heterologous vaccine combinations have similar or superior humoral and cellular immunogenicity compared to homologous regimens.
いくつかの異種ワクチンの組み合わせが、同種のレジメンと比較して、体液性および細胞性免疫原性が類似または優れていることを示しています。
In addition, we classified the 16 vaccine combinations into five distinct groups based on differing humoral and cellular immune signatures induced in vaccinated individuals.
さらに、16 種類のワクチンの組み合わせを、ワクチン接種を受けた個人で誘発される体液性および細胞性免疫の特徴の違いに基づいて、5 つの異なるグループに分類しました。
Our finding that the heterologous regimens AZD/mRNA-1273 and AZD/Ad5 induced stronger humoral and cellular responses compared to AZD/AZD agree with preliminary reports showing improved immunogenicity for AZD when combined with mRNA vaccines (mRNA-1273 or BNT162b2).
異種レジメン AZD/mRNA-1273 および AZD/Ad5 が AZD/AZD と比較してより強い体液性および細胞性応答を誘導したという我々の発見は、mRNA ワクチン (mRNA-1273 または BNT162b2) と組み合わせた場合に AZD の免疫原性が改善されることを示す予備報告と一致しています。
In BBIBP-primed individuals, all heterologous combinations led to stronger immune responses than the homologous regimen.
BBIBP でプライミングされた個人では、すべての異種の組み合わせが、同種のレジメンよりも強力な免疫応答をもたらしました。
These findings corroborate the results of antibody analyses from the complete ECEHeVac cohort (which included three additional centres in Argentina).
これらの調査結果は、完全な ECEHeVac コホート(アルゼンチンの 3 つの追加センターを含む)からの抗体分析の結果を裏付けるものです。
In general, the administration of mRNA-1273 as Dose 2 clearly improved immunogenicity in all assessed conditions.
一般に、用量 2 としての mRNA-1273 の投与は、評価されたすべての条件で免疫原性を明らかに改善しました。
Combinations such as AZD/Ad5, BBIBP/Sput 26, and BBIBP/AZD also proved to be highly immunogenic.
AZD/Ad5、BBIBP/Sput 26、および BBIBP/AZD などの組み合わせも、免疫原性が高いことが証明されました。
Together, these results provide a strong rationale for the superiority of heterologous vaccine regimens against SARS-CoV-2 among non-mRNA based vaccines, suggesting that this strategy could improve the efficiency of vaccination programmes, particularly in regions with limited vaccine supply.
まとめると、これらの結果は、非mRNAベースのワクチンの中で、SARS-CoV-2に対する異種ワクチンレジメンの優位性の強力な根拠を提供します。この戦略は、特にワクチンの供給が限られている地域で、ワクチン接種プログラムの効率を改善できることを示唆しています。
Interestingly, as also observed in other studies, the order of vaccine administration in heterologous regimens also appears to be important – in line with other studies, we observed that BBIBP induced strong immune responses as Dose 1 but not as Dose 2.
興味深いことに、他の研究でも観察されたように、異種レジメンでのワクチン投与の順序も重要であるように思われます。他の研究と一致して、BBIBP は用量 1 として強力な免疫応答を誘発しましたが、用量 2 としては誘発しませんでした。
Spike-binding mBC phenotypes differed among the vaccine combinations; boosting with BBIBP induced a resting phenotype, while boosting with mRNA-1273 led to an activated phenotype.
スパイク結合 mBC 表現型は、ワクチンの組み合わせ間で異なりました; BBIBP によるブーストは休止表現型を誘導しましたが、mRNA-1273 によるブーストは活性化された表現型をもたらしました。
The exact mechanisms underlying these differences in mBC induction remain unclear, but differential interactions between B cells and membrane-bound vs. soluble antigens may be responsible.
mBC誘導におけるこれらの違いの根底にある正確なメカニズムは不明のままですが、B細胞と膜結合抗原と可溶性抗原との間の異なる相互作用が原因である可能性があります。
Furthermore, we found that boosting with BBIBP coincided with the highest proportions of CXCR5hiCXCR3lo mBCs, a phenotype reminiscent of naïve B cells.
さらに、BBIBP によるブーストは、ナイーブ B 細胞を連想させる表現型である CXCR5hiCXCR3lo mBC の割合が最も高いことと一致することがわかりました。
As in our study, Zhang et al. reported a correlation between NAb titres and CXCR3 expression by mBCs in individuals who received an adenovirus-based COVID-19 vaccine.
私たちの研究と同様に、Zhangらは、アデノウイルスベースのCOVID-19ワクチンを受けた個人のmBCによるNAb力価とCXCR3発現との相関関係を報告しました。
mBCs are of particular interest in the context of new SARS-CoV-2 variants, as these cells undergo fewer somatic hypermutations than plasma cells and are potentially more flexible in responding to different viral subtypes.
mBC は、新しい SARS-CoV-2 バリアントとの関連で特に興味深いものです。これらの細胞は形質細胞よりも体細胞超変異が少なく、さまざまなウイルス サブタイプへの応答においてより柔軟である可能性があるからです。
IgM+ mBCs tend to migrate to B cell follicles and re-initiate germinal centre reactions upon rechallenge, thus potentially increasing the breadth of the antibody response; meanwhile, IgG+ mBCs preferentially differentiate into plasma cells to rapidly induce specific antibody production.
IgM+ mBC は B 細胞濾胞に移動し、再チャレンジ時に胚中心反応を再開する傾向があるため、抗体応答の幅が広がる可能性があります。 一方、IgG+ mBC は優先的に形質細胞に分化し、特異的な抗体産生を急速に誘導します。
In our study, IgM-expression of spike-binding mBCs was higher in BBIBP-primed individuals at T3, independent of the booster.
私たちの研究では、T3 時のスパイク結合 mBC の IgM 発現は、ブースターに関係なく、BBIBP でプライミングされた個人でより高かった。
Conversely, priming with the other vaccines resulted in the generation of primarily IgG+ spike-binding mBCs.
逆に、他のワクチンでプライミングすると、主に IgG+ スパイク結合 mBC が生成されました。
In mouse models, rapamycin-induced reduction of germinal centre formation and loss of class switching in B cells led to broader protective antibody response against influenza virus subtypes, and immunization with Dengue virus variant proteins predominantly stimulated IgM+ mBCs.
マウスモデルでは、ラパマイシンが誘導する胚中心形成の減少と B 細胞のクラス切り替えの喪失により、インフルエンザ ウイルス サブタイプに対する防御抗体応答が広がり、デングウイルス変異タンパク質による免疫は主に IgM+ mBC を刺激しました。
In humans, one study showed fewer IgG+ cells among switched (IgD-) S-RBD-specific mBCs and stronger neutralizing activity against SARS-CoV-2 (including viral variants) after heterologous AZD/BNT162b2 compared to homologous BNT162b2/BNT162b2 vaccination.
ヒトでは、1 つの研究で、同種の BNT162b2/BNT162b2 ワクチン接種と比較して、異種 AZD/BNT162b2 ワクチン接種後に、切り替えられた (IgD-) S-RBD 特異的 mBC の中で IgG+ 細胞が少なく、SARS-CoV-2 (ウイルス変異体を含む) に対するより強い中和活性が示されました。
Thus, a vaccine response that induces less IgG switching of mBCs might lead to a broader immune response, increasing immunity against viral variants.
したがって、mBC の IgG スイッチングが少ないワクチン応答は、より広範な免疫応答につながり、ウイルス変異体に対する免疫が増加する可能性があります。
Concordantly, another recent study of homologous vs. heterologous vaccine combinations showed that BBIBP/mRNA-1273 had the highest neutralizing activity against the Omicron variant.
一致して、同種ワクチンと異種ワクチンの組み合わせに関する最近の別の研究では、BBIBP/mRNA-1273 が Omicron バリアントに対して最も高い中和活性を持つことが示されました。
Regarding the induction of spike-specific T cells, priming with BBIBP proved to be an optimal base for a strong IFNγ response.
スパイク特異的 T 細胞の誘導に関しては、BBIBP によるプライミングが、強力な IFNγ 応答の最適な基盤であることが証明されました。
We found two T cell clusters (CD4-/CD8- clusters 3&8) that consistently expanded to a greater extent in the BBIBP-primed groups.
2 つの T 細胞クラスター (CD4-/CD8- クラスター 3&8) が、BBIBP で感作されたグループで一貫してより大きな範囲で拡大していることを発見しました。
These clusters were similar to the canonical and CD4-/CD8- T cell subsets but displayed higher expression of CD27 and CD45RA and lower expression of KLRG1.
これらのクラスターは、正規および CD4-/CD8- T 細胞サブセットと類似していましたが、CD27 および CD45RA の発現が高く、KLRG1 の発現が低かったことが示されました。
While KLRG1hi T cells are generally considered short-lived, it has been shown that KLRG1 can be downregulated (ex-KLRG1), giving rise to multiple memory populations that contribute to an effective antiviral response.
KLRG1hi T 細胞は一般に短命であると考えられていますが、KLRG1 がダウンレギュレートされる可能性があることが示されています (ex-KLRG1)。効果的な抗ウイルス反応に寄与する複数の記憶集団を生み出します。
Of note, our data do not show whether the described T cell clusters are themselves responsible for the observed IFNγ production after stimulation with spike peptides, as the clusters were identified through correlative analyses.
注目すべきは、私たちのデータは、記載されている T 細胞クラスター自体が、スパイク ペプチドによる刺激後に観察された IFNγ 産生の原因であるかどうかを示していません。クラスターは相関分析を通じて特定されたためです。
However, they could nonetheless serve as biomarkers for the cellular response after COVID-19 vaccination.
それでも、COVID-19 ワクチン接種後の細胞応答のバイオマーカーとして機能する可能性があります。
While clinical studies are needed to determine whether the comparatively higher immunogenicity of specific vaccination regimens translates to reliable protection from SARS-CoV-2, the immune signatures described in our study can serve as a guide for vaccine development.
特定のワクチン接種レジメンの比較的高い免疫原性が SARS-CoV-2 からの信頼できる保護につながるかどうかを判断するには臨床研究が必要ですが、私たちの研究で説明されている免疫シグネチャはワクチン開発のガイドとして役立ちます。
It was previously reported that serum antibody titres are not reliable markers of the CD4+ T cell response; however, we observed a significant correlation between anti-S-RBD IgG levels and spike-induced IFNγ production 4 weeks after Dose 2.
血清抗体価は CD4+ T 細胞応答の信頼できるマーカーではないことが以前に報告されました; しかし、用量 2 の 4 週間後、抗 S-RBD IgG レベルとスパイク誘導 IFNγ 産生との間に有意な相関関係が観察されました。
A certain sample size may be needed to detect this relationship, since analysis of individual groups did not reveal such a correlation.
個々のグループの分析ではこのような相関関係が明らかにならないため、この関係を検出するには一定のサンプル サイズが必要になる場合があります。
The usefulness of IgG antibodies as a marker for the cellular response to COVID-19 vaccines might therefore be restricted to larger cohorts and early time points after vaccination.
したがって、COVID-19 ワクチンに対する細胞応答のマーカーとしての IgG 抗体の有用性は、より大きなコホートとワクチン接種後の初期の時点に限定される可能性があります。
A limitation of this study is the difference in time intervals between Doses 1 and 2 for some groups.
この研究の限界は、一部のグループでの投与 1 と 2 の間の時間間隔の違いです。
A 12-week interval was previously shown to induce higher NAb titres, but weaker T cell responses, compared to a 4-week interval for homologous and heterologous combinations of AZD and BNT162b2.
12 週間の間隔は、AZD と BNT162b2 の同種および異種の組み合わせの 4 週間の間隔と比較して、より高い NAb 力価を誘発するが、T 細胞応答はより弱いことが以前に示されました。
Nonetheless, some of the regimens with the shortest dosing intervals in our cohort (e.g., mRNA-1273/mRNA-1273) displayed the highest NAb titres among all the groups, and the intervals were comparable among individuals receiving the same Dose 1.
それにもかかわらず、私たちのコホートで最も投与間隔が短いレジメンのいくつか(mRNA-1273/mRNA-1273 など)は、すべてのグループの中で最高の NAb 力価を示し、間隔は同じ投与 1 を受けた個人間で同等でした。
Additionally, we did not evaluate the real-world efficacy of the different vaccine combinations and the persistence of their immune responses over time.
さらに、さまざまなワクチンの組み合わせの実際の有効性と、経時的な免疫応答の持続性を評価しませんでした。
As many of the heterologous prime-boost regimens we investigated had not been previously studied in detail, these results considerably expand our understanding of the most potent combinations of COVID-19 vaccines and provide guidance for the design of clinical trials measuring the effectiveness of these heterologous regimens.
私たちが調査した異種のプライムブーストレジメンの多くは、これまで詳細に研究されていなかったため、これらの結果は、COVID-19 ワクチンの最も強力な組み合わせについての理解を大幅に広げ、これらの異種レジメンの有効性を測定する臨床試験の設計に関するガイダンスを提供します。
In addition, the identified immune signatures of the most successful vaccine protocols may be highly valuable not only for the development and testing of COVID-19 vaccines but also for the future design, selection, and deployment of vaccines against other important diseases as well as cancer.
さらに、最も成功したワクチン プロトコルの特定された免疫シグネチャは、COVID-19 ワクチンの開発とテストだけでなく、他の重要な疾患や癌に対するワクチンの将来の設計、選択、展開にとっても非常に価値がある可能性があります。
以下省略。
