鏡の中の生物学
生命は普遍的にL-アミノ酸とD-核酸(DNA、RNA)のみを用いていることが知られており、ルイス・パスツールが分子キラリティーを発見以後160年間、自然界でこれらと異なる鏡像体を用いた生命はみつかっていない。これは生命が単一起源から進化してきたことを示す一つの証拠にもなっている。
人工的なD-アミノ酸とL-核酸で構成される、鏡の中の(ミラーイメージの)分子生物学におけるセントラルドグマの達成は挑戦的であるが、合成生物学的ロマンがある。ミラーイメージDNA複製、DNAからRNAへの転写、RNAからDNAへの逆転写は既に達成されており、ミラーイメージセントラルドグマの完成のために、ミラーイメージ翻訳の達成が待たれていた。
本研究ではスプリットタンパク質の結合とイソロイシン置換を組み合わせて100kDaのミラーイメージT7RNAポリメラーゼを作製し、高精度で長いL体RNAを素早く転写できることを示した。これにより、ミラーイメージ翻訳の重要な構成要素となるL体rRNAを合成することができた。
Xu, Yuan, and Ting F. Zhu. "Mirror-image T7 transcription of chirally inverted ribosomal and functional RNAs." Science 378.6618 (2022): 405-412.
DOI: 10.1126/science.abm0646
Results
図1では、T7-RNAポリメラーゼのL体(自然界に存在)とD体(ミラーイメージ)について述べられている。D-T7-RNAポリメラーゼは、L-DNAからL-RNAへの効率的で高精度な転写によるミラーイメージrRNAの合成に必要な要素である(図1A)。自然界に存在するT7-RNAポリメラーゼ(883アミノ残基)とその鏡像異性体を化学合成(約400残基が限界)するために、タンパクを3つに分割した(図1B)。SDSページ法を用いてタンパク質を泳動し、T7-RNAポリメラーゼを3分割したタンパク質断片と同じ長さのタンパク質断片を化学合成できていることを確かめた(図1C)。ここでは、分割しても自発的に元の構造をとり、活性が落ちないような部位を探してタンパク質の分割を行っている。
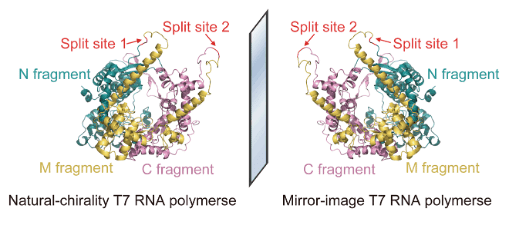
本文図1Bに対応
図2、3ではミラーイメージ(D体)T7-RNAポリメラーゼがミラーイメージ(L体)RNAを転写できることが示されている。自然界に存在するものとミラーイメージT7-RNAポリメラーゼで5S, 16S, 23SrRNAの転写を行い電気泳動にかけると、それぞれ意図したとおりの塩基長のRNAを精製でき、数千キロ塩基にわたる転写が可能であることが分かった。また、自然界に存在するRNA分解酵素で分解を試みると、ミラーイメージT7-RNAポリメラーゼで転写したL体RNAは分解されにくいことが分かった(図3C)。これは、ミラーイメージリボソーム(図3D)はRNA分解酵素への耐性があるため、一般的なリボソームよりも組み立てが容易であることを示唆している。
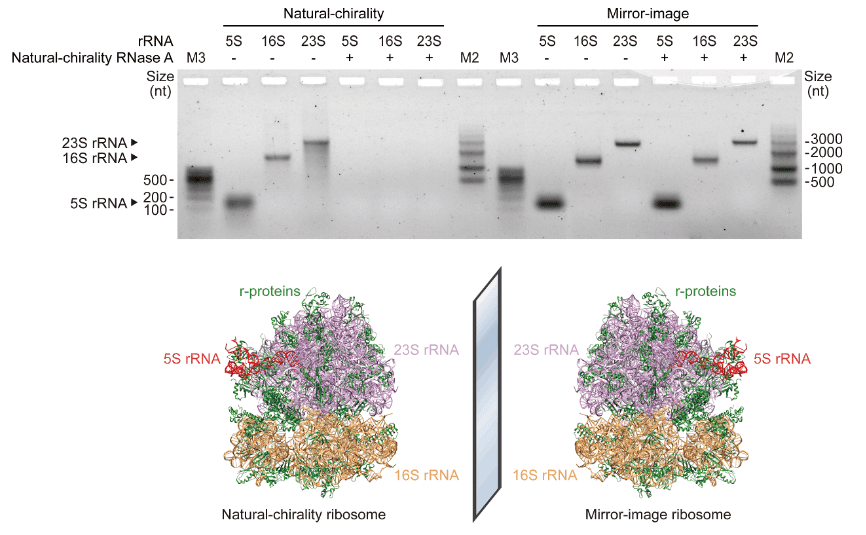
本文図3C、Dに対応
図4では、細胞内の生化学系と直交する人工反応系としての応用例として、リボスイッチセンサーが挙げられている。グアニンアプタマーとスピナッチアプタマーを結合させることで、グアニンの結合が構造変化を誘導し、DFHBIの結合と蛍光を可能にするミラーイメージリボスイッチを設計した (図4A)。ここで、グアニンとDFHBIは共に光学不活性である。D体とL体のリボスイッチ両方ともにグアニンを添加した場合特異的に蛍光が見られた(図4C)。この蛍光の持続時間を調べてみると、ミラーイメージリボスイッチは自然界に存在するものよりも安定で長時間蛍光を発することが分かった(図4D)。これは自然界のリボスイッチはRNA分解酵素感受性で、ミラーイメージリボスイッチはRNA分解酵素耐性があるためではないかとディスカッションされているが、図4DではRNA分解酵素阻害剤を入れた場合でも、入れていない場合と同程度D体リボスイッチが分解されているので、まだ検証の余地がありそうである。
そのほかのT7-RNAポリメラーゼの応用として、図5では転写された長鎖L体RNAの安定性が、図6ではL体リボザイムに触媒されたL体RNAの伸長が調べられている。
Discussion
今回の結果で示されたように、L体のRNAはRNA分解酵素による分解を受けず安定なため、生化学実験、情報保持、医学応用などの面で使用できる可能性がある。また、ミラーイメージセントラルドグマを完成させるためにはミラーイメージリボソームの合成が必要だが、今回合成したrRNAに修飾を入れて異なる塩基に変換する部分が現状困難なようだ。
鏡の中のセントラルドグマが達成できれば、原理上現存するすべての生物の生化学的反応系と直交する反応系を構築することができ、夢が膨らむ。実験的にD体タンパク質のみで構成される酵素反応系を細胞に導入した場合、それが似たような細胞に内在する基質と反応してしまうオフターゲット効果のような現象が起きる心配をする必要がない。また、新たな抗生物質を発見しても、速やかにそれを分解するなどにより多くの場合抗生物質耐性が細菌側に生じてしまうことが知られているが、D体タンパク質で構成された抗生物質の場合生化学的な反応によって分解されてしまうようなことは原理的に起きない。(そもそも光学不活性な場合を除いて内在の生化学系にアクセスできないため、そのような抗生物質を作れるかが疑問だが…)
生命はL-アミノ酸とD-核酸のみを使用し、ミラーイメージ体を使用した生命は見つかっていない。研究ではミラーイメージT7RNAポリメラーゼを作成し、L体RNAを転写できることを示した。ミラーイメージセントラルドグマの達成により、反応系の直交性や新たな抗生物質の開発が可能になる。
サムネイル画像の出典:https://www.science.org/doi/10.1126/science.abm0646