エラストマー製輸液ポンプにおけるベンジルペニシリンカリウムおよびアンピシリンの安定性はどうか?
今日は、日本化学療法学会に参加をしいます。
あるシンポジウムのある演者の先生が発表されていたスライドで提示されていた論文の内容に興味があり、論文を読んでみました。
主な内容としては、ペニシリンGやアンピシリンがどの輸液でどういう条件で安定なのかという内容です。
論文の導入部分にも記載されていますが、感染性心内膜炎、骨髄炎、膿瘍などでは、一般的に、長期間の治療が必要になります。点滴加療が必要な状態であれば、長期間入院が必要です。
しかし、患者さんのQOL、医療費のことを考えると、外来治療ができることが望ましいです。
実際、千葉県にある、亀田総合病院では、外来での点滴加療を行っているようです(下記リンクの記事、論文参照)
今回読んだ論文は、外来で非経口抗菌薬で、患者さんの治療を行うための情報としては非常に重要です。また、入院患者においても、これらの薬剤で安定性があるなら、感染性心内膜炎(IE)の治療時はPCG、ABPCなどでは、1日6回投与ということもあり、医療スタッフ (主に看護師)の負担、患者自身のストレス (頻回に医療スタッフが夜間含めて訪問する)などを解消できるかもしれません。
そういう意味で、このような報告は非常に重要かと思いますし、内容をみなさんが知っておくべきかと思います。
では、本論文の和訳を示していきます。
Nakamura T, Enoki Y, Uno S, et al. Stability of benzylpenicillin potassium and ampicillin in an elastomeric infusion pump. J Infect Chemother. 2018;24(10):856-859. doi:10.1016/j.jiac.2018.04.003
感染性心内膜炎、骨髄炎、膿瘍などの感染症の中には、長期間の静脈内抗菌薬による治療が必要なものがあります。そのため、治療を受けるために入院が必要となり、患者のQOLが低下する。これらの問題点を克服するためにも、日本では持続的輸液ポンプによる外来非経口抗菌薬治療(OPAT)の確立が望まれている。しかし,輸液に溶解した抗菌薬の24時間安定性は不明である。そこで本研究では,5種類の輸液に溶解した抗菌薬の24時間安定性を臨床現場で検討した。ベンジルペニシリンカリウム(PCG)とアンピシリン(ABPC)を5種類の輸液に別々に溶解し,25または31.1℃で24時間保存した。酢酸リンゲル液に溶解したPCGは、25及び31.1℃の温度で24時間安定であった(それぞれ101.7±1.4%及び92.9±1.3%)。また、31.1℃で24時間経過しても、PCG溶液はエラストマー輸液ポンプに吸着しなかった。また、酢酸リンゲル液に溶解したPCGは、4℃でエラストマー輸液ポンプに保持した後、10日間安定であった(99.7±0.5%)。ABPCは、試験したすべての輸液および温度で不安定であった。我々の結果に基づいて、酢酸リンゲル液中のPCGは、連続注入ポンプを備えたOPATで使用することができる。
外来非経口抗菌薬治療(OPAT)は、外来患者の在宅で行うことができる静脈内抗菌薬治療の投与である。1974年に初めて報告されて以来、いくつかの国で定着しており、頻繁に使用されている[1]。2004年には米国感染症学会(IDSA)によりOPATのガイドラインが発表され、世界中で使用されている[2, 3]。OPATは入院による医療費の削減やQOLの向上につながることから有用とされている[4,5]。しかし、日本では、装置の健康保険適用が不十分であること、薬剤の安定性に関する情報が不十分であること[6]、医療支援体制が整っていないことなどの問題があるため、OPATは広く実施されていない。OPATのモデルとしては、1)病院の外来・診療所での実施、2)患者の自宅での医療従事者による投与、3)患者の自宅での自己投与またはOPATスタッフによる訓練後の介護者による投与などが考えられる[7]。各OPATモデルでは、静脈アクセス装置および持続的輸液ポンプシステム(シリンジポンプ、機械式ポンプ、またはエラストマー輸液ポンプ)が必要である。エラストマー輸液ポンプは、オーストラリアやシンガポールでOPATに頻繁に使用されており[4, 8]、他のポンプシステムに比べて比較的便利で経済的である。また、エラストマー輸液ポンプによる投与は、より簡単に行うことができる。Haseらは、日本ではエラストマー輸液ポンプとケアアテンダントサービスを組み合わせることでOPATの使用が容易になる可能性があると報告している[5]。しかし、薬剤の安定性に関する情報の明確化の必要性も強調していた。OPATは、長期の抗菌化学療法を必要とする軟部組織感染症、骨髄炎、感染性心内膜炎(IE)、または膿瘍の治療に使用される[2、3、9]。しかし、OPATで使用できる抗菌薬は、水溶液中での安定性のために限られている。ベンジルペニシリンカリウム(PCG)およびアンピシリン(ABPC)を除くほとんどのβ-ラクタム系抗菌薬は安定であり、OPATでの使用が認められている[9]。しかし、セファロスポリン系やカルバペネム系のスペクトルが広いため、Streptococcus viridansやStreptococcus bovisに起因することが多いIEなどの感染症の治療には適していない[10]。したがって、PCGやABPCを使用した輸液ポンプでOPATを確立することは、より良い抗菌薬のスチュワードシップを促進する可能性がある。しかし、これらは溶液中での安定性が不明であるため、OPATには使用されていない。また、抗菌剤は製造国によって賦形剤の含有量が異なる。外国産に比べて国内産のPCGは緩衝剤が含まれておらず、水溶液中での安定性が不安定であると考えられる。そのため,外国で製造された抗菌薬の安定性データは,日本では適用できない可能性がある。PCGとABPCの安定性は,先行研究に基づいて4℃と25℃で試験されている[9]が,臨床現場では,これらの試験で検討された温度よりも高い温度での試験が行われている[9]。温度を上げると抗菌薬の分解が促進される可能性がある。そのため,日本の臨床現場に即した薬剤の安定性に関する情報が必要である。
本研究の目的は、日本で製造されているβ-ラクタム系、抗菌薬、すなわちPCGおよびABPCの保存下(4℃)および投与時(25℃、31.1℃)における安定性を明らかにすることであった。
PCGとABPCの標準品とリン酸は、和光純薬工業株式会社(大阪府)から購入したから。注射用PCG(ペニシリンGカリウム)およびABPCは明治製菓株式会社(東京都)から購入した。アセトニトリルは関東化学株式会社(東京、日本)から購入した。東京、日本)から購入した。リン酸二水素ナトリウム二水和物及びリン酸二水素カリウム二水和物は、ナカライテスク株式会社(京都市)から購入した。酢酸リンゲル液 (ヴィーンFらしい)は、興和ファルマ株式会社(東京、日本)から購入した。生理食塩水、5%ブドウ糖液は大塚製薬(株)より購入した。塩化カリウムを含まないブドウ糖電解質溶液 (ソルデム1らしい)はテルモ株式会社(東京)より購入した。テルモ社(東京、日本)より塩化カリウム入りブドウ糖電解液(ソルデム3らしい)を購入した。バクスターインフューザーLV10は、Baxter International Inc. 米国イリノイ州)から購入した。
バクスター・インフューザーLV10ポンプは、10mL/hで溶液を排出するエラストマー製の輸液ポンプで、240mLまでの容量に対応している。感染性心内膜炎治療のための科学的根拠によると、IE治療におけるPCGの投与量は2,400万単位、ABPCの投与量は12g/日とされている[11]。したがって、PCGおよびABPCの最大濃度は、それぞれ10万単位/mLおよび0.05g/mLと決定された。エラストマー輸液ポンプは31.1℃で機能するように設計されているため、これらの抗菌剤の25℃および31.1℃での安定性を調査した。これらの抗菌剤を5種類の輸液に溶解し、ポリプロピレン製遠心管に入れて25℃または31.1℃で保存した。0、1、2、4、6、8、および24時間におけるPCGおよびABPCの残留比をHPLCにより決定した。
エラストマー輸液ポンプ中でのPCGの24時間安定性を決定するために、PCGを酢酸リンゲル液に溶解し、エラストマー輸液ポンプ中で31.1℃で24時間保持した。PCGの残留率をHPLCで測定した。また、PCGを酢酸リンゲル液に溶解し、エラストマー輸液ポンプ中で4℃に保持した。0日、1日、3日、5日、7日、10日におけるPCGの残存率をHPLCにより測定した。
PCGおよびABPCの濃度は、以前に記載されているように、HPLCによって測定した[12、13]。PCGとABPCの標準物質は希釈水に溶解した。PCGとABPCは5種類の輸液に別々に溶解し、HPLCで測定する前に任意の温度と時間で保存した。HPLCシステムは、HITACHI L-7100ポンプ、HITACHI L-7300カラムオーブン、HITACHI L-4200 UV検出器から構成されています。固定相には、TSK-GEL ODS-80TM カラム(4.6 mm × 250 mm, 5 μm, 東ソー株式会社, 東京, 日本)を用いた。移動相は、PCGは100mMリン酸緩衝液(pH3.0)-アセトニトリル(65:35, v/v)、ABPCは10mMリン酸カリウム(pH4.7)-アセトニトリル(85:15, v/v)から構成されていた。流量は1.0 mL/minとした。検出波長は、PCGは210nm、ABPCは219nmであった。
酢酸リンゲル液中の溶存PCGは、24時間後も25℃および31.1℃で安定であった(それぞれ101.7±1.4%および92.9±1.3%)(図1AおよびC)。24時間後および25℃では、生理食塩水、5%ブドウ糖水溶液、塩化カリウムを含まないブドウ糖電解液、塩化カリウムを含むブドウ糖電解液におけるPCGの残留比は、それぞれ52.1±0.8、56.6±1.0、83.0±1.2、および84.6±1.1%であった(図1A)。さらに、31.1℃において、生理食塩水、5%ブドウ糖水溶液、塩化カリウムを含まないブドウ糖電解液、塩化カリウムを含むブドウ糖電解液に溶解したPCGの安定性は、それぞれ11.4±0.3、13.6±0.0、46.8±1.1、48.6±0.9であった(図1C)。25および31.1℃では、PCGを添加すると、これらの溶液のpHは直ちに低下したが、この低下は酢酸リンゲル液ではあまり顕著ではなかった(図1BおよびD)。
下記図1
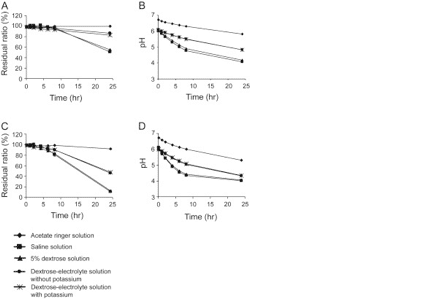
エラストマー輸液ポンプ中のPCGの31.1℃での24時間後の安定性およびpHは、それぞれ91.6±0.8%、5.3±0.03であった。また、4℃で10日後の酢酸リンゲル液に溶解したPCGの残留率は99.7±0.5%であった(図2A)。また、4℃で10日後のPCGアセテートリンガー溶液のpHはわずかに低下した(0日目6.8±0.05、10日目5.9±0.02)(図2B)。
下記図2

ABPCの残留比は、25および31.1℃の温度で90%以下に低下した(図3AおよびC)。25℃で24時間後の酢酸リンゲル液及び生理食塩水に溶解したABPCの残留比は、他の溶液(酢酸リンガー溶液78.5±0.9%、生理食塩水77.8±1.5%、5%ブドウ糖溶液44.4±0.6%、塩化カリウムを含まないブドウ糖電解液53.9±1.0%、塩化カリウムを含むブドウ糖電解液53.2±1.0%)と比較して高かった。31.1℃で24時間後のABPCの残留比は、25℃での残留比よりも低かった(アセテートリンガー溶液、72.6±0.9%、生理食塩水、73.2±1.6%、5%ブドウ糖溶液、36.2±0.5%、塩化カリウムを含まないブドウ糖電解液、46.6±0.1%、塩化カリウムを含むブドウ糖電解液、47.1±1.2%)。各ABPC溶液のpHは、ABPC溶解後に上昇(pH9.0〜9.3)し、その後わずかに低下した(図3B、D)。各溶液のpHの変化には目立った差は見られなかった(図3B、D)。

日本では外来患者に対するセフトリアキソンなどの抗菌化学療法が行われているが、OPATはそれほど広く行われていない[5]。オーストラリアやシンガポールでは、OPATは連続注入ポンプを用いて臨床現場で実施されている[4, 8]。Haseらは、日本ではOPAT用のエラストマー製輸液ポンプが有用である可能性があると報告している。さらに、β-ラクタム類の薬物動態や薬力学に基づいて、連続注入の方が臨床での使用に適している可能性がある。β-ラクタム系薬剤の有効性は,最小阻害濃度以上の時間に依存する。また,β-ラクタムの血清中濃度は,持続的に注入することで維持される可能性があると考えられた。今後,抗菌薬の安定性については,エラストマー製輸液ポンプを用いたOPATの国内での普及に向けて,さらなるデータの蓄積が必要である。
水溶液中に溶解した抗菌薬の安定性は温度に影響される[6]。その安定性については多くの報告があるが[6, 9]、4~25℃の温度でしか試験されていない。輸液装置は患者の体の近くに運ばれるため、体温や衣服による断熱材の影響を受け、溶液温度の上昇を引き起こす可能性があります。バクスターLV10はOPATに広く使用されているが、31.1℃で機能するように設計されている。したがって、臨床で使用するためには31.1℃での安定性データを明らかにすることが重要である。また、ポリプロピレンチューブとエラストマー輸液ポンプの31.1℃におけるPCGの残留率の結果から、PCGはエラストマー輸液ポンプに吸着しなかった。
この結果から、PCGは酢酸リンゲル液に溶解しても安定であった。ペニシリンGカリウムの添付文書によると、PCGは酸性溶液中や糖類などの還元剤によって容易に分解されるとのことだが、酢酸リンゲル液以外の溶液では、PCGを添加するとすぐにpHが低下する。我々の結果では、酢酸リンゲル液を除く他の輸液は、PCGを添加すると直ちにpHが低下した。他の輸液と比較して、酢酸リンゲル液には緩衝剤として働く酢酸が含まれている。ペニシリンGカリウムの添付文書によると、乳酸緩衝液に溶解したPCGの残留割合は、緩衝剤を含まない他の輸液に比べて安定である。試験した溶液のうち、糖であるデキストロースの濃度は、他のものと比較して酢酸リンガー(0.6%)が低かった(5%デキストロース溶液、5%;塩化カリウムを含まないデキストロース電解質溶液、2.6%;デキストロース電解質溶液) 塩化カリウムを含む、2.7%)。
対照的に、ABPCはこの研究で試験したどの輸液でも安定ではなかった。ABPC溶液は、約pH6.0で最も安定であり、アルカリ溶液中で急速に分解される[14]。我々の結果に基づいて、様々なABPC溶液の初期pHは9.31から9.53の間であった。ABPCの分解率はブドウ糖濃度に比例するため、ブドウ糖濃度の高い溶液では分解が促進される。したがって、水溶液中でのABPCの安定性特性は、本研究で得られたABPCの残留比と一致している。以前、Maherらは、生理食塩水に溶解したABPCにリン酸ナトリウムを注入することで安定性が向上することを報告している[15]。注入用リン酸ナトリウムのpHは6.2~6.8であり、緩衝剤としても働く。したがって、緩衝剤を添加することで輸液を最適化することができる。ABPCの安定性を向上させるためには、さらなる研究が必要である。
結論として、日本で製造されたPCGは、酢酸リンゲル液に溶解しても24時間安定であり、エラストマー輸液ポンプを用いたOPATに使用できる可能性がある。
いいなと思ったら応援しよう!

