製薬R&Dのサービス化&外部化と臨床薬理屋の「成立」
こんにちは!田中@臨床薬理屋です。
このnoteを始めて以来、僕は自身の仕事を「臨床薬理屋」と称していますが、「臨床薬理屋」の「屋」は、八百屋の「屋」、よろず屋の「屋」、電気屋の「屋」で、何かを売る人の意味です。電気屋さんは家電メーカーのことではなく家電小売サービスを行うお店のことですが、僕自身も自身の専門である臨床薬理をサービスとして売ることによって当面の生計を立てようとしているというのは、前回の記事「なぜ製薬会社キャリアから降りたのか:"独立系"臨床薬理コンサルタントキャリアを選んだ理由
」を読んでいただけるとわかるかと思います。
さて、今回はこの「臨床薬理屋」という職種がなぜ成り立つようになったのか、私見を交えて、というかほぼ私見をお話ししたいと思います。僕は現在35歳で医薬品開発の経験はたった10年ですが、かつての日本社会では、経験たった10年のペーペーが大手製薬会社のキャリアをやめて、よくわからない小さな会社でコンサルをやってますなんて状況は生まれなかったと思います。僕が臨床薬理屋としてやっていける(別に独立開業しているわけではありませんが)ようになったのは、外部環境の変化によるところが大きいのです。
製造業のサービス化・製薬産業のサービス化
IBMが自らの業態を製造業からサービス業に転換することを宣言してからもうすぐ20年というタイミングになると思うのですが、日本の製造業にもサービス化という概念が広がってきたらしく、東芝がサービスをメインビジネスとすることを宣言したりしています。メインビジネスとは言わないまでも、トヨタがKINTOを始めたりしているのも傾向としては同じです。欧米から20年遅れで日本の製造業もようやく転換期を迎えたということで、これでようやく「失われた20年」にも終止符が打てるのでしょうか…。
ザ・製造業である日本の製薬会社にもそういった潮流の変化が訪れています。このあいだ塩野義製薬がHaaS、ヘルスケア・アズ・ア・サービスという概念を提示していましたが、やはり同じ潮流がここにもあるのだと思います(中身は知りませんが…)。
製薬産業の外部化:研究開発オペレーションのCROへの外注
実は、製薬業界というのは、実は昔から研究開発業務を外部化してきた業界です。通常企業の研究開発業務というのは企業秘密ですからあまり外部化しないことの方が普通だと思いますが、製薬産業はそうでもないのです。
研究開発業務を完全に外出しするわけではありません。医薬品の研究開発業務の一部には「労働集約的」な部分が存在し、またその実施にはある程度の技術が必要とはされるものの、企業秘密の実質的な公開はなくとも外出しできるためです。要は研究開発業務の中のオペレーション部分が外に出されるのですが、医薬品の研究開発業務には多くのオペレーション部分が含まれているということになります。
医薬品の研究開発業務は、世界共通で法律にがんじがらめにされている部分があります。研究開発を行うにも守らなくてはならない規制規則がたくさんあり、つまりそれが研究開発業務におけるオペレーション部分に該当します。企業としては積極的ににやりたいことではないことでも、法の規制でやらなくてはいけない業務、外注したくなります。外注することは法的に認められており、その業務の委託先のことを一般にCROと呼ぶわけです。
製薬産業の外部化:オープンイノベーションの名の下に
ところが、ここまで話したのはあくまで「昔から行われてきた外部化」の話ですが、このセクションの主題ではありません。製薬産業の外部化は「オープンイノベーション」の名の下に、もっと大胆な形で進みました。
医薬品開発に成功して医薬品として承認されて初めてその化合物に価値が付いた時代もあったのではないかと思われますが、今では医薬品開発の過程はほぼオープンなので、化合物が発見された時点ですでに価値が評価できる、すなわち価格が付くようになりました。非臨床毒性試験をクリアし、健康成人試験をクリアし、POCが証明され、Phase3試験に成功し、という段階を踏むことで医薬品開発の成功確率は上がりますので、それだけ価格が段階的に高くなります。また、開発化合物のポートフォリオとも言うべき企業の開発パイプラインは会社の価値そのものですので、最近はMA活動としてむしろ会社の方から積極的に情報を公開していることも多いですし、化合物あるいは企業が積極的に売りに出ているケースもあります。
一方、患者がたくさんいて開発に成功すればジャンジャン売れるような生活習慣病のような疾患に向けた医薬品はほぼ開発し尽くされてしまい、今は患者が少ない治療法も確立していない、下手したら診断すら怪しい疾患ばかりが残ってしまい、医薬品開発の難度が以前に比べてかなり増しています。一発逆転の大博打を打つことはもはやほぼ不可能で、当たっても小さな花火が上がる程度、医薬品開発の初期段階に大きなリスクやコストを許容できる時代ではなくなってしまいました。
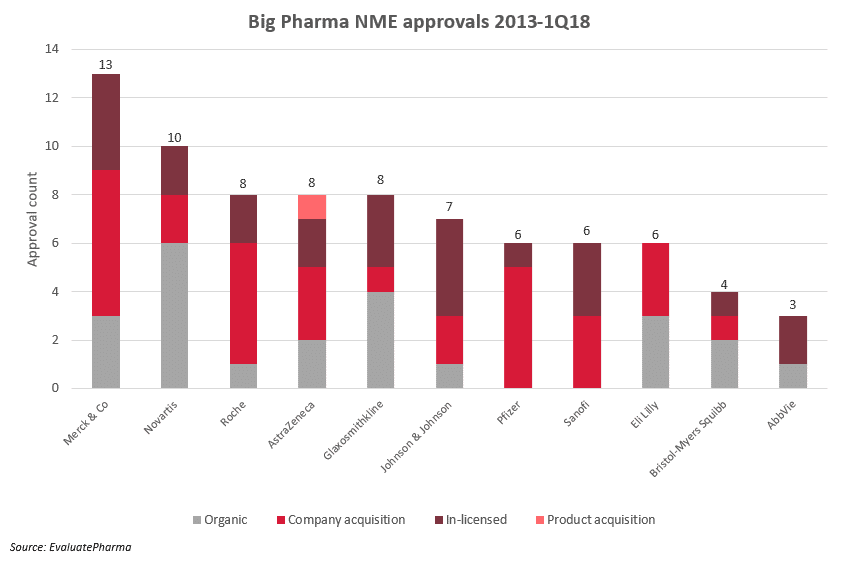
医薬品の発見の部分は創薬の基盤技術を持っている専門の会社にまかせ、失敗確率の高い初期の医薬品開発は貪欲な成功体験を求めるバイオベンチャー起業家に任せ、自分達はある程度成功確率が高い化合物を市場から購入し、最後の仕上げを行って自社のグローバル販売網で手広く売りまくる「医薬品商社モデル」が、今のグローバル製薬産業の中心になっているように思います(下図、出典はリンク先)。
日本は出遅れていますが、世界における医薬品開発のエコシステムは明らかに変化しました。医薬品のPOC以後の開発と販売を担う「医薬品商社」化し、最終段階でかかる莫大な研究開発費は自らの資金を投資します。化合物のPOCまでを担うのはバイオベンチャーであり、その開発資金はVC等のリスクマネーにより賄われ、化合物のライセンスアウトや買収によって投資家が利益を享受する仕組みです。稀少疾患の医薬品開発の場合は販売規模の小ささから「医薬品商社」があまり興味を持たないため、開発の最終段階がそれほど大規模にならず、また成功確率が高いと期待される場合には、ライセンスアウトせずにそのまま医薬品開発を完遂、バイオベンチャーが自ら販売するパターンもあり得ます。
製薬産業のオープンイノベーションの実態としては、製薬会社の一部業務の外部化にはとどまらず、もはや製薬企業の原型をとどめない形になっています。製薬産業のR&Dは「医薬品商社」を頂点とした広大なサプライチェーン(エコシステム)を形成しており、医薬品候補の化合物はバイオベンチャーにより、その初期開発資金はVCなどにより提供されている構造になっています。このピラミッド構造を前提とすると、「医薬品商社」には目利きの能力こそ必要あれど、「研究」機能も「開発」機能も内部には必要なくなります。これらの機能はCROが提供できるため、CROも研究開発機能を提供する主体として、この巨大なサプライチェーン(エコシステム)に取り込まれる結果となりました。武田薬品などは、このエコシステムを自ら積極的に構築するべく(もちろんリストラの意味合いも大きかったのですが)、湘南に建設した研究所を利用開始からものの数年で外部テナントに解放してしまい、湘南イノベーションパークという名で、エコシステム・サプライチェーンに組み込まれるプレーヤーを物理的に一カ所に集めて、仮想の研究拠点っぽくしているわけです。
医薬品開発はもはやサービス業として製薬業とは区別される産業
かつて医薬品開発は製薬企業の独占技術だったのですが、医薬品商社に医薬品開発の機能はもはや多くは必要なく、少数の歴戦の精鋭達を幹部として目利きを担当させればいいだけです。初期開発を担うバイオベンチャーは最低限の社内メンバー構成で、R&Dオペレーション機能はもちろんのこと、高度に細分化された研究開発専門機能を全部内部リソースとして持ちきることは不可能なので、製薬企業の外部に医薬品開発の専門サービスを提供を求めるようになります。
CROはかつてはオペレーションのみを担い、司令塔としての機能は製薬企業の内部の開発専門家が担いましたが、バイオベンチャーが初期の臨床開発を担う割合が増加し、医薬品開発専門性の需要が増加したことから、CROがその司令塔機能を担うためにCRO内部機能を拡充し、バイオベンチャーからの医薬品開発の全面受託を可能にします。すると大手製薬会社の医薬品商社化に伴う内部リソースの整理・効率化の観点から、大手製薬会社も内部医薬品開発リソースを外部化し、CROがその受け皿となって大手製薬会社の医薬品開発も全面受託するようになる、そういった産業構造の変化が欧米でおきたわけです。医薬品開発の機能は製薬会社内の機能ではなくなり、製薬会社を顧客として、医薬品開発の専門性を持ったCROがサービスを提供する一つの独立したサービス業として成立するようになったわけです。
前回の記事で「衝撃のリストラ」として、某大手製薬会社から出ることになった話を書きましたが、ここまで書いた文脈からすると、衝撃でもなんでもない「当然のリストラ」ということになります。(本当は「衝撃」部分はここではないのですが。)これは、欧米の製薬会社出身の経営陣に経営を任せた某大手内資系製薬会社が、その欧米で起きた産業構造の変化を日本でも再現しようとしたことに、結果的に僕が巻き込まれたということになります。
この変化が日本の他の製薬企業でも今すぐに起こるとは私はあまり思っていませんし、そんな意思決定を日本の製薬会社が簡単にできるとも思えません。ただ、日本の(新薬)製薬産業については皆さんご存知の通り内需は衰退の一方なので、海外の需要が取り込めない製薬会社の経営環境は今後苦しくなる一方ですが、先ほど出した某大手内資系製薬会社のケースのように、外部化したい余剰リソースの引き取り手となるCROがあるのかという問題もありますので、このモデルでの構造転換で生き残りを図るのは難しいでしょうね。
日本の製薬産業の構造はこのままでよいのか?
日本ではこの産業構造転換は進んでいません。某大手内資系製薬会社がそれを図りましたが後が続かないので、このモデル自体は結局うまくいかないかもしれません。医薬品開発の専門性を持っていたとしても、それ相応の仕事の委託がないのであればただの宝の持ち腐れで、逆にCROにとってそのリソースの保有は経営の負担になるだけです。
その真っ只中に僕は放り出されたのですが、僕は今のところ仕事に困っていません。所属する会社の顧客は基本的に海外のバイオベンチャーなので、その営業ルートさえ確保されていれば、海外からの仕事で生業を続けることができます。
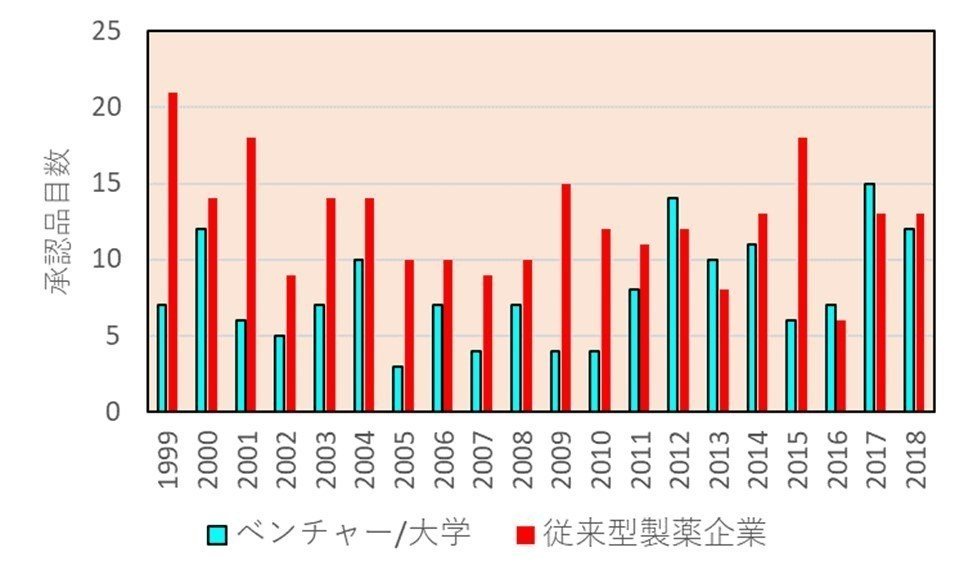
それはなぜか?世界で発売される新薬のうち日本発の新薬の割合は20%を切ります(下図、出典はリンク先)。最近は増えているようにも見えますが、拡大傾向が続くとは到底思えません。
というのは、これまでも述べてきたように、新薬のオリジネーターは製薬会社からバイオベンチャーに移ってきています。下図(出典はリンク先)は新薬のオリジネーターの推移ですが、年々ベンチャーの比率が上がってきていることがわかります。
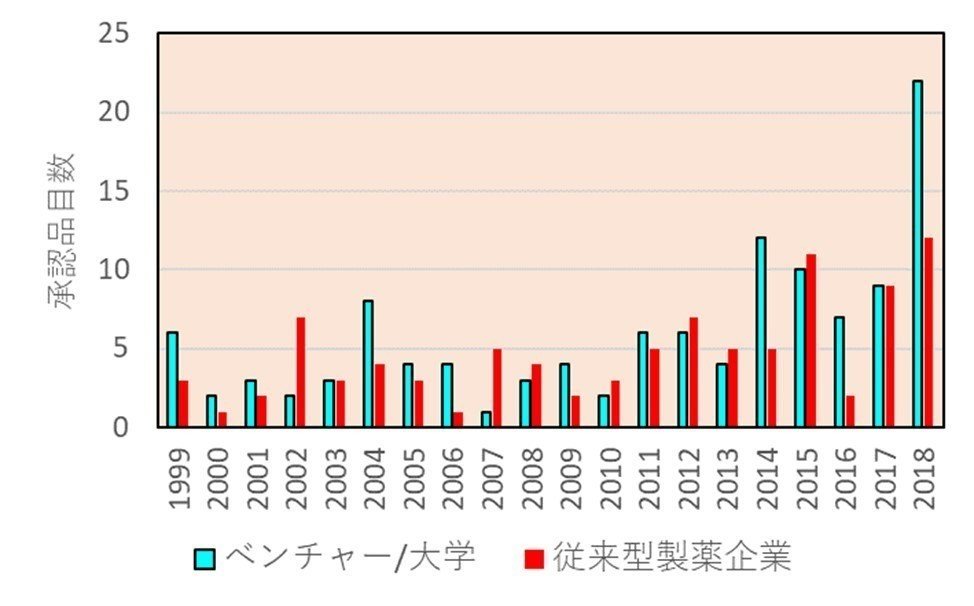
さらに、ベンチャーが自らの手で開発を行うオプションがある稀少疾患やオーファンドラッグについては、新薬の中での割合も最近急激に増えてきており、下図(出典はリンク先)は上のグラフをオーファンドラッグに絞ったものです。オーファンドラッグについては、まさに開発の主体がバイオベンチャーということになります。
では、海外のベンチャーが承認を取得した新薬を、日本においてはいったい誰が開発するのでしょうか?下図(出典はリンク先)は3極の承認取得主体を示したものですが、最新の2017年の場合、アメリカではその半数近くがベンチャー(定義:設立が1975年以降)になっていますが、日本ではベンチャーの承認取得数はごく一部であり、ほとんどが従来型製薬企業(設立が1974年以前)によるものです。
日本で開発される新薬のうち、日本発のものはそのほとんどがオリジネーターによる開発するでしょうが、海外発の新薬の場合、日本にすでに拠点のある大手の外資製薬企業がその開発を手がけていれば、日本でもそれほどの遅れはなく開発が行われると思われますが、海外のベンチャー、特に日本に拠点がないベンチャーが開発した新薬は、誰が日本で開発するのでしょう。ビジネス的に大きな売上・利益をもたらしうる医薬品であれぱ、日本の製薬企業がライセンスを買って開発することになりますが、オーファンドラッグについてはどうなんでしょうか?
これは現代のドラッグラグの原因になっています。20年ほど前のドラッグラグといえば、外資系製薬企業が日本での開発を後回しにすることによって起きていました。当時の日本は「日本人データ」でのフル医薬品開発を求め、日本のためだけに膨大な開発コストをかけることを要求していたわけです(たぶん)。しかし、ブリッジング戦略や国際共同治験という概念が確立され、日本当局にも受け入れられるようになったことにより、日本での開発コストは大幅に下がり、外資系製薬企業の「ジャパンパッシング」が回避されるようになったため、ドラッグラグは過去のものになったとの理解がどちらかという浸透してきているのではないでしょうか?
しかし、現代のドラッグラグは現実に起きており、PMDAのHPにもそのリストは公開されています。その製品のほとんどは名も知らぬ海外企業のもののはずです。外資系でも大手の製薬企業であれば、日本で他の開発案件もあるでしょうし現に販売している製品もあるでしょうから、日本の医薬品開発環境がコスパの観点でイマイチだったとしてもあまやないがしろにはできないでしょう。ただ、会社の規模が小さいバイオベンチャーにしてみれば、自分達の(初めての)製品をアメリカ・ヨーロッパで上市するので精一杯で、中国ほどの人口を抱えているならまだしも、日本だか韓国だかよくわからない極東の小国での開発なんてことに手はなかなか回らないわけです。日本で開発しようとすると、すでにPh3で有効性・安全性の検討を終えている化合物に対し自国民データを要求してくる薬事当局を相手にするというさらなる面倒を抱えることになるのですが、そのようなことを知ってるベンチャー自体、ほとんどないでしょう。これらの医薬品が日本にやってくることを待っているだけでは、いつまでたっても開発は始まりません。
現代のドラッグラグへの対処
国もこの現状に対してただ指を咥えているだけではなく、医療上の必要性が高い未承認薬・適応外薬検討会議というものを設けて、学会や患者団体(個人も可能)からの国内未承認薬の開発要望を受け入れています。開発要望が受け入れられた場合、海外で製造販売している会社の日本支社に開発要望が入りますが、日本支社がない場合には開発担当企業を「公募」します。この公募システム、手挙げする企業にとってのメリットは、新薬創出加算、つまり開発を引き受けてくれたらその企業のほかの薬に薬価上のメリットを与えます、というもので徐々に制度の改訂も加えられているのですが、未だに10年前に開発要望された薬剤のうち承認されていないものがある現状もあります。
開発要望受託企業の側に立つと、薬価上のメリットを除けばほぼ「ボランティア」な仕事、言わばやらされ感のあるボランティアです。ただ、実務としてはライセンスインと同じなので、ライセンス保持企業との交渉ごとになるのですが、企業側が引き下がれないことに対して足下を見られて法外なライセンス料を提示されたり、そもそもライセンス保持企業の側のやる気もいまいちなので交渉の話自体が進まなかったりするので、要望受託企業としても薬価上のメリットを確保できる「最低限」の進捗を確保しようとするので、放置される案件も出てきます。いかにも社会主義的な施策で起きそうな「非効率」です。
欲しい医薬品がいつまでたっても開発されない、患者団体は厚生労働大臣に署名や要望書を提出したりしますが、医薬品開発自体を国が実施するわけではないので、国ができることは、申請されたものを早く承認すること、せいぜいできたとして国内開発のハードルを低くすることです。ベンチャーが日本進出を検討するほど日本市場を魅力的にできるわけではないです。痺れを切らした医師側が、AMED資金等を使って医師主導治験を起こしたりすることもありますが、承認申請をできるのは医師ではなく医薬品の製造販売業の許可を受けた「製薬企業」であり、医薬品開発の部分を乗り越えたとしても、製造販売承認を受けた後の製薬企業としての義務が当然発生するので、最終的に日本に拠点を持つかどうかの判断はベンチャー企業側に委ねられるわけです。
日本の医療発展に必要なサービスを製薬産業が提供するには?
海外のベンチャー企業が開発するオーファンドラッグは当然、日本の患者さんや医師だって必要としています。日本の製薬業界はこれをビジネスチャンスと捉えるべきだというのが私見です。
もちろん、販売面に関しては大して利益にはつながりませんし、場合によっては赤字です。オーファンドラッグに特化するからこそ成り立つビジネスだと考えられるので、多品目展開の日本の製薬企業がありとあらゆるオーファンドラッグをライセンスインさせようとする社会主義政策は、資本主義の原則に反するものでうまくいかない、というのは前のセクションでほのめかしました。
そうではなく、あくまでこれらの医薬品を販売するのはライセンスを持つ企業に任せ、あくまでそのサポートをサービスとして展開してそれ相応の対価を得れば、シード不足でだぶつかせている社員のスキルを活かすことができ、リストラの回避にもつながりますよね、という提案になります。つまり、医薬品開発支援、製造販売拠点設立支援をサービスとして展開しては?ということです。日本型の製薬産業のサービス化です。
別にその機能を外部に置いたって構わないわけです。現に開発業務を子会社化している企業もいくつかあります。場合によっては既存のCROと統廃合して、さらなる効率化を追求したって構わないわけです。
現在、医薬品開発のコンサルタント業を行う小さな会社に僕は属していますが、ビジネスの需要は高く、会社のリソースが追いついていない状態です。海外のベンチャー企業が日本に進出しないのは日本が興味から外れているからであり、興味を持たせることができれば是非日本でもという話は出てきます。その際に必要な支援を行えれば最終的には日本での医薬品販売にこぎつけることができます。
むしろ今の業態の最大のライバル、競合がいるとすれば、内資の大手製薬企業が本気で同様のサービスを展開してきた場合です。医薬品開発のスキル、リソースともに申し分ないわけで、小さな会社には太刀打ちできないかもしれません。製薬会社側の自社製品が優先されるという利益相反は当然起き得ますが、マッチングする相手を間違えないようにDDすれば、なんとかなりそうな気もします。
臨床薬理屋の成立
僕の生業である「臨床薬理屋」が成立しうる背景はなんとなくわかってきたでしょうか?世界で開発される新薬のうちの多くが、日本に拠点を持たない海外の中小の製薬企業やベンチャー企業がライセンスを保有している状態で、それらを日本で開発したいと企業が思っていても、日本のルールに沿って進めなくてはならない。日本のルールに沿った医薬品開発、医薬品の製造販売を支援してくれるビジネスパートナーさえいれば、海外で利用できるオーファンドラッグが日本でも利用できるようになるわけです。
臨床薬理屋はここで医薬品開発をサポートするチームメンバーの一員になり得ます。実際に僕はそういう仕事をしています。特に臨床薬理専門職は数が少なく雇用するにはそれなりにコストがかかるわりにカバーする業務範囲はそれほど広くないため、例えばベンチャー企業が1、2化合物しか持っていないという状況では企業内臨床薬理専門職を雇用することは実質的にはできません。外部に臨床薬理に特化したサービスを提供できる業者がいれば、そのサービスを利用して穴を埋めることができます。
臨床薬理コンサルタントの製薬会社以外での居所としては、①臨床薬理サービスの専門ベンダー(臨床薬理コンサルティングの他にPPKPD解析等も実施できる)、②総合CRO又は医薬開発コンサルティングファームの臨床薬理専門職、③フリーランスの3パターンに別れます。海外の場合はどのパターンも多くいますが、日本では今のところいずれもほとんどいません。詳しい内部事情はわかりませんが、①の臨床薬理専業ベンダーの日本国内リソースは、主に国内顧客向けに使われるのであろうと僕は想定します。③が厳しいのは営業リソースがほとんどなく、これまでの人脈がほぼ全てです。僕がこれまで長々と述べてきた文脈では②のパターンに活躍の場がある、つまり日本での医薬品開発業務自体をチームとして受注し、その中で臨床薬理部分を担当するという働き方です。実際僕は②のパターンで仕事をしています。信頼できるチームで常に仕事ができるというのは重要で、①や③の場合にはクライアントのチームにスポットで入るか、コンサルタントの混成チームで働くことになるので、チームワークを安定して発揮しづらい側面もあると思います。
臨床薬理屋業のいいところわるいところ
最後は、製薬企業の臨床薬理専門職から臨床薬理屋への転身を考える方のために、内部事情を紹介します。
・スキルアップの観点
製薬企業のように、入社後にアソシエイトとしての修行期間があるとは思わない方がよいです。働く場にも依存しますが、一般的にコンサルティングではサービスを売ってなんぼで、サービスを売れないコンサルタントはただのコストでしかないです。コンサルタントとして独立・自律してクライアントにサービスが提供できるだけのスキルがまずは要求されます。
その上で、自分のスキルアップについては自らの責任でトレーニングを設計することになります。予算があれば所属する会社が費用を負担してくれることもあるでしょうが、必要経費と考えて(フリーランスであれば実際経費になりますが)身銭を切ってトレーニングを受けることも必要でしょう。
ちなみに、PMDAラウンドテーブル会議は各企業からの参加人数が決まっているのはご存知だと思いますが、小さな会社に所属すれば、そういう枠はほぼ100%確保できます。製薬協に所属していないのでそういった情報は得にくいのですが、規制の最新動向は別ルートでも取れますし、業界活動自体は意外と可能でむしろ露出の機会は増えるかもしれないです。
・業務経験について
僕の場合は、今現在手がけている仕事は全てオーファンです。製薬企業でそういう経験をすることは極めて稀だと思います。それを偏った経験と見るか幅広い経験と見るかは、価値観にもよるでしょう。
オーファンばかり手がけることのメリットは、オーファンについては業界第一人者になれることです。薬事だと重宝されそうですが、臨床薬理屋の場合はどうでしょう?僕は臨床薬理屋にとってオーファン領域の専門性はかなり大きなメリットだと考えます。統計学的有意性が承認申請に使えないときに活躍できるのは、臨床薬理専門職だからです。
・ソフトウェア
メーカーの方はWinNonlinのライセンスは基本的に付与してもらえるのが当たり前だと思ってらっしゃるかもしれませんが、そんな年間100万円近くするライセンスは持たせてもらえません。サービス料で年間100万円分取り返せるのか、って話です。CROでWinNonlinのライセンスを持てるのは、NCAをサービスとして提供し、その費用を回収できる人だけです。僕はCRO時代から持ってません。
他のソフトウェアについても同様のことが言えます。SASだって怪しいですし、NONMEMだって持ってない、ましてやSimCYPなんてあり得ないです。でも僕はRは使ってます、タダなので。
僕の仕事はコンサルティングなので、解析ではないです。解析を仕事にしてないので、解析ソフトは持ってないです。解析が必要な場合は、CROに発注します。
ただ、コンサルティングを実施する上で、手元で非公式にデータを分析したいときもあります。その時はRを使えばよいのです。NCAなんてお手のもの(ほとんどやらないですが)、僕がよくやるのはPPKPDモデルのシミュレーションです。母集団解析自体も実施できるみたいですが、そこまではやったことはないです。あと、PBPKもできますがパラメーターの入力か面倒で…。
まとめ:臨床薬理屋というキャリアが当たり前のものになるように
長々と書いてきましたが、ざーっくりとまとめると、日本社会にとって製薬企業からは独立した医薬品開発屋が今後は必要とされるということです。医薬品開発コンサルタントは決して製薬会社で肩たたきにあったオジサマ達の流れ着く先ではなく、日本におけるオーファンドラッグ開発をリードする存在になり得るのです。
臨床薬理屋はその希少性から特に多くのプロジェクトから引っ張りだこにされるため、製薬企業内でも特に忙しそうな存在として認知されていることが多いと思います。それが企業内だけでなく、日本社会全体でそういうことが起きている、と言ってもいいんじゃないかと僕個人は思っていますが果たして。。臨床薬理屋というキャリアは、まだ当たり前のものとは言えないと思いますが、数が増えないことには業界としての発展がないので、競合が増えるのはかえって歓迎ですし、臨床薬理専門職のキャリアの中でそれが当たり前のものとなっていくことを、僕は期待しています。
今回も長文にもかかわらず、ここまで読んでいただきありがとうございました。
Twitterやってます↓。Twitterはそれなりの頻度で呟きます。
田中真吾@臨床薬理屋 (@STapcdm)さんをチェックしよう https://twitter.com/STapcdm?s=09