
グラフェン量子ドットを用いた新規mRNAデリバリープラットフォーム
Y. Liu, C. Zhao, A. Sabirsh, L. Ye, X. Wu, H. Lu, J. Liu, ChemistryOpen 2021, 10, 666.
ChemistryOpen. 2021 Jul; 10(7): 666–671.
Published online 2021 Apr 7. doi: 10.1002/open.202000200
PMCID: PMC8248920
PMID: 33829677
元記事はこちら。
要 旨
要旨: ここ数十年、治療用メッセンジャーRNA(mRNA)をドラッグデリバリーシステムと併用することへの関心が高まっている。しかし、整形されていない裸のmRNAは細胞膜を通過することができず、分解を受けやすい。そこで私たちは、ポリエチレンイミンで修飾したグラフェン量子ドット(GQD)を用いて、新しいmRNAデリバリーシステムを開発しました。
その結果、この修飾GQDを用いると、Huh-7肝癌細胞に無傷の機能性mRNAを低用量で送達できること、また、この第一世代の修飾粒子では細胞毒性が問題となるが、GQDには毒性がないことが明らかになった。
機能化 GQD は、製造が容易で、安定かつ効果的な、潜在的に興味深いデリバリーシステムである。
キーワード:ドラッグデリバリー、機能化、グラフェン量子ドット、肝細胞癌、mRNA
要 旨
メッセージをお届けします 新規なグラフェン量子ドットを用いたmRNAドラッグデリバリープラットフォームを作製した。
その結果、これらの修飾GQDは低用量でHuh-7肝癌細胞にインタクトで機能的なmRNAを送達することができることが示された。FGQDs/mRNA複合体のトランスフェクション効率は、4000 ng mRNA/mLの製剤濃度で25%であったが、担体と荷物の比率を最適化すれば、より低い用量で同等のトランスフェクション効率を達成することが可能であった。
この研究は、安定で効果的なmRNA送達システムのための興味深い調製法への第一歩を踏み出したことを説明しています。

1. はじめに
近年、グラフェン量子ドット(GQD)は、バイオセンシング、バイオメディカルイメージング、ドラッグデリバリーなどのバイオ応用のための魅力的なプラットフォームとして浮上してきた。
これは、分散性、生体適合性、大きな表面積、コロイド安定性、表面構造の調整可能性など、GQDの様々な望ましい特性によるものである。
さらに、GQDは磁場、超音波[3]、光などの物理的刺激に応答することができる。このようなユニークな応答特性により、薬物放出の正確な制御が可能となる[1a]。[現在までに、酸化グラフェン/炭素/メソポーラスシリカを用いた光応答性薬物送達プラットフォーム、電場活性化グラフェンマイクロカプセルプラットフォーム、グラフェンを用いた光熱療法 [7] など、いくつかの興味深い事例が報告されている。特に、GQDはDNAやRNAと選択的に相互作用し、それらを酵素による分解から保護することができるため[1b]、GQDをDNAやRNAベースの治療薬に統合する可能性を示唆している。
メッセンジャーRNA(mRNA)ベースの治療薬は、遺伝毒性が低い、生成物(タンパク質)形成の制御性が高い、核局在や転写が不要、生体システムとの適合性が高いなど、様々な利点を持つ有望な治療薬の一種である。mRNAは一本鎖のポリヌクレオチドで、細胞内でDNAを鋳型として転写され、タンパク質に翻訳される。
しかし、mRNA分子は大きく、正電荷を持ち、ほとんどの生体液中で不安定である。このような細胞への浸透性の悪さや不安定性から、治療薬としての利用には限界がある。
この問題に対処するため、mRNAとGQDからなる複合粒子は、GQDの表面特性とコロイド安定性により、これらの問題の多くを改善することができると考えられます。[1b]
しかし、未修飾のGQDはmRNAとあまり結合しないため、GQDを機能化する必要がある。この点、ポリエチレンイミン(PEI)は高いカチオン電荷密度を持ち、RNAとDNAの複合化を可能にする。さらに、PEIを機能化したカーボンナノチューブ(CNT)は、核酸送達のための設計に成功している。GQD と CNT の表面特性が似ていることから、我々は PEI が mRNA の送達システムとしての GQD の有用性を探るための良い出発点であると仮定している。
本研究では、クエン酸からGQDを調製し、PEIによってGQDの表面ゼータ電位を調整した。また,機能化GQD(FGQD)とmRNAを結合させ,GQD/mRNA複合体を作製した。その結果、単純な電荷相互作用の結果として、mRNA分子が粒子に結合することがわかった。最後に、この新しいFGQDを用いて、無傷で機能的なmRNAをHuh-7肝癌(肝臓)細胞に送達することに成功した。この細胞株は、ほとんどのナノメディシン粒子が肝臓で除去されるため、肝臓のモデルとして使用され、その結果、この器官でより高いレベルのトランスフェクションが可能となった。
2. 結果と考察
図 1 に示すように、クエン酸から GQD を調製した。熱分解と炭化の後、炭素原子が成長し、互いに結合した六角形の炭素環(赤色環状部位)を形成し、グラフェンができあがります。その後、PEIを用いて、グラフェンのカルボキシル基と反応させ、GQDの表面を官能基化することができた。PEIは正電荷のアミノ基を高濃度に有するため、表面のゼータ電位が高くなり、mRNAの複合化が可能になる。

図1
FGQDs合成の概略図。赤いリングと矢印は、炭化反応部位を示す。
FTIRを用いて、GQDとPEI-GQDの特性を調べた。熱分解後のGQDsのFTIRスペクトルには、図2(a)に示すように、620, 1646, 2103 cm-1にC-O-C、C=O、C=C=O基に対応するピークのみが観測され、GQDsの調製に成功したことを示している。さらに、GQDsのスペクトルにはC-H結合に起因する吸収は見られず、クエン酸の完全な炭化が示唆された。PEI官能基化後のFGQDsのFTIRスペクトルでは、1550cm-1と1396cm-1にC-NとN-Hの典型的なピークが観測された(図2(b)参照)。PEIの吸収ピークと比較すると、C-NとN-Hの吸収ピークの位置は低波数側にシフトする傾向がある。このようなブルーシフト現象は、これら2つの結合の極性が低下していることを示唆しており、GQDsとPEIの間でC-N結合が形成されていることに起因していると考えられる。

図2
(a) GQDs とクエン酸の FTIR スペクトル (b) PEI,FGQDs,GQDs の FTIR スペクトル。
図3(a)に示すように、GQDの平均サイズは2-5 nm、厚さは1 nm未満であり、GQDが1-3層のグラフェンシートから構成されていることがわかった。PEIで官能基化した後、FGQDsは数十ナノメートルまで成長する。一方、FGQDは1-6層のグラフェンシートからなり、その厚さは0.33-2 nmであった。この結果は、GQDのTEM像(図S1参照)と整合している。GQDsの表面ゼータ電位は、水酸基やカルボキシル基などの酸素含有官能基により-36 Vであった。PEIを官能基化すると、FGQDの表面ゼータ電位は+24.2 Vまで上昇した。この上昇は、PEI上の正に帯電したアミノ基の結果である。図S2に示すように、調製したFGQDの表面ゼータ電位はpH安定性を示すことが注目される。FGQDの表面ゼータ電位は、pH4-14の範囲で+22 V程度に留まっている。この正に帯電した表面によって、GQDはmRNAと結合することができる。さらに、図S3では、GQDsとFGQDsの紫外線吸収と蛍光の特性を調べた。GQDsとFGQDsはともに360 nmの紫外光を吸収し、青色の蛍光を発することができる。

図3
(a) GQDと(b) FGQDの原子間力顕微鏡による画像。挿入図は、示した線に沿った画像の強度を示す。パネル(c)と(d)は、それぞれPEI官能基化前と後のGQDの表面電荷を示す(3回繰り返し)。
FGQDは表面が正に帯電しているので、FGQDと負に帯電したEEGFP mRNAとの間には静電的な相互作用が期待される。FGQDsとmRNAの比率は、FGQDs中のNとmRNA中のPのモル比(N/P比)として表した。図4に示すように、アガロースゲル電気泳動により、様々なN/P比(すなわちN/P 2, 4, 6, 8, 10, 20, 40 60, 100)においてFGQDsとmRNAの複合体が形成されていることが確認された。すべてのN/P比において、mRNAはFGQDsと完全に複合化し、ローディング位置に近い状態で保持された。様々なN/P比で形成されたFGQDs/mRNA複合体の粒子径は、N/P比が低いほど正電荷のFGQDsが少なくなり、粒子径が小さくなることを示している(図5(a))。すべての FGQDs/mRNA 複合体の粒子径は 300 nm 未満であった。
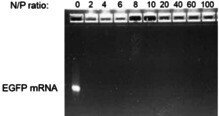
図4
eGFP mRNAのゲル電気泳動は、様々な電荷(N/P)比(0-100)のFGQDとの複合化により遅延している。

図5
様々な FGQD と mRNA の比率における粒子径と機能。(a) 溶液中の mRNA 分子の数に対して FGQDs の割合が増加すると、mRNA の凝縮が増加し、粒子径が小さくなる。(b)2時間のパルスで粒子...
2.1. 細胞培養への機能性 mRNA の送達
mRNA を用いた治療法は、疾病治療の新たな可能性をもたらすことから、脂質ナノ粒子、[10] 高分子ナノ粒子、[11] 金ナノ粒子などの様々な生体材料ベースの mRNA 導入系が開発されてきた[12]。[しかし、mRNA を特定の部位に安定的かつ安全に、高い選択性で効率よく送達し、タンパク質を発現させることができる新規の生体材料送達システムを見出すことが必要である。ここでは、FGQD を用いて mRNA を導入し、ハイスループット顕微鏡による画像中の EGFP 陽性細胞の割合を算出することで、トランスフェクション効率を定性的にも定量的にも評価し ている。
FGQDs と mRNA の複合体の検討は、FGQDs と mRNA の最適な比率を決定する実験から始まりました。様々な比率で粒子を作製し、DLS測定を行った結果、mRNAの添加に伴い粒子径が増大すること、また、予想通り、FGQDの添加によりmRNAの凝縮が促され、より多くの電荷が得られると粒子径が小さくなることがわかった(図5(a))。なお、結合していないmRNA(N/P 0)は、水系緩衝液中で球状を呈する。機能的な細胞実験は、この第一ラウンドの製剤が酸性であるため、比較的低い用量で行われ、曝露は短時間であった。FGQDs/mRNA 複合体の高用量における eGFP 産生の減少は(図 5(b))、FGQDs の毒性ではなく、培地の酸性の結果である。FGQDs の割合が増加すると、効果が低下するという明確な関係が見られた(Figure 5(c))。この結果と、ごく低用量でタンパク質の生成が見られたことに勇気づけられ、我々は、より酸性度の低い製剤に改良して、機能実験の第二ラウンドを継続することにした。
参照脂質ナノ粒子(図 6(a)および(c))および FGQD((b)および(d))はいずれも、機能的な EGFP mRNA を Huh-7 細胞に送達することが可能であった。質的にも、違いは明らかである。FGQD で処理したウェルでは、EGFP を発現している細胞は少ない傾向にあったが、陽性細胞は多くのタンパク質を生成していた。これは、LNPトランスフェクション後に得られた、より均一な発現とは対照的である。同様に、FGQDsで処理したウェルは、参照用の脂質ベースの粒子よりもヨウ化プロピジウム染色が多く、グラフェンそのものというよりもPEI官能基化の副作用と思われる細胞膜の破壊が大きいことを示している。

図6
トランスフェクション後に得られた機能的な細胞データ。LNP(aおよびc)、FGQD(bおよびd)、およびバッファーを投与した対照細胞(e)の代表的な画像であり、2時間のトランスフェクションを開始してから24時間後に撮影された。
GQD は生体適合性が高く,薬物送達に有望であると報告されている [13] が,GQD のサイズや機能化は,その細胞毒性に様々な形で影響を与える可能性がある.細胞への取り込みを容易にするため、ナノ粒子はしばしばカタトニックに帯電するように設計され、アニオン性の細胞膜と粒子の相互作用を高めることができるが、これは細胞毒性効果ももたらす[14]。[EGFP 産生と細胞毒性の間の比率を考慮すると、最適な投与量と製剤は FGQD の比較的低い用量で生じる。213 ng/mL mRNA は N/P 比 2、緩衝系として PBS または Tris を使用、2 時間のパルス投与で最適(図 6(f)および(h))である。) より長い、24時間の曝露は、細胞毒性を増加させ、その結果、タンパク質発現が低下する(図6(g)および(i))。図 S4 の細胞健康データも同様の結果を示している。興味深いことに、FGQD と mRNA カーゴの N/P 比を 1 にすると、効力が弱くなるが、毒性も弱い粒子となり、この場合、最適用量は 1 桁以上高くなることがわかった。
今回テストしたFGQDは、参照用のLNPベースのmRNA送達システムよりも効果も毒性も低かったが、これは予想外ではなかった。LNPがより成熟した技術であるのに対し、FGQDは当社が開発した第1世代の機能化グラフェン・ベース送達システムだからだ。さらに、毒性は主に官能基化[16]とその結果として生じる粒子の電荷に起因するため、別の官能基化戦略によって毒性の低い粒子を製造できる可能性もある。GQDと脂質の複合体からなるハイブリッド粒子は、興味深い可能性を持っている。しかし、GQDは、大きな表面積や、超音波、磁場、光などの外部刺激に応答する能力など、他の望ましい特性も有している。LNPは製剤化時のせん断力に敏感であるため(AstraZeneca未発表データ),N/P 2で形成したFGQDs/mRNA複合体についてせん断耐性試験を実施した。FGQDs/mRNA複合体の性能は、この処理に対してあまり敏感ではなく、実質的な活性を保持していた、図6(f-i)。最後に、1回の凍結融解サイクルは、複合体の効力に影響を与えるが、細胞毒性を低下させないことを見出した。
3. 結論
本研究では,GQD を用いた新しい mRNA 導入プラットフォームを構築した。GQDsの表面をPEIで共有結合的に修飾することにより、正電荷を持つGQDs(機能化GQDsまたはFGQDsと呼ぶ)を得ることができた。その結果、FGQDはmRNAをうまく複合化し、Huh-7肝癌細胞の細胞質へ無傷で送達することができることがわかった。さらに、LNPとは異なり、FGQDs/mRNA複合体はせん断力に対してあまり敏感でないことがわかった。FGQDs/mRNA複合体のトランスフェクション効率は、4000 ng mRNA/mLの製剤濃度で25 %と高いが、担体と荷物の比率を最適化すれば、同等のトランスフェクション効率をはるかに低い用量で達成することが可能であった。本研究は、GQD を用いた安定で効果的な mRNA 導入システムのための興味深い調製法への第一歩を記 述するものである。
実験セクション
材料
50 wt % ポリエチレンイミン (PEI, GPC による Mw 60,000) 溶液およびクエン酸は Sigma-Aldrich Co. Ltd.(スウェーデン)から購入した。EEGFP mRNA (5moU)はTrilink BioTechnologies, Inc.(米国)から購入した。huh-7肝癌細胞株は、AstraZeneca AB, Swedenから入手し、元々はATCCから供給された。 pH試験紙は、Fisher Scientific Co. Ltd.(スウェーデン)から購入した。化学物質は分析的に純粋であり、受け取ったまま使用した。
GQDの調製
GQDは、典型的なボトムアップ法を用いて調製した。簡単に言うと,1 g のクエン酸を 80 mL の蒸留水に溶かし,室温で 30 分間攪拌した。次に、調製した透明溶液を150 mLのテフロンライニングのステンレス鋼製オートクレーブに移した。その後,オートクレーブを200℃のマッフル炉に6時間入れ,得られたオレンジ色の液体を10 mg /mL NaOH溶液100 mLに激しく攪拌しながら一滴ずつ加えてGQDを調製した。pHを7.0に調整した後,GQDsの水溶液を得た。この溶液をろ過し、流水下で7日間透析(3.5 kDaカットオフ)した。遠心分離(8000 r/min)を用いて濃縮した後、GQDsのオレンジ色の溶液(4 mg/mL)を得た。製造収率は約 56 %と算出された。
機能化 GQD(FGQD)の作製
PEI を用いて,あらかじめ調製した GQD の表面ゼータ電位を変化させた。100 mL の GQDs 溶液にエチレンジアミン(EDA)とジシクロヘキシカルボジイミド(DCC)を加え,80 ℃で 1 時間攪拌して GQDs をアミノ化した。その後,アミノ化したGQDs溶液に10 wt%のPEI溶液を8時間攪拌しながら添加した。得られた溶液をさらに3.5 K MWCO透析チューブを用いて流水下で7日間精製し,最終濃度2.8 mg/mL FGQDsを得た。FGQDs は、スペクトルの緑色部分(520 nm 付近)でやや蛍光を発するが、ここで用いた濃度での蛍光は eEGFP と比較して強くないため、中程度の濃度を用いることで緩和される可能性がある。
FGQDs/mRNA 複合体の形成
FGQDs と mRNA の比率は、FGQDs 中の N と mRNA 中の P のモル比(N/P 比)として表した。FGQDs/mRNA複合体は、所望のN/P比になるように様々な量のFGQDsとmRNA溶液を水中で混合するか、1M Tris pH 8を用いてpH 7.5に調整し、分析前にRTで1時間インキュベートすることで形成させた。得られたFGQDs/mRNA複合体をアガロースゲル電気泳動(1 % Agarose E-GelEX、Invitrogen社製)により検討した。粒子径は Zetasizer APS (Malvern Instrument) を用いて測定した。
細胞導入効率と細胞毒性試験
Huh-7肝癌細胞を10 %牛胎児血清、5 %L-グルタミン、5 %ピルビン酸ナトリウムを添加したDMEMで培養し、37 ℃、5 %CO2でインキュベートした。細胞は、試験の 2 日前に 384 ウェル Perkin Elmer Cell Carrier イメージングプレートに播種した。FGQDs/mRNA ソースプレートは、音響分注(Echo 655)を用いて作成し、ロボット搬送(Agilent Bravo)を用いて Huh-7 培養物に移した。LNPとFGQDは、細胞の維持に通常使用される増殖培地とともにインキュベートされ、細胞はFGQDs/mRNAとともに2種類の方法でインキュベートされた:24時間の連続インキュベーション、または2時間のパルスインキュベーションに続いてFGQDs/mRNAを除去し、新しい増殖培地で22時間の追加インキュベーションを使用する方法。MC3ベースの脂質ナノ粒子(LNP)を添加し、コントロールとして使用した。Hoechst 33342とヨウ化プロピジウムを生きた細胞に24時間直接添加して、核と損なわれた膜を持つ細胞をそれぞれ染色した。共焦点画像は、20×対物レンズ(Olympus、NA 0.95)を用いて、すべてのウェルで2点ずつ取得した(Yokogawa CV7000)。ウェルは3連で投与し、実験は2回行った。
粒子の特性評価
GQDとFGQDの化学構造を明らかにするために,FTIR(Fourier-Transform infrared)とラマン分光法を用いた。ゼータ電位の値は,Malvern zetasizer (Malvern Panalytical, England) を用いて測定した.原子間力顕微鏡(AFM)を用いて,NSC15 チップ(シリコンカンチレバー,MikroMasch)を装着した Nanoscope IIIa (Digital Instruments) でタッピングモードで GQD と FGQD の形態を解析した.高分解能透過電子顕微鏡(HRTEM)観察は、Tecnai G2 F20S-TWIN 200KV 電子顕微鏡で行った。紫外可視吸収は,紫外可視近赤外分光光度計(Agilent Cary 60)を用いて特性評価を行った.FLスペクトルはすべてFL分光光度計(Cary Eclipse, Varian)を用いて得た。 pH値はpH試験紙を用いて得た。
データ解析
FGQDs/mRNA と共に 24 時間インキュベートした後,共焦点イメージングを用いて eEGFP mRNA のトランスジーンの発現を調べた.mRNA のトランスフェクションおよび細胞毒性試験には、1 製剤あたり 8 用量を使用し(表 S1 に示す)、1用量あたり 3 レプリケートし、各ウェルで 2 視野を取得した。画像の自動解析にはColumbus (ver2.9; Perkin Elmer)を使用した。1 濃度あたり 15000 個の細胞が分析され、初期分析では 1 細胞あたり 16 のパラメータが抽出された。細胞は、EGFP陽性、PI陽性(死滅)、PI陰性(生存)に分類された。細胞の健全性に関連する追加の測定値も生成された(細胞数、核強度、核形態学的測定値)。
利益相反
著者らは、利益相反はないことを宣言している。
参考資料
本誌では、著者と読者へのサービスとして、著者から提供された情報を掲載している。これらの情報は,査読を経て,オンライン配信用に再編成されることがあるが,コピー編集やタイプセットは行われない。サポート情報に起因する技術的な問題(ファイルの欠落を除く)については,著者にお問い合わせください。
補足
追加データファイルはこちら(182K, pptx)
補足
追加データファイルはこちら(802K, pdf)
謝辞
SiografenプログラムによるSwedish Board for Innovation (Vinnova)、契約番号621-2007-4660によるSwedish National Science Foundation、契約番号SE13-0061によるSwedish Board for Strategic Research (SSF)からの資金援助に感謝します。SE13-0061、Formasから契約番号:FR-2017/0009、Sweden National Science Foundationから契約番号:621-2007-4660。FR-2017/0009、STINTのダブルディグリー博士課程共同研究プログラムより契約番号:DD2016-6502。DD2016-6502、およびスウェーデンのチャルマース工科大学のProduction Area of Advanceから。J.L.はまた、中国国家自然科学基金(No: 51872182)からの財政支援に謝意を表します。H.L.は上海国際共同研究プロジェクト(No: 19520713900)および復旦大学高分子分子工学国家重点実験室からの財政支援に感謝する。
備考
Y. Liu, C. Zhao, A. Sabirsh, L. Ye, X. Wu, H. Lu, J. Liu, ChemistryOpen 2021, 10, 666.
投稿者情報
Dr. Xiaoqiu Wu, Email: moc.acenezartsa@uW.uiqoaiX.
Prof. Hongbin Lu、電子メール:nc.ude.naduf@ulnibgnoh.
Prof. Johan Liu, Email: es.sremlahc@uil.nahoj, Email: nc.ude.uhs@uilnahoj.
記事情報
ChemistryOpen. 2021 Jul; 10(7): 666-671.
オンライン公開 2021 Apr 7. doi: 10.1002/open.202000200
PMCID: PMC8248920
PMID: 33829677
Ya Liu, 1 , 2 , + Changhong Zhao, 1 , 6 , + Alan Sabirsh, 3 , + Lilei Ye, 4 Dr. Xiaoqiu Wu,corresponding author 3 Prof. Hongbin Lu,corresponding author 2 and Prof. Johan Liucorresponding author 1 , 5
1 シャルマー工科大学マイクロテクノロジー・ナノサイエンス学部、9 Kemivägen、Gothenborg、412 96 Sweden
2 復旦大学ポリマー・高分子複合材料共同イノベーションセンター高分子科学部、2005 Songhu Road, Shanghai 200433 China
3 アストラゼネカ社製薬科学研究部アドバンストドラッグデリバリー、1 Pepparedsleden, Mölndal 431 50 スウェーデン
4 SHT Smart High Tech AB, 6 Kemivägen, Gothenburg 412 58 Sweden
5 上海大学機械工学・自動化学部 SMIT センター、20 Chengzhong Road, Shanghai 201800 China
6 新郷医科大学生命科学技術学院 〒453003 中国新郷市金水路 601 番地
Dr. Xiaoqiu Wu, Email: moc.acenezartsa@uW.uiqoaiX.
投稿者情報
corresponding authorCorresponding author.
+これらの著者は、この仕事に等しく貢献した。
Received 2021 Jan 21; Revised 2021 Jan 28
著作権 © 2021 The Authors. 発行:Wiley-VCH GmbH
本論文は、http://creativecommons.org/licenses/by-nc-nd/4.0/ ライセンスに基づくオープンアクセス論文であり、原著を適切に引用し、利用が非商業的であり、改変や翻案が行われない限り、あらゆる媒体での利用や配布が許可されています。
この記事は、PMCの他の記事から引用されています。
ChemistryOpenからの記事は、Wiley-Blackwellの好意によりここに提供されています。
参考文献
1.
1a. Gu Z., Zhu S., Yan L., Zhao F., Zhao Y., Adv. メーテル 2019, 31, 1800662; [PubMed] [Google Scholar].
1b. Sanchez V. C., Jachak A., Hurt R. H., Kane A. B., Chem. Res. Toxicol. 2011, 25, 15-34. [PMC フリーアーティクル] [PubMed] [Google Scholar] 。
2. peng E., Choo E. S. G., Chandrasekharan P., Yang C. T., Ding J., Chuang K. H., Xue J.。M., Small 2012, 8, 3620-3630. [PubMed] [Google Scholar].
3 Dai C., Zhang S., Liu Z., Wu R., Chen Y., ACS Nano 2017, 11, 9467-9480. [PubMed][Google Scholar]。
4. yang K., Hu L., Ma X., Ye S., Cheng L., Shi X., Li C., Li Y., Liu Z., Adv. Math. メーテル 2012, 24, 1868-1872. [PubMed][Google Scholar]。
5. Chen Y. W., Chen P. J., Hu S. H., Chen I. W., Chen S. Y., Adv. ファンクション メーテル 2014, 24, 451-459. [Google Scholar】。]
6 Liu H. W., Huang W. C., Chiang C. S.S.、Hu S.H.、Liao C. H., Chen Y. Y., Chen S. Y., Adv. ファンクション メーテル 2014, 24, 3715-3724.[Google Scholar].
7 Yang K., Zhang S., Zhang G., Sun X., Lee S.-T., Liu Z., Nano Lett. 2010, 10, 3318-3323. [PubMed] [Google Scholar].
8.
8a. Li B., Zhang X., Dong Y., Wires. ナノメド ナノビ。2019, 11, e1530; [PMC free article] [PubMed] [Google Scholar].
8b. チャルバターニG. M., Dana H., Gharagouzloo E., Grijalvo S., Eritja R., Logsdon C. D., Memari F., Miri S. R., Rad M. R., Marmari V., Int. Math. J. Nanomed. 2019, 14, 3111. [PMC free article] [PubMed] [Google Scholar].
9 Wang L., Shi J., Zhang H., Li H., Gao Y., Wang Z., Wang H., Li L., Zhang C., Chen C., Biomaterials 2013, 34, 262-274. [PubMed][Google Scholar]。
10.
10a. Zohra F. T., Maitani Y., Akaike T., Biol. ファーム ブルです。2012, 35, 111-115; [PubMed] [Google Scholar].
10b. バオ・イー、ジン・イー、チブクラ・ピー、チャン・ジェイ、リウ・イー、リウ・ジェイ、クラム・ジェーピー、マハト・R・I、ン・D、イン・W、ワン・イー、ユー・エル、ファーマシー。Res. 2013, 30, 342-351. [PubMed][Google Scholar]。
11.
11a. メノン J. U. 、ラヴィクマール P. 、ピセ A. 、ギャワリ D. 、シア C. C. W. 、グエン K. 。T., Acta Biomater. 2014, 10, 2643-2652; [PMC free article] [PubMed] [Google Scholar].
11b. Su Z., Erdene-Ochir T., Ganbold T., Baigude H., Int. J. Biol. マクロモル 2019, 143, 118-125... [PubMed] [Google Scholar].
12. kumar S., Diwan A., Singh P., Gulati S., Choudhary D., Mongia A., Shukla S., Gupta A., RSC Adv. 2019, 9, 23894-23907 [Google Scholar].
13 Chen F., Gao W., Qiu X., Zhang H., Liu L., Liao P., Fu W., Luo Y., Front. 研究室 メド。2017, 1, 192-199. [Google Scholar].
14. Nurunnabi M., Khatun Z., Huh K. M.、Park S.Y.、Lee D.Y.、Cho K. J.、Lee Y. K., ACS Nano 2013, 7, 6858-6867. [PubMed][Google Scholar]。
15. fischer D., Li Y., Ahlemeyer B., Krieglstein J., Kissel T., Biomaterials 2003, 24, 1121-1131. [PubMed] [Google Scholar].
16. Liu y., Zhao x., Wang c., Zhang l., Li m., Pan y., Fu y., Liu j., Lu h., J. メーテル ケム A 2018, 6, 18267-18275. [Google Scholar】。]
この記事が気に入ったらサポートをしてみませんか?
