遺伝子およびドラッグデリバリーのための酸化グラフェン系ナノ材料の機能化および最適化戦略
PubMed
Xiao-Min Han, Ke-Wen Zheng, [...], and Qiang Ma
Published online 2020 May 15
論文情報
元記事はこちら。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7270027/
要 旨
グラフェン系ナノ材料(GFN)は、その光学特性、熱特性、薬物吸収特性から、がん治療、組織工学、抗菌、生体イメージングに広く用いられてきた。薬物や遺伝子のナノキャリアとして使用する場合、凝集、生体適合性、薬物や遺伝子の不適切な放出が主な制約となる。
これらの問題を克服するために、研究者はさまざまな機能化プロセスを開発してきた。このレビューでは、特に遺伝子送達に重点を置いて、装飾分子によって機能化をグループ化した。
酸化グラフェン(GO)に機能性部位を導入するための主要なセットとして、有機材料と無機材料が挙げられた。また、GOデリバリーシステムで使用される標的分子を分類し、放出制御や磁気ターゲティングなど、デリバリー効果を高める他の戦略も紹介した。
キーワード 酸化グラフェン、ナノキャリア、遺伝子デリバリー、ターゲットデリバリー
はじめに
ナノテクノロジーは最も急速に発展している分野の 1 つである。デンドリマー、リポソーム、ポリマー、金属ナノ粒子(NP)、カーボンナノ材料、ウイルスNPなど、ユニークで並外れた生理学的・化学的特性を持つ多くの異なるナノ材料が、現在前臨床試験や臨床試験を実施中である。
これらはすべて、機能性、物理化学的性質、生体内分布、薬物動態、免疫原性、毒性などの点で明確な長所と短所を持っている[1,2]。その中で、グラフェンはその一種である]。中でもグラフェンは、ナノメディシンに広く用いられているカーボンナノ材料の一種である。グラフェンの理論的な存在は、60年前にSlonczewskiとWeissによって議論された[3]。その後、(2004年に)単板化された]。その後(2004年)、Novoselovによる機械的剥離(剥離の繰り返し、スコッチテープ法)により、単層グラフェンが単離された[4]。
グラフェンは、その光学的、熱的、機械的、電気的特性から、導電性高分子、電池電極、印刷用インク、抗菌紙などに応用されている[5-7]。原始的なグラフェンをさらに活用するために、数層グラフェン(FLG)、極薄グラファイト、グラフェン量子ドット(GQD)、酸化グラフェン(GO)、還元酸化グラフェン(rGO)、グラフェンナノシート(GNS)などのグラフェン系ナノ材料(GFNs)が開発されている [6、8、9]。このように、GFNはカーボンナノチューブ(CNT)に類似しており、壁数、直径、長さ、および表面化学が変化することがある[6]。原始的なグラフェンと比較して、他のGFNは、その異なる表面特性により、明確な分散・凝集挙動、生体適合性、およびその他の利点を示す[10-12]。2008年、Sunらは、凝集することなく緩衝液や血清に可溶なペグ化GO(PEG-GO)を開発した[13]。2012年には、Sasidharanらが、カルボキシル基を有するグラフェンがより優れた血液適合性を有することを明らかにした[11]。さらに、Mendoncaらは、rGOの毒性作用は、全身投与後の短期分析で末梢的かつ一過性であることを見出した[14]。毒性に関するコンセンサス】。] 臓器、血液、細胞および細胞内構造など、さまざまなレベルで身体に影響を及ぼすGFNの毒性に関するコンセンサスはまだ得られていない[15]。それにもかかわらず、研究者は、グラフェンの毒性がその形状、用量、サイズ、時間および機能化によって異なるという標準的見解に到達している[16]。
GFNと生体分子との相互作用は、これまでの研究でも取り上げられている[6]。2008年、LiuらはPEGとナノグラフェンを用いて、疎水性の芳香族分子であるカンプトテシン(CPT)アナログSN38を吸収できる送達材料を得ている[17]。それ以来、GFNは、遺伝子導入薬、バイオイメージング、および組織工学に適用されるナノキャリアとして、集中的に研究されてきた[18]。遺伝子治療は、主に治療用遺伝子を標的とする細胞にうまく導入できるかどうかにかかっている[19]。遺伝子治療の主な限界は,細胞への取り込みが悪いこと,ヌクレアーゼによる分解,全身投与後の急速な腎クリアランスである。GFNsの装飾は,標的薬剤や遺伝子の凝集を防ぎ,その副作用を最小限に抑え,化学療法における適切な時間や場所での放出を制御することができる.この論文では、最近2年間に発表された薬物および遺伝子送達に使用されるGFNに関する研究をレビューした。これらの機能性部位はいくつかのカテゴリーに要約された。さらに、デリバリー効果を向上させるための戦略についても紹介した。
デリバリーで使用されるグラフェンの機能化
優れた加工性を有する酸化グラフェン(GO)は、様々なバイオメディカル用途に有望な機能性ナノ補強材料となっている。「グラフト」や「ロード」と呼ばれる共有結合あるいは非共有結合の方法を用いて、GOは他のナノ粒子(NP)や生体分子で修飾することができ、その生物医学的用途を拡大することができる [20]。ナノハイブリッドは、それぞれの相手方のユニークな特性により、いくつかの利点を提供する。2017年と2018年には、ナノキャリアとして使用されるGOに関する200近くの論文があり、GOの装飾を特定のタイプに分類していました(図1)。有機と無機が大きく2つのセットである。有機機能については、線状ポリマー、非線形ポリマー、多糖類、アミノ酸-タンパク質-アダプター(APA)、ノンポリマーに分類した。これらのカテゴリーは、使用頻度の低いノンポリマーを除いて、図1に一覧表と打ち出しを示した。最初の3つのカテゴリーの代表的な文献をTable 1に示す。サブグループは別々のカテゴリーで打ち切った。また、in vivo抗腫瘍アッセイに合格したサブグループには赤のラベルを付け、青い星は遺伝子導入に成功したことを示す。
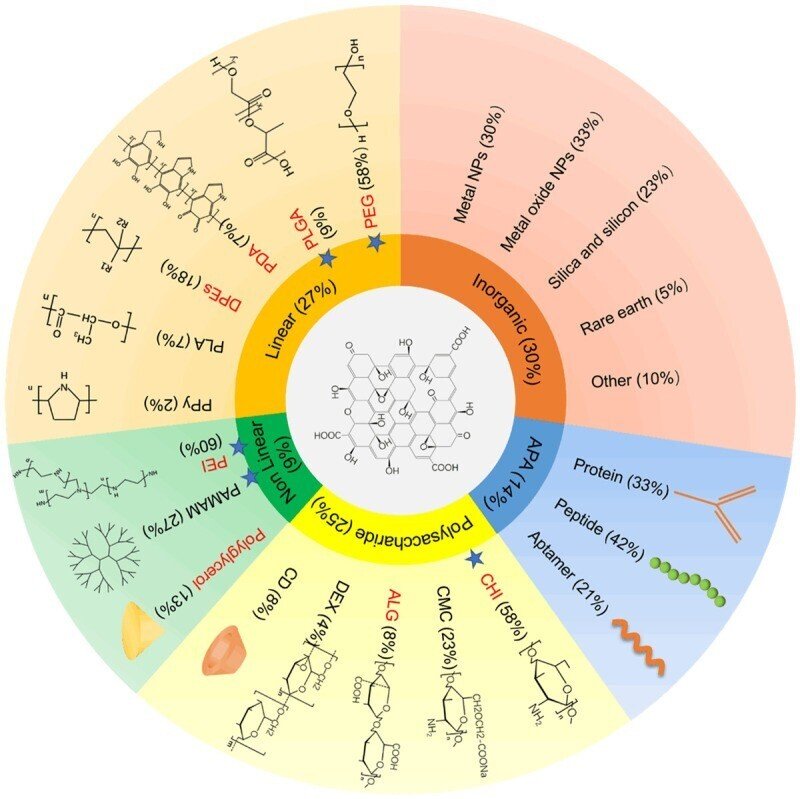
図1
GOの機能化。有機と無機が2つの主要なセットであった。有機物はさらに、線状高分子、非線状高分子、多糖類、アミノ酸-タンパク質-アダプター(APA)、非高分子(図示せず)に分類された。このうち、合格したサブグループは ...
表1
有機サブセットの最初の3つのカテゴリーの代表的な文献をリストアップした。
有機装飾
線状ポリマー ポリエチレングリコール(PEG)は、最も頻繁に使用される線状ポリマーである。生体適合性のある中性荷電PEGは、血清などの生理的溶液中で高い水溶性と安定性を示します[21,22]。2008 年、Liu らは PEG と GO を用いて、疎水性の芳香族分子であるカンプトテシン(CPT)アナログ SN38 を吸収できる送達材料を得た [17](Liu et al. リボヌクレアーゼA(RNase A)およびプロテインキナーゼA(PKA)も、PEG化GOに担持させることに成功した[23]。さらに、Yinらは、BALB/cマウスのMIA PaCa-2細胞にHDAC1およびK-Ras siRNAを共導入するためのビークルとして、PEG化GOを使用した[24]。
PLGA(poly (D, L-lactic-co-glycolic acid))は,優れた生体適合性と生体内生分解速度の調整により,当初は臨床用縫合糸材料として使用されていた.PLGAベースのマイクロ/ナノ粒子は、タンパク質や様々な種類の核酸などの高分子の送達に使用することができる[25]。GO/PLGAナノファイバーは、エレクトロスピニング技術によって形成され、ヒト胚性腎臓293細胞や間葉系幹細胞(MSCs)をpGFP-GO/PLGAによってうまくトランスフェクトすることができる [26]。さらに、5-ヨード-2-デオキシウリジン(IUdR)または5-フルオロウラシルをPLGA機能化GOに担持することができ、粒子の特性(フィット機能、磁気標的特性およびMRI能力)をさらに改善できる [27,28].また、骨組織工学において、GO-PLGAをマイクロキャリアとして用いることで、骨形成タンパク質-2(BMP-2)を送達することができる[30]。
ポリドーパミン(PDA)は、その優れた付着特性から、表面改質やナノキャリアの安定化のために使用された[31]。PDAを添加したグラフェンナノハイブリッドは、DNAを吸収することでバイオイメージングに利用されたり[32]、メソポーラスシリカナノ粒子を包み込むことでドラッグデリバリーに利用されたり[33]している。例えば、化学療法と光熱療法を併用したHeLa担持マウスにおいて、in vivoでの抗腫瘍アッセイが実施された[34]。しかし、これまでのところ、PDA-GOデリバリーシステムでの遺伝子デリバリーは報告されていない。
他の線状ポリマーのほとんどはポリエチレンの誘導体(DPE)であり,その中でもポリビニルピロリドン(PVP)が最も頻繁に使用されていた。PVP は,非イオン性で無毒の生体適合性高分子界面活性剤であり,生理的環境における GO の生体適合性安定化剤としても機能する可能性がある [35].PVP を機能化した GO は,SN-38 のナノキャリアとして同定されている [36].PVP-rGO/Bi2S3ナノコンポジットでは,DOXの高い貯蔵容量を持つと同時に,NIR領域で完璧な光熱変換効率を示す[37].DPEには、ポリエチレングリコール[38]、ポリアクリル酸(PAA)[39,40]、ポリメタクリル酸(PMAA)[41]も含まれます。さらに、ポリ乳酸(PLA)[42]、ポリピロール(PPy)[43]などのポリマーもある。
非線形ポリマー 高分岐ポリエチレンイミン(PEI),ポリアミドアミン(PAMAM),ポリグリセリン(PG),シクロデキストリン(CD)などの非線形ポリマーは顕著な空間構造を持ち,自己担体として扱われる。PEIのようなカチオン性ポリマーは、プラスミドDNAとRNAを静電相互作用によって安定な複合体に凝縮することができる[44]。Wangらは、Raw264.7細胞におけるGO-PEIとGO-PEGの細胞内デリバリー効率を比較し、GO-PEIが細胞質でより良い凝集特性を持つことを見出した[45]。したがって、PEG と PEI の二重機能化 GO は、遺伝子ナノキャリアとしてより適している。さらに、GO-PEG-PEI(RGPPとも呼ばれる)は、ヒト、マウス、癌、正常細胞を含む11の細胞株において、siRNAと大きなサイズのプラスミドの両方に対して、様々な送達能力を示した[46]。さらに、プラスミドベースのStat3 siRNAを搭載したGO-PEG-PEIは、マウスの悪性黒色腫の成長を抑制することができる[47,48]。miR-7b過剰発現プラスミドやCkip-1を標的とするsiRNAを担持させると、骨形成が増加する[49,50]。さらに,Yueらは,高分子量Cas9/シングルガイドRNA(sgRNA)複合体の送達のためのGO-PEG-PEIナノキャリアを構築し,ヒトAGS細胞において遺伝子編集の機能を効率的に実行した[51].GO-PEI遺伝子導入システムに関する研究の多くは,in vivoでの心臓修復に関する先行報告を除き,細胞レベルに焦点を当てたものである[24,52].薬物送達を扱った研究は比較的少ないが、これらの研究では、GO-PEI薬物送達システムを介してin vivoで抗腫瘍アッセイが実施された[53]。
デンドリマーは、高度に分岐したほぼ球形の対称的な高分子である。ポリ(アミドアミン)(PAMAM)は最もよく使用されるデンドリマーで、内部キャビティは疎水性または親水性の薬物をカプセル化するために使用され、その外側の表面は末端機能化により物理化学、反応性、ダイナミクス、生物学的特性を変化させる[54]。2012年には、グラフェン-オレイン酸-PAMAMまたはGO-PAMAMが、EGFPのプラスミドDNAをHeLa細胞およびMG-63細胞に送達するために使用された[55]。DOXとMMP-9 shRNAプラスミドの共配布もGO-PAMAMによって行うことができ、MCF-7細胞に対してより高い細胞毒性をもたらすことができた[56]。Yadavらは、PEGおよびPAMAM修飾GO(GPD)を開発し、EPAC1 siRNAをコーティングした場合、MDA-MB-231細胞の細胞移動を阻害し、浸潤を減少させた[57]。さらに、メタロプロテアーゼ9(MMP-9)過剰発現プラスミドを担持したPAMAM機能付きグラフェンナノスターは、人工肝硬変マウスの肝線維化を抑制した[58]。その上、新しい種類のGFNであるグラフェンナノスターは、PAMAM-G5と連結した後、メタロプロテアーゼ9をコードするプラスミドを負荷すると、肝硬変マウスの肝損傷を著しく軽減し、肝臓の回復を改善することができた[58]。しかし、GO-PAMAMナノキャリアを用いたin vivoの抗腫瘍アッセイについては試験されていない。
Tuらは、高分岐ポリグリセロールアミンと2,3-ジメチルマレイン酸無水物(DA)を用いてグラフェンを修飾することにより、pHトリガーによる表面電荷変換、および近赤外線照射(NIR)によるDOX放出制御という特性を持つグラフェン誘導体を得ている。このナノハイブリッドは、腫瘍を持つマウスにおいて高い抗腫瘍効果を示した[59]。環状ポリマーであるシクロデキストリン(CD)については、多糖類サブグループで紹介する。
多糖類 多糖類は一般的に使用されている生体高分子の一種で、そのほとんどが天然由来である[60]。キトサンは、キチンの脱アセチル化体から誘導され、その生体適合性、抗菌性、および生分解性の特性により、薬物キャリアやその他のバイオメディカル材料の製造に広く使用されている[61]。2011年,キトサンを機能化したGOが,簡便なアミド化プロセスによって初めて得られ,ヒト癌細胞株へのカンプトテシン(CPT)またはpDNA(pRL-CMV)送達に成功した[62].MDR1 siRNAは、キトサン機能化GOによってトランスフェクトされ、MCF-7/Dox細胞におけるMDR1 mRNAおよびその翻訳産物P-gpの発現レベルを効率的にノックダウンすることができた[63]。Wangらは、ガラクトシル化キトサン装飾GOのin vivoでの抗腫瘍効果を測定している[64]。
グルコースの別のポリマーであるセルロースもまた、ドラッグデリバリーシステムに使用されている。例えば、カルボキシメチルセルロース(CMC)およびヒドロキシエチルセルロース(HEC)は、GOの装飾に頻繁に使用されている。DOXを担持したCMC/グラフェン量子ドット(GQD)ナノコンポジットヒドロゲルフィルムまたはCMC/GOには、pH依存性の放出プロファイルがあり、K562またはSW480細胞に対して強い細胞毒性がある[65,66]。また、rGO-HECナノハイブリッドへの葉酸(FA)の薬物担持および放出挙動も研究されている[67]。
シクロデキストリン(CD)は、比較的疎水性の中心空洞と親水性の外表面を持ついくつかのグルコースサブユニットからなる大環状化合物のファミリーに属している[68]。このため,CD は難溶性の薬物を受け入れ,生体適合性の高い複合体を形成することで,ドラッグデリバリーに広く利用されている.GO を足場として機能化した CD は,さらなる装飾を施しても施さなくても,DOX,CPT,Dexamethasone(DEX),SN38(7-エチル-10-ヒドロキシカンプトテシン)を送達して細胞増殖を変化させることができた [69-72].しかし、これまでのところ、これらのCDの抗腫瘍効果はin vivoではテストされていない。他の多糖類に関しては、GO-アルギネート(ALG)はpH制御された5-フルオロウラシル(5-FU)放出と高い抗腫瘍効果を有している[73]。デキストラン(DEX)を結合させたGOにクルクミン(CUR)を担持させたものは、4T1およびMCF-7ヌクレオリン過剰発現癌細胞に対する細胞毒性が検出されている[74]。
ハイドロゲルに基づく薬物送達システムは、薬物放出の制御および調節を容易にする[75]。最も一般的に使用されているハイドロゲルは、多糖類をベースとした材料である。これらは、CMC [65]、ステルクリアガムおよびカーボポールポリマー [76]、ステルクリアガム-ポリアクリルアミドヒドロゲル [77]、トラガカントゴム [78] 、ポリ(エチレングリコール)ジメタクリレート [79] 、ポリアクリルアミドヒドロゲル [80] 、キトサン [81] 、キトサン-ポリ(N - イソプロピルアクリルアミド)(CPN) [82] などである。また、トリペプチド(多糖類ではない)ハイドロゲル[83]もGOを改質するために研究されている。このうち、CMC [65], キトサン [81], CPN [82] は、がん治療への応用が試みられている。特に、GOFA-DOX/HACPNは、MCF-7/LUC細胞を移植したヌードマウスでテストされている[82]。
ハイドロゲルと比較して、ナノゲルはサイズが小さいため、より実現可能な送達システムとして使用することができる[84]。これまでに、DOX を担持したアルギン酸 [85]、イソプロピルアクリルアミド [86]、サレップおよびイソプロピルアクリルアミド [87] 修飾 GO ナノゲルの in vitro 抗癌性評価が実施されている。GO およびポリビニルアルコール(PVA)をベースとするエアロゲルは、皮膚への送達および外傷性出血の治療に使用できる可能性がある[88]。キトサン、CMCおよびGOのハイブリッドエアロゲルからの5-FUの放出もまた、以前の研究によって扱われている[89]。ポリアクリルアミド/酸化グラフェン/ゼラチン/アルギン酸ナトリウム(PAM/GO/Gel/SA)複合ハイドロゲルと末梢神経再生を促進させる[90]。これらのハイドロゲル-グラフェンナノキャリアは、近赤外線(NIR)またはpHに依存した放出が可能である。しかしながら、ハイドロゲル-グラフェンナノキャリアによるRNAやDNAのデリバリーに関する報告はない。
アミノ酸-タンパク質-アダプター
タンパク質およびアミノ酸の機能化は、GOのための一般的なツールである。ジンセノサイドRh2(Rh2)は、ArgまたはLysで機能化したプリスティングラフェンに担持させることができる[91]。コラーゲンでコーティングされた3Dグラフェンは、追加的な負荷なしにそれ自体が発泡し、MSCからのDAニューロンの分化を刺激する[92]。FA-BSAで装飾したGOにDOXを添加すると、MCF-7およびA549細胞に対する有効薬剤濃度が増加することが確認された[93]。ゼラチン[90]やトリペプチド[83]で装飾したGOを用いたハイドロゲルは、神経再生や薬物送達に利用されている。さらに、カスパーゼ-3特異的ペプチドプローブは、FAMでタグ付けされ、さらにGOに固定されている。また、カスパーゼ3特異的なペプチドプローブをFAMでタグ付けし、GOに固定化することにより、カスパーゼ3活性化イメージング剤を取得し、細胞のアポトーシスを検出することができる。さらに、ターゲット分子として扱われるペプチドや抗体(オクタアルギニン(R8)、抗HER2抗体など[95])についても後段で取り上げる。
アプタマーは、抗体と同様の親和性、特異性でターゲットに結合することができるオリゴヌクレオチド分子である。この親和性は、バイオセンサーやバイオメディシンに応用されている[96]。蛍光標識アプタマーの多くは、π-πスタッキング相互作用を介してGOに結合しており、効率的な消光により弱い蛍光シグナルを示すが、ナノコンポジットが細胞に入り、アプタマーが高親和性標的分子に結合すると蛍光が活性化される。この手法は、シトクロム c (Cyt c) [94]、がん関連マイクロRNA (miRNA) [97]、腫瘍エクソソーム検出 [98]などに利用されている。トロンビン結合アプタマー(TBA)は、カリウム(K+)を添加すると構造変化を起こし、これまで、FRETベースのセンサーと組み合わせたカリウムの検出に利用されてきた[99]。ターゲットデリバリに応用されるアプタマー分子の親和性については、後ほど説明する。
非ポリマー 研究者たちは、GOの機能特性を向上させるために、非ポリマー有機材料を用いてきた。Ma らは、大豆ホスファチジルコリン(SPC)膜を使用して、DOX 担持 NGO(NGO/DOX)をカプセル化し、その安定性と生体適合性を向上させた。DOXを封入したNGOをマウスに投与すると、腫瘍の成長を抑制し、生存時間を延長させることができる[100]。さらに、分子センシングにおいてより優れた特性を有するフッ素化グラフェンを用いて、DOXおよびCPTをHelaおよび口腔上皮細胞に送達した[101]。一方、アジピン酸ジヒドラジド(ADH)およびヘパリン(Hep)修飾GOを用いてDOXをHepG2およびMCF-7細胞に送達し、心臓、肺および腎臓でのDOX放出を減少させることができた[102]。チオール-マレイミド「クリック」化学によって合成されたGO-DOPA-マレイミド-c(RGDfC)は、MDA-MB-231およびHeLa細胞に対する標的DOX化学療法および光熱療法に適用された[103]。Sedghiらは、3-アミノプロピルトリエトキシシラン(APTES、Si(OEt)3)をエレクトロスパンナノファイバーとGOとの間の架橋として使用した[104]。また、ペグ化リン脂質は、機能性分子をGOに固定するためのリンクとして使用することができる[105]。
無機 NPs の装飾
無機 NPs は,高い体積表面積比,制御可能な形状およびサイズ,容易な表面改質,安定性およびユニークな光学・磁気特性を有する [106] 金属 NPs(Au,Ag,Cu,Pt,Ti),金属酸化物 NPs(Fe3O4,ZnO,TiO2),希土類 NPs(Gd,Ce,Eu)やその他の無機物質(SiO2 など) [107-109] などが含まれる.有機-無機ナノハイブリッドは、有機と無機の対応するユニークな特性を組み合わせることで、多くの利点を提供する。2012年、Huangらはグラフェン-無機ナノハイブリッドを確立し、現在、エレクトロニクス、光学、電気化学エネルギー変換・貯蔵、太陽エネルギーハーベスティングなどの分野で応用されている[8]。本論文では、ナノキャリアとして用いられるグラフェン-無機ナノハイブリッドについて概説する。
金属NPs 2013 年,PEI 機能化 GO-encapsulating gold NPs (GOPEI-AuNPs) は,新規 pDNA 遺伝子ベクターとして HeLa 細胞への DNA 導入に応用され,そのトランスフェクション効率は PEI 機能化 GO より高かった [110] .Au@PANI(ポリアニリン)コアシェル・ナノ粒子に付着したGOシートは,近赤外線/pH応答性のDOX放出特性と優れた近赤外線光熱変換効率を示し,担癌マウスにおける相乗的な治療効果につながった [111]からである.さらに、Usmanらは、GOに希土類金属Gd(ガドリニウム)およびプロトカテク酸を水素結合およびπ-π相互作用を介してドープし、静電相互作用を介してナノ材料をAuNPsでコーティングすることにより、PAナノキャリアおよび磁気共鳴イメージング(MRI)造影剤として使用可能なGAGPAuを作製している [112]-[11] .グラフェン-金複合体は、miRNA-101やmiRNA-122をがん細胞内に送達することもできる[113,114]。これらの報告のほとんどは、金をMRIやSERS(表面増強ラマン分光法)の造影剤として用い、GOを負荷部位として用いている。グラフェン-銀複合体では、銀の部分が抗菌活性をもたらすこともできる[115]。一方、HabibaらはAg-GQDsの光線力学療法が、GQDsに比べてAgによって増強されることを明らかにした[116]。銅で架橋したカルボキシメチルセルロース/ナプロキセン/グラフェン量子ドットナノコンポジットは、ドラッグデリバリーナノキャリアとして報告されている[117]。GOでコーティングされたチタンは、骨インプラントとして、常に薬物送達に使用され、細胞分化をもたらした[118]。希土類常磁性金属 Gd ベースの NP は、MRI 造影剤として使用されている[119]。
金属酸化物 NP 金属酸化物 NP には、酸化鉄、酸化チタン、および酸化亜鉛が含まれる。主に使用される磁性ナノ粒子は、酸化鉄およびその誘導体(CoFe2O4[115]など)である[120]。酸化鉄ナノ粒子(IONP)は、その高い磁気特性から、主に磁気誘導型細胞シグナルとして、バイオメディカル用途で広く研究されている[121]。IONP は,GO や GQD と組み合わせた場合,MRI イメージング [27,122],磁気温熱療法 [123,124],および磁気誘導行動 [27,125] に適用されてきた.さらに、IONPの磁気ハイパーサーミアにより、GOの温度依存的な薬物放出が促進された[124]。TiO2ベースのナノハイブリッドは、光触媒の分野で大きな注目を集めている[126]。酸化グラフェンナノシートと希土類金属プラセオジム(Pr)をドープしたTiO2ナノ結晶からなるハイブリッドナノ複合体Pr-TiO2/NGOは、光触媒活性治療、光熱療法、抗癌剤DOXを組み合わせ、HeLa細胞の著しい増殖抑制につながった [127].メソポーラス酸化亜鉛(ZnO)足場は、ドロップキャスト酸化グラフェン(GO)でコーティングされ、遅延放出型バイオレイヤーシステムを形成し、骨組織工学に使用することができる[128]。
その他の無機ナノ粒子 メソポーラスシリカナノ粒子(MSN)は、薬物の担持に利用できる高い表面積を有している[129]。GO または GQDs をコーティングした薬物担持 MSN は、近赤外線による熱効果で分解されるため、薬物の放出制御が可能である [43,130].シリカと GO の間には、MSN の中空部に組み込むことができる GQD のような異なるモードがある。この放出制御型薬物送達プラットフォームは、担癌マウスで証明されている[131]。
上記の無機 NPs 以外に,ZnS QD はその光学的特性から診断薬候補である.Zengらは,miR-122を担持したGOにInP/ZnS(コア/シェル)QDを組み合わせることによってセラノスティックナノ粒子を得,これを担癌マウスにおける標的イメージングおよび薬剤耐性肝細胞のアポトーシス誘導に使用することができる[132].同様に,Diaz-Diestraらは,DOXをリードしたGOにZnS:Mnを結合させ,セラノスティックプラットフォームを得た[133].
ハイドロキシアパタイト(HAP)は、生体適合性、生物活性、骨伝導性を有しており、医療分野、特に骨修復や再生、ドラッグデリバリー用途に広く利用されている。GO-HAP 複合体は,骨再生以外にも,吸収性イブプロフェン(IBU) [134] や 5-FU [135] を送達することが可能である.Cheangらは,GO-HAPナノコンポジットを使って,自殺遺伝子である単純ヘルペスウイルスチミジンキナーゼ(HSV-TK)を発現するプラスミドを送達し,癌細胞の増殖を阻害した[136].
デリバリー効果を向上させるための最適化戦略
毎年何十種類もの新薬が登場しているが、そのほとんどが病気の組織や細胞に効果的に作用させるという課題を抱えている。薬物送達の有効性を高め、副作用を低減するために、いくつかの効果的な戦略が存在する。その中でも、標的薬剤の修飾は、NPs ベースの薬剤にとって実行可能な戦略である[137]。GO ベースのナノキャリアを改良するために、さまざまなターゲット剤が使用されてきた [138]。腫瘍の微小環境に依存するトリガー・コントロール・デリバリーは、指定された細胞に特異的に薬効を与える[139]。ここでは、GO ベースのプラットフォームの最適化に使用された、いくつかのターゲティング剤およびトリガー制御システムを紹介する(図 2)。また、ターゲットと効果の比較を行った代表的な文献をTable 2に示す。
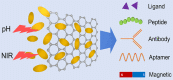
図2
デリバリー効果を向上させるための最適化戦略。放出制御刺激としては、光熱や酸性条件下での放出が一般的であった。ターゲット分子には、リガンド、タンパク質、ペプチド、アプタマーなどがある。磁気ターゲティングは、無機化合物や有機化合物などに対して強力な方法であった。
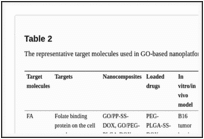
表2
GOベースナノプラットフォームで使用される代表的な標的分子
リガンド
最もよく使われる標的薬剤は葉酸(FA)である。葉酸受容体の過剰発現は、多くの癌細胞で確認されている[140]。GO NPs を修飾した FA のターゲティング効果は,in vitro および in vivo で証明されている.これまでに,DOX,コルヒチン(COLC)[141],パクリタキセル[142],クルクミン[143],カンプトテシン[144],銅錯体(置換シスジクロジアミンプラチナとしてみなす)[145],および siRNA[24]を搭載した GO など FA でコーティングしたさまざまな粒子がテストされてきた.HELA 細胞 [100] 、HepG2 細胞 [141] 、PaCa-2 細胞 [24] 、B16 細胞 [29] 、 MCF-7 細胞 [82] または EAT (Ehrlich Ascites Tumor) 細胞 [146] を持つマウスが先行研究でモデルとして使用されてきた。これらのin vivoアッセイのうち、2つは腫瘍の成長を有意に抑制する効果を示した[29,100]。
ヒアルロン酸(HA)は、CD44(ヒアルロン酸)受容体に高い親和性で結合する主要なリガンドとして広く用いられている。FAレセプターと同様に、CD44レセプターは多くのガン組織で過剰発現している[147]。HAで修飾したGOやGQDは、DOX [148], ヒスタミン二塩酸塩(HDC) [149], 5-Fluorouracil (5-FU) [150], SNX-2112 [151], miR-21 peptide nucleic acid (PNA) probes [152] in vitroあるいはin vivoでの送達に使用されてきた。HELA細胞[148]、Panc-1細胞[150]、MDA-MB-231搭載マウス[152]において抗腫瘍アッセイが確認されている。しかしながら、GOベース材料のin vivoでの抗腫瘍効果の違いをHAの有無で比較した化学療法研究はまだない。それでも、Miaoらは2015年に光熱療法で驚くべき結果を得ている[153]。
GOベースのナノキャリアでは、トリフェニルホスホニウム(TPP)[59,154]、グリチルレチン酸(GA)[155]、ハイペリシン[156]がミトコンドリアをターゲットとして使用されている。ミトコンドリアの機能の変化は、悪性腫瘍の形成と関連しており、これは新しい癌治療薬の標的を提供する[157]。その中でも,GAは肝細胞癌(HCC)細胞を標的とすると考えられており,SMMC-7721に対してある程度の標的性を示す[158].他のドラッグデリバリーシステムは,これらのミトコンドリア標的分子を使用し,ミトコンドリアの優先的な蓄積によって薬効を高め,細胞をアポトーシス段階に押しやる.
タンパク質
がん細胞(CMM)に過剰発現しているマーカー分子の抗体によって、ナノハイブリッドをがん細胞へ誘導することができる[159]。P-糖タンパク質(P-gp)は、がん細胞が多剤耐性(MDR)を獲得する際に過剰発現する[160]。Zengらは、ヌードマウスにおいて、P-gp抗体を利用して腫瘍を標的にするGPMQNs(graphene-P-gp loaded with miR-122-InP@ZnS quantum dots nanocomposites)を合成した [132](Graphene-P-gp loaded with miR-122-InP@ZnS quantum dots nanocomposites)。モノクローナル抗体は,血管内皮増殖因子(VEGF)に対して使用され,GOを修正し,VEGFが過剰発現した癌細胞への送達効果を高めるために使用されている[161]などであった.上皮成長因子受容体(EGFR)は、腫瘍細胞の表面上に高度に発現している。Cetuximab(CET、EGFRモノクローナル抗体)修飾GOは、CT-26細胞を移植した異種移植腫瘍の成長を抑制する可能性がある[162]。さらに、肝細胞癌(HCC)の潜在的な分子標的であるヘパリン硫酸プロテオグリカンのグリピカン-3(GPC3)の抗体が、rGOの装飾に使用されている[163]。ヒト乳癌の25%~30%で過剰発現している膜貫通型チロシンキナーゼ受容体の抗体である抗HER2が、S180細胞搭載マウスに使用されている[95]。トランスフェリン(TF)やラクトフェリン(LF)などのタンパク質は,DOXを担持したGO NPを,その受容体を介してそれぞれメラノーマ細胞やグリオーマ細胞へ誘導することができる[164,165].
ペプチドおよびアプタマー
細胞侵入ペプチド(CPP)および細胞標的ペプチド(CTP)は,化学療法薬の選択的な送達を促進する[166,167].これらのペプチドは、ポリ-L-アルギニン (P-L-Arg) [113], Arg-Gly-Asp (RGD) [168], c (RGDfC) [103], c (RGDyK) [169], オクタアルギニン (R8) [95] などで、GOナノハイブリッドの選択性強化に使用されている。miRNAや薬物を担持させたCPPやCTPを用いたGOのin vitroおよびin vivo試験が既に行われている。キメラペプチド(MPG-2H1)は、pDNA を担持した GQD のエンドサイトーシスを促進するように設計されている[170]。
Kimらは、線維芽細胞活性化タンパク質(FAP)活性化プロメリチン装飾rGOナノシートDOX送達システムを作製し、in vivoで腫瘍微小環境標的療法によるより良い抗腫瘍効果を示した。さらに、このシステムで使用されているメリチンは、あらゆる脂質膜を攻撃する非特異的な細胞溶解ペプチドである。FAPは、Pro-Xxxアミノ酸結合を特異的に切断するセリンプロテアーゼであり、がん関連線維芽細胞(CAF)の膜に選択的に過剰発現していることが報告されている[105]。
AS1411アプタマーは,ヌクレオリンに認識され,細胞内への取り込みを改善できるssDNAアプタマーであり,CUR担持GOが4T1細胞やMCF-7細胞をターゲットにすることを支援する[74].ST-3アプタマーは,GOのバイオフィルムへの侵入を容易にし,ST-3-GOの抗菌活性をその構成分子より優れたものにしている[171].
トリガー制御デリバリーシステム
トリガーによる薬物放出制御、およびその応用は、強化された効率またはより有益な治療を提供するための新しい薬物送達システムにおいて開発されてきた[172]。GOベースのハイドロゲルは、前のセクションで議論された。これらのデリバリー・プラットフォームは、薬物放出を延長し、持続させることができる。GOとその荷物の間の動的な結合相互作用は、pHや温度の変化などの外部刺激に対する制御された反応を示している。光熱効果は、近赤外光の吸収によるグラフェンの誘導加熱により、癌治療や薬物放出制御への応用が示唆されている[173,174]。DOX(133)、クルクミン(Cur)(143)、コルヒチン(COLC)(141)、5-FU(73)など多くの薬剤が、中性状態よりも酸性状態(ちょうど腫瘍と同じ)の方がはるかに速い放出を示すことが分かっている。NIRやpHは、GOベースのナノキャリアの薬物放出制御における主要な刺激である。大腸のアルカリ環境に溶解したアルギン酸(ALG)を用いた別の例があり、GO-ALGに負荷された5-FUは、経口投与により大腸に特異的に放出され、腫瘍成長を著しく阻害した[73]。
グルタチオン(GSH)トリガー放出は,ナノキャリアとしてGPMQN(グラフェン酸化物InP@ZnS QDs)を用いて成功することが示された[132].Fibroblast activation protein(FAP)は,細胞溶解ペプチドを活性化するために使用されている(詳細は前のセクションで)[105].このような特殊な標的微小環境は,放出制御のための刺激応答性薬物送達システムを設計する機会を提供するものであった.IONPおよびGOナノハイブリッドは、外部磁場を用いることで誘導することができる[175]。Luらは、セツキシマブ(CET)と磁気デュアルターゲット送達システムを開発し、化学療法と光熱療法を併用した[162]。
結論と展望
GFNは、癌やバクテリアの治療、組織工学、および生体イメージングに広く使用されています。これらの用途のほとんどは、GOベースの材料の優れた吸収特性に依存している。GO系材料を遺伝子および薬剤のナノキャリアとして改良するために、さまざまな装飾を介した取り組みがなされてきた。本研究では、使用される核酸送達に重点を置き、装飾分子に従って機能化をグループ化した(図1)。有機材料と無機材料は、GOに機能部を導入するために使用される主要なセットである。有機サブグループの最初の3つのカテゴリの代表的な文献を表1に示す。がん治療効率に関しては、GOデリバリーナノプラットフォームとフリードラッグを用いた場合、抗腫瘍抑制率に有意な差はない。しかし、光線療法、ターゲットデリバリー、放出制御など、他の戦略と組み合わせた場合は異なるだろう。
放出制御や標的化は、ナノキャリアの有効性と臨床応用を制限する。GOベースのナノプラットフォームは、薬効を向上させるためのいくつかの実行可能な戦略を提供する。光熱放出およびpH制御放出は、GOナノキャリアの優れた特性である[59,73]。GOデリバリーシステムで使用される最も一般的な標的分子を図2に示す。ほとんどの標的分子は、癌細胞の標的に対して特異的に親和性を有している。特定の酵素や癌微小環境中の他の分子の触媒作用のもとで、開裂可能な化学結合は、明示的に薬物の蓄積または活性化を与える可能性がある[29,105]。さらに、マクロファージや単球は、その腫瘍向きの移動特性や強力な貪食能力から、送達効果を高めるための細胞キャリアとして機能することができ、バイオミメティック送達システム(BDS)とも呼ばれる。GO ベースのナノ材料は、マクロファージを介した送達に組み合わされ、評価できる腫瘍抑制率を示す[176]。
化学療法は担癌マウスで成功したが、Paul の心臓修復に関する研究 [52]と Yin の抗腫瘍に関する研究 [24] を除いて、ほとんどの遺伝子治療は細胞レベルにとどまっている。プラスミド DNA と低分子 RNA のいずれも、GO ベースのナノキャリアを介して送達することができる。In vivoでの遺伝子導入は、ほとんどの場合、組織工学およびバイオイメージングのために実施された[177,178]。結論として、GO ベースのナノ材料は、臨床応用、特に遺伝子デリバリーにおいて、まだ長い道のりを歩んでいる。我々は、最適化戦略としてのターゲットデリバリーおよび放出制御は、さらに探求されるべき分野であると確信している。
謝辞
本研究は温州市厚生科学技術基金会(Y20160336)、浙江省自然科学基金会(LQ17H050002)、中国内モンゴル自治区自然科学基金(2017BS0805、2018BS08014)の支援を受けて実施した。内モンゴル自治区大学科学技術若手人材プログラム(NJYT-20-B22)、内モンゴル自治区大学科学技術研究プログラム(NJZZ18186)、包頭医学院研究費(BYJJ-YF 201616, BSJJ201707, BSJJ201708).
利益相反の開示
なし。
記事情報
Am J Transl Res. 2020; 12(5): 1515-1534.
2020年5月15日オンライン公開。
PMCID: PMC7270027
PMID: 32509159
Xiao-Min Han,1,* Ke-Wen Zheng,3,* Rui-Long Wang,4 Shu-Fen Yue,1 Jing Chen,1 Zi-Wei Zhao,1 Fang Song,1 Yan Su,1,2 and Qiang Ma1,2
1 中国内モンゴル自治区包頭市包頭医科大学基礎・法医学研究室(014040
2 中国内モンゴル自治区包頭医科大学血液保存研究所 〒014040
3 温州医科大学第一附属病院泌尿器科、温州医科大学第一臨床学院、浙江省温州市、325000、中国
4 中国内モンゴル自治区包頭市第五鉄道中学校
宛先は以下の通りです。中国内モンゴル自治区包頭市包頭医科大学血液保存研究所 馬強博士 〒014040 Tel: +86-472-7167841; E-mail: moc.liamtoh@oaguotzwtb
*平等な貢献者。
Received 2019 Sep 19; Accepted 2020 Apr 14.
AJTR Copyright © 2020
この記事は、PMCの他の記事から引用されています。
American Journal of Translational Researchの記事は、e-Century Publishing Corporationの提供でここに提供されます。
参考文献
元記事参照。